紫马铃薯具有丰富的营养成分,而且富含花青素、多酚等多种生物活性成分。市面上关于紫马铃薯的食品以鲜品为主,加工产品较少,发酵制品更少。紫马铃薯发酵酒是以紫马铃薯为原料,经过挑选、粉碎、糖化及发酵等加工流程,制得的酒体通透且呈紫色,口感微酸,香气宜人的产品[1],但目前紫马铃薯酒的制备方法中,存在紫马铃薯汁花青素含量较低、可溶性固形物含量少、发酵液浑浊度较高及其加热处理温度和时间局限性大等问题[2],影响发酵成品质量。
花青素具有抗氧化[3]、防癌、护肝、降血糖[4]、抗衰老和预防疾病[5]等多种功效,但其相对不稳定,在加工及储存过程中易降解,尤其在煮沸过程,花青素损失最高[6]。方忠祥等[7]研究了紫肉甘薯中的花青素在不同环境条件下的稳定性,结果表明,在不同pH环境中,花青素呈现颜色不同,且对温度的耐热性较差,在100 ℃条件下保存5 h,粗提取物保留率仅为47.4%。孙倩怡等[8]对蓝莓花青素的稳定性研究得出,pH≤3条件保存6 h后,花青素保存率基本趋于稳定(90%以上),而乳清蛋白对花青素保留率达到89%。通过使用酶解方法对紫马铃薯汁进行处理,有利于提高发酵效率、增加发酵底物产量和提高感官质量,同时糖化升温过程,热处理会将多糖分解为简单的单体,并且杀死不必要的微生物[9]。邹颖等[10]研究了不同高温α-淀粉酶添加量对紫马铃薯的出汁率、花色苷含量和还原糖的影响,紫马铃薯出汁率随着添加高温α-淀粉酶显著增加,花色苷含量亦随之升高,并且酶用量增大,还原糖含量显著提高。
因此,本试验以紫马铃薯为原料,通过单因素及田口试验设计对紫马铃薯酶解工艺进行优化,通过单因素及双因素方差分析对紫马铃薯汁护色条件进行优化,以期达到提升紫马铃薯发酵酒质量的目的。
1 材料与方法
1.1 材料与试剂
紫马铃薯(黑金刚,产于西藏):市售;无水柠檬酸:潍坊英轩实业有限公司;乳清蛋白粉:永信食品配料有限公司;纤维素酶(2×103 IU/mg)、果胶酶(2×104 IU/mg):北京鸿润宝顺科技有限公司;高温α-淀粉酶(1×104 IU/mg):南宁庞博生物工程有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UV-5200紫外可见分光光度计:上海元析仪器有限公司;ESJ120-4B分析天平:北京市六一仪器厂;L-500 折光计:温湿制造公司;101型电热鼓风干燥箱:上海-恒科学仪器有限公司;JYL-C19V 搅拌机:九阳股份有限公司;K2025 高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技有限公司;LDZX-75L 立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;WGZ-100 浊度计:上海昕瑞仪器仪表有限公司。
1.3 方法
1.3.1 紫马铃薯汁制备操作要点[11-14]
挑选称量500 g紫马铃薯,清洗、去皮,切割为2 cm方块,快速添加试剂(柠檬酸、乳清蛋白)和酶,混匀后放入搅拌机2 300 r/min搅碎1 min,转接入玻璃容器,在电热鼓风干燥箱中分3个阶段升温(N1:55 ℃、3 h,N2:80 ℃、3 h,N3:100 ℃、3 h)并不断搅拌,使其受热均匀,直至达到出现分层现象,过滤取上清液,得成品紫马铃薯汁。
1.3.2 紫马铃薯酶解工艺优化单因素试验
以不添加酶(空白组)为对照,参考GB 2760—2014《食品安全国家标准食品添加剂使用标准》中最大使用量,分别考察高温α-淀粉酶(0.1%、0.2%、0.3%)、果胶酶(0.1%、0.2%、0.3%)和纤维素酶(0.1%、0.3%、0.5%)添加量对紫马铃薯出汁率、可溶性固形物、浊度的影响。平行测定3组,重复2组。
1.3.3 紫马铃薯酶解工艺优化田口试验
在单因素试验的基础上,采用田口试验分析法[15-16]对紫马铃薯酶解工艺进行优化,设定控制因素为高温α-淀粉酶添加量(A)、果胶酶添加量(B)和纤维素酶添加量(C),选择单因素试验中效果最佳2个水平;噪音(不可控因素)为糖化升温过程中3个阶段N1(55 ℃、3 h)、N2(80 ℃、3 h)和N3(100 ℃、3 h),进行优选研究,田口试验因素与水平见表1。
表1 紫马铃薯酶解工艺优化田口试验因素与水平
Table 1 Factors and levels of taguchi experiments for enzymatic process optimization of purple potato

水平 A 高温α-淀粉酶/% B 果胶酶/% C 纤维素酶/%1 2 0.2 0.3 0.2 0.3 0.3 0.5
1.3.4 紫马铃薯汁护色工艺优化单因素试验[15-16]
分别考察柠檬酸(1.4%、1.5%、1.6%)、乳清蛋白(0.1%、0.2%、0.3%)添加量对紫马铃薯汁花青素含量及花青素保留率的影响。平行测定3组,重复2组。
1.3.5 紫马铃薯汁护色工艺优化双因素试验
在单因素试验的基础上,进一步采用双因素试验对紫马铃薯汁护色工艺优化,双因素试验因素与水平见表2。
表2 紫马铃薯汁护色工艺优化双因素试验因素与水平
Table 2 Factors and levels of two-factor experiments for color protection process optimization of purple potato juice

水平 A 柠檬酸/% B 乳清蛋白/%1 2 3 1.4 1.5 1.6 0.1 0.2 0.3
1.3.6 测定方法
可溶性固形物含量:按照参考文献[17-18]的方法进行;出汁率:按照参考文献[19]的方法进行;浊度值:按照参考文献[20]的方法进行。
总花青素含量[21-22]:取紫马铃薯汁,分别加入pH 1.0和pH 4.5的缓冲液,避光放置15 min,测定波长510 nm处和波长700 nm处的吸光度值。每个样品平行测定3次,取平均值,计算总花青素含量,其计算公式如下:
式中:A为吸光度值差值A=(A510 nmpH1.0-A700 nmpH1.0)-(A510 nm pH4.5-A700 nmpH4.5);ε为矢车菊花素-3-O-葡萄糖苷的消光系数(26 900 L/(mol·cm));AW为矢车菊花素-3-葡萄糖苷的分子质量(449.2 g/mol);DF为稀释因子,mg;L为光程,cm。
总花青素保留率[23-24]:测定紫马铃薯汁加热前后在波长525 nm处的吸光度值,计算保留率,其计算如下:
式中:R为总花青素保留率,%;A为加热后紫马铃薯汁OD525 nm的值;A0为加热前紫马铃薯汁OD525 nm的值。
花青素含量、种类:按照参考文献[25-26]的方法进行测定。
1.3.7 数据处理
采用R 4.2.2软件进行方差齐性检验、多因素方差分析和田口试验分析、差异显著性检验分析。每个试验重复3次,数据以“平均值”或“平均值±标准差”的形式来表示。
2 结果与分析
2.1 紫马铃薯酶解工艺优化试验
2.1.1 紫马铃薯酶解工艺优化单因素试验
由图1可知,随着高温α-淀粉酶添加量的增加,紫马铃薯的出汁率和可溶性固形物含量增长趋势明显,且在高温α-淀粉酶添加量为0.2%时到达顶点,分别为(54.6±6.6)%和(66±11.4)g/L,同时,浊度值呈明显下降趋势,高温α-淀粉酶添加量为0.3%时,浊度值下降,但出汁率和可溶性固形物含量下降。因此,当高温α-淀粉酶添加量为0.2%和0.3%时,紫马铃薯的品质指标有所提升。选择高温α-淀粉酶添加量为0.2%和0.3%进行后续试验。
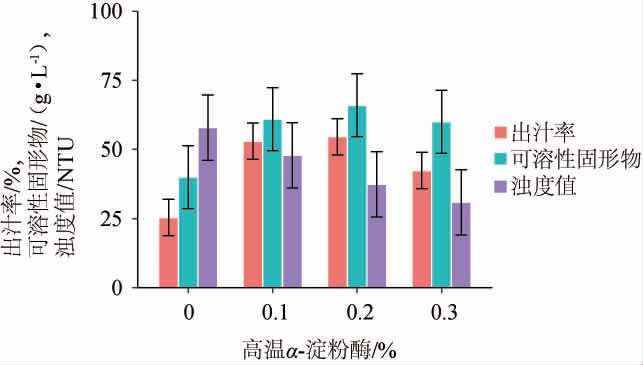
图1 高温α-淀粉酶对紫马铃薯出汁率、可溶性固形物含量及其浊度的影响
Fig.1 Effect of thermostable α-amylase on juice yield, soluble solid content and turbidity in purple potato
由图2可知,随着果胶酶添加量的增加,紫马铃薯的出汁率和可溶性固形物含量增加趋势明显,且在果胶酶添加量为0.3%时达到顶点,分别为(51.4±6.0)%和(66±11.8)g/L,但同时浊度值高达(106.9±10.3)NTU,观察时有明显浑浊现象。果胶酶添加量0.2%和0.3%进行对比,紫马铃薯汁出汁率、可溶性固形物含量和浊度值无明显差异。因此,在改善紫马铃薯出汁率和可溶性固形物含量方面,果胶酶添加量为0.2%和0.3%有类似效果。因此,选择果胶酶添加量为0.2%和0.3%进行后续试验。
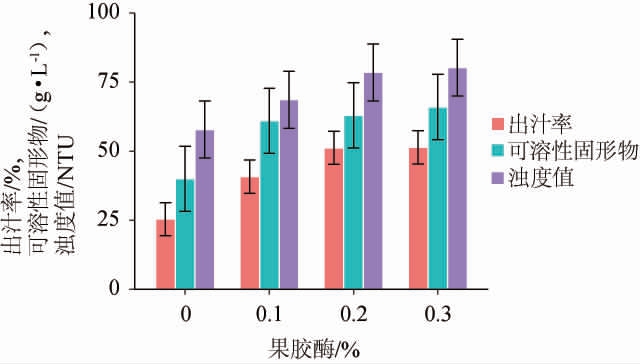
图2 果胶酶对紫马铃薯出汁率、可溶性固形物及其浊度的影响
Fig.2 Effect of pectinase addition on juice yield, soluble solid content and turbidity in purple potato
由图3可知,随着纤维素酶添加量的增加,紫马铃薯的出汁率和可溶性固形物含量增加趋势明显,且在纤维素酶添加量为0.5%时达到顶点,分别为(44.6±8.1)%和(58±7.5)g/L,但同时浊度值高达(68.65±4.9)NTU。当纤维素酶含量为0.3%时,其出汁率和可溶性固形物含量相对0.1%纤维素酶较高,而浊度值相对0.5%添加量较低。因此,选择纤维素酶添加量为0.3%和0.5%进行后续试验。
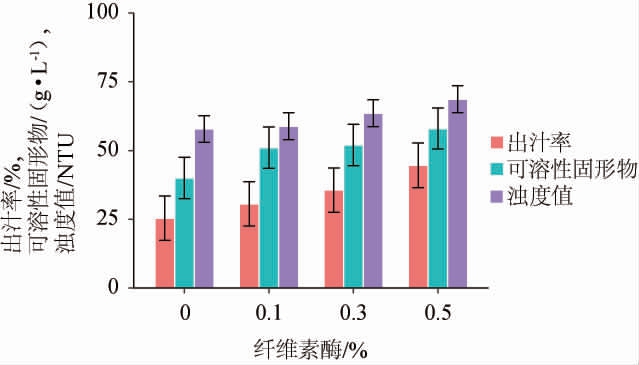
图3 纤维素酶对紫马铃薯出汁率、可溶性固形物及其浊度的影响
Fig.3 Effect of cellulase addition on juice yield, soluble solid content and turbidity in purple potato
总体来说,单独使用三种酶,都能够有利于改善紫马铃薯部分品质,但并不能直接确定酶含量,缺乏判定依据。因此,结合实际添加情况(考虑外部因素的影响)以及酶含量的影响,设计同时添加三种酶,进一步研究确定高温α-淀粉酶、果胶酶和纤维素酶的使用量,从而达到最佳添加量以提升紫马铃薯出汁率、可溶性固形物的目的。
2.1.2 紫马铃薯酶解工艺优化田口试验设计
按表1设计16种酶解组合进行试验,分别测定可溶性固形物含量。计算信噪比(S/N),以其作为评价指标,优选制备工艺,结果见表3。
表3 紫马铃薯酶解工艺优化田口试验设计及结果
Table 3 Design and results of taguchi experiments for enzymatic process optimization of purple potato
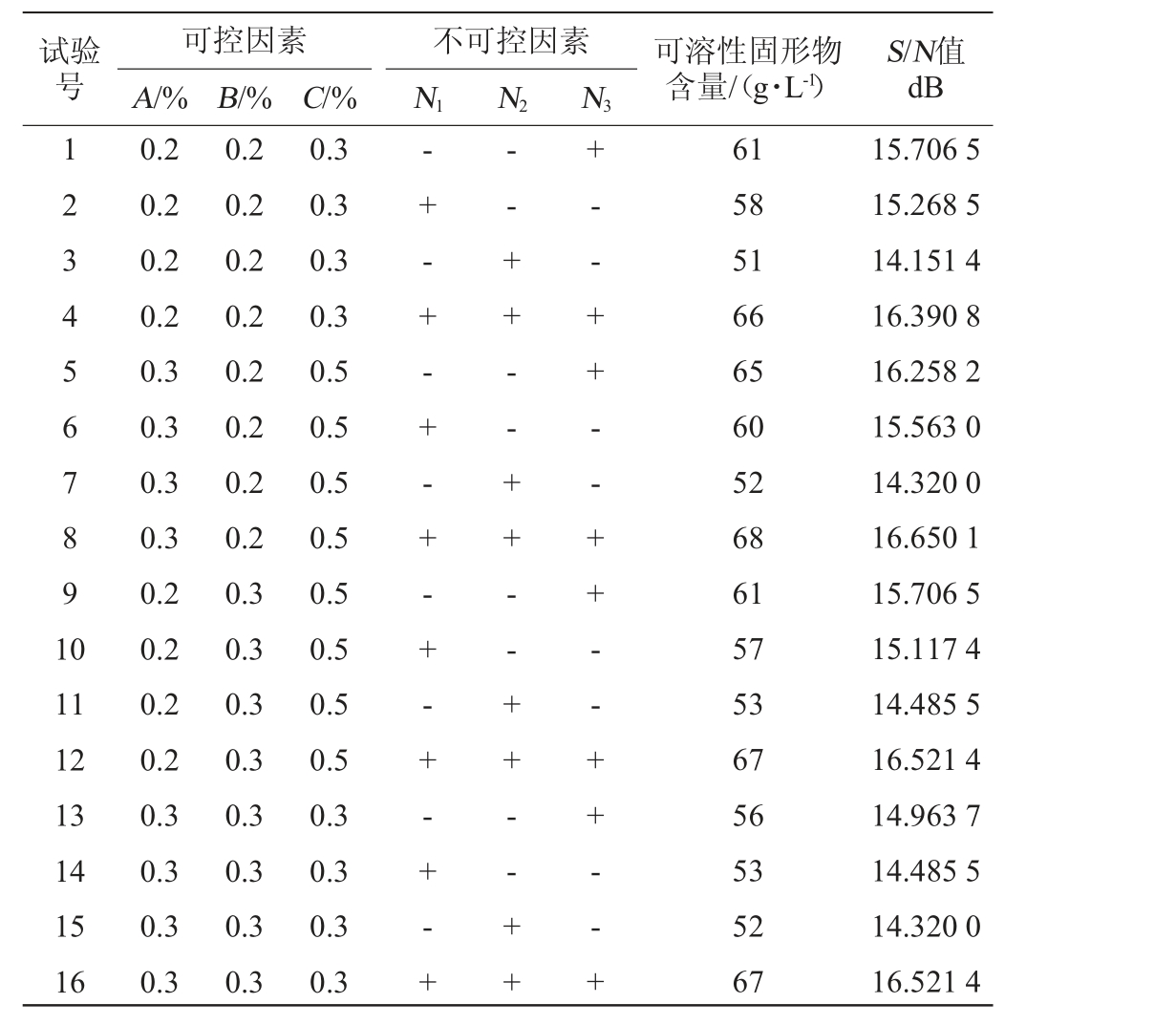
试验号可控因素A/% B/%不可控因素N1 N2 N3可溶性固形物含量/(g·L-1)S/N值dB 123456789 1 0 11 12 13 14 15 16 0.2 0.2 0.2 0.2 0.3 0.3 0.3 0.3 0.2 0.2 0.2 0.2 0.3 0.3 0.3 0.3 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.3 0.3 0.3 0.3 0.3 0.3 0.3 0.3 C/%0.3 0.3 0.3 0.3 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.3 0.3 0.3 0.3-+ - + - + - + - + - + - + - +-- + + - - + + - - + + - - + ++- - + + - - + + - - + + - - +61 58 51 66 65 60 52 68 61 57 53 67 56 53 52 67 15.706 5 15.268 5 14.151 4 16.390 8 16.258 2 15.563 0 14.320 0 16.650 1 15.706 5 15.117 4 14.485 5 16.521 4 14.963 7 14.485 5 14.320 0 16.521 4
由于田口方法中,S/N值越大表明其效果越理想,求出各个因在不同水平上的S/N值,并以图形式给出了各个因素随不同水平的变化趋势(图4)。由图4可知,A因素(高温α-淀粉酶)的水平1,B因素(果胶酶)的水平2,C因素(纤维素酶)水平2为各因素的最佳水平。
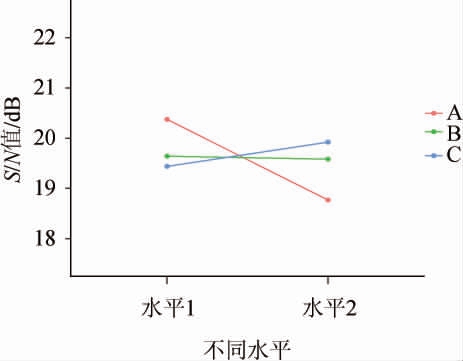
图4 不同因素在不同水平的S/N变化趋势图
Fig.4 S/N change trends map of different factors at different levels
通过图4预测,A1B2C2各因素水平上最优水平条件下信噪比为16.81 dB,带入S/N计算,可以得出紫马铃薯固形物含量最佳预测值为69.3 g/L。
所选方案是正交表中存在方案,需做试验加以验证结果的准确性。按方案A1B2C2进行酶解,共3组,其余操作不变。结果表明,紫马铃薯可溶性固形物含量均值为70.3 g/L,相对偏差在2.4%以内,与预测值比较相差不大,结果较为满意。
2.2 紫马铃薯汁护色工艺优化
2.2.1 紫马铃薯汁护色工艺优化单因素试验
不同柠檬酸和乳清蛋白添加量对紫马铃薯汁的总花青素含量及其保留率的影响见图5。由图5可知,紫马铃薯汁的总花青素含量平均值和保留率随着柠檬酸添加量的增加而增加,并且当柠檬酸添加量为1.6%时,花青素保留率为81.40%,总花青素含量为91.20 mg/L,说明柠檬酸对稳定花青素有积极影响。随着乳清蛋白添加量的增加,总花青素含量也略有增加,并且当添加量为0.3%时,花青素保留率为22.06%,总花青素含量为24.71 mg/L,说明乳清蛋白对稳定花青素也有一定积极作用。
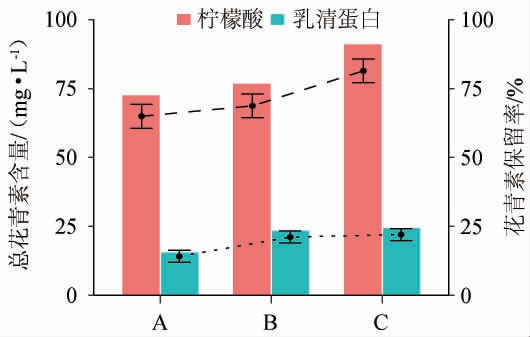
图5 柠檬酸和乳清蛋白添加量对紫马铃薯汁的总花青素含量及保留率影响
Fig.5 Effect of citric acid and whey protein addition on total anthocyanin content and retention rate of purple potato juice
图中A、B、C分别表示柠檬酸和乳清蛋白的添加量分别为1.4%、1.5%、1.6%,0.1%、0.2%、0.3%。
柠檬酸改变了花青素环境的pH值,而花青素在不同的pH条件下颜色不同,此现象与其分子结构发生改变有关,并且酸类物质与花青素在加热时发生了分子间的辅色效应,能够提高花青素耐热性,且保留率会上升[7]。另一方面,柠檬酸浓度过高会影响紫马铃薯汁饮用,添加糖类物质会影响花青素稳定性[8]。而乳清蛋白能够提高花青素耐热性,并且花青素会影响乳清蛋白的极性和疏水性,两者存在相互作用[16]。
因此,为了更好稳定紫马铃薯汁中的花青素,同时使用不同含量柠檬酸和乳清蛋白对花青素的影响有了实际意义,进一步分析探究柠檬酸和乳清蛋白在稳定紫马铃薯汁中花青素是否存在相互作用。
2.2.2 紫马铃薯汁护色工艺优化双因素方差分析试验
由表4~表6可知,添加1.6%柠檬酸和0.3%乳清蛋白护色效果最佳,在此条件下,紫马铃薯汁总花青素含量最高为102.4 g/L,平均含量为99.06 g/L。因素A(柠檬酸)和因素B(乳清蛋白)的P值都远大于0.05的显著性水平,不能拒绝原假设,说明因素A和因素B各水平是满足方差齐性。通过双因素方差分析,结果说明因素A和因素B的P值均小于0.001,表示两种因素分组的试验下,花青素含量明显不同,即两种因素都对结果产生影响,却无交互作用。
表4 紫马铃薯汁护色工艺优化双因素试验设计及结果
Table 4 Design and results of two-factor experiments for color protection process optimization of purple potato juice
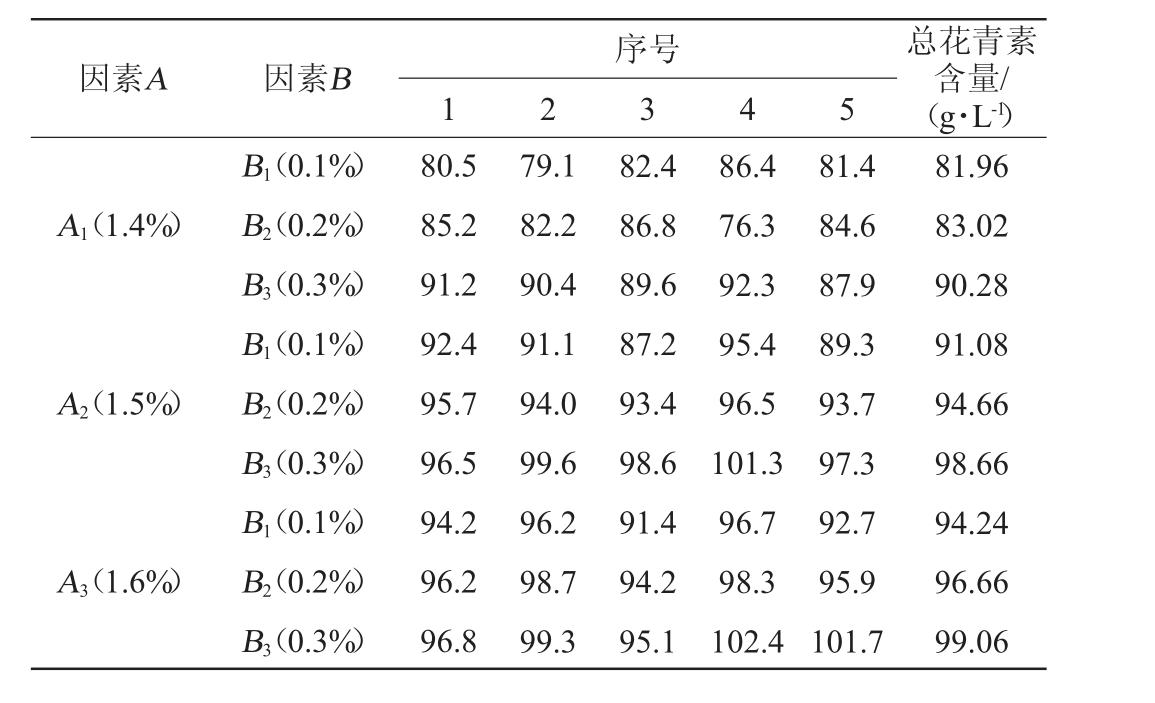
因素A 因素B 序号1 2 3 4 5总花青素含量/(g·L-1)A1(1.4%)A2(1.5%)A3(1.6%)B1(0.1%)B2(0.2%)B3(0.3%)B1(0.1%)B2(0.2%)B3(0.3%)B1(0.1%)B2(0.2%)B3(0.3%)80.5 85.2 91.2 92.4 95.7 96.5 94.2 96.2 96.8 79.1 82.2 90.4 91.1 94.0 99.6 96.2 98.7 99.3 82.4 86.8 89.6 87.2 93.4 98.6 91.4 94.2 95.1 86.4 76.3 92.3 95.4 96.5 101.3 96.7 98.3 102.4 81.4 84.6 87.9 89.3 93.7 97.3 92.7 95.9 101.7 81.96 83.02 90.28 91.08 94.66 98.66 94.24 96.66 99.06
表5 方差齐性检验结果
Table 5 Test results of homogeneity of variance

注:“***”表示对结果影响极显著(P<0.001);“**”表示对结果影响非
常显著(P<0.01);“*”表示对结果影响比较显著(P<0.05)。下同。
因素 K-squared 自由度 P 值AB 2.515 3 1.706 3 22 0.284 3 0.426 1
表6 双因素试验结果方差分析
Table 6 Variance analysis of two-factor experiments results
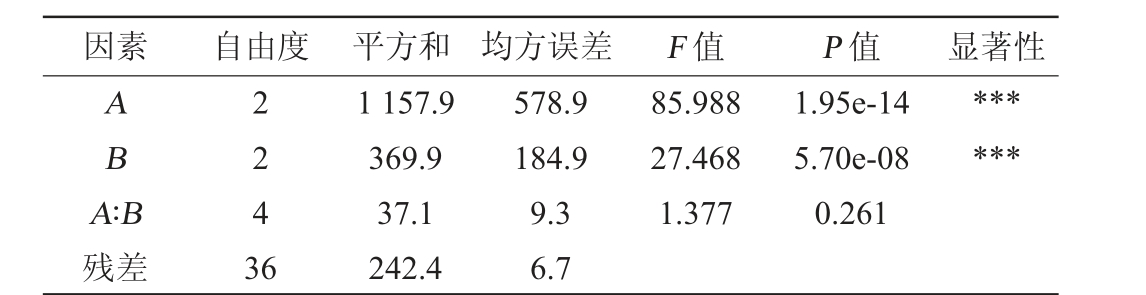
因素 自由度 平方和 均方误差 F 值 P 值 显著性AB******A∶B残差2243 6 1 157.9 369.9 37.1 242.4 578.9 184.9 9.3 6.7 85.988 27.468 1.377 1.95e-14 5.70e-08 0.261
2.3 紫马铃薯汁花青素种类及其含量分析
通过HPLC分析经过酶解优化工艺制备的紫马铃薯汁,其花青素含量及其种类如图6。由图6可知,紫马铃薯汁中总花青素含量为150.81 mg/L,其中含量最高为矮牵牛色素(69.21 mg/L),锦葵色素、矢车菊色素、飞燕草色素占比相对较少,此外含有微量的天竺葵色素。
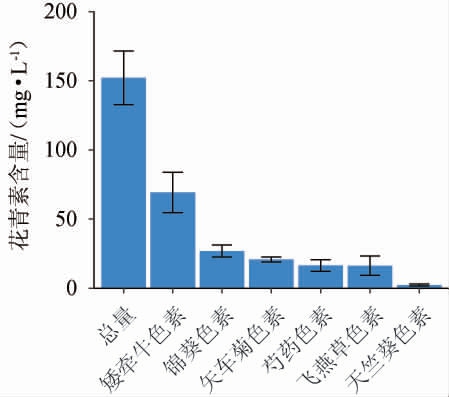
图6 紫马铃薯汁中花青素种类及其含量
Fig.6 Anthocyanin species and contents in purple potato juice
3 结论
本试验通过单因素及田口试验设计对紫马铃薯酶解工艺进行优化,通过单因素及双因素试验对紫马铃薯汁护色条件进行优化。结果表明,添加0.2%高温α-淀粉酶、0.3%果胶酶和0.5%纤维素酶时,紫马铃薯汁可溶性固形物含量最高为70.3 g/L;添加1.6%柠檬酸和0.3%乳清蛋白护色效果最佳,紫马铃薯汁总花青素含量最高为102.4 g/L,平均含量为99.06 g/L。
[1] LIU Z H, GUO J.Preparation and antioxidant activity of purple potato wine[J].Open Biomed Eng J,2015,9:282-287.
[2]DWIYANTI G,SISWANINGSIH W,FEBRIANTI A.Production of purple sweet potato(Ipomoea batatas L.)juice having high anthocyanin content and antioxidant activity[C]//Journal of Physics: Conference Series.UK:IOP Publishing Ltd,2018:1013.
[3]HAN K H,SEKIKAWA M,SHIMADA K,et al.Anthocyanin-rich purple potato flake extract has antioxidant capacity and improves antioxidant potential in rats[J].British J Nutr,2006,96(6):1125-1134.
[4] ZHAO J G,YAN Q Q,LU L Z,et al.In vivo antioxidant,hypoglycemic,and anti-tumor activities of anthocyanin extracts from purple sweet potato[J].Nutr Res Pract,2013,7:359-365.
[5]HERAWATI E R N,SANTOSA U,SENTANA S,et al.Protective effects of anthocyanin extract from purple sweet potato (Ipomoea batatas L.) on blood MDA levels,liver and renal activity,and blood pressure of hyperglycemic rats[J].Prev Nutr Food Sci,2020,25(4):375.
[6] MULYAWANTI I, BUDIJANTO S, YASNI S.Stability of anthocyanin during processing,storage and simulated digestion of purple sweet potato pasta[J].Indon J Sci,2018:1-8.DOI:http//dx.doi.org/10.21082/ijas.v.19.n1.2018.p.1-8.
[7]方忠祥,倪元颖,李洪民.紫肉甘薯中花青素在不同环境条件下稳定性的研究[J].食品与发酵工业,2002(10):31-34.
[8]孙倩怡,任珅,鲁宝君,等.蓝莓花青素的稳定性研究[J].营养学报,2017,39(4):400-404.
[9]CHEN C C,LIN C,CHEN M H,et al.Stability and quality of anthocyanin in purple sweet potato extracts[J].Foods,2019,8(9):393.
[10]邹颖,卜智斌,余元善,等.酶法制备紫马铃薯汁及其乳酸菌发酵特性[J].食品工业科技,2020,41(2):16-20.
[11]曾雪丹.高压脉冲电场预处理紫薯汁液应用于低酒精度饮料酒发酵的研究[D].雅安:四川农业大学,2020.
[12]赵晶,郝金伟,李萌,等.紫马铃薯与百香果复合果蔬汁饮料[J].食品工业,2019,40(9):56-61.
[13]申光辉,李志洪,赵清锋,等.以紫色马铃薯酶解汁液为辅料的浓色啤酒发酵工艺优化及抗氧化活性[J].华南农业大学学报,2021,42(2):124-132.
[14]郑宁.紫薯汁的酶解工艺及其饮料的开发[D].福州:福建农林大学,2013.
[15]王显凤,吴品江,魏萍,等.田口(Taguchi)实验设计法优选中药材补骨脂的提取工艺[J].成都中医药大学学报,2010,33(2):80-83.
[16]范洪岩,杨瑞飞,刘晓峰,等.酒精发酵副产物生产微生物发酵饲料工艺初探[J].酿酒,2023,50(1):130-133.
[17]邢爽.白酒发酵过程中酯类物质形成机理的研究[D].天津:天津科技大学,2018.
[18]钱建强,姜长军,杨溪林,等.啤酒糖度测量仪[J].工业计量,1999(2):36-38.
[19]吴闯.白刺果花青素性质研究及产品开发[D].大连:大连工业大学,2020.
[20]黄筱静.影响苹果浊汁品质关键因素的研究[D].北京:中国农业大学,2005.
[21]许铭珠.葡萄皮花青素提取物与蛋白质的相互作用及其对色素稳定性的影响[D].无锡:江南大学,2015.
[22]谭亮,李玉林,杲秀珍,等.改进pH示差法检测不同植物源性食品中花青素的方法[J].食品与发酵工业,2022,48(21):276-285.
[23]DAMSA F,WOINAROSCHY A,OLTEANU G.Quantification of total flavonoid and total anthocyanin content from purple potato[J].Rev Chim(Bucharest),2015,66(2):227-229.
[24]王贝,侯益明.pH示差法测定花青素含量的方法研究[J].山东化工,2021,50(21):94-96.
[25]殷丽琴,彭云强,钟成,等.高效液相色谱法测定8个彩色马铃薯品种中花青素种类和含量[J].食品科学,2015,36(18):143-147.
[26]刘雷,陈黎,李华,等.高效液相色谱法测定不同开花时期大马士革Ⅲ玫瑰(Rosa damascene tyigintipetala)花青素种类及含量[J].四川林业科技,2020,41(4):58-63.