党参来源于桔梗科植物党参(Codonopsis pilosula(Franch.)Nannf.)、素花党参(Codonopsis pilosula Nannf.var.modesta(Nannf.)L.T.Shen.)或川党参(Codonopsis tangshen Oliv.)的干燥根,具有健脾益肺、养血生津等功效[1]。现代研究证明,党参具有增强免疫系统功能、抗炎、调节内分泌系统等药理作用[2]。通常生产上党参的药用部位为根部,而茎叶部分则常作为生产副产品丢弃。近年来的研究发现,党参茎叶所含的皂苷、黄酮、多糖、营养成分等与根部接近[3-6],具有较强的抗氧化、增强免疫力等作用,因此对党参茎叶进行开发研究,对于党参资源的综合利用具有重要意义。
随着微生物发酵技术的广泛应用,中药发酵已成为一种提高传统中药活性成分含量、降低毒性的有效方法[7]。中药材在一定条件下借助微生物及其产生的酶等作用,一方面增加有效成分的溶出,另一方面促使大分子物质分解,使有效成分透过细胞膜,更好的被机体吸收利用,提高药效。张命龙等[8]研究发现,牛蒡根在灵芝发酵前后化学成分差异较大,并新产生三萜酸和腺苷,具有明显的生物转化作用;在灵芝菌液体发酵人参茎叶研究中,可明显改变其化学成分,得到抗肿瘤活性更佳的药效物质,可作为新药研发得原料药[9]。
为了充分利用党参茎叶,本研究以党参茎叶多糖含量为响应值,在单因素试验基础上,采用Box-Behnken响应面法,对灵芝菌液体发酵党参茎叶条件进行研究,并对其发酵前后成分进行比较分析,以期为党参茎叶的开发与利用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
灵芝菌(BNCC336079):北纳创联生物科技有限公司;党参茎叶:采自山西省陵川县党参道地产区;马铃薯:市售。
1.1.2 化学试剂
D-(+)-葡萄糖(分析纯):斯坦福分析化学公司;芦丁(分析纯):成都普菲德生物技术有限公司;人参皂苷Re(分析纯):上海麦克林生化科技股份有限公司G861279;其他试剂均为国产分析纯。
1.1.3 培养基
综合马铃薯葡萄糖琼脂(comprehensive potato dextrose agar,CPDA)培养基:马铃薯煮液100 mL、葡萄糖2 g/100 mL、MgSO40.15g/100mL、KH2PO40.3g/100mL、琼脂粉2g/100mL、维生素B1(vitamin B1,VB1)0.01 g/100 mL。
营养型培养基:蒸馏水100 mL、葡萄糖2 g/100 mL、酵母粉0.2 g/100 mL、MgSO4 0.1 g/100 mL、KH2PO4 0.1 g/100 mL、蛋白胨0.5 g/100 mL。
以上培养基均在115 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
SW-CJ-2FD净化工作台:上海博迅实业有限公司医疗设备厂;BSD-WF2200光照全温振荡器:常州金坛精达仪器制造有限公司;FD-1A-50真空冷冻干燥机:北京博医康实验仪器有限公司;Ultra-3660系列紫外-可见分光光度计:普源精电科技股份有限公司。
1.3 方法
1.3.1 种子液制备
在超净工作台上将保藏的灵芝菌斜面划线接种于CPDA培养基,28 ℃恒温培养,观察平板直至长满菌丝。用无菌接种锄和接种铲从CPDA培养基上取0.5×0.5 cm2小正方形块,接种至100 mL营养型培养基中,28 ℃、170 r/min培养5 d,得种子液用于接种发酵。
1.3.2 党参茎叶液体发酵
将党参茎叶晾干后剪碎成长约1 cm的小段(茎∶叶=1∶1),粉碎过40目。精确称量5 g的党参茎叶药材粉末,置于250 mL锥形瓶,加入100 mL营养型培养基,用10%盐酸溶液或4%氢氧化钠溶液将党参茎叶液体培养基调至pH值为5.0,封口膜及牛皮纸包扎,121 ℃高压蒸汽灭菌20 min后接种菌龄为5 d的种子液5%,置于28 ℃、170 r/min摇床培养7 d,冻干即得党参茎叶发酵物。接种时应注意全程保持无菌状态。
1.3.3 党参茎叶液体发酵条件优化
(1)单因素试验设计
以发酵产物多糖含量为考察指标,分别考察发酵时间(5 d、6 d、7 d、8 d、9 d)、料液比(2.5∶100、5.0∶100、7.5∶100、10.0∶100、12.5∶100(g∶mL))、种子液菌龄(3 d、5 d、7 d、9 d、11 d)、接种量(3%、5%、7%、9%、11%)、培养基初始pH值(5、6、7、8、9、10)对党参茎叶液体发酵的影响。
(2)响应面试验设计
在单因素试验的基础上,选择发酵时间(A)、料液比(B)、培养基初始pH值(C)3个因素为自变量,根据Box-Behnken设计进行3因素3水平的响应面分析试验,响应面试验因素与水平见表1。
表1 党参茎叶液体发酵条件优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken tests for optimization of liquid fermentation conditions of stems and leaves of Codonopsis
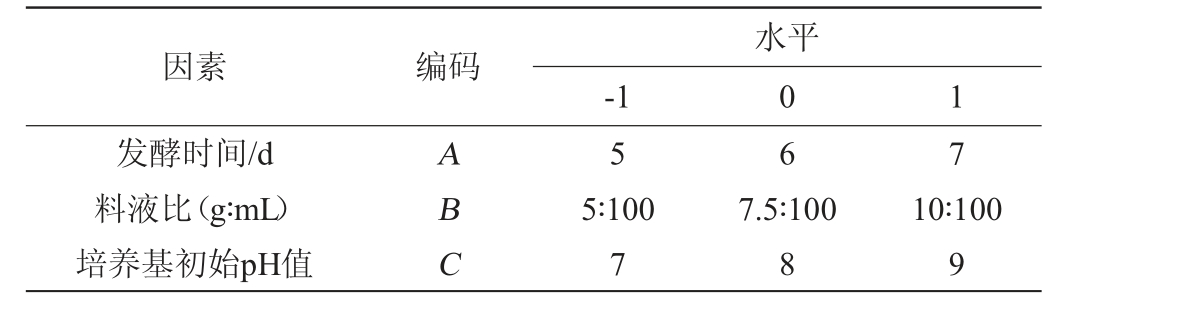
因素 编码发酵时间/d料液比(g∶mL)培养基初始pH值-1水平0 1 ABC 5 6 7 5∶100 7 7.5∶100 8 10∶100 9
1.3.4 测定方法
总皂苷:参考文献[10-11]测定;总黄酮:参考文献[12]测定;总多糖:参考文献[13]测定。
1.3.5 数据处理
采用Origin 2022进行数据处理和分析;响应面优化、显著性差异分析采用Design-Expert 13统计软件。
2 结果与分析
2.1 单因素试验
2.1.1 发酵时间对党参茎叶多糖含量的影响
由图1可知,随着发酵时间的延长,党参茎叶发酵液多糖含量呈先升高后降低最后趋于平稳的趋势。在发酵第6天发酵液多糖含量达到最大值,为39.355 3 mg/g;发酵6 d后多糖含量迅速下降,在第8天时发酵液多糖含量达最低并趋于稳定。究其原因可能是由于发酵前期为菌体对数生长期,培养基中营养成分充足,灵芝菌生长速率提高,代谢产物量不断积累,使得第6天多糖含量达到最高;发酵6 d后进入稳定衰退期,菌体自身会分泌一些酶,分解菌体的同时使得菌体代谢产物合成速率下降,表现为多糖含量下降并趋于稳定。因此,选择发酵时间为6 d。
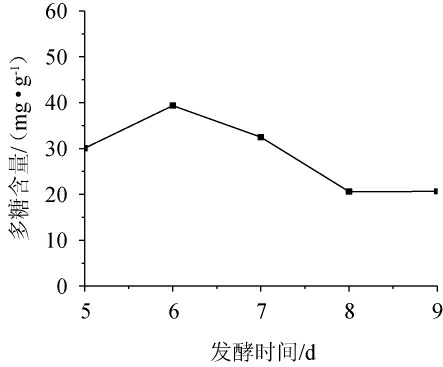
图1 发酵时间对多糖含量的影响
Fig.1 Effect of fermentation time on polysaccharides contents
2.1.2 料液比对党参茎叶多糖含量的影响
由图2可知,随着料液比的变化,党参茎叶发酵液多糖含量呈先升高后降低的趋势。在料液比为7.5∶100(g∶mL)时多糖含量达到最大值,为55.311 8 mg/g;之后多糖含量随着料液比的变化而降低。分析认为,发酵基质含水量过低,会使党参茎叶发酵液浓稠,灵芝菌生长缓慢甚至生长困难,影响多糖物质溶出;发酵基质含水量过高,会降低发酵基质中氧气的含量和空气的流通,导致灵芝菌生长和代谢产物合成缓慢。因此,选择料液比为7.5∶100(g∶mL)。
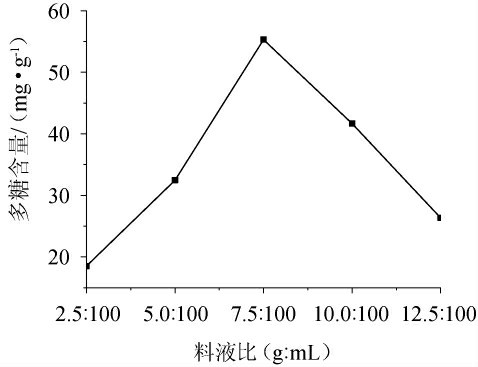
图2 料液比对多糖含量的影响
Fig.2 Effect of solid to liquid ratio on polysaccharide content
2.1.3 种子液菌龄对党参茎叶多糖含量的影响
由图3可知,随着菌龄的增加,党参茎叶发酵液多糖含量呈现先升高后降低最后趋于平稳的趋势。在菌龄为5 d时,多糖含量达到最大值,为32.472 3 mg/g,之后发酵液多糖含量随着菌龄的增加而降低。分析认为,菌龄<5 d时菌丝体量较少,酶活性较低,不能在发酵培养基中快速增殖;菌龄>5 d后,由于营养物质的耗竭,菌丝生物量就不再增加,趋于老化,抑制了代谢产物活动,表现为多糖含量下降。因此,选择菌龄为5 d。
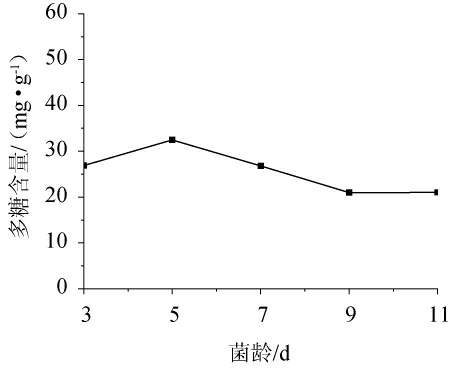
图3 种子液菌龄对多糖含量的影响
Fig.3 Effect of age for bacteria in seed liquid on polysaccharide content
2.1.4 接种量对党参茎叶多糖的影响
由图4可知,随着接种量的增大,党参茎叶发酵液多糖含量呈现先升高后降低的趋势。当接种量<5%时,随接种量的增加,发酵培养基中灵芝菌数量不断增加,多糖产量增高;接种量为5%时,多糖含量达到最大值,为32.472 3 mg/g;之后随接种量的增大,多糖含量开始逐渐降低。分析认为,随接种量的增加,相应的代谢产物也增加;而接种量过高时,培养基中营养成分不能满足菌株的正常生长代谢,使得代谢产物减少。因此,选择接种量为5%。

图4 接种量对多糖含量的影响
Fig.4 Effect of inoculum on polysaccharide content
2.1.5 培养基初始pH值对党参茎叶多糖的影响
由图5可知,随着培养基初始pH值的升高,多糖含量呈现先升高后降低的趋势。当培养基初始pH为8时,多糖含量达到最大值,为49.196 4 mg/g;当培养基初始pH为9~10时逐步降低且趋于稳定。分析认为,在弱碱性条件下发酵有利于灵芝菌菌丝体的生长,更利于代谢物质的合成。因此,选择培养基初始pH为8。
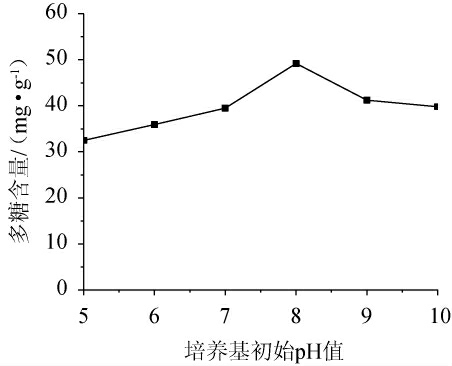
图5 培养基初始pH值对多糖含量的影响
Fig.5 Effect of initial pH of medium on polysaccharide content
2.2 发酵工艺响应面分析试验
2.2.1 响应面分析方案与试验结果
在单因素试验结果的基础上,以发酵时间(A)、料液比(B)、培养基初始pH值(C)3个因素为自变量,以多糖含量(Y)为响应值进行3因素3水平响应面分析试验,试验设计与结果见表2,方差分析见表3。
表2 党参茎叶液体发酵条件优化响应面试验设计与结果
Table 2 Design and results of response surface tests for optimization of liquid fermentation conditions of stems and leaves of Codonopsis

试验号 A B C 多糖含量/(mg·g-1)1 2 3 4 5 6 7 8 9 1 0-1 1-1 1-1 1-1-1-1 1 1 0 0 0 0 -0 0 0 0 -1-1 1 1 -1-1 11 12 13 14 15 16 17 1 0 0 0 0 0 0 0 0 0 1 1 -1 1 0 0 0 0 0 1 1 0 0 0 0 0 21.088 6 32.766 2 19.112 0 36.949 9 19.604 9 30.120 9 15.377 7 36.659 1 27.129 5 27.910 2 25.946 9 34.442 1 32.202 2 34.983 1 34.963 5 34.716 0 33.158 6
表3 回归模型方差分析
Table 3 Variance analysis of regression mode
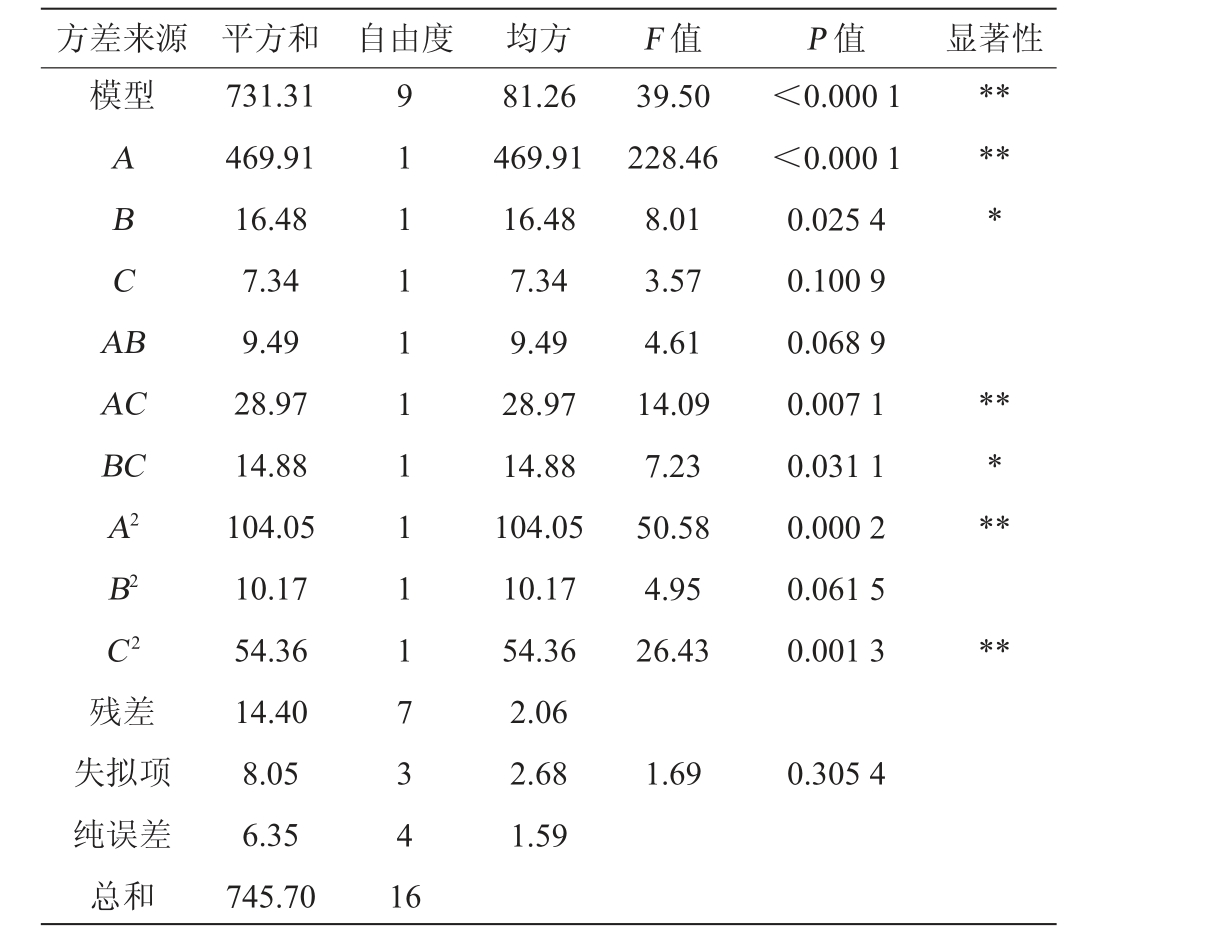
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著
(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B*****AC BC A2 B2 C2残差失拟项纯误差总和731.31 469.91 16.48 7.34 9.49 28.97 14.88 104.05 10.17 54.36 14.40 8.05 6.35 745.70 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 81.26 469.91 16.48 7.34 9.49 28.97 14.88 104.05 10.17 54.36 2.06 2.68 1.59 39.50 228.46 8.01 3.57 4.61 14.09 7.23 50.58 4.95 26.43<0.000 1<0.000 1 0.025 4 0.100 9 0.068 9 0.007 1 0.031 1 0.000 2 0.061 5 0.001 3*******1.69 0.305 4
利用Design-Expert 13对表2数据进行二次多元回归拟合,得到多糖含量预测值(Y)对编码自变量A、B和C的二次多项回归方程:Y=37.31+7.66A+1.44B+0.96C+1.54AB+2.69AC+1.93BC-4.97A2-1.55B2-3.59C2。由表3可知,模型的P<0.000 1,极显著,说明该模型有效,失拟项P=0.305 4,失拟项不显著(P>0.05),说明该模型不存在失拟现象。
方差分析显著性检验表明,决定系数R2=0.980 7、校正决定系数R2Adj=0.955 9,回归方程模型与实际试验拟合性较好,试验误差小,证明应用响应面优化发酵条件是可行的,具有参考性。由P值可知,一次项A、二次项A2、C2和交互项AC对多糖含量的影响极显著(P<0.01),一次项B和交互项BC对多糖含量的影响显著(P<0.05),其他项对多糖含量的影响不显著(P>0.05)。由F值可知,各因素对多糖含量影响次序为发酵时间>料液比>培养基初始pH值。
2.2.2 发酵工艺的优化
根据回归方程绘制各因素交互作用对党参茎叶发酵液多糖含量影响的响应面图和等高线图,结果见图6。由图6可知,发酵时间与培养基初始pH值、料液比与培养基初始pH值交互作用较强,响应面的曲线图中曲线走势较陡,其影响显著;发酵时间与料液比交互作用较弱,响应面的曲线图中曲线走势较平滑,其影响不显著;与表3方差分析结果一致。由图6可知,A、B、C存在极值点,对多糖含量的二次多项式数学模型解逆矩阵得知,最佳发酵条件为发酵时间6.559d、料液比7.638∶100(g∶mL)、培养基初始pH值8.093,此工艺条件下党参茎叶发酵液多糖含量的预测值为37.066 mg/g。

图6 发酵时间、料液比、培养基初始pH值间交互作用对党参茎叶发酵液多糖含量影响的响应曲面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between fermentation time, solid to liquid ratio and initial pH of medium on polysaccharide content in fermentation broth of stems and leaves of Codonopsis
2.2.3 验证试验
考虑到试验设备和实际操作可行性等因素进行调整,确定党参茎叶发酵液发酵条件为发酵时间6.5 d、料液比7.5∶100(g∶mL)、培养基初始pH值8,在此条件下进行3次平行试验,所得党参茎叶发酵液多糖含量平均值为37.590 3 mg/g,与理论值误差为1.41%,表明响应面方法可靠,可较好地应用于党参茎叶与灵芝菌液体共发酵工艺的优化。
2.3 发酵前后有效成分含量变化研究
由表4可知,发酵后的党参茎叶的总皂苷含量较发酵前降低了56.22%,总黄酮含量较发酵前降低了77.33%,多糖含量较发酵前提高了115.32%。
表4 发酵前后有效成分比较
Table 4 Comparison of effective components before and after fermentation
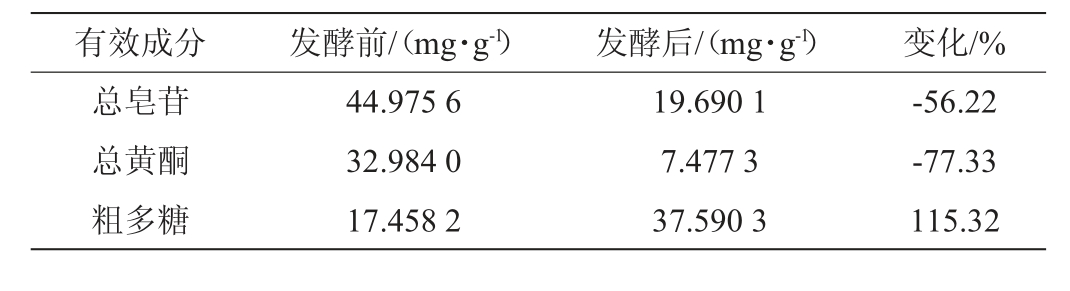
有效成分 发酵前/(mg·g-1) 发酵后/(mg·g-1) 变化/%总皂苷总黄酮粗多糖44.975 6 32.984 0 17.458 2 19.690 1 7.477 3 37.590 3-56.22-77.33 115.32
3 讨论
发酵时间是微生物生产及产物的累积的关键因素之一,发酵前期主要为菌体增长阶段,中期主要为代谢物质积累阶段,后期主要为营养物质大量消耗阶段[15]。胡永乐等[16]研究发现,蛹虫草与厚朴双向液体发酵3~9 d,发酵液胞外多糖含量迅速增长,在12 d时达到最高值,继续培养至15 d,发酵液胞外多糖逐渐减少;在黑霉菌固体发酵黄芪研究中,7 d前发酵液中多糖含量随发酵时间的增长而增高,至7 d时达到最高,但当发酵时间再增加时多糖含量却有略微下降[17]。与以上结果类似,本研究发现培养前期发酵培养基中营养充足时,菌体生长达到一定阶段产生大量多糖,但随着发酵天数的增加,灵芝菌迅速消耗培养基中多糖,出现营养供给不足,表现为多糖含量急速下降,此时发酵体系有可能生成较多次生代谢产物。料液比决定了发酵基质的初始含水量,对液体发酵具有重要的影响[18]。在蛹虫草与厚朴双向液体发酵研究中,当厚朴的添加量从2 g增加至5 g,发酵所得胞外多糖含量明显增加,添加量为5 g时胞外多糖含量达到最大值,继续增加至6 g时,胞外多糖含量呈下降趋势[16];张庆明等[19]对灵芝菌-玄七通痹胶囊药渣双向发酵结果进行分析,含水量过多或过少都会对灵芝菌的生长代谢造成不利影响,当固液比为1∶1.5时,发酵产物中多糖含量达到最高。本研究中,高压灭菌期间,较高含水率将使发酵基质即党参茎叶粉末排列松散,有利于菌体快速繁殖,从而加快菌体对底物的快速利用。同时发酵基质中的水环境也有助于灵芝菌产生多糖的扩散,以及分解后葡萄糖和其他物质的扩散,使更多菌体吸收和利用。发酵基质含水量太低,会使党参茎叶发酵液浓稠,灵芝菌生长缓慢、甚至生长困难。而含水量过高,亦会使发酵基质发粘,造成通气性不佳,影响灵芝菌的生长代谢。在种子培养过程中,菌龄的不同,菌丝生物量及酶的活性均会不同[20]。有研究表明,杏鲍菇液态发酵随着种子液菌龄的增长,菌丝体生物量呈先增长后降低趋势,在第6天菌丝体生物量达到最大值[21];在元蘑液体菌种的优化培养研究中,菌龄在3~11 d,随着菌龄的增加,菌丝体生物量和菌丝球密度先增加后减少,在菌龄为5 d 时的液体菌种,菌丝体的生长情况最佳[22]。与以上研究类似,本研究发现当菌龄<5 d时,种子液中的菌丝体可能由于菌龄太短而菌丝体量太少,酶活性较低,不能很快的在发酵培养基中增殖;菌龄>5 d时,可能是由于营养物质的耗竭,菌丝生物量就不再增加,趋于老化菌体衰老,抑制了代谢活动,进而导致多糖含量不高。综合考虑,党参茎叶灵芝菌液体发酵较适宜的种子液菌龄为5 d。接种量的大小决定培养基中菌体的生长速度[23]。在蛹虫草菌双向发酵杜仲和杨树花研究中,虫草多糖的含量与菌种含量呈正相关,多糖含量也随之增加[24];周向辉[25]利用格式乳酸菌发酵猴头菇研究结果表明,随着格氏乳杆菌接种量的提高,多糖的提取率呈先增长后降低趋势,当接菌量为5%时,提取出的发酵猴头菇多糖提取率最高。与前人结果相似,本研究中随接种量的增加,发酵党参茎叶多糖含量呈先增高后下降趋势。接种量越大,菌细胞数量则越快达到最大值,但当接种量>5%时,发酵培养基中灵芝菌数量过多,需氧量增大,对培养基营养成分消耗加快,但培养基中营养物质有限,其个体营养则会受到限制,从而制约菌体生长,导致多糖含量下降。综合以上因素,党参茎叶灵芝菌液体发酵较适宜的接种量为5%。培养基初始pH值影响真菌生长和发酵代谢产物的重要因素,在碱性条件下发酵更有利于灵芝菌菌丝体的生长[26]。在灵芝-何首乌双向液体发酵研究中,随着发酵培养基初始pH的升高,发酵菌质的抗氧化活性呈先降后升再降趋势,当pH=7时,发酵菌质的抗氧化活性达到最大值,发酵菌质中多糖含量是对照灵芝菌丝体的1.96倍[27];在灵芝-银杏双向液体发酵研究中,随着初始pH值不断增加,新型菌株的还原能力呈先增加又降低的趋势,当pH=7时,多糖含量达到最大值[28]。同样的随着培养基初始pH的升高,本研究中多糖含量呈先降后升再降趋势,当初始pH=8时,多糖含量达到最大值。真菌生长最适pH值和产物形成最适pH值不总是相同,灵芝菌在酸性或碱性环境中均可生长,但发酵物多糖含量在弱碱性环境中达到最高。
本研究中灵芝菌与党参茎叶共发酵后灵芝菌丝体生长良好,说明党参茎叶可为菌丝体生长及活性成分分泌提供物质基础,同时,灵芝菌对共发酵产物中粗多糖、总黄酮、总皂苷的影响存在较大差异。研究表明,南韩灵芝发酵对灵芝-泽泻双向液体发酵菌质粗多糖含量由未发酵基质的5.83%增至发酵后的7.86%[29];灵芝菌发酵玉竹产水溶性多糖较未发酵的培养基提高了73.48%[30];灵芝黄芪双向发酵菌质灵芝多糖组分PG-1相较于未添加黄芪发酵的菌质多糖中的PG-2组分在多糖得率上增加325%[31]。本研究在最佳发酵工艺条件下,与灵芝菌共发酵后党参茎叶粗多糖含量较发酵前提高了115.32%,可能是因为党参茎叶中多糖成分在灵芝菌分泌的酶作用下得到有效分解,使得植物细胞壁分解,胞内有效成分能得到更充分释放,使得多糖的溶出率显著增加,与以上研究结果一致。研究表明,灵芝菌-玄七通痹胶囊药渣双向发酵过程中总皂苷含量随着时间的进行逐渐减少[19];灵芝菌液体发酵人参茎叶后,总皂苷含量较发酵前降低了19.70%[9]。本研究在最佳发酵工艺条件下,与灵芝菌共发酵后党参茎叶总皂苷含量较发酵前降低了56.22%,说明灵芝菌对党参茎叶的皂苷类物质进行了转化,具体机制后续需要进一步探索。研究发现经灵芝菌株个体发酵后,不同品种的枇杷叶总黄酮含量可以视为未检出[32];牛蒡根经灵芝菌丝体发酵后,总黄酮含量由3.47%降低至0.34%[8]。本研究在最佳发酵工艺条件下,与灵芝菌共发酵后党参茎叶总黄酮的含量较发酵前下降的更为显著,可能是因为发酵过程中灵芝菌代谢的丰富酶系破坏了黄酮类化合物能发生显色反应的邻苯二酚结构,或培养基高温灭菌对黄酮类化合物有一定的降解作用,与以上研究结果一致。
4 结论
本试验以灵芝菌为发酵菌种,通过单因素和响应面优化党参茎叶液体发酵工艺,得到最佳条件为发酵时间6.5 d、料液比7.5 g/100 mL、培养基初始pH值为8,在此条件下测得发酵党参茎叶粗多糖平均含量为37.590 3 mg/g。与发酵前相比,发酵党参茎叶中粗多糖含量增加115.32%,总皂苷含量降低56.22%,总黄酮含量降低77.33%。该研究为党参茎叶资源的开发利用提供参考,也可为中药材非药用部位的发酵利用提供实验依据。
[1]国家药典委员会.中华人民共和国药典.一部[M].北京:中国医药科技出版社,2020:65-67.
[2]李力恒,陈昌瑾,胡晓阳,等.党参的化学成分及药理作用研究进展[J].中医药学报,2023,51(3):112-115.
[3]蔡兴航,孙晓春,孙安敏,等.党参茎叶总皂苷提取工艺及其抗氧化活性研究[J].中国农学通报,2018,34(26):146-151.
[4]唐文文,陈垣.党参地上茎叶总黄酮提取工艺及其抗氧化活性[J].江苏农业科学,2021,49(17):171-177.
[5]成铭,皮文霞,陆兔林,等.党参地上部分的党参炔苷、多糖含量测定及影响因素分析[J].中药材,2020,43(5):1092-1098.
[6]任宏远,张兆旺,庞鹤鸣,等.中草药饲料添加剂营养成分研究与利用[J].畜牧兽医杂志,2015,34(3):40.
[7]何栾樱,林子淳,卢建东,等.基于灵芝双向固体发酵雷公藤减毒持效的研究[J].北京化工大学学报(自然科学版),2021,48(4):48-56.
[8]张命龙,杨秋玲,阚慧建,等.基于牛蒡根的灵芝固体发酵菌质化学成分的初步分析[J].中国食用菌,2019,38(3):44-49.
[9]贾雪巍,董金香,于洋,等.灵芝菌液体发酵人参茎叶总皂苷化学成分变化及其抗肿瘤活性[J].吉林大学学报(医学版),2017,43(3):543-549,668.
[10] LIU H, XU R, WANG L.Study on the process of ultrasonic extraction of total saponins from Panax notoginseng peduncles[J].Int J Food Sci Agr,2023,7(2):278-284.
[11]王婧,刘慧婷,柴庆凯,等.响应面分析法优化超声提取党参皂苷的工艺研究[J].天津农业科学,2017,23(10):14-20.
[12]刘薇.潞党参中总黄酮的提取及含量测定[J].质量安全与检验检测,2020,30(5):62-64.
[13]刘霜,刘林莉,刘琴,等.白及块茎与须根多糖提取及止血作用研究[J].贵州科学,2022,40(1):19-23.
[14]樊精敏,白瑞斌,王艳,等.酵母发酵鲜党参中多糖的提取及免疫活性研究[J].中国现代应用药学,2022,39(19):2444-2450.
[15]GE Y,DUAN Y F,FANG G Z,et al.Polysaccharides from fruit calyx of Physalis alkekengi var.francheti:Isolation,purification,structural features and antioxidant activities[J].Carbohyd Polym,2009,77(2):188-193.
[16]胡永乐,张传海,林崇展,等.响应面法优化蛹虫草与厚朴双向液体发酵工艺[J].菌物学报,2020,39(5):944-954.
[17]刘超,陈俊荣,于春涛.响应面法优化黄芪固体发酵工艺[J].食品研究与开发,2019,40(7):184-188.
[18]张惠捷,罗盟錡,王金龙,等.响应面法优化混合益生菌发酵银杏叶药渣工艺条件的研究[J].中国饲料,2022,716(24):108-114.
[19]张庆明,徐云燕,顾宁宁,等.灵芝菌-玄七通痹胶囊药渣双向发酵工艺的研究[J].东南国防医药,2016,18(6):585-590.
[20]辛宇,邱智东,伍法杰,等.灵芝菌生物发酵北五味子果汁降酸工艺优化及其护肝作用[J].食品工业科技,2020,41(2):177-182,194.
[21]王艳萍,赵娜,付丽红,等.杏鲍菇液态发酵培养的初步研究[J].中国酿造,2012,31(5):30-35.
[22]李延雷,陈炜东,滕素岩,等.元蘑液体菌种的优化培养[J].安徽农业科学,2016,44(26):1-3.
[23]薛燕,李丽,刘光荣,等.铁皮石斛多糖液态发酵工艺及其抗氧化活性研究[J].食品工业科技,2017,38(9):155-159.
[24]李建正,张丽,刘应鹏,等.蛹虫草菌双向发酵杜仲和杨树花的工艺研究[J].现代牧业,2022,6(4):10-14.
[25]周向辉.响应面法优化发酵猴头菇多糖提取工艺研究[J].化学工程师,2023,37(5):10-14,52.
[26]唐晨旻,张劲松,刘艳芳,等.pH对灵芝液态发酵代谢物及抗氧化活性的影响[J].菌物学报,2023,42(2):570-583.
[27]辛燕花,张铁丹,张建华,等.灵芝-何首乌双向液体发酵菌质抗氧化活性研究[J].食用菌学报,2018,25(3):63-71.
[28]辛燕花,梁彬,王颖霞,等.灵芝-银杏双向液体发酵条件优化及抗氧化的研究[J].菌物学报,2017,36(10):1427-1435.
[29]胡永乐,尤永芳,黄薇,等.灵芝-泽泻双向发酵前后菌质活性成分分析[J].新乡学院学报,2020,37(6):10-13,20.
[30]罗灿,刘玉洁,陈劭舒,等.灵芝菌液体发酵玉竹产水溶性多糖的工艺优化和抗氧化性研究[J].中国酿造,2022,41(11):180-186.
[31]裴智鹏,郑雪艳,何冰芳,等.灵芝-黄芪双向发酵菌质多糖的分离纯化及生物活性研究[J].生物加工过程,2019,17(5):521-529.
[32]张平,李晔,陈婵,等.灵芝菌株固体发酵对枇杷叶主要活性成分的影响[J].天然产物研究与开发,2016,28(2):242-246,209.