曲为酒之骨,说明大曲在白酒酿造过程中的重要性[1]。大曲是富集培养有益微生物及其代谢产物的载体[2],在酿酒发酵过程中起着重要的糖化、发酵等作用[3],可以有效地将原料中的淀粉、蛋白质等大分子物质转化为酒精及特征风味物质,并能在发酵过程中为白酒提供大量的呈香呈味物质或香味前体物质[4-5]。大曲发酵的产量和质量与酿造过程中的微生物密切相关[6],有好酒必有好曲,大曲的品质是白酒质量的重要影响因素[7]。
大曲是酿酒的源头,为了满足与日俱增的市场需求,提高大曲的生产质量和产量便成为泥坑酒业的迫切任务。酵母菌作为产酒的主体[8],是产酒的主要途径[9]。传统酿酒行业使用的大曲,含有丰富多样的物系、菌系和酶系[10],其分离出的菌株主要有霉菌、酵母菌、细菌和放线菌[11],为传统固态酿酒发酵提供了香味成分[12]、能量营养物[13]以及催化动力[14-15]。中高温大曲的顶温60 ℃,此时绝大部分酵母菌死亡[16],影响了白酒主体呈香及呈味物质的合成与积累,不利于保持成曲质量的稳定性。泥坑酒业所处地域夏季气温炎热潮湿,昼夜温差小,最高气温在35 ℃以上,致使曲坯入房初始温度达到30 ℃以上,难以满足酵母菌等微生物附着、繁殖最佳条件[17]。成曲在夏季贮存后,会出现糖化力较高和发酵力较低现象。
本研究为提高泥坑浓香型白酒中高温大曲综合生产性能,筛选综合性能较高的酵母菌株,采用2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)显色初筛,以糖液发酵液酒精度、发酵力、总酸、总酯、还原糖为检测指标复筛,并考察筛选菌株菌株之间的配比对成曲发酵特性的影响,探索复配酵母菌株强化高温大曲的生产应用价值,以进一步完善浓香型白酒酿造微生物功能菌菌种资源库,为培曲强化菌种的合理搭配、使用及大曲科学化生产提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料中高温大曲样品:河北凤来仪酒业有限公司制曲车间;高粱:辽宁阜新;大麦、小麦:来自本地。
1.1.2 试剂
淀粉酶(酶活2 000 U/g)、糖化酶(酶活50 000 U/g):邢台新华酶制剂厂;2,3,5-氯化三苯基四氮唑(分析纯):青岛海博生物技术有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:青岛海博生物技术有限公司。
富集培养基(4°Bé麦芽汁培养基):大麦洗净浸泡12 h,阴凉处发芽后晒干研磨成粉,取粉碎样若干,加入4倍麦芽质量的水,搅拌均匀,在55~60 ℃水浴内保温糖化4 h,取出过滤,滤液调整到4°Bé麦芽汁。0.1 MPa灭菌20 min。
分离培养基:YPD固体培养基1 000 mL,孟加拉红0.033 g,氯霉素0.1 g。121 ℃灭菌20 min。
初筛培养基:TTC下层培养基为YPD固体培养基,121 ℃灭菌20 min;TTC上层培养基,TTC 0.5 g、葡萄糖5 g、琼脂15 g、蒸馏水1 000 mL、pH 6.0,115 ℃灭菌20 min。培养基灭菌后,冷却至60 ℃时,加入TTC溶液10 mL完全覆盖下层菌落,立即倾于底层平板上。
发酵培养基:取一定质量高粱粉,加入5倍质量蒸馏水蒸煮1~2 h,按20 U/g高梁粉质量加入淀粉酶液化,液化完全后补加与高粱粉同等质量的60 ℃水[18],加入0.5%的糖化酶,搅拌均匀,在60 ℃糖化3~4 h,用稀碘液试之不显蓝色,再加热至90 ℃,用细白布过滤,测量溶液的糖度并调整为6°Bé。121 ℃灭菌20 min[19]。
6°Bé糖液培养基:100 mL6°Bé糖液,115 ℃灭菌20 min。小麦粉培养基:取曲块压制前加水后的小麦粉加入10倍质量28 ℃温水。
1.2 仪器与设备
DNP-9052电热恒温培养箱:上海精其仪器有限公司;HH-6恒温数显水浴锅:金坛新瑞仪器厂;THZ-103B摇床:上海一恒科学仪器有限公司;BSM520.3电子分析天平:上海卓精电子天平有限公司;SW-CJ-2G净化工作台:上海精密仪器仪表有限公司;XSP-BM-10C显微镜:上光仪器有限公司;75A高压灭菌锅:上海三申医疗器械有限公司。
1.3 方法
1.3.1 菌株富集
曲坯入曲室培养30~40 h时,选取大曲表面白色和淡黄色“突起”和片状“白斑”(酵母菌),用接种环勾取3~4环,放入富集培养基中,30 ℃、150 r/min恒温振荡培养20 h,静置,挑去菌膜附着物,去掉上清液,取沉淀酵母二环,连续富集2~3次。
1.3.2 菌株分离和纯化
将富集后的菌株按10倍梯度稀释,吸取稀释梯度为10-4、10-5、10-6的菌液0.1 mL均匀涂布于分离培养基,30 ℃恒温静置培养24 h,挑取生长良好,菌落、细胞形态不同且均符合酵母菌特性菌株,于分离培养基平板划线纯化,30 ℃恒温培养24 h。
1.3.3 TTC平板显色初筛
将分离纯化得到的酵母菌点接到TTC下层培养基上,35 ℃培养8~16 h,待长出菌落后,倒入10 mL TTC上层培养基,覆盖菌落,于30 ℃避光保温,培养16 h。TTC能使酵母菌的代谢产物产生呈色变化,鉴别酵母中呼吸酶活力的高低,即酵母产酒精效率的优劣[20],颜色越深,效率越高[21]。因此初筛出颜色深红,生长良好的菌株。
1.3.4 发酵实验复筛
将初筛菌种接种至YPD液体培养基中活化,30 ℃、150 r/min振荡培养20 h后,接种到发酵培养基中,每瓶接种2 mL,发酵栓密封,30 ℃恒温培养10 d,测定其酒精度、发酵力、总酯、总酸及还原糖含量。
1.3.5 筛选菌株复配
将通过初筛、复筛得到的Y1、Y2、Y3 3株菌株,单独接种至6°Bé糖液培养基中,在30 ℃、150 r/min条件下振荡培养24 h后,得到种子液。分别制备Y1-Y2、Y1-Y3、Y2-Y3混合种子液(体积比1∶1)、Y1-Y2-Y3混合种子液(体积比1∶1∶1),再将混合后的种子液以2%接种量接种至6°Bé糖液培养基中,30 ℃、150 r/min振荡培养20 h,酵母菌计数。得到混合培养后的Y1-Y2、Y1-Y3、Y2-Y3、Y1-Y2-Y3菌悬液,接种至发酵培养基中进行发酵实验。
1.3.6 筛选菌株接种量优化响应面试验
根据生产实践经验,以菌株发酵液的主成分综合得分(Z综合得分)(Y)为响应值,菌株Y1接种量(A)、菌株Y2接种量(B)和菌株Y3接种量(C)为自变量,利用Design-Expert 8.0.6软件进行响应面试验,响应面试验因素及水平见表1。
表1 菌株接种量优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for strain inoculum optimization

因素A 菌株Y1/(×108个·mL-1)B 菌株Y2/(×108个·mL-1)C 菌株Y3/(×108个·mL-1)-1水平0 1 5.4 2.2 1.3 6.4 2.6 1.5 7.4 3.0 1.7
1.3.7 酵母强化大曲生产应用
曲块入房时,将筛选酵母按最佳比例制成混合培养液,用毛刷沾培养液均匀涂抹于曲坯表面,然后将曲坯放入培养室内培养,同时以没有涂混合培养液的大曲作对照,培曲30 d后取样,检测大曲质量指标(水分、酸度、发酵力、糖化力、液化力、皮张),培曲条件同常规管理。
1.3.8 分析检测
发酵力、水分含量、酸度、糖化力、液化力的测定:参考QB/T 4257—2011《大曲通用分析方法》;皮张的测定:参照《白酒生产技术全书》[10];酒精度的测定:采用酒精计;总酸的测定:采用氢氧化钠滴定法;还原糖的测定:采用斐林试剂滴定法;总酯的测定:参考GB/T 10345—2022《白酒分析方法》中的皂化法;酵母菌数:采用血球计数板计数。
1.3.9 主成分分析及综合得分
主成分分析(principal component analysis,PCA)用于多指标综合评价,在分析过程中经过数学变换生成相对于人为确定较少的权数,减少了工作量,有助于更客观地描述处理的效果[22]。根据林海明等[23]的方法计算2个主成分与原来5个品质指标的标准化数据的线性组合,即各主成分的表达式,其线性组合为:
第一主成分:Z1=0.284×发酵力-0.412×酸度+0.18×总酯+0.311×酒精度-0.092×还原糖,
第二主成分:Z2=-0.096×发酵力-0.305×酸度+0.565×总酯-0.029×酒精度+0.367×还原糖。
应用这一线性组合计算出各主成分值和方差贡献率(Z1为67.997、Z2为30.701),最后利用各个主成分的方差贡献率得到综合主成分函数:Z综合得分=67.997×Z1+30.701×Z2。
1.3.10 数据处理
使用Excel 2016整理,采用Design Expert 8.0.6软件进行响应面试验设计,并运用SPSS 16.0统计软件对实验结果进行PCA,每组试验重复3次。
2 结果与分析
2.1 酵母菌的分离筛选
2.1.1 酵母菌的分离、初筛
共分离纯化8株菌落形态不同的菌株,菌落均为乳(洁)白色,圆润,易挑起,结合细胞形态初步鉴定8株菌株为酵母菌属。通过菌落形态观察和菌落是否带有酒酯香味为依据,选取菌落大而凸起、酒酯香味浓郁的4株菌作进一步筛选。在相同培养条件下,菌落的大小和TTC颜色的深浅可反映酵母菌的增殖能力和活力,即产酒能力越强,颜色越明显[24-25]。其中,共得到菌落颜色呈深红色的3株菌,编号分别为Y1、Y2、Y3,其菌落、细胞形态见图1。

图1 菌株Y1、Y2、Y3的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strains Y1, Y2 and Y3
2.1.2 酵母菌的复筛
酵母菌能在无氧条件下将糖类机质转化为酒精[26],并产生二氧化碳[27-28]。因此可根据发酵液中的酒精度、总酸、总酯、还原糖以及发酵力来判断酵母菌的生命活力及产酒产酯能力[29]。菌株Y1、Y2、Y3的发酵能力检测结果见表2。
表2 筛选菌株发酵能力检测结果
Table 2 Fermentation ability results of the screened strains

菌株 酒精度/%vol总酸/(g·L-1)总酯/(g·L-1)发酵力/[g·(g·72 h)-1]还原糖/(g·100 mL-1)Y1 Y2 Y3 2.31 1.42 3.51 7.75 6.94 6.76 16.24 21.81 6.66 3.96 3.06 4.46 2.62 3.41 1.93
由表2可知,菌株Y1发酵液的酒精度为2.31%vol,总酯为16.24 g/L,说明菌株Y1有较强的产酒能力及产酯能力,菌株Y2发酵液的酒精度为1.42%vol,总酯为21.81 g/L,说明菌株Y2产酯能力在3株菌株中最强,但产酒能力较弱,菌株Y3发酵液的酒精度为3.51%vol,总酯为6.66 g/L,说明菌株Y3产酒能力在3株菌株中最强,但产酯能力最弱。此外,菌株Y1的总酸含量最高(7.75 g/L),菌株Y2的还原糖含量最高(3.41 g/100 mL),菌株Y3的发酵力最高,为4.46 g/(g·72 h)。
2.2 复配菌株发酵性能分析
混合培养结果表明3株菌间有较好的共生能力,但在发酵性能上是否存在协同促进作用需要一步研究证明,因此本试验先对3株菌之间进行复配发酵试验,复配菌株发酵能力检测结果见表3。
表3 复配菌株发酵能力检测结果
Table 3 Fermentation ability results of the mixed strains

菌株组合酒精度/%vol总酸/(g·L-1)总酯/(g·L-1)发酵力/[g·(g·72 h)-1]还原糖/(g·100 mL-1) Z综合得分Y1-Y2 Y1-Y3 Y2-Y3 Y1-Y2-Y3 0.58 3.10 2.70 2.59 8.76 7.62 5.92 6.12 17.60 17.07 16.78 17.42 2.61 4.74 4.52 4.58 2.54 1.65 2.19 1.89 260.64 368.93 414.80 423.68
由表3可知,复配菌株综合得分由高到低的顺序为:菌株Y1-Y2-Y3、Y2-Y3、Y1-Y3、Y1-Y2,分别为423.68、414.80、368.93、260.64。Y1-Y2-Y3组合的综合得分最高,为最优试验组,表明从大曲中筛选出的这3株菌能够较好地进行菌株协同发酵。
2.3 菌株接种量优化响应面试验
2.3.1 响应面试验结果
响应面试验设计及结果见表4,方差分析见表5。采用Design Expert 8.0.6软件对表4中的数据进行多项二次拟合,并获得Z综合得分对菌株Y1接种量(A)、菌株Y2接种量(B)和菌株Y3接种量(C)的二次多项回归方程为:
表4 接种量优化响应面试验设计与结果
Table 4 Design and results of response surface experiments for strain inoculum optimization
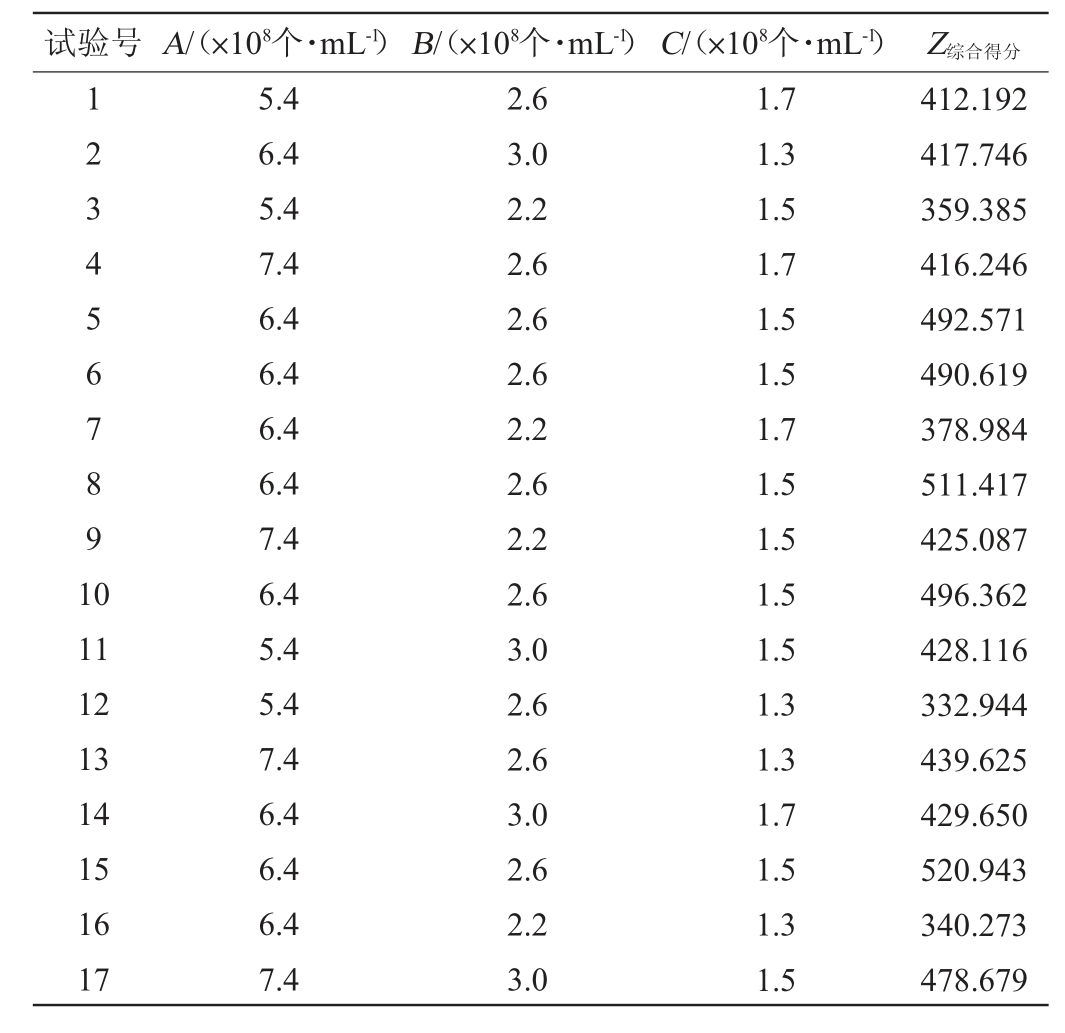
试验号A/(×108个·mL-1)B/(×108个·mL-1)C/(×108个·mL-1) Z综合得分1234567891 0 11 12 13 14 15 16 17 5.4 6.4 5.4 7.4 6.4 6.4 6.4 6.4 7.4 6.4 5.4 5.4 7.4 6.4 6.4 6.4 7.4 2.6 3.0 2.2 2.6 2.6 2.6 2.2 2.6 2.2 2.6 3.0 2.6 2.6 3.0 2.6 2.2 3.0 1.7 1.3 1.5 1.7 1.5 1.5 1.7 1.5 1.5 1.5 1.5 1.3 1.3 1.7 1.5 1.3 1.5 412.192 417.746 359.385 416.246 492.571 490.619 378.984 511.417 425.087 496.362 428.116 332.944 439.625 429.650 520.943 340.273 478.679
表5 回归模型的方差分析
Table 5 Variance analysis of regression model
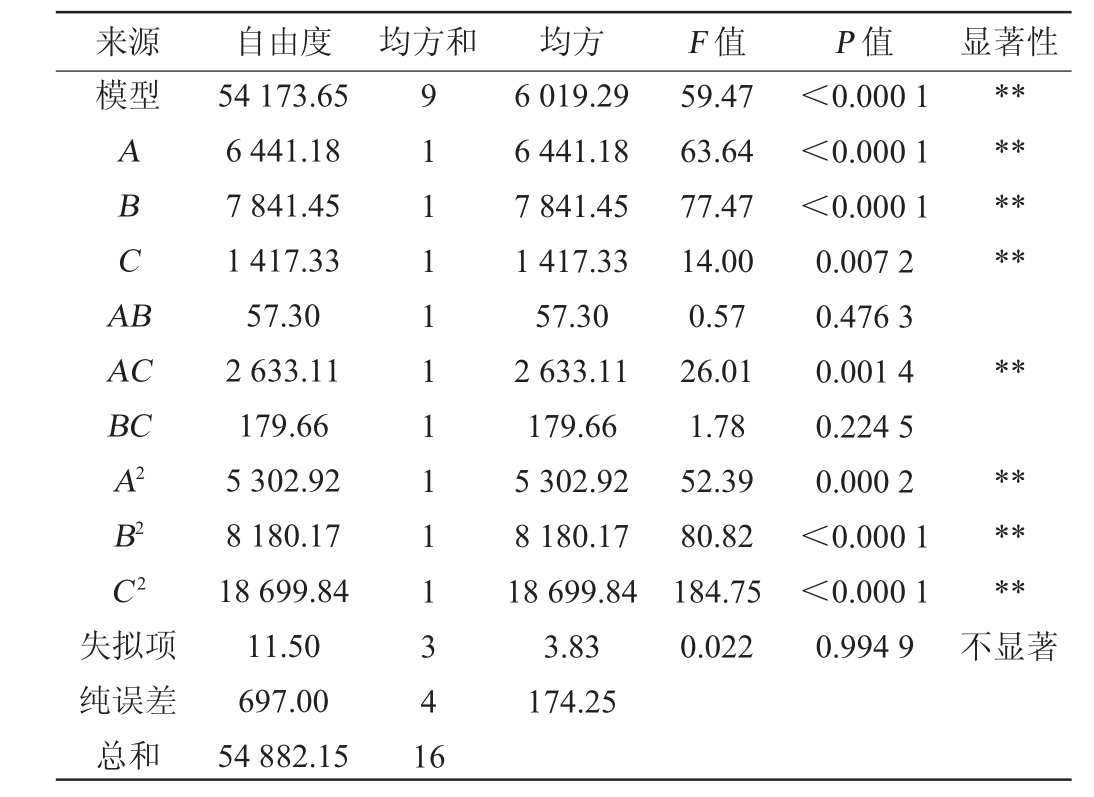
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著
(P<0.01)。
来源 自由度 均方和 均方 F 值 P 值 显著性模型ABCA B********AC BC A2 B2 C2失拟项纯误差总和54 173.65 6 441.18 7 841.45 1 417.33 57.30 2 633.11 179.66 5 302.92 8 180.17 18 699.84 11.50 697.00 54 882.15 9111111111341 6 6 019.29 6 441.18 7 841.45 1 417.33 57.30 2 633.11 179.66 5 302.92 8 180.17 18 699.84 3.83 174.25 59.47 63.64 77.47 14.00 0.57 26.01 1.78 52.39 80.82 184.75 0.022<0.000 1<0.000 1<0.000 1 0.007 2 0.476 3 0.001 4 0.224 5 0.000 2<0.000 1<0.000 1 0.994 9********不显著
由表5可知,该模型极显著(P<0.000 1),失拟项不显著(P值=0.994 9>0.05),说明该回归模型可靠。另外,模型的决定系数R2=0.987 1,调整决定系数R2Adj=0.970 5,说明拟合程度良好,表明该回归模型可用于综合得分值的预测。由P值可知,一次项A、B、C,交互项AC,二次项A2、B2、C2对综合评分值影响极显著(P<0.01),其他项对结果影响不显著(P>0.05);由F值可知,影响Z综合得分的因素顺序为:菌株Y2接种量(B)>菌株Y1接种量(A)>菌株Y3接种量(C)。
2.3.2 各因素间交互作用的响应面分析
响应面越陡峭、等高线图越接近椭圆,说明两因素间交互作用对响应值的影响越大[30]。各因素间交互作用对Z综合得分影响的响应曲面及等高线见图2。
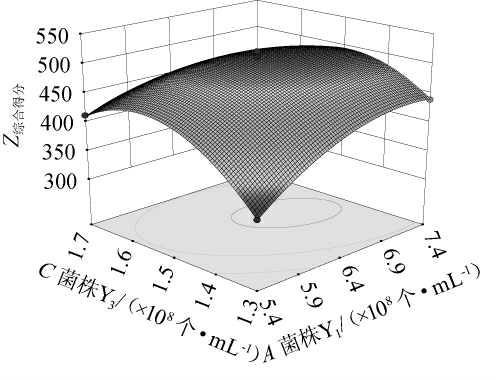
图2 菌株Y1、Y3接种量间交互作用影响综合得分值的响应面及等高线
Fig.2 Response surface and contour lines of the effect of the interaction between strain Y1 and Y3 inoculum on the overall score value
由图2可知,交互项AC的响应面较陡峭,等高线形状最接近椭圆,对Z综合得分的影响极显著(P<0.01),这与方差分析结果一致。
由Design-Expert 8.0.6软件预测出菌株Y1、Y2和Y3的接种量分别为6.9×108个/mL、2.7×108个/mL、1.5×108个/mL,在此优化条件下,Z综合得分理论值为513.107,为方便实际生产操作,将菌株接种量条件修正为:7.0×108个/mL、3.0×108个/mL、1.5×108个/mL,在此条件下进行3次平行验证试验,Z综合得分实际值为513.096,与预测值相差不大,验证了该模型具有较好的准确性。
2.4 酵母强化大曲的生产应用
对照曲与试验曲理化指标的检测结果见表6。
表6 对照曲与试验曲理化指标分析结果
Table 6 Analysis results of physicochemical indexes in control and experimental Daqu

液化力/[g·(g·h)-1]试验曲对照曲曲样 发酵力/[g·(g·72 h)-1]水分/%酸度/(mmol·10 g-1)糖化力/[mg·(g·h)-1]皮张/cm 3.46 0.66 13.36 13.58 1.17 1.08 994 932 0.22 0.66 1.12 1.06
由表6可知,经过酵母强化后,所生产的大曲发酵力、糖化力和液化力分别为3.46 g/(g·72 h)、994 mg/(g·h)、1.12 g/(g·h),与对照曲相比,分别提高了424%、6.7%和5.7%,尤其发酵力明显提升。所生产的大曲水分含量为13.36%,比对照曲降低0.22%,说明发酵能排出更多的水分,发酵比对照曲更良好;皮张为0.22 cm,比对照曲减少0.44 cm,说明残余淀粉减少,淀粉利用率提升,发酵更彻底;酸度为1.17 mmol/10 g,比对照曲增加0.09 mmol/10 g,说明复配酵母菌株活力增强,曲质更优良。
3 结论
本研究从中高温大曲中共分离纯化出8株菌株,其中,3株产酒性能良好的菌株Y1、Y2、Y3,其最佳接种量分别为7.0×108个/mL、3.0×108个/mL、1.5×108个/mL,在此优化复配条件下,主成分Z综合得分为513.096,采用该菌株生产的强化大曲发酵力、糖化力和液化力分别为3.46 g/(g·72 h)、994 mg/(g·h)、1.12 g/(g·h),比优化前提高了424%、6.7%和5.7%。
[1]刘宇,王莉,管桂坤,等.基于强化大曲的北方酱香型白酒品质提升研究[J].酿酒科技,2021(11):80-84.
[2]董琪,蒲顺昌,刘飞翔,等.浓香型大曲中功能性酵母菌的筛选、鉴定及发酵特性研究[J].中国酿造,2020,39(6):106-110.
[3]候召华,宁浩然,聂帅,等.国内外酒曲研究进展[J].特产研究,2013(3):72-75.
[4]姚粟,葛媛媛,李辉,等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业,2012,38(6):1-6.
[5]明红梅,余欢,周健,等.大曲中产香兼性厌氧细菌的筛选及挥发性成分分析[J].食品与机械,2015,31(2):7-10.
[6]YANG J G,DOU X,MA Y Y.Diversity and dynamic succession of microorganisms during Daqu preparation for Luzhou-flavour liquor using second-generation sequencing technology[J].J I Brewing,2018,124(4):498-507.
[7]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[8]张宗启.酱香型白酒大曲中功能微生物菌群及其酶系研究进展[J].酿酒科技,2021(3):92-99.
[9]张杰,程伟,李娜,等.夏秋茶大曲与传统中温大曲中微生物群落及多样性研究[J].酿酒科技,2021(11):36-44.
[10]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2013:51-53,64-69.
[11]罗方雯,黄永光,涂华彬,等.基于高通量测序技术对茅台镇酱香白酒主酿区酵母菌群结构多样性的解析[J].食品科学,2020,41(20):127-133.
[12]金伟,谢玉球,时晓,等.浓香型白酒生产中酿酒微生物研究与应用现状[J].酿酒科技,2016(3):106-109.
[13]炊伟强.大曲传统感官评价与其内在质量、理化指标的关系[D].无锡:江南大学,2010.
[14]孙利林,李立郎,胡萍,等.酱香型白酒大曲的微生物菌群结构及风味成分分析[J].现代食品科技,2020,36(8):299-306,193.
[15]李大和.白酒酿造与技术创新[M].北京:中国轻工业出版社,2017:217-282.
[16]王珍,张永利,孟勤燕,等.耐高温高产酒精酵母的筛选及其大曲生产应用研究[J].酿酒科技,2020(1):107-114.
[17]谭崇尧,徐军,王令.影响大曲“穿衣”的因素及其解决措施[J].酿酒科技,2009(6):70-71,75.
[18]曹润洁,周鹏磊,何宏魁,等.堆积酒醅中酵母菌代谢的分析研究[J].酿酒科技,2021(11):57-60.
[19]MENG X,WU Q,WANG L,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J].J Ind Microbiol Biot, 2015,42(12):1601-1608.
[20] HAN Z S, TIAN J Y, LIANG H, et al.Measuring the activity of heterotrophic microorganism in membrane bioreactor for drinking water treatment[J].Bioresource Technol,2013,130:136-143.
[21]夏玙,谢军,黄丹,等.异常威克汉逊酵母的麸曲制作工艺优化[J].食品研究与开发,2018,39(22):118-123.
[22]高惠璇.应用多元统计分析[M].北京:北京大学出版社,2005:265-290.
[23]林海明,杜子芳.主成分分析综合评价应该注意的问题[J].统计研究,2013,30(8):25-31.
[24]刘宇,管桂坤,万自然,等.浓香型白酒酿造环境中酵母的筛选及其组合发酵特性[J].酿酒科技,2021(10):140-144.
[25]李晓欢,何宏魁,李冬冬,等.高耐受酿酒酵母的筛选及酵母曲制备工艺的优化[J].酿酒科技,2020(2):110-120.
[26] SRIVASTAVA A K, TRIPATHI A D, JHA A, et al.Production, optimization and characterization of lactic acid by Lactobacillus delbrueckii NCIM 2025 from utilizing agro-industrial byproduct(cane molasses)[J].J Food Sci Technol,2015,52(6):3571-3578.
[27]谭莹,梁思宇.大酒饼在豉香白酒酿造中的作用和特色[J].酿酒科技,2020(2):116-120.
[28]张宗启.酱香型白酒大曲中功能微生物菌群及其酶系研究进展[J].酿酒科技,2021(3):92-99.
[29]穆文彬.提高大曲发酵力的研究[J].酿酒,2010(7):47-50.
[30]黄玉坤,宋亚宁,陈芳,等.基于响应面法优化柱前衍生-高效液相色谱法分析传统郫县豆瓣中8种生物胺[J].西华大学学报(自然科学版),2020,39(6):61-71.