食用植物酵素是以植物为原料,经微生物发酵制得的含有特定生物活性成分可食用的酵素产品[1],具有美容养颜、降脂、解酒、促进消化等[2-3]功效。以原料种类为划分依据可分为包括谷物酵素、水果酵素、蔬菜酵素和药食同源植物酵素类酵素等在内的单一型酵素和复合型酵素[4]。研究表明,经过乳酸菌发酵不仅提高酵素的黄酮等功能性成分含量和人体吸收率[5-9],还增加芳香化合物含量[10]改善风味。药食两用植物酵素兼具食药两用特点,经微生物发酵溶出功效酶、多酚、有机酸和多糖等多种活性成分,能降低活性氧引起的机体伤害[11]。超氧化物歧化酶(superoxide dismutase,SOD)是酵素的功效酶之一,可催化超氧阴离子自由基(O2-·)歧化成分子氧和过氧化氢[12],是生物体内O2-·的天然消除剂,是抗氧化酶防御系统的第一道和最重要的一道防线[13],在应对氧化应激中起关键作用[14],保护生物体细胞。
青稞(Hordeum vulgare L.)为大麦属禾谷类作物[15],富含β-葡聚糖、多酚等功能因子,具有抗氧化、抗肿瘤、降糖、抗心血管疾病等多种生物活性,因此青稞具有改善人体生理功能的潜力[16]。蕨麻(Potentilla anserina L.),藏文中又称“延寿草”、“仙人果”和“戳玛”等,是食药两用植物,为蔷薇科委陵菜属植物鹅绒委陵菜的块根,具有悠久的食用历史,在我国主要分布在青藏高原地区[17-18]。多糖、黄酮和皂苷等活性物质赋予蕨麻显著的抗缺氧、抗氧化、增强免疫力和保肝等功效[19-21]。目前,对青稞食饮品的研究有青稞酒类、青稞面包、青稞蛋糕、能浸泡出功能成分的烘焙青稞、通过藏灵菇发酵富集青稞中β-葡聚糖和γ-氨基丁酸等[22-28],对蕨麻也有蕨麻酸奶、蕨麻苏打饼干、未发酵的蕨麻复合饮料等[29-31]研究,而酵素类饮品的研究较少报道。
该研究以16株植物乳杆菌(Lactobacillus plantarum)为研究对象,对其酸、糖耐受性进行分析,选取一株耐受性能优良的发酵菌株,并以筛选菌株为发酵剂,青稞、蕨麻为主要原料制备青稞蕨麻酵素。以超氧化合物歧化酶(SOD)酶活性为响应值,采用单因素试验及响应面试验对其发酵工艺条件进行优化,并对其理化指标及抗氧化活性进行分析,以期为研发含高抗氧化性的青稞蕨麻酵素功能饮品提供参考,丰富青稞和蕨麻资源应用的多样性,为开发具备抗氧化功能的食药同源型酵素提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
青稞和蕨麻:购自拉萨市场;试验涉及的16株植物乳杆菌由西藏自治区农牧科学院农产品开发与食品科学研究所保存,分别为LL1-5、LL1-6、LL2-3、LL2-4、LL3-3、LL3-4、LL4-5、LL5-2、LL5-3、LL5-4、LL6-1、LL6-2、LL6-6、LL7-1、LL7-3和LL7-4。
1.1.2 培养基
MRS琼脂培养基、MRS肉汤培养基:北京陆桥技术股份有限公司。
1.1.3 试剂
无水葡萄糖(分析纯):国药集团化学试剂有限公司;甜酒曲:安琪酵母股份有限公司;可滴定酸检测试剂盒:上海抚生实业有限公司;氨基酸含量检测试剂盒、还原糖含量检测试剂盒、SOD酶活性检测试剂盒、铁离子还原/抗氧化能力(ferric ion reducing/antioxidant power,FRAP)法检测试剂盒:北京索莱宝科技有限公司;1,1二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基(DPPH·)测定试剂盒、抑制与产生超氧阴离子(O2-·)自由基测定试剂盒、羟自由基(·OH)测定试剂盒、植物总酚检测试剂盒、植物类黄酮检测试剂盒:南京建成生物工程研究所有限公司。
1.2 仪器与设备
UV-7502PCS紫外-可见光分光光度计:上海欣茂仪器有限公司;K6600-B酶标仪:北京凯奥科技发展有限公司;PH400 pH计:科邦检测集团有限公司;LRH-250生化培养箱:上海齐欣科学仪器有限公司;TGL-16MS台式高速冷冻离心机:上海卢湘仪离心机仪器有限公司;TS-5000Z日本INSENT味觉分析系统:北京盈盛恒泰科技有限责任公司。
1.3 方法
1.3.1 青稞蕨麻酵素加工工艺流程及操作要点

操作要点:
原料准备:挑选籽粒饱满软硬适中的青稞40 g,清洗干净后加入约2/3质量的无菌水浸泡24 h,煮至爆腰后控干晾凉至28 ℃备用。干蕨麻洗净后晾干,用粉碎机粉碎后过100目筛,并称取20 g蕨麻粉与青稞混合。
拌曲糖化:向青稞蕨麻混合物中接入甜酒曲[32](0.15 g甜酒曲/10 g干物料),拌曲搭窝,在30 ℃下密封糖化1.5 d。
加糖灭菌:添加一定量的糖可为微生物提供合适的碳源[33]并提升发酵产品的口感,向糖化结束后的半固体物料中补充18 g白砂糖和150 g无菌水,85 ℃下保温2 h灭菌,晾凉至室温。
接种发酵:按3%(V/V)接入筛选菌株,混匀后在35 ℃条件下发酵5 d。
离心灭菌:发酵结束后纱布过滤,室温条件下4 500 r/min离心10 min后分离取上清液,60 ℃巴氏杀菌30 min后即得成品。
1.3.2 发酵剂的筛选
(1)植物乳杆菌种子液的制备
将-80 ℃条件下保存的16株植物乳杆菌解冻后于MRS平板上划线,挑取单菌落入MRS液体培养基中,在30 ℃条件下恒温静置活化16~18 h,重复活化2~3次后制备成107~108 CFU/mL的菌悬液备用。
(2)耐酸能力测定和耐糖能力测定
用2 mol/L HCl和0.1 mol/L NaOH配制不同pH值(3.0、3.5、4.0)的MRS液体培养基,用无水葡萄糖配制不同含糖量(25%、30%、35%)的MRS液体培养基。将上述菌悬液以1%(V/V)的接种量分别接种于上述培养基中,30 ℃静置培养24 h,测定OD600 nm值,以未处理的MRS液体培养基为对照,按照以下公式计算存活率:
式中:A为生长在酸化或糖化处理的MRS液体培养基中植物乳杆菌的OD600 nm值;B为生长在未处理的MRS液体培养基中植物乳杆菌的OD600 nm值。
(3)生长曲线和产酸曲线测定
菌悬液以1%(V/V)接种量接种到MRS液体培养基中,30 ℃静置培养48 h。生长曲线的取样时间为:前16 h内,每隔2 h取样一次,16~48 h内,每隔4 h取样一次测定菌液OD600 nm值;产酸曲线的取样时间为:前8 h内,每隔2 h取样一次,8~48 h内,每隔4 h取样一次测定pH值。
1.3.3 青稞蕨麻酵素发酵工艺优化
单因素试验:采用单因素轮换法分别考察蕨麻添加量(2.4%、4.8%、7.2%、9.6%、12.0%)(以干青稞和糖水的质量计)、发酵时间(1 d、2 d、3 d、4 d、5 d、6 d、7 d)、发酵温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)对青稞蕨麻酵素SOD酶活性的影响。
响应面试验:在单因素试验的基础上,选取蕨麻添加量(A)、发酵时间(B)、发酵温度(C)为自变量,以SOD酶活性(Y)为响应值,设计Box-Behnken试验对青稞蕨麻酵素发酵工艺条件进行优化,因素与水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization

因素A 蕨麻添加量/%B 发酵时间/d C 发酵温度/℃-1水平0 1 7.2 3 25 9.6 4 30 12.0 5 35
1.3.4 分析检测
(1)理化指标和体外抗氧化能力检测
总酸含量、氨基酸含量、还原糖含量、总酚含量、类黄酮含量、SOD酶活性、铁离子还原/抗氧化能力、DPPH·清除能力、抑制O2-·能力、·OH清除能力:均采用相应试剂盒进行检测。
(2)电子舌检测
进样体积25 mL,数据采集时间120 s,采集周期1 s,清洗时间为10 s。电子舌所得所有数据均是以人工唾液(参比溶液)为标准的绝对输出值,电子舌测试人工唾液的状态,模拟人口腔中只有唾液时的状态。其中参比溶液的输出值为无味点(tasteless),参比溶液(reference)由氯化钾和酒石酸组成味觉值。每份样品按照平行测试5次,进行分析处理。导出数据时,将响应值转化成味觉值,开展后续分析。
1.3.5 数据处理
每个试验重复3次,利用Design-Expert 8.0软件进行响应面设计,Origin 2021软件作图,SPSS 21统计软件对数据进行统计处理和显著性分析。
2 结果与分析
2.1 发酵剂的筛选
2.1.1 耐酸能力测定不同菌株对pH值的耐受性试验检测结果见图1。
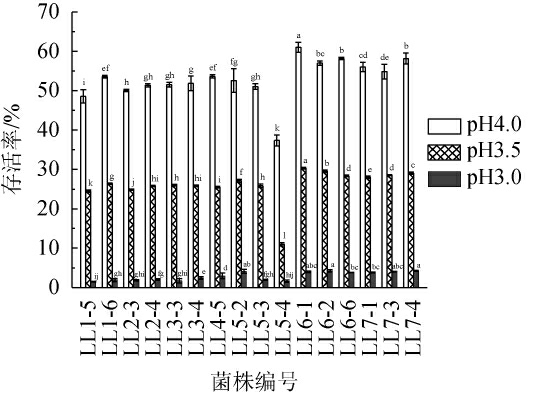
图1 不同菌株对pH值的耐受性
Fig.1 Tolerance of different strains to pH
同一pH值组不同字母代表差异显著(P<0.05)。
由图1可知,低酸环境对16株植物乳杆菌的生长有明显抑制作用。pH 4.0条件下,16株菌株存活率为37.38%~61.05%,其中菌株LL6-1的存活率最高,为61.05%,与其余菌株有显著差异(P<0.05);其次为菌株LL7-4和LL6-6,其存活率分别为58.21%、58.18%。pH 3.5条件下,16株菌株存活率为11.0%~30.34%,其中菌株LL6-1的存活率最高,为30.34%,与其余菌株有显著差异(P<0.05);其次为菌株LL6-2和LL7-4,其存活率分别为29.53%、29.08%。pH 3.0条件下,16株菌株存活率为1.51%~4.26%,其中菌株LL7-4、LL6-2、LL7-3和LL6-1较高,均>4.00%,4株菌的存活率无显著差异(P>0.05);综上可知,菌株LL6-1的耐酸能力较高。
2.1.2 耐糖能力测定
不同菌株对葡萄糖含量的耐受性试验结果见图2。
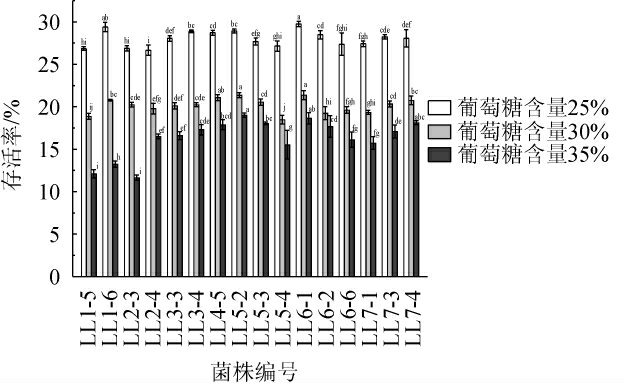
图2 不同菌株对葡萄糖含量的耐受性
Fig.2 Tolerance of different strains to glucose contents
同一糖浓度组不同字母代表差异显著(P<0.05)。
由图2可知,葡萄糖含量为25%时,16株菌株存活率为26.85%~29.76%,其中菌株LL6-1和LL1-6存活率较高,分别为29.76%、29.40%,二者无显著差异(P>0.05)。葡萄糖含量为30%时,菌株存活率为18.48%~21.37%,其中菌株LL6-1、LL5-2和LL4-5存活率较高,分别为21.37%、21.35%和21.08%,三者无显著差异(P>0.05)。葡萄糖含量为35%时,16株菌存活率为12.10%~19.00%,其中菌株LL5-2、LL6-1和LL7-4存活率较高,分别为19.00%、18.64%、18.13%,三者无显著差异(P>0.05)。综上可知,菌株LL6-1的耐糖能力较高。因此,选择耐酸和耐糖能力均较强的菌株LL6-1为发酵剂。
2.1.3 生长曲线和产酸曲线测定
菌株LL6-1的生长曲线和产酸曲线见图3。由图3可知,菌株LL6-1无生长停滞期,直接进入对数生长,培养20 h进入生长稳定期直至48 h,可见其生长速度较快;此外,随着菌株LL6-1的生长,0~16 h内菌液的pH值呈持续下降趋势,当培养16 h时,pH值降至4.0,16~48 h趋于平稳,最终降至3.74,产酸能力较强。
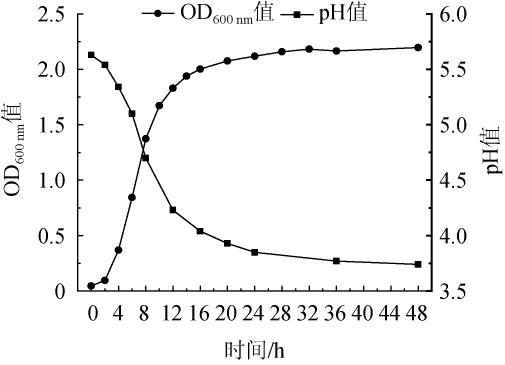
图3 菌株LL6-1的生长曲线和产酸曲线
Fig.3 Growth curve and acid production curve of strain LL6-1
2.2 青稞蕨麻酵素发酵工艺条件优化
2.2.1 单因素试验结果
利用单因素试验考察蕨麻添加量、发酵时间和发酵温度3个因素对酵素SOD酶活性的影响,结果见图4。
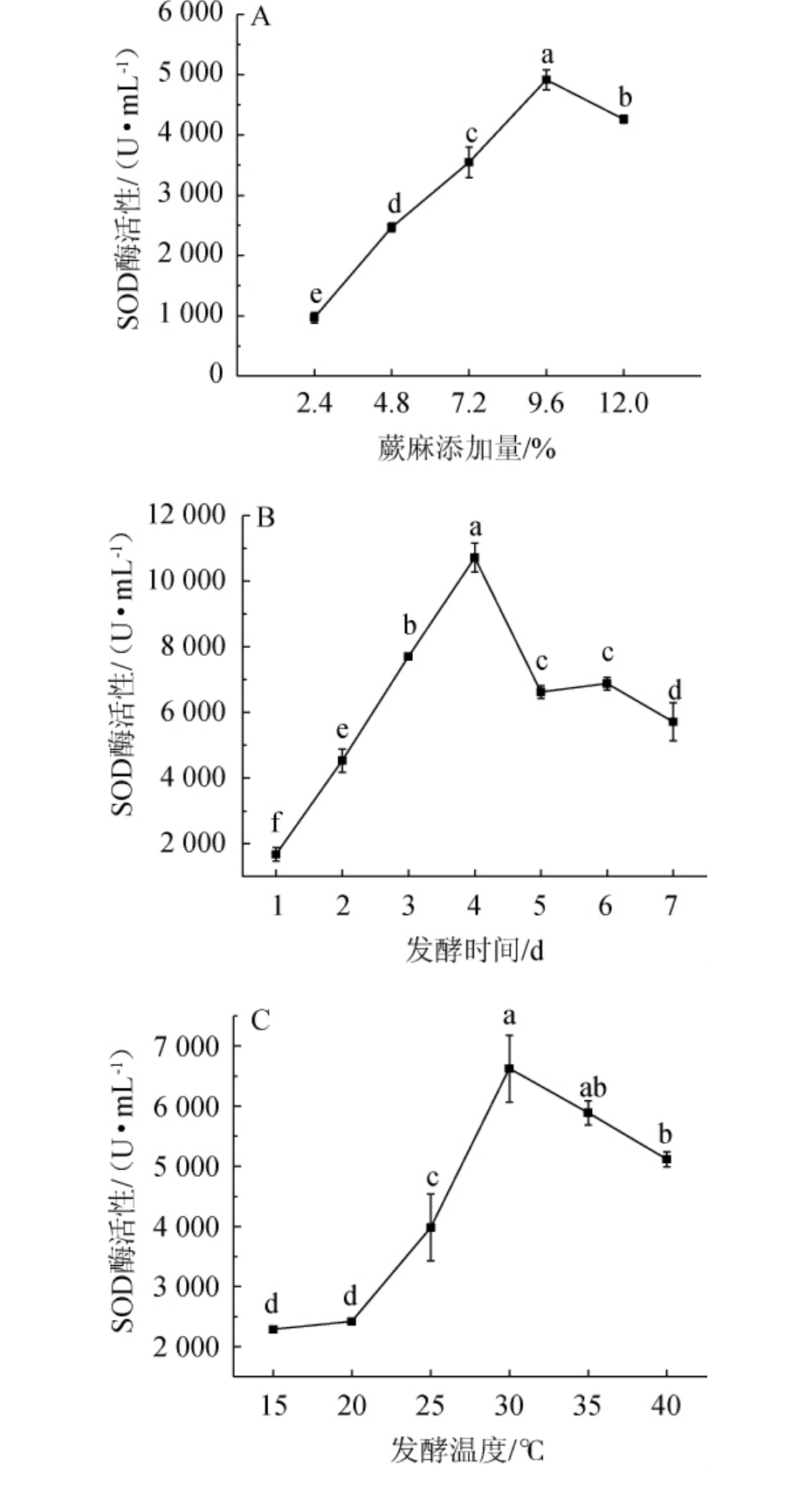
图4 发酵条件优化单因素试验结果
Fig.4 Results of single factor tests for fermentation conditions optimization
图中不同小写字母代表差异显著(P<0.05)。
由图4A可知,当蕨麻添加量为2.4%~12.0%时,SOD酶活逐渐增加;当蕨麻添加量为9.6%时,SOD酶活达到最大值,为4 915.57 U/mL;当蕨麻添加量>9.6%时,SOD酶活有所下降。因此,确定最适蕨麻添加量为9.6%。由图4B可知,当发酵时间为1~4 d时,SOD酶活性逐渐增加;当发酵时间为4 d时,SOD酶活性达到最大,为10 718.21 U/mL;当发酵时间>4 d时,SOD酶活性逐渐下降。随着发酵时间的延长,体系中有机酸酸含量增加pH值降低,降低了SOD酶活性,与程杨等[23]结果一致。因此,确定最适发酵时间为4 d。图4C可知,当发酵温度为15~30 ℃时,SOD酶活性逐渐增加;当发酵温度为30 ℃时,SOD酶活性达到最高值,为6 626.32 U/mL;当发酵温度>30 ℃,SOD酶活性有所下降,这与程杨等[34]的研究结果基本一致。因此,确定最适发酵温度为30 ℃。
2.2.2 响应面试验结果与方差分析
在单因素试验的基础上,选取蕨麻添加量(A)、发酵时间(B)、发酵温度(C)为自变量,以SOD酶活性(Y)为响应值,利用Box-Behnken设计3因素3水平响应面试验,试验设计与结果见表2,方差分析见表3。
表2 发酵条件优化响应面试验设计及结果
Table 2 Design and results of response surface tests for fermentation conditions optimization
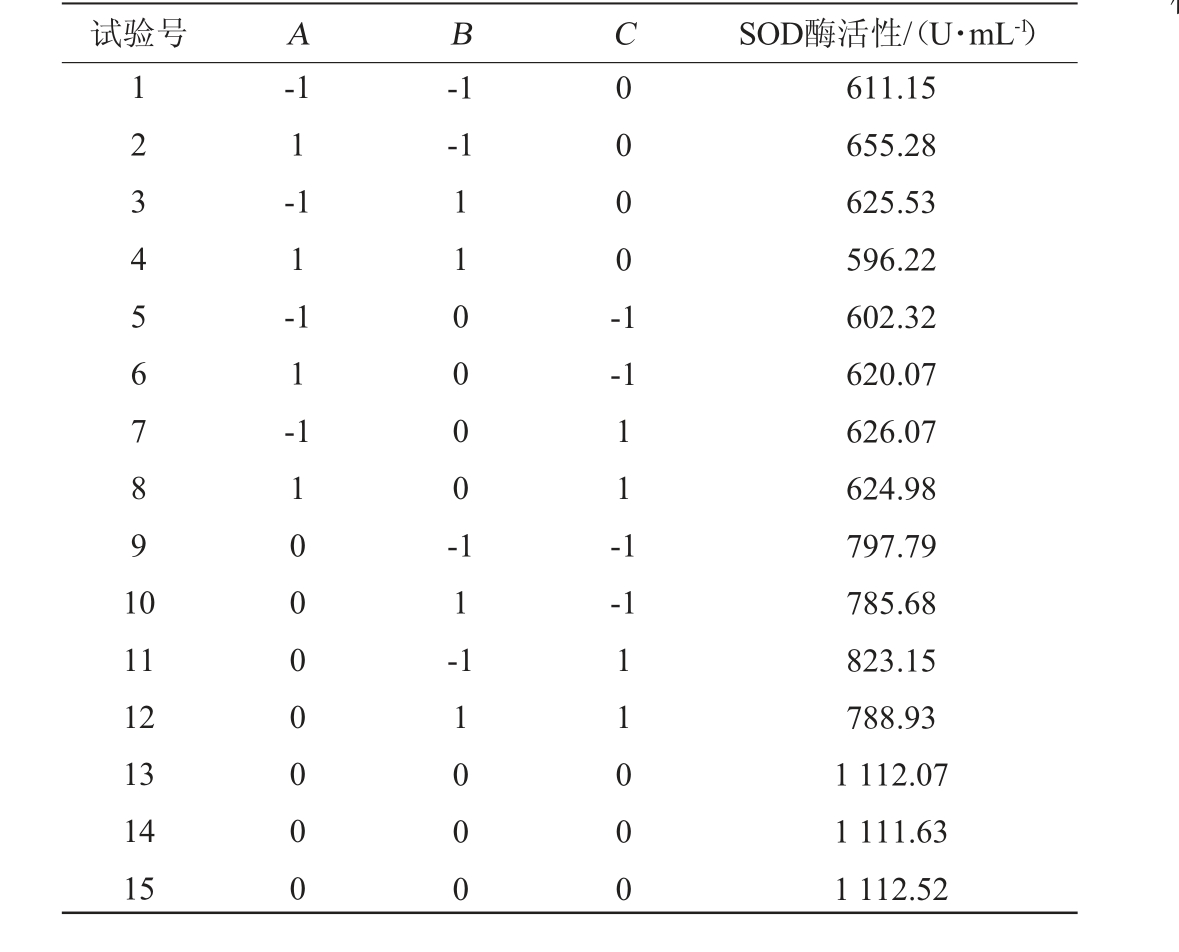
试验号 A B C SOD酶活性/(U·mL-1)1 234 567891 0-1 1 --1-1 1 1 -1 1 -11 0000 -0 0 0 0 -1-1 1 1 -1-1 11 12 13 14 15 110000000 1 1 -11000 11000 611.15 655.28 625.53 596.22 602.32 620.07 626.07 624.98 797.79 785.68 823.15 788.93 1 112.07 1 111.63 1 112.52
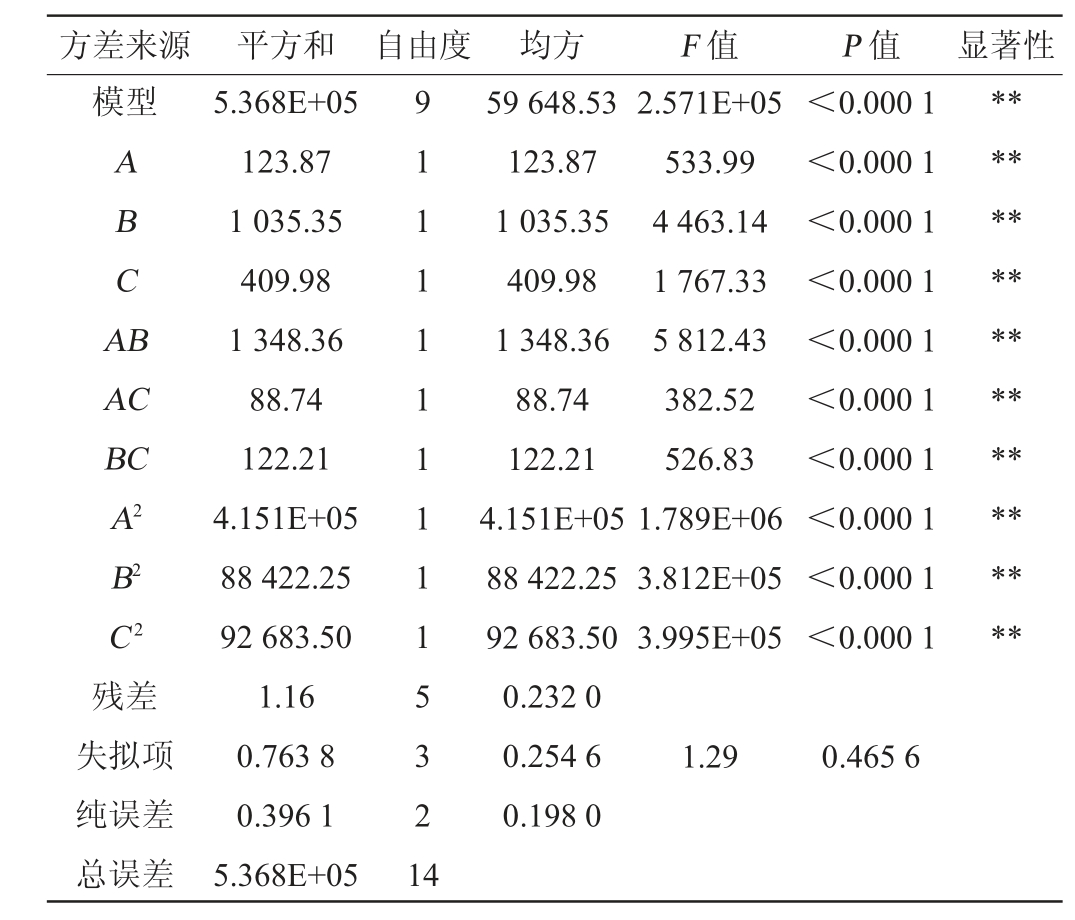
表3 回归方程方差分析
Table 3 Variance analysis of regression equation
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总误差5.368E+05 123.87 1 035.35 409.98 1 348.36 88.74 122.21 4.151E+05 88 422.25 92 683.50 1.16 0.763 8 0.396 1 5.368E+05 9 1 1 1 1 1 1 1 1 1 5 3 2 1 4 59 648.53 123.87 1 035.35 409.98 1 348.36 88.74 122.21 4.151E+05 88 422.25 92 683.50 0.232 0 0.254 6 0.198 0 2.571E+05 533.99 4 463.14 1 767.33 5 812.43 382.52 526.83 1.789E+06 3.812E+05 3.995E+05<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1********************1.29 0.465 6
通过响应面回归分析,获得各因素对SOD酶活性的二次回归方程:
Y=1 112.07+3.93A-11.38B+7.16C-18.36AB-4.71AC-5.53BC-
335.28A2-154.75B2-158.44C2
由表3可知,该二次方程模型极显著(P<0.000 1),失拟项不显著(P值=0.465 6>0.05),决定系数R2=100%,调整决定系数R2adj=100%,表明该模型拟合程度良好,可用该模型推测试验结果。由P值可知,一次项、二次项及交互项均对SOD酶活性的影响极显著(P<0.01)。由F值可知,影响SOD酶活性的各因素主次顺序为:发酵时间(B)>发酵温度(C)>蕨麻添加量(A)。
响应曲面坡度越陡,等高线越密集,表明交互作用显著。各因素之间交互作用对SOD酶活性影响的3D响应曲面见图5。由图5可知,蕨麻添加量(A)、发酵时间(B)、发酵温度(C)因素之间交互作用均极显著(P<0.05)。这与方差分析结果一致。
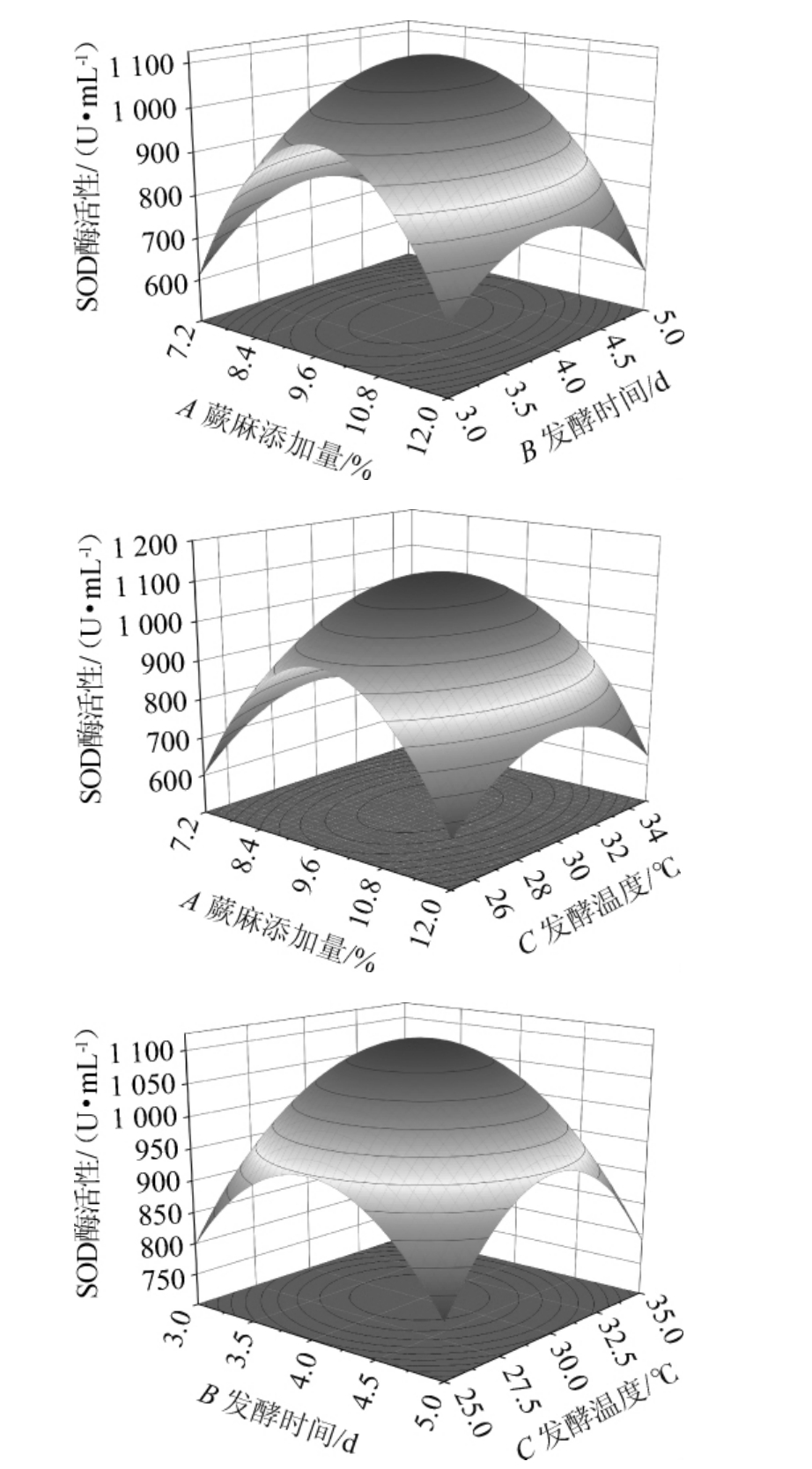
图5 各因素间交互作用对超氧化歧化酶酶活性影响的响应曲面
Fig.5 Response surface plots of interaction between various factors on the superoxide dismutase activity
2.2.3 验证试验
利用Design-Expert 8.0软件分析得到青稞蕨麻酵素的最佳发酵工艺条件为:蕨麻添加量9.62%、发酵时间3.96 d、发酵温度30.11 ℃,在此优化条件下,青稞蕨麻酵素的SOD酶活性预测值为1 112.38 U/mL。为方便操作,将发酵条件修正为:蕨麻添加量9.6%、发酵时间4 d和发酵温度30 ℃,试验重复3次,SOD酶活性实际值为1 112.07 U/mL,实际值接近预测值,说明模型有效,此酵素的SOD酶活性符合QB/T5323—2018《植物酵素》[34]规定的SOD酶活性≥15 U/L的要求。
2.3 酵素的理化指标及抗氧化活性分析
酵素的理化指标及抗氧化活性检测结果见表4。由表4可知,青稞蕨麻酵素总酸含量为3.93%,满足液态食用植物酵素总酸含量0.8 g/100 g的要求[35]。除了含有氨基酸和还原糖,该酵素还含有多酚和类黄酮活性物质,说明其有一定抗氧化功能,其DPPH·、O2-·和·OH清除或抑制能力以及铁离子还原/抗氧化能力分别为1 710.18 μg Trolox/mL、777.17 U/L、1 701.31 U/mL和6.39 μmol/mL,表明青稞蕨麻酵素具有抗氧化活性。
表4 酵素的理化指标及抗氧化活性检测结果
Table 4 Determination results of physicochemical indexes and antioxidant activities of Jiaosu

项目 含量理化指标抗氧化活性总酸/%还原糖含量/(mg·mL-1)氨基酸含量/(μmol·mL-1)总酚含量/(mmol·L-1)类黄酮含量/(mg·L-1)DPPH·清除能力/(μg Trolox·mL-1)铁离子还原/抗氧化能力/(μmol·mL-1)·OH清除能力/(U·mL-1)抑制O2-·能力/(U·L-1)3.93±0.03 29.22±0.25 1.06±0.84 3.03±0.02 184.91±1.56 1 710.18±16.00 6.39±0.05 1 701.31±34.75 777.17±12.25
2.4 酵素的电子舌分析
对照无味点[36]分析青稞蕨麻酵素的味觉特征,电子舌味觉分析雷达图见图6。
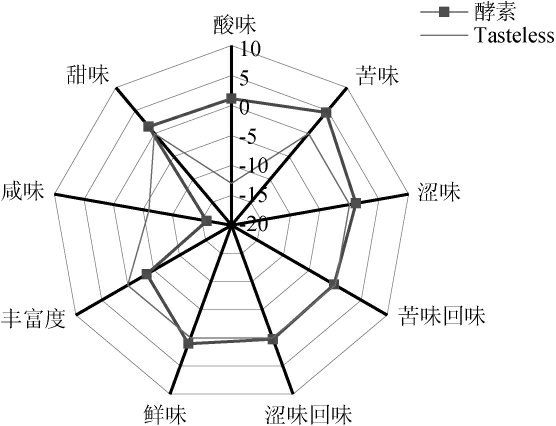
图6 电子舌分析雷达图
Fig.6 Radar map of electronic tongue analysis
由图6可知,青稞蕨麻酵素的咸味和丰富度(鲜味回味)低于无味点,苦味回味和涩味回味接近无味点,表明品尝该酵素时不能尝出咸味和丰富度(鲜味回味),且很难尝出苦味回味和涩味回味。酸味、苦味、甜味、涩味和鲜味高于无味点,说明这5味是该酵素的味觉指标,其中酸味最突出,苦味次之,若食用需增加甜味改善口感。
3 结论
本研究以青稞、蕨麻为主要原料制备酵素,以SOD酶活性为评价指标,确定最优发酵工艺条件为蕨麻添加量9.6%、发酵时间4 d、发酵温度30 ℃。在此优化条件下,SOD酶活性为1 112.07 U/mL。总酸、还原糖、氨基酸、总酚、类黄酮含量分别为3.93%、29.22 mg/mL、1.06 μmol/mL、3.03 mmol/L、184.91 mg/L。此外,其DPPH·、O2-·和·OH清除或抑制能力以及铁离子还原/抗氧化能力分别为1 710.18 μg Trolox/mL、777.17 U/L、1 701.31 U/mL和6.39 μmol/mL,表明青稞蕨麻酵素具有抗氧化活性。本研究不仅丰富了青稞和蕨麻酵素产品种类,还为植物乳杆菌发酵制备抗氧化功能的青稞蕨麻酵素提供数据支持。
[1]中国生物发酵产业协会.T/CBFIA 08003—2017 食用植物酵素[S].北京:中国标准出版社,2017.
[2]PÉREZ-BURILLO S,RUFIÁN-HENARES J A,PASTORIAZ S.Towards an improved global antioxidant response method(GAR+):Physiologicalresembling in vitro digestion-fermentation method[J].Food Chem,2018,239:1253-1262.
[3]邸鹏月,彭宇,李晨,等.基于宏基因组分析桑葚酵素的微生物多样性[J].中国食品学报,2020,20(5):251-257.
[4]朱政,周常义,曾磊,等.酵素产品的研究进展及问题探究[J].中国酿造,2019,38(3):10-13.
[5]赵敏,王瑜,杨娟,等.天麻酵素的发酵工艺优化与品质评价[J].中国酿造,2022,41(10):177-182.
[6]朱德艳.酵母菌发酵制备葛根酵素的工艺优化[J].食品工业科技,2020,41(12):82-87.
[7]PASQUALE F,LOUBNA A,IVANA C,et al.Exploitation of the healthpromoting and sensory properties of organic pomegranate(Punica granatum L.)juice through lactic acid fermentation[J].Int J Food Microbiol,2013,163(2-3):184-192.
[8]YU Y S,XIAO G S,XU Y J,et al.Slight fermentation with Lactobacillus fermentium improves the taste(sugar:acid ratio) of Citrus (Citrus reticulata cv.chachiensis)juice[J].J Food Sci,2015,80(11):M2543-M2547.
[9]PARK J B,LIM S H,SIM H S,et al.Changes in antioxidant activities and volatile compounds of mixed berry juice through fermentation by lactic acid bacteria[J].Food Sci Biotechnol,2017,26(2):441-446.
[10]DI CAGNO R,FILANNINO P,GOBBETTI M.Lactic acid fermentation drives the optimal volatile flavor-aroma profile of pomegranate juice[J].Int J Food Microbiol,2017,248:56-62.
[11]尹欢,方伟.药食两用植物酵素活性成分及发酵机理研究进展[J].农产品加工,2020(3):89-91,94.
[12]张秋月,黎谢飞,曾小群,等.产超氧化物歧化酶乳酸菌的筛选及发酵条件优化[J].中国食品学报,2021,21(10):143-150.
[13]FATTMAN C L,SCHAEFER L M,OURY T D.Extracellular superoxide dismutase in biology and medicine[J].Free Radic Biol Med,2003,35(3):236-256.
[14]MILLER A F.Superoxide dismutases:active sites that save,but a protein that kills[J].Curr Opin Chem Biol,2004,8(2):162-168.
[15]姜欣,江伟,谢三款,等.青稞品种对青稞发酵酒营养与感官品质的影响[J].食品科学,2023,44(5):38-44.
[16]余勤业,吴彤,罗颖婷,等.青稞功能成分与生物活性研究进展[J].食品工业科技,2021,42(5):357-362,368.
[17]慕星星.蕨麻多糖亚硒酸酯的制备表征及抗辐射效应研究[D].兰州:西北师范大学,2019.
[18]刘静贤,罗晓敏,顾健,等.基于代谢组学技术探究藏药蕨麻对环磷酰胺致骨髓抑制的改善作用机制[J].药学学报,2023,58(7):1851-1858.
[19]董浩,李军乔,王雅琼,等.响应面法优化藏药蕨麻总生物碱提取工艺及其抗氧化研究[J].湖南师范大学自然科学学报,2020,43(4):69-74.
[20]ZHAO L X,CHENG J,LIU D,et al.Potentilla anserina polysaccharide alleviates cadmium-induced oxidative stress and apoptosis of H9c2 cells by regulating the MG53-mediated RISK pathway[J].Chin J Nat Med,2023,21(4):279-291.
[21]WU D Y,LIU Z W,FENG Y Y,et al.Development and characterization of DEC-205 receptor targeted Potentilla anserina L polysaccharide PLGA nanoparticles as an antigen delivery system to enhance in vitro and in vivo immune responses in mice[J].Int J Biol Macromol, 2023, 224: 998-1011.
[22]王静,曹新志,宋泽丽,等.不同原料处理方式对青稞白酒及酒醅的影响[J].食品研究与开发,2023,44(6):57-64.
[23]梁丽静,王松涛,贾俊杰,等.不同青稞籽粒品质特性与酿酒品质关系分析[J].食品科学,2022,43(23):27-33.
[24]张烁,王倩,郭志顶,等.β-葡聚糖酶对青稞面包质构特性及其风味物质的影响[J].食品工业科技,2023,44(10):11-19.
[25]HE Y,WANG A X,QIN W Y,et al.Effects of semidry-milling on the properties of highland barley flour and the quality of highland barley bread[J].J Sci Food Agr,2023,103(10):5077-5086.
[26]翟会生,李俏,刘廷辉,等.青稞蒸蛋糕与小麦蒸蛋糕的品质差异[J].应用与环境生物学报,2022,28(4):982-988.
[27]WANG C,TIAN X Y,FANG S J,et al.Brewing characteristics,physicochemicalconstituents,and antioxidant activityofthe infusionsofcolored highland barley roasted at different times[J].J Cereal Sci,2023,110:103639.
[28]张奋搏,陈琼,蒋涛,等.藏灵菇发酵富集青稞中β-葡聚糖和γ-氨基丁酸的工艺优化[J].现代食品科技,2022,38(11):192-199.
[29]王红,张建华,魏廷俊,等.蕨麻牦牛酸奶的工艺优化研究[J].农产品加工,2023(5):52-56.
[30]杜亚飞,王刘星月,黄鑫琦,等.蕨麻苏打饼干的研制及配方优化[J].粮食加工,2022,47(2):36-39.
[31]张晴.野生蕨麻复合饮料主剂工艺与特性研究[D].天津:天津科技大学,2019.
[32]尼玛扎西,张玉红,王姗姗,等.一种高花青素青稞酵素及其酿造方法:CN107114771A[P].2017-09-01.
[33]朱雪洋.沙棘青稞复合酵素制备及其功能活性研究[D].芜湖:安徽工程大学,2022.
[34]程杨,战虎,庞泉.SOD的稳定性及修饰的研究[J].食品研究与开发,2018,39(14):15-18.
[35]中华人民共和国工业和信息化部.QB/T 5323—2018 植物酵素[S].北京:中国标准出版社,2018.
[36]AN X W,WANG Z J,LI J M,et al.Analysis of flavor-related compounds in fermented persimmon beverages stored at different temperatures[J].LWT-Food Sci Technol,2022,163:113524.