白酒是一种源于中国的独特的蒸馏酒[1]。2022年全国酿酒行业完成产品销售收入9 509.0亿元,累计实现利润总额2 491.5亿元,其中白酒行业完成销售收入6 626.5亿元,实现利润2 201.7亿元,白酒在国民经济建设中起着重要的作用。近年来,人们对于健康的意识增强,功能保健型白酒研发是中国行业发展的新趋势。传统白酒是粮谷为原料,以酒曲为糖化发酵剂,通过固态发酵、固态蒸馏而得[2]。进入21世纪后,先进分析仪器的使用,尤其是气相色谱-质谱联机、高效液相色谱-质谱联用等分析技术的应用,已在白酒中检出2 000多种成分,包括酯类、醇类、酸类、吡嗪类、萜烯类、呋喃类、芳香类化合物等多种有益健康成分[3]。一般来说,白酒中的健康因子有两种来源:一种是在白酒复杂的酿造工艺中由酿酒微生物代谢产生;另一种是由酿酒原料本身带入。然而,这些因子所产生的健康促进作用仍然相对受限。因此,健康白酒研究的关注一直在稳步加强[4-5]。近年来,利用中药以及某些具有健康因子的酿造原料赋予白酒更加丰富的风味与保健功能的研究日渐增多[6-7],然而发酵型保健酒中部分活性成分易残留在酒糟,未能充分利用[8]。
苦荞麦(Fagopyrum tataricum(L.)Gaertn.)是起源于我国西南地区的一种重要的药食同源作物,富含维生素和膳食纤维等多种营养物质与生物类黄酮[9-10]。研究表明,苦荞中黄酮具有降低血糖,降低血脂等多种保健及药理功能[11-13],因此苦荞酒中含有的黄酮类物质使其具有一定的保健作用[14-15]。但受限于白酒蒸馏工艺及黄酮类物质的理化性质,其无法蒸馏至酒体而残留于酒糟中,苦荞功能性成分未能得到合理利用[16-17]。周清华等[18]研究出一种黄酮含量达15.27 mg/mL的苦荞浸泡酒工艺,但浸泡时间较长,黄酮类物质利用率不高。汤焘[19]利用苦荞酒糟提取物复配得到优质苦荞酒,为黄酮类物质的充分利用提供了一种开发方向。
超声波辅助提取苦荞黄酮具有设备成本较低和有机溶剂残留较少的特点。然而,其提取物纯度相对较低[20-23]。近年来,大孔树脂已在中草药有效成分的分离和纯化领域得到广泛应用[24-27],这主要归功于其稳定的理化性质、环保优势以及操作简便等特点[28]。李姝等[29]发现,大孔树脂在纯化苦荞黄酮过程中,无需经过再生处理,且具备多次使用的优势。因此,该研究为开发富含黄酮类物质的苦荞酒,通过优化苦荞酒糟总黄酮超声提取工艺,在超声提取的基础上优化了AB-8型大孔树脂纯化苦荞酒糟总黄酮提取物工艺,并得到一种苦荞蒸馏酒的配制方案。旨在为苦荞酒糟中总黄酮化合物的工业化回收利用提供一种新的实验方法以及实验基础。
1 材料与方法
1.1 材料与试剂
苦荞麦:云南昆明;大米:天津小站稻米;根霉曲:昆明市显贡祥胜酒曲厂;酿酒活性干酵母:安琪酵母股份有限公司;D61、001X7树脂:天津南大树脂科技有限公司;D71、AB-8、D301R树脂:天津波鸿树脂科技有限公司;D151树脂:蚌埠东立化工有限公司;芦丁标准品(纯度≥98.0%):北京百灵威科技有限公司;甲醇、氢氧化钠、盐酸(均为分析纯):天津市江天化工技术股份有限公司;乙酸钾(分析纯):天津市永大化学试剂开发中心;三氯化铝(分析纯):天津市百世化工有限公司。
1.2 仪器与设备
ATP-3200蠕动泵:天津奥特赛恩斯仪器有限公司;7230G紫外分光光度计:上海普天分析仪器有限公司;SY-300超声波萃取仪:上海宁商超声仪器有限公司;RE201D旋转蒸发仪:上海博彩仪器有限公司;LD5-10低速离心机:北京医用离心机厂。
1.3 方法
1.3.1 富含黄酮苦荞蒸馏酒制备工艺流程及操作要点

操作要点:
原料处理:选取籽粒丰满,无空壳和霉变的苦荞麦;大米需色泽明亮、均匀和黄斑;苦荞麦与大米质量比为3∶7,洗至清澈无浑浊,补充适量水浸泡6 h。
蒸料糊化:浸泡结束后,蒸煮30~40 min,蒸好的原料疏松不糊,均匀一致。
培菌糖化:蒸煮结束后,冷却至30 ℃左右,加入原料质量2%的根霉曲,搅拌均匀,装瓶,用纱布封口并置于30 ℃恒温培养箱内,培菌糖化24 h。
活性干酵母活化:称取原料质量0.1%的酿酒活性干酵母,按1 g溶于20 mL 4%葡萄糖溶液的比例将其溶解,置于30 ℃下活化0.5~1.0 h。
发酵:将活化后的活性干酵母加入培菌糖化后的原料中,在30 ℃下发酵5~7 d。
蒸馏:待发酵结束后,将发酵醪加适量水稀释至酒精度10%vol左右,再加入上次蒸馏的酒尾,加热开始蒸馏,视酒质情况取初馏酒头1%~2%;继续蒸馏接酒,一直到混合酒液的酒精度为63%vol左右,此为酒基;以后即为酒尾,单独接取,酒尾的大部分掺入下次蒸馏。
苦荞酒糟超声提取:称取晾干的苦荞酒糟5.00 g,加入不同体积分数乙醇溶液,超声提取,离心过滤,以乙醇溶液定容至250 mL,在不同超声功率下进行提取。
大孔树脂纯化:将一定体积超声提取液经旋转蒸发仪(40~60 MPa真空,温度50 ℃)浓缩至膏状,再用等体积的去离子水复溶,抽滤得清液,备用,称取一定量树脂,加入样品液后振摇一段时间,洗脱。
浓缩、干燥:将经大孔树脂纯化所得样品蒸发浓缩至浸膏状,再倒入洁净平板,30 ℃恒温箱中干燥成粗粉末。
复配:酒基与酒尾按照一定量比例配制,梯度加入不同量酒糟纯化黄酮提取物,即得富含黄酮苦荞蒸馏酒。
1.3.2 苦荞酒糟黄酮超声提取工艺优化单因素试验
称取晾干的苦荞酒糟5.00 g,加入一定体积分数乙醇溶液,500 W超声提取30 min,4 000 r/min离心10 min,过滤,以乙醇溶液定容至250 mL。测定样品的总黄酮含量,以总黄酮得率为评价指标,分别考察超声功率(300 W、400 W、500 W、600W、700W)、乙醇体积分数(50%、60%、70%、80%、90%)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50)(g∶mL)和提取时间(10 min、20 min、30 min、40 min、50 min)4个因素对超声提取酒糟总黄酮得率的影响。
1.3.3 苦荞酒糟黄酮超声提取工艺优化正交试验
在单因素试验的基础上,选择超声功率(A)、乙醇体积分数(B)、料液比(C)和提取时间(D)为评价因素,以总黄酮得率为评价指标,设计并进行正交试验,超声提取工艺优化正交试验因素与水平见表1。
表1 苦荞酒糟黄酮超声提取条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for flavonoids extraction conditions optimization from buckwheat distiller's grains by ultrasonic

水平 A 超声功率/W B 乙醇体积分数/%C 料液比(g∶mL)D 超声时间/min 123 400 500 600 70 80 90 1∶10 1∶20 1∶30 30 40 50
1.3.4 苦荞酒糟黄酮纯化工艺(1)树脂的选择与处理
选取D151、D61、D71、AB-8、001×7和D301R大孔树脂进行试验,树脂预处理:将树脂用体积分数95%乙醇浸泡24 h,充分溶胀后用蒸馏水洗至无醇,然后用5%盐酸溶液浸泡12 h,用蒸馏水洗至中性;最后用5%氢氧化钠溶液浸泡12 h,再用蒸馏水洗至中性,备用;利用不同的树脂进行苦荞酒糟总黄酮粗提液的静态吸附和解吸,分别计算其静态吸附率和静态解吸率。
(2)吸附条件优化
以选出的最佳大孔树脂对样品进行纯化,以吸附率、解吸率及黄酮含量为评价指标,分别研究了上样pH(3、4、5、6、7)、上样流速(1 mL/min、2 mL/min、3 mL/min、4 mL/min、5 mL/min)、上样质量浓度(0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL)对大孔树脂动态吸附率的影响,以及洗脱剂用量(每5 mL进行一次测定)、洗脱剂(乙醇)体积分数(50%、60%、70%、80%和90%)和洗脱流速(1 mL/min、3 mL/min、5 mL/min、7 mL/min、9 mL/min、11 mL/min、13 mL/min、15 mL/min、17 mL/min)对大孔树脂动态洗脱效果的影响。
1.3.5 纯度与吸附率的计算
(1)纯度的计算
将经大孔树脂纯化所得样品蒸发浓缩至浸膏状,再倒入洁净平板,30 ℃恒温箱中干燥成粗粉末,选择其中一部分用适量体积分数为70%的乙醇溶解,测定溶解液总黄酮质量浓度,计算经大孔树脂纯化所得样品收集液的纯度,其计算公式如下:
(2)吸附率的计算
取干燥树脂1.00 g,精确至0.001,加入100 mL样品(0.2 mg/mL),100 r/min振摇1 d,过滤,用样品等体积的蒸馏水冲洗树脂,使用等体积的体积分数70%乙醇溶液溶解样品中总黄酮物质,相同条件振摇1 d,过滤,计算各型号大孔树脂的静态吸附率及解吸率,其计算公式如下:

取干燥大孔树脂1.00 g,加入适量总黄酮质量浓度为0.2 mg/mL的样品,以每分钟为单位进行取样,每次1 mL,在时间达到20 min后,将取样时间间隔更改为10 min一次,测定样品质量浓度。以时间为横坐标,总黄酮质量浓度为纵坐标绘制静态吸附动力学曲线。

1.3.6 理化指标测定
酒精度的测定:按照国家标准GB 5009.225—2023《食品安全国家标准酒和食用酒精中乙醇浓度的测定》中酒精计法[30]。总黄酮含量测定方法参照李欣等[31]的方法,以吸光度值(x)为横坐标,芦丁标准品质量浓度(y)为纵坐标绘制芦丁标准曲线,根据标准曲线回归方程y=0.030 98x-0.000 25(R2=0.999 8)计算提取液中总黄酮含量(以芦丁计),总黄酮得率计算公式如下:

1.3.7 富含黄酮的苦荞蒸馏酒的配制
测定酒基与酒尾的酒精度,根据基酒酒精度为55%vol确定酒基与酒尾比例[18];酒糟黄酮提取液经旋转蒸发仪浓缩至膏状后置于干净玻璃平板中,30 ℃恒温干燥至粉末状。添加一定量的苦荞酒糟黄酮提取物使酒中总黄酮提取物含量约为250 mg/L、400 mg/L、600 mg/L和800 mg/L,对酒体进行感官评价。
1.3.8 感官评定方法
参照GB/T 33405—2016《白酒感官品评术语》[32]、GB/T 33404—2016《白酒感官品评导则》[33]等相关标准,选择10人组成品鉴小组,其中包括研究白酒风味的8名研究生和2名国家白酒评委,对添加不同含量苦荞黄酮提取物的苦荞蒸馏酒进行品评,分别从酒体颜色及清亮程度、苦荞香明显程度、口感醇和度与苦味适宜程度四个方面进行综合品评,结果取平均值,每项评分满分按10分记。
1.3.9 数据处理
使用Excel 2016计算分析数据;使用Origin 2019软件绘图。
2 结果与分析
2.1 超声提取条件优化
2.1.1 超声提取条件优化单因素试验
预试验中对酒头、酒基与酒尾中的物质进行了测定,均未检测到黄酮类物质,说明蒸馏出的酒样中不含黄酮类物质。对苦荞酒糟中黄酮类物质进行超声提取和测定,不同提取条件对总黄酮得率的影响结果见图1。
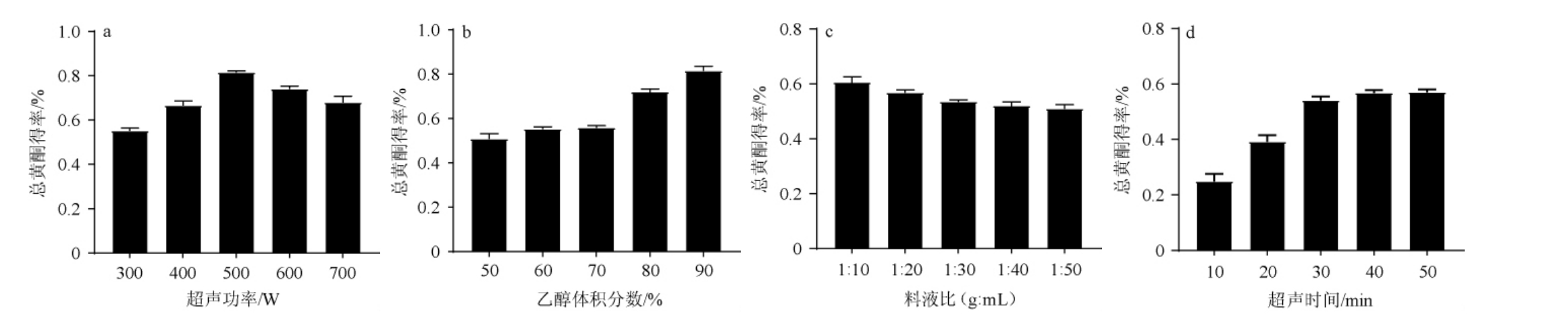
图1 超声功率(a)、乙醇体积分数(b)、料液比(c)和超声时间(d)对总黄酮得率的影响
Fig.1 Effect of ultrasonic power (a), ethanol concentration (b), material-to-liquid ratio (c) and ultrasonic time (d) on the yield of flavonoids
由图1a可知,超声功率对苦荞酒糟总黄酮得率影响呈先增大后减小的趋势,超声功率为500 W时,总黄酮得率达到最大;超声功率>500 W时,总黄酮得率开始呈现出递减趋势,可能是由于合适的功率能更加高效的破碎细胞,从而更加有效地提取出成分[34],而超声功率过高或者过低会使得有效物质的提取受到影响;因此,选取400 W、500 W、600 W进行正交试验。由图1b可知,总黄酮得率随着乙醇体积分数的升高而提高,是由于乙醇体积分数的增加,溶液极性随着乙醇体积分数不断升高而减小,与黄酮类化合物的亲和性变大,因此选取乙醇体积分数70%、80%与90%进行正交试验。由图1c可知,随着料液比的增加,总黄酮得率随着液体比例的增大呈现出不断下降的趋势,或许是水的增加影响了酒糟的极性,导致其加强了对黄酮物质的吸附,导致提取更加困难;而料液比低于1∶10(g∶mL)时不利于试验进行,因此,迭取料液比1∶10、1∶20及1∶30(g∶mL)进行正交试验。由图1d可知,随着超声时间的增加,总黄酮得率呈现出增加的趋势。当超声时间<30 min时,总黄酮得率随着超声时间的延长呈现出较快的增长趋势,当超声时间达到40 min后,总黄酮得率与最初相比增长了一倍有余;但在超声时间达到40 min后,增长趋于平缓,考虑时间及经济因素,选取30min、40 min、50 min进行正交试验。
2.1.2 正交试验设计与结果
根据单因素试验结果,以超声功率(A)、乙醇体积分数(B)、料液比(C)和超声时间(D)为评价因素,以总黄酮得率为评价指标设计正交试验,结果见表2,方差分析结果见表3。
表2 苦荞酒糟黄酮超声提取条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for flavonoids extraction conditions optimization from buckwheat distiller's grains by ultrasonic
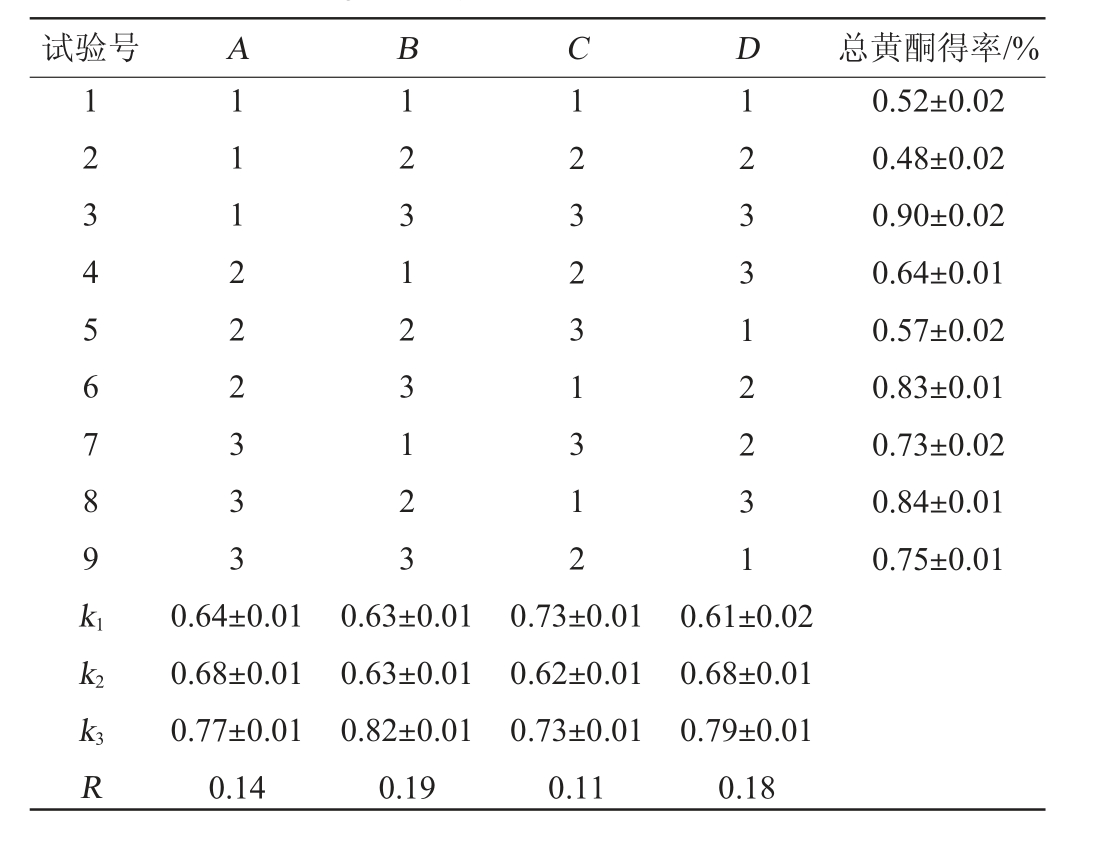
试验号 A B C D 总黄酮得率/%1 2 3 4 5 6 7 8 9 k1 111222333 1231 2312 3 123231312 123 312231 0.52±0.02 0.48±0.02 0.90±0.02 0.64±0.01 0.57±0.02 0.83±0.01 0.73±0.02 0.84±0.01 0.75±0.01 k2 k3R 0.64±0.01 0.68±0.01 0.77±0.01 0.14 0.63±0.01 0.63±0.01 0.82±0.01 0.19 0.73±0.01 0.62±0.01 0.73±0.01 0.11 0.61±0.02 0.68±0.01 0.79±0.01 0.18
表3 正交试验结果方差分析
Table 3 Analysis of variance of orthogonal test results
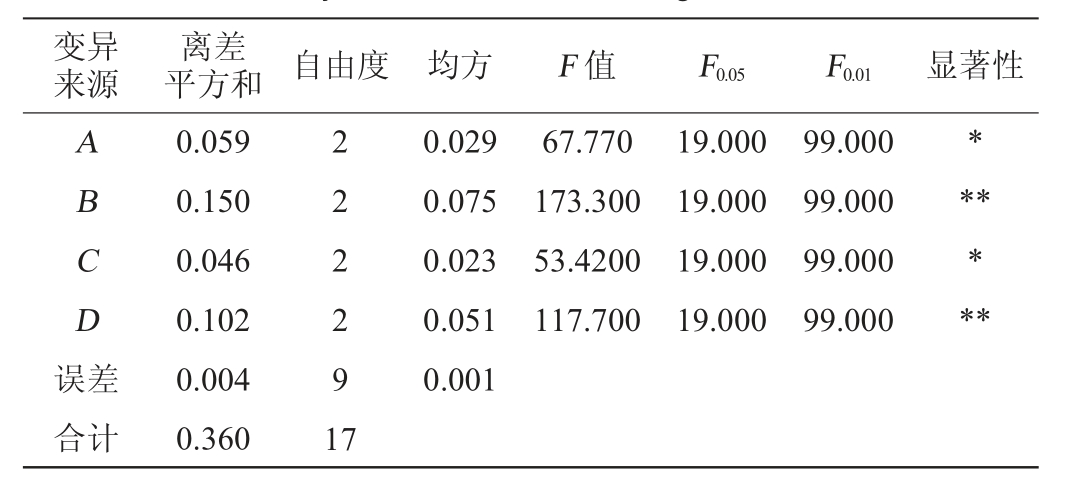
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著
(P<0.01)。
变异来源离差平方和 自由度 均方 F 值 F0.05 ABCD误差0.029 0.075 0.023 0.051 0.001 67.770 173.300 53.4200 117.700 19.000 19.000 19.000 19.000 F0.01 显著性99.000 99.000 99.000 99.000******合计0.059 0.150 0.046 0.102 0.004 0.360 2 2 2 2 9 1 7
由表2可知,各因素影响超声提取总黄酮得率的顺序为B>D>A>C,即乙醇体积分数>超声时间>超声功率>料液比;由表3可知,乙醇体积分数、超声时间、超声功率及料液比对于超声提取工艺影响程度各不相同。其中,乙醇体积分数(B)与超声时间(D)因素对结果影响极显著(P<0.01),超声时间(A)与料液比(C)对结果影响因素(P<0.05)。根据极差分析结果得出,苦荞酒糟黄酮超声提取的最佳工艺条件为A3B3C3D3,在此工艺条件下,总黄酮得率为0.90%,干燥后黄酮粉末纯度为38.3%。
曹娅等[35]在响应面优化苦荞黄酮超声波提取工艺中得到总黄酮提取率最高为2.26%;李欣等[31]通过超声提取苦荞黄酮平均得率为2.70%与2.35%。由于本试验以苦荞麦和大米混料发酵,其中苦荞麦占30%,因此通过超声提取苦荞酒糟得率为0.9%已较为理想,在优化后的超声提取条件下可以有效的提取苦荞酒糟黄酮,但其黄酮提取物干燥后的粉末纯度仅为38.3%,纯度并不理想,具有进一步纯化的空间,因此选择大孔树脂对其进行纯化处理。
2.2 大孔树脂纯化工艺研究
2.2.1 大孔树脂的筛选
6种大孔树脂静态吸附率和解吸率测定结果见图2。
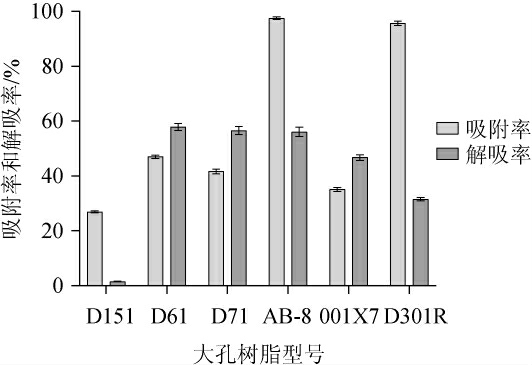
图2 6种大孔树脂静态吸附率和解吸率
Fig.2 Static adsorption and desorption rates of 6 macroporous resins
由图2可知,D151、D61、D71、AB-8、001X7、D301R型树脂对苦荞酒糟黄酮的静态吸附和静态解吸效果各不相同。AB-8型树脂和D301R型树脂的静态吸附率明显高于其他型号,且D61型树脂吸附率和解析率均略高于另外三种树脂;因此选取AB-8、D301R和D61型树脂进行吸附动力学试验,结果见图3。
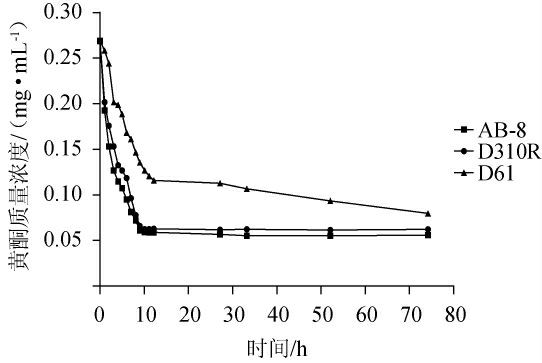
图3 树脂静态吸附曲线
Fig.3 Static adsorption curve of resin
由图3可知,AB-8和D301R型树脂均在短时间内基本完成了对黄酮类化合物的吸附,随着时间增加黄酮质量浓度基本维持不变;其次,在此时间内AB-8树脂的吸附动力学曲线斜率优于D301R树脂。上述分析表明,用于苦荞酒糟黄酮纯化的最佳大孔树脂为AB-8型。
2.2.2 AB-8大孔树脂动态吸附研究
不同的pH、上样流速和上样质量浓度对大孔树脂吸附率的影响结果见图4。
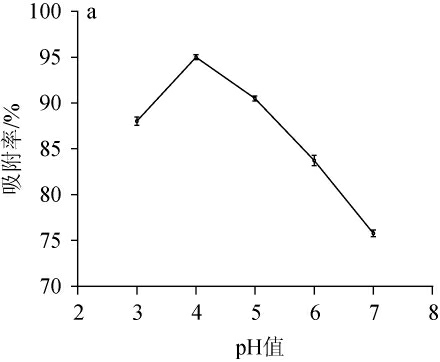
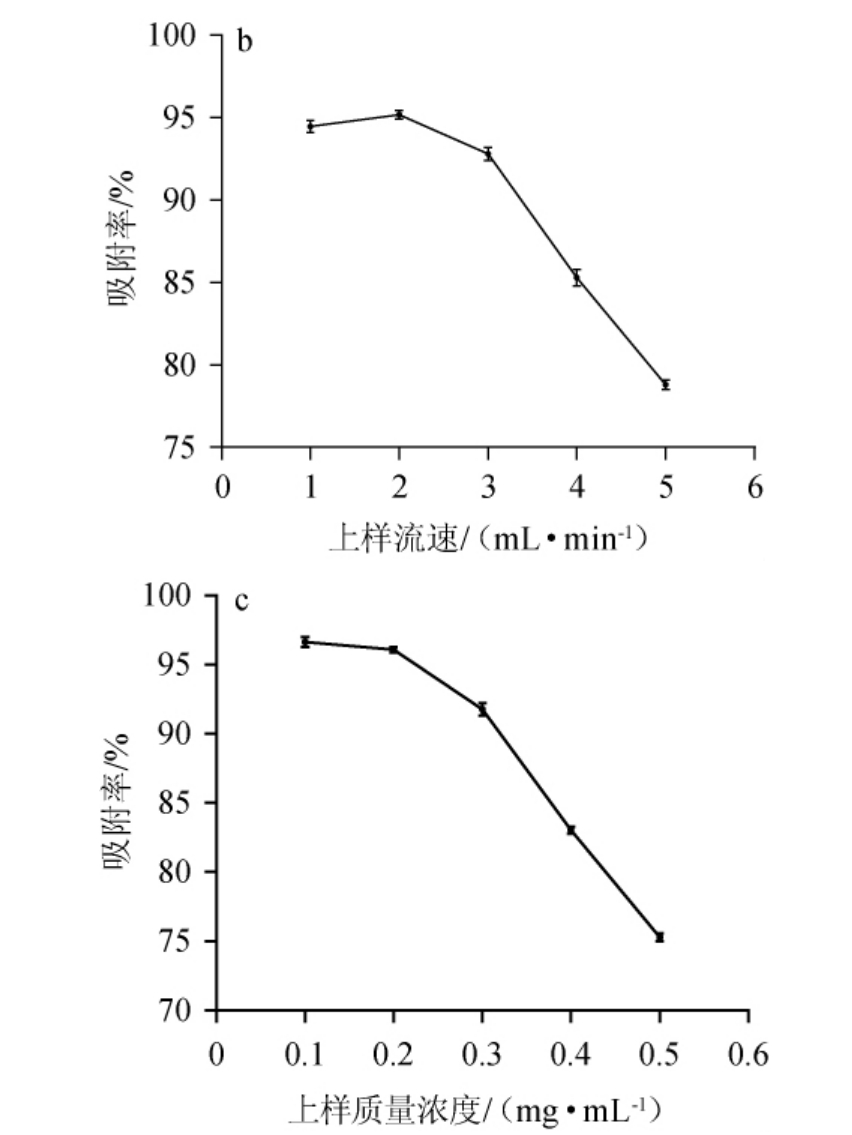
图4 pH(a)、上样流速(b)和上样质量浓度(c)对AB-8大孔树脂吸附率的影响
Fig.4 Effect of pH(a),loading flow rate(b)and loading concentration(c)on adsorption rate of macroporous resin AB-8
由图4a可知,上样液pH<4时,树脂吸附率逐渐升高,当上样液pH为4时AB-8树脂的吸附率最高,当pH>4时,吸附率呈现出快速的下降趋势;因此,选择pH=4作为上样液的最佳pH。由图4b可知,随着上样流速的增加,树脂吸附率呈先升高后降低的趋势,当上样流速为2 mL/min时吸附率最高,当上样流速>2 mL/min后吸附率开始下降,且流速越快下降趋势越明显;因此,苦荞酒糟黄酮粗提液纯化的最佳上样流速为2 mL/min。由图4c可知,随着上样质量浓度的增加,AB-8树脂对样品的吸附率逐渐减小;当上样质量浓度由0.1 mg/mL增加至0.2 mg/mL时,吸附率略微下降,超过0.2 mg/mL后开始迅速下降,但同时间内0.2 mg/mL的上样质量浓度所处理的样品体积更多;因此,进行纯化的样品最佳质量浓度为0.2 mg/mL。
2.2.3 动态解吸研究
洗脱液体积、乙醇体积分数和洗脱流速对黄酮提取物洗脱效果的影响见图5。
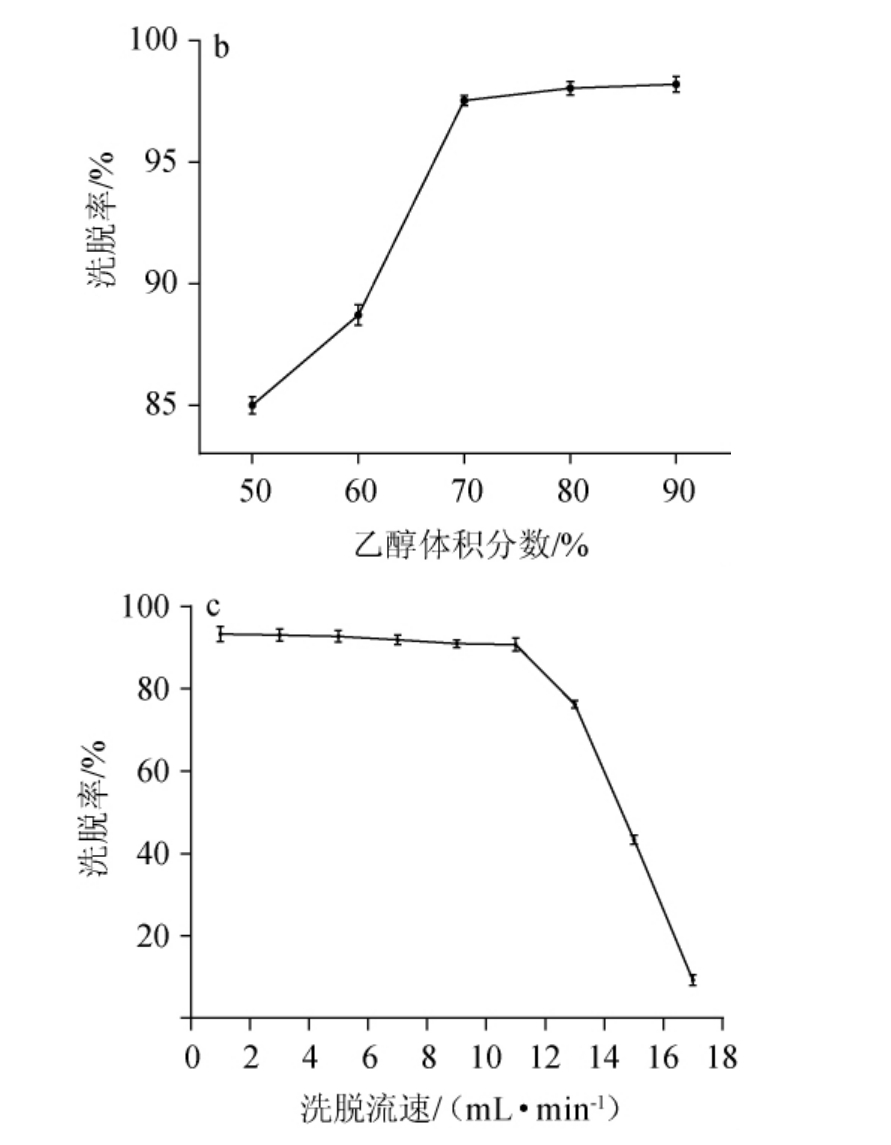
图5 洗脱液体积(a)、乙醇体积分数(b)和洗脱流速(c)对黄酮提取物洗脱的影响
Fig.5 Effect of eluent volume (a), ethanol volume fraction (b) and elution flow rate (c) on the elution of flavonoid extracts
由图5a可知,随着洗脱液体积的增加,总黄酮质量浓度快速升高,当洗脱液体积为10 mL时达到最高,随后开始快速减少,当洗脱液体积增加至40 mL时,总黄酮质量浓度下降趋势逐渐平稳;当体积增加至50 mL时,黄酮物质基本被洗脱;综合考虑洗脱效果及洗脱剂的成本,50 mL是洗脱液体积的最佳选择。由图5b可知,洗脱率随着乙醇体积分数的上升而增加。当乙醇体积分数上升至70%后,洗脱率上升趋势逐渐缓慢;故选取体积分数为70%作为乙醇溶液的最佳洗脱体积分数。由图5c可知,当洗脱流速<11 mL/min时,洗脱率虽有略微起伏,但几乎维持不变;当洗脱流速>11 mL/min以后,洗脱率开始快速降低,洗脱流速11 mL/min时在相同时间内纯化样品体积更多,纯化效率更优,因此最佳洗脱流速为11 mL/min。

综上,AB-8大孔树脂纯化苦荞酒糟黄酮的最佳工艺为:上样pH 4、上样流速2 mL/min、上样质量浓度0.2 mg/mL、50 mL体积分数70%乙醇洗脱、洗脱流速11 mL/min;经过此工艺条件下大孔树脂纯化的苦荞酒糟黄酮提取物纯度为85.36%,相比于超声提取法所获得的黄酮提取物纯度有了大幅度提高,提升了47.06个百分点。
2.3 富含黄酮的苦荞蒸馏酒的配制
蒸馏前50 mL得到的酒液为酒头,之后得到酒精度为63%vol的酒基及20%vol的酒尾。当酒基与酒尾按照100∶23(V/V)配制时,酒精度为55%vol,此时酒体风味协调,口感较好。对不同添加量纯化黄酮提取物的酒体进行感官评价,结果见图6。
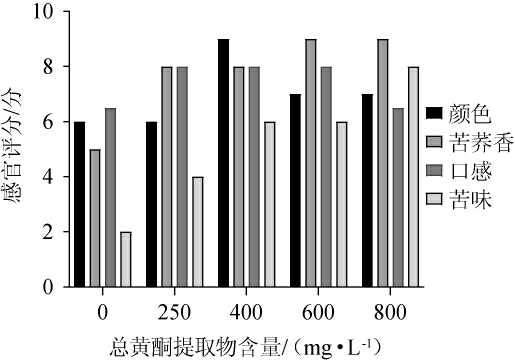
图6 富含黄酮的苦荞蒸馏酒感官评价结果
Fig.6 Sensory evaluation results of buckwheat distilled spirits enriched with flavonoid
由图6可知,当复配型苦荞蒸馏酒中总黄酮提取物含量为400~600 mg/L时,颜色较好,为微黄清亮,具有独特的有苦荞香的同时,又不会因添加过高的黄酮提取物赋予酒过重的苦味,苦味温和不突出,口感良好。
3 结论
本试验使用苦荞、大米发酵制作苦荞蒸馏酒,通过单因素试验及正交试验优化苦荞酒糟黄酮超声提取与大孔树脂纯化工艺,得到黄酮提取物纯度为85.36%,添加黄酮提取物至苦荞蒸馏酒中,制作出一款酒精度为55%vol、黄酮提取物含量为400~600 mg/L的复配型苦荞蒸馏酒,该酒颜色良好、苦味适宜,具有苦荞酒独特的香味。本研究的结果对于解决传统苦荞酒酿造过程中对苦荞生物类黄酮资源利用率低的问题具有一定的理论和实际意义,为更好的利用苦荞麦资源提供了参考依据。
[1]TU W,CAO X,CHENG J,et al.Chinese Baijiu:the perfect works of microorganisms[J].Front Microbiol,2022,13:919044.
[2]WEI Z,ZHAO C Q,HUIBO L.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:a review[J].Front Microbiol,2018,9:671.
[3] LI Y, YUAN S, YONG X, et al.Research progress on small peptides in Chinese Baijiu[J].J Funct Food,2020,72:104081.
[4]龙亚飞,唐佳代,王相勇,等.中国白酒中健康因子及其富集途径的研究进展[J].中国酿造,2022,41(2):23-28.
[5]李雅新,梁慧珍,张文生,等.保健酒制作工艺的研究进展[J].中国酿造,2022,41(5):23-27.
[6]武纪天,程浩,殷实,等.丹参保健酒发酵条件优化[J].中国酿造,2020,39(7):197-201.
[7]单义民,周慧,陈默思,等.中国劲酒抗疲劳、调节免疫力及增强性功能作用的研究[J].中成药,2018,40(7):1600-1603.
[8]秦月,严沁,张玲,等.中国保健酒的历史发展及研究进展[J].中国酿造,2021,40(9):7-11.
[9]汤焘,赵江林,江兰,等.苦荞酒的研究现状及发展前景[J].食品与发酵科技,2020,56(5):81-85,96.
[10]严慧玲,陈泓旭,叶雪玲,等.我国荞麦产业发展现状与对策浅析[J].四川农业科技,2023(2):12-15,23.
[11]王雪,乔博,张健鑫,等.黄酮类化合物的应用研究进展[J].中国食品添加剂,2020,31(4):159-163.
[12]冯艺飞,王笑颖.黄酮类化合物的研究概况[J].江西化工,2021,37(4):102-104.
[13]何伟俊,曾荣,白永亮,等.苦荞麦的营养价值及开发利用研究进展[J].农产品加工,2019(23):69-75.
[14]HUNG P,MORITA N.Distribution of phenolic compounds in the graded flours milled from whole buckwheat grains and their antioxidant capacities[J].Food Chem,2008,109(2):325-331.
[15]LI C,HE J,YANG Y,et al.White tip silver needle(slightly fermented white tea) flavonoids help prevent aging via antioxidative and anti-inflammatory effects[J].Drug Design Develop Therapy,2021,15:1441-1457.
[16]周金虎,张玉,方尚玲,等.苦荞黄酒发酵工艺[J].食品工业,2019,40(6):165-169.
[17]白永亮,林柔敏,王海燕,等.半固态发酵苦荞黄酒工艺优化及香气分析[J].酿酒科技,2022(9):75-84.
[18]周清华,林巧,袁健.高黄酮含量苦荞蒸馏酒的研究[J].食品安全导刊,2018(27):179-182.
[19]汤焘.一种苦荞复配白酒的开发研制[D].成都:成都大学,2021.
[20] WANG N N, CHEN T, YANG X, et al.A practicable strategy for enrichment and separation of four minor flavonoids including two isomers from barley seedlings by macroporous resin column chromatography,medium pressure LC and high-speed counter-current chromatography[J].J Separat Sci,2019,42(9):1717-1724.
[21]CHAVAN Y, SINGHAL R S.Ultrasound-assisted extraction (UAE) of bioactives from arecanut(Areca catechu L.)and optimization study using response surface methodology[J].Inn Food Sci Emerg Technol,2013,17:106-113.
[22]ZHENG L L,WANG D,LI Y Y,et al.Ultrasound-assisted extraction of total flavonoids from Aconitum gymnandrum[J].Pharmacogn Mag,2014,10(Suppl 1):S141-146.
[23]刘春花,高金锋,王鹏科,等.超声波法提取苦荞黄酮的工艺研究[J].西北农业学报,2009,18(1):281-284.
[24]WAN J B,ZHANG Q W,YE W C,et al.Quantification and separation of protopanaxatriol and protopanaxadiol type saponins from Panax notoginseng with macroporous resins[J].Separat Purif Technol, 2007,60(2):198-205.
[25]FAN Q B,LI Y.Enrichment of rosmarinic acid from Salvia przewalskii Maxim.leaves using macroporous resin:Adsorption/desorption behavior,process optimization followed by scale-up[J].Ind Crop Prod,2023,191(115931).
[26] NA C,JUN J X,YU L L, et al.Preparation and characterization of antioxidant flavonoid-enriched extract from saffron by-product: a combination of ultrasound-assisted extraction and macroporous resin purification[J].Chem Pap,2021,75(6):1-15.
[27] SU X Y, ZHANG X, WANG C H, et al.Adsorption properties and preparative separation of flavonoids from Rhizoma smilacis glabrae using macroporous resins[J].Separations,2022,9(12):431-431.
[28]LI Z C,ZHANG J Y,WU Y Q,et al.Adsorption and desorption studies of betaxanthin from yellow beet onto macroporous resins[J].Separat Sci Technol,2021,56(14):2327-2337.
[29]李姝,王松涛,张娜,等.ADS-7大孔树脂连续使用对苦荞精制品中黄酮成分的影响[J].中国测试,2022,48(6):58-63.
[30]中华人民共和国国家卫生和计划生育委员会,国家市场监督管理总局.GB 5009.225—2023 食品安全国家标准酒和食用酒精中乙醇浓度的测定[S].北京:中国标准出版社,2023.
[31]李欣,王步军.两种苦荞黄酮提取方法的优化及含量测定[J].食品科学,2010,31(6):80-85.
[32]中国轻工业联合会.GB/T 33405—2016 白酒感官品评术语[S].北京:中国标准出版社,2017
[33]中国轻工业联合会.GB/T 33404—2016 白酒感官品评导则[S].北京:中国标准出版社,2017.
[34]蔡国强,徐志杰,权琰,等.天然产物提取技术研究进展[J].中国野生植物资源,2023,42(4):78-85.
[35]曹娅,钱志伟.响应面优化苦荞黄酮超声波提取工艺[J].食品工业,2020,41(1):180-183.