薏仁米(Coix chinensis Tod)是禾本科植物薏仁干燥成熟的种仁,又称苡仁米、薏米等,其具有营养、保健、美容等多种功效,一直被用作营养膳食补充剂[1]。贵州省黔西南州兴仁县是我国薏仁米主要产区之一,有“中国薏仁米之乡”之称[2]。薏仁米糠是薏仁米在加工过程中经脱皮和胚加工制成的副产物,富含蛋白、米糠油、多糖、植酸钙等多种营养成分,具有很大的开发潜力[3]。由于生产企业生产设备落后,技术不完善,缺乏精深加工等原因,目前,薏仁米加工大多属于粗放型,产生的大量米糠被直接用作饲料,综合利用不充分,造成极大浪费。
多肽是通过肽键连接α-氨基酸形成的化合物,其一般由不超过100个氨基酸组成。植物多肽是在特定条件下植物蛋白质水解形成的小分子多肽[4],其具有原始蛋白质和氨基酸所没有的特定生物功能,如抗氧化、抗过敏、抗糖尿病、抗癌等[5-11]。刘威等[12]研究发现,通过碱性蛋白酶水解核桃蛋白制备的多肽具有清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基和羟基自由基的能力;周亭屹等[13]通过生物酶解花椰菜茎叶蛋白的粗提物得到花椰菜多肽,并从中筛选出具有辅助降血脂效果的分离组分G15-Ⅱ,其能够降低大鼠血液中的总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)水平,提高高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDLC)水平;王凯凯[14]研究发现,绿豆中的多肽可以促进巨噬细胞的增殖,增加巨噬细胞的活性,并促进其免疫效应。由于植物多肽对人类疾病的预防和控制更安全、更温和,且食用安全性高,现已成为医学和食品领域研究的焦点[15]。
目前,对薏仁米糠的研究还处于起步阶段,主要围绕薏仁米糠油脂[16]、蛋白[17]和多肽[18]等方面开展研究,其中薏仁米糠多肽的制备主要通过酶法水解薏米糠蛋白制备[19],对微生物发酵生产薏仁米糠多肽的研究还鲜见报道。采用微生物发酵法生产薏仁米多肽不仅可以利用其在培养过程中产生的各种蛋白酶水解蛋白来获得功能更多的小肽[20-21],而且还能大大降低生产成本,适于工业化生产。因此,本研究采用枯草芽孢杆菌(Bacillus subtilis)发酵生产薏仁米糠多肽,以水解度为评价指标,通过单因素试验及正交试验对其发酵工艺进行优化,并对其抗氧化特性进行研究,为薏仁米糠的深度开发和提高薏仁米糠资源的利用率提供参考。
1 材料与方法
1.1 材料与试剂
新鲜薏仁米糠:贵州泛亚实业(集团)有限公司,经石油醚脱脂处理后,粉碎过20目筛,-18 ℃保存备用;枯草芽孢杆菌(Bacillus subtilis):中国工业微生物菌种保藏管理中心;牛肉膏、蛋白胨、琼脂(均为生化试剂):武汉唯美生物有限公司;DPPH、ABTS(均为分析纯):国药集团化学试剂有限公司;维生素C(vitamin C,VC)(分析纯):上海阿拉丁生化科技股份有限公司。
营养肉汤培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 000 mL,pH为7.0,121 ℃高压蒸汽灭菌20 min。固体营养肉汤培养基:营养肉汤培养基中添加20 g琼脂。
1.2 仪器与设备
BM2000生物显微镜:上海班特仪器有限公司;BT585酸度计、AT21型电子天平:上海良平仪器有限公司;B-206恒温水浴锅:上海印溪仪器仪表有限公司;UV-2700紫外分光光度计:上海精科实业有限公司;ZD-85恒温振荡器:常州国华电器有限公司;TGL-16A离心机、YXQ-LS-50SII高压蒸汽灭菌锅:深圳市康初源有限公司;DH4000II恒温培养箱:武义海纳电器有限公司;101-1电热恒温干燥箱:上海路达实验仪器有限公司。
1.3 实验方法
1.3.1 薏仁米糠的发酵
将枯草芽孢杆菌接种至营养肉汤固体培养基,37 ℃条件下活化培养24 h后,接种至营养肉汤培养基中,37 ℃、150 r/min条件下培养72 h作为种子液,备用。准确称取5 g脱脂薏仁米糠,加入100 mL蒸馏水,按5%接种枯草芽孢杆菌种子液后,37 ℃、150 r/min条件下发酵24 h。
1.3.2 水解度的测定
参照罗斌等[21]的方法,采用三硝基苯磺酸(trinitrobenzene-sulfonic acid,TNBS)法测定游离氨基酸含量,并计算水解度(degree of hydrolysis,DH),其计算公式如下:
式中:Lt表示发酵一段时间后发酵液中的游离氨基含量,mg/mL;L0 表示发酵前溶液中的游离氨基含量,mg/mL;Lmax表示米糠中蛋白完全水解后溶液的游离氨基含量,mg/mL。
1.3.3 枯草芽孢杆菌发酵薏仁米糠条件优化
(1)单因素试验
以水解度为评价指标,采用单因素轮换法依次考察发酵时间(8 h、16 h、24 h、32 h、40 h)、发酵温度(31 ℃、33 ℃、35 ℃、37 ℃、39 ℃)、接种量(1%、3%、5%、7%、9%)、初始pH值(5、6、7、8、9)对水解度的影响。
(2)正交试验
在单因素试验的基础上,以水解度为评价指标,以发酵时间(A)、接种量(B)、发酵温度(C)、初始pH值(D)为评价指标,设计4因素3水平的L9(34)正交试验,试验因素与水平见表1。
表1 枯草芽孢杆菌发酵薏仁米糠条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation condition optimization of adlay bran by Bacillus subtilis

水平 A 发酵时间/h B 接种量% C 发酵温度/℃ D 初始pH值123 16 24 32 357 35 37 39 678
1.3.4 薏仁米糠多肽的制备
将发酵液在4 ℃条件下6 000 r/min离心15 min,上清液用0.45 μm滤膜过滤后,再经真空浓缩以及冷冻干燥即得到薏仁米糠多肽粉末。
1.3.5 抗氧化活性测定
用蒸馏水将薏米糠多肽制备成不同质量浓度的样液,测定抗氧化活性。DPPH自由基参照YOU Q等[22]的方法,ABTS自由基清除率的测定参照董烨等[23]的方法,羟基自由基清除率的测定参照魏明等[20]的方法,还原力的测定参照廖卢艳等[24]的方法。
1.3.6 数据处理
试验数据使用SPSS 20.0软件进行处理,使用GraphPad Prism 8作图,结果以“平均数±标准差”表示。
2 结果与分析
2.1 枯草芽孢杆菌发酵薏仁米糠条件优化单因素试验
2.1.1 发酵时间对薏仁米糠发酵液水解度的影响
发酵时间对薏仁米糠发酵液水解度的影响见图1。由图1可知,发酵8 h后,随着发酵时间的增加,薏仁米糠水解度逐渐上升,在发酵24 h时,水解度达到20.15%,当发酵时间>24 h后,随着发酵时间的延长,水解度没有明显的变化。分析原因可能是由于在发酵前期菌种处于适应环境阶段,生长缓慢,酶产量较低,因此发酵液中的蛋白质底物水解度较低;当菌种进入对数生长期后,生长代谢旺盛,蛋白质底物的水解度随着胞外酶分泌量的加大逐步升高;稳定期以后菌种生长逐渐平稳,产酶量饱和,蛋白质底物的水解度也达到最大值,继续延长发酵时间,发酵液中的营养物质逐渐耗尽,并且代谢废物开始累积,导致溶氧量不足而影响酶的合成,因此发酵后期水解度趋于平缓[25]。综上,选择培养24 h为发酵的最佳时间。
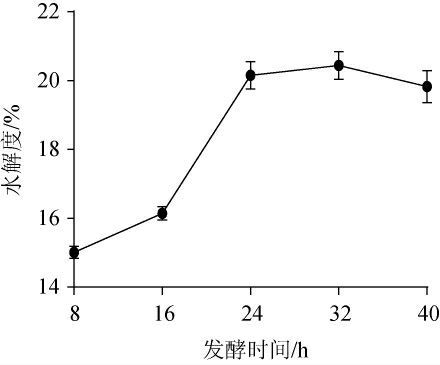
图1 发酵时间对薏仁米糠发酵液水解度的影响
Fig.1 Effect of fermentation time on the hydrolysis degree of adlay bran fermentation broth
2.1.2 枯草芽孢杆菌接种量对薏仁米糠发酵液水解度的影响
枯草芽孢杆菌接种量对薏仁米糠发酵液水解度的影响见图2。由图2可知,随着接种量的增大,水解度逐渐增加,当接种量达到5%时,水解度达到19.86%,继续增加接种量水解度无明显变化。究其原因这可能是,当接种量较低时,发酵液中菌种含量较低,产生的胞外酶也较少,不足以分解发酵液中的蛋白质底物;而接种量过高,又使发酵前期菌体生长以及营养消耗过快,导致后期营养不足进而引起菌体自溶[26]。因此,当接种量相对薏仁米糠达到饱和后,继续增加接种量就无法达到增加体系水解度的效果。因此,选择接种量5%较为适宜。
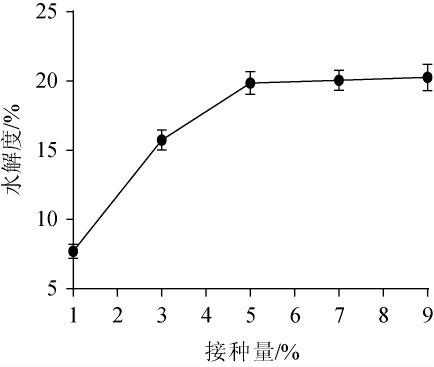
图2 枯草芽孢杆菌接种量对薏仁米糠发酵液水解度的影响
Fig.2 Effect of inoculum on the hydrolysis degree of adlay bran fermentation broth
2.1.3 发酵温度对薏仁米糠发酵液水解度的影响
发酵温度对薏仁米糠发酵液水解度的影响见图3。由图3可知,发酵液的水解度在31~37 ℃范围内随着发酵温度的升高而逐渐增加,当发酵温度为37 ℃时,水解度达到最大值,为20.21%。而当发酵温度高于37 ℃后,发酵液的水解度开始下降。究其原因可能是发酵温度为37 ℃时,菌种的生长速度较快,并且分泌大量蛋白酶,因而发酵液中蛋白质底物水解度最大;而发酵温度高于或低于37 ℃都会造成微生物生长受阻,代谢速率降低,从而影响发酵效果[27]。因此,选择最佳发酵温度为37 ℃。
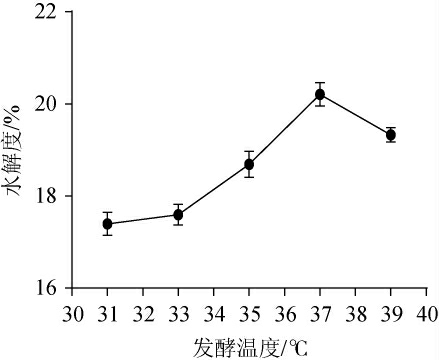
图3 发酵温度对薏仁米糠发酵液水解度的影响
Fig.3 Effect of fermentation temperature on the hydrolysis degree of adlay bran fermentation broth
2.1.4 初始pH对薏仁米糠发酵液水解度的影响
有研究发现,发酵基质初始pH值不但影响菌种对环境的适应速度、生长繁殖速度,还对菌种的产蛋白酶能力也有一定的影响[28-29]。初始pH对薏仁米糠发酵液水解度的影响见图4。由图4可知,随着初始pH的增加,薏仁米糠发酵液的水解度呈现先上升后下降的趋势。当初始pH为7时,水解度达到最大,为19.90%。这可能与微生物的最适生长pH以及蛋白酶酶解的最适pH有关,当偏离最适pH时,不利于菌体生长以及胞外酶的产生,进而影响发酵效果,使发酵液中的蛋白质底物水解度下降[29]。因此,选择最佳初始pH值为7。

图4 初始pH值对薏仁米糠发酵液水解度的影响
Fig.4 Effect of initial pH on the hydrolysis degree of adlay bran fermentation broth
2.2 枯草芽孢杆菌发酵薏仁米糠条件优化正交试验
在单因素试验的基础上,以发酵液水解度为评价指标,以发酵时间(A)、接种量(B)、发酵温度(C)、初始pH值(D)为评价指标,采用正交助手设计4因素3水平的正交试验,试验结果与分析见表2。
表2 枯草芽孢杆菌发酵薏仁米糠条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for fermentation condition optimization of adlay bran by Bacillus subtilis
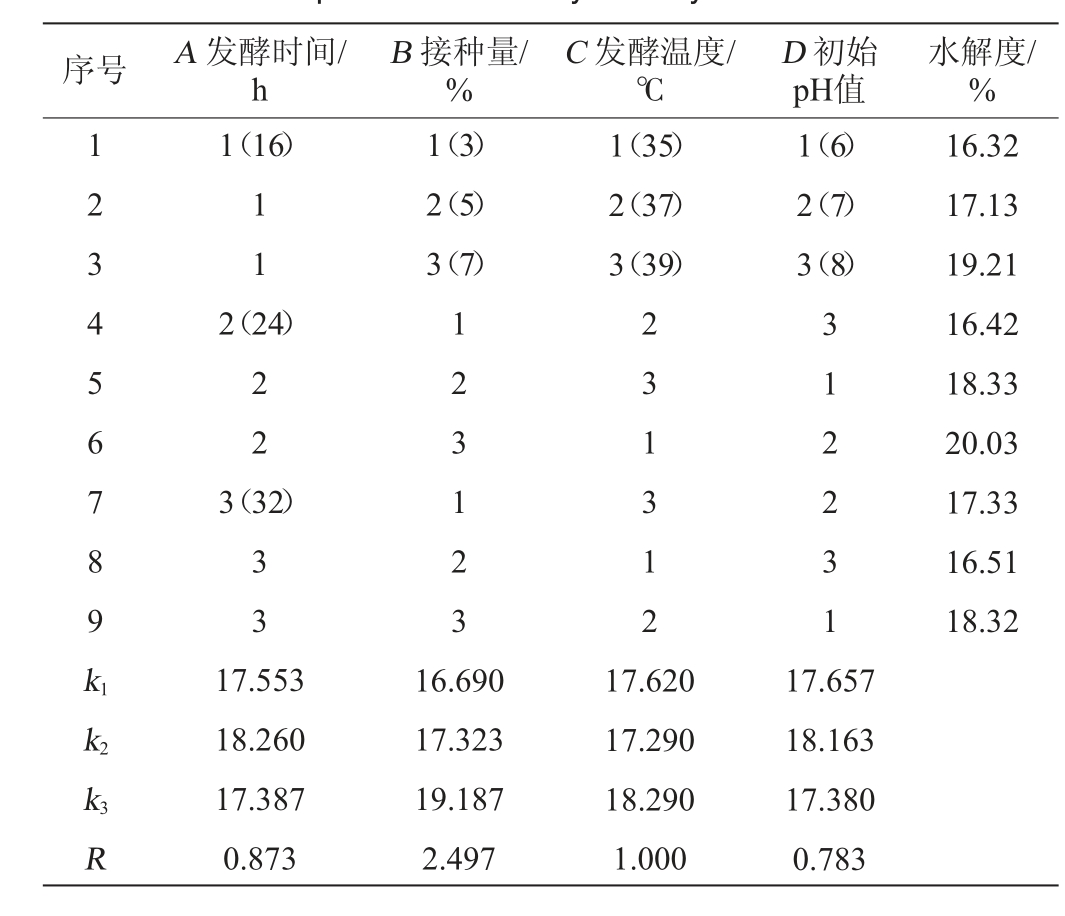
序号 A 发酵时间/h B 接种量/%C 发酵温度/℃D 初始pH值水解度/%1 2 3 4 5 6 7 8 9 k1 1(16)1 1 1(3)2(5)3(7)1(35)2(37)3(39)1(6)2(7)3(8)2(24)2 2 3(32)3 3 1 2 3 1 2 3 2 3 1 3 1 2 3 1 2 2 3 1 16.32 17.13 19.21 16.42 18.33 20.03 17.33 16.51 18.32 k2 k3R 17.553 18.260 17.387 0.873 16.690 17.323 19.187 2.497 17.620 17.290 18.290 1.000 17.657 18.163 17.380 0.783
由表2可知,影响发酵液多肽得率的各因素主次顺序为B(接种量)>C(发酵温度)>A(发酵时间)>D(初始pH值),最优组合为A2B3C3D2,即发酵时间24 h、接种量7%、发酵温度39 ℃、初始pH值7。在此条件下进行验证试验,薏仁米糠发酵液水解度可达到21.33%,高于正交处理组中的最高值(20.03%),因此可以确定此条件为最优发酵条件。
2.3 薏仁米糠多肽体外抗氧化活性测定
2.3.1 薏仁米糠多肽对DPPH自由基的清除作用
薏仁米糠多肽对DPPH自由基的清除作用见图5。
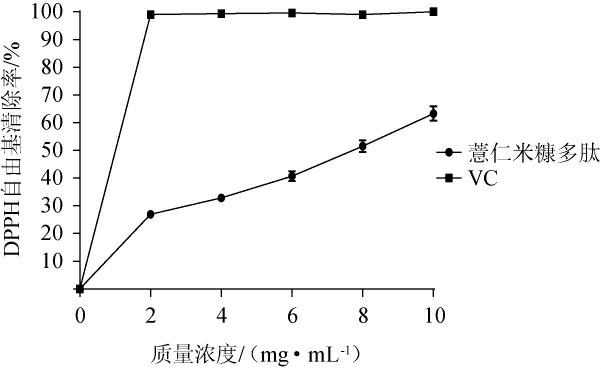
图5 薏仁米糠多肽对DPPH自由基的清除能力
Fig.5 Scavenging ability of peptides from adlay bran on DPPH free radical
由图5可知,薏仁米糠多肽对DPPH自由基具有清除作用,且随着多肽质量浓度的增加,DPPH自由清除率也逐渐增大,呈现出良好的量效关系,其半抑制浓度(half maximal inhibitory concentration,IC50)值为7.23 mg/mL,当多肽质量浓度为10 mg/mL时,DPPH自由基清除率为63.29%。虽然其清除DPPH自由基的能力弱于VC,但高于陈敏等[30]通过酶法制备的燕麦多肽的清除能力。
2.3.2 薏仁米糠多肽对羟基自由基的清除作用
薏仁米糠多肽对羟基自由基的清除作用见图6。
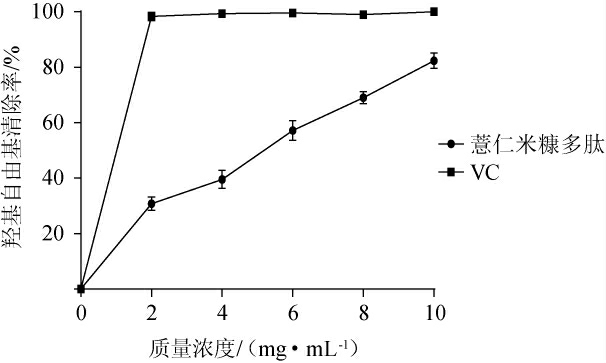
图6 薏仁米糠多肽对羟基自由基的清除能力
Fig.6 Scavenging ability of peptides from adlay bran on hydroxyl free radical
由图6可知,薏仁米糠多肽对羟基自由基的清除作用随着多肽质量浓度的增加而上升,表现出剂量相关性,其IC50值为4.47 mg/mL,当多肽质量浓度为10 mg/mL时,羟基自由基的清除率为82.37%。活性多肽清除羟自由基的能力主要由其暴露出来的氨基酸侧链基团和肽序列所决定,特别是蛋氨酸和酪氨酸是提高抗氧化肽的活性以及稳定性的重要氨基酸[31-33]。薏仁米糠多肽在一定程度上能够抑制羟自由基,可能与发酵过程中蛋白质的水解使蛋氨酸和酪氨酸在一定程度上暴露出来有关,但产生多肽具体的结构及其抑制羟自由基的机理还需进一步研究。
2.3.3 薏仁米糠多肽对ABTS自由基的清除作用
薏仁米糠多肽对ABTS自由基的清除作用见图7。
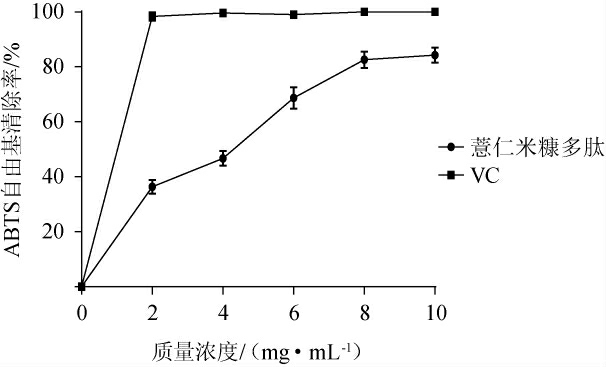
图7 薏仁米糠多肽对ABTS自由基的清除能力
Fig.7 Scavenging ability of peptides from adlay bran on ABTS free radical
由图7可知,随着薏仁米糠多肽质量浓度的增加,其对ABTS自由基的清除作用也随之上升,表明其质量浓度与ABTS自由基清除率呈现量效关系。当多肽质量浓度为10 mg/mL时,ABTS自由基清除率为84.28%,经计算其IC50值为3.45 mg/mL。虽然其ABTS自由基清除能力弱于对照VC,但仍高于尹乐斌等[25]通过枯草芽孢杆菌发酵制得的大豆多肽的ABTS自由基清除率,这可能与多肽的氨基酸组成以及结构不同有关。有研究发现,多肽中酪氨酸和半胱氨酸的含量与多肽的ABTS自由基清除能力呈现正相关[34],而组氨酸出现在肽链中特定位置时能够提高其抗氧化活性[35],推测薏仁米糠多肽具有较高的ABTS自由基清除能力可能与此有关。
2.3.4 薏仁米糠多肽对超氧阴离子自由基的清除作用
超氧阴离子是一种具有高度反应性的自由基,过多的超氧阴离子可以与细胞内的蛋白质以及脱氧核糖核酸(deoxyribonucleic acid,DNA)等其他分子结合并引起氧化损伤,导致如心血管疾病、癌症、糖尿病、中风和神经退行性疾病等的发生和发展[36]。薏仁米糠多肽对超氧阴离子自由基的清除作用见图8。由图8可知,薏仁米糠多肽对O2-·的清除率随质量浓度的增加而升高,表现出明显的量效关系,当多肽质量浓度为10 mg/mL时,其对O2-·清除率为63.58%,经计算可得IC50值为7.33 mg/mL,表明其对O2-·具有一定的清除能力,但与VC相比差距较大。这可能是由于薏仁米糠多肽中氨基酸具有的酚羟基、巯基等活性基团没有在发酵过程中充分显露出来,导致其与氧自由基反应不完全,故表现出较低的清除氧自由基率[37]。
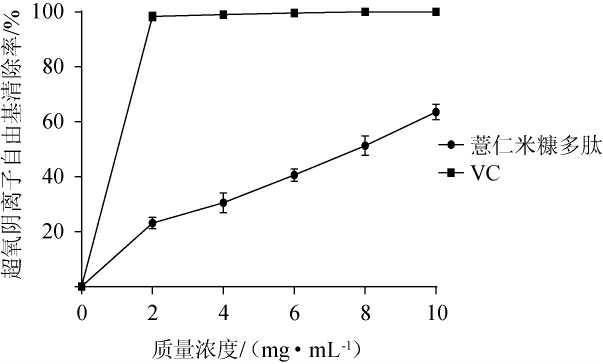
图8 薏仁米糠多肽对超氧阴离子自由基的清除能力
Fig.8 The scavenging effects of peptides from adlay bran on superoxide anion free radical
3 结论
利用枯草芽孢杆菌为发酵菌株,采用微生物发酵法制备薏仁米糠多肽,以水解度为评价指标,通过单因素试验和正交试验得到枯草芽孢杆菌发酵薏仁米糠的最佳工艺为:发酵时间24 h,接种量7%、发酵温度39 ℃、pH 7.0。在此条件下,薏仁米糠发酵液水解度可达到21.33%。采用最优发酵工艺制备的薏仁米糠多肽具有较好的体外抗氧化活性,各项抗氧化指标均随多肽质量浓度增加而增强,呈现出明显的量效关系,其中对DPPH自由基、羟基自由基、ABTS自由基以及超氧阴离子的IC50值分别为7.23 mg/mL、4.47 mg/mL、3.45 mg/mL以及7.33 mg/mL。本研究为薏仁米糠的深加工和开发以及延伸薏仁米全产业链提供了一定的理论指导,也为薏仁米糠多肽生物活性的深入研究奠定了基础。
[1]ZHU F.Coix:Chemical composition and health effects[J].Trends Food Sci Technol,2017,61:160-175.
[2]杨帅.贵州兴仁薏仁米产业发展现状及对策研究[J].粮食问题研究,2022(5):16-18.
[3]杨华连,陈莉,卢红梅,等.薏仁米糠多肽的功能特性研究[J].中国酿造,2019,38(4):126-130.
[4]FENG L,WANG Y,YANG J,et al.Overview of the preparation method,structure and function, and application of natural peptides and polypeptides[J].Biomed Pharmacother,2022,153:113493.
[5]ZOU T B,HE T P,LI H B,et al.The structure-activity relationship of the antioxidant peptides from natural proteins[J].Molecules,2016,21(1):72.
[6] ZHUANG H, TANG N, DONG S T, et al.Optimisation of antioxidant peptide preparation from corn gluten meal[J].J Sci Food Agr,2013,93(13):3264-3270.
[7] SCHLEGEL K, SONTHEIMER K, HICKISCH A, et al.Enzymatic hydrolysis of lupin protein isolates-Changes in the molecular weight distribution, technofunctional characteristics, and sensory attributes[J].Food Sci Nutr,2019,7(8):2747-2759.
[8]LI W,WANG Y,ZHAO H,et al.Improvement of emulsifying properties of soy protein through selective hydrolysis: Interfacial shear rheology of adsorption layer[J].Food Hydrocolloids,2016,60(10):453-460.
[9] MEINLSCHMIDT P, SCHWEIGGERT-WEISZ U, EISNER P.Soy protein hydrolysates fermentation: Effect of debittering and degradation of major soy allergens[J].LWT-Food Sci Technol,2016,71(9):202-212.
[10] URBIZO-REYES U,MARTIN-GONZÁLEZ M F S,GARCIA-BRAVO J,et al.Physicochemical characteristics of chia seed (Salvia hispanica)protein hydrolysates produced using ultrasonication followed by microwaveassisted hydrolysis[J].Food Hydrocolloids,2019,97(11):105187.
[11]范海茹.豆粕鲜味肽的制备与呈味机制探索[D].北京:中国农业科学院,2020.
[12]刘威,闵伟红,刘春雷,等.核桃清蛋白抗氧化肽的制备及其活性研究[J].食品研究与开发,2017,38(17):40-44.
[13]周亭屹,么春艳,徐深录,等.西兰花茎叶肽的酶法制备及其降血脂功能研究[J].食品工业科技,2019,40(20):88-93.
[14]王凯凯.绿豆肽的结构鉴定及对小鼠巨噬细胞免疫活性物质的影响作用研究[D].大庆:黑龙江八一农垦大学,2016.
[15]WANG W,LIU Z,LIU Y,et al.Plant polypeptides:A review on extraction,isolation,bioactivities and prospects[J].Int J Biol Macromol,2022,207:169-178.
[16]蔡莹,汪岳刚,吴金鸿,等.超临界CO2流体提取薏仁米糠油及其脂肪酸成分分析[J].食品与药品,2012,14(9):309-312.
[17]任勰珂,陈莉,卢红梅,等.响应面法优化薏仁米糠蛋白碱提工艺的研究[J].中国酿造,2017,36(8):99-103.
[18]任勰珂,陈莉,卢红梅,等.薏仁米糠蛋白酶法提取工艺的优化[J].中国酿造,2017,36(7):167-171.
[19]杨华连,陈莉,卢红梅,等.薏仁米糠多肽的功能特性研究[J].中国酿造,2019,38(4):126-130.
[20]魏明,薛正莲,赵世光,等.米曲霉发酵米糠制取米糠多肽及其抗氧化活性研究[J].食品工业科技,2014,35(19):114-118.
[21]罗斌,邱波,谢作桦.枯草芽孢杆菌发酵米糠制备活性肽及其抗氧化性评价[J].安徽农业科学,2017,45(2):122-124.
[22]YOU Q,YIN X,ZHANG S,et al.Extraction,purification,and antioxidant activities of polysaccharides from Tricholoma mongolicum Imai[J].Carbohyd Polym,2014,99(2):1-10.
[23]董烨,张益奇,姚洪正,等.鳙鱼骨酶解产物的抗氧化活性及相对分子质量分布[J].中国食品学报,2021,21(9):281-287.
[24]廖卢艳,张喻.枯草芽孢杆菌发酵米渣制备抗氧化肽发酵工艺条件的优化[J].激光生物学报,2015,24(4):368-372.
[25]尹乐斌,李乐乐,何平,等.枯草芽孢杆菌发酵豆渣制备多肽及其活性研究[J].中国酿造,2022,41(1):75-79.
[26]黄威,许海宁,代春华,等.微生物固态发酵菜籽粕制备多肽的条件优化[J].中国粮油学报,2023,38(2):90-95.
[27]闵钟熳,贾笑雨,解铁民,等.微生物发酵法提取米糠粕中可溶性膳食纤维的研究[J].中国酿造,2017,36(8):53-56.
[28]钟晓霞,刘志云,周晓容,等.特基拉芽孢杆菌液态发酵制备菜籽多肽的工艺研究[J].中国粮油学报,2022,37(10):230-237.
[29]尹乐斌,周娟,何平,等.乳酸菌发酵豆清液制备多肽及其体外抗氧化活性研究[J].食品与发酵工业,2020,46(11):131-137.
[30]陈敏,何远清,马超月,等.酶法制备燕麦多肽的工艺条件优化及分析[J].食品工业,2022,43(10):109-115.
[31]MILIAUSKAS G,VENSKUTONIS P R,VAN BEEK T A.Screening of radical scavenging activity of some medicinal and aromatic plant extracts[J].Food Chem,2004,85(2):231-237.
[32]包怡红,李雪龙,徐思源,等.乳清蛋白肽的制备及羟自由基的清除作用[J].中国乳品工业,2006,34(8):23-26.
[33] ELIAS R J, BRIDGEWATER J D, VACHET R W, et al.Antioxidant mechanisms of enzymatic hydrolysates of β-lactoglobulin in food lipid dispersions[J].J Agr Food Chem,2006,54(25):9565-9572.
[34]ZHENG L,ZHAO M M,XIAO C Q,et al.Practical problems when using ABTS assay to assess the radical-scavenging activity of peptides:Importance of controlling reaction pH and time[J].Food Chem, 2016, 192:288-294.
[35]冯美琴,张译文,孙健.植物乳杆菌CD101和模仿葡萄球菌NJ201对发酵香肠多肽体内外抗氧化活性的影响[J].食品科学,2022,43(18):113-120.
[36]赵艳红,李建科,李国秀.天然抗氧化物体外活性评价方法的优选与优化[J].食品科学,2008,29(6):64-69.
[37]贾木春.小米多肽的制备及其抗氧化作用研究[D].天津:天津科技大学,2022.