酯酶既能催化酯键水解又能使其合成,基于此特性也被称为酯合成酶和酯分解酶[1]。酯酶是催化白酒香气成分形成与香味物质转化的主要酶类[2]。它在细胞内参与各类催化反应,广泛分布在动植物和微生物中,常被运用于食品业、医药、化工等领域[3-4],其中微生物源的酯酶运用得最多[1]。
目前对产酯酶微生物研究主要集中在酵母和霉菌等真菌,对细菌研究较少[5-6]。产酯酶的霉菌主要有伞枝犁头霉[7]、红曲霉[8]、黑曲霉和根霉[9]等。细菌是白酒生产发酵中的一类重要产酯酶微生物,但目前对酯化细菌的研究主要集中在葡萄球菌、单胞菌和放线菌[10-11]。
酯酶在食品领域,通常运用于酒类、酱油和食醋等酿造食品以催化产生酯类等呈香物质[12]。白酒在我国已有上千年的历史,根据其不同的风味口感,可分为包括浓香型、酱香型、清香型在内的十二种香型[13-14]。白酒的风味成分主要有醇类、酸类、酯类、酮类、萜类和含硫化合物等,它们气味各异且相互影响[15]。在白酒酿造过程中,菌群的相互作用会对白酒的风味产生极大的影响[16]。白酒的发酵源于各种微生物的协同作用[17],白酒中的风味物质主要来源于微生物的代谢生长、生物酶促反应、非酶促反应等。微生物代谢生成的酯酶能使有机酸缩合,生成己酸乙酯、乙酸乙酯等白酒的主体香气成分[18]。微生物源的酯酶具有较高的酯化能力,能够提高白酒中酯类物质(乙酸乙酯、己酸乙酯)的含量,从而明显提升白酒的品质和风味[19]。白酒发酵前中期产生的酸类和醇类由酯酶催化生成酯类物质[20-21]。因此酯酶广泛运用于白酒行业,为白酒提酯增香[22-23],以改善传统白酒酯香味不足的缺陷[6]。谢恩举等[24]利用产酯酶己酸菌液与酶制剂一同加入窖池发酵,极大的提升了浓香型白酒的产量和风味,创造了客观的经济效益。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术由于其安全可靠,操作简单的特点,是近二十年来为改善微生物的某些效应常用的方法[25]。它是通过高纯度的氦气为载体气流,利用高活性等离子体流作用于微生物,使其遗传物质发生突变,从而改变某些特性的方法[26]。紫外(ultraviolet,UV)诱变技术使用的紫外线是一种物理诱变剂,它能使脱氧核糖核酸(deoxyribonucleic acid,DNA)分子间(内)的交联嘧啶形成嘧啶二聚体造成碱基对转换,修复后造成差错和缺失,导致微生物遗传物质的改变[27-28]。李豪等[29]通过ARTP-UV诱变枝孢菌(Cladosporium),使其产纤维素酶的能力提高了36.14%。将这两种技术进行复合运用,能得到更加可靠稳定的诱变效果,是目前相关研究常用的复合诱变方法。
本研究以实验室前期筛选保藏的产酯酶菌株格氏乳球菌(Lactococcus garvieae)S5-4为出发菌株,通过多轮次ARTP-UV复合诱变,选育高产酯酶传代稳定的突变菌株,对突变菌株进行耐受性试验,并通过单因素试验优化培养基组分,采用单因素及响应面试验优化突变菌株发酵条件,提升突变株的产酯酶能力,从而达到提升白酒的风味和品质的目的。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
格氏乳球菌(Lactococcus garvieae)S5-4:实验室前期筛选保藏。其酯酶酶活为(15.74±0.03)U/mL,已保藏于广东省微生物菌种保藏中心,保藏编号为GDMCC No:63054。
1.1.2 试剂
三丁酸甘油酯、聚乙烯醇(均为分析纯):上海麦克林生化科技有限公司;牛肉膏、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;氯化钠、磷酸氢二钾、硫酸镁、硫酸亚铁、硫酸铵(均为分析纯):成都市科隆化学品有限公司。
1.1.3 培养基
筛选培养基[30]:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L,3%聚乙烯醇-三丁酸甘油酯乳化液20%,霉菌素25 μg/mL,自然pH。121 ℃灭菌20 min。
种子培养基[31]:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L,自然pH。121 ℃灭菌20 min。
发酵培养基:葡萄糖20 g/L,牛肉膏20 g/L,氯化钠5 g/L,pH 7.0。121 ℃灭菌20 min。
1.2 仪器与设备
ARTP-P常压室温等离子体诱变仪:无锡源清天木生物科技有限公司;SW-CJ2D超净工作台:上海苏净实业有限公司;HZ150L型恒温培养摇床:武汉瑞华仪器设备有限责任公司;LS-50HJ立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司。
1.3 方法
1.3.1 出发菌株S5-4的活化及菌悬液制备
将在实验室保藏的格氏乳球菌(Lactococcus garvieae)S5-4从甘油管中移到种子培养基中,置于摇床35℃、150r/mim培养活化24 h。连续活化两代后作为出发菌株。
将斜面培养基上保存的出发菌株S5-4,接种于种子培养基中,37 ℃、180 r/min振荡培养至对数期,得到菌株S5-4种子液。吸取5 mL的菌株S5-4种子液于离心管中,于5 000 r/min条件下离心10 min。弃去上清液,沉淀加入4 mL 磷酸盐缓冲液(phosphate buffer solution,PBS)混匀,同样条件下再次离心,反复3次。最后用PBS重悬,得到菌株S5-4菌悬液,调整菌悬液OD600nm值为0.6~1.0。
1.3.2 酯酶活力的测定
酯酶活力的测定采用滴定法。具体操作如下:3%聚乙烯醇-三丁酸甘油酯乳化液4 mL与0.025 mol/L磷酸缓冲溶液(pH 7.5)5 mL于锥形瓶中混匀,然后在40 ℃水浴锅中预热5 min,再加入1 mL提前制备好的粗酶液,反应15 min后加入15 mL体积分数为95%乙醇,滴加2~3滴酚酞指示剂,最后用0.05 mol/L的NaOH标准溶液滴定,空白组加入等量灭菌后的无菌水[32]。酯酶酶活计算公式如下:
式中:U为酯酶酶活,U/mL;V1为粗酶液消耗NaOH溶液的体积,mL;V2为空白对照消耗NaOH溶液的体积,mL;n为稀释倍数;t为反应时间,h。
酯酶酶活定义:在一定条件下,每分钟催化三丁酸甘油酯水解生成1 μmol正丁酸的量,定义为一个酶活力单位(U/mL)。
1.3.3 ARTP-UV复合诱变
(1)ARTP诱变
将制备好的菌悬液用移液枪取10 μL于金属载片上,再将滴有菌液的金属载片置于诱变仪载物台,将参数设置为:射频功率130 W、工作气流为10 L/min。室温常压下,诱变处理时间分别为0 s、10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s、90 s、100 s、110 s、120 s、130 s。将已诱变的载片置于装有1 mL PBS的离心管中,并调整菌悬液浓度为10-1~10-3。取100μL将其涂布于筛选培养基上,各梯度3组平行。于37℃恒温培养48 h后再进行菌落数统计,并计算致死率[33]。选择致死率在90%[31]左右的诱变时间再对目的菌株按照上述同样方法进行ARTP诱变处理,所得到的菌悬液涂布于筛选培养基平板上,37 ℃培养5 d,测量菌落直径(d)及透明圈直径(D),选择D/d较大的菌落再进行紫外诱变[34]。致死率[33]计算公式如下:
(2)紫外诱变
将经ARTP诱变后得到的酯酶酶活较高的突变菌株,制备成菌悬液。吸取5 mL的菌悬液于无菌培养皿,并置于磁力搅拌器上,距紫外灯50 cm处进行照射。照射时间设置为0、10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s、90 s、100 s、110 s、120 s、130 s、140 s、150 s。照射结束后,在超净工作台内关灯避光稳定10 min。吸取1 mL培养皿内已诱变的菌悬液,调整浓度梯度为10-1~10-3备用。取100 μL涂布于筛选培养基上,各梯度3组平行。37 ℃培养48 h后统计菌落数,并计算致死率。以致死率为90%[31]的时间对目的菌株进行UV诱变处理,所得菌悬液涂布于筛选培养基,37 ℃培养3 d后,测量菌落直径(d)和透明圈直径(D),得出D/d值[34]。再将所得到的突变菌株用上述方法测定其酯酶活力,判断诱变效果,选出高产酯酶的突变菌株。
(3)多轮次ARTP-UV复合诱变
菌悬液经一次ARTP诱变后,将筛选出产酯酶活力最高的突变株再进行一次UV诱变,这个过程称为一轮ARTP-UV复合诱变。为筛选出稳定且产酯酶活力高的菌株,将原始菌株S5-4按照上述诱变方法进行第一轮的复合诱变,筛选出高产酯酶的突变菌株。第一轮复合诱变得出产酯酶活力最高的突变株,按上述方法进行第二轮ARTP-UV复合诱变,再次得出产酯酶活力最高的突变菌株。连续进行三轮ARTP-UV复合诱变,筛选出产酯酶活力最高的菌株作为此次诱变筛选得到的菌株。
1.3.4 突变菌株遗传稳定性
将经过复合诱变筛选出高产酯酶的突变株在发酵培养基斜面上连续培养15代,并不断地测定其产酯酶能力。将这些不同传代次数间的产酯酶能力高低进行不断地比较,得出相应的结果。当同一菌株连续传代5次,其产物产量无明显差异,则认为该菌株已具有良好的遗传稳定性[31]。
1.3.5 突变菌株生理耐受性
(1)温度和pH耐受性试验
将原始菌株和突变菌株活化后,接种至发酵培养基。分别在不同的温度(20℃、25℃、30℃、35℃、40℃、45℃、50 ℃)、不 同 的 初 始pH 值(1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0)条件下,于180 r/min培养3 d后,分别测定OD600 nm值,测定原始菌株和突变菌株的温度和pH耐受性。
(2)葡萄糖耐受性试验
将原始菌株和突变菌株接种至不同葡萄糖质量浓度(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L、80 g/L)的发酵培养基,保持培养基其余条件均不变。置于摇床180 r/min、28 ℃培养3 d,分别测定OD600 nm值,测定原始菌株和突变菌株的葡萄糖耐受性。
(3)乙醇耐受性试验
将原始菌株和突变菌株接种至发酵培养基,以发酵培养基质量(100%)计,向发酵培养基中加入不同体积分数的乙醇(0、1%、2%、3%、4%、5%、6%、7%、8%、9%、10%);乙醇添加前过0.22 μm的滤膜除菌,每组3个平行。在28 ℃、180 r/min条件下培养3 d,取OD600 nm值的平均值,以测定原始菌株和突变菌株乙醇的耐受性。
(4)丁酸和己酸耐受性试验
将原始菌株和突变菌株接种至发酵培养基,以发酵培养基质量(100%)计,分别向发酵培养基中加入不同质量浓度的丁酸(0、5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)和己酸(0、1 g/L、2 g/L、3 g/L、4 g/L、5 g/L)。测定发酵液的OD600nm值,确定原始菌株和突变株在不同丁酸和己酸质量浓度下的生长情况。
1.3.6 突变株液态发酵培养基优化
将液态发酵培养基以不同的碳源(葡萄糖、可溶性淀粉、蔗糖、玉米粉、乳糖)添加量为20 g/L;不同的氮源(牛肉膏、硝酸铵、硫酸铵、蛋白胨、酵母粉)添加量均为10 g/L;不同的无机盐(K2HPO4、KH2PO4、MgSO4·7H2O、MnSO4、NaCl)添加量均为5 g/L。培养基成分确定后,再将最佳碳源和最佳氮源添加量分别设置为5 g/L、10 g/L、15 g/L、20 g/L、25 g/L,最佳无机盐的添加量分别设置为1 g/L、3 g/L、5 g/L、7 g/L、9 g/L。于37 ℃、180 r/min培养2 d后,测定突变株的酶活,用以确定最佳培养基组分及其添加量[35]。
1.3.7 突变菌株发酵条件优化
(1)单因素试验
测定突变菌株在不同接种量(1%、3%、5%、7%、9%)、不同发酵时间(1 d、2 d、3 d、4 d、5 d)、不同转速(140 r/min、160 r/min、180 r/min、200 r/min、220 r/min)、不同发酵温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)、不同初始pH值(6.0、6.5、7.0、7.5、8.0)条件下发酵48 h后测定产酯酶的高低,以确定突变菌株液态发酵产酯酶的最佳条件。
(2)响应面试验
在单因素试验基础上,将对突变菌株的产酯酶酶活力影响较大的发酵时间(A)、发酵温度(B)、初始pH值(C)为自变量,酯酶酶活力为响应值(Y),设计3因素3水平的Box-Behnken试验,采用Design-Expert 13.0软件进行结果分析,Box-Behnken试验因素与水平见表1。
表1 发酵条件优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments for fermentation conditions optimization
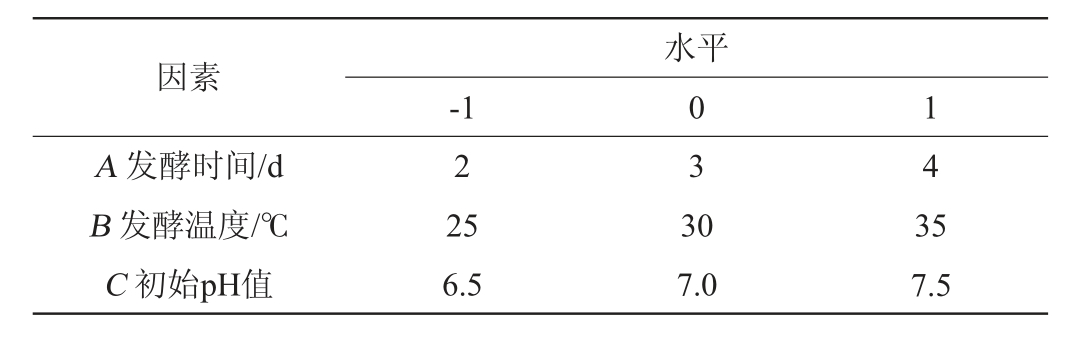
因素A 发酵时间/d B 发酵温度/℃C 初始pH值-1水平0 1 2 3 4 25 6.5 30 7.0 35 7.5
1.3.8 数据处理
采用Excel 2021、Design-Expert 13.0、IBM SPSS Statistics 27.0、Origin 2021进行数据分析和绘图。
2 结果与分析
2.1 ARTP-紫外复合诱变
2.1.1 ARTP-紫外复合诱变致死曲线
原始菌株S5-4经ARTP和紫外诱变将其进行培养后计菌落数,通过计算后得出不同时间段突变株的致死率,并将其制成致死曲线见图1。由图1可知,随着诱变时间的增加,出发菌株S5-4的致死率也在增加。前40 s ARTP诱变致死率与紫外诱变致死率增加趋势基本相同,致死率随时间急速增加。之后致死率增加速度放缓,ARTP诱变致死率在80 s时达到90%,并缓慢增长;紫外诱变致死率在110 s时达到94%,并持续增加。由于较高的致死率是保证诱变菌株有效突变的前提,一般认为致死率在90%左右是最为合适的诱变时间[36-37]。因此,ARTP与紫外诱变最合适的时间分别设置为80 s和110 s。

图1 不同ARTP和UV诱变处理时间下出发菌株S5-4的致死率曲线
Fig.1 Lethal rate curves of original strain S5-4 under different time treated by ARTP and UV mutation
2.1.2 ARTP-UV复合迭代诱变
原始菌株S5-4经三轮次的ARTP-UV复合诱变后,通过测定酯酶酶活来选育高产菌株,三轮次ARTP-UV复合诱变的酯酶酶活测定结果见图2。由图2可知,突变菌株既有正向突变(即酶活提升)又有逆向突变(即酶活下降)。基于实验目的,应筛选正向突变菌株作为下一次突变的出发菌株,轮次迭代诱变选育出产酶较高且遗传稳定的突变株。
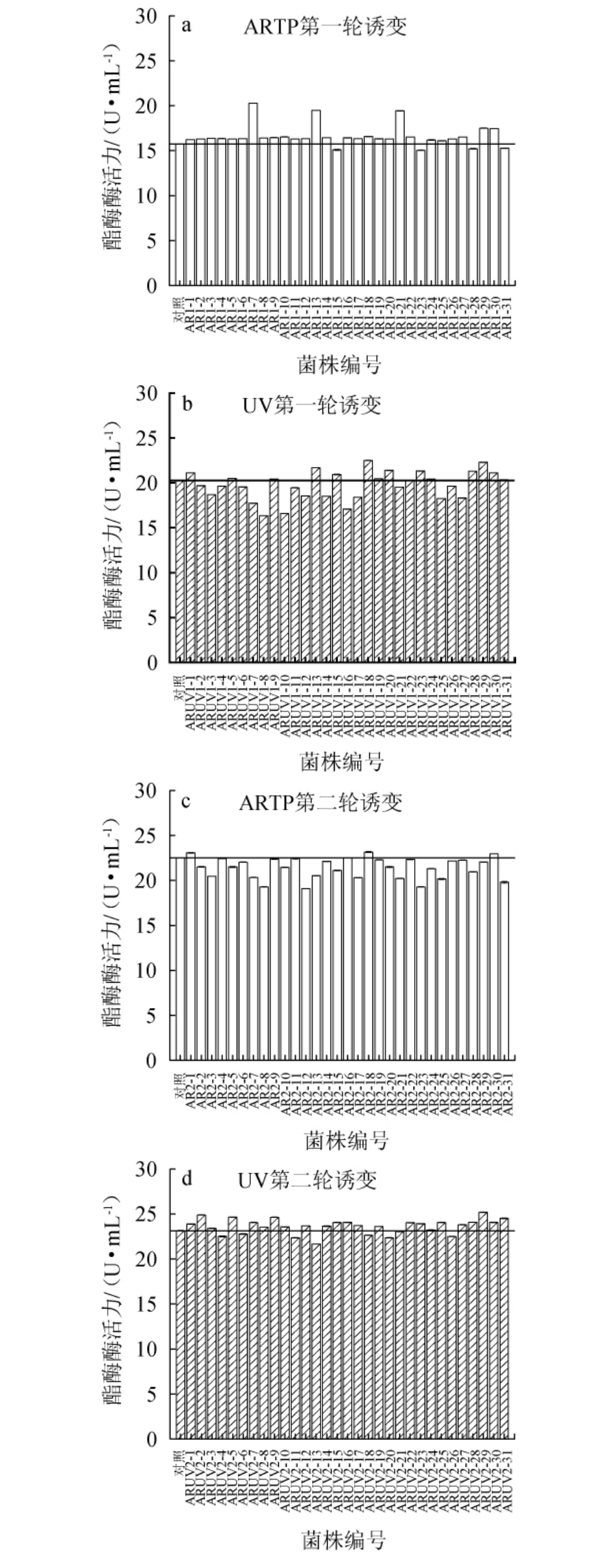
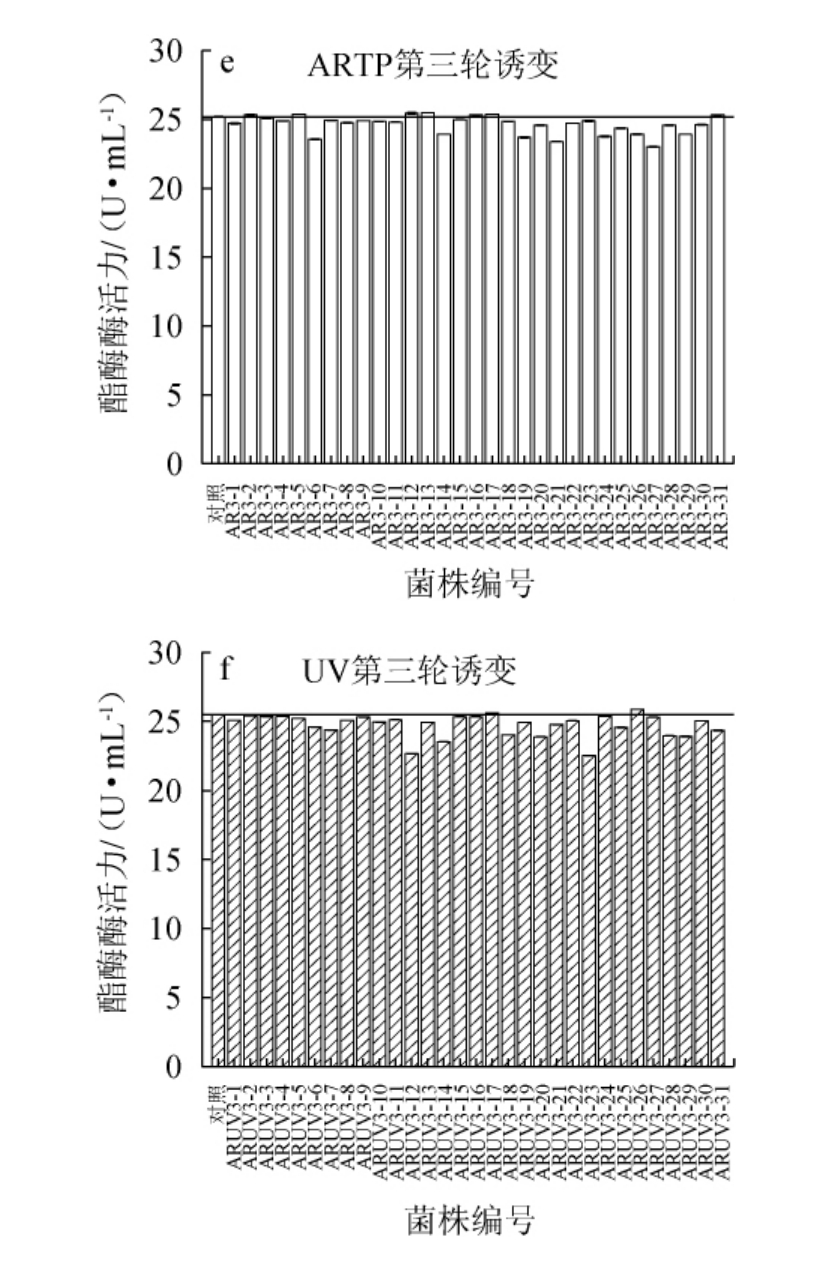
图2 ARTP-UV复合迭代诱变突变株酯酶酶活力
Fig.2 Esterase activities of mutant strains ARTP-UV compound iterative mutagenesis
由图2a和图2b可知,第一轮ARTP诱变中菌株AR1-7酶活力最高,为(20.28±0.02)U/mL,其他突变株酶活力都在(15.05±0.04)~(19.48±0.02)U/mL。因此,以菌株AR1-7作为UV诱变的出发菌株,通过透明圈法共筛选了31株透明圈较大的突变株。对这31株菌的酶活进行测定,得出突变菌株ARUV1-18酶活力最高,为(22.51±0.02)U/mL,其余突变株酶活力在(16.35±0.02)~(21.69±0.02)U/mL。将经第一轮复合诱变得出酶活最高突变菌株ARUV1-18,制成菌悬液,进行第二轮的ARTP-紫外复合诱变。
由图2c可知,菌株ARUV1-18经第二次ARTP诱变后,突变菌株AR2-18酶活力最高,为(23.14±0.06)U/mL;其次是菌株AR2-16,酶活力为(22.49±0.02)U/mL。因此,选择菌株AR2-18进行第二次紫外诱变。
由图2d可知,突变菌株ARUV2-29酶活力最高,为(25.19±0.04)U/mL,其余突变株酶活力值均在(21.66±0.02)~(24.90±0.03)U/mL。以突变株最高酶活为原则,选择突变菌株ARUV2-29进行第三轮的复合诱变。
由图2e和图2f可知,经三轮ARTP-UV复合诱变后,少部分突变株的酶活仍在正向增加和逆向减少。大部分突变株酶活升高呈现出趋于稳定的趋势,逐渐平稳达到高点。从总体情况来说,三轮复合诱变作用于菌株对其产酯酶能力具有一定的累加效应。从此次诱变效果来看,经三轮诱变后,菌株的产酯酶能力已达到较好且稳定的效果。在第三轮ARTP-UV复合诱变的菌株中,菌株ARUV3-26酶活力为(25.88±0.02)U/mL,相比于初筛提高了64.42%;并且其余突变株酶活力也在(22.67±0.03)~(25.41±0.06)U/mL。因此,选用突变株ARUV3-26进行下一步遗传稳定性测试。
2.1.3 突变菌株ARUV3-26遗传稳定性
通过突变株ARUV3-26传代15次并依次测定其产酯酶活力的结果见图3。由图3可知,总体趋势为酯酶活力在第1次((25.48±0.08)U/mL)传代到第2次((23.69±0.02)U/mL)传代出现了明显的下降,第2次直至第15次传代的酯酶活力虽有小幅度的波动但总体是趋于平稳(酯酶活力范围在(23.51±0.02)~(23.56±0.02)U/mL)。因此传代稳定后突变菌株ARUV3-26的酶活,相比于原始菌株L.garvieae S5-4的初始酶活[(15.74±0.03)U/mL]提升了49.36%~49.68%;由此可知,突变菌株ARUV3-26经传代测试15代后,表现出良好的稳定性。KONG F等[35]对分解甲醛的Pseudomonas putida W1进行诱变所获得突变株进行传代稳定性测试,在第4次到第5次传代时降解率下降了5%,随后在第10次传代后表现出良好的遗传稳定性。
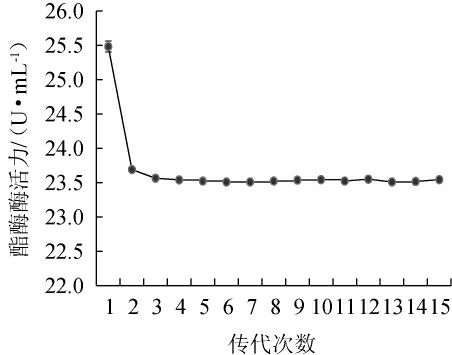
图3 突变菌株ARUV3-26遗传稳定性测试
Fig.3 Genetic stability experiment of mutant strain ARUV3-26
2.1.4 突变菌株ARUV3-26耐受性试验
由图4a可知,原始菌株S5-4与突变菌株ARUV3-26在20~50 ℃时OD600nm值随温度上升呈现出先升后降的趋势,在温度为35 ℃时OD600 nm值达到最高,此时原始菌株S5-4 OD600 nm值为8.10±0.07,突变菌株ARUV3-26 OD600 nm值为8.37±0.03。总体来看,整个温度范围内两株菌有良好的生长情况,其中在温度35 ℃时为最佳。由图4b可知,随pH值在1~10的范围内变化,两株菌的OD600 nm值都呈现出先升后降的趋势,都在pH为6.0时达到峰值,此时原始菌株S5-4 OD600 nm值为5.84±0.05,突变菌株ARUV3-26 OD600 nm值为6.84±0.05,且突变菌株ARUV3-26高于原始菌株S5-4,说明突变菌株ARUV3-26 pH耐受性也较原始菌株S5-4高。由图4c可知,葡萄糖质量浓度在10~80 g/L时,OD600nm值随葡萄糖质量浓度升高呈现出先升后降的趋势。其中原始菌株S5-4的OD600 nm值在葡萄糖质量浓度为40 g/L时OD600 nm值达到峰值8.12±0.01;突变菌株ARUV3-26的OD600 nm值在葡萄糖质量浓度为50g/L时达到峰值8.79±0.01。因此在培养时也应将葡萄糖质量浓度分别设置为40 g/L和50 g/L。由图4d可知,乙醇体积分数为0~10%时,随乙醇体积分数升高两株菌的OD600 nm值不断降低,在10%时达到最低值。但突变菌株ARUV3-26的OD600nm值高于原始菌株S5-4的OD600nm值,说明突变菌株ARUV3-26耐受乙醇能力高于原始菌株S5-4。由图4d、图4f可知,随丁酸和己酸的质量浓度增加,OD600 nm值不断降低。但当丁酸质量浓度为20 g/L时,原始菌株S5-4几乎不生长,而突变菌株ARUV3-26的生长情况良好;当己酸质量浓度为5g/L时,两株菌都停止生长,但己酸质量浓度为1~4 g/L时,突变株ARUV3-26的OD600nm值高于原始菌株S5-4。
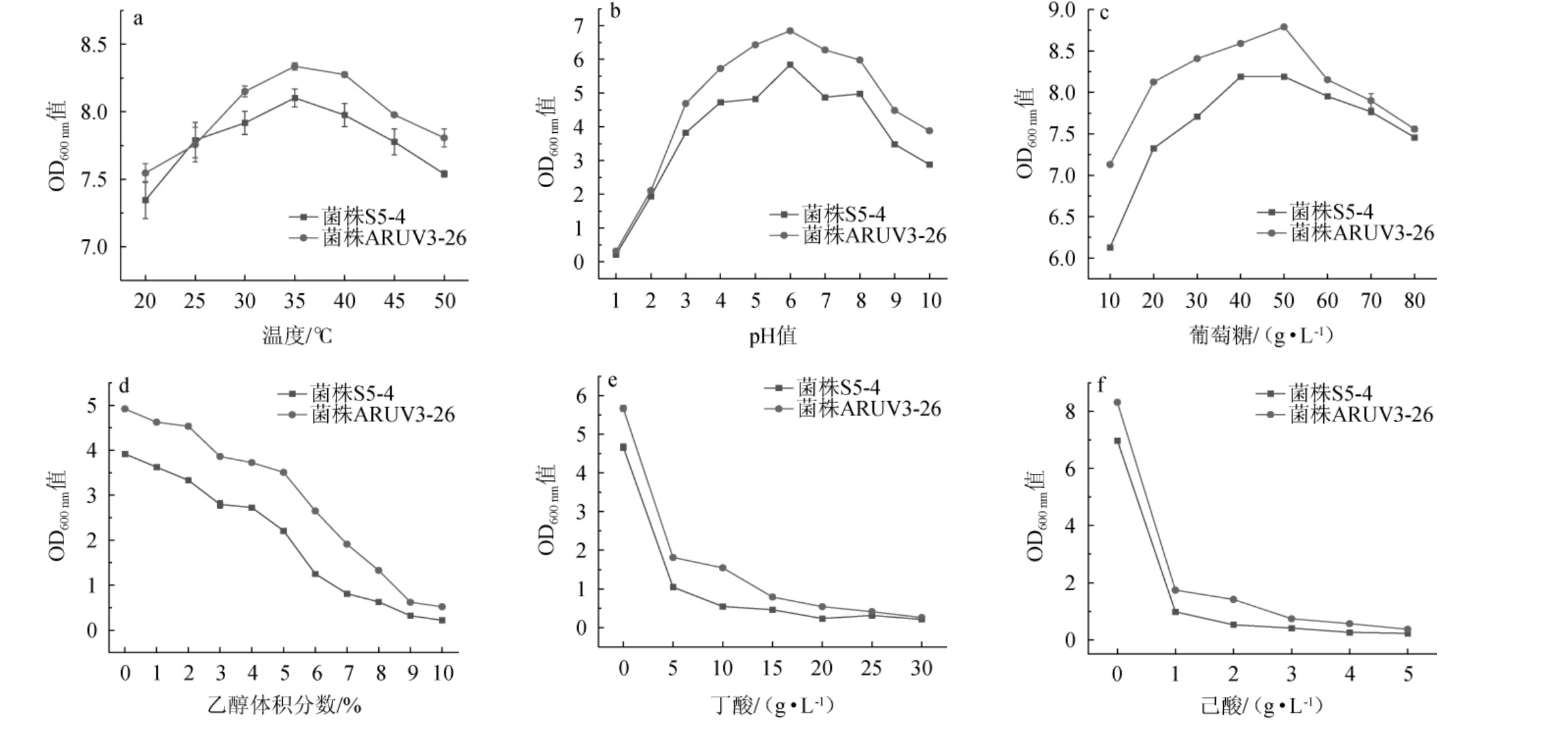
图4 原始菌株S5-4和突变菌株ARUV3-26耐受性试验结果
Fig.4 Tolerance tests results of original strain S5-4 and mutant strain ARUV3-26
2.2 突变菌株ARUV3-26产酯酶培养基优化
探究不同的碳源及最佳碳源添加量、不同的氮源及最佳氮源添加量、不同的无机盐及最佳无机盐添加量对突变菌株ARUV3-26产酯酶活力的影响,结果见图5。由图5a可知,突变菌株ARUV3-26以葡萄糖为碳源时,产酯酶活力最高,为(25.63±0.02)U/mL。因此,最佳碳源为葡萄糖。由图5b可知,突变株ARUV3-26以蛋白胨为氮源时,酯酶酶活最高,为(26.65±0.02)U/mL。因此,最佳氮源为蛋白胨。由图5c可知,突变株ARUV3-26以NaCl为无机盐时,酯酶酶活力最高,为(25.65±0.021)U/mL。因此,最佳无机盐为NaCl。由图5d可知,当葡萄糖添加量为5~20 g/L时,酯酶酶活力随之增高;当葡萄糖添加量为20 g/L时,酯酶酶活力最高,为(26.75±0.03)U/mL;当葡萄糖添加量>20 g/L之后,酯酶酶活力有所下降。因此,最佳葡萄糖添加量为20 g/L。由图5e可知,当蛋白胨添加量为5~15 g/L时,酯酶酶活力随之增高;当蛋白胨添加量为15 g/L时,酯酶酶活力最高,为(26.65±0.03)U/mL;当蛋白胨添加量>15 g/L之后,酯酶酶活力有所下降。因此,最佳蛋白胨添加量为15 g/L。由图5f可知,当NaCl添加量为1~5 g/L时,酯酶酶活力随之增高;当NaCl添加量为5 g/L时,酯酶酶活力最高,为(27.65±0.03)U/mL;当NaCl添加量>5 g/L之后,酯酶酶活力有所下降。因此,最佳NaCl添加量为5 g/L。
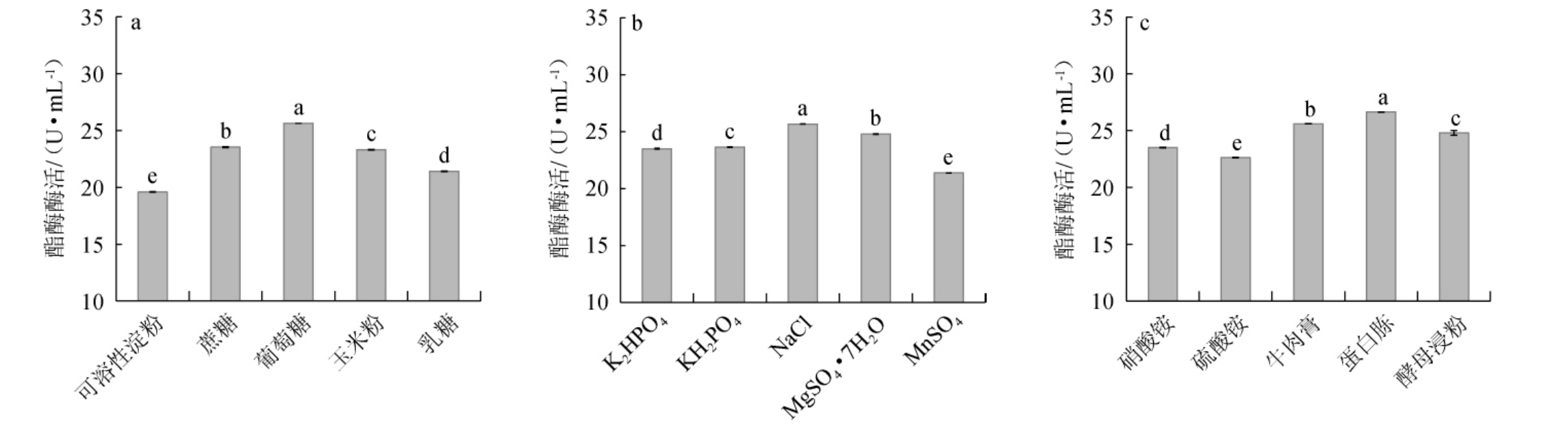

图5 培养基成分对突变株ARUV3-26产酯酶酶活的影响
Fig.5 Effects of medium composition on activities of esterase produced by the mutant ARUV3-26
不同小写字母表示差异显著(P<0.05)。下同。
2.3 突变菌株ARUV3-26产酯酶培养条件优化
2.3.1 单因素试验
突变菌株ARUV3-26产酯酶培养条件优化单因素试验结果见图6。
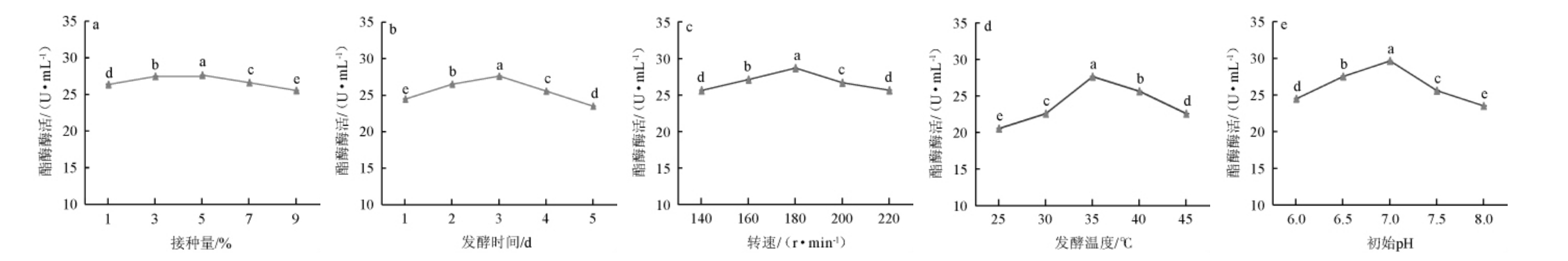
图6 不同培养条件对突变株ARUV3-26产酯酶酶活的影响
Fig.6 Effects of different culture conditions on activities of esterase produced by mutant ARUV3-26
由图6a可知,突变菌株ARUV3-26随接种量增加,酯酶酶活呈现先上升后下降趋势,但幅度不大。接种量为1%~5%时,酯酶活力随之增加;接种量为5%时,酯酶活力达到最高,为(27.63±0.02)U/mL;接种量>5%之后,酯酶活力随之下降。因此,最适接种量为5%。由图6b可知,突变菌株ARUV3-26随发酵时间的增加呈现出先增后减的趋势,且变化幅度较大。当发酵时间为1~3 d时,酯酶活力随之增加;当发酵时间在3 d时,酯酶活力达到最高,为(27.60±0.02)U/mL;当发酵时间>3 d之后,酯酶活力随之下降。因此,最适发酵时间为3 d。由图6c可知,转速影响菌株代谢,随着转速增加突变株ARUV3-26酯酶活力先增后减,趋势明显。当转速为140~180 r/min时,酯酶活力随之增加;当转速为180 r/min时,酯酶活力达到最高,为(28.69±0.02)U/mL;当转速>180 r/min之后,酯酶活力随之下降。因此,最适转速为180 r/min。极端的温度和pH会导致菌株受到胁迫作用,从而影响其生长代谢,使酶活下降。由图6d可知,当发酵温度不断升高,突变株ARUV3-26酯酶活力先升后降。当发酵温度为25~35 ℃时,酯酶活力随之增加;发酵温度为35 ℃时,此时酶活最高[(28.65±0.02)U/mL];当发酵温度>35 ℃之后,酯酶活力随之下降。因此,最适发酵温度为35 ℃。由图6e可知,随着pH的增加,突变株ARUV3-26酯酶活力先增后减。当pH值为6~7时,酯酶活力随之增加;pH值为7时,酶活最高达到(29.64±0.02)U/mL;当pH值>7之后,酯酶活力随之下降。因此,最适pH值为7。
2.3.2 响应面试验
在单因素试验基础上,以对试验结果影响最大的3个因素:发酵时间(A)、发酵温度(B)、初始pH值(C)作为自变量,以酯酶酶活力作为响应值(Y),设计响应面分析试验。发酵条件优化Box-Behnken试验设计及结果见表2,回归模型方差分析见表3。
表2 发酵条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for fermentation conditions optimization
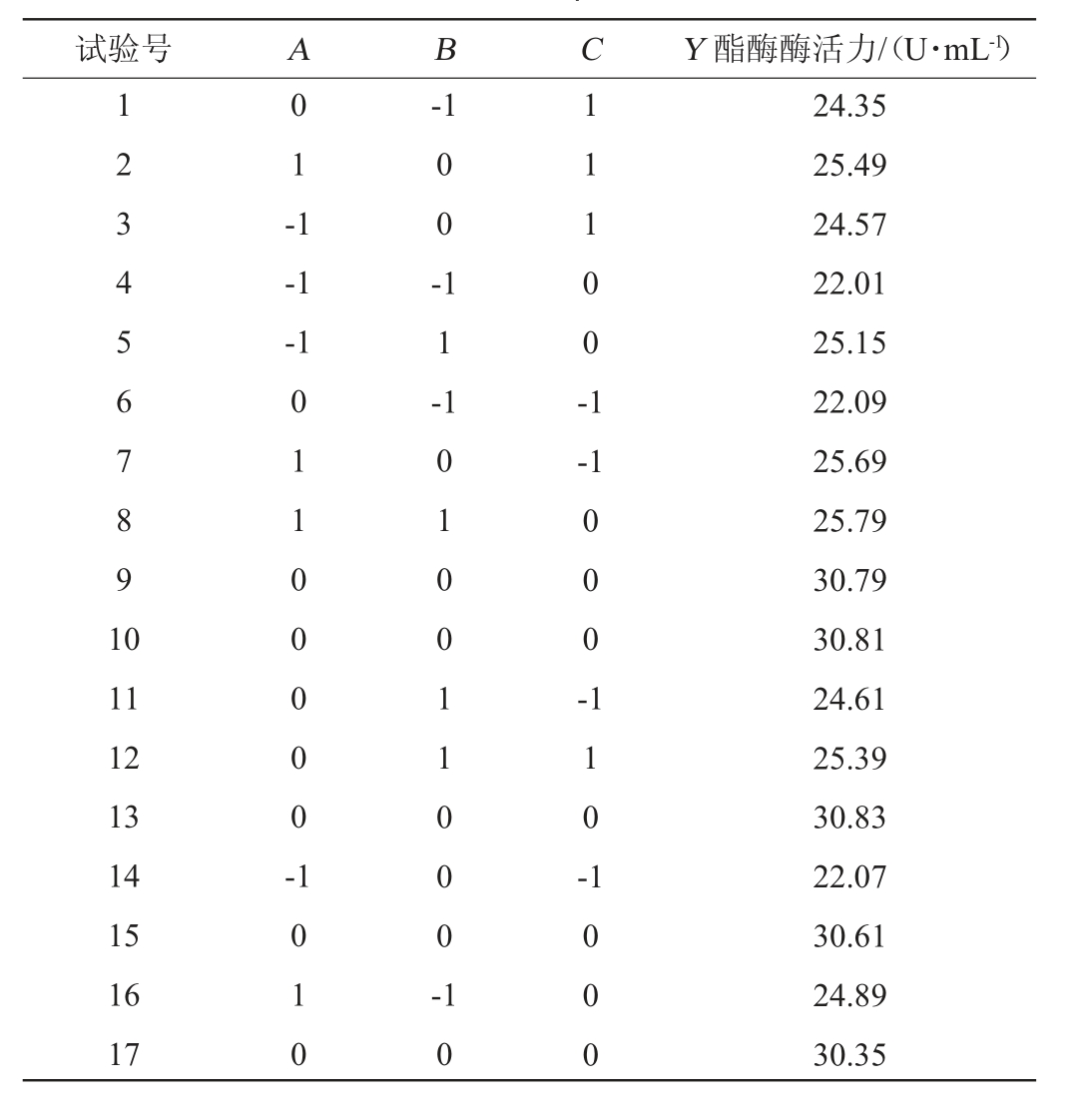
试验号 A B C Y 酯酶酶活力/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0 0 1 -1-1-1-1 0 0 -1 1 -1 1 1 0 0 -1-1 11 12 13 14 15 16 17 0 1 1 0 0 0 0 0 -0 0 0 -1 0 1 0 1 0 1 0 0 1 1 0 0 0 -1 1 0 -1 0 1 0 0 0 24.35 25.49 24.57 22.01 25.15 22.09 25.69 25.79 30.79 30.81 24.61 25.39 30.83 22.07 30.61 24.89 30.35
表3 回归模型方差分析
Table 3 Variance analysis of regression model

注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著
(P<0.01)。
项目 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总和163.85 8.12 6.88 3.81 1.25 1.82 0.688 9 36.87 44.72 44.86 0.455 6 0.290 3 0.165 3 164.31 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 18.21 8.12 6.88 3.81 1.25 1.82 0.688 9 36.87 44.72 44.86 0.065 1 0.096 8 0.041 3 279.74 124.77 105.74 58.52 19.27 28.00 1058 566.45 687.13 689.24<0.000 1<0.000 1<0.000 1 0.000 1 0.003 2 0.001 1 0.014 0<0.000 1<0.000 1<0.000 1*******************2.34 0.214 5
通过Design-Expert 13.0对表2中的数据进行分析,得到拟合方程如下:
由表3可知,模型的P<0.000 1,该模型极显著。失拟项P=0.214 5>0.05,不显著。由此可知,该二次回归方程拟合度良好,能较好地进行响应面预测。决定系数R2=0.997 2,调整决定系数R2adj=0.993 7,预测决定系数R2pre=0.970 2,这表明拟合程度良好,可以采用此模型预测突变株的酯酶酶活力。由P值可知,一次项A、B、C,交互项AB、AC,二次项A2、B2、C2对结果影响极显著(P<0.01),交互项BC对结果影响显著(P<0.05)。由F值可知,3个因素对酯酶酶活力影响的大小顺序为:A(发酵时间)>B(发酵温度)>C(初始pH值)。
发酵时间、发酵温度和初始pH值交互作用对突变株ARUV3-26产酯酶能力影响的响应面及等高线见图7。由图7可知,AB、AC交互作用对结果影响极显著(P<0.01),BC交互作用对结果影响显著(P<0.05),这与表3方差分析结果一致。
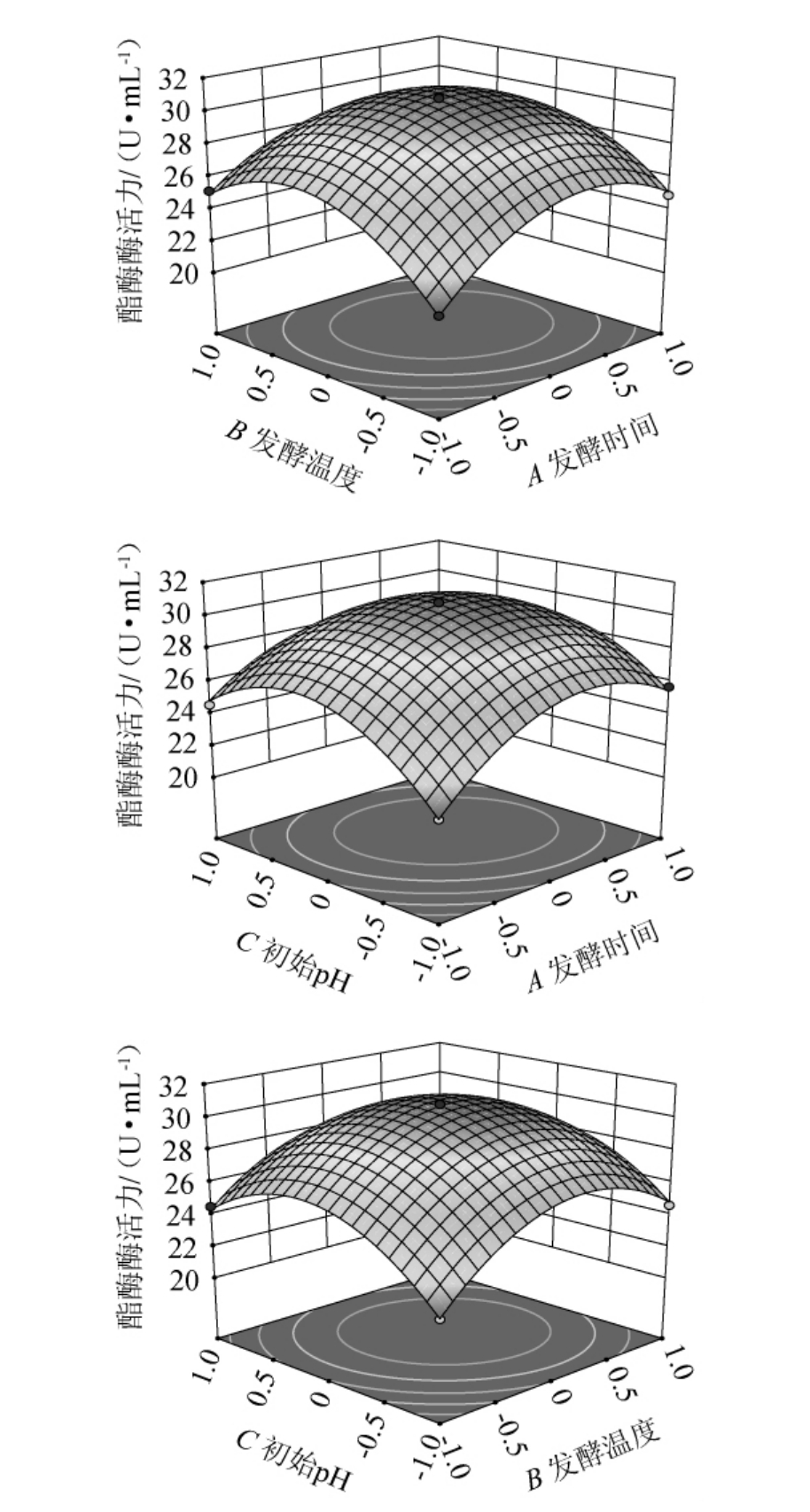
图7 各因素间交互作用对酯酶酶活力影响的响应面及等高线
Fig.7 Response surface plots and contour lines of effect of interaction between various factors on esterase activities
经Design-Expert 13.0软件分析,突变菌株ARUV3-26最优发酵条件为发酵时间3.133 d,发酵温度30.133 ℃,初始pH值为7.133。在此条件下,酯酶活力预测值为30.830 U/mL。再根据实际操作条件,调整最优发酵条件为:发酵时间3.0 d、发酵温度30 ℃、初始pH值为7.0。在此优化条件下,进行3次平行验证试验,酯酶活力实际值为(30.67±0.17)U/mL,与预测值十分接近。上述试验结果表明该方程拟合性好,模型准确。
3 结论
本研究采用实验室前期筛选出的菌株格氏乳球菌S5-4,进行三轮ARTP-紫外复合诱变。筛选出一株高产酯酶的突变株ARUV3-26,酶活力为(25.88±0.02)U/mL比初始酶活提高了64.42%。经15代传代测试后,突变株酶活稳定在(23.51±0.02)~(23.56±0.02)U/mL,与初始菌株相比提高49.36%~49.68%。突变株ARUV3-26与原始菌株L.garvieae S5-4相比,突变株ARUV3-26的温度耐受性、pH耐受性、葡萄糖耐受性、乙醇耐受性、丁酸和己酸耐受性均有一定的提升。单因素试验优化液体发酵培养基条件,确定的最优发酵培养基为:葡萄糖20 g/L,蛋白胨15 g/L,NaCl 5 g/L。通过单因素试验和响应面优化突变株ARUV3-26的发酵条件,所得到最佳的发酵条件为:发酵时间3.0 d、发酵温度30 ℃、初始pH值为7.0。此时突变株ARUV3-26产酯酶酶活力为(30.67±0.17)U/mL,比原始菌株S5-4的产酯酶能力提高了30.45%。本研究为产酯酶细菌的选育与培养提供参考。
[1]李晓如,白晶,张剑.微生物酯酶的性质及其应用[J].中国洗涤用品工业,2018(4):59-67.
[2]范文来,徐岩.大曲酶系研究的回顾与展望[J].酿酒,2000,27(3):35-40.
[3] BARZKAR N, SOHAIL M, TAMADONI JAHROMI S, et al.Marine bacterial esterases: Emerging biocatalysts for industrial applications[J].Appl Biochem Biot,2021,193(4):1187-1214.
[4]BORNSCHEUER U T.Microbial carboxyl esterases:classification,properties and application in biocatalysis[J].FEMS Microbiol Rev,2002,26(1):73-81.
[5]张瑞瑞,徐子一,孙厚权,等.新型酯酶在传统白酒酿造行业中的应用[J].酿酒,2018,45(6):13-16.
[6]侯小歌,张杰,孙忠科,等.大曲产酯酶芽孢菌的分离鉴定及其发酵条件优化研究[J].轻工学报,2018,33(4):13-20.
[7]杜春迎.浓香型大曲中高产酯酶菌株的筛选及产酶条件优化[D].哈尔滨:黑龙江大学,2012.
[8]王晓丹,李付丽,胥思霞,等.一株产酯酶菌株的分离鉴定及产酶[J].酿酒,2014,41(5):42-47.
[9]朱莉莉,黄治国,卫春会,等.酒曲中产香霉菌的筛选及其培养条件优化[J].食品研究与开发,2019,40(10):193-197.
[10]沈怡方.白酒中四大乙酯在酿造发酵中形成的探讨[J].酿酒科技,2003(5):28-31.
[11]李大和,刘念,李国红.浓香型大曲酒酿造中酯化菌研究的现状与展望[J].酿酒科技,2008(2):92-98.
[12]覃拥灵,何海燕,张云开,等.酯酶高产菌株的诱变选育与发酵条件优化研究[J].中国酿造,2007,26(7):45-48.
[13]WANG Z,WANG Y,ZHU T T,et al.Characterization of the key odorants and their content variation in Niulanshan Baijiu with different storage years using flavor sensory omics analysis[J].Food Chem, 2021, 376:131851.
[14]ZHANG W X,WU Z Y,ZHANG Q S,et al.Combination of newly developed high quality Fuqu with traditional Daqu for Luzhou-flavor liquor brewing[J].World J Microbiol Biot,2009,25(10):1721-1726.
[15]郑福平,马雅杰,侯敏,等.世界6大蒸馏酒香气成分研究概况与前景展望[J].食品科学技术学报,2017,35(2):1-12.
[16]LIU C C,FENG S B,WU Q,et al.Raw material regulates flavor formation via driving microbiota in Chinese liquor fermentation[J].Front Microbiol,2019,10:1520.
[17]ZHENG X W,HAN B Z. Baijiu,Chinese liquor: History,classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[18]赵志军,位宁,刘延波,等.窖泥中酯化型细菌的筛选及产酶条件优化[J].中国酿造,2019,38(9):74-79.
[19]陈晓春,赵晓本.根霉酯酶用于双轮底强化发酵工艺技术研究[J].酿酒,2002,29(2):74-76.
[20]张中义,畅晓霞,雷安亮,等.全自动顶空进样法与回流-滴定法分析酿酒醪液中香气物质[J].中国酿造,2009,28(1):146-150.
[21]刘玉平,黄明泉,郑福平,等.中国白酒中挥发性成分研究进展[J].食品科学,2010,31(21):437-441.
[22]成林,成坚,王琴,等.酒曲微生物菌群对酿造酒产品风味影响的研究进展[J].中国酿造,2020,39(10):1-4.
[23]范光森,吴秋华,刘朋肖,等.脂肪酶在白酒酯类化合物合成中的作用研究进展[J].中国食品学报,2021,21(1):351-360.
[24]谢恩举,徐世江,周士升.红曲酯酶制剂在浓香型粮食酒生产中的应用[J].中国酿造,2000,29(1):27.
[25]戴剑漉,张晓婷,卢智黎,等.新型常压室温等离子体-紫外复合诱变选育埃莎霉素Ⅰ高产菌株[J].中国抗生素杂志,2018,43(2):182-188.
[26]张雪,吴叶,陈雪雪,等.常压室温等离子诱变筛选高产酯酶的菠萝蜜果酒酿酒酵母[J].食品与发酵工业,2022,48(22):110-118.
[27]LIVNEH Z,COHEN-FIX O,SKALITER R,et al.Replication of damaged DNA and the molecular mechanism of ultraviolet light mutagenesis[J].Crit Rev Biochem Mol,1993,28(6):465-513.
[28]MILLER J H.Perspective on mutagenesis and repair:the standard model and alternate modes of mutagenesis[J].Crit Rev Biochem Mol,2005,40(3):155-179.
[29]李豪,白光剑,吴静,等.紫外-常压室温等离子体复合诱变高产纤维素酶真菌[J].食品与发酵工业,2019,45(15):81-86.
[30]颜丽.高活力酯化菌株的筛选与优化研究[D].济南:齐鲁工业大学,2020.
[31]赵志军,张艳珠,刘延波,等.高产酯酶细菌的复合诱变选育及固态发酵条件优化[J].食品与发酵工业,2021,47(2):174-181.
[32]刘延波,唐艳彦,赵志军,等.张弓老酒大曲中高产酯酶细菌的分离筛选及产酶条件优化[J].甘肃农业大学学报,2021,56(2):150-159.
[33]张萍,丁亚莲,牛春.尼莫克汀高产菌株诱变选育研究[J].国外医药(抗生素分册),2022,43(5):356-61.
[34]潘俊潼,寇凤雨,刘瑞艳,等.常压室温等离子体-紫外复合诱变选育β-法尼烯高产菌株[J].微生物学通报,2020,47(2):542-551.
[35]黄丹,张强,严芳,等.浓香型大曲中酯酶细菌的分离鉴定及产酶条件研究[J].中国酿造,2009,28(8):57-59.
[36]GUO T,TANG Y,XI Y L,et al.Clostridium beijerinckii mutant obtained by atmospheric pressure glow discharge producing high proportions of butanol and solvent yields[J].Biotechnol Lett,2011,33(12):2379-2383.
[37] JIANG Y, SHANG Y P, LI H, et al.Enhancing transglutaminase production of Streptomyces mobaraensis by iterative mutagenesis breeding with atmospheric and room-temperature plasma(ARTP)[J].Bioresourc Bioprocg,2017,4(1):37.