苯乳酸(phenyllactic acid,PLA),即2-羟基-3-苯基丙酸[1],是蜂蜜中的天然抑菌物质,具有抑菌谱广、热稳定性强及对动物和人体细胞安全无毒等特点[2-5]。苯乳酸的制备方法分为化学合成法[6]和微生物发酵法,其中苯乳酸的化学合成操作步骤耗时,所需试剂对环境不友好,不利于工业应用[7-8],而微生物合成法更具生产性和高效性[9]。研究表明,白地霉(Geotrichum candidum)[10]、丙酸菌(Propionibacterium acnes)[11]和乳酸菌[12]等均被报道能够合成苯乳酸,但乳酸菌由于公认的安全性和益生性等优点,对乳酸菌产苯乳酸研究更加深入和广泛。但苯乳酸产量都不高,无法实现工业化生产。因此,筛选高产苯乳酸的益生菌,提高苯乳酸的合成量尤为重要。王立梅等[13]研究表明,在乳酸菌发酵过程中添加葡萄糖和苯丙酮酸,苯乳酸产量可达到2.12 g/L。李芬等[14]优化乳酸菌的发酵条件使苯乳酸的合成量由712 mg/L增加至2 930 mg/L。同时LAVERMICOCCA P等[15]研究发现,苯乳酸是苯丙氨酸的内源代谢产物,可由乳酸菌代谢产生。同时研究还发现,代谢的第一步就是通过非特异性氨基转移酶的转氨反应,然后将α-氨基转移到合适的受体,进而得到苯丙酮酸和氨基酸,最后脱氢酶催化还原苯丙酮酸为苯乳酸,由此得出,促进苯乳酸的合成可以通过添加苯丙氨酸来实现。
豆粕是豆类加工后的副产品,含有丰富的蛋白质和营养物质,但同时也含有一些抗营养因子。通过发酵,可以显著降低或钝化这些抗营养因子,将大分子蛋白质分解为小肽或氨基酸,提高豆粕中的蛋白质含量。此外,发酵还可以提高豆粕中的酸溶蛋白和总酸含量,降低饲料成本[16]。然而,在发酵过程中,豆粕可能会受到一些不良微生物的污染,如大肠杆菌(Escherichia coli)和霉菌,它们可能会消耗豆粕的营养物质,从而降低发酵品质。苯乳酸作为饲料添加剂应用于发酵饲料,改善豆粕营养水平的同时提高豆粕防腐效果[17],将成为当下研究的新思路。
本研究通过溶钙圈法和牛津杯法从泡菜中分离纯化具有抑菌作用的乳酸菌,采用高效液相色谱(high performance liquid chromatography,HPLC)法检测菌株发酵液中苯乳酸含量,筛选出高产苯乳酸的菌株,对筛选菌株进行菌落及细胞形态学观察、生理生化特性试验和16S rDNA鉴定,并利用筛选菌株对豆粕进行固态发酵,研究底物添加方式、底物添加量、发酵组合方式优化对发酵豆粕中苯乳酸含量的影响,以期提高发酵豆粕中苯乳酸含量,为高产苯乳酸菌株应用到实际生产中提供重要参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料及菌株
泡菜、去皮豆粕(无结块,黄色,无异味,无霉变,粉碎后过0.45 mm孔径筛)、糖蜜(粘稠,黑褐色,呈半流动,糖蜜的甜味):市售;金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli):山东宝来利来生物工程有限公司生物工程研究院菌种资源保藏中心保藏。
1.1.2 试剂
细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、碱性蛋白酶(酶活5 000 U/g):山东隆科特酶制剂有限公司;苯丙酮酸标准品(纯度≥99.5%)、苯丙氨酸标准品(纯度≥99%)、DL-苯乳酸标准品(纯度≥98.0%):美国Sigma公司;琼脂(生化试剂)、葡萄糖(分析纯):山东祥瑞药业有限公司;酵母膏、牛肉膏(均为生化试剂):天津市英博生化试剂有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;柠檬酸铵(分析纯):上海抚生实业有限公司;硫酸镁、硫酸锰(均为分析纯):济南汇丰达化工有限公司;吐温-80(生化试剂):天津凯通化学试剂有限公司;乙酸钠(分析纯):青岛捷世康生物科技有限公司;三氟乙酸、甲醇(均为色谱纯):天津市永大化学试剂有限公司。
1.1.3 培养基
营养肉汤、营养琼脂培养基:青岛海博生物技术有限公司。
MRS液体培养基:蛋白胨1.0%、柠檬酸铵0.2%、牛肉膏1.0%、硫酸镁0.05%、磷酸氢二钾0.5%、酵母膏0.5%、乙酸钠0.5%、硫酸锰0.02%、葡萄糖2.0%、吐温-80 0.1%,pH 6.0,121 ℃灭菌20 min。MRS固体培养基:MRS液体培养基中加1.5%琼脂粉。
富集培养基:MRS培养基中加入2.0 mg/mL的DL-3苯乳酸标准品。
初筛下层培养基:MRS琼脂培养基中加入5.0 g/L的苯丙酮酸。
初筛上层培养基:MRS琼脂培养基中加入30 g/L的碳酸钙(单独灭菌)。
发酵培养基:改良MRS液体培养基中加入5.0 g/L的苯丙酮酸。
1.2 仪器与设备
DHP-9082数显恒温培养箱:上海一恒科学仪器有限公司;DHG-9140ASD120D超声波清洗机:宁波新芝生物科技股份有限公司;LD5-2A低速离心机:北京京立离心机有限公司;SW-CJ-2F(2)超净工作台:苏州安泰空气技术有限公司;LC-20A HPLC仪:日本岛津公司。
1.3 方法
1.3.1 产苯乳酸菌株的初筛
取少许不同来源的泡菜10 g,使用研钵捣碎后放入含有100 mL蒸馏水的灭菌三角瓶中,置于振荡器上,振荡30 min。取1 mL泡菜处理液接种于苯乳酸含量为2.0 mg/mL的富集培养基中,37 ℃富集培养24 h。采用常规平板梯度稀释法进行初筛,取0.1 mL稀释富集菌液接入10 mL初筛下层培养基中,在37 ℃条件下静置培养24 h,再次注入初筛上层培养基继续培养24 h,筛选出溶钙圈较大单菌落镜检。将革兰氏阳性单菌落划线纯化培养并重复3次,挑选单菌落转接至斜面MRS培养基中,在37 ℃条件下培养24 h,然后放入4 ℃冰箱待用。
采用牛津杯法筛选,将金黄色葡萄球菌与大肠杆菌接种于40 mL营养肉汤培养基的三角瓶中,37 ℃、200 r/min振荡培养24 h,活化完成后采用无菌操作分别将金黄色葡萄球菌和大肠杆菌稀释一定的倍数,取0.1 mL菌液在营养琼脂培养基进行均匀涂布,放入牛津杯,每个杯中分别注入培养好的初筛菌发酵液0.26 mL,37 ℃静置培养24 h,筛选有抑菌圈的菌落,设置营养肉汤培养基为阴性对照。
1.3.2 高产苯乳酸菌株复筛
将初筛菌株接种至MRS固体斜面培养基,37 ℃静置培养48 h,在无菌条件下用接种环将培养好的斜面接种至含3 g/L苯丙酮酸的MRS液体培养基中,对照组不添加苯丙酮酸,37 ℃静置培养24h,取5.0mL发酵液离心(10 000 r/min、5 min),用0.22 μm滤膜将上清液经过两次过滤后即为待测样品,使用高效液相色谱(HPLC)法检测发酵液中苯乳酸含量。
1.3.3 高效液相色谱分析
标准溶液制备:精确称取0.205 8 g DL-3苯乳酸标准品并用超纯水溶解定容到100 mL,获得质量浓度为2.048 g/L的苯乳酸标准溶液,经过稀释获得0.128 g/L、0.256 g/L、0.512 g/L、1.024 g/L、2.048 g/L的系列标准工作液。
HPLC色谱条件:采用InertSustain AQ-C18色谱柱(5 μm,4.6×250 mm),柱温30 ℃,进样量20 μL,流速1.0 mL/min,检测波长为210 nm。流动相A:0.05%三氟乙酸水溶液,流动相B:0.05%三氟乙酸甲醇溶液,0~15 min从40%B增加至80%B,15~16 min维持在80%B,为16~18 min从80%B下降至40%B。
定性、定量分析:采用保留时间定性;将上述各浓度梯度的标准溶液分别进样分析后,以标准溶液质量浓度(X)为横坐标、峰面积(Y)为纵坐标建立苯乳酸标准工作曲线,得到标准曲线回归方程Y=2.151e-8X-0.109 2(相关系数R2=0.995 5),再根据样品的峰面积自动计算出样品中苯乳酸的含量。
1.3.4 固态发酵豆粕产苯乳酸菌株的筛选
精确称量200 g的国产去皮豆粕,加入0.15%苯丙酮酸,以料水比1∶0.45(g∶mL)加水,装料量200 g/袋并压实。菌株组为将经过培养的筛选菌株种子液分别以2%的接种量接种。空白组为不接种任何菌株,对照组为接种菌株但不添加任何底物。每组设3个平行,均置于37 ℃培养箱进行厌氧固态发酵,发酵72 h取样测定发酵样品中苯乳酸含量。
1.3.5 菌株的鉴定
(1)形态学观察
选择产苯乳酸效果较好的菌株的纯培养物接种于MRS琼脂培养基平皿中,30 ℃培养48 h,观察菌落形态。采用显微镜观察细胞形态。
(2)生理生化特性试验
参照《常见细菌真菌鉴定手册》和《伯杰细菌鉴定手册》[18]的鉴定标准,使用生化鉴定管对分离的菌株进行生理生化特征分析。
(3)分子生物学鉴定
采用试剂盒提取菌体DNA,并对其进行16S rDNA序列扩增。所用引物为通用引物:1492r(5'-GGTTACCTTGTTACGACTT-3'),27f(5'-AGAGTTGATCCTGGCTCAG-3')。PCR扩增体系(50 μL)为:Mixture 25 μL(含Taq DNA聚合酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)、MgCl2、反应缓冲液),上下游引物各1 μL,模板DNA 2 μL,超纯水21 μL。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸2 min,25个循环;72 ℃再延伸10 min。PCR产物送北京博尚生物技术有限公司进行序列测定。测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性搜索,与NCBI16SrDNA数据库中的数据进行比对,得到与待测物种序列相似性最大的同源序列。采用Mega 6.0中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.6 苯乳酸产生菌固态发酵豆粕对苯乳酸含量的影响(1)苯丙酮酸添加方式的选择
精确称量200 g的国产去皮豆粕,以料水比为1∶0.45(g∶mL)加水,装料量为200 g/袋并压实。将经过培养的高产苯乳酸菌株种子液37 ℃静置培养24 h,以2%(V/V)的接种量进行接种。空白组为不接种菌株;对照组为种子液和固态发酵时均不添加苯丙酮酸;试验组1为种子液中不添加苯丙酮酸,固态发酵时添加0.15%苯丙酮酸;试验组2为种子液中添加3 g/L苯丙酮酸,固态发酵时不添加苯丙酮酸。每组设3个平行,均置于37 ℃培养箱进厌氧固态发酵,发酵72 h取样测定发酵物料中苯乳酸含量。
(2)苯丙酮酸添加量的选择
精确称量200 g的国产去皮豆粕,在豆粕中分别加入苯丙酮酸,加入量为0.05%、0.10%、0.15%、0.20%,以料水比为1∶0.45(g∶mL)加水,装料量200 g/袋并压实。将经过培养的R69种子液以2%的接种量进行接种。空白组为不接种任何菌株的原料,对照组为接种菌株但不添加苯丙酮酸。每组设3个平行,均置于37 ℃培养箱进行厌氧固态发酵,发酵72 h取样测定发酵料中苯乳酸含量。
(3)不同基质发酵豆粕对苯乳酸含量的影响
精确称量200 g的国产去皮豆粕,以料水比为1∶0.45(g∶mL)加水,装料量200 g/袋,压实。将经过培养的筛选菌株种子液以2%的接种量对试验1组、2组、3组和4组进行接种,其中试验1组不添加其他物质,试验2组按豆粕的0.15%加入苯丙酮酸,试验3组按豆粕的1.0%和3.0%分别加入中性蛋白酶和糖蜜,试验4组按豆粕的0.15%、1.0%和3.0%分别加入苯丙酮酸、中性蛋白酶和糖蜜。空白组不接种菌株,每组设3个平行,均置于37 ℃培养箱进行厌氧固态发酵72 h,测定发酵料苯乳酸含量。
1.3.7 微生物指标的测定
分别按照国标GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》及GB 4789.3—2016《食品安全国家标准食品微生物学检验大肠菌群计数》检测霉菌和大肠杆菌。
1.3.8 数据分析
试验数据采用Excel 2010进行初步处理后,采用SPSS 22.0软件进行单因素方差分析(analysisofvariance,ANOVA),结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 高产苯乳酸菌株的分离与筛选
2.1.1 泡菜样品中产苯乳酸菌株的分离筛选
经过初筛及复筛,得到48株具有明显溶钙圈的菌株,大肠杆菌和金黄色葡萄球菌均有抑菌作用的乳酸菌8株,分别为菌株R15、R21、R69、R92、R111、R112、R126和R410,其中菌株R69的碳酸钙溶解圈及其对大肠杆菌及金黄色葡萄球菌的抑菌圈见图1。
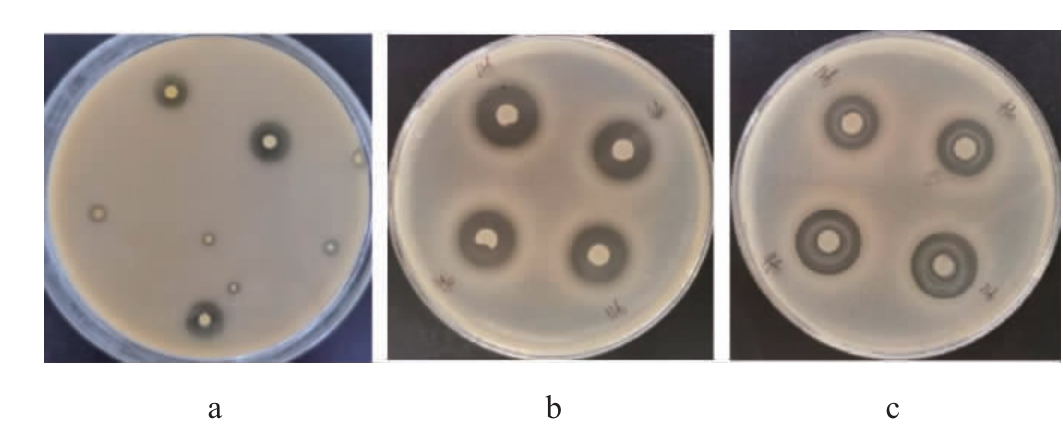
图1 菌株R69的碳酸钙溶解圈(a)及对大肠杆菌(b)和金黄色葡萄球菌(c)的抑菌圈
Fig.1 Calcium carbonate dissolution ring(a)of strain R69,and inhibition zone on Escherichia coli(b)and Staphylococcus aureus(c)
采用HPLC法对8株具有抑菌作用的乳酸菌培养24 h的发酵液中的苯乳酸含量进行检测,结果见表1。
表1 8株乳酸菌培养24 h后发酵液中的苯乳酸含量
Table 1 Phenyllactic acid contents in fermentation broth of 8 strains of lactic acid bacteria cultured for 24 h

注:同列肩不同小写字母表示差异显著(P<0.05)。下同。
产苯乳酸菌株R15 R21 R69 R92 R111 R112 R126 R410苯乳酸产量/(mg·mL-1)对照组 苯丙酮酸组0.167±0.007cd 0.203±0.009ab 0.201±0.006abc 0.153±0.010d 0.156±0.016d 0.210±0.011ab 0.179±0.006bcd 0.229±0.007a 0.565±0.032b 0.943±0.096ab 1.248±0.146a 0.710±0.054b 0.826±0.031b 0.651±0.046b 0.837±0.039b 1.111±0.113a
由表1可知,初筛获得的8株乳酸菌都可以产生苯乳酸,但产量较低;添加苯丙酮酸时苯乳酸产量提高,菌株R21、R69和R410培养24 h时发酵液中苯乳酸含量分别为0.943 mg/mL、1.248 mg/mL、1.111 mg/mL,高于其他菌株。MAGNUSSON J等[19]从酸面团中分离到植物乳杆菌(Lactobacillus plantarum)21B,其苯乳酸产量为56 mg/L。齐世华等[20]研究表明,植物乳杆菌Lp45在与酸乳发酵剂一起发酵酸乳时,能够展现出良好的生物保鲜效果。微生物发酵法已经成为目前制备苯乳酸的一种有效方法,但不同菌株的产苯乳酸能力不同。另外,利用微生物转化前体合成苯乳酸,通过添加外源的前体物质,也可以增加苯乳酸的产量。因此,选择优良的菌株和合适的前体物质成为研究的重要方向。张莉力等[21]从24株益生菌中筛选到7株苯乳酸产量>60 mg/L的菌株,其中一株乳酸菌P421的苯乳酸产量甚至可达80.5 mg/L。李明华等[22]研究了L.plantarum静息细胞合成苯乳酸,通过添加苯丙酮酸对苯乳酸的生物合成途径进行了优化,苯乳酸产量达到1.68 g/L。因此,选取菌株R21、R69和R410这3株菌进行后续分析。
2.1.2 固态发酵豆粕产苯乳酸含量检测
不同菌株对固态发酵豆粕产苯乳酸的影响见表2。
表2 不同菌株对固态发酵豆粕产苯乳酸的影响
Table 2 Effects of solid-state fermentation of soybean meal by different strains on phenyllactic acid production
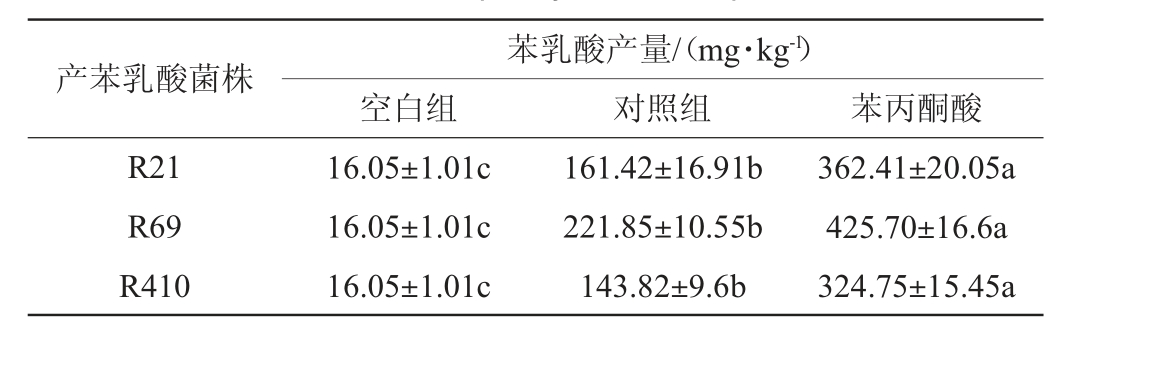
产苯乳酸菌株R21 R69 R410苯乳酸产量/(mg·kg-1)空白组 对照组 苯丙酮酸16.05±1.01c 16.05±1.01c 16.05±1.01c 161.42±16.91b 221.85±10.55b 143.82±9.6b 362.41±20.05a 425.70±16.6a 324.75±15.45a
由表2可知,在豆粕中添加苯丙酮酸时,菌株R69固态发酵豆粕72 h苯乳酸含量最高,为425.70 mg/kg。STROOM K等[23]从草青贮饲料中分离出一株抗真菌的L.plantarum Mi LAB393,苯乳酸的合成能力为94 mg/L。在本研究中,被试菌株均能提高苯乳酸产量,其中菌株R69发酵豆粕产苯乳酸含量最高,因此,选择菌株R69进行后续试验。
2.2 菌株R69的鉴定
2.2.1 形态学观察
菌株R69的形态学特征见图2。由图2可知,菌株R69在30 ℃培养48 h后,培养基上的菌落形态光滑、凸起、湿润、白色、易挑。显微镜下细胞形态呈杆状,单个、成对或短链排列,从菌落形态和菌体形态初步判断为乳杆菌属(Lactobacillus)。
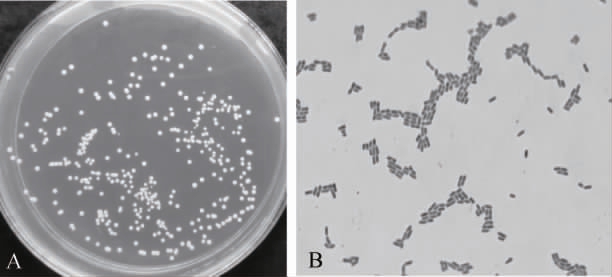
图2 菌株R69的菌落(A)及细胞(B)形态
Fig.2 Colony (A) and cell (B) morphology of strain R69
2.2.2 生理生化特性试验
菌株R69的生理生化试验结果见表3。由表3可知,菌株R69明胶液化试验、过氧化氢反应、淀粉水解、产生吲哚试验等试验结果均呈现阴性,不能利用木糖,其他结果均呈阳性,根据结果可初步判断为乳杆菌属。
表3 菌株R69的生理生化试验结果
Table 3 Physiological and biochemical test results of strain R69
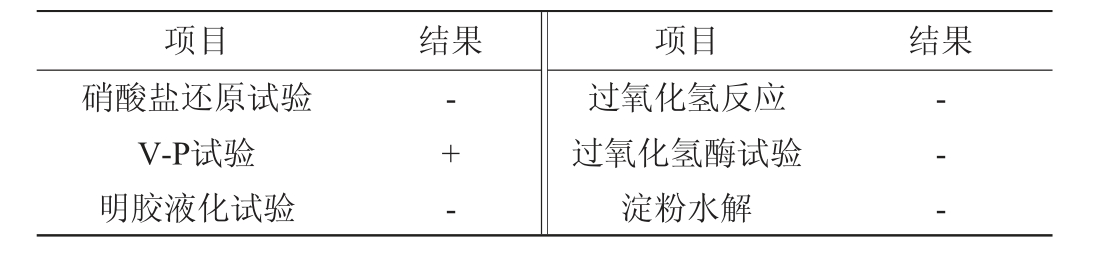
项目 结果 项目 结果硝酸盐还原试验V-P试验明胶液化试验-+ -过氧化氢反应过氧化氢酶试验淀粉水解-- -
续表

注:“-”表示结果呈阴性;“+”表示结果呈阳性。
项目 结果 项目 结果葡萄糖产酸乳糖木糖产生吲哚试验七叶苷纤维二糖麦芽糖++ - - + + +甘露醇水杨苷山梨醇蔗糖菊糖半乳糖果糖+++++++
2.2.3 分子生物学鉴定
将测序序列提交至NCBI的GenBank数据库进行BLAST比对,采用MEGA6.0对同源性较高的序列进行分析,采用NJ法构建系统发育树,结果见图3。由图3可知,菌株R69与植物乳杆菌(Lactobacillus plantarum)AJ965482.1聚于同一支,最大序列相似度为99%,因此,菌株R69被鉴定为植物乳杆菌(Lactobacillus plantarum)。
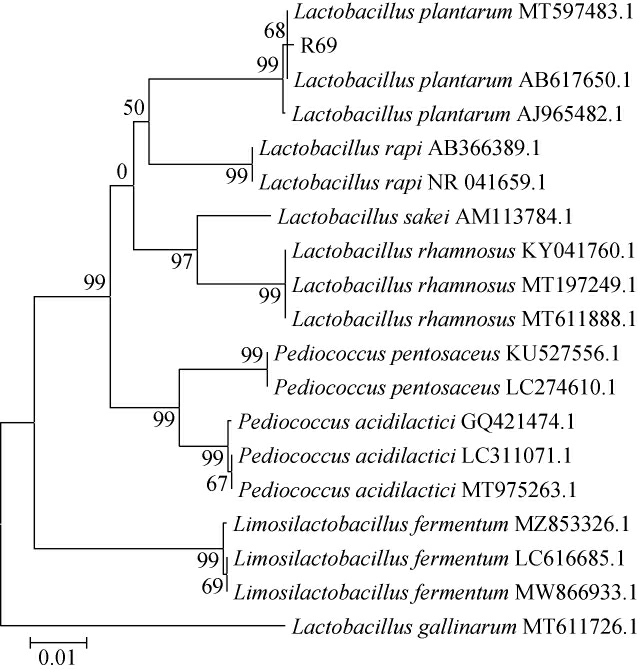
图3 基于16S rDNA基因序列菌株R69的系统发育树
Fig.3 Phylogenetic tree of strain R69 based on 16S rDNA gene sequence
2.3 苯乳酸产生菌R69固态发酵豆粕对苯乳酸含量的影响
2.3.1 苯丙酮酸添加方式的选择
苯丙酮酸添加方式对菌株R69固态发酵豆粕产苯乳酸的影响见表4。
表4 苯丙酮酸添加方式对发酵豆粕产苯乳酸的影响
Table 4 Effect of pyruvate addition mothod on phenyllactic acid content in fermented soybean meal

组别 空白组 对照组 试验组1 试验组2苯乳酸产量/(mg·kg-1) 16.05±1.01d 221.85±10.55c 425.70±16.6a 294.42±26.85b
由表4可知,苯乳酸产量试验1组(固态发酵时添加苯丙酮酸)>试验2组(发酵液中添加苯丙酮酸)>对照组(未添加苯丙酮酸),且差异显著(P<0.05)。WU W Y等[24]对植物乳杆菌的发酵条件和生长营养物质进行了优化,结果表明,优化后的样品产苯乳酸的能力是优化前的7.61~13.26倍。本研究中,菌株R69在发酵豆粕中添加苯丙酮酸比在发酵液中添加苯丙酮酸提高了44.60%,说明固态发酵时直接添加苯丙酮酸产苯乳酸能力优于发酵液中添加苯丙酮酸(P<0.05)。因此,选择在固态发酵中直接添加苯丙酮酸进行后续试验。
2.3.2 苯丙酮酸添加量的选择
苯丙酮酸添加量对菌株固态发酵豆粕产苯乳酸含量的影响见表5。
表5 苯丙酮酸添加量对发酵豆粕产苯乳酸的影响
Table 5 Effect of phenylpyruvate addition on phenyllactic acid content in fermented soybean meal
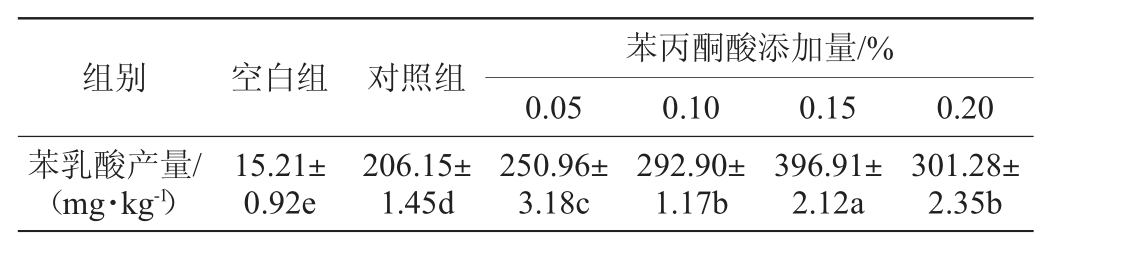
组别 空白组 对照组苯乳酸产量/(mg·kg-1)苯丙酮酸添加量/%0.05 0.10 0.15 0.20 15.21±0.92e 206.15±1.45d 250.96±3.18c 292.90±1.17b 396.91±2.12a 301.28±2.35b
由表5可知,与不添加苯丙酮酸的对照相比,添加0.05%、0.10%和0.15%的苯丙酮酸时,苯乳酸含量显著增加(P<0.05),分别是不添加苯丙酮酸的对照的1.11倍、1.42倍和1.92倍;添加0.20%苯丙酮酸时,苯乳酸产量下降,苯乳酸合成量不再随苯丙酮酸的增加而增加。其原因是苯乳酸含量提高是由于酶促反应的结果,使苯丙酮酸在转氨酶和羟基酸脱氢酶的作用下进一步生成苯乳酸[25],提高幅度下降可能是由于脱氢酶数量有限,苯丙酮酸的脱氢反应受到限制,转化率下降。结果表明,固态发酵豆粕时,底物苯丙酮酸添加量为0.15%,发酵72 h苯乳酸含量达到396.91 mg/kg。因此,选择苯丙酮酸最适添加量为0.15%进行后续试验。
2.3.3 不同基质发酵豆粕对苯乳酸产量的影响
不同基质发酵豆粕对苯乳酸含量的影响见表6。
表6 不同基质对发酵豆粕产苯乳酸的影响
Table 6 Effects of different substrates on the production of phenyllactic acid from fermented soybean meal
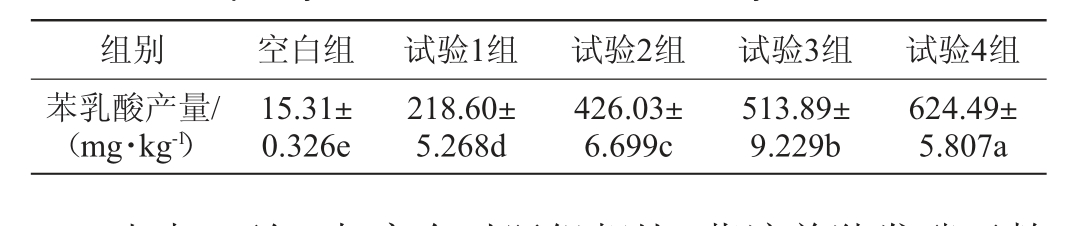
组别 空白组 试验1组 试验2组 试验3组 试验4组苯乳酸产量/(mg·kg-1)15.31±0.326e 218.60±5.268d 426.03±6.699c 513.89±9.229b 624.49±5.807a
由表6可知,与空白对照组相比,菌液单独发酵豆粕(试验1组)可以显著提高苯乳酸含量(P<0.05),高达218.60 mg/kg,是空白对照组的14.28倍;以苯丙酮酸为底物时(试验2组)苯乳酸含量高达426.03 mg/kg,是试验1组的1.95倍,差异显著(P<0.05);与试验1组相比,添加中性蛋白酶和糖蜜(试验3组)苯乳酸含量显著提高(P<0.05),高达513.89 mg/kg,是试验1组苯乳酸含量的2.35倍;试验4组额外添加苯丙酮酸、中性蛋白酶和糖蜜时苯乳酸产量最高,高达624.49 mg/kg。分析原因可能与发酵豆粕中额外添加的碳源参与了苯乳酸合成反应有关。乳酸菌属于化能异养型微生物,其营养要求复杂,碳源为菌体提供组成细胞物质或代谢产物中的营养物质,李兴峰等[26]在研究碳源对乳酸菌合成苯乳酸的影响时研究表明,添加葡萄糖可提高苯乳酸的产量,这与本试验结果一致。
3 结论
通过溶钙圈法和牛津杯法从泡菜中分离到一株高产苯乳酸的植物乳杆菌(Lactiplantibacillus plantarum)R69,液体发酵24 h时,其苯乳酸产量为1.248 mg/mL,添加苯丙酮酸时,固态发酵豆粕72 h,苯乳酸产量可达425.70 mg/kg,菌株R69固态发酵豆粕时,添加0.2%蛋白酶、3%糖蜜和0.15%苯丙酮酸可提高苯乳酸含量,苯乳酸的含量达到624.49 mg/kg。
[1] ARMAFBRTE E, CARRI S, FERRI G, et al.High-performance liquid chromatography determination of phenyllactic acid in MRS bmth[J].J Chromatogr A,2006,113(1):281-284.
[2]LEN K L,MOLALL P C,REID G M.A survey of the ail acterial activity of some New Zealand honeys[J].J Pharm Phamacol,1991,43(12):817-822.
[3] YU S, ZHOU C, ZHANG T, et al.Short communication: 3-phenyllactic acid production in milk by Pediococcus pentosaceus sk25 during laboratory fementation process[J].J Dairy Sci,2015,98(2):813-817.
[4] RODRIGUEZ-PAZO N, SALGADO J M, C0RT6S-DI69UEZ S, et al.Biotechnnological production of phenyllactic acid and biosurfactants from trimming Vine shoot hydrolyzates by microbial coculture fermentation[J].Appl Biochem biotechnol,2013(169):2175-2188.
[5] LI L, SHIN S Y, LEE K W, et al.Production of natural antimic robial compound D phenyllactic acid using Leuconostoc mesenteroides ATCC 8293 whole cells involving highly active D-lactate dehydrogenase[J].Lett Appl Micmbiol,2014(59):404-411.
[6]李兴峰.乳杆菌生物合成苯乳酸的研究[D].无锡:江南大学,2008.
[7] VAN DRAANEN N A, HENGST S.The conversion of l-phenylalanine to (S)-2-hydroxy-3-phenylpropanoic acid: a simple, visual example of a stereospecific SN2 reaction[J].J Chem Edu,2010,87(6):623-624.
[8]邓喜玲,陈学敏,周淑芳,等.β-苯基乳酸的合成[J].西北药学杂志,2001,16(1):36-37.
[9]BUBL E C,BUTTS J S.A method of synthesis of phenyl-lactic acid and substituted phenyl lactic acids[J].Chinese Chem Lett,1993(8):19-20.
[10] DIEULEVEUX V, VAN D P D, CHATAUD J, et al.Purification and characterization of anti-Listeria compounds produced by Geotrichum candidum[J].Appl Environ Microbiol,1998,64(2):800.
[11]THIERRY A,MAILLARD M B.Production of cheese flavour compounds derived from amino acid catabolism by Propionibacterium freudenreichii[J].Dairy Sci Technol,2002,82(1):17-32.
[12]LIND H,SJÖGREN J,GOHIL S,et al.Antifungal compounds from cultures of dairy propionibacteria type strains[J].FEMS Microbiol Lett,2010,271(2):310-315.
[13]王立梅,腾宇,陈文飞,等.pH 值及底物对副干酪乳杆菌发酵生产苯乳酸的影响[J].食品科学,2014,35(1):163-166.
[14]李芬,刘晨,梁茜茜,等.植物乳杆菌UN-30 菌株高产苯乳酸的发酵条件优化[J].中国食品添加剂,2016(8):135-141.
[15] LAVERMICOCCA P, VALERIO F, VISCONTI A.Antifungal activity of phenyllactic acid against molds isolated from bakery products[J].Appl Environ Microbiol,2003,69(1):634-640.
[16]侯楠楠,王梅,王倩,等.乳酸菌固态发酵豆粕产酸性能分析[J].中国酿造,2022,41(9):124-129.
[17] DHUNDALE V, HEMKE V, DESAI D, et al.Evaluation and exploration of lactic acid bacteria for preservation and extending the shelf life of fruit[J].Int J Fruit Sci,2018(11):l-14.
[18]R.E.布坎南.伯杰细菌鉴定手册[M].北京:科学出版社,1984:54-76.
[19] MAGNUSSON J,STROM K,ROOS S,et al.Broad and complex antifungal activity among environmental isolates of lactic acid bacteria[J].FEMS Microbiol Lett,2003,219(1):129-135.
[20]齐世华,张栋,范如意,等.抑制霉菌植物乳杆菌的筛选及功能研究[J].食品科技,2020,45(3):1-7.
[21]张莉力,柴虹宇.产苯乳酸乳酸菌的筛选及鉴定[J].安徽农业科学,2010,38(5):2590-2592.
[22]李明华,孟秀梅.植物乳杆菌生物合成苯乳酸条件优化研究[J].中国酿造,2018,37(4):93-97.
[23]STROOM K,SJOGREN J,BROBERG A,et al.Lactobacillus plantarum Mi LAB 393 produces the antifungal cyclic dipeptides Cyclo(L-Phe-L-Pro)and Cyclo (L-Phe-trans-4-OH-L-Pro) and 3 phenyllactic acid[J].Appl Environ Microbiol,2002,68(9):4322-4327.
[24]WU W Y,DENG G,LIU C J,et al.Optimization and multiomic basis of phenyllactic acid overproduction by Lactobacillus plantarum[J].J Agr Food Chem,2020,68(6):1741-1749.
[25]李芬.苯乳酸生产菌株LY-78的乳酸脱氢酶基因克隆表达及酶学性质分析[D].大庆:黑龙江八一农垦大学,2017.
[26]李兴峰,江波,潘倍蕾,等.乳酸菌产生的新型抗菌物质一苯乳酸的抑菌性质及作用机理研究[J].乳业科学与技术,2011,34(2):94-98.