过量饮酒或饮酒不当会引起严重的健康问题,全世界每年有300万人死于过量饮酒,占所有死亡人数的5.3%[1-3]。乙醇进入人体后主要在小肠中吸收[4],随后穿过生物膜并分布到全身,在几乎所有组织中进入柠檬酸循环[5]。大脑、心脏、胃肠道和肝脏等多个器官的200多种疾病都与习惯性饮酒有关[6]。在这些酒精损伤的器官中,肝脏是体内酒精代谢的主要部位,因此更易受到损伤。因乙醇造成的肝组织疾病包括酒精性脂肪肝、酒精性肝炎、酒精性肝硬化和肝癌等[7-8]。
人们对如何解酒的探讨也是长盛不衰,目前,有关解酒的研究主要围绕中草药、果蔬、粮油类、畜产类等原料及其制品进行[9-13],如解酒功能成分分析(主要为多糖、多肽、黄酮、酶等)及解酒酵素、复方制剂、保健凉茶的研制等[12-13]。其解酒原理主要集中在影响乙醇代谢或抑制乙醇吸收方向,如基于乙醇脱氢酶(alcohol dehydrogenase,ADH)和乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)参与的氧化代谢途径,通过加强乙醇的首过效应而达到解酒的目的[14];或者基于保肝护肝的原理,通过代谢增强肝组织中超氧化歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽(glutathione,GSH)的活性,改善肝细胞的通透性等起到解酒护肝的作用[15];或者减少、减慢胃和十二指肠对乙醇的吸收来实现解酒功能等[16]。这些醒酒方式虽具有一定解酒、醒酒功效,但也会伴随着不同的副作用,对人体健康不利。对此,微生物制剂以能够直接降解乙醇特点受到人们的广泛关注,刘威良等[17]筛选得到1株乙醇耐受性强的嗜酸乳杆菌(Lactobacillus acidophilus),其在体积分数为20%的乙醇条件下培养24 h后,乙醇含量降为10%左右;在体积分数为40%的乙醇条件下培养24 h后,乙醇含量降为15%左右。杨小柏[18]从黄水和窖泥中筛选得到1株降解乙醇能力较强的菌株,其降解乙醇速度达1.45mL/d。
为了进一步研究开发具有解酒功能的益生菌,本研究采用传统培养分离法从传统发酵食品奶疙瘩中分离乳酸菌,通过乙醇降解能力的测定筛选具有降解乙醇功能的菌株,并通过形态观察、生理生化试验及分子生物技术对其进行菌种鉴定,同时,对其安全性及耐受性进行研究,并通过小鼠试验研究该菌株对体内防醉和解酒的功效,为其解酒应用提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与动物
传统发酵食品奶疙瘩样品:内蒙古呼伦贝尔额尔古纳市三河回族乡,无菌操作取样寄送至实验室,并于-20 ℃条件保存备用。
60只健康昆明小鼠,年龄6周,体质量25~30 g,雌雄各1/2,购自辽宁长生生物技术有限公司,生产许可SCXK(辽)2020-0001。动物在抵达后用标准饮食喂养一周后进行试验。环境温度维持在25 ℃左右,相对湿度控制在50%左右,光暗12 h循环。
1.1.2 培养基
MRS液体培养基[19]:酵母蛋白胨10 g/L,牛肉粉3 g/L,酵母浸出物4 g/L,磷酸二氢钾2 g/L,一水柠檬酸2 g/L,乙酸钠5 g/L,无水葡萄糖20 g/L,硫酸镁0.58 g/L,硫酸锰0.25 g/L,吐温-80 0.6 g/L,番茄汁10 mL/L,调pH至6.5,115 ℃高压蒸汽灭菌30 min;MRS固体培养基:MRS液体培养基中添加2%琼脂。
改良的MRS固体培养基[19]:酵母蛋白胨10 g/L,牛肉粉3 g/L,酵母浸出物4 g/L,磷酸二氢钾2 g/L,一水柠檬酸2 g/L,乙酸钠5 g/L,无水葡萄糖20 g/L,硫酸镁0.58 g/L,硫酸锰0.25 g/L,吐温-80 0.6 g/L,碳酸钙10 g/L,中性红0.05 g/L,番茄汁10 mL/L,琼脂粉20 g/L,调pH至5.5,115 ℃高压蒸汽灭菌30 min。
基础培养基:酵母蛋白胨10 g/L,酵母浸出物5 g/L,无水葡萄糖20 g/L,一水柠檬酸2 g/L,L-苹果酸3 g/L,乙酸钠5 g/L,磷酸二氢钾2 g/L,硫酸镁0.5 g/L,硫酸锰0.01 g/L,pH 6.60。115 ℃高压蒸汽灭菌30 min。
优化培养基:酵母蛋白胨10 g/L,酵母浸出物30 g/L,无水葡萄糖30 g/L,一水柠檬酸2 g/L,L-苹果酸3 g/L,乙酸钠5 g/L,磷酸二氢钾2 g/L,硫酸镁0.5 g/L,硫酸锰0.01 g/L,吐温80 0.1 g/L,氯化钙0.5 g/L,pH 6.60。115 ℃高压蒸汽灭菌30 min。
1.1.3 试剂
无水葡萄糖、三氯乙酸、苯酚(均为分析纯):天津市大茂化学试剂厂;浓硫酸、无水乙醇(均为分析纯):国药集团化学试剂有限公司;重铬酸钾(纯度99%):西陇科学股份有限公司。牛胆盐(纯度99.8%):西格玛奥德里奇(上海)贸易有限公司;盐酸、氢氧化钠(均为分析纯)、胃蛋白酶(酶活12 000 U/g):北京奥博星生物技术有限公司;磷酸缓冲盐溶液(phosphate buffer saline,PBS):生工生物工程(上海)股份有限公司;梅里埃21342革兰氏阳性细菌鉴定卡VITEK GP及配套试剂:法国生物梅里埃股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
DHP-500BS恒温培养箱:北京市永光明医疗仪器有限公司;LDZX-50KBS灭菌锅:上海申安医疗器械厂;SW-CJ-1D无菌操作台:上海沪净医疗器械有限公司;TGL-16M高速冷冻离心机:湖南湘仪离心机仪器有限公司;EPOCH2NSC-SN酶标仪:美国伯腾仪器有限公司;UPT-II-20T纯水仪:四川优普超纯科技有限公司;C20-F3E电磁炉:格兰仕生活电器制造有限公司;VITEK2 Compact全自动微生物分析系统:法国生物梅里埃股份有限公司。
1.3 方法
1.3.1 传统奶疙瘩样品中乳酸菌菌株的分离纯化
取适量奶疙瘩样品于MRS液体培养基中,37 ℃富集24 h。将富集后的样品混匀,采用无菌水按10倍梯度稀释,取不同梯度的稀释液涂布于改良的MRS固体培养基上,37 ℃条件下培养48 h。挑取菌落呈球状、细胞成对排列、无内生芽孢、革兰氏阳性的单菌落进行多次分离纯化,得到纯化菌株,4 ℃保存备用。
1.3.2 高效降解乙醇功能菌株的筛选
将分离纯化的菌株接种至5 mL MRS液体培养基中,37 ℃培养20 h后,取5 mL菌液接种至100 mL MRS液体培养基中,37 ℃培养17 h,作为种子液。
将分离菌株的种子液按5%的接种量接种于乙醇体积分数为10%的MRS液体培养基中,以乙醇体积分数为10%的MRS液体培养基为空白对照,37 ℃培养24 h。取培养好的菌液10 000 r/min离心10 min,取上清液,利用重铬酸钾-硫酸法测定乙醇含量,并计算乙醇降解率,分析各菌株的乙醇降解能力。乙醇降解率的计算公式如下:
式中:C0为空白对照中乙醇的体积分数,%;C为试验组中乙醇的体积分数,%。
1.3.3 筛选菌株的乙醇耐受性分析
将分离菌株的种子液按2%的接种量接种于不同乙醇体积分数(4%、6%、8%、10%、12%)的MRS液体培养基中,37 ℃进行乙醇胁迫12 h,同时以不含乙醇的MRS液体培养基培养组作为阴性对照,胁迫后采用紫外分光光度计在波长620 nm处测定OD620 nm值,比较其生长状况,并计算存活率,其计算公式如下:
式中:A1为含乙醇的MRS培养基培养12 h后的OD620nm值;A0为不含乙醇的MRS培养基培养12 h后的OD620nm值。
1.3.4 筛选菌株的鉴定
形态学观察:将筛选菌株接种至MRS固体培养基,37 ℃培养48 h,观察菌株形态。挑取单个菌落进行革兰氏染色,在生物显微镜下观察细胞形态。
生理生化鉴定:利用梅里埃21342革兰氏阳性细菌鉴定卡VITEK GP和VITEK2 Compact全自动微生物分析系统对筛选菌株进行生理生化鉴定。
分子生物学鉴定:参照文献[20]对筛选菌株进行分子生物学鉴定。
1.3.5 筛选菌株的安全性评价
药物敏感性试验:参照CLSI M45-A3《不常见或苛养菌药敏方法》(2015)标准执行。
溶血试验:参照文献[21]进行。
1.3.6 筛选菌株的耐酸及耐胆盐试验
耐酸及耐胆盐试验:将筛选菌株的种子液按10%的接种量分别接种于不同pH(2.0、3.0、6.5)及不同胆盐含量(0、0.3%、0.5%、1.0%和1.5%)的MRS液体培养基中,37 ℃静置培养,于培养0 h、1 h、2 h和4 h取样,用灭菌生理盐水按10倍梯度稀释后,取适宜稀释度的菌液1 mL接种于MRS固体培养基,37 ℃静置培养36 h后进行菌落计数[22]。
耐酸及耐胆盐延迟时间测定:将筛选菌株的种子液按10%的接种量分别接种于不同pH(2.0、3.0、6.5)及不同胆盐含量(0、0.3%、0.5%、1.0%和1.5%)的MRS液体培养基中,37 ℃静置培养。其中耐酸延迟时间试验在培养2 h后,按照10%的接种量转接在pH 6.5的MRS液体培养基中继续培养,耐胆盐延迟时间试验不进行转接。每隔30 min取样测定OD620 nm值,直到OD620 nm值增长0.3个单位时,停止测定。计算菌株在酸性/含胆盐培养基中与在pH6.5/胆盐含量0%的培养基中OD620nm值增加0.3个单位所需的时间,二者之差被称为延迟时间[22]。
1.3.7 筛选菌株耐胃液试验
人工模拟胃液的配制[22]:取稀盐酸16.4 mL,加蒸馏水800mL,加入胃蛋白酶10g,摇匀后用蒸馏水定容至1000mL,调节pH值至2.0,0.22 μm有机滤膜过滤除菌。
取菌悬液10 mL离心(5 000×g,10 min,4 ℃)获得菌泥,用PBS冲洗2次,获得的菌泥重悬于10 mL人工模拟胃液中,37 ℃条件下消化3 h,分别于0 h、3 h取样,用灭菌的生理盐水进行10倍梯度稀释,取适宜稀释度的菌液1 mL涂布于MRS固体培养基,37 ℃静置培养36 h后,进行菌落计数。
1.3.8 筛选菌株防醉和醒酒能力体内试验
按照10%的接种量将冻存管中复苏的菌体转接到10mL基础培养基中,37 ℃静置培养17 h,获得菌悬液。将该菌悬液转接到100 mL基础培养基中,37 ℃静置培养17 h。然后将该菌悬液以3%的接种量接种到200 mL优化培养基中,37 ℃静置培养17 h。培养结束后将其稀释为活菌数分别为1×107 CFU/mL、1×108 CFU/mL、1×109 CFU/mL的菌悬液,备用。
参考文献[23],将60只小鼠随机分为10组,解酒试验和防醉试验各5组,每组6只,雌雄各占50%。根据常见市售白酒的酒精度,本试验小鼠在禁食12 h后,各组灌胃10 mL/kg体质量(body mass,bm)体积分数为50%的乙醇以建立醉酒模型。乙醇灌胃30 min前(防醉试验)及5 min后(解酒试验),阴性对照组(NC)灌胃10 mL/kg bm生理盐水,阳性对照组(PC)灌胃10 mL/kg bw美他多辛(约500 mg/kg bm),低(L)、中(M)、高(H)剂量组灌胃10 mL/kg bm菌悬液,活菌数分别为1×107 CFU/mL、1×108 CFU/mL、1×109 CFU/mL。记录5组小鼠翻正反射消失时间和翻正反射恢复时间,翻正反射消失时间的标准为小鼠仰卧保持30 s,否则认为翻正反射恢复。计算醉酒潜伏期(灌酒到翻正反射消失时间)、醒酒时间(翻正反射消失到翻正反射恢复时间)。
1.3.9 数据处理
每个试验重复3次平行测定,试验数据采用SPSS 17.0软件进行单因素方差分析,并利用Duncan's法进行多重比较,结果以“平均值±标准差”表示。
2 结果与分析
2.1 乳酸菌的分离及高效降解乙醇菌株的筛选结果
采用传统培养分离法从奶疙瘩样品中共分离得到12株疑似乳酸菌菌株,其乙醇降解能力见图1。
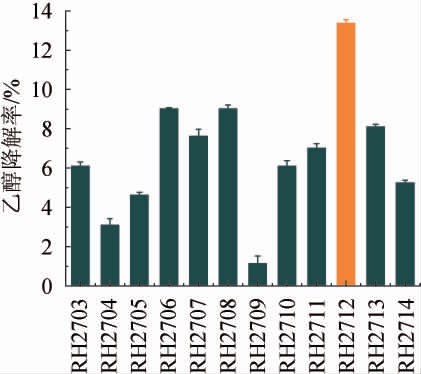
图1 分离菌株的乙醇降解能力
Fig.1 Ethanol degradation abilities of isolated strains
由图1A可知,所有菌株均具有乙醇降解能力,乙醇降解率为1.15%~13.38%,其中,菌株RH2712的乙醇降解率最高为13.38%。因此,将菌株RH2712作为高效降解乙醇的目标菌株。
2.2 菌株RH2712的乙醇耐受性
菌株RH2712的乙醇耐受性试验结果见见图2。由图2可知,随着乙醇体积分数的增加,菌株RH2712存活率逐渐下降,当乙醇体积分数为10%时,菌株RH2712的存活率为45.34%;当乙醇体积分数为12%时,菌株RH2712的存活率仍可达34.20%,说明菌株RH2712具有较好的乙醇耐受性,可耐受体积分数为12%的乙醇。
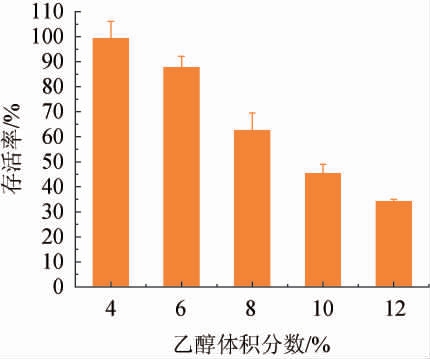
图2 菌株RH2712的乙醇耐受性
Fig.2 Ethanol tolerance of strain RH2712
2.3 菌株RH2712的鉴定
2.3.1 形态观察
菌株RH2712的菌落及细胞形态见图3。由图3可知,菌株RH2712的菌落为白色,圆形,表面湿润,不透明,边缘整齐;细胞呈球状,直径为0.7~1.0 μm,单个或成对排列,革兰氏染色为阳性。
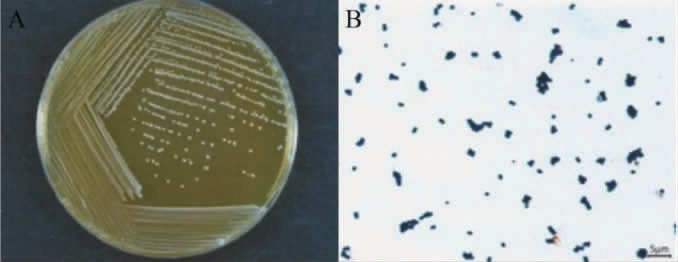
图3 菌株RH2712的菌落(A)及细胞(B)形态
Fig.3 Colony (A) and cell (B) morphology of strain RH2712
2.3.2 生理生化鉴定
菌株RH2712的生理生化鉴定结果见表1。由表1可知,D-苦杏仁甙、β-半乳糖苷酶、水杨素、磷脂酰酯酶C、α-葡糖苷酶、支链淀粉等29项结果呈阴性,亮氨酸芳胺酶、L-脯氨酸芳胺酶、丙氨酸芳胺酶、L-乳酸盐碱化、杆菌肽耐受等14项结果呈阳性。根据VITEK2 Compact全自动微生物分析系统中的GP结果,初步鉴定该菌株为片球菌属(Pediococcus sp.)。
表1 菌株RH2712的生理生化试验结果
Table 1 Results of physiological and biochemical tests of strain RH2712

注:“+”表示结果呈阳性,“-”表示结果呈阴性。
项目 结果 项目 结果D-苦杏仁甙β-半乳糖苷酶水杨素亮氨酸芳胺酶蔗糖D-山梨醇D-核糖D-麦芽糖D-甘露醇D-棉子糖D-海藻糖精氨酸水解酶1环糊精磷酸酶α-半乳糖苷酶磷脂酰酯酶C α-葡糖苷酶支链淀粉L-脯氨酸芳胺酶β-葡萄糖醛酸酶尿素酶L-乳酸盐碱化-- - + - - - - - - - + - - - - - - + - - +杆菌肽耐受D-甘露糖O/129耐受精氨酸双水解酶2酪氨酸芳胺酶D-半乳糖N-乙酰-D-氨基葡萄糖6.5%Nacl生长D-木糖丙氨酸-苯丙氨酸-脯氨酸芳胺酶α-甘露糖苷酶β-葡萄糖醛酸酶丙氨酸芳胺酶多粘菌素B耐药乳糖新生霉素耐受甲基-β-D-吡喃葡萄糖苷β-半乳糖吡喃糖苷酶奥普托欣耐药L-天冬氨酸芳胺酶L-吡咯烷酮芳胺酶++ + + - + - + - - - - + - - + - - + - +
2.3.3 分子生物学鉴定
基于16S rDNA基因序列构建菌株RH2712的系统发育树,结果见图4。由图4可知,菌株RH2712与乳酸片球菌(Pediococcus acidilactici)DSM 20284T在一个分支上,亲缘关系最近。结合形态、生理生化鉴定结果,最终鉴定菌株RH2712为乳酸片球菌(Pediococcus acidilactici)。

图4 基于16S rDNA基因序列菌株RH2712的系统发育树
Fig.4 Phylogenetic tree of strain RH2712 based 16S rDNA gene sequences
2.4 乳酸片球菌RH2712的安全性评价结果
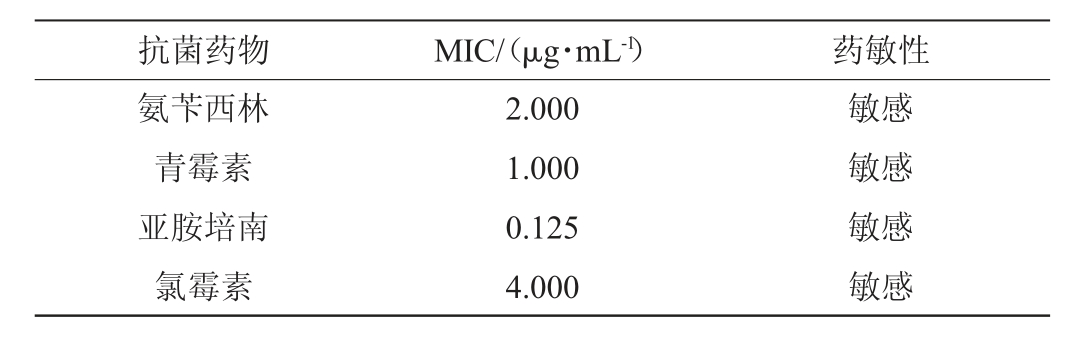
乳酸片球菌RH2712耐药性实验结果见表2,溶血试验结果见图5。
表2 乳酸片球菌RH2712最小抑菌浓度值及药敏性
Table 2 Minimal inhibitory concentration and drug sensitivity of Pediococcus acidilactici RH2712
抗菌药物 MIC/(μg·mL-1) 药敏性氨苄西林青霉素亚胺培南氯霉素2.000 1.000 0.125 4.000敏感敏感敏感敏感

图5 乳酸片球菌RH2712的溶血性实验的结果
Fig.5 Hemolysis test results of Pediococcus acidilactici RH2712
A:阴性对照菌,英诺克李斯特氏菌CICC 10417;B:阳性对照菌,金黄色葡萄球菌CCIC 10473;C:乳酸片球菌RH2712。
由表2可知,乳酸片球菌RH2712对氨苄西林、青霉素、亚胺培南、氯霉素敏感,最低抑菌浓度(minimum inhibitory concentration,MIC)值分别为2 μg/mL、1 μg/mL、0.125 μg/mL和4 μg/mL。由图5可知,阳性对照菌金黄色葡萄球菌(Staphylococcus aureus)CICC 10473出现明显的透明圈,表现为溶血,乳酸片球菌RH2712与阴性对照菌英诺克李斯特氏菌(Listeria innocua)CICC 10417结果一致,均无透明圈,说明乳酸片球菌RH2712溶血性安全,可作为安全益生菌使用。
2.5 乳酸片球菌RH2712耐逆性试验结果
乳酸片球菌RH2712的耐逆性试验结果见图6。
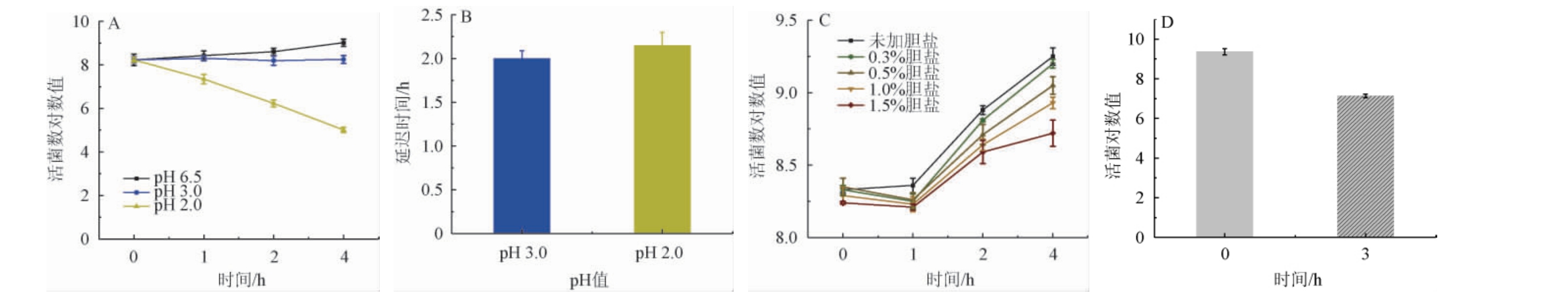
图6 乳酸片球菌RH2712耐逆性试验结果
Fig.6 Stress tolerance test results of Pediococcus acidilactici RH2712
A:耐酸试验结果;B:耐酸延迟时间;C:耐胆盐试验结果;D:人工模拟胃液耐受性试验结果。
由图6A和6B可知,乳酸片球菌RH2712在pH 6.5的条件下活菌数对数值随着培养时间的延长而增加;在pH 3.0的条件下活菌数对数值无明显变化,延迟时间为2 h;在pH 2.0的条件下活菌数对数值降低,延迟时间为2.15 h。由图6C可知,在不同胆盐含量条件下,活菌对数值随培养时间的延长均呈现先下降后上升的趋势,0.3%、0.5%和1.0%胆盐含量下延迟时间均为0 h。即使胆盐含量达到1.5%,培养4 h后活菌对数值也达到8.72,延迟时间也只有0.5 h。由图6D可知,乳酸片球菌RH2712在人工模拟胃液条件下,0 h的活菌对数值为9.19,经3 h处理后活菌对数值也达到7.14。
通常情况下人在空腹状态时的胃酸pH约在0.9~1.5,饭后胃液被稀释,pH也在3.5左右[24]。当益生菌进入人体后,胃酸会导致其活力下降[25],而乳酸片球菌RH2712在模拟胃液条件下经3 h处理后活菌数对数值仍能达到7.14,表明其能顺利通过胃进入肠道。乙醇的主要吸收部位在小肠,小肠中胆盐含量一般在0.03%~0.30%之间,高含量的胆盐会抑制益生菌的生长和定植[26-28],本研究中即使胆盐含量达到1.5%时培养4 h后活菌对数值也能达到8.72,表明乳酸片球菌RH2712能够顺利进入并定植于小肠中。延迟时间代表菌株在逆环境下受到影响的大小,乳酸片球菌RH2712无论在酸还是胆盐的胁迫下延迟时间都在可接受范围内,表明该菌株还具有良好的耐酸耐胆盐能力,满足益生菌生理功能正常发挥的要求。
2.6 乳酸片球菌RH2712防醉和醒酒能力体内实验结果
通过灌胃乙醇建立小鼠醉酒模型进一步验证乳酸片球菌RH2712的解酒防醉的效果,结果表明,所有组小鼠都出现了不同程度的醉酒症状,且无雌雄差异。乳酸片球菌RH2712对小鼠醉酒潜伏期和醒酒时间的影响见图7。由图7可知,与阴性对照组相比,其他组小鼠醉酒潜伏期显著增加(P<0.05),醒酒时间显著降低(P<0.05)。

图7 乳酸片球菌RH2712对小鼠醉酒潜伏期(A)和醒酒时间(B)的影响
Fig.7 Effects of Pediococcus acidilactici RH2712 on drunken latency(A) and sober up time (B) in mice
不同小写字母代表组间差异显著(P<0.05);“**”表示组内解酒试验和防醉试验差异显著(P<0.05)。
由图7A可知,在解酒试验中,与阳性对照组相比,中、高剂量乳酸片球菌RH2712组的醉酒潜伏期显著增加(P<0.05);低剂量乳酸片球菌RH2712组的醉酒潜伏期无显著差异(P>0.05)。在防醉试验中,高剂量乳酸片球菌RH2712组的醉酒潜伏期与阳性对照组无显著差异(P>0.05)。由图7B可知,在解酒试验中,高剂量乳酸片球菌RH2712组醒酒时间显著低于阳性对照组(P<0.05),而在防醉试验中阳性对照组效果最佳。此外,无论是从醉酒潜伏期还是醒酒时间来看,乳酸片球菌RH2712的解酒能力显著强于防醉能力(P<0.05)。
本研究所用的阳性对照美他多辛(哆醇L-2-吡咯烷酮-5-羧酸盐)是一种常见的解酒药,能够增加细胞中乙醇和乙醛脱氢酶的活性,加快血浆中乙醇和乙醛的消除[29]。与美他多辛相比,中、高剂量乳酸片球菌RH2712的解酒功能更强,低剂量时效果也与之相似。而在防醉试验中,只有高剂量乳酸片球菌RH2712醉酒潜伏期达到美他多辛的效果。说明该菌株更适合在饮酒后立即服用,这可能是因为饮酒后胃酸被稀释,使胃中pH升高,从而更适合菌株的生长。
3 结论
本研究从传统发酵食品奶疙瘩中分离筛选出一株乙醇降解率为13.38%、可耐受体积分数12%乙醇的菌株RH2712,经形态观察、生理生化试验及分子生物学技术鉴定为乳酸片球菌(Pediococcus acidilactici)。该菌株对氨苄西林、青霉素、亚胺培南、氯霉素敏感,MIC值分别为2 μg/mL、1 μg/mL、0.125 μg/mL和4 μg/mL,溶血性安全,可作为安全益生菌使用。该菌株具有良好的耐酸、耐胆盐能力,在pH 3.0的条件下活菌对数值几乎不变,延迟时间为2 h;在1.5%胆盐含量下培养4 h后活菌对数值达到8.72,延迟时间仅为0.5 h;在人工模拟胃液条件下处理3 h后活菌对数值仍能达到7.14。乳酸片球菌RH2712在小鼠试验中表现出明显的防醉解酒的功效,且活菌数为1×108~1×109 CFU/mL时解酒功能强于美他多辛。本研究为益生菌在急性酒精中毒上的应用提供了依据,未来市场前景广阔。
[1] WU X,FAN X,MIYATA T,et al.Recent advances in understanding of pathogenesis of alcohol-associated liver disease[J].Annu Rev Pathol,2023,18:411-438.
[2]HO A M,PEYTON M P,SCALETTY S J,et al.Chronic intermittent ethanol exposure alters behavioral flexibility in aged rats compared to adult rats and modifies protein and protein pathways related to Alzheimer's disease[J].ACS Omega,2022,7(50):46260-46276.
[3] PINHEIRO B G, LUZ D A, CARTÁGENES S C, et al.The role of the adenosine system on emotional and cognitive disturbances induced by ethanol binge drinking in the immature brain and the beneficial effects of caffeine[J].Pharmaceuticals (Basel),2022,15(11):1323.
[4]李慧臻,史佳鹭,占萌,等.乳酸菌缓解酒精性肝病的研究进展[J].食品科学,2020,41(7):306-314.
[5] LE DARÉ B, LAGENTE V, GICQUEL T.Ethanol and its metabolites:update on toxicity, benefits, and focus on immunomodulatory effects[J].Drug Metab Rev,2019,51(4):545-561.
[6]WILSON D F,MATSCHINSKY F M.Ethanol metabolism:the good,the bad,and the ugly[J].Med Hypotheses,2020,140:109638.
[7] HYUN J, HAN J, LEE C, et al.Pathophysiological aspects of alcohol metabolism in the liver[J].Int J Mol Sci,2021,22(11):5717.
[8]SOOKYOUNG J,ROTONYA C.Alcohol effects on hepatic lipid metabolism[J].J Lipid Res,2020,61(4):470-479.
[9]解傲,赵恕.国内解酒制品研究进展[J].中国微生态学杂志,2012,24(12):1146-1149.
[10]吕思瑶,陈兴明,黄立归,等.解酒类功能食品的研究进展[J].吉林医药学院学报,2019,40(4):286-287.
[11]范丽.国内天然解酒饮品研究现状[J].农产品加工,2015(10):73-74,76.
[12]张鸿志,李璐,刘永明,等.解酒制品研究进展[J].酿酒科技,2021(9):65-73.
[13]熊大艳,刘万云.药物解酒护肝机制的研究进展[J].宜春学院学报,2017,39(6):35-38.
[14]PALMER E,TYACKE R,SASTRE M,et al.Alcohol hangover:underlying biochemical, inflammatory and neurochemical mechanisms[J].Alcohol Alcoholism,2019,54(3):196-203.
[15]CHUPRADIT S,BOKOV D,ZAMANIAN M Y,et al.Hepatoprotective and therapeutic effects of resveratrol: a focus on anti-inflammatory and antioxidative activities[J].Fund Clin Pharmacol,2022,36(3):468-485.
[16]RUBBENS J,RIETHORST D,BROUWERS J,et al.Gastric and duodenal ethanol concentrations after intake of alcoholic beverages in postprandial conditions[J].Mol Pharmaceut,2017,14(12):4202-4208.
[17]刘威良,毛瑞霞,王雪峰,等.乙醇降解菌种的筛选及其发酵乳产品解酒功效评价[J].食品科学,2020,41(2):107-113.
[18]杨小柏.乙醇降解菌的筛选及特性研究[D].重庆:重庆大学,2005.
[19]闵祥博,汤纯,矫艳平,等.动物双岐杆菌乳亚种HCS04-002小鼠体内功能性研究[J].食品工业,2022,43(4):180-183.
[20]曹蓝,白玉芹,余萍,等.降血脂鼠李糖乳杆菌的筛选及其对高脂模型地鼠血脂的影响[J].现代食品科技,2022,38(7):48-54,69.
[21]矫艳平,余萍,赵迪,等.植物乳杆菌HCS03-001安全性评价及其益生特性分析[J].食品工业科技,2022,43(5):165-171.
[22]余萍,曹蓝,矫艳平,等.副干酪乳杆菌HCS17-040的筛选鉴定及其益生特性[J].食品与机械,2021,37(11):28-33,129.
[23]刘加友.富含γ-氨基丁酸葛根酵素发酵及其解酒功能的研究[D].镇江:江苏大学,2016.
[24]RAMSAY P T,CARR A.Gastric acid and digestive physiology[J].Surg Clin N Am,2011,91(5):977-982.
[25]HODA S,SAYED E L,AHMED M M.Encapsulation of probiotics using mixed sodium alginate and rice flour to enhance their survivability in simulated gastric conditions and in UF-Kariesh cheese[J].Biocatal Agr Biotech,2023,50:102738.
[26]CHEN M L,HUANG X,WANG H,et al.CAR directs T cell adaptation to bile acids in the small intestine[J].Nature,2021,593(7857):147-151.
[27] COLLINS S L, STINE J G, BISANZ J E, et al.Bile acids and the gut microbiota: metabolic interactions and impacts on disease[J].Nat Rev Microbiol,2023,21(4):236-247.
[28] GADALETA R M, CARIELL M, CRUDELE L, et al.Bile salt hydrolase-competent probiotics in the management of IBD: Unlocking the"Bile Acid Code"[J].Nutrients,2022,14(15):3212.
[29]MIRIJELLO A,ADDOLORATO G.Treatment of acute alcohol intoxication:the role of metadoxine[J].Eur J Int Med,2023,110:128.