豆豉是我国四大传统发酵大豆制品之一[1],因其富含营养、口感独特,一直深受人们喜爱[2],是人们餐桌上不可缺少的食品和调味品,其种类根据形态、产地和发酵微生物的不同分有多个品种[3-6]。浏阳豆豉是湖南特色的发酵豆制品,也是国家地理标志性产品,是以泥豆或小黑豆为原料,经过浸泡、蒸煮、自然制曲、洗曲、堆积发酵、晒干而成的曲霉型淡豆豉[7],历史悠久,药食兼用[8]。一般由黑豆经过发酵制成豆豉只要半个月左右的时间,成品豆豉呈黑褐色或酱红色,风味浓郁。但生产更多的沿袭传统工艺,以经验式控制为主,存在生产条件粗放、装备比较落后等问题,且至今仍然没有明确的质量标准和生产规范,存在一定的安全隐患。尽管由于其低盐被作为药食同源使用,但由于产品品质不稳定,日常仍主要作为调味品使用,如浏阳蒸菜。
在实际生产过程中,浏阳豆豉的前期发酵采用自然制曲的方法,将熟化冷却后的黑豆原料放入曲室内进行自然发酵,使得微生物在适宜的温度和湿度条件下生长并分泌多种胞外酶。发酵至7 d左右,豆粒表面覆盖1~2 cm厚的菌丝,菌丝颜色由白变灰并出现黑色孢子[9],制曲进入成熟阶段,此时微生物生长旺盛酶系多且活力高,但豆醅温度较高,容易出现烧曲现象[5],应开窗通气降温,控制微生物生长,俗称“晾曲”,即晾曲阶段。经3~8 d甚至更长时间的“晾曲”(晾曲时间根据天气情况确定),豆醅水分含量降低,所得黑豆干而不燥,表面无水滴,手抓不粘,无异臭后,再进行洗曲。洗曲的目的是去除豆曲表面的曲霉菌孢子、菌丝及黏附物[9],使蛋白酶活力降低避免苦味肽的过多产生[10],洗曲后曲料含水量达到45%,利于后续发酵。目前,国内关于浏阳豆豉的研究主要集中在微生物菌种筛选、鉴定及分布和微生物多样性[11-13],也有对浏阳豆豉生产工艺比较、生物活性、酶活性及挥发性物质的研究[14-16],关于曲霉型豆豉制曲和发酵过程中的微生物群落的研究也有很多学者关注[17-18]。但目前关于晾曲对豆豉生产的影响鲜见报道。
本研究对浏阳豆豉晾曲阶段微生物、理化指标及关键酶活性的变化规律进行研究,探索该工序对浏阳豆豉品质的影响以及其存在的必要性,可为浏阳豆豉品质的稳定和提高提供数据支撑,为浏阳豆豉的工艺优化提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黑豆(陕西肾型小黑豆):市售。
1.1.2 试剂
氯化钠、氢氧化钠、盐酸、95%乙醇、酚酞、甲醛、邻苯二甲酸氢钾、磷酸(均为分析纯或生化试剂):上海国药集团化学试剂有限公司;乙腈、甲醇、二甲基亚砜(均为色谱纯):上海杰星生物科技有限公司;大豆苷、染料木苷、大豆苷元、染料木素标准品(纯度≥98%):成都曼思特生物科技有限公司;α-淀粉酶试剂盒、纤维素酶试剂盒、脂肪酶试剂盒、中性蛋白酶试剂盒、酸性蛋白酶试剂盒、碱性蛋白酶试剂盒:武汉默沙克生物科技有限公司。
1.1.3 培养基
平板计数琼脂培养基、马铃薯葡萄糖琼脂培养基、孟加拉红培养基:上海国药集团化学试剂有限公司。
1.2 仪器与设备
W-HL218超低温冷冻储存箱:合肥美的电冰箱有限公司;LDZX-50 KBS立式高压蒸汽灭菌锅:上海申安医疗器械厂;LRH-250智能生化培养箱:上海飞越实验仪器有限公司;JE502电子天平:上海浦春计量仪器有限公司;DSHZ-82B水浴恒温振荡器:常州金南仪器制造有限公司;SW-CJ-1F CIMO新苗无菌超净工作台:上海新苗医疗器械制造有限公司;Read Max 1900光吸收全波长酶标仪:上海闪谱生物科技有限公司;PHS-3C雷磁pH计:上海仪电科学仪器股份有限公司;Agilent1100series高效液相色谱(highperformance liquid chromatography,HPLC)仪:安捷伦科技(中国)有限公司;SCIENTZ-10N冷冻干燥机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 豆豉曲的制备及取样
参照陈怡等[11]的方法制备浏阳豆豉曲。将豆豉曲从培养箱中取出,放置在通风干燥处,开始晾曲,取晾曲0、6 h、18 h、24 h、30 h、42 h、48 h、72 h、96 h共9个豆豉曲样品。所有豆豉曲样品经标记后均放入-20 ℃冰箱保存。
1.3.2 微生物数量的测定
菌落总数测定:参照GB 4789.2—2022《食品安全国家标准食品微生物学检验菌落总数测定》[19];霉菌和酵母总数测定:参照GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》[20]。
1.3.3 理化指标的测定
水分含量的测定:参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》[21];总糖含量的测定:参照索化夷等[22]的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法;总酸含量的测定:参照GB 12456—2021《食品安全国家标准食品中总酸的测定》[23]中的酸碱滴定法;氨基酸态氮含量的测定:参照GB 5009.235—2016《食品安全国家标准食品中氨基酸态氮的测定》[24]中的酸度计法;大豆异黄酮的测定:参照GB/T 23788—2009《保健食品中大豆异黄酮的测定方法高效液相色谱法》[25]。
1.3.4 关键酶活性的测定
按照试剂盒说明书测定豆豉曲的α-淀粉酶、纤维素酶、脂肪酶和蛋白酶活力。α-淀粉酶活力定义:每g磨碎样品组织每分钟催化产生1 mg还原糖定义为1个酶活力单位(U/g)。纤维素酶活力定义:每g磨碎样品每分钟催化产生1 μg 葡萄糖定义为1个酶活力单位(U/g)。脂肪酶活力定义:37 ℃中每g磨碎样品每分钟水解橄油生成1 μmo1脂肪酸为1个酶活力单位(U/g)。蛋白酶活力定义:37 ℃中每g磨碎样品每分钟催化水解产生1 nmol酪氨酸为1个酶活力单位(U/g)。
1.3.5 数据处理及统计分析
所有试验重复测定三次,结果用“平均值±标准偏差”来表示,使用Excel 2016进行数据分析和图表制作,用IBM SPSS Statistics 26.0软件进行方差分析和Pearson's相关性分析。
2 结果与分析
2.1 浏阳豆豉晾曲阶段水分含量的变化
在晾曲阶段,豆豉曲发生最明显的变化是水分含量下降,水分含量是判断豆醅是否可以洗曲的重要依据。当豆豉曲干而不燥、不粘腻时方可进行洗曲,因此,测定晾曲阶段豆豉曲的水分含量很有必要,且水分含量对豉曲的微生物数量、基本品质指标和酶活均有直接或间接的影响。晾曲阶段豆豉曲水分含量的变化见图1。
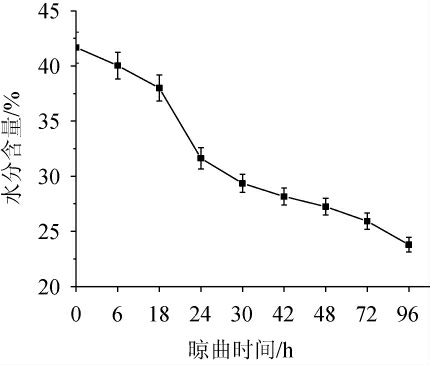
图1 浏阳豆豉晾曲阶段水分含量的变化
Fig.1 Changes of moisture of Liuyang Douchi during koji-cooling stage
由图1可知,在晾曲阶段,豉曲水分含量呈明显的下降趋势,晾曲开始时,水分含量为41.67%,晾曲结束后水分含量减少了42.88%,仅为23.80%,与谢靓等[26]洗曲前的水分相比,本实验中豆豉曲的水分含量偏低,可能是晾曲阶段受外界环境湿度低等影响较大有关。
2.2 浏阳豆豉晾曲阶段微生物数量的变化
浏阳豆豉作为典型的传统曲霉型发酵豆豉,其风味和微生物作用密切相关[27]。尽管接入纯种米曲霉,但固态发酵模式下仍有大量的微生物参与制曲过程。有研究表明,豆豉发酵整体以霉菌、细菌和酵母菌为主,但均是以制曲阶段和堆积发酵阶段的豆豉曲为样品[28]。因此,测定晾曲阶段豉曲的细菌和真菌(霉菌和酵母)总数的变化,结果见图2。
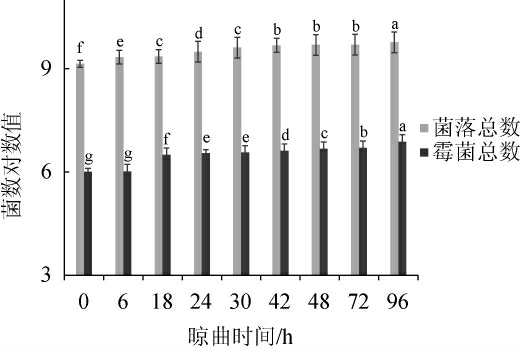
图2 浏阳豆豉晾曲阶段菌落总数和真菌总数的变化
Fig.2 Changes of total colonies counts and fungi counts of Liuyang Douchi during koji-cooling stage
同一指标不同小写字母表示差异显著(P<0.05)。
由图2可知,在晾曲阶段,豆豉曲的菌落总数明显高于霉菌和酵母总数,这与汪孟娟等[29]研究结果一致。结合水分含量的变化,在晾曲6~30 h水分含量明显下降的同时,细菌、霉菌和酵母总数均有明显增长。晾曲30 h后,水分含量持续下降,微生物数量却基本稳定,可能由于低水分环境抑制了微生物增殖。当晾曲时间为96 h时,微生物数量最高,这与谢靓等[26]发现细菌和真菌数量在洗曲时均累积达到最大值的结果基本一致。
2.3 浏阳豆豉晾曲阶段总糖、总酸和氨基酸态氮含量的变化
晾曲阶段豆豉曲总糖、总酸、氨基酸态氮含量的变化可以反映此工序对浏阳豆豉生产工艺的重要性[30],因此,测定不同晾曲时间豆豉曲总糖、总酸和氨基酸态氮含量的变化,结果见图3。
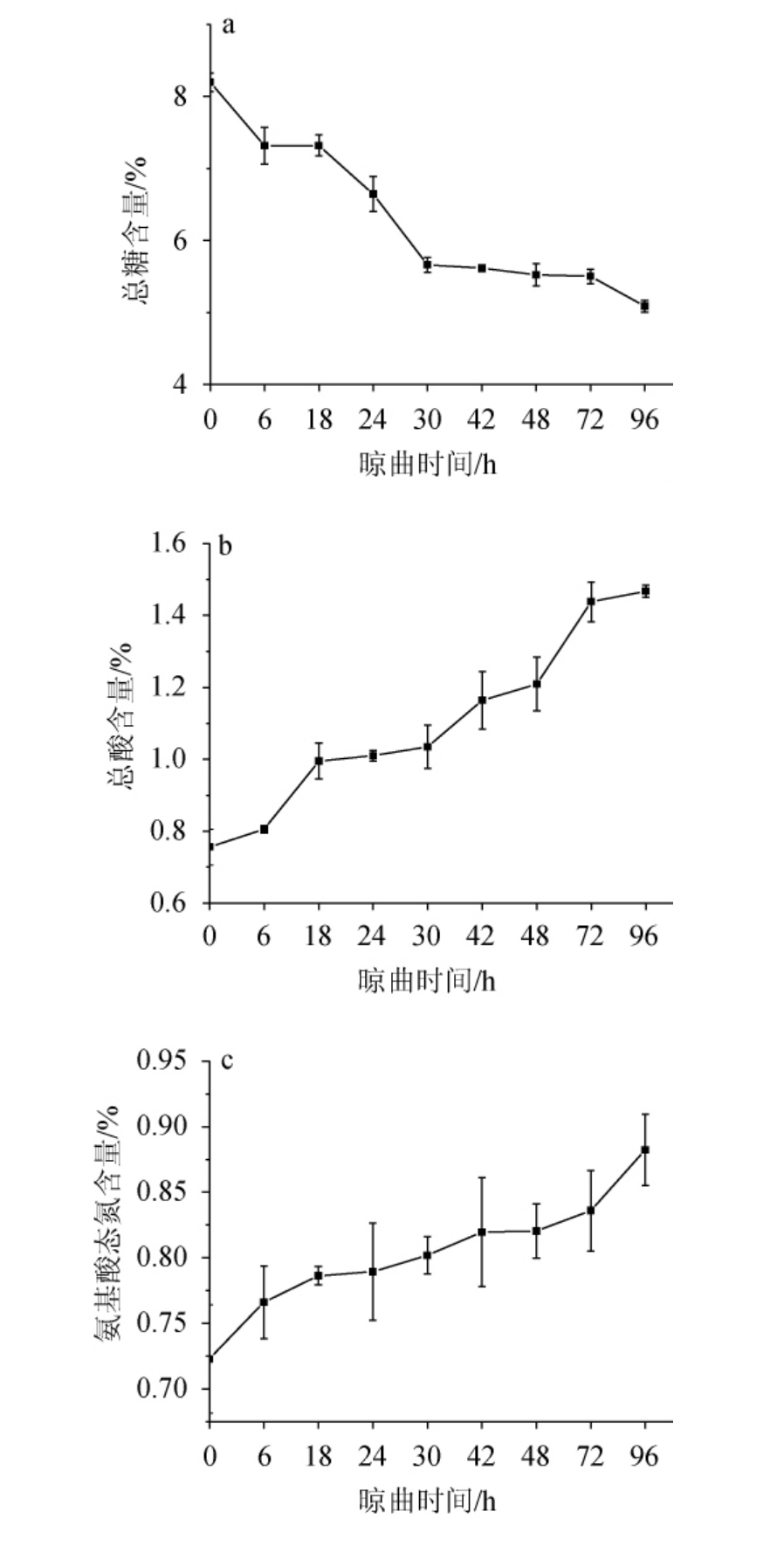
图3 浏阳豆豉晾曲阶段总糖(a)、总酸(b)及氨基酸态氮(c)含量的变化
Fig.3 Changes of total sugar (a), total acid (b) and amino acid nitrogen (c) contents of Liuyang Douchi during koji-cooling stage
由图3a可知,在晾曲阶段,总糖含量持续下降,与索化夷等[22]的研究报道相似,总糖含量从8.20%降到5.09%,推测原因可能是随着发酵的进行,微生物呼吸作用加剧,部分糖被分解。由图3b可知,豆豉曲的总酸含量整体呈增长趋势,与谢靓等[26]检测结果类似,晾曲开始时总酸含量达0.75%,晾曲96 h后总酸含量增加到1.46%;观察晾曲时间在18~30 h的总酸含量发现,此时间段总酸含量增幅很小,而在此期间水分含量出现明显下降、微生物数量明显增加的现象,说明在这个时间段内微生物及酶降解糖类产生的有机酸大部分随水分减少而损失。由图3c可知,豆豉曲的氨基酸态氮含量累积升高,在晾曲96 h达到最高(0.88%),整个晾曲过程氨基酸态氮含量增加了0.16%,涨幅较小,但高于文献[26]中氨基酸态氮含量涨幅(0.04%),说明可能在晾曲阶段微生物和有关酶对蛋白质的降解等代谢活动不活跃。
2.4 浏阳豆豉晾曲阶段大豆异黄酮组成及含量的变化
大豆异黄酮,又被称为植物雌激素,目前已知的大豆异黄酮共有12种,主要包括难以被人体肠道吸收的糖苷型异黄酮(大豆苷、染料木苷)和易被吸收的苷元型异黄酮(大豆苷元、染料木素)[31]。大豆异黄酮具有抗肿瘤、抗胆固醇、抗氧化等多种生物活性,其中染料木素对抑制癌细胞的增殖有一定的抑制作用[32]。豆豉原料中的大豆异黄酮绝大部分是糖苷型异黄酮,经微生物发酵和β-葡萄糖苷酶的降解,苷元型异黄酮含量上升,不仅有利于人体吸收,也能提高豆豉的抗氧化活性,浏阳豆豉晾曲阶段大豆异黄酮含量的变化见表1。
表1 浏阳豆豉晾曲阶段大豆异黄酮组成及含量的变化
Table 1 Changes of composition and contents of soybean isoflavones in Liuyang Douchi during koji-cooling stage
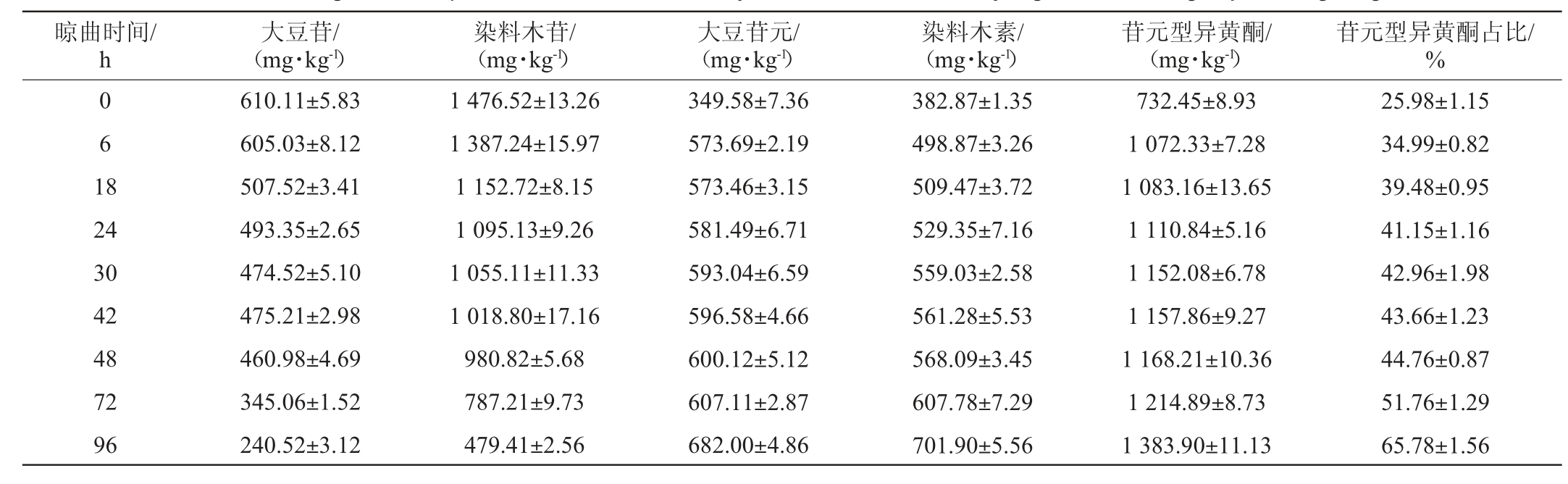
晾曲时间/h 0 6 1 8 24 30 42 48 72 96大豆苷/(mg·kg-1)610.11±5.83 605.03±8.12 507.52±3.41 493.35±2.65 474.52±5.10 475.21±2.98 460.98±4.69 345.06±1.52 240.52±3.12染料木苷/(mg·kg-1)1 476.52±13.26 1 387.24±15.97 1 152.72±8.15 1 095.13±9.26 1 055.11±11.33 1 018.80±17.16 980.82±5.68 787.21±9.73 479.41±2.56大豆苷元/(mg·kg-1)349.58±7.36 573.69±2.19 573.46±3.15 581.49±6.71 593.04±6.59 596.58±4.66 600.12±5.12 607.11±2.87 682.00±4.86染料木素/(mg·kg-1)382.87±1.35 498.87±3.26 509.47±3.72 529.35±7.16 559.03±2.58 561.28±5.53 568.09±3.45 607.78±7.29 701.90±5.56苷元型异黄酮/(mg·kg-1)732.45±8.93 1 072.33±7.28 1 083.16±13.65 1 110.84±5.16 1 152.08±6.78 1 157.86±9.27 1 168.21±10.36 1 214.89±8.73 1 383.90±11.13苷元型异黄酮占比/%25.98±1.15 34.99±0.82 39.48±0.95 41.15±1.16 42.96±1.98 43.66±1.23 44.76±0.87 51.76±1.29 65.78±1.56
由表1可知,浏阳豆豉晾曲阶段,大豆苷和染料木苷的含量均呈下降趋势,大豆苷元和染料木素的含量则呈上升趋势,说明在晾曲阶段糖苷型大豆异黄酮向苷元型大豆异黄酮的转化明显[7]。其中,大豆苷和染料木苷的含量分别减少了60.58%和67.53%,而对应的大豆苷元和染料木素的含量分别增加95.10%和83.32%,说明在晾曲阶段大豆苷有很大一部分转化成了大豆苷元,其利用率较高,染料木苷相对来说损失的较高;苷元型大豆异黄酮在总大豆异黄酮中的占比从晾曲开始的25.98%增长到晾曲结束时的65.78%,这可能与豆豉曲中β-葡萄糖苷酶的活性较高有关。且与某些豆豉曲对比,黑豆原料中大豆异黄酮含量普遍偏高[22]。霍红等[33]也发现黑色大豆以及黑豆豆豉中的染料木素含量均高于黄色大豆和黄豆豆豉,陈怡等[31]研究也得出以黄豆为原料的细菌型豆豉中的苷元型大豆异黄酮含量均低于以黑豆为原料的曲霉型豆豉。
2.5 浏阳豆豉晾曲阶段关键酶活性的变化
微生物分泌各种酶如蛋白酶、淀粉酶、脂肪酶、纤维素酶对原料发酵有很大作用[34]。因此,对晾曲阶段豆豉曲的关键酶活力进行测定,结果见图4。由图4可知,α-淀粉酶的活力整体呈先上升后下降的趋势,在晾曲42 h时达到最高值(1.98 U/g)。纤维素酶活力整体较高,但也呈现先上升后下降的变化趋势,晾曲30 h时最高为475 U/g,晾曲96 h时降到最低(271 U/g)。α-淀粉酶和纤维素酶后期酶活的降低可能是导致总酸含量在晾曲后期增长缓慢的原因。脂肪酶活力在晾曲阶段出现两次明显增长和降低,但酶活整体呈下降的趋势,最低酶活力出现在晾曲42 h仅为35 U/g,分析原因可能是取样差异以及环境影响。米曲霉所产的蛋白酶在较广的pH范围内皆有活性[35],在豆豉曲晾曲阶段,蛋白酶酶活中中性蛋白酶优势明显,其次是碱性蛋白酶,这与赵文鹏[36]研究发现中性蛋白酶在发酵过程中起主要作用的结论一致。但与邵良伟等[37]研究的潼川毛霉型豆豉制曲过程中的蛋白酶活力相比,优势蛋白酶差异较大,后者的优势蛋白酶为酸性蛋白酶,其次是中性蛋白酶,可以反映出不同霉菌型发酵豆豉的区别。
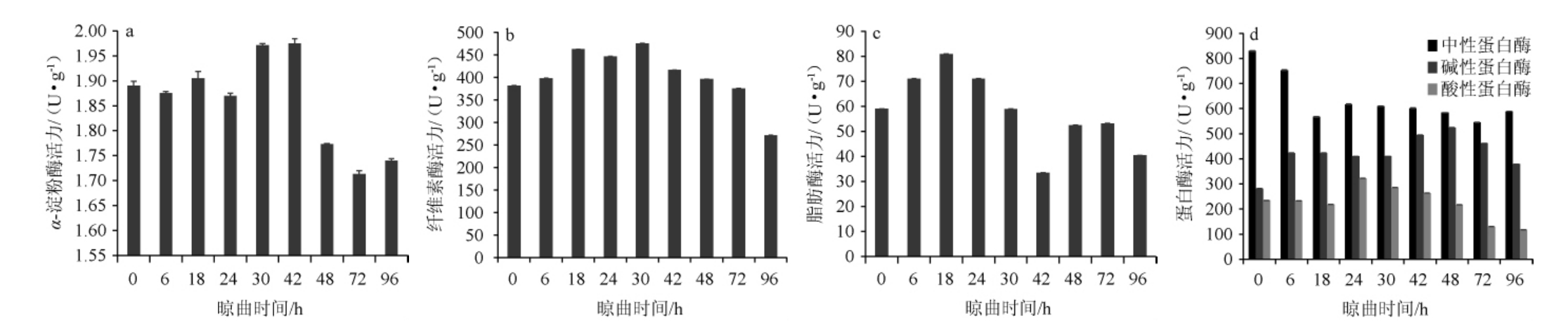
图4 浏阳豆豉晾曲阶段α-淀粉酶(a)、纤维素酶(b)、脂肪酶(c)和蛋白酶(d)活力的变化
Fig.4 Changes of activities of α-amylase(a), cellulase (b), lipase (c) and protease (d) of Liuyang Douchi during koji-cooling stage
2.6 浏阳豆豉晾曲阶理化指标与微生物数量、关键酶活力间的相关性分析
总酸和氨基酸态氮是评判豆豉质量高低的重要指标,晾曲阶段微生物数量和酶活对洗曲后渥堆发酵具有重要的影响,因此,对浏阳豆豉晾曲阶理化指标与微生物数量、关键酶活力间的相关性进行分析,可对工业化生产定向调控提供理论支撑,结果见表2。
表2 浏阳豆豉晾曲阶理化指标与微生物数量、关键酶活力间的相关性分析结果
Table 2 Results of correlation analysis between physicochemical indexes, microbial quantities and key enzyme activities of Liuyang Douchi during koji-cooling stage
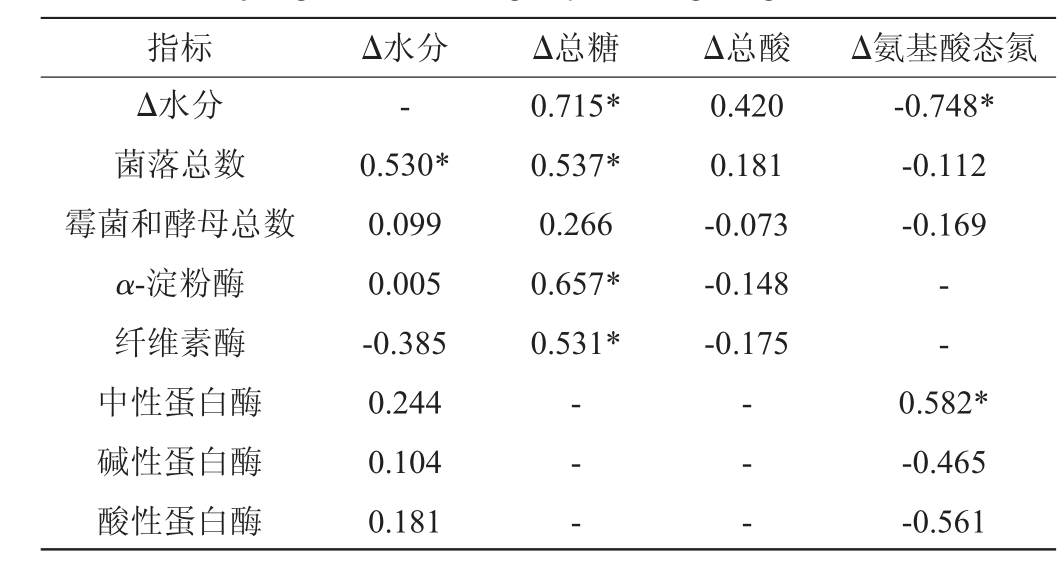
注:“Δ”为后一阶段与前一阶段的差值;“*”表示相关性显著(P<0.05),
“-”表示无相关性。
指标 Δ水分 Δ总糖 Δ总酸 Δ氨基酸态氮Δ水分菌落总数霉菌和酵母总数α-淀粉酶纤维素酶中性蛋白酶碱性蛋白酶酸性蛋白酶-0.530*0.099 0.005-0.385 0.244 0.104 0.181 0.715*0.537*0.266 0.657*0.531*0.420 0.181-0.073-0.148-0.175-0.748*-0.112-0.169—— --- -0.582*-0.465-0.561
由表2可知,豆豉曲的水分含量变化与菌落总数呈显著正相关(P<0.05),而与霉菌和酵母总数的相关性极低,说明真菌的生长繁殖受水分影响小。水分含量对关键酶活的影响也很小,因此酶活力的差异可能与菌种的差异有关。总糖含量变化与水分含量变化、菌落总数、α-淀粉酶以及纤维素酶活力均呈显著正相关(P<0.05),说明在晾曲阶段除一部分总糖随水分流失以外,还出现了部分总糖转化为还原糖以及微生物和酶对单糖的消耗,以上可能是导致总糖含量下降的重要原因。氨基酸态氮含量变化与水分含量变化呈显著负相关(P<0.05),而与中性蛋白酶呈显著正相关(P<0.05),说明水分的减少对氨基酸态氮主要起到了浓缩的作用,其与中性蛋白酶的相关性反映出氨基酸态氮的来源与酶有密切联系,该分析结果在近年的研究报道中也有类似的发现[36]。同时从表2中也可知,霉菌和酵母总数与水分、总糖、总酸、氨基酸态氮含量变化均没有显著相关性(P>0.05),总酸含量与其他各项指标也没有显著相关性(P>0.05),总酸含量增加可能与酶的水解有关。
3 结论
本研究考察了浏阳豆豉晾曲阶段理化指标、微生物、酶系变化,并通过相关性分析分析其对豆豉品质的影响,结果发现,在晾曲阶段,晾曲过程中,豆豉曲的菌落总数、霉菌和酵母总数均呈逐渐上升的趋势,并在96 h达到最大值,分别为5.9×109 CFU/g和7.6×106 CFU/g;水分含量减少至23.80%,总糖含量下降至5.09%,而总酸、氨基酸态氮和苷元型异黄酮含量分别上升至1.46%、0.88%、1 383.90 mg/kg;除中性蛋白酶外,α-淀粉酶、脂肪酶、纤维素酶、酸性蛋白酶和碱性蛋白酶的活力整体均先升高后降低,且在晾曲阶段中性蛋白酶为主要酶。相关性分析结果表明,浏阳豆豉晾曲阶段,水分含量与菌落总数,总糖含量与菌落总数、α-淀粉酶、纤维素酶活力,以及氨基酸态氮含量与中性蛋白酶活力呈显著正相关(P<0.05),而氨基酸态氮含量与水分含量呈显著负相关(P<0.05)。结果表明,晾曲对整个制曲阶段具有一定的影响,该结果可为浏阳传统曲霉型豆豉的工艺优化提供理论依据。
[1]程教擘,谢艳华,刘金,等.传统发酵豆制品生产过程中的安全隐患及改进措施[J].食品安全质量检测学报,2017,8(8):3092-3098.
[2]蒋立文,周传云,李宗军.传统发酵大豆制品的质量与安全控制探讨[J].中国酿造,2006,25(1):1-3.
[3]张鹏飞,乌日娜,武俊瑞.传统发酵大豆制品挥发性成分和微生物多样性的研究进展[J].中国酿造,2018,37(12):1-6.
[4]吴兰芳,蒋爱民,曲直,等.霉菌型黑豆豆豉的主要成分及其抗氧化活性研究[J].现代食品科技,2013,29(1):51-54.
[5]谭小琴.西南地区传统细菌型豆豉品质特点及微生物群系研究[D].重庆:西南大学,2021.
[6] ZHANG J H, TASTUMI E, DING C H, et al.Angiotensin I-converting enzyme inhibitory peptides in douchi, a Chinese traditional fermented soybean product[J].Food Chem,2005,98(3):551-557.
[7]陈怡,刘洋,蒋立文,等.浏阳豆豉发酵过程中抗氧化成分及活性变化研究[J].食品工业科技,2020,41(19):273-278.
[8]VILLARES A,ROSTAGNO M A,GARCÍA-LAFUENTE A,et al.Content and profile of isoflavones in soy-based foods as a function of the production process[J].Food Bioprocess Tech,2011,4:27-38.
[9]蒋立文,周双都.曲霉型(浏阳)豆豉的现状和发展前景[J].中国酿造,2003,22(6):4-6.
[10]KIM I M R,KAWAMURA Y,LEE C H.Isolation and identification of bitter peptides of tryptic hydrolysate of soybean 11S glycinin by reversephase high-performance liquid chromatography[J].J Food Sci, 2003,68(8):2416-2422.
[11]陈怡,刘洋,蒋立文,等.基于高通量测序分析不同浏阳豆豉中真菌的多样性[J].中国酿造,2020,39(11):66-70.
[12]石聪,李世瑞,李跑,等.基于高通量测序浏阳豆豉不同发酵阶段微生物多样性分析[J].食品与发酵工业,2018,44(2):27-32,39.
[13] CHEN Y, LI P, HE W W, et al.Analysis of microbial community and the characterization of Aspergillus flavus in Liuyang Douchi during fermentation[J].LWT-Food Sci Technol,2022,154(2):112567.
[14]谢靓,蒋立文,涂彬,等.电子舌-固相微萃取-气相色谱-质谱联用比较3种不同干燥方式对浏阳豆豉品质的影响[J].食品科学,2016,37(22):92-98.
[15]陈怡,刘洋,蒋立文,等.浏阳豆豉发酵中高产酶活菌株的分离鉴定及酶活性分析[J].中国酿造,2020,39(8):37-41.
[16]CHEN Y,LI P,LIAO L Y,et al.Characteristic fingerprints and volatile flavor compound variations in Liuyang Douchi during fermentation via HS-GC-IMS and HS-SPME-GC-MS[J].Food Chem,2021,361:130055.
[17] HE B, LI H R, HU Z H, et al.Difference in microbial community and taste compounds between Mucor-type and Aspergillus-type Douchi during koji-making[J].Food Res Int,2019,121:136-143.
[18]YANG H L,YANG L,ZHANG J,et al.Exploring functional core bacteria in fermentation of a traditional Chinese food, Aspergillus-type douchi[J].PloS One,2019,14(12):e0226965.
[19]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 4789.2—2022 食品安全国家标准食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2022.
[20]中华人民共和国国家卫生和计划生育委员会.GB 4789.15—2016 食品安全国家标准食品微生物学检验霉菌和酵母计数[S].北京:中国标准出版社,2016.
[21]中华人民共和国国家卫生和计划生育委员会.GB 5009.3—2016 食品安全国家标准食品中水分的测定[S].北京:中国标准出版社,2016.
[22]索化夷,赵欣,骞宇,等.永川豆豉发酵过程中总糖和氨基酸变化与滋味的形成[J].食品科学,2015,36(21):100-104.
[23]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 12456—2021 食品安全国家标准食品中总酸的测定[S].北京:中国标准出版社,2021.
[24]中华人民共和国国家卫生和计划生育委员会.GB 5009.235—2016 食品安全国家标准食品中氨基酸态氮的测定[S].北京:中国标准出版社,2016.
[25]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23788—2009 保健食品中大豆异黄酮的测定方法高效液相色谱法[S].北京:中国标准出版社,2009.
[26]谢靓,蒋立文,龚彩姣,等.浏阳豆豉生产过程中理化性质的变化研究[J].现代食品科技,2016,32(8):225-232,122.
[27]李浩.传统曲霉型豆豉中微生物与风味形成的关联研究[D].南昌:江西师范大学,2021.
[28] SCHMEISSER C, STEELE H, STREIT W R.Metagenomics, biotechnology with non-culturable microbes[J].Appl Microbiol Biotechnol,2007,75(5):955-962.
[29]汪孟娟,熊顺强,陈廷涛,等.PCR-DGGE监测豆豉制曲过程中菌群的动态变化[J].南昌大学学报(理科版),2010,34(6):571-574,578.
[30]邱琳.诱导法制备曲霉型豆豉后酵过程的品质动态分析[D].广州:仲恺农业工程学院,2015.
[31]陈怡,陆敏捷,刘洋,等.不同类型豆豉抗氧化活性差异与影响因素分析[J].食品与发酵工业,2020,46(13):36-41.
[32]郭瑞华,王和平,焦丽艳,等.豆豉中大豆异黄酮及苷元对四氧嘧啶糖尿病模型小鼠血糖及组织的活性作用[J].现代预防医学,2009,36(20):3919-3921,3923.
[33]霍红,田明,王秀海,等.大豆与其生物发酵制品淡豆豉异黄酮含量研究[J].中医药学报,2011,39(3):74-76.
[34]荀冉,卢艳波,杨小雁,等.基于抗原蛋白评价的豆粕菌酶协同发酵研究[J].食品与发酵工业,2023,49(19):127-134.
[35]刘有晴,黄丹,左勇,等.曲霉型豆豉酿造中米曲霉产蛋白酶作用条件研究[J].中国食品添加剂,2015(8):110-113.
[36]赵文鹏.曲霉型豆豉发酵过程中品质特性及微生物变化规律研究[D].南昌:江西师范大学,2020.
[37]邵良伟,邹强,张琼,等.潼川豆豉制曲过程中理化指标变化规律[J].中国调味品,2019,44(10):14-17,25.