高温大曲作为酱香型白酒生产过程中重要的糖化剂和发酵剂[1],含有丰富的微生物及多种酶系[2-6],在白酒酿造中发挥着糖化、发酵、生香等关键作用[7-8]。大曲采用开放生产,微生物区系组成复杂,微生物种类丰富多样[9]。大曲中的微生物主要是细菌,霉菌次之,酵母最少,大都是有益菌[10]。细菌包括己酸菌、丁酸菌、黏液菌和多种杆菌如乳酸杆菌(Lactobacillus)、枯草芽孢杆菌(Bacillus subtilis)、醋酸杆菌(Acetobacter aceti)等,其主要优势细菌菌群为芽孢杆菌(Bacillus sp.)[11]。细菌分泌的各种水解酶类组成的酶系更加复杂多样,产生各种丰富、复杂的代谢产物,如多元醇、呋喃酮类、乙酸乙酯、杂环化合物等,这些化合物是白酒风味及其风味前体物质,是影响酱香型白酒风味的关键因素[12]。
芽孢杆菌(Bacillus sp.)代谢产生的生物酶酶活力强,能利用乙酸乙酯和乙醇合成丁酸乙酯,并进一步合成己酸乙酯等酯类物质,有的芽孢杆菌还会代谢产生四甲基吡嗪、2,3-丁二醇、双乙酰等风味物质[13-14]。赵群丽[15]依据透明圈法初筛和液体发酵测定粗酶液酶活力复筛,从酱香大曲中筛选得到一株产淀粉酶能力较强的枯草芽孢杆菌,并采用气相色谱-质谱联用技术(gas chromatography-mass spectrometry,GC-MS)检测到特征发酵产物主要为3-羟基-2-丁酮(乙偶姻)、2,3-丁二醇、1,3-丁二醇、愈创木酚、四甲基吡嗪、棕榈酸;张丽杰等[16]研究表明,枯草芽孢杆菌Nr.5可合成7种烷基吡嗪;吡嗪类物质生成与酱香的形成有关[17];王西等[18]将从高温大曲中筛选得到的产香枯草芽孢杆菌应用到酱香型白酒生产中,能增强酒的风格特征。
目前,关于高温大曲中同时能产淀粉酶和蛋白酶的菌株鲜有报道。因此,本研究采用稀释涂布平板法、平板划线法从高温大曲中分离菌株,利用透明圈法及酶活力测定筛选高产淀粉酶及蛋白酶的菌株,通过形态学观察及分子生物学技术对其进行菌种鉴定,并对其耐高温和耐酸性进行研究,为酱香型白酒生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高温大曲:贵州省仁怀市茅台镇某酒厂。
1.1.2 试剂
细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Mastermix:上海李记生物科技有限公司;三氯乙酸(分析纯):武汉玺矩生物科技有限公司;蛋白胨、琼脂粉、可溶性淀粉、牛肉膏(均为生化试剂):北京奥博星生物技术有限公司;葡萄糖、氯化钠(均为分析纯):生工生物工程(上海)股份有限公司、磷酸二氢钾、七水硫酸镁、磷酸氢二钾(均为分析纯):湖南比克曼生物科技有限公司。
1.1.3 培养基
琼脂培养基、淀粉透明圈培养基、蛋白酶透明圈培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基均参考赵丽群[15]的配方,种子培养基参考曾德勇等[19]的配方,产酶培养基参考马校卫等[20]的配方,牛肉膏蛋白胨培养基参考李桂霞等[21]的配方。
1.2 仪器与设备
UV-5100紫外可见分光光度计:上海元析仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌锅:上海博讯医疗科技有限公司;XS-212-202显微镜:常州上特仪器制造有限公司;TD5Z医用离心机:杭州瑞析科技有限公司;S1000 PCR仪、BIO-RAD Chemi DocXRS凝胶成像系统:成都百乐科技有限公司。
1.3 方法
1.3.1 菌株的分离纯化
称取10 g大曲于烧杯中,加入90 mL无菌水,用玻璃棒搅拌并振荡20 min,静置,取上清液按10倍梯度稀释至10-7,吸取0.1 mL稀释度为10-4、10-5、10-6、10-7的稀释液分别涂布于琼脂培养基平板上,37 ℃培养24 h[15];用接种环挑取形态不同的菌株分别接种在琼脂培养基平板上划线,37 ℃培养,重复上述操作,直至得到单个菌落,将其接种到琼脂培养基斜面,37 ℃培养24 h,获得初步纯化的菌株。
1.3.2 高产淀粉酶和蛋白酶菌株的筛选
初筛:将分离得到的菌株分别点种于淀粉酶透明圈培养基和蛋白酶透明圈培养基平板上,37 ℃培养24 h;将稀碘液缓慢倒在淀粉酶透明圈培养基平板上,观察是否有透明圈产生,蛋白酶透明圈培养基可直接观察透明圈,使用直尺分别量取透明圈的直径(D)和菌落直径(d),计算D/d,每株菌进行3个平行实验。
复筛:将初筛得到的菌株接种到装液量为60 mL/250 mL的种子培养基中,37 ℃活化20 min后,接种到液体产酶培养基中,35 ℃、130 r/min条件下培养20 h,4 200 r/min离心15 min,取上清液,测定淀粉酶活力和蛋白酶活力。
1.3.3 酶活力测定
淀粉酶活力的测定:参考文献[22-23]的方法。淀粉酶活力的定义为在37 ℃,pH值6.0条件下,每分钟水解1 mg淀粉的酶量为一个活力单位(U/mL)。
蛋白酶活力测定:参考文献[24-25]的方法。蛋白酶活力定义为在40 ℃条件下,1 min内水解酪蛋白产生相当于1 μg酪氨酸的酶量为一个酶活单位(U/mL)[25]。
1.3.4 菌株的鉴定
形态学观察[26]:将筛选出来的菌株划线到琼脂培养基平板,37 ℃培养24 h,观察菌落形态,并进行革兰氏染色,采用显微镜观察细胞形态。
分子生物学鉴定:参照基因组DNA提取试剂盒说明书的操作方法提取菌株的基因组DNA,以其为模板,采用16S rDNA通用引物27F(5'-CAGAGTTTGATCCTGGCT-3')、1492R(5'-AGGAGGTGATCCAGCCGCA-3')进行PCR扩增[26],PCR扩增体系:引物27F、1492R各0.5 μL,DNA模板1 μL,2×Taq PCR Mastermix 12.5 μL,双蒸水(ddH2O)10.5 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火35 s,72 ℃延伸1 min,共计35个循环;72 ℃再延伸8 min。PCR扩增产物经1%琼脂糖凝胶电泳检测。将PCR扩增产物委托重庆拟南芥生物科技有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源序列检索,选取同源性较高的菌株的16S rDNA,利用软件MEGA 11中的邻接法(neighbor-joining,NJ)构建系统发育树,确定目标菌株的分类学地位。
1.3.5 菌株的耐受性分析
种子液制备[24]:将活化好的菌种转接至种子培养基中,将其置于恒温摇床30 ℃、180 r/min培养24 h,得种子液。
耐高温试验[20]:按10%(V/V)的接种量将种子液接种于牛肉膏蛋白胨液体培养基中,分别置于温度为30 ℃、40 ℃、50 ℃和60 ℃条件下处理2 h[28],于37 ℃下培养24 h,采用紫外分光光度计在波长600 nm处测定吸光度值(OD600 nm值);不经处理作为对照组;每个试验3个平行和1个对照组。
耐酸性试验:将种子液按10%(V/V)的接种量接种于初始pH分别为2、3、4、5、6、7的PDA液体培养基中,37 ℃、130 r/min条件下培养,分别于0 h、12 h、24 h、36 h测定培养液的OD600nm值;每个梯度3个平行和1个对照组。
1.3.6 数据处理
使用GraphPad Prism9.0软件[29]进行统计分析,P<0.05为差异具有统计学意义;使用GraphPad Prism9.0软件绘图。
2 结果与分析
2.1 高温大曲中菌株的分离纯化
采用涂布平板稀释法和平板划线法从高温大曲中分离得到15株形态不同的菌株,分别编号为KC-1~KC-15。
2.2 高产淀粉酶和蛋白酶菌株的筛选
2.2.1 初筛结果
通过透明圈法从15株分离菌株中筛选得到3株产淀粉酶透明圈的菌株(KC-6、KC-13和KC-14)和3株产蛋白酶透明圈的菌株(KC-6、KC-12和KC-13),其在平板上的透明圈直径、菌落直径及D/d值见表1。
表1 筛选菌株的淀粉酶和蛋白酶透明圈与菌落直径
Table 1 Transparent circle and colony diameter of amylase and protease of screened strains
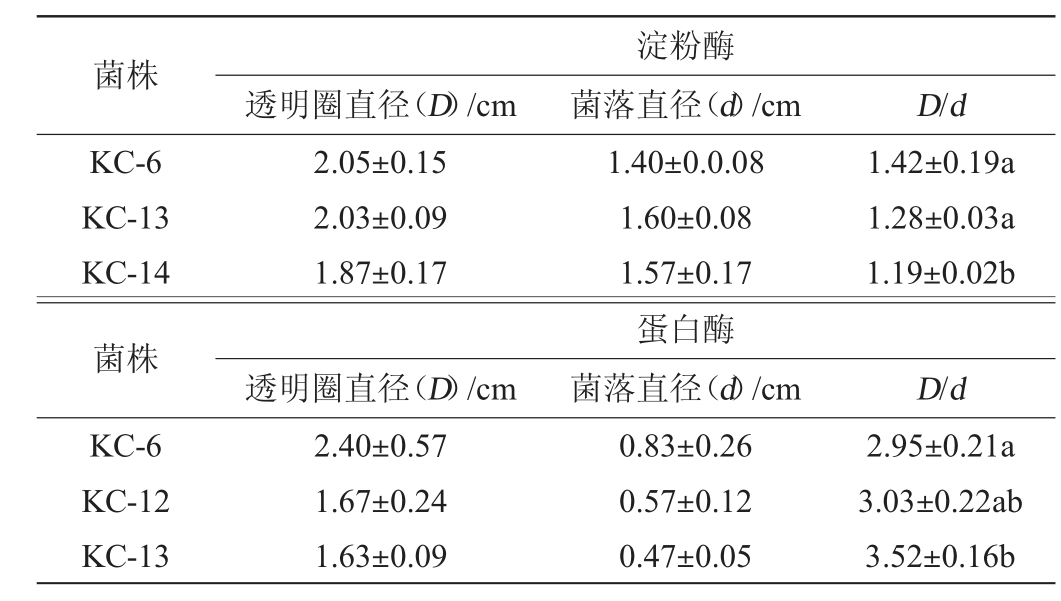
注:不同字母表示差异显著(P<0.05)。下同。
菌株 透明圈直径(D)/cm淀粉酶菌落直径(d)/cm D/d KC-6 KC-13 KC-14菌株KC-6 KC-12 KC-13 2.05±0.15 2.03±0.09 1.87±0.17 1.42±0.19a 1.28±0.03a 1.19±0.02b透明圈直径(D)/cm 2.40±0.57 1.67±0.24 1.63±0.09 1.40±0.0.08 1.60±0.08 1.57±0.17蛋白酶菌落直径(d)/cm 0.83±0.26 0.57±0.12 0.47±0.05 D/d 2.95±0.21a 3.03±0.22ab 3.52±0.16b
由表1可知,在产淀粉酶活力方面,菌株KC-6的D/d值(1.42±0.19)最大,其次为菌株KC-13(1.28±0.03),但两菌株的D/d值无显著差异(P>0.05)。在产蛋白酶活力方面,菌株KC-13的D/d值(3.52±0.16)最大,其次为菌株KC-12(3.03±0.22),两菌株的D/d值也无显著差异(P>0.05)。其中菌株KC-6和KC-13既能产淀粉酶又能产蛋白酶,因此,对菌株KC-6、KC-13的产酶活力进行测定。
2.2.2 复筛结果
为了筛选出一株高产淀粉酶和蛋白酶菌株,测定初筛菌株KC-6、KC-13的淀粉酶和蛋白酶活力,结果见图1。
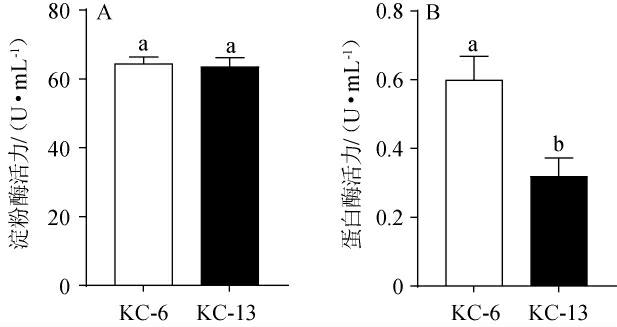
图1 菌株KC-6和KC-13的淀粉酶活力(A)及蛋白酶活力(B)测定结果
Fig.1 Determination results of amylase (A) and protease activities (B)of strains KC-6 and KC-13
由图1可知,菌株KC-6和KC-13的淀粉酶活力无显著差异(P>0.05),分别为64.45 U/mL、63.52 U/mL。菌株KC-6的蛋白酶活力显著高于菌株KC-13(P<0.05),分别为0.60 U/mL、0.32 U/mL。综上,菌株KC-6产淀粉酶和蛋白酶能力相对较强。赵华等[30]从酒曲中筛选到一株产蛋白酶活力为10.48 U/mL的枯草芽孢杆菌(Bacillus subtilis),经培养条件优化后蛋白酶活力能达到154.75 U/mL;胡晓龙等[31]从中高温大曲筛选到一株产淀粉酶活力为552.78 U/mL的枯草芽孢杆菌(B.subtilis),经培养条件优化后淀粉酶活力能达到8 158.23 U/mL。虽然本研究菌株KC-6的产酶活力较低,但该菌株能同时产淀粉酶和蛋白酶。
2.3 菌株KC-6的鉴定
2.3.1 形态观察
菌株KC-6的菌落形态及细胞形态见图2。由图2可知,菌株KC-6的菌落表面不光滑、有褶皱、颜色呈乳白色;细胞呈短杆状,革兰氏染色呈紫色,为革兰氏阳性菌。
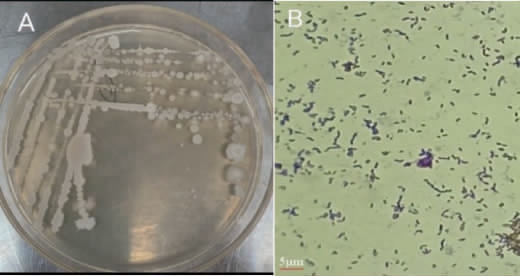
图2 菌株KC-6的菌落(A)及细胞(B)形态
Fig.2 Colony (A) and cell (B) morphology of strain KC-6
2.3.2 分子生物学鉴定
基于16S rDNA基因序列构建菌株KC-6的系统发育树,结果见图3。由图3可知,菌株KC-6与苏云金芽孢杆菌(Bacillus thuringiensis)聚于同一分支,亲缘关系最近。结合形态特征,鉴定菌株KC-6为苏云金芽孢杆菌(Bacillus thuringiensis)。
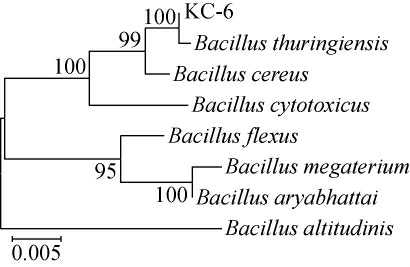
图3 基于16S rDNA基因序列菌株KC-6的系统发育树
Fig.3 Phylogenetic tree based on 16S rDNA sequence of strain KC-6
2.4 菌株KC-6的耐受性分析
2.4.1 耐高温能力测试
高温大曲的制作过程中温度能达到60 ℃以上,高温培养出的微生物才能代谢获得酿造酱香型白酒所需的各种酶和香味物质[17]。因此,考察菌株KC-6高温耐受性,结果见图4。由图4可知,与对照组相比,30 ℃处理后能显著促进菌株KC-6的生长,当培养温度高于30 ℃后,OD600 nm值逐渐下降,菌株的生长受到抑制,但当温度达到60 ℃,KC-6菌株的OD600nm值仍接近1,表明该菌株能耐受60 ℃高温。
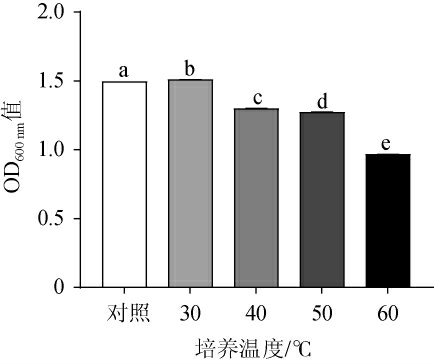
图4 不同温度对菌株KC-6生长的影响
Fig.4 Effects of different temperature on the growth of strain KC-6
2.4.2 耐酸性测试
酒醅固态发酵过程中,适应的酸度为微生物正常生长提供良好的环境[32],菌株KC-6的耐酸性能见图5。
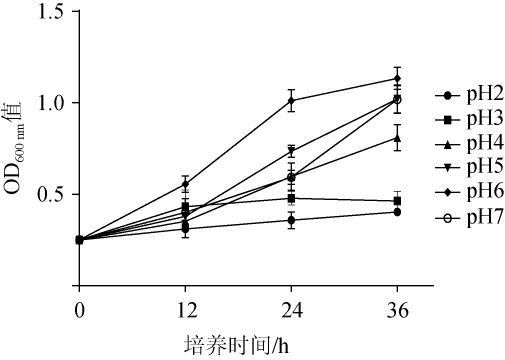
图5 不同pH对菌株KC-6生长的影响
Fig.5 Effects of different pH on the growth of strain KC-6
由图5可知,当pH为2和3时,培养36 h,菌株KC-6的OD600 nm值增幅小,说明菌株能微弱生长;当pH>4之后,培养36 h,菌株KC-6的OD600 nm值增幅加快,尤其pH为5、6和7时OD600 nm值增幅更快,且在培养36 h时OD600nm值接近,结果表明,菌株KC-6在强酸性条件生长缓慢,在弱酸和中性环境中生长旺盛。
3 结论
本研究采用稀释涂布平板法、平板划线法从高温大曲中分离得到15株细菌,通过透明圈法及酶活力测定筛选得到1株高产淀粉酶及蛋白酶的菌株,编号为KC-6,其所产淀粉酶活力为64.45 U/mL,蛋白酶活力为0.6 U/mL;通过形态学观察及分子生物学技术鉴定菌株KC-6为苏云金芽孢杆菌(Bacillus thuringiensis);其可耐受60 ℃的高温,在强酸性条件生长缓慢,在弱酸和中性环境中生长旺盛。
[1]陈阔,欧阳英,何天翔,等.一株耐酸、高产淀粉酶酵母菌的筛选及初步鉴定[J].食品安全导刊,2022(16):75-79.
[2]范伟业.宏蛋白质组学解析浓香型大曲酶系组成[D].无锡:江南大学,2021.
[3]张宗启.酱香型白酒大曲中功能微生物菌群及其酶系研究进展[J].酿酒科技,2021(3):92-99.
[4]刘晶晶.大曲酶系和代谢物组分析及其中产复合酶菌株的应用研究[D].北京:中国农业大学,2018.
[5]卫春会,黄治国,黄丹,等.高温大曲高产蛋白酶菌株的分离鉴定及其产酶性能研究[J].食品与机械,2014,30(4):24-29.
[6]刘茗铭.高温大曲中产香功能微生物的筛选及其应用研究[D].自贡:四川轻化工大学,2019.
[7]李杰.微生物技术在酱香型白酒生产中的应用[J].中小企业管理与科技(中旬刊),2019(10):158-159.
[8]何猛超,任义平,熊林,等.茅台地区不同高温大曲微生物群落结构解析[J].中国酿造,2022,41(6):51-57.
[9]肖东光,赵树欣,陈叶福,等.白酒生产技术[M].北京:化学工业出版社,2011:157-160.
[10]孙利林,李立郎,胡萍,等.酱香型白酒大曲的微生物菌群结构及风味成分分析[J].现代食品科技,2020,36(8):299-306,193.
[11]郭丽丹,张晓妍,周婉婷,等.枯草芽孢杆菌拮抗菌的筛选鉴定及其抑菌特性研究[J].食品工业科技,2022,43(21):152-158.
[12]闫杨,刘月静,陈芳.枯草芽孢杆菌的应用现状概述[J].生物学教学,2019,44(2):2-3.
[13]任道群,唐玉明,姚万春,等.酯化酶动力学研究[J].酿酒科技,2006(6):39-40.
[14]林群,肖之陶,付秋香,等.产香风味地衣芽孢杆菌(Bacillus licheniformis)的分离及发酵代谢产物分析[J].酿酒科技,2013(12):49-52.
[15]赵群丽.酱香大曲中酿酒微生物的筛选及发酵工艺研究[D].贵阳:贵州大学,2016.
[16]张丽杰,张怀志,徐岩.枯草芽孢杆菌Nr.5和底物添加促进酱油中吡嗪类物质合成[J].食品与发酵工业,2020,46(21):1-8.
[17]崔利.酱香型白酒中吡嗪类化合物的生成途径及环节[J].酿酒,2007,34(5):39-40.
[18]王西,沈毅,张亚东,等.产香枯草芽孢杆菌在酱香型白酒生产中的应用[J].酿酒科技,2018(7):70-75.
[19]曾德勇,方镒,刘涛,等.酱香型高温大曲中高产蛋白酶细菌的分离及鉴定[J].酿酒科技,2015(3):27-30.
[20]马校卫,颜林春,汤二将,等.高温大曲中产耐热性蛋白酶芽孢杆菌的筛选和鉴定[J].食品工业科技,2012,33(15):169-173.
[21]李桂霞,韩玉乐,谈春季.不同种类小肽对枯草芽孢杆菌生长的影响[J].北方牧业,2022(5):27.
[22]李力.高淀粉酶蛋白酶活力枯草芽孢杆菌的选育及酶基因阳性克隆的筛选[D].乌鲁木齐:新疆农业大学,2009.
[23]YOO Y J,HONG J,HATCH R T.Comparison of alpha-amylase activities from different assay methods[J].Biotechnol Bioeng,1987,30:147-151.
[24]张学英.蛋白酶及其活力的测定[J].酿酒,2008,35(6):100-102.
[25]赵笑,蔡淼,杨智杰.解淀粉芽孢杆菌GSBa-1凝乳酶对切达干酪成熟过程中蛋白水解及生物活性的影响[J].食品科学,2020,41(22):103-111.
[26]谭啸,章熙东.革兰氏染色法观察与区分细菌[J].生物学教学,2019,44(7):71-72.
[27]韩雪,童攀.一株产脂肪酶蜡状芽孢杆菌的分离鉴定[J].江汉大学学报(自然科学版),2017,45(1):68-71.
[28]ZHANG J,JIANG H,DU Y,et al.Members of chitin synthase family in Metarhizium acridum differentially affect fungal growth,stress tolerances,cell wall integrity and virulence[J].PLoS Pathog,2019,15(8):e1007964.
[29]BERKMAN S J,ROSCOE E M,BOURRET J C.Comparing self-directed methods for training staff to create graphs using Graphpad Prism[J].J Appl Behav Anal,2019,52:188-204.
[30]赵华,任青霞,张敏,等.酒曲中高产蛋白酶菌株的筛选及其发酵培养基优化[J].中国酿造,2023,42(5):157-164.
[31]胡晓龙,冯大鸿,田瑞杰,等.中温大曲产淀粉酶菌株的筛选鉴定及培养条件优化[J].中国酿造,2023,42(1):78-85.
[32]万勇,张兆丰,熊翔,等.酱香型不同轮次发酵酒醅理化因子变化规律研究[J].中国食品工业,2022(4):107-111.