发酵辣椒是指新鲜辣椒在微生物发酵作用下,形成一种具有特殊风味以及营养价值的食品[1]。传统自然发酵辣椒通常以家庭为单位,利用辣椒自身携带的乳酸菌进行发酵,这种自发性发酵发酵效率低,品质参差不齐[2]。新鲜辣椒本身携带能够还原硝酸盐的微生物,使自然发酵辣椒中亚硝酸盐富集,亚硝酸盐在人体内消化过程中易形成强致癌物亚硝胺[3]。同时,微生物发酵辣椒会代谢产生生物胺,人体摄入生物胺后会导致头痛、呼吸紊乱及血压变化等不良反应[4]。
针对此现象,有研究通过控制发酵时间[5]、改变辣椒处理方式[6]或添加乳酸菌发酵[7]等方式降低亚硝酸盐或生物胺含量[8]。其中,添加乳酸菌发酵相比其他方式能有效降低亚硝酸盐与生物胺含量,同时还有加快发酵速度、赋予独特风味、维持品质稳定、提高安全性等特点,被广泛应用于辣椒发酵中[9]。王雪雅等[10]向辣椒中分别单独接种德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.bulgaricus)、发酵乳杆菌(Lactobacillus fermentum)、乳酸片球菌(Pediococcus acidilactici)、乳酸链球菌(Streptococcus lactis)、嗜酸乳杆菌(Lactobacillus acidophilus)、食果糖乳杆菌(Lactobacillus fructivorans)、双发酵乳杆菌(Lactobacillus bifermentans)、戊糖乳杆菌(Lactobacillus pentosus)、植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(Lactobacillus brevis),测得接种发酵辣椒中亚硝酸盐含量比自然发酵辣椒均有所降低,且最低为1.7 mg/kg;夏学超等[11]研究发现,酪胺和组胺是发酵辣椒中含量最多的2种生物胺,向辣椒中接种植物乳杆菌(Lactobacillus plantarum)发酵14 d后,可以降低生物胺含量。为丰富发酵辣椒风味,部分工艺在生产发酵辣椒过程中会加入黄酒、白酒等物质,过高浓度的乙醇会影响乳酸菌生长,导致发酵效果不佳[12]。耐乙醇片球菌(Pediococcus ethanolidurans)最初从河北省一个蒸馏酒窖中分离得到[13],其能够利用葡萄糖和果糖等糖产生乳酸[14],并能在高乙醇和低糖浓度的恶劣条件下生存[13],同时能够产生多种挥发性化合物特别是酯类和萜烯类,增加发酵产品的独特风味[15]。因耐乙醇片球菌具有高乙醇耐受性,为发酵辣椒风味提供了更多的可能。LI Y等[15]在东仓泡菜辣椒中分离获得一株可以降低发酵辣椒中亚硝酸盐含量的耐乙醇片球菌M1117,但未对生物胺含量进行检测。
本研究以从新疆传统发酵辣椒中分离得到的优势乳酸菌CICC 6282为研究对象[16],采用形态观察、生理生化实验及分子生物学技术对其进行菌种鉴定,从耐盐耐酸能力、抑菌能力、生长状况、产酸能力、亚硝酸盐降解能力和氨基酸脱羧酶活性等方面全面表征其生物学特性,并将该菌株接种到辣椒发酵过程中,通过测定发酵辣椒的总酸含量、亚硝酸盐含量和生物胺种类及含量探究该菌株在发酵辣椒过程中的作用,探讨乳酸菌CICC 6282作为发酵剂的可能性,并为其作为发酵剂改良发酵辣椒提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与材料
乳酸菌菌株CICC 6282:分离于新疆传统发酵辣椒样品;大肠埃希氏菌(Escherichia coli)CICC 10354:中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC);螺丝椒(“猪大肠”辣椒):市售。
1.1.2 试剂
API 50 CH碳水化合物鉴定生化试剂条:生物梅里埃公司;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、DL2000脱氧核糖核酸(deoxyribonucleic acid,DNA)marker、Taq DNA聚合酶(5 U/μL):天根生化科技(北京)有限公司;蛋白酶(50 U/mL):德国Merk公司;核酸染料GoldView:北京赛百盛基因技术有限公司;溶菌酶:美国Sigma公司;细菌基因组DNA提取试剂盒:美国OMEGA公司;氨基酸脱羧酶生化鉴定管:青岛海博生物技术有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
MRS肉汤培养基、MRS培养基:美国Becton Dickinson公司。
1.2 仪器与设备
AC2-4S1生物安全柜:新加坡Esco公司;GHP-9050隔水式培养箱、BHG-8082型恒温培养箱:上海一恒科学仪器有限公司;温度梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Biometra公司;7200紫外分光光度计:尤尼科(上海)仪器有限公司;FE20 pH计:梅特勒-托利多仪器(上海)有限公司;8010扫描电镜:株式会社日立制作所;U3000高效液相色谱(high performance liquid chromatography,HPLC)仪:赛默飞世尔科技公司。
1.3 试验方法
1.3.1 菌株CICC 6282的鉴定
形态学鉴定:使用四区划线,将菌株CICC 6282接种至MRS培养基上,37℃培养48 h,记录菌落形态。取一环新鲜培养的菌体于1 mL 2.5%戊二醛中,4 ℃过夜固定。6 000 r/min离心2 min,收集固定后菌体,使用无菌水漂洗2次,再依次使用体积分数分别为50%、70%、85%、95%与100%的乙醇进行梯度脱水后,进行二氧化碳临界点干燥。将干燥后的样品放置在载物台上进行喷金,使用扫描电镜观察菌体形态[17]。
生理生化鉴定[18]:使用API 50 CHL鉴定系统对菌株CICC 6282的底物利用特征进行检测。
分子生物学鉴定[19]:使用细菌基因组提取试剂盒提取菌株CICC 6282的基因组DNA,以其为模板,利用引物27F与1492R对16S rRNA基因序列进行PCR扩增;利用引物21F和23R对pheS基因序列进行PCR扩增。使用1%琼脂糖凝胶电泳对PCR扩增产物进行检测,将检测合格的PCR扩增产物委托北京诺赛基因组研究中心有限公司进行测序。
使用ContigExpress软件对测序结果进行分析,将分析后结果递交到EzBioCloud和美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行比对分析,选取近缘种的16S rRNA基因和pheS基因序列,采用MEGA 7.0软件中的Clustal功能进行多序列比对,并使用邻接(neighbour joining,NJ)法构建系统发育树。
1.3.2 菌株CICC 6282的生物学特性研究
将菌株CICC6282接种至MRS肉汤培养基,37 ℃活化培养48h,重复活化1次,使菌悬液的活菌数达到6×108CFU/mL,作为种子液备用[20]。
耐盐和耐酸能力的测定:将种子液按照1%(V/V)的接种量,分别接种至含2%、4%、6%、8%、10%NaCl的MRS肉汤培养基中,37 ℃培养48 h,测定OD600nm值,探究NaCl含量对菌株CICC 6282生长的影响;将种子液按照1%(V/V)的接种量,分别接种至pH值为3.0、4.0、5.0、6.0、7.0的MRS肉汤培养基中,37 ℃培养48 h,测定OD600nm值,探究pH值对菌株CICC 6282生长的影响[21]。
生长曲线与产酸能力的测定:将种子液按照1%(V/V)的接种量接种至MRS肉汤培养基中,37 ℃培养48 h,每4 h测定OD600nm值,同时使用pH计测定发酵液的pH值[22-23]。
亚硝酸盐降解能力的测定:将种子液按照1%(V/V)的接种量接种至含有125 μg/mL NaNO2的MRS肉汤培养基中,37 ℃培养48 h,使用盐酸萘乙二胺法测定培养24 h和48 h后发酵液中的NaNO2含量[24]。
氨基酸脱羧酶试验:将活化好的菌落制备成6×106CFU/mL的菌悬液,将0.1 mL菌悬液加入氨基酸脱羧酶试验的安瓿瓶中,37 ℃培养24 h后,记录试验管与对照管结果。
抑制大肠埃希氏菌生长实验:将种子液按照1%(V/V)的接种量,接种至MRS肉汤培养基中,37 ℃培养48 h后,8 000 r/min离心2 min,取上清液。参照GB4789.43—2016《食品安全国家标准食品微生物学检验微生物源酶制剂抗菌活性的测定》测定上清液对大肠埃希氏菌的抑菌效果[25]。
1.3.3 发酵辣椒的发酵工艺流程[26]
操作要点:
选料清洗:挑选出无褐变、无腐烂的新鲜螺丝椒(“猪大肠”辣椒),清洗干净。
破碎、装瓶:去蒂去籽后,将辣椒剁碎,称取100 g辣椒放入灭菌后的发酵瓶中,同时加入3%白砂糖和3%食盐。
自然发酵:拧紧发酵瓶,摇匀后,置于30 ℃下自然发酵7 d,制成发酵辣椒。
接种发酵:将菌株CICC 6282接种至MRS肉汤培养基,37 ℃活化培养48 h,重复活化1次,使菌悬液的活菌数达到6×108 CFU/mL,作为种子液。将种子液按照1%的接种量接种至辣椒中。拧紧发酵瓶,摇匀后,置于30 ℃下发酵7 d,制成接种发酵辣椒。
1.3.4 发酵辣椒品质的测定
亚硝酸盐含量的测定:采用盐酸萘乙二胺法[24]。总酸含量的测定:参照GB 12456—2021《食品安全国家标准食品中总酸的测定》中的酸碱滴定法[27]。生物胺种类及含量的测定:参照GB 5009.208—2016《食品中生物胺的测定》中的第一法液相色谱(LC)法[28]。
1.3.5 数据处理
每个实验设置3次平行,使用Excel 2021软件处理数据,结果用“平均值±标准差”表示。使用SPSS 18.0进行显著性分析。
2 结果与分析
2.1 菌株CICC 6282的多相分类学鉴定
2.1.1 形态学鉴定
菌株CICC 6282的菌落及细胞形态见图1。由图1可知,菌株CICC 6282在MRS培养基上的菌落呈白色,表面湿润,圆形且边缘整齐;菌体呈球状,单个、成对或成堆排列,直径为0.6~1.1 μm。
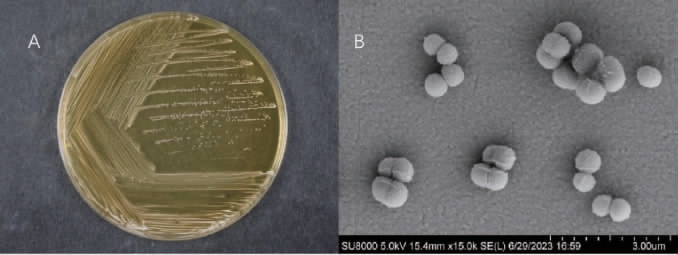
图1 菌株CICC 6282的菌落(A)及细胞(B)形态
Fig.1 Colony (A) and cell (B) morphology of strain CICC 6282
2.1.2 生理生化鉴定
菌株CICC 6282对不同碳源的利用情况见表1。由表1可知,菌株CICC 6282 能利用D-半乳糖、D-葡萄糖、D-果糖、D-甘露糖、N-乙酰葡糖胺、苦杏仁苷、七叶灵、水杨苷、D-纤维二糖、D-麦芽糖、D-蔗糖、D-海藻糖、D-龙胆二糖产酸,不能利用其他碳源产酸。
表1 菌株CICC 6282对不同碳源的利用情况
Table 1 Utilization of different carbon sources by strain CICC 6282

注:“+”表示结果呈阳性,能产酸;“-”表示结果呈阴性,不能产酸。
碳源 结果 碳源 结果甘油D-核糖β-甲基-D-木糖苷D-甘露糖肌醇α-甲基-D-葡萄糖苷七叶灵D-乳糖菊糖糖原D-来苏糖D-阿拉伯醇5-酮基-葡萄糖酸盐赤藓糖醇D-木糖D-半乳糖L-山梨糖甘露醇N-乙酰葡糖胺水杨苷D-蜜二糖D-松三糖木糖醇D-塔格糖L-阿拉伯醇-- - + - - + - - - - - - - - + - - + + - - - - -D-阿拉伯糖L-木糖D-葡萄糖L-鼠李糖山梨醇苦杏仁苷D-纤维二糖D-蔗糖D-棉籽糖D-龙胆二糖D-岩藻糖葡萄糖酸钾L-阿拉伯糖阿东醇D-果糖卫矛醇α-甲基-D-甘露糖苷熊果苷D-麦芽糖D-海藻糖淀粉D-土伦糖L-岩藻糖2-酮基-葡萄糖酸盐-- + - - + + + - + - - - - + - - - + + - - - -
2.1.3 分子生物学鉴定
基于16S rRNA基因序列构建菌株CICC 6282的系统发育树,结果见图2A。由图2A可知,菌株CICC 6282与耐乙醇片球菌(Pediococcus ethanolidurans)DSM 22301T和酒窖片球菌(Pediococcus cellicola)DSM 17757T聚于一大分支,同源性分别达到99.93%、98.73%。因此,通过16S rRNA基因序列鉴定只能将菌株CICC 6282鉴定为片球菌属(Pediococcus)。在此基础上,进一步采用pheS基因确定菌株CICC 6282的分类学地位,结果见图2B。由图2B可知,菌株CICC 628与耐乙醇片球菌(Pediococcus ethanolidurans)DSM 22301T聚于一支,同源性达99.90%,亲缘关系最近,与其他模式菌株的同源性均在87%以下。结合形态观察及生理生化实验结果,最终将菌株CICC 6282鉴定为耐乙醇片球菌(Pediococcus ethanolidurans)。
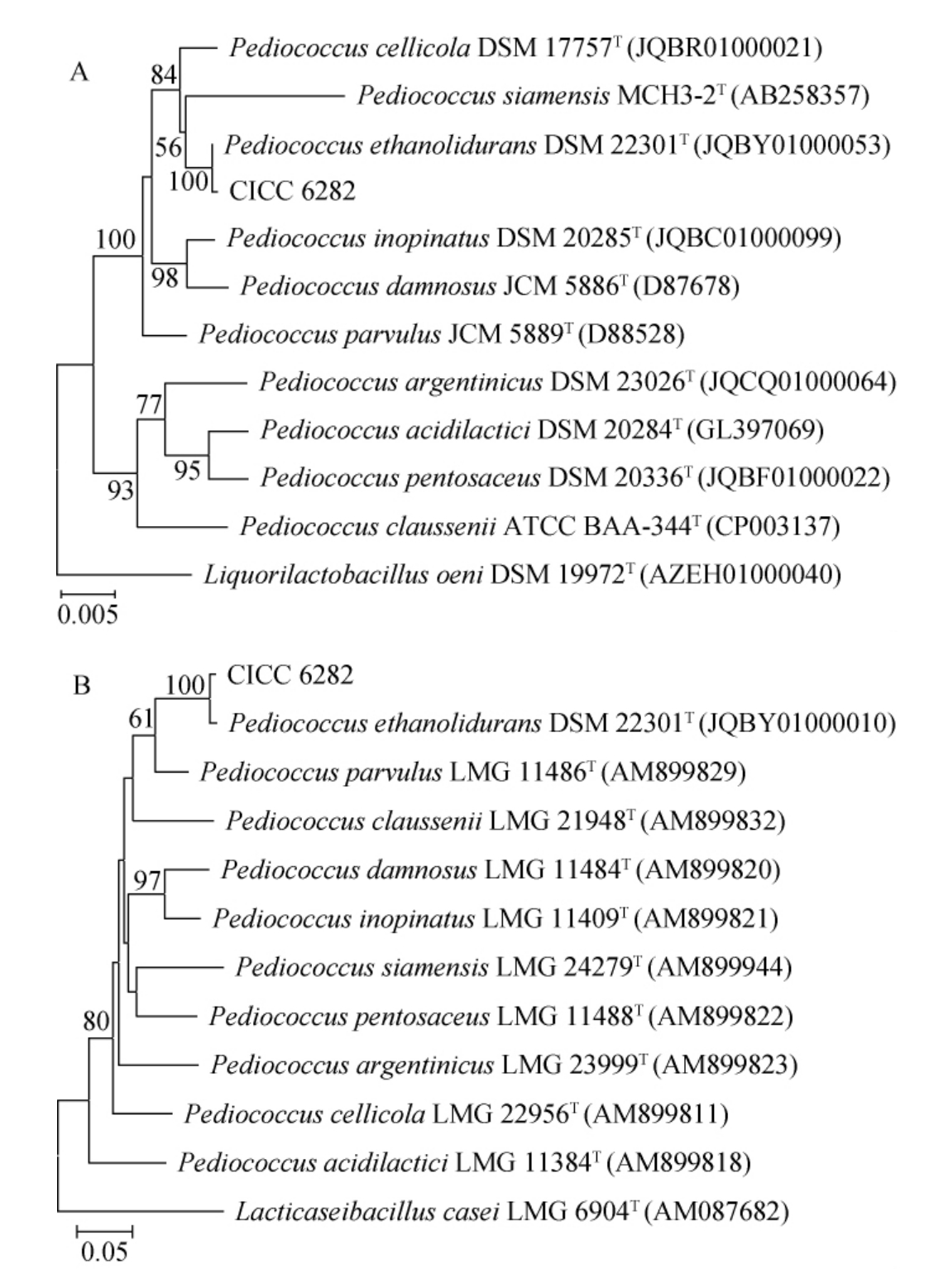
图2 基于16S rRNA(A)与pheS(B)基因菌株CICC 6282的系统发育树
Fig.2 Phylogenetic tree of strain CICC 6282 based on 16S rRNA (A)and pheS (B) gene
2.2 耐乙醇片球菌CICC 6282的生物学特性研究
2.2.1 耐盐及耐酸试验
随着食品加工变得更加多样化,对于乳酸菌对发酵环境的耐受性提出了更高的要求[29],因此,考察耐乙醇片球菌CICC 6282的耐盐及耐酸性,结果见图3。由图3可知,随着NaCl含量的升高与pH值的下降,菌株CICC 6282的OD600 nm值均呈下降趋势,当NaCl含量为10%、pH值为3.0时,OD600nm值为0,说明菌株CICC 6282在该条件不能生长;当NaCl含量为8%时,OD600 nm值为0.635,pH为4.0时,OD600 nm值为0.128,说明菌株CICC 6282在8%NaCl生长良好,在pH 4.0的条件下生长虽受到了抑制,但仍能生长,说明菌株CICC 6282可耐受8%NaCl和pH 4.0的环境。谷懿寰等[30]从内蒙古奶豆腐中分离鉴定得到一株戊糖片球菌(Pediococcus pentosaceus)S28,其能够耐受6%NaCl与pH4.5的环境,在pH 4.0的培养基中OD595 nm值与对照无差异,与本研究菌株CICC 6282相比具有更好的耐酸及耐盐性。此外,IUCHI A等[31]研究发现,从发酵泡菜中分离到的耐乙醇片球菌A4-27能够耐受10%NaCl与pH 4.0的环境。这与本研究结果一致,说明耐乙醇片球菌具有良好的耐盐性与一定的耐酸性,具有作为发酵菌剂的潜力。
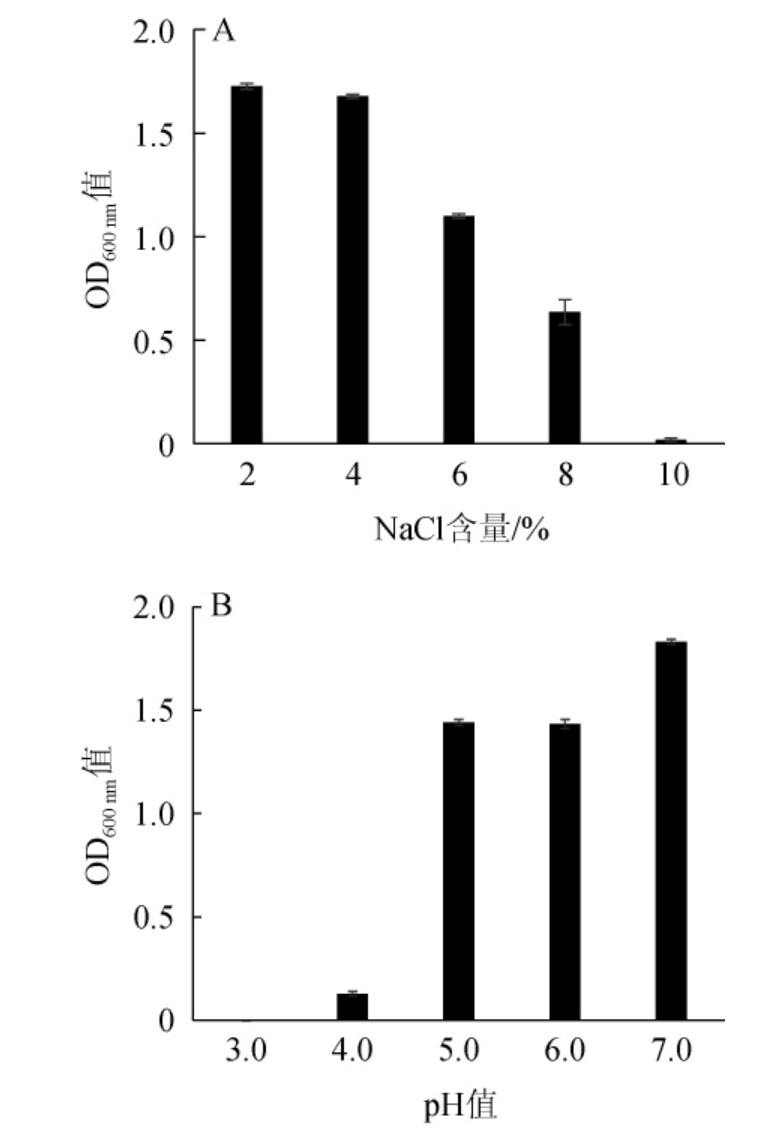
图3 耐乙醇片球菌CICC 6282的耐盐(A)和耐酸(B)试验结果
Fig.3 Results of salt (A) and acid (B) tolerance tests of Pediococcus ethanolidurans CICC 6282
2.2.2 生长曲线及产酸能力
耐乙醇片球菌CICC 6282的生长曲线及产酸能力见图4。由图4可知,菌株CICC 6282在培养过程中,0~12 h为迟滞期,12~36 h为生长对数期,36~48 h为稳定期。同样,菌株CICC 6282在培养12~36 h产酸速率较快,36 h之后产酸速率趋于稳定,pH基本稳定在4.2保持不变。董硕等[32]研究发现,随着发酵时间的延长,当pH值降至5.0,细菌开始受到抑制,pH<4.0时,乳酸菌总数也开始降低。耐乙醇片球菌CICC 6282可以在26 h内将pH降至5.0以下,且维持pH在4.2,抑制了辣椒中细菌生长。
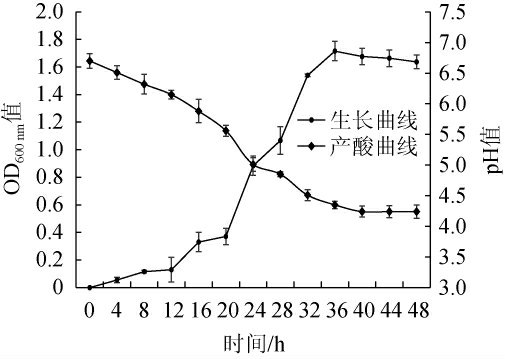
图4 耐乙醇片球菌CICC 6282的生长曲线及产酸曲线
Fig.4 Growth curve and acid production curve of Pediococcus ethanolidurans CICC 6282
2.2.3 亚硝酸盐降解能力
耐乙醇片球菌CICC 6282对亚硝酸盐的降解能力见图5。由图5可知,随着培养时间的延长,菌株CICC 6282降解亚硝酸盐的能力增强,培养24 h时,亚硝酸盐降解率为90.2%;培养48 h时,亚硝酸盐降解率达到100%。田辉等[33]对分离自甘肃省传统泡菜中的2株短乳杆菌(Lactobacillus brevis)与1株植物乳杆菌(Lactobacillus plantarum)的亚硝酸盐降解能力进行检测,结果发现,植物乳杆菌Lp-9-1的亚硝酸盐降解率最高为50%;赵海霞等[34]从甘肃农户浆水中分离得到35株具有亚硝酸盐降解能力的乳酸菌,其中植物乳杆菌通渭A7的亚硝酸盐降解率最高,为93.81%。相比之下,耐乙醇片球菌CICC 6282具有更高的亚硝酸盐降解能力。
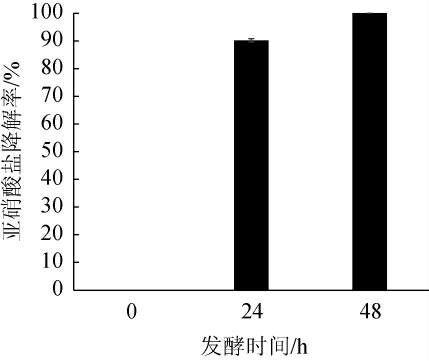
图5 耐乙醇片球菌CICC 6282的亚硝酸盐降解能力测定结果
Fig.5 Determination results of nitrite degradation capacity of Pediococcus ethanolidurans CICC 6282
2.2.4 氨基酸脱羧酶试验
有研究发现,发酵微生物能代谢产生氨基酸脱羧酶,进而通过脱羧作用产生生物胺,生物胺被人体摄入后能够引起心跳加速、血压异常等中毒症状[35]。因此,考察耐乙醇片球菌CICC 6282的氨基酸脱羧酶活性,结果发现,菌株CICC 6282的精氨酸双水解酶、赖氨酸脱羧酶和鸟氨酸脱羧酶活性均为阴性。其中精氨酸在精氨酸双水解酶作用下生产鸟氨酸,鸟氨酸经过鸟氨酸脱羧酶作用生成腐胺[36]。蛋白质腐败时赖氨酸在赖氨酸脱羧酶的作用下发生脱羧反应生成尸胺[37]。尸胺与腐胺可以用来评价食品的新鲜或腐败程度,其含量可作为卫生质量的指标,而且食品中的尸胺被认为有潜在的危险,对人体有排斥作用,腐胺则可以引起人体各种不良反应[38-39]。结果表明,菌株CICC 6282能够降低产品中生物胺含量,具有一定发酵安全性。
2.2.5 抑菌活性试验
有研究发现,大肠埃希氏菌在低酸环境适应一段时间后,会对强酸环境产生耐受性,同时其耐热性、耐低温与耐渗透压的能力也会有所增强[40]。因此检测耐乙醇片球菌CICC 6282发酵上清液对大肠埃希氏菌抑制作用,结果见图6。由图6可知,耐乙醇片球菌CICC 6282周围有明显的透明抑菌圈,抑菌圈直径为23 mm,说明菌株CICC 6282发酵上清液能够抑制大肠埃希氏菌生长,能够有效预防发酵蔬菜受到大肠埃希氏菌污染。
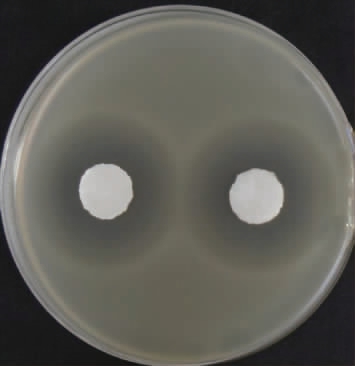
图6 菌株CICC 6282抑制大肠埃希氏菌生长试验结果
Fig.6 Tests results of inhibition of strain CICC 6282 on Escherichia coli growth
2.3 发酵辣椒品质的分析
2.3.1 pH值及总酸含量的测定
辣椒发酵过程中pH值及总酸含量的变化见图7。由图7可知,随着发酵时间的延长,自然发酵和接种发酵辣椒的pH值均呈下降趋势,且接种发酵辣椒的pH值始终低于自然发酵。自然发酵4 d后pH值下降至4.4,发酵7 d后pH值为4.3;而接种发酵开始后,辣椒的pH迅速下降,发酵4 d后pH值下降至4.1,发酵7 d后pH值为4.0。由图7亦可知,发酵辣椒总酸含量的变化趋势与pH值变化趋势正好相反,且接种发酵辣椒的pH值始终高于自然发酵,发酵7 d时,自然发酵辣椒和接种发酵辣椒的总酸含量分别为4.93 g/kg、5.53 g/kg。这与韩宏娇等[41]的结果基本一致。结果表明,接种菌株CICC 6282后,菌株CICC 6282快速生长、产酸,导致pH值下降,总酸含量增加。
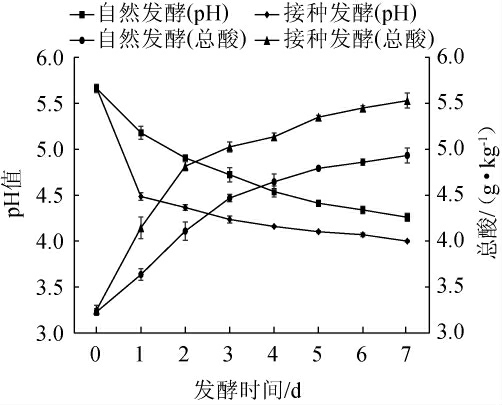
图7 辣椒发酵过程中pH值与总酸含量的变化
Fig.7 Changes of pH and total acid contents of during chili fermentation process
2.3.2 亚硝酸盐含量的测定
辣椒发酵过程中亚硝酸盐含量的变化见图8。由图8可知,随着发酵时间的延长,自然发酵和接种发酵辣椒的亚硝酸盐含量均呈现先上升后下降的趋势,发酵第2天出现亚硝酸盐峰,接种菌株CICC 6282发酵辣椒中的亚硝酸盐含量为5.26 mg/kg,自然发酵辣椒中的亚硝酸盐含量为7.22 mg/kg,发酵7 d时,自然发酵辣椒中的亚硝酸盐含量为3.31 mg/kg,接种菌株CICC 6282发酵辣椒中的亚硝酸盐含量为0.71 mg/kg,说明接种菌株CICC 6282可以降低发酵辣椒中亚硝酸盐含量,进一步提高安全性。
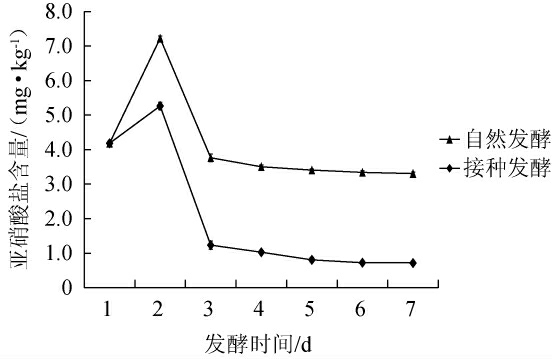
图8 辣椒发酵过程中亚硝酸盐含量的变化
Fig.8 Changes of nitrite contents during chili fermentation process
2.3.3 生物胺的测定
发酵辣椒中生物胺种类及含量的测定结果见表2。由表2可知,自然发酵辣椒中的生物胺总量为194.41 mg/kg,接种菌株CICC 6282发酵辣椒中的生物胺总量为84.29 mg/kg,相比自然发酵辣椒降低了57%。自然发酵辣椒中检出尸胺、腐胺、苯乙胺、组胺、酪胺与亚精胺6种生物胺;而在接种菌株CICC 6282发酵辣椒中仅检出组胺、酪胺与亚精胺3种生物胺,未检出尸胺、腐胺与苯乙胺。除尸胺、腐胺能够给人体带来不良影响外,人体摄入过量苯乙胺也可导致偏头痛[42]。接种发酵辣椒中未检出尸胺、腐胺这与菌株CICC 6282氨基酸脱羧酶结果呈阴性相呼应。有研究现,发酵过程中能够产生苯乙胺的常见细菌多为乳杆菌属[43],这也与本研究结果一致。结果表明,耐乙醇片球菌CICC 6282是一种更有效降低生物胺含量的发酵菌株。
表2 发酵辣椒中生物胺种类及含量的测定结果
Table 2 Determination results of species and contents of biogenic amines in fermented chili
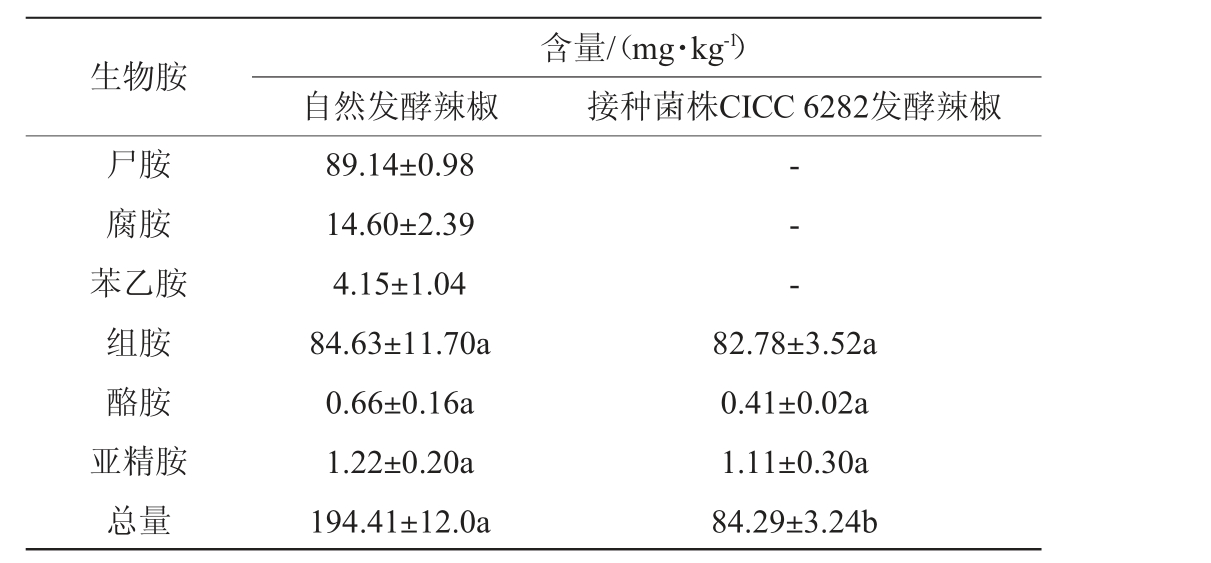
注:“-”表示未检出;同行不同小写字母表示差异显著(P<0.05)。
生物胺尸胺腐胺苯乙胺组胺酪胺亚精胺总量含量/(mg·kg-1)自然发酵辣椒 接种菌株CICC 6282发酵辣椒89.14±0.98 14.60±2.39 4.15±1.04 84.63±11.70a 0.66±0.16a 1.22±0.20a 194.41±12.0a-- -82.78±3.52a 0.41±0.02a 1.11±0.30a 84.29±3.24b
3 结论
通过形态观察、生理生化实验及分子生物学技术将分离自新疆传统发酵辣椒中的乳酸菌菌株CICC 6282鉴定为耐乙醇片球菌(Pediococcus ethanolidurans),该菌株具有盐(8%NaCl)、酸(pH 4.0)耐受力强、生长速度快、降解亚硝酸盐、抑制大肠埃希氏菌生长、精氨酸双水解酶、赖氨酸脱羧酶和鸟氨酸脱羧酶阴性等良好的发酵特性与安全特性。接种菌株CICC 6282发酵辣椒,能提高发酵辣椒中的总酸含量(5.53 g/kg),降低亚硝酸盐含量(0.71 mg/kg)及生物胺总量(84.29 mg/kg),且在发酵辣椒中未检测到尸胺、腐胺、苯乙胺。本研究结果证明了利用耐乙醇片球菌CICC6282作为发酵菌剂的可行性,同时可以提高发酵辣椒安全性,为发酵辣椒工业化生产提供基础。
[1]史婷,高甜甜,刘伟,等.不同发酵剂对剁辣椒品质的影响[J].食品与发酵工业,2022,48(15):144-153.
[2]MISIHAIRABGWI J,CHEIKHYOUSSEF A.Traditional fermented foods and beverages of Namibia[J].J Ethnic Foods,2017,4(3):145-153.
[3]陈援援,牛文秀,马凯华,等.接种乳酸菌发酵剂对风干肠加工过程中理化性质及安全品质的影响[J].食品工业科技,2022,43(8):148-156.
[4]张永生,刘冬敏,王建辉,等.植源性天然产物在食品中降生物胺作用研究进展[J].食品科学,2022,43(3):315-324.
[5]黄舞钰,龚福明,何彩梅.剁椒天然发酵工艺优化[J].安徽农业科学,2021,49(10):153-156.
[6]张郁松.发酵辣椒不同处理工艺的对比研究[J].食品工业,2023,44(6):48-50.
[7]蔡鹏.直投式发酵小米辣关键技术研究[D].南昌:南昌大学,2023.
[8]杨晓.怀集黄菜关键发酵微生物和接种发酵品质控制研究[D].广州:华南理工大学,2022.
[9]颜宇鸽.产香酵母与植物乳植杆菌混菌发酵对遵义辣椒酱品质提升研究[D].重庆:西南大学,2023.
[10]王雪雅,吴华丽,丁筑红,等.纯种乳酸菌接种发酵辣椒综合品质特性研究[J].中国酿造,2016,35(9):119-124.
[11]夏学超,于金换,曲桂武.强化发酵对辣椒中生物胺及理化指标影响的研究[J].食品科技,2021,46(10):13-18.
[12]王晓雯,蒋彩虹,卢士玲,等.耐受乙醇乳酸菌诱变的研究[J].中国酿造,2015,34(10):32-36.
[13]LIU L,ZHANG B,TONG H,et al.Pediococcus ethanolidurans sp.nov.,isolated from the walls of a distilled-spirit-fermenting cellar[J].Int J Syst Evol Micr,2006,56(10):2405-2408.
[14] FRANCO W,PÉREZ-DÍAZ I M.Role of selected oxidative yeasts and bacteria in cucumber secondary fermentation associated with spoilage of the fermented fruit[J].Food Microbiol,2012,32(2):338-344.
[15] LI Y, LUO X, LONG F, et al.Quality improvement of fermented chili pepper by inoculation of Pediococcus ethanolidurans M1117:Insight into relevance of bacterial community succession and metabolic profile[J].LWT-Food Sci Technol,2023,179:114655.
[16]凌空,翟磊,姚粟,等.新疆传统发酵食品中乳酸菌的分离鉴定及其生长代谢特性[J].食品与发酵工业,2017,43(3):123-129.
[17]傅奇,林俊杰,庄峙厦,等.一株海洋来源蛋白酶产生菌Parengyodontium album HX2019006的鉴定及其发酵条件研究[J].食品与发酵工业,2020,46(10):185-190.
[18]刘莉颖,宋天霖,周艺萍,等.青海传统发酵牦牛乳制品中乳酸菌资源发掘及评价[J].食品与发酵工业,2021,47(18):70-76.
[19]TAMURA K,DUDLEY J,NEI M,et al.MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Mol Biol Evol,2007,24(8):1596-1599.
[20]代超凡,李兰兰,旭日花,等.响应面法优化乳酸菌产抗真菌物质的培养条件[J].畜牧与饲料科学,2020,41(5):1-7.
[21]郭艳霞,杨承剑,彭开屏,等.甘蔗尾中乳酸菌的分离筛选和鉴定[J].草业科学,2019,36(2):548-555.
[22]杨俊俊.西藏牦牛奶渣中微生物的分离鉴定及优良乳酸菌的筛选[D].杨凌:西北农林科技大学,2014.
[23]薛元泰,吴世芳,李义恒,等.八种精油对乳酸菌及致病菌的选择抑制性筛选及其应用研究[J].食品与发酵工业,2022,48(23):124-131.
[24]郭志华,王聪,陈红玲.红茶菌中降解亚硝酸盐乳酸菌的筛选、鉴定及其功能特性[J].中国食品学报,2021,21(8):309-316.
[25]国家卫生和计划生育委员会,国家食品药品监督管理总局.GB4789.43—2016 食品安全国家标准食品微生物学检验微生物源酶制剂抗菌活性的测定[S].北京:中国标准出版社,2016.
[26]李文青,罗凤莲,曾希珂,等.多菌种接种发酵生产低盐剁辣椒的工艺优化[J].现代食品科技,2019,35(1):206-214.
[27]白芸,蓝伟杰,林莹.广西红糟酸的营养与安全性评价[J].食品工业,2020,41(11):340-344.
[28]邢旋,任清.黄酒麦曲中一株产细菌素菌株的鉴定及其降生物胺功效研究[J].食品科学技术学报,2019,37(2):56-62.
[29]焦时阳,王晓彤,侯玉新,等.柿子醋醪中优良乳酸菌的筛选及其耐受性和功能性分析[J].食品工业科技,2023,44(8):161-169.
[30]谷懿寰,江正强,刘军,等.奶豆腐中戊糖片球菌的分离鉴定及其产胞外多糖的益生活性[J].食品与发酵工业,2022,48(9):84-90.
[31]IUCHI A,HARUGUCHI S,MONGKOLTHANARUK W,et al.Characterization of novel amylase from amylolytic lactic acid bacteria Pediococcus ethanolidurans isolated from Japanese pickles(nuka-zuke)[J].Food Sci Technol Res,2012,18(6):861-867.
[32]董硕,孟宪军,张庆芳.乳酸菌发酵蔬菜菌体生长规律的研究[J].中国调味品,2010,35(11):59-62.
[33]田辉,马卓,陈嘉祎,等.短乳杆菌与植物乳杆菌的发酵特性[J].微生物学通报,2023,50(2):802-814.
[34]赵海霞,吴丹,王晓蕾,等.降解亚硝酸盐乳酸菌的筛选及其在菜用枸杞浆水发酵中的应用[J].中国酿造,2022,41(11):113-119.
[35]张殿伟,张玉华,马元辰,等.发酵食品中生物胺检测技术研究进展[J].食品安全质量检测学报,2023,14(20):140-151.
[36]宋颖,董全.黄酒中生物胺的形成与控制研究进展[J].食品工业科技,2016,37(8):387-391.
[37]赵柄舒,王梦竹,陈丹丹,等.臭鳜鱼中氨基酸产生菌的分离鉴定及其加工特性评价[J].食品与发酵工业,2020,46(9):195-200.
[38]张敏,吴俊铨,姚嘉文,等.基于变性血红蛋白和二胺氧化酶的生物传感器检测马鲛鱼中的尸胺[J].食品科学,2020,41(18):288-295.
[39]毛顺,李蕊婷,卢士玲.NaCl对德氏乳杆菌AGDI基因转录及产腐胺的影响[J].食品工业科技,2018,39(15):96-101,107.
[40]韩吉娜,罗欣,朱立贤,等.大肠埃希氏菌的诱导耐酸响应及其交叉保护作用机制研究进展[J].食品科学,2023,44(11):214-221.
[41]韩宏娇,丛敏,李欣蔚,等.自然发酵酸菜化学成分含量和微生物数量的动态变化及其相关性分析[J].食品工业科技,2019,40(2):148-153.
[42]赵晓娟,周婵媛,张敏,等.电流-时间曲线法测定鱼露中的苯乙胺[J].食品科学,2019,40(12):340-344.
[43]唐小曼,唐垚,张其圣,等.传统发酵蔬菜中生物胺的研究进展[J].食品工业科技,2019,40(15):345-348.