心血管疾病(cardiovascular diseases,CVDs)是一种常见的易致死疾病,根据世界卫生组织(world health organization,WHO)提供的数据,心血管疾病每年夺去1 790万人的生命,占全球死亡人数的31%[1]。目前,我国约有心血管病患者3.3亿,心血管病死亡率占居民疾病死亡构成的44%以上,高于肿瘤及其他疾病。而血栓形成是导致心血管疾病中缺血性脑卒中、心肌梗死和静脉血栓栓塞症等的主要原因[2],多年来,抗凝剂如华法林、达比加群和利伐沙班等被用于溶解血凝块[3]。然而,这些药物除了生产成本高外,还存在不良反应,如出血、食管炎、心肌梗死、肝损伤等[4-5]。另外,纤溶酶原激活剂,如尿激酶、链激酶和组织型纤溶酶原激活剂也被用于治疗血栓。但是,这些治疗方法均有报道过会导致出血等致命并发症[6]。由于这些不良副作用,新一代的溶栓药物应具备安全性好、副作用少、半衰期长、价格便宜、溶栓效率高等优势。近些年,天然来源的纤溶酶被广泛研究,其在溶栓治疗中变得非常重要。
纤溶酶是一种蛋白水解酶,能有效降解纤维蛋白(血栓),是纤溶系统中重要的组成部分[7]。在人体正常生理状态下,纤维蛋白的降解和形成过程是一种稳态的平衡。然而当这种稳态被破坏,纤维蛋白不能及时水解而聚集,就会促进血栓形成,诱发心肌梗死、缺血性脑卒中和动脉粥样硬化等疾病的发生[8]。因此,在溶栓治疗中,能快速溶解血栓并重新恢复正常血流尤为重要。
近年来有许多学者对自然来源的纤溶酶进行了大量研究,主要集中在酶的来源、生产工艺、分离纯化、理化性质、酶的应用和酶的体内外溶栓效果等方面,这为开发安全性高、疗效好、价格低廉的天然溶栓药物奠定了基础,拓宽了纤溶酶高值化利用的新途径。本文综述了血栓形成及纤溶酶的作用机制,总结了纤溶酶的来源(海洋微生物、发酵食品微生物、植物和动物)和生产方法,旨在推动纤溶酶的发展和应用,使其成为一种具备增值潜力的资源提供理论参考。
1 血栓形成和纤溶酶的作用机制
1.1 血栓形成机制
纤溶酶的主要作用是溶解血栓,因此在讨论纤溶酶的来源之前,有必要探讨血栓形成和纤溶酶的作用机制。血栓形成是指血管内限制或阻塞血流的病理性凝块形成,其与血液凝固密切相关[9]。血栓形成主要有两种类型,静脉血栓和动脉血栓。静脉血栓也被称为红血栓,富含血细胞,与内皮功能障碍和凝血系统激活有关;动脉血栓形成与血小板活化有关,被称为白血栓。血栓的形成主要包括血小板的粘附聚集和凝血级联反应过程。当血管内皮细胞的结构和功能受到破坏时,许多粘附大分子被暴露在血液中,与血小板表面受体糖蛋白相互作用,之后血小板整合素构象的转变触发血小板积累和聚集,促成血栓的形成。凝血级联包含三种途径(外源性凝血途径、内源性凝血途径和共同途径)[10]。在凝血途径中,每个凝血因子由一种酶原组成,酶原通过上游活化的凝血因子转化为活性酶。外源性凝血途径涉及凝血因子I、II、VII和X等,始于组织因子(tissue factor,TF)和激活的凝血因子VII,直接诱导凝血因子X和凝血酶原的按序激活。内源性凝血途径则始于凝血因子XII的裂解,最后形成因子Xa。当因子Xa由内源性或外源性途径形成时,需要另一种共同途径来形成纤维蛋白网。在共同途径中,凝血酶原首先被Xa激活为凝血酶,凝血酶激活纤维蛋白原形成纤维蛋白。同时,血小板粘附在受损的血管上,纤维蛋白与血小板一起聚集,血栓形成[11]。
1.2 纤溶酶作用机制
血栓溶解是指粘附在血小板周围的纤维蛋白网络的溶解,包括纤溶酶原被激活的间接作用机制和由纤溶酶类酶引起的直接作用机制。通常来说,间接作用机制是正常生理过程,主要是组织型纤溶酶原激活物(tissue-type plasminogen activator,t-PA)或尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator,u-PA)激活纤溶酶原为纤溶酶,另一方面,直接作用机制是纤溶酶直接降解纤维蛋白网状结构。最终,纤溶酶将纤维蛋白降解为可溶性纤维蛋白降解产物[9]。一些溶栓药物,如尿激酶、链激酶和葡激酶等都属于纤溶酶原激活剂,它们通过激活纤溶酶原转变为纤溶酶降解纤维蛋白;纳豆激酶和蚓激酶等可以直接水解纤维蛋白网,使血栓溶解[12]。
2 纤溶酶的来源
2.1 微生物
2.1.1 海洋微生物
海洋微生物是纤维蛋白溶解酶的重要资源,产纤溶酶海洋微生物的来源、种类及所产纤溶酶的特性见表1,它们大部分是细菌,所产酶的类型为丝氨酸蛋白酶,且纤溶酶活性在一定范围内维持稳定。ZHAO L H等[13]从海洋衍生的真菌杂色曲霉(Aspergillus versicolor)中鉴定出一种新的双功能纤溶酶,其分子质量为37.3 kDa,在温度40.0 ℃和pH 5.0时表现出最大酶活性,并且该酶还显示出溶栓和抗凝双重活性。为了提高纤溶酶的产量,降低成本,满足工业化生产,PANSH等[14]从海洋微生物中分离出一种细菌枯草芽孢杆菌(Bacillus subtilis)D21-8,经过其发酵工艺参数优化,获得酶活力高达3 787 U/mL。庞光武等[15]对来自海洋的枯草芽孢杆菌LC6-1进行紫外诱变得到突变菌株PW6-3,并对培养基组分优化,菌株PW6-3产酶量较之前提高了72.53%。总体来说,芽孢杆菌属的海洋微生物是生产纤维蛋白溶解酶的重要资源。
表1 产纤溶酶海洋微生物的来源、种类及所产纤溶酶的特性
Table 1 Sources, species and characteristics of fibrinolytic enzymes produced by fibrinolytic enzyme producing marine microorganisms

产纤溶酶微生物来源 微生物 微生物种类印度西南海岸各地海洋中的褐管海绵阿拉伯海岸采集的海水印度东南海岸的土壤样本南海北部湾各地印度西部海岸弯曲芽孢杆菌(Bacillus flexus)放射性链霉菌VITSD8(Streptomyces radiopugnans)VITSD8粘质沙雷氏菌(Serratia marcescens subsp.)红色链霉菌VITPSS1(Streptomyces rubiginosus)VITPSS1贝莱斯芽孢杆菌Z01(Bacillus velezensis)Z01枯草芽孢杆菌ICTF-1(Bacillus subtilis)ICTF-1细菌细菌细菌细菌细菌细菌纤溶酶名称 类型 pH值和温度 分子质量参考文献---Sakuensis-Velefibrinase-丝氨酸蛋白酶丝氨酸金属蛋白酶-丝氨酸金属蛋白酶丝氨酸蛋白酶8.0;50.0 ℃7.0;33.0 ℃7.0;55.0 ℃7.2;37.0 ℃7.0;40.0 ℃9.0;50.0 ℃32.0 kDa 38.0 kDa 43.0 kDa 45.0 kDa 32.3 kDa 28.0 kDa[16][17][18][19][20][21]
2.1.2 发酵食品微生物
发酵食品中的微生物已被证明是纤溶酶的重要来源,翁美芝等[22]在淡豆豉发酵过程中筛选鉴定出3种产纤溶酶的优势菌株,分别是枯草芽孢杆菌、嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)和微球菌(Micrococcus),并用纯种液体发酵发现枯草芽孢杆菌的酶活力达527.49IU/mL。KIM C等[23]在韩国发酵食物中发现腌鱼中存在纤溶酶活性,通过凝胶过滤和离子交换色谱法纯化了两种名为JP-I和JP-II的新型纤溶酶,其分子质量均为36.0 kDa;纤溶酶JP-I在50.0 ℃和pH 8.1时溶解活性最高,而JP-II在45.0 ℃和pH 9.9时活性最高,且两种酶在较宽的pH值范围内表现稳定。在印度尼西亚的纳豆中分离出一种细菌枯草芽孢杆菌G8,利用全血凝块溶解、优球蛋白凝块溶解和纤维蛋白平板法与纳豆激酶进行比较,发现枯草芽孢杆菌G8所产纤溶酶能够溶解全血和优球蛋白凝块,且枯草芽孢杆菌G8的粗提取物显示出六个酶谱带:42.0 kDa、35.5 kDa、30.8kDa、26.7kDa、20.0 kDa和13.7 kDa,尤其是在20.0 kDa处观察到最强活性[24]。这些研究大部分集中在从传统发酵食品发酵过程中,分离出来的微生物生产蛋白酶上,其中一些蛋白酶能水解食品中富含的蛋白质,从而为其生长提供营养物质;一些蛋白酶能降解纤维蛋白,使发酵食品具有纤溶活性,产纤溶酶发酵食品微生物的来源、种类及所产纤溶酶的特性见表2。发酵食品中发现的微生物大部分是细菌,尤其是芽孢杆菌,因其分布广泛且安全性好,被认为是最常见的蛋白酶生产者[25]。虽然已经发现了发酵食品中许多微生物能生产纤溶酶,但对微生物的研究还是较少,微生物在食品发酵过程中产生对纤维蛋白具有特异性活性的纤溶酶机理还有待进一步研究。
表2 产纤溶酶发酵食品微生物的来源、种类及所产纤溶酶的特性
Table 2 Sources, species and characteristics of fibrinolytic enzymes produced by fibrinolytic enzyme producing fermented foods
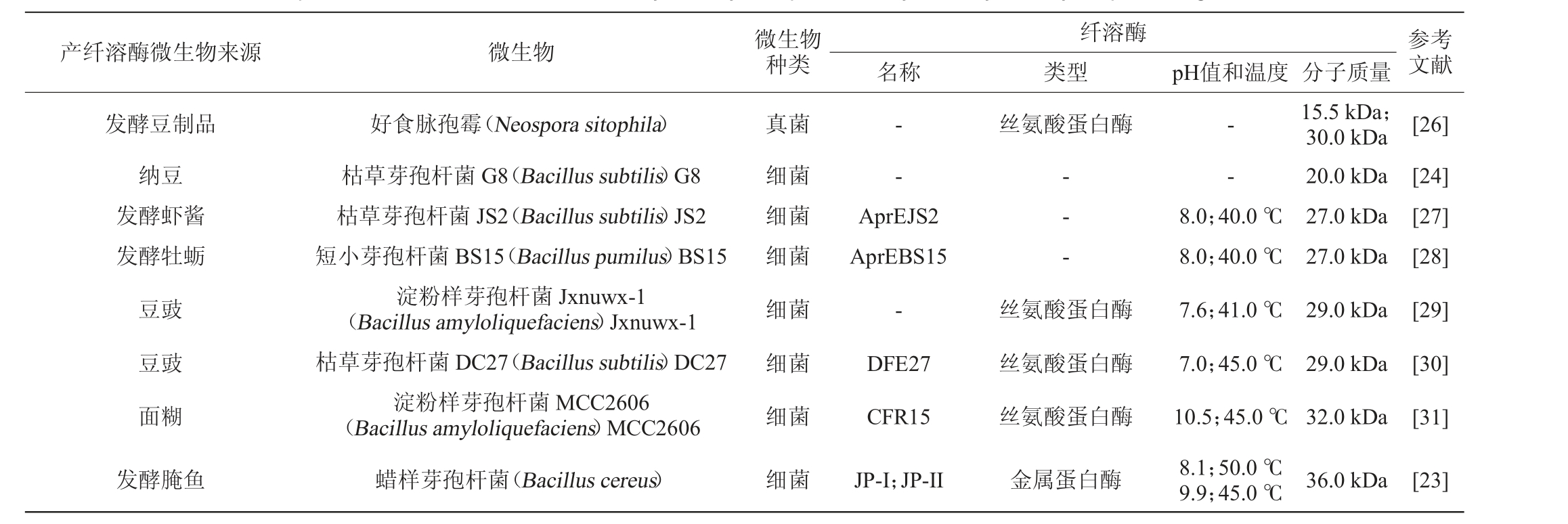
产纤溶酶微生物来源 微生物 微生物种类发酵豆制品纳豆发酵虾酱发酵牡蛎豆豉豆豉面糊真菌细菌细菌细菌细菌细菌细菌发酵腌鱼好食脉孢霉(Neospora sitophila)枯草芽孢杆菌G8(Bacillus subtilis)G8枯草芽孢杆菌JS2(Bacillus subtilis)JS2短小芽孢杆菌BS15(Bacillus pumilus)BS15淀粉样芽孢杆菌Jxnuwx-1(Bacillus amyloliquefaciens)Jxnuwx-1枯草芽孢杆菌DC27(Bacillus subtilis)DC27淀粉样芽孢杆菌MCC2606(Bacillus amyloliquefaciens)MCC2606蜡样芽孢杆菌(Bacillus cereus)细菌纤溶酶名称 类型 pH值和温度 分子质量参考文献--丝氨酸蛋白酶--AprEJS2 AprEBS15-DFE27 CFR15-- -丝氨酸蛋白酶丝氨酸蛋白酶丝氨酸蛋白酶15.5 kDa;30.0 kDa 20.0 kDa 27.0 kDa 27.0 kDa 29.0 kDa 29.0 kDa 32.0 kDa[26][24][27][28][29][30][31]JP-I;JP-II 金属蛋白酶8.0;40.0 ℃8.0;40.0 ℃7.6;41.0 ℃7.0;45.0 ℃10.5;45.0 ℃8.1;50.0 ℃9.9;45.0 ℃36.0 kDa [23]
2.2 植物
一些研究表明,植物提取物或分离化合物能促进纤维蛋白溶解,如石蒜、乌头叶花棘麻和刺猬黄瓜等[32-35]。AHAMED N A等[36]从植物芦荟的根中分离出产生纤溶酶的内生菌株,经过培养基组分优化发现,牛肉和酵母提取物能提高纤溶酶的产量,Ca2+和Mg2+能够增加纤溶酶的产生。在一项随机交叉实验中,给与人体干大蒜粉(900 mg/d;持续14日;安慰剂对照研究)后t-PA活性增加,但纤溶酶原激活物抑制剂1(plasminogen activator inhibitor-1,PAI-1)和纤维蛋白原水平不受影响[37]。这些产纤溶酶植物的来源广泛,种类较多,其所产纤溶酶大部分属于丝氨酸蛋白酶家族,分离得到的纤溶酶大部分来源于传统草药(见表3)。它们在体外实验中表现出较高的纤溶酶活力和较好的特异性,但这些实验观察到的结果可能是植物蛋白酶的存在,又或者可能是植物材料中存在的各类植物化学物质,对纤维蛋白溶解酶调节的结果。在整个生物体的水平上,促进纤维蛋白溶解或抗血栓形成作用的分子机制非常复杂。植物来源的物质能够影响止血系统的不同成分[38],包括刺激纤维蛋白溶解系统、调节凝血级联反应和血小板活性等。
表3 产纤溶酶植物的来源、种类及所产纤溶酶的特性
Table 3 Sources, species and characteristics of fibrinolytic enzymes produced by fibrinolytic enzyme producing plants
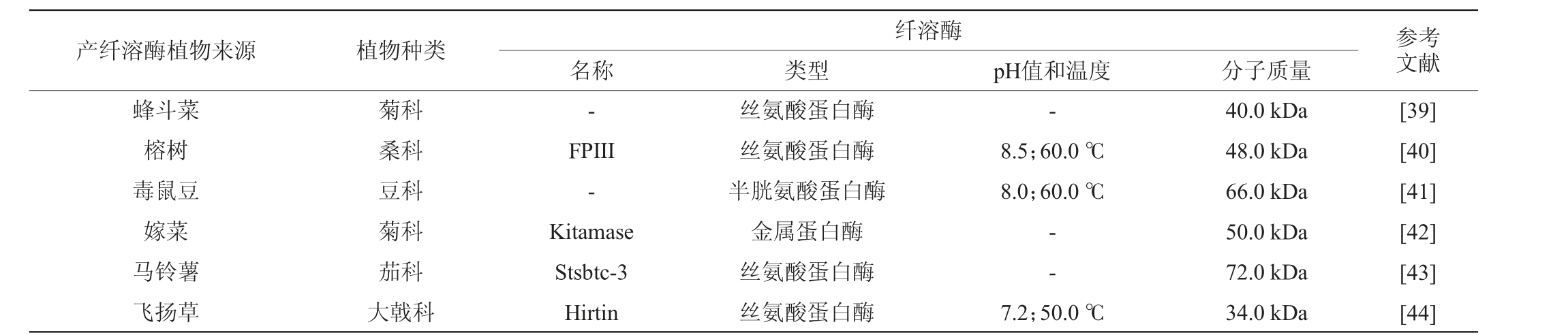
产纤溶酶植物来源 植物种类 参考文献纤溶酶名称 类型 pH值和温度 分子质量蜂斗菜榕树毒鼠豆嫁菜马铃薯飞扬草菊科桑科豆科菊科茄科大戟科--FPIII-Kitamase Stsbtc-3 Hirtin丝氨酸蛋白酶丝氨酸蛋白酶半胱氨酸蛋白酶金属蛋白酶丝氨酸蛋白酶丝氨酸蛋白酶8.5;60.0 ℃8.0;60.0 ℃--7.2;50.0 ℃40.0 kDa 48.0 kDa 66.0 kDa 50.0 kDa 72.0 kDa 34.0 kDa[39][40][41][42][43][44]
2.3 动物
蛇的毒液是纤溶酶的重要来源,能直接降解纤维蛋白,临床研究表明其给药后,溶栓效果好[45]。但由于其来源特殊,制作工艺不同,保存运输费用高,质量难以控制,因此在临床上,其应用少于其他同类溶栓药物。蚓激酶是从蚯蚓中提取的一组蛋白水解酶。据报道,健康成人服用蚓激酶较安全[46],但是其治疗作用相对较慢。水蛭素是从水蛭中分离出来的一种纤溶酶。REN K Y等[47]研究重组葡萄激酶-水蛭素融合蛋白的体外凝血模型和动物模型发现其溶栓效果明显,可以预防和减少溶栓后的再栓塞,降低抗凝药物联合用引起的出血副作用。但由于水蛭口服的吸收效果较差,在鼻腔给药方面的研究较多[48]。XAVIER M A等[49]在寄生虫的体内发现了一种蛋白质BmCL1,通过基因重组BmCL1发现其能利用Aα和Bβ链水解纤维蛋白原。综上,动物来源的纤溶酶研究较多(见表4),它们所产纤溶酶的分子量较小,尤其是蚯蚓来源的纤溶酶分子质量最小为14.0 kDa;扇头蜱、宽体金线蛭和蝮蛇在pH值为7.5~8.0时产生的纤溶酶活性较高,但是一些动物来源的纤溶酶作用方式不同,仍然需要进行全面系统的研究。
表4 产纤溶酶动物的来源、种类及所产纤溶酶的特性
Table 4 Sources, species and characteristics of fibrinolytic enzymes produced by fibrinolytic enzyme producing animals
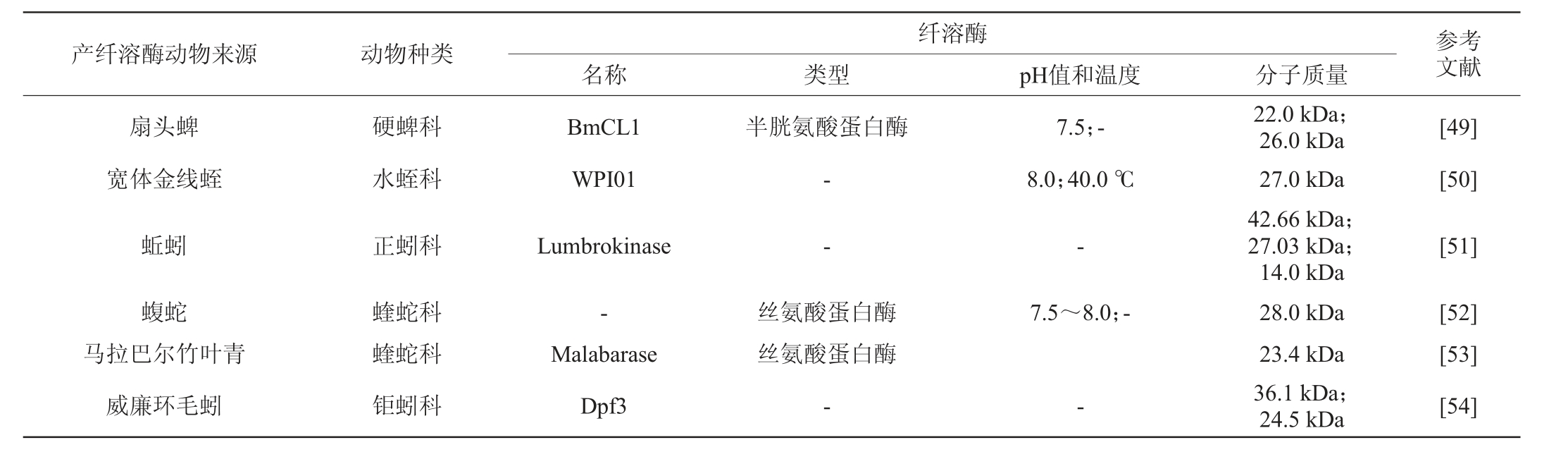
纤溶酶名称 类型 pH值和温度 分子质量扇头蜱宽体金线蛭产纤溶酶动物来源 动物种类 参考文献硬蜱科水蛭科BmCL1 WPI01半胱氨酸蛋白酶7.5;-8.0;40.0 ℃[49][50]蚯蚓正蚓科Lumbrokinase---[51][52]马拉巴尔竹叶青威廉环毛蚓蝮蛇蝰蛇科-丝氨酸蛋白酶7.5~8.0;-22.0 kDa;26.0 kDa 27.0 kDa 42.66 kDa;27.03 kDa;14.0 kDa 28.0 kDa蝰蛇科钜蚓科Malabarase Dpf3丝氨酸蛋白酶--23.4 kDa 36.1 kDa;24.5 kDa[53][54]
3 纤溶酶生产方法
3.1 发酵法
在发酵工艺中,高产纤溶酶的重要因素就是对固态发酵和液态发酵的方法进行优化,包括菌种的选择,经济环保的培养基,发酵条件中的营养(碳源、氮源和金属离子源)、pH值、温度和时间等。王明瑞等[55]以玉米粉为主要培养基对蛹虫草进行固态发酵,优化发酵参数后,蛹虫草所产纤溶酶在血纤维蛋白平板上形成的溶解圈面积为169.34 mm2。MOHARAM M E等[56]用枯草芽孢杆菌Egy进行固态发酵生产纤溶酶,优化发酵条件后枯草芽孢杆菌产生的纤溶酶活力达141.02 U/g,且体内细胞毒性评估实验结果显示,在治疗后的前24 h内老鼠没有死亡,肝脏和肾脏的组织病理学检查显示结构正常。在优化发酵过程中,影响因素非常多,为了使实验更具合理性,通常采用两种或两种以上的方法组合使用。除了优化发酵培养基和发酵条件外,微生物固定化发酵也可用于提高酶的产率。GUO N等[57]用磁性固定的方法将纳豆芽孢杆菌(Bacillus natto)固定在银杏种子上,以银杏发酵种子的纤维蛋白溶解活性为参数,通过Plackett-Burman和Box-Behnken设计方法进行优化后纤溶酶活性达到(3 175±43)IU/g。虽然获取纤溶酶的发酵方法在不断优化和改进,但对于工业化生产来说,纤溶酶产量仍然很低,且影响该过程产酶量的因素非常多。
3.2 生物技术法
针对目前需要大量生产纤溶酶来说,低成本、效率高的重组技术生产纤溶酶的方法受到广泛关注。生物技术法的应用主要包括两个方面,提高纤溶酶的产量以及菌株在发酵剂培养中的纤溶活性。ZOU Y等[58]开发应用了一体化质粒CRISPR-Cas9系统,用于枯草芽孢杆菌的迭代基因组编辑,只需要一个质粒转化和固化,就能加速基因组编辑的周期,且使用该系统连续敲除两个细胞外蛋白酶基因epr和bpr,2.5 d就能完成一轮基因组编辑,采用工程菌株表达豆豉纤溶解酶DFE27,纤溶酶活性达到159.5 FU/mL。YAN G B等[59]使用毕赤酵母(Pichia pastoris)异源表达系统表达来自纳豆枯草芽孢杆菌(B.subtilis natto)NK-Bs的纳豆激酶,构建携带1~7个纳豆枯草芽孢杆菌的aprN基因拷贝的表达菌株,当靶蛋白的表达水平在靶基因的五个拷贝处达到最大值,同时将携带单个aprN基因拷贝的毕赤酵母用于摇瓶和高密度发酵,结果显示摇瓶发酵的蛋白产量为320 mg/L,高密度发酵的蛋白产量约为9.5 g/L,且重组纳豆激酶表现出较高的热稳定性和pH稳定性。除了应用外源表达来提高纤溶酶的产率之外,也可以通过突变和蛋白质工程等方法对产纤溶酶的微生物进行修饰。HAN L C等[60]用甘油作为碳源,用抗终结蛋白GlpP及其靶序子PglpD在枯草芽孢杆菌中构建高效的甘油诱导表达系统(glycerolinducible expression system,GIES),枯草芽孢杆菌通过对葡萄糖和甘油的顺序利用,GIES能够以自诱导的方式表达基因,其中甘油的浓度可调节基因表达的强度,葡萄糖的浓度既影响诱导的时间,也影响基因表达的强度,GIES也进一步应用于纳豆激酶的高产量生产。总而言之,现代分子技术为发现新的纤溶酶以及改善其催化性能提供了良好的机会,生物技术工具对纤溶酶的可持续生产发挥了重要作用。
4 总结与展望
纤溶酶潜在的医学价值较高,来源广泛,包括微生物、植物和动物,其中微生物来源中的细菌是产纤溶酶的主要来源。到目前为止,纤溶酶生产方法仍处于研究阶段,还存在许多问题。第一,纤溶酶质量评价还有待提高,其评价目前主要依赖于酶活性的测定,尚不全面,应结合其在不同温度、pH值等影响因素下的稳定性评价,将更有利于纤溶酶的开发利用。第二,需要从野生菌株中发现具有耐酸性、耐高温以及对纤维蛋白有较强特异性等生物化学特性的纤溶酶,或通过基因工程和蛋白工程等方法在工程菌株中进行改进。第三,纤溶酶的生产成本很高,因此需要寻求更为经济可行的方法,从而科学指导纤溶酶产业的升级,提高经济效益。未来可考虑在其他不同领域深入研究,开发研究新型产品,通过技术革新,提高产品质量。
[1] SHARMA C,OSMOLOVSKIY A,SINGH R.Microbial fibrinolytic enzymes as anti-thrombotics: production, characterisation and prodigious biopharmaceutical applications[J].Pharm,2021,13(11):1880.
[2]马丽媛,王增武,樊静,等.《中国心血管健康与疾病报告2021》概要[J].中国介入心脏病学杂志,2022,30(7):481-496.
[3]ADEBOYEJE G,SYLWESTRZAK G,BARRON J J,et al.Major bleeding risk during anticoagulation with warfarin,dabigatran,apixaban,or rivaroxaban in patients with nonvalvular atrial fibrillation[J].J Manag Care Spec Pharm,2017,23(9):968.
[4] LIN S, WANG Y, ZHANG L, et al.Dabigatran must be used carefully:literature review and recommendations for management of adverse events[J].Drug Des Devel Ther,2019,13:1527-1533.
[5]CHRISTOPOULOU E C,FILIPPATOS T D,ELISAF M S.Non-hemorrhage-related adverse effects of rivaroxaban[J].Arch Med Sci Atheroscler Dis,2017,2:108-112.
[6]ZAPATA-WAINBERG G,QUINTAS S,RICO A X,et al.Prognostic factors and analysis of mortality due to brain haemorrhages associated with vitamin K antagonist oral anticoagulants.results from the TAC registry[J].Neurologia (Engl Ed),2018,33(7):419-426.
[7]于洪远,景淑贤,景倩.血栓分子标志物与急性缺血性脑卒中病情严重程度及溶栓预后的相关性[J].现代生物医学进展,2023,23(8):1506-1510.
[8]LIU H K,PIETERSZ G,PETER K,et al.Nanobiotechnology approaches for cardiovascular diseases:site-specific targeting of drugs and nanoparticles for atherothrombosis[J].J Nanobiotechnol,2022,20(1):75.
[9]MOULA A A,BAVISETTY S C B.Purification,physicochemical properties,and statistical optimization of fibrinolytic enzymes especially from fermented foods:A comprehensive review[J].Int J Biol Macromol,2020,163:1498-1517.
[10] CARNEY E F.Thrombosis: new mechanism of thrombus formation in CKD[J].Nat Rev Nephrol,2016,12(12):715.
[11]KATTULA S,BYRNES J R,WOLBERG A S.Fibrinogen and fibrin in hemostasis and thrombosis[J].Arterioscler Thromb Vasc Biol,2017,37(3):13-21.
[12] ITO K.Effect of water-extractive components from funazushi, a fermented crucian carp,on the activity of fibrinolytic factors[J].J Sci Food Agr,2020,100(6):2482-2487.
[13] ZHAO L H, LIN X P, FU J Y, et al.A novel bi-functional fibrinolytic enzyme with anticoagulant and thrombolytic activities from a marinederived fungus Aspergillus versicolor ZLH-1[J].Mar Drugs,2022,20(6):356.
[14]PAN S H,CHEN G G,ZENG J J,et al.Fibrinolytic enzyme production from low-cost substrates by marine Bacillus subtilis: process optimization and kinetic modeling[J].Biochem Eng J,2019,141:268-277.
[15]庞光武,梁智群.海洋枯草芽孢杆菌产纤溶酶的诱变育种与发酵工艺优化[J].中国生物工程杂志,2022,42(12):27-36.
[16] AL FARRAJ D A,KUMAR T S J, VIJAYARAGHAVAN P, et al.Enhanced production,purification and biochemical characterization of therapeutic potential fibrinolytic enzyme from a new Bacillus flexus from marine environment[J].J King Saud Univ Sci,2020,32(7):3174-3180.
[17]DHAMODHARAN D,JEMIMAH S,MERLYN S,et al.Novel fibrinolytic protease producing Streptomyces radiopugnans VITSD8 from marine sponges[J].Mar Drugs,2019,17(3):164.
[18]KRISHNAMURTHY A,BELUR P D.A novel fibrinolytic serine metalloprotease from the marine Erratia marcescens subsp.sakuensis: purification and characterization[J].Int J Biol Macromol,2018,112:110-118.
[19]VERMA P,CHATTERJEE S,KEZIAH M S,et al.Fibrinolytic protease from marine Streptomyces rubiginosus VITPSS1[J].Cardiovasc Hematol Agents Med Chem,2018,16(1):44-55.
[20]ZHOU Y T,CHEN H Z,YU B,et al.Purification and characterization of a fibrinolytic enzyme from marine Bacillus velezensis Z01 and assessment of its therapeutic efficacy in vivo[J].Microorganisms,2022,10(5):843.
[21] MAHAJAN P M, NAYAK S, LELE S S.Fibrinolytic enzyme from newly isolated marine bacterium Bacillus subtilis ICTF-1: media optimization, purification and characterization[J].J Biosci Bioeng, 2012,113(3):307-314.
[22]翁美芝,邓雄伟,王立元,等.淡豆豉炮制过程中产纤溶酶微生物的筛选和鉴定[J].中草药,2020,51(24):6221-6228.
[23] KIM C,RI K,CHOE S.A novel fibrinolytic enzymes from the Korean traditional fermented food-Jotgal:purification and characterization[J].J Food Biochem,2020,44(7):13255.
[24] PINONTOAN R, ELVINA, SANJAYA A, et al.Fibrinolytic characteristics of Bacillus subtilis G8 isolated from natto[J].Biosci Microbiota Food Health,2021,40(3):144-149.
[25] DANILOVA I, SHARIPOVA M.The practical potential of Bacilli and their enzymes for industrial production[J].Front Microbiol,2020,11:1782.
[26]邓永平,车鑫,艾瑞波,等.好食脉孢霉纤溶酶的纯化及体外纤溶活性研究[J].天然产物研究与开发,2020,32(11):1937-1942.
[27]YAO Z,KIM J A,KIM J H.Properties of a fibrinolytic enzyme secreted by Bacillus subtilis JS2 isolated from saeu(small shrimp)jeotgal[J].Food Sci Biotechnol,2018,27(3):765-772.
[28]YAO Z,KIM J A,KIM J H.Gene cloning,expression,and properties of a fibrinolytic enzyme secreted by Bacillus pumilus BS15 isolated from gul(oyster)jeotgal[J].Biotechnol Bioprocess Eng,2018,23(3):293-301.
[29] YANG H L, YANG L, LI X, et al.Genome sequencing, purification,and biochemical characterization of a strongly fibrinolytic enzyme from Bacillus amyloliquefaciens Jxnuwx-1 isolated from Chinese traditional douchi[J].J Gen Appl Microbiol,2020,66(3):153-162.
[30]HU Y L,YU D,WANG Z T,et al.Purification and characterization of a novel, highly potent fibrinolytic enzyme from Bacillus subtilis DC27 screened from douchi,a traditional Chinese fermented soybean food[J].Sci Rep,2019,9(1):9235.
[31] DEVARAJ Y,RAJENDER S K,HALAMI P M.Purification and characterization of fibrinolytic protease from Bacillus amyloliquefaciens MCC2606 and analysis of fibrin degradation product by MS/MS[J].Prep Biochem Biotechnol,2018,48(2):172-180.
[32]SADEGHI M,SAFAEIAN L,GHAZVINI M A,et al.Evaluation of fibrinolytic and antioxidant effects of allium affine hydroalcoholic extract[J].Res Pharm Sci,2017,12(4):299-306.
[33]SAFAEIAN L,ZOLFAGHARI B,AGHAYE-GHAZVINI M,et al.Evaluation of fibrinolytic and antioxidant effects of Allium elburzense bulb extracts[J].Avicenna J Phytomed,2017,7(3):223-231.
[34]QUINTAL-MARTÍNEZJ P,QUINTAL-ORTIZ I G,ALONZO-SALOMÓN L G,et al.Antithrombotic study and identification of metabolites in leaf extracts of chaya [Cnidoscolus aconitifolius (mill.) I.M.Johnst.][J].J Med Food,2021,24(12):1304-1312.
[35]MADHU C S,SHARADA A C.Fibrinogenolytic activity of serine proteases(s)from cucumis dipsaceus[J].Biocatal Agric Biotechnol,2019,17:685-689.
[36]AHAMED N A,ARIF I A,AL-RASHED S,et al.In vitro thrombolytic potential of fibrinolytic enzyme from Brevibacterium sp.isolated from the root of the plant,Aloe castellorum[J].J King Saud Univ Sci,2022,34(3):101868.
[37]LEGNANI C,FRASCARO M,GUAZZALOCA G,et al.Effects of a dried garlic preparation on fibrinolysis and platelet aggregation in healthy subjects[J].Arzneimittel-forschung,1993,43(2):119-122.
[38]SUBRAMANI B,SATHIYARAJESWARAN P.Current update on herbal sources of antithrombotic activity—a comprehensive review[J].The Egypt J Intern Med,2022,34(1):26.
[39] KIM D W, CHOI J H, PARK S E, et al.Purification and characterization of a fibrinolytic enzyme from petasites japonicus[J].Int J Biol Macromol,2015,72:1159-1167.
[40] HAMED M B, EL-BADRY M O, KANDIL E I, et al.A contradictory action of procoagulant ficin by a fibrinolytic serine protease from egyptian Ficus carica latex[J].Biotechnol Rep,2020,27:00492.
[41] DA SILVA A V, DO NASCIMENTO J M, RODRIGUES C H, et al.Partial purification of fibrinolytic and fibrinogenolytic protease from Gliricidia sepium seeds by aqueous two-phase system[J].Biocatal Agric Biotechnol,2020,27:101669.
[42] CHOI J H, KIM D W, PARK S E, et al.Novel thrombolytic protease from edible and medicinal plant Aster yomena(kitam.)honda with anticoagulant activity: purification and partial characterization[J].J Biosci Bioeng,2014,118(4):372-377.
[43]PEPE A,FREY M E,MUNOZ F,et al.Fibrin(ogen)olytic and antiplatelet activities of a subtilisin-like protease from Solanum tuberosum (stsbtc-3)[J].Biochimie,2016,125:163-170.
[44]PATEL G K,KAWALE A A,SHARMA A K.Purification and physicochemical characterization of a serine protease with fibrinolytic activity from latex of a medicinal herb euphorbia hirta[J].Plant Physiol Biochem,2012,52:104-111.
[45] DEITCHER S R, FUNK W D, BUCHANAN J, et al.Alfimeprase: a novel recombinant direct-acting fibrinolytic[J].Expert Opin Biol Ther,2006,6(12):1361-1369.
[46]梁鹏宇,潘霞,任宇豪,等.溶栓酶的研究进展[J].广西科学,2017,24(1):77-82.
[47]REN K Y,GONG H,HUANG J J,et al.Thrombolytic and anticoagulant effects of a recombinant staphylokinase-hirudin fusion protein[J].Thromb Res,2021,208:26-34.
[48]董超,马萱,史延茂.血栓病治疗药物-纤溶酶的生物来源[J].生物信息学,2019,17(2):76-85.
[49] XAVIER M A, TIRLONI L, TORQUATO R, et al.Blood anticlotting activity of a Rhipicephalus microplus cathepsin L-like enzyme[J].Biochimie,2019,163:12-20.
[50]JIANG Q,WANG L N,LIU Q,et al.Purification and characterization of a novel fibrinolytic enzyme from Whitmania pigra whitman[J].Protein Expr Purif,2020,174:105680.
[51] STEPHANI L, RAHAYU P, RETNONINGRUM D, et al.Purification and proteomic analysis of potent fibrinolytic enzymes extracted from Lumbricus rubellus[J].Proteome Sci,2023,21(1):8.
[52]GORNITSKAIA O V,ROVINSKAYA I N,PLATONOVA T N.Purification and characterization of the fibrinolytic enzyme from agkistrodon halys venom[J].Ukr Biokhim Zh (1999),2002,74(3):42.
[53]KUMAR R V,YARISWAMY M,JOSHI V,et al.Malabarase,a serine protease with anticoagulant activity from Trimeresurus malabaricus venom[J].Comp Biochem Physiol B Biochem Mol Biol, 2013, 164(2):111-116.
[54]WU Y,HU S N,MA Y N,et al.Novel Pheretima guillelmi-derived antithrombotic protein DPf3:identification,characterization,in vitro evaluation and antithrombotic mechanisms investigation[J].Int J Biol Macromol,2020,154:545-556.
[55]王明瑞,邓永平,宋青燕,等.蛹虫草固态发酵联产多糖和纤溶酶的工艺优化[J].食品工业科技,2021,42(4):71-76.
[56]MOHARAM M E,EL-BENDARY M A,ABO E M M,et al.Modeling and in-vivo evaluation of fibrinolytic enzyme produced by Bacillus subtilis Egy under solid state fermentation[J].Heliyon,2023,9(5):e16254.
[57]GUO N,SONG X R,KOU P,et al.Optimization of fermentation parameters with magnetically immobilized Bacillus natto on ginkgo seeds and evaluation of bioactivity and safety[J].LWT-Food Sci Technol,2018,97:172-179.
[58]ZOU Y,QIU L,XIE A W,et al.Development and application of a rapid all-in-one plasmid CRISPR-Cas9 system for iterative genome editing in Bacillus subtilis[J].Microb Cell Fact,2022,21(1):173.
[59]YAN G B,SHU M,SHEN W,et al.Heterologous expression of nattokinase from B.subtilis natto using Pichia pastoris GS115 and assessment of its thrombolytic activity[J].BMC Biotechnol,2021,21(1):49.
[60]HAN L C,CHEN Q Q,LUO J,et al.Development of a glycerol-inducible expression system for high-yield heterologous protein production in Bacillus subtilis[J].Microbiol Spectr,2022,10(5):e132222.