黑果腺肋花楸(Aronia melanocarpa)于2018年被列入我国新食品原料,其果实含有丰富的多酚、花青素、维生素、有机酸、多糖等多种活性成分[1-3]。研究表明,黑果腺肋花楸具有抗氧化[4]、抑菌抗炎[5-6]、调节大脑功能[7]、降血压[8]和降血糖[9]等功效,因而受到学者和食品从业者的广泛关注[10]。黑果腺肋花楸的多酚含量是蓝莓的5倍,抗氧化活性是蔓越莓的9倍,是已知植物中含量最高的[11],但由于黑果腺肋花楸的单宁含量较高,口感酸涩,故鲜食不易被消费者接受,因此将花楸果进行发酵可改善其食用品质[12]。发酵制果酒是花楸加工的一个主要方向,可丰富花楸风味,改善口感,提高食用价值。WITKOWSKA A M等[13]研究发现,黑果腺肋花楸果酒的抗氧化能力强于红葡萄酒、黑加仑酒、醋栗果酒。
本研究以黑果腺肋花楸果为原料进行果酒酿造,以感官评分为评价指标,通过单因素和响应面试验对黑果腺肋花楸果酒发酵条件进行优化,并对果酒的品质、多酚含量、花色苷含量及抗氧化活性进行研究,旨在研制出风味佳、抗氧化活性强的黑果腺肋花楸果酒,为花楸资源的深加工提供理论支持。
1 材料与方法
1.1 材料与试剂
黑果腺肋花楸果:产地辽宁大连;果胶酶(50 000 U/g)、纤维素酶(10 000 U/g):河南万邦实业有限公司;偏重亚硫酸钾(分析纯):河南禾兴生物科技有限公司;柠檬酸(分析纯):广州利成实业有限公司;安琪果酒专用酵母(RW):安琪酵母股份有限公司;白砂糖:上海市糖业烟酒有限公司;没食子酸(纯度≥99%)、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazo line-6-sulphonate),ABTS)(纯度≥98%):北京沃凯生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度≥98%):美国Sigma公司;福林酚试剂、过硫酸钾、甲醇(99.5%)、硫酸亚铁、水杨酸、抗坏血酸等试剂(分析纯):国药集团。
1.2 仪器与设备
XY600-2C型电子秤:常州市幸运电子设备有限公司;HH-S8型水浴锅:金坛市全城国盛实验仪器厂;DF-101SE型磁力搅拌器:南京予华仪器有限责任公司;HT 512ATC型酒精度折射仪:福安普和电子有限公司;1001-00A型恒温培养箱:佛山劲申机电设备有限公司;PHS-3E酸度计:上海仪电科学仪器股份有限公司;WZS 32手持折光仪糖度计:上海仪电物理光学仪器有限公司;BT25S型电子分析天平:梅特勒-托利多仪器有限公司;DHG9101-2S型电热恒温干燥箱:上海精科实业有限公司;T6-紫外可见分光光度计:北京普析通用仪器有限责任公司;PRIMOR型高速冷冻离心机:美国Thermo Fisher公司。
1.3 方法
1.3.1 黑果腺肋花楸果酒发酵工艺流程与操作要点
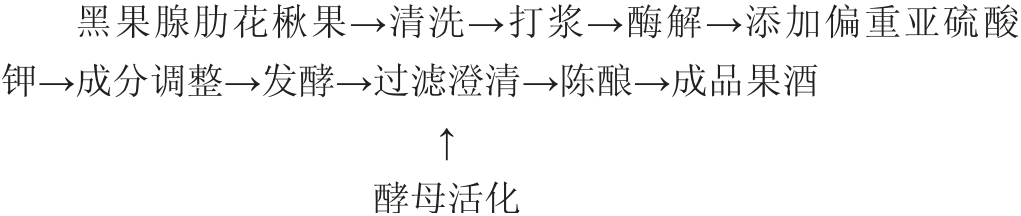
操作要点:
原料预处理:挑选无霉变、完好的黑果腺肋花楸果,洗净、晾干、直接打浆。
酶解:取黑果腺肋花楸果浆1 000 g,加入0.2%的果胶酶和0.2%的纤维素酶,搅拌均匀,50 ℃酶解2 h,再90 ℃灭酶5 min,冷却至室温。
添加偏重亚硫酸钾:使用100目尼龙网滤布过滤,过滤出的果汁直接添加80 mg/L偏重亚硫酸钾,搅拌溶解。
成分调整:使用柠檬酸将黑果腺肋花楸果汁pH值调节至3.0~5.0,补加一定量白砂糖调节黑果腺肋花楸果汁的初始糖度。
酵母发酵:将11 g安琪果酒酵母RW加入110 mL由无菌水配制的50 g/L糖水中,37 ℃活化30 min,以一定的比例接种至黑果腺肋花楸果汁中,25 ℃恒温发酵一定时间。
陈酿、过滤:使用300目尼龙网滤布过滤,4 ℃陈酿10 d后即为黑果腺肋花楸果酒成品。
1.3.2 黑果腺肋花楸果酒发酵条件优化单因素试验
在预试验基础上,设定果胶酶的添加量0.2%、纤维素酶的添加量0.2%、偏重亚硫酸钾的添加量80 mg/L、发酵温度25 ℃为固定水平,以黑果腺肋花楸果酒的感官评分、酒精度为评价指标,分别考察酵母接种量(0.4%、0.7%、1.0%、1.3%、1.6%)、初始糖度(18 °Bx、20 °Bx、22 °Bx、24 °Bx、26 °Bx)、初始pH值(3.5、4.0、4.5、5.0、5.5)、发酵时间(5 d、6 d、7 d、8 d、9 d)对黑果腺肋花楸果酒品质的影响。
1.3.3 黑果腺肋花楸果酒发酵条件优化响应面试验
在单因素试验的基础上,以酿酒酵母接种量(A)、初始糖度(B)、初始pH值(C)和发酵时间(D)为影响因素,以感官评分为响应值,设计4因素3水平响应面试验,响应面试验因素与水平见表1。
表1 黑果腺肋花楸果酒发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface method for fermentation technology optimization of A. melanocarpa fruit wine
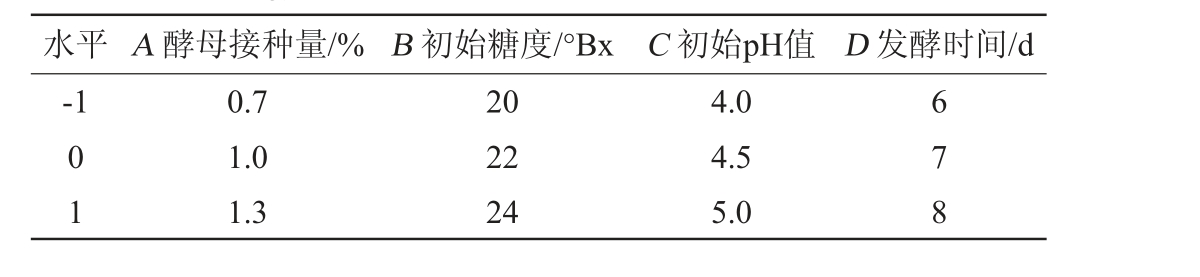
水平 A 酵母接种量/% B 初始糖度/°Bx C 初始pH值 D 发酵时间/d-1 01 0.7 1.0 1.3 20 22 24 4.0 4.5 5.0 678
1.3.4 测定方法
黑果腺肋花楸果酒的感官评价分析:参考魏春雨[14]的方法,根据NY/T 1508—2017《绿色食品 果酒》,选取具有一定果酒感官评定经验的10人组成评价小组,对黑果腺肋花楸果酒从外观、风格、香气、滋味4个方面进行打分,取10人平均分,满分100分。感官评分标准见表2。
表2 黑果腺肋花楸果酒感官评分标准
Table 2 Sensory evaluation standard of A. melanocarpa fruit wine

项目要求 评分/分色泽外观(10分)澄清度风格(20分)香气(30分)滋味(40分)宝石色透明或者深红色,有光泽,颜色协调统一澄清透明,颜色为深红色没有光泽,红颜色略浅砖红色、暗红颜色暗沉,没有光泽无沉淀浑浊现象少量有沉淀,略微浑浊有大量沉淀物,浑浊严重浑浊很典型,风格独特,优雅细腻具有典型性,风格良好不具备典型性,风格差有明显的果香味,酒香浓郁,香味协调,舒服有果香,酒香稍差果香不足甚至没有,有异味,口感稍差酒体丰满,具有新鲜感,醇厚且协调,爽口舒服柔和爽口,酸甜适中,整体协调舒服酒体协调酒味少,酸甜比例不协调,过酸过甜或味道寡淡4~5 3~4 2~3 1~2 0~1 4~5 3~4 1~3 0~1 16~20 11~15 0~10 23~30 16~22 0~15 36~40 26~35 11~25 0~10
DPPH自由基清除率:参考金海炎等[15]的方法进行测定;ABTS+自由基清除率:参考吴双从等[16]的方法进行测定;羟自由基清除率:参考YANG H等[17]的方法进行测定;多酚含量:参照姚芳等[18]的方法采用福林酚法进行测定;花青素含量:参照魏春雨[14]的方法采用pH示差法进行测定。
酒精度:酒精度折射仪进行测定;糖度:手持式糖度仪进行测定;总糖、总酸、挥发酸含量:分别参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的直接滴定法、电位滴定法和蒸馏法进行测定;菌落总数:参照GB 4789.2—2022《食品安全国家标准食品微生物学检验菌落总数测定》进行测定;大肠菌群:参照国标GB 4789.3—2016《食品安全国家标准食品微生物学检验大肠菌群计数》进行测定。
1.3.5 数据处理
采用Design-Expert 8.06和Excel 2019进行数据分析,利用SPSS 23.0软件进行显著性分析。每个数据重复测定3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 黑果腺肋花楸果酒发酵条件优化单因素试验结果
2.1.1 酿酒酵母接种量对黑果腺肋花楸果酒品质的影响
酿酒酵母接种量对黑果腺肋花楸果酒品质的影响见图1。
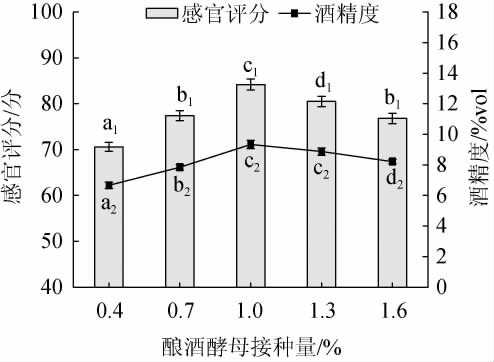
图1 酿酒酵母接种量对黑果腺肋花楸果酒品质的影响
Fig.1 Effect of Saccharomyces cerevisiae inoculum on the quality of A. melanocarpa fruit wine
不同小写字母表示差异显著(P<0.05),下同。
由图1可知,随着酿酒酵母接种量的增加,黑果腺肋花楸果酒感官评分、酒精度均呈现先上升再下降的趋势。酵母接种量较低时,因发酵不完全而产生的乙醇较少,酒香也不明显,故感官评分也低;而酵母接种量过大时,酵母菌的自身繁殖消耗了大量的营养物质,增加了产酸量,会抑制酵母菌的生长,生成的酒精量减少,同时破坏了果酒的风味[19],感官评分也降低。酵母接种量为1.0%时,黑果腺肋花楸果酒的感官评分、酒精度均达到最高,分别为84.2分、9.34%vol;且显著高于其他接种量(P<0.05)。此时,黑果腺肋花楸果酒的品质达到最佳,故选择较适的酿酒酵母接种量为1.0%。
2.1.2 初始糖度对黑果腺肋花楸果酒品质的影响
初始糖度对黑果腺肋花楸果酒品质的影响见图2。
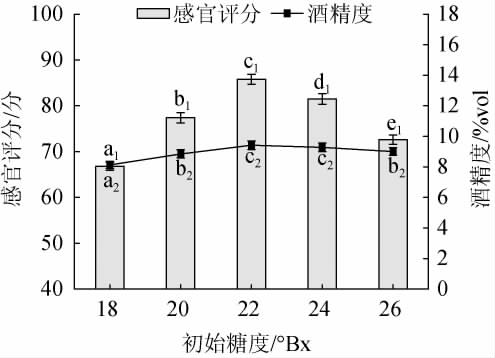
图2 初始糖度对黑果腺肋花楸果酒品质的影响
Fig.2 Effect of different initial sugar content on the quality of A. melanocarpa fruit wine
由图2可知,随着初始糖度的增加,黑果腺肋花楸果酒感官评分、酒精度均呈现先上升再下降的趋势。糖类是酵母发酵所需的重要营养物质,适量的糖会促进酵母的发酵;初始糖度较低时,酵母发酵不充分,不利于酒精度和风味的形成,酒体单薄,感官评分低[19]。但初始糖度过高时,由于高渗透作用会抑制酵母菌的生长[20],导致酒精度下降,果酒甜度过高,破坏了果酒的糖酸比,感官评分下降。初始糖度为22°Bx时,黑果腺肋花楸果酒的感官评分、酒精度均达到最高,分别为85.8分、9.42%vol;且显著高于其他初始糖度(P<0.05)。故选择较适的初始糖度为22°Bx。
2.1.3 初始pH值对黑果腺肋花楸果酒品质的影响
初始pH值对黑果腺肋花楸果酒品质的影响见图3。
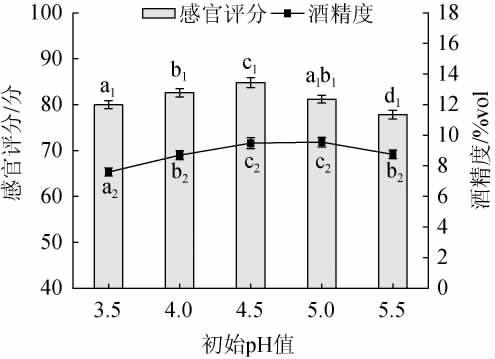
图3 初始pH值对黑果腺肋花楸果酒品质的影响
Fig.3 Effect of initial pH value on the quality of A. melanocarpa fruit wine
由图3可知,随着初始pH值的增加,黑果腺肋花楸果酒感官评分、酒精度均呈现先上升再下降的趋势。酵母菌有其生长的最适pH值,过低或过高的pH值会影响酵母菌的生长和发酵产物的生成。当初始pH值过低或过高时,酵母菌生长缓慢,酒精度下降,发酵产物减少,果酒的风味较平淡,感官评分下降[21]。初始pH值为4.5时,黑果腺肋花楸果酒的感官评分、酒精度均为达到最高,分别为84.8分、9.48%vol。故选择较适的初始pH值为4.5。
2.1.4 发酵时间对黑果腺肋花楸果酒品质的影响
发酵时间对黑果腺肋花楸果酒品质的影响见图4。
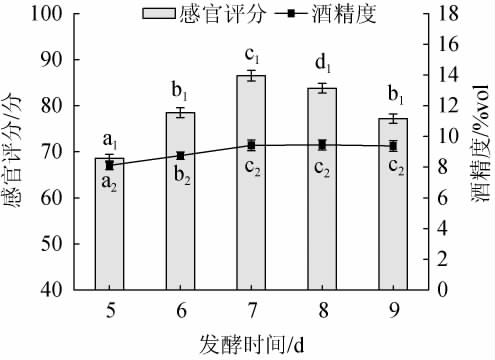
图4 发酵时间对黑果腺肋花楸果酒品质的影响
Fig.4 Effect of fermentation time on the quality of A. melanocarpa fruit wine
由图4可知,随着发酵时间的延长,黑果腺肋花楸果酒感官评分呈现先上升再下降的趋势,酒精度呈先上升后平缓的趋势。当发酵时间短时,花楸发酵未完全,果酒的酒精度低,酒味偏淡,酒体中残糖含量高,口感偏甜;而当发酵时间过长时,果酒中残糖含量偏低,口感偏酸,酒体不协调,酒精度变化差异不显著,与王娟等[22]有关拐枣山楂果酒发酵的研究结果相似。发酵时间为7 d时,果酒的感官评分最高,且显著高于其他发酵时间(P<0.05),酒精度也达到了最大值,分别为86.5分、9.40%vol。故选择较适的发酵时间为7 d。
2.2 黑果腺肋花楸果酒发酵条件优化响应面优化试验结果
2.2.1 响应面试验分析
黑果腺肋花楸果酒发酵条件优化的响应面试验分析见表3。
表3 黑果腺肋花楸果酒发酵条件优化响应面试验设计及结果
Table 3 Design and results of response surface tests for optimization of fermentation conditions of A. melanocarpa fruit wine
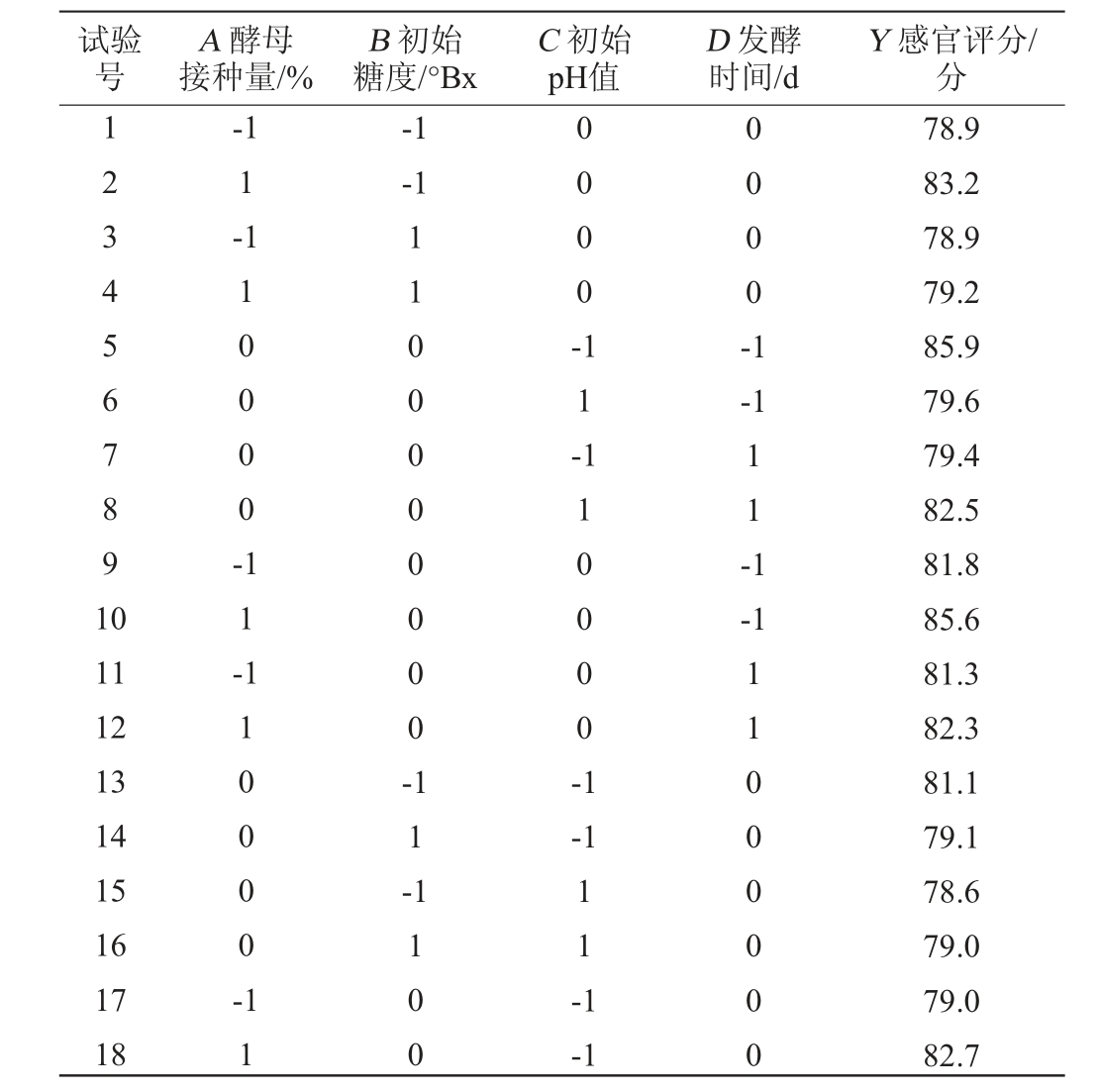
试验号A 酵母接种量/%B 初始糖度/°Bx C 初始pH值D 发酵时间/d Y 感官评分/分1234567891 0-1 1-1-1-1 10000-0000-11-0000-1-1 11-1-1 11 12 13 14 15 16 17 18 1 1-110000-1100000000-11-110000-1-1 11 1100 11 -1-1 11000000 78.9 83.2 78.9 79.2 85.9 79.6 79.4 82.5 81.8 85.6 81.3 82.3 81.1 79.1 78.6 79.0 79.0 82.7
续表
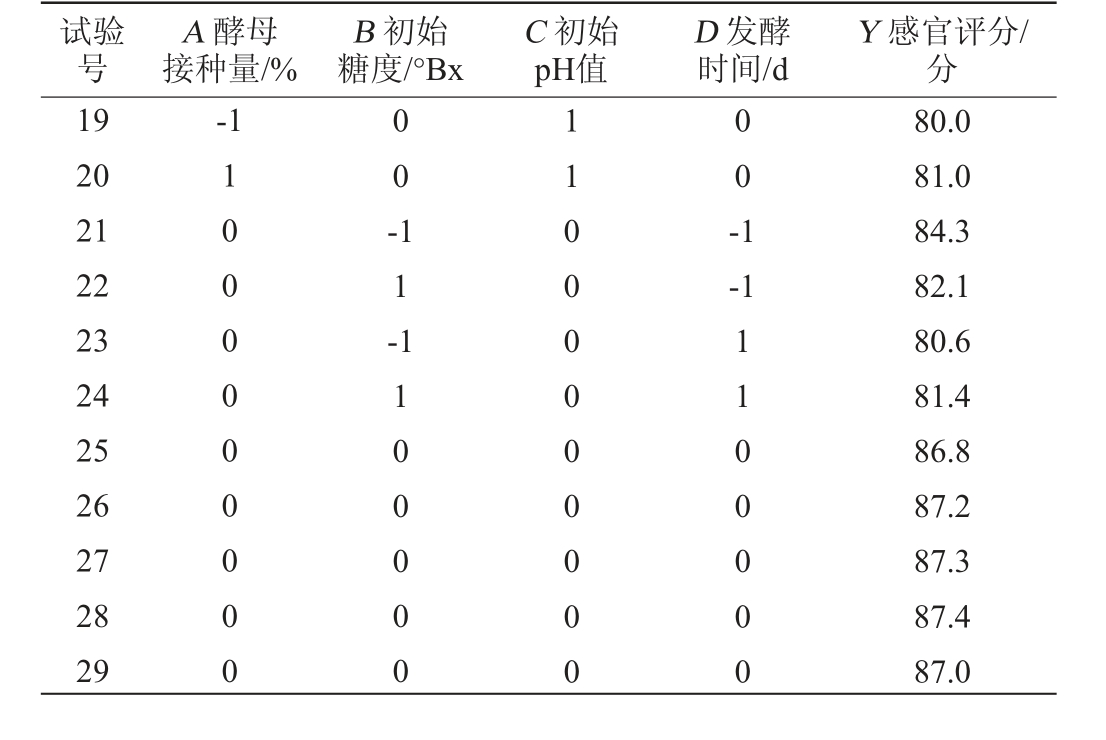
试验号A 酵母接种量/%B 初始糖度/°Bx C 初始pH值D 发酵时间/d Y 感官评分/分19 20 21 22 23 24 25 26 27 28 29-1 1000000000 0 0 -1 1 -00-1-1 1100000 11000000000 1100000 80.0 81.0 84.3 82.1 80.6 81.4 86.8 87.2 87.3 87.4 87.0
利用Design-Expert 8.06数据分析软件对表3的结果进行多元回归拟合,得到回归模型的二次多项方程:
Y=87.14+1.18A-0.58B-0.54C-0.98D-1.0AB-0.68AC-0.7AD+
0.6BC+0.75BD+2.35CD-2.98A2-3.92B2-3.73C2-1.37D2
2.2.2 黑果腺肋花楸果酒感官评分回归模型的方差分析
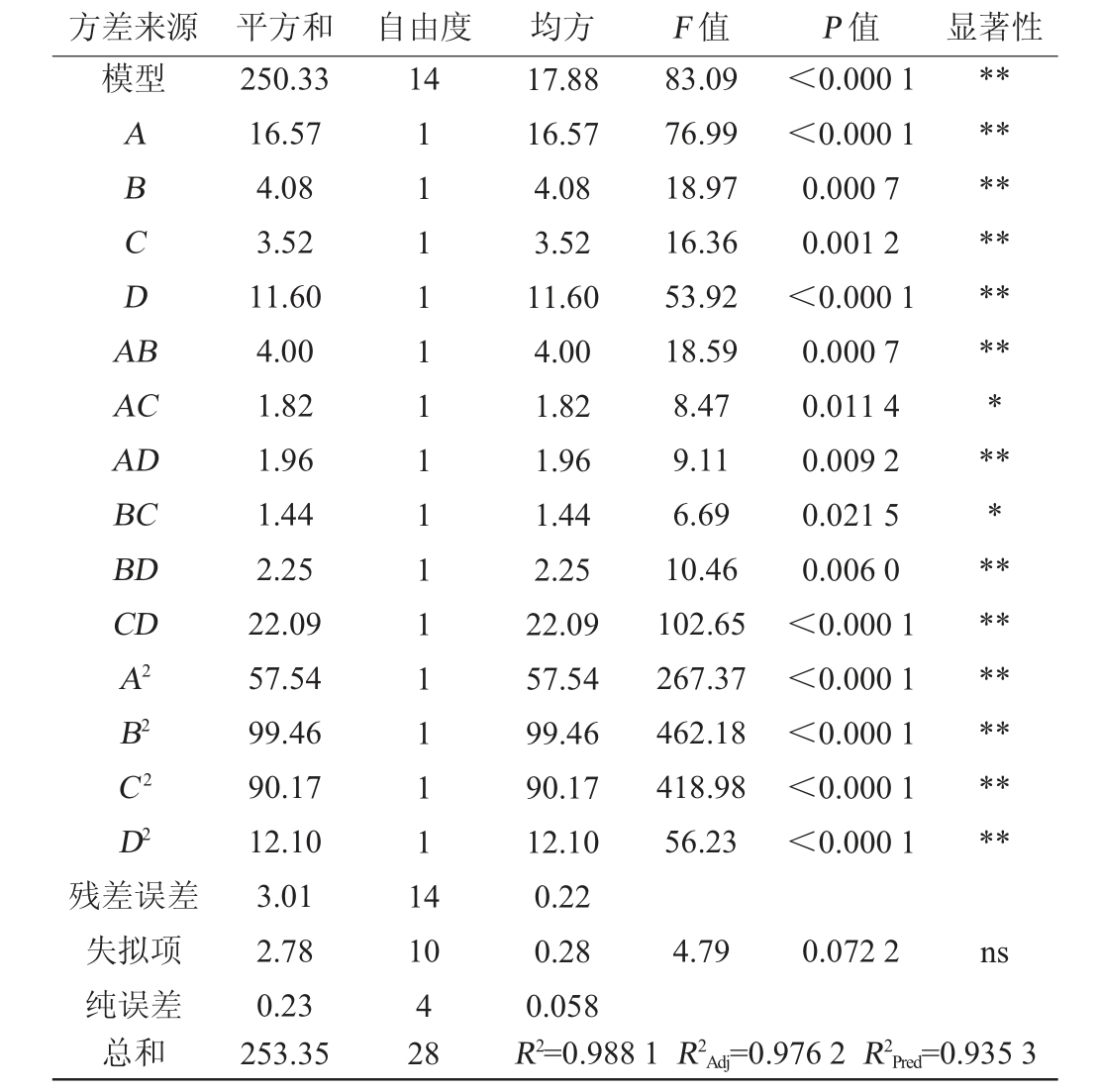
以黑果腺肋花楸果酒感官评分为考察指标的模型及回归系数进行回归分析,结果见表4。
表4 感官评分回归模型的方差分析
Table 4 Variance analysis of regression model of sensory score
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05),下同。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B AC AD BC BD CD A2 B2 C2 D2残差误差失拟项纯误差总和250.33 16.57 4.08 3.52 11.60 4.00 1.82 1.96 1.44 2.25 22.09 57.54 99.46 90.17 12.10 3.01 2.78 0.23 253.35 111111111111111 4 83.09 76.99 18.97 16.36 53.92 18.59 8.47 9.11 6.69 10.46 102.65 267.37 462.18 418.98 56.23 17.88 16.57 4.08 3.52 11.60 4.00 1.82 1.96 1.44 2.25 22.09 57.54 99.46 90.17 12.10 0.22 0.28 0.058 R2=0.988 1 R2Adj=0.976 2 R2Pred=0.935 3<0.000 1<0.000 1 0.000 7 0.001 2<0.000 1 0.000 7 0.011 4 0.009 2 0.021 5 0.006 0<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1****************************10 4 28 4.79 0.072 2 ns
从表4可以看出,黑果腺肋花楸果酒感官评分模型的F值为83.09,该模型极显著(P<0.01)。失拟项P=0.072 2>0.05不显著,表明响应面模型有效。决定系数R2值为0.988 1,校正决定系数R2Adj为0.976 2,预测决定系数R2Pred=0.935 3,说明模型的拟合效果好、数据可信度高,预测性好。回归方程中一次项A、B、C、D,交互项AB、AD、BD、CD和二次项A2、B2、C 2、D2对黑果腺肋花楸果酒感官评分有极显著影响(P<0.01),交互项AC和BC对黑果腺肋花楸果酒感官评分有显著影响(P<0.05)。
2.2.3 响应面作用的交互作用分析
各因素交互作用对黑果腺肋花楸果酒感官评分影响的响应曲面及等高线见图5。

图5 各因素交互作用对黑果腺肋花楸果酒感官评分响应曲面和等高线
Fig.5 Response surface plot and contour lines effect of interaction between various factors on the sensory score of A. melanocarpa fruit wine
由图5可知,AB、AD、BD、CD交互作用的响应面图中等高线密度分布不均匀,曲面陡峭,表明AB、AD、BD、CD交互作用强,对黑果腺肋花楸果酒的感官评分影响极显著(P<0.01),与表4的方差分析结果一致。以AB交互作用的响应面图为例,当初始糖度(B)一定时,随着酵母接种量(A)的增加,黑果腺肋花楸果酒感官评分呈现出先增加,达到峰值后再显著下降,响应面曲面的变化十分陡峭。同时,从等高线的疏密程度来看,酵母接种量(A)对果酒的感官评分的影响高于初始糖度(B)。由此可知,各因素对黑果腺肋花楸果酒感官评分的影响顺序为酵母接种量>初始糖度>发酵时间>初始pH值。
2.3 验证试验
经Design-Expert 23.0软件分析得到最优发酵条件为酵母接种量1.05%、初始糖度21.77 °Bx、初始pH值4.47、发酵时间6.33 d。在此条件下,得黑果腺肋花楸果酒感官评分预测值为87.6分。考虑实际操作的便利性,将该条件修正为酵母接种量1.0%、初始糖度21.8 °Bx、初始pH值4.5、发酵时间6.4 d,进行3次平行验证试验,测得黑果腺肋花楸果酒感官评分实际值为(87.2±1.3)分,与黑果腺肋花楸果酒感官评分的预测值相差不大。
2.4 黑果腺肋花楸果酒成品的检测结果
最佳发酵工艺下酿造出的黑果腺肋花楸果酒色泽呈深红色有光泽,澄清无沉淀,花楸果香浓郁、酸甜协调,酒体丰满,风格优雅,感官评分达87.2分;酒精度、总酸、挥发酸、总糖分别为9.56%vol、7.62 g/L、0.18 g/L、8.15 g/L,理化和微生物指标均符合NY/T 1508—2017《绿色食品果酒》标准。
2.5 黑果腺肋花楸果酒的抗氧化活性分析
对黑果腺肋花楸果酒的总多酚、花青素及抗氧化活性进行检测,结果见图6和图7。
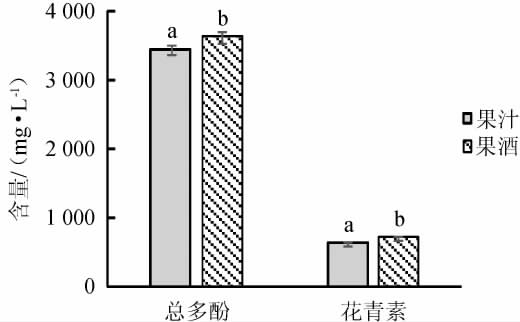
图6 黑果腺肋花楸果汁及果酒的总多酚和花青素的含量
Fig.6 Total polyphenols and anthocyanins contents of A. melanocarpa juice and fruit wine
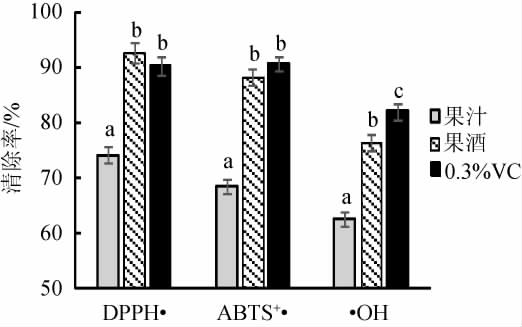
图7 黑果腺肋花楸果汁及果酒的抗氧化活性
Fig.7 Antioxidant activities of A. melanocarpa juice and fruit wine
由图6和图7可知,与黑果腺肋花楸果汁相比,发酵后的果酒中总多酚含量3 617.3 mg/L、花青素含量697.6 mg/L、DPPH自由基清除率93.8%、ABTS自由基清除率88.4%和羟自由基清除率76.5%,均显著增加(P<0.05),与WILKOWSKA A等[23]的研究结果相似。黑果腺肋花楸果酒的DPPH、ABTS自由基清除率与0.3%维生素C(vitamin C,VC)的测定结果无显著性差异(P>0.05),羟自由基清除率显著低于0.3%VC(P<0.05)。说明在发酵过程中,酵母菌产生的各种酶系作用可使大分子酚类物质和花青素转化成可溶性的小分子物质,黑果腺肋花楸果实和果皮中的总多酚和花青素等抗氧化物质能更有效的释放溶出[24],同时发酵产生的酒精也有助于酚类物质和花青素的溶出[25],故果酒中抗氧化活性成分含量升高,抗氧化活性显著提升。
3 结论
本研究采用单因素和响应面试验对黑果腺肋花楸果酒的发酵工艺进行优化,确定最佳发酵工艺条件为酿酒酵母接种量1.0%、初始糖度21.8 °Bx、初始pH值4.5、发酵时间6.4 d,所制得的果酒呈深红色有光泽,澄清无沉淀,花楸果香浓郁,酸甜协调,感官评分达87.2分,酒精度为9.56%vol,多酚含量为3 617.3 mg/L,花青素含量697.6 mg/L,DPPH自由基清除率93.8%,ABTS自由基清除率88.4%,羟自由基清除率76.5%,各项理化和微生物限量均符合NY/T 1508—2017《绿色食品果酒》标准。成品果酒中总多酚含量、花青素含量、DPPH自由基清除率、ABTS自由基清除率和羟自由基清除率均显著高于未发酵的果汁,具有较强的抗氧化活性,可为高品质黑果腺肋花楸果酒的开发提供依据。后期将进一步对黑果腺肋花楸果酒的生理功能进行研究。
[1]王申萌,管清杰,张廷秀,等.黑果腺肋花楸果实的功能活性物质及产品开发进展[J].食品科技,2021,46(5):64-69.
[2]王莹,柳青,陈月,等.黑果腺肋花楸活性成分及研究开发进展[J].食品工业,2020,41(6):249-253.
[3] SIDOR A, GRAMZA-MICHAOWSKA A.Black chokeberry Aronia melanocarpa L.:A qualitative composition,phenolic profile and antioxidant potential[J].Molecules,2019,24(20):3710-3766.
[4]DABROWSKA Z,DABROWSKA E,ONOPIUK B,et al.The protective impact of black chokeberry fruit extract (Aronia melanocarpa L.) on the oxidoreductive system of the parotid gland of rats exposed to cadmium[J].Oxid Med Cell Longev,2019,2019:3203264.
[5]DENEV P,CˇÍŽ M,KRATCHANOVA M,et al.Black chokeberry(Aronia melanocarpa)polyphenols reveal different antioxidant,antimicrobial and neutrophil-modulating activities[J].Food Chem,2019,284:108-117.
[6]ALI M S,LEE E B,LEE S J,et al.Aronia melanocarpaextract fermented by Lactobacillus plantarum EJ2014 modulates immune response in mice[J].Antioxidants,2021,10(8):1276.
[7]DASKALOVA E,DELCHEV S,TOPOLOV M,et al.Aronia melanocarpa(Michx.) Elliot fruit juice reveals neuroprotective effect and improves cognitive and locomotor functions of aged rats[J].Food Chem Toxicol,2019,132:110674.
[8]HAWKINS J, HIRES C, BAKER C, et al.Daily supplementation with Aronia melanocarpa(chokeberry)reduces blood pressure and cholesterol:a meta-analysis of controlled clinical trials[J].J Diet Sup, 2021, 18(5):517-530.
[9] KOBUS Z, NADULSKI R, WILCZYNSKI K, et al.Effect of the black choke berry(Aronia melanocarpa(Michx.)Elliott)juice acquisition method on the content of polyphenols and antioxidant activity[J].Plos One,2019,14(7):e0219585.
[10]胡文泽,李淼,郭东旭,等.黑果腺肋花楸研究进展[J].食品与发酵工业,2020,46(23):316-322.
[11]王思溥,朱丹,宁志雪,等.黑果腺肋花楸保健功能与加工利用研究进展[J].黑龙江八一农垦大学学报,2022,34(4):65-73.
[12]MU J J,XIN G,ZHANG B,et al.Beneficial effects of Aronia melanocarpa berry extract on hepatic insulin resistance in type 2 diabetes mellitus rats[J].J Food Sci,2020,85(4):1307-1318.
[13]WITKOWSKA A M,ZUJKO M E,BORAWSKA M,et al.Antioxidant properties and selenium content of wines[J].Pol J Environ Stud,2006,15(2):208-211.
[14]魏春雨.黑果腺肋花楸酒酿造工艺的研究[D].无锡:江南大学,2021.
[15]金海炎,王丰园,鲁云风,等.混菌发酵猕猴桃果酒工艺条件优化及抗氧化性研究[J].食品与发酵工业,2022,48(3):177-185.
[16]吴双从,曹新志,张楷正,等.枳椇山楂果酒酿酒工艺优化及抗氧化活性分析[J].中国酿造,2022,41(4):192-198.
[17]YANG H,SU W,WANG L H,et al.Molecular structures of nonvolatile components in the Hai hong fruit wine and their free radical scavenging effect[J].Food Chem,2021,353(24):129298.
[18]姚芳,肖香,董英.大麦乳酸菌发酵液粉中多酚的提取及其抗氧化性研究[J].食品工业科技,2017,38(10):211-216,235.
[19]颜燕.富硒蓝莓全果果酒发酵工艺优化及抗氧化活性研究[J].中国酿造,2022,41(9):176-182.
[20]马德秀,白羽嘉,冯作山,等.香梨全果果浆与果汁发酵工艺及果酒香气成分分析[J].现代食品科技,2021,37(5):237-249,295.
[21]郑玉琳,周文敏,何映江,等.云南黄泡果酒酿造工艺优化及抗氧化活性研究[J].食品安全质量检测学报,2022,13(6):1927-1934.
[22]王娟,魏贞,石明生,等.拐枣山楂果酒发酵工艺优化及其抗氧化活性分析[J].中国酿造,2022,41(11):169-173.
[23] WILKOWSKA A, AMBROZIAK W, ADAMIEC J, et al.Preservation of antioxidant activity and polyphenols in chokeberry juice and wine with the use of microencapsulation[J].J Food Process Pres,2017,41(3):e12924.
[24]MINNAAR P P,PLESSIS H W D,JOLLY N P,et al.Non-Saccharomyces yeast and lactic acid bacteria in Co-inoculated fermentations with two Saccharomyces cerevisiae yeast strains: A strategy to improve the phenolic content of Syrah wine[J].Food Chem: X,2019,4:100070.
[25]梁敏,包怡红.蓝靛果酒发酵工艺优化及发酵过程对花色苷的影响[J].食品科学,2018,39(10):151-157.