安梨,又名酸梨,为蔷薇科(Rosaceae)梨亚科(Pomoidease)秋子梨属(Pyrus ussurienisi Maxim)的重要品种之一[1],主要分布于京津冀以及辽西等燕山地区[2],安梨富含绿原酸、表儿茶素、奎尼酸、槲皮素等多种酚类物质,多种三萜类化合物以及黄酮类功能性成分[3],其乙酸乙酯层提取物对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的最高清除率达60.47%,具有较强的抗氧化活性,可以较好的抑制人肝癌细胞Bel-7402的生长[4]。尽管安梨营养丰富,但鲜食性较低,市场接受度差、售价偏低,制约了安梨产业的发展,因此提高安梨深加工能力、开发安梨深加工产品是安梨产业健康发展的必由之路。高海生等[1]以安梨和银耳为试验原料开发了一款具有润肺止咳功效的安梨银耳复合果汁;周云等[5]以辽西特产安梨与小米为主要原料酿造安梨小米酒;杨冰峰[6]以安梨为原材料制备出一款透光率高,可溶性固形物含量丰富的安梨膏产品,但是这些产品仅处于实验室阶段,未进行市场大规模生产。
安梨中富含苹果酸、柠檬酸等多种有机酸[7],可以赋予果酒醇厚、协调的口感,因此可以用于酿造果酒。目前已经开发的安梨果酒的酒精度范围为14%vol~18%vol,孔明明[8]对安梨果酒的制备工艺进行优化,发现安琪SY酵母发酵后的果酒抗氧化活性较高,安梨果酒品质较好;孙翠焕等[9]采用清汁发酵安梨果酒,同时在制汁过程中添加D-异抗坏血酸用于防止氧化褐变;张大为等[10]通过在安梨果酒发酵过程中加入地衣芽孢杆菌(Bacillus licheniformis)SH003的生物降酸法,使得酒体酸度降低36.3%,提升了安梨果酒口感。低醇果酒(酒精度1%vol~7%vol)由于酒精度低、保留了原料的营养成分[11],同时酿造微生物又赋予了酿造香以及微生物的胞外代谢产物,跟其他果酒相比,具有受众广、消费者接受度高的优点,因此更具市场潜力。
本研究以安梨为原料,制备低醇安梨果酒。以褐变抑制率为考察指标,通过单因素试验及正交试验优化低醇安梨果酒复合护色剂配比;以酒精度和感官评分评价指标,通过单因素试验及响应面试验优化低醇安梨果酒发酵工艺,并采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)联合气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)技术分析低醇安梨果酒挥发性风味成分。旨在为低醇安梨果酒的工业化生产提供理论依据,同时也为丰富安梨深加工产品提供借鉴与参考。
1 材料与方法
1.1 材料与试剂
安梨(燕安3号):河北科技师范学院安梨种植基地;安琪SY果酒专用酵母:安琪酵母股份有限公司;L-抗坏血酸、壳聚糖、乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium salt,EDTA-2Na)(均为分析纯):上海瑞楚生物科技有限公司;Lallzyme HC果胶酶(1×105 U/g):法国拉曼公司;白砂糖(食品级):成都太古糖业有限公司;氯化钠(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
UV2600A紫外可见分光光度计:尤尼柯(上海)仪器有限公司;SMY-2000测色色差仪:北京盛名扬科技开发有限责任公司;CR22N高速冷冻离心机:株式会社日立制作所;DY-BM07榨汁机:广东大宇科技实业有限公司;FA-1004电子天平:上海舜宇恒平科学仪器有限公司;ZQPL-200立式全温振荡培养箱:天津莱伯特瑞仪器设备有限公司;6890N-G5795B气相色谱仪质谱仪、HP-5MS色谱柱(30 m×0.25 mm×0.25 μm):安捷伦科技有限公司。
1.3 试验方法
1.3.1 低醇安梨果酒加工工艺流程及操作要点
安梨鲜果→挑选→清洗→破碎→添加护色剂→榨汁→添加果胶酶→安梨清汁→初始糖度调整→酒精发酵→过滤→澄清→灭菌灌装→低醇安梨果酒
挑选:选择新鲜、无病虫害、无腐烂以及机械损伤的成熟期安梨。
清洗:清洗安梨果实表面,存放于阴凉干燥处沥干表面水分。
榨汁:将安梨切分成3~4 cm规则的块状(去核),按照安梨与水4∶1混合,添加复合护色剂(L-抗坏血酸、壳聚糖、EDTA-2Na),采用榨汁机打浆180 s。
酶解:按照安梨果浆总质量0.25%加入果胶酶,50 ℃静置酶解6 h[12],采用纱布过滤出安梨清汁。
酵母活化:酵母由低温环境取出至室温条件解冻,按照1∶10溶于5%蔗糖水溶液,35 ℃活化20 min。
酒精发酵:调整安梨果浆初始糖度为10%,活性干酵母的添加量为0.1%,25 ℃下避光发酵4 d,待酒体不再产生气泡,酒精度不再变化,即可结束酒精发酵。
过滤:使用经灭菌滤网对完成发酵后的酒液进行过滤。澄清:避光环境下于0~5 ℃澄清42 d。
灭菌灌装:对澄清后的果酒采用多级膜过滤进行灭菌(5μm/0.45μm/0.22μm),装瓶封口,即得低醇安梨果酒成品。
1.3.2 安梨汁褐变抑制率的测定
参考LOPEZ-TOLEDANO A等[13]的方法并进行改良。取一定量的安梨汁,3 500 r/min离心10 min,取上清液作待测样。利用紫外分光光度计,以蒸馏水作为空白,于波长420nm处测定安梨汁上清液的吸光度值A,用吸光度值反映安梨汁褐变度。试验重复测定3次,褐变抑制率计算公式如下:
式中:R为安梨汁褐变抑制率,%;A0为对照组未经护色处理安梨汁吸光度值;Ak为实验组经护色剂处理后安梨汁的吸光度值。
1.3.3 复合护色剂配比优化(1)单因素试验
为了确定复合护色剂的组成成分,选择3种食品中常用的护色剂,利用单因素试验确定3种护色剂的浓度范围。其中L-抗坏血酸的添加量为0.12 g/100 mL、0.24 g/100 mL、0.36g/100mL、0.48g/100mL、0.60g/100mL;壳聚糖的添加量为0.05g/100mL、0.15g/100mL、0.25g/100mL、0.35 g/100 mL、0.45 g/100 mL;EDTA-2Na的添加量为0.03 g/100 mL、0.06 g/100 mL、0.09 g/100 mL、0.12 g/100 mL、0.15 g/100 mL,分别测定各护色剂在不同浓度值时对安梨汁的褐变抑制率,从而确定每种护色剂在安梨汁中的浓度范围。每个浓度重复进行3次试验,结果取3次的平均值。
(2)正交试验
在单因素试验基础上,选用L-抗坏血酸(A)、壳聚糖(B)、EDTA-2Na(C)添加量作为安梨汁复合护色剂的组成成分,并进行3因素3水平正交试验。以其对安梨汁褐变抑制率为考察指标,确定复合护色剂最佳配比,正交试验因素与水平见表1。
表1 复合护色剂配比优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for compound color protectants ratio optimization
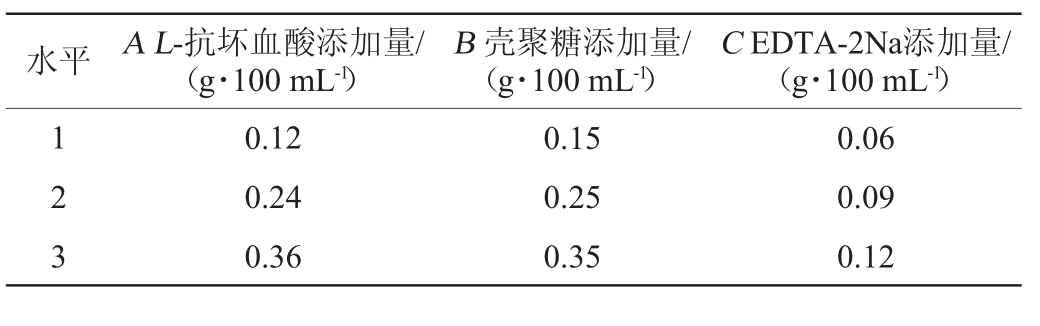
水平 A L-抗坏血酸添加量/(g·100 mL-1)B 壳聚糖添加量/(g·100 mL-1)C EDTA-2Na添加量/(g·100 mL-1)1 2 3 0.12 0.24 0.36 0.15 0.25 0.35 0.06 0.09 0.12
1.3.4 低醇安梨果酒发酵工艺优化
(1)单因素试验
通过单因素试验研究初始糖度、发酵时间、发酵温度、酵母菌接种量对低醇安梨果酒品质的影响,以确定低醇安梨果酒最优酒精发酵工艺条件。固定初始糖度10%、发酵时间96 h、发酵温度25 ℃、酵母菌接种量为0.1%,以感官评分和酒精度为评价指标,考察不同酵母菌接种量(0.06%、0.08%、0.10%、0.12%、0.14%)、初始糖度(6%、8%、10%、12%、14%)、发酵温度(21 ℃、23 ℃、25 ℃、27 ℃、29 ℃)、发酵时间(24 h、48 h、72 h、96 h、120 h)对低醇安梨果酒品质的影响。
(2)响应面试验
根据单因素试验结果,选择初始糖度(A)、发酵时间(B)、发酵温度(C)、酵母菌接种量(D)为自变量,以感官评分(Y)为响应值,设计4因素3水平响应面试验,确定低醇安梨果酒最佳发酵工艺条件,响应面试验设计因素与水平见表2。
表2 发酵工艺优化响应面试验因素与水平
Table 2 Factors and levels of response surface tests for fermentation process optimization
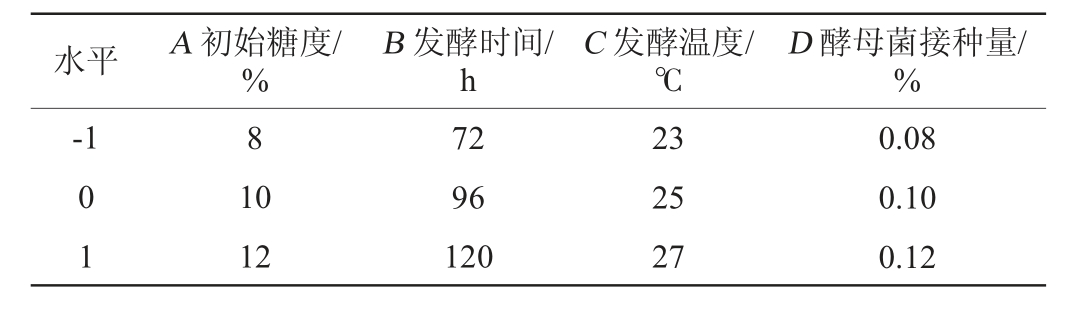
水平 A 初始糖度/%D 酵母菌接种量/%-1 B 发酵时间/h C 发酵温度/℃8 0 1 10 12 72 96 120 23 25 27 0.08 0.10 0.12
1.3.5 低醇安梨果酒感官评价及基础理化指标测定
邀请10名(5男5女)具有专业感官评价经验的人员分别从口感、香气、色泽、澄清度对果酒进行感官评价,满分100分,低醇安梨果酒感官评分标准见表3。
表3 低醇安梨果酒感官评分标准
Table 3 Sensory evaluation standards of low-alcohol Anli wine
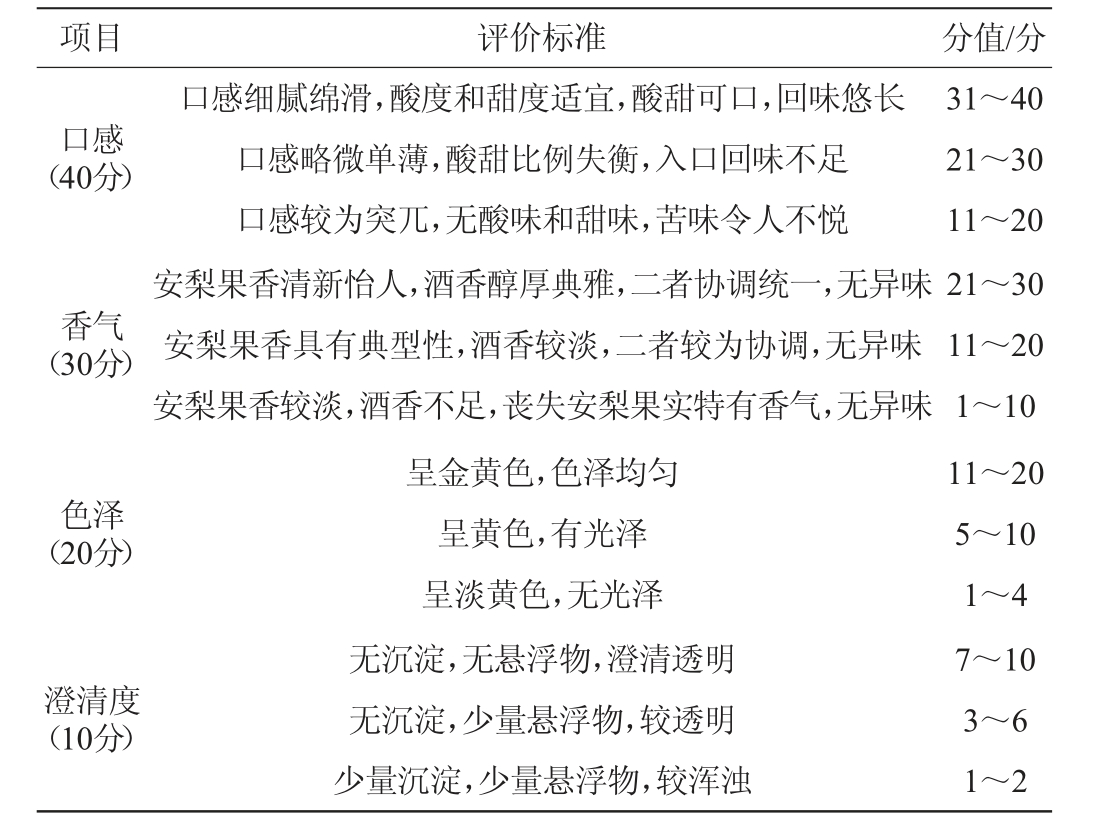
项目 评价标准 分值/分口感(40分)口感细腻绵滑,酸度和甜度适宜,酸甜可口,回味悠长口感略微单薄,酸甜比例失衡,入口回味不足口感较为突兀,无酸味和甜味,苦味令人不悦31~40 21~30 11~20香气(30分)安梨果香清新怡人,酒香醇厚典雅,二者协调统一,无异味安梨果香具有典型性,酒香较淡,二者较为协调,无异味安梨果香较淡,酒香不足,丧失安梨果实特有香气,无异味色泽(20分)澄清度(10分)呈金黄色,色泽均匀呈黄色,有光泽呈淡黄色,无光泽无沉淀,无悬浮物,澄清透明无沉淀,少量悬浮物,较透明少量沉淀,少量悬浮物,较浑浊21~30 11~20 1~10 11~20 5~10 1~4 7~10 3~6 1~2
酒精度的测定:参考GB 5009.225—2023《食品安全国家标准酒中乙醇浓度的测定》[14];总酸含量、总糖含量的测定:参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》[15]中的电位滴定法、直接滴定法;
1.3.6 低醇安梨果酒挥发性风味化合物测定
利用HS-SPME-GC-MS技术对低醇安梨果酒发酵后的挥发性风味化合物进行测定[16-17]。
HS-SPME条件:称取5mL低醇安梨果酒样品置于20 mL顶空瓶中,加入饱和氯化钠,压盖,置于80 ℃水浴中平衡20 min后,再将固相微萃取针扎进顶空中,继续放入80 ℃水浴中30 min,进样口250 ℃解吸5 min。
GC条件:HP-5MS色谱柱(30 m×0.25 mm×0.25 μm);升温程序为初温50 ℃保持2 min,以5 ℃/min升至180 ℃保持5 min,再以10 ℃/min升至250 ℃,保持5 min;进样口温度250 ℃;传输线温度280 ℃;载气流速1.0 mL/min;不分流进样。
MS条件:离子源温度230 ℃;四级杆温度150 ℃;电子电离(electronic ionization,EI)源;全扫描模式,扫描范围为40~600 m/z。
定性定量方法:通过美国国家标准技术研究所(national institute of standards and technology,NIST)MS Search2.3数据库进行物质鉴定,根据保留时间对检测组分进行定性分析,并采用峰面积归一法计算低醇安梨果酒各香气成分相对含量。
1.3.7 数据处理
采用软件IBM SPSS Statistics 29.0对单因素试验数据以及正交试验数据进行统计处理与分析;采用软件Design-Expert 10.0.6进行响应面试验设计以及数据处理;采用Origin 2022绘图。
2 结果与分析
2.1 复合护色剂配比优化单因素试验
2.1.1 L-抗坏血酸添加量的确定
L-抗坏血酸是一种抗氧化活性较强的酸性多羟基化合物[18],可以通过复原被多酚氧化酶(polyphenol oxidase,PPO)氧化成醌的多酚起到抑制果汁颜色加深,继而起到抑制酶促褐变的作用。L-抗坏血酸添加量对安梨汁褐变的影响结果见图1。
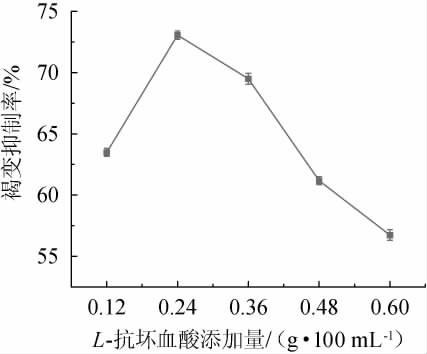
图1 L-抗坏血酸添加量对安梨汁褐变的影响
Fig.1 Effect of L-ascorbic acid addition on browning of Anli juice
由图1可知,随着L-抗坏血酸添加量在0.12~0.24 g/100 mL范围内增加,安梨汁褐变抑制率逐渐增加;当L-抗坏血酸添加量为0.24 g/100 mL时,褐变抑制率最高,为73.164%;当L-抗坏血酸添加量>0.24 g/100 mL之后,褐变抑制率逐渐降低,可能浓度过高引发自身氧化的产物生成褐色素造成颜色加深[19]。因此,确定L-抗坏血酸最佳添加量为0.24 g/100 mL。
2.1.2 壳聚糖添加量的确定
壳聚糖是一种碱性多聚氨基葡萄糖,其分子中的羟基和氨基反应活性较为良好,同时氨基会在与金属铜离子发生配位反应的情况下形成络合物[20],从而抑制PPO活性,起到防止酶促褐变的效果。壳聚糖添加量对安梨汁褐变的影响结果见图2。
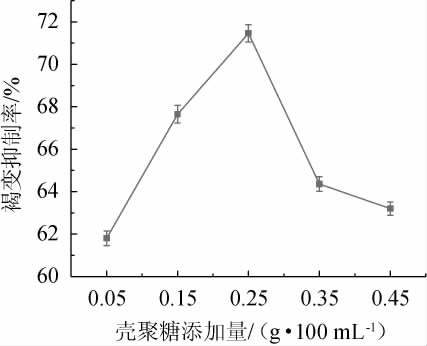
图2 壳聚糖添加量对安梨汁褐变的影响
Fig.2 Effect of chitosan addition on browning of Anli juice
由图2可知,随着壳聚糖添加量在0.05~0.25 g/100 mL范围内增加,安梨汁褐变抑制率随之上升;当壳聚糖添加量为0.25 g/100 mL时,褐变抑制率最高,为71.395%;当壳聚糖添加量>0.25 g/100 mL之后,褐变抑制率逐渐降低。因此,确定壳聚糖最适添加量为0.25 g/100 mL。
2.1.3 EDTA-2Na添加量的确定
EDTA-2Na是一种含有羟基和氨基的金属螯合剂,能够对PPO的辅基(铜离子)起到螯合作用,从而降低PPO的活性来达到抑制氧化褐变的效果[21],EDTA-2Na添加量对安梨汁褐变的影响结果见图3。
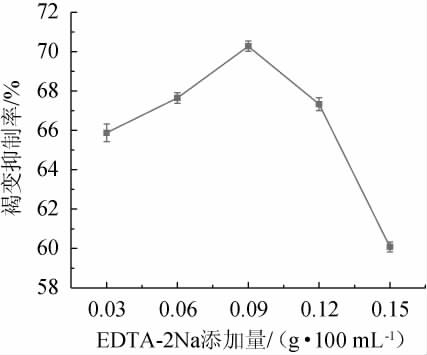
图3 EDTA-2Na添加量对安梨汁褐变的影响
Fig.3 Effect of EDTA-2Na addition on browning of Anli juice
由图3可知,随着EDTA-2Na添加量在0.03~0.09g/100mL范围内增加,安梨汁褐变抑制率逐渐提高;当EDTA-2Na添加量为0.09 g/100 mL时,安梨汁褐变抑制率最高,为70.237%;当EDTA-2Na添加量>0.09 g/100 mL之后,褐变抑制率降低。因此,确定EDTA-2Na的最适添加量为0.09 g/100 mL。
2.1.4 复合护色剂配比优化正交试验
为考察安梨汁复合护色剂最佳配比,根据单因素试验结果,进行3因素3水平正交试验,以褐变抑制率为评价指标,确定安梨汁复合护色剂最佳配比,正交试验设计与结果见表4。
表4 复合护色剂配比优化正交试验结果与分析
Table 4 Results and analysis of orthogonal tests for compound color protectants ratio optimization
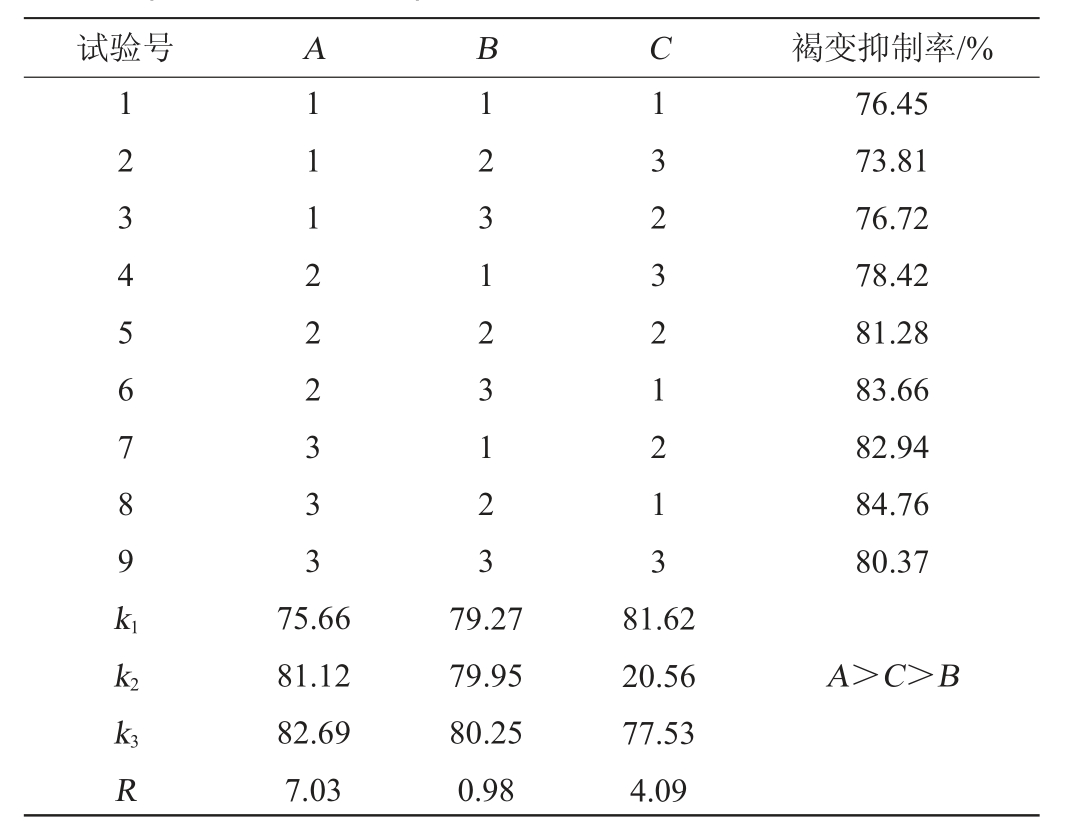
试验号 A B C 褐变抑制率/%1 23456789k1 111222333 1 231 23123 1323 2121 3 76.45 73.81 76.72 78.42 81.28 83.66 82.94 84.76 80.37 k2 A>C>B k3R 75.66 81.12 82.69 7.03 79.27 79.95 80.25 0.98 81.62 20.56 77.53 4.09
由表4可知,复合护色剂最佳配比组合为A3B2C1,即L-抗坏血酸添加量为0.36g/100mL,壳聚糖添加量为0.35g/100mL,EDTA-2Na添加量为0.06 g/100 mL。该优化条件下,安梨汁色泽淡黄,通透澄清。
2.2 单因素试验优化低醇安梨果酒发酵工艺条件
2.2.1 初始糖度对低醇安梨果酒品质的影响
由图4可知,当初始糖度为6%~10%时,其酒精度及感官评分也随之上升;当初始糖度为10%时,安梨果酒糖酸比例适中口感酸甜可口,感官评分、酒精度最高,分别为84.38分、4.09%vol;当初始糖度>10%之后,会对酒体内酵母菌的繁殖起到抑制作用[22],造成酵母菌发酵不充分,发酵性能减弱,感官评分与酒精度下降。因此,确定最佳初始糖度为10%。
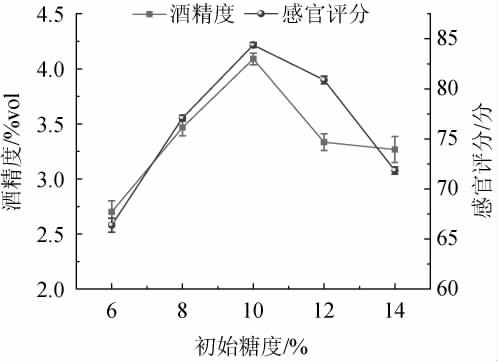
图4 初始糖度对低醇安梨果酒品质的影响
Fig.4 Effect of initial sugar content on the quality of low-alcohol Anli wine
2.2.2 发酵时间对低醇安梨果酒品质的影响
由图5可知,当发酵时间为24~96 h时,低醇安梨果酒感官评分与酒精度随之增加;当发酵时间为96 h时,安梨果酒感官评分、酒精度最高,分别为82.94分、4.13%vol;当发酵时间>96 h之后,感官评分及酒精度有所下降。可能是由于碳源短缺,酵母开始利用乙醇作为碳源造成的下降。因此,确定最佳发酵时间为96 h。
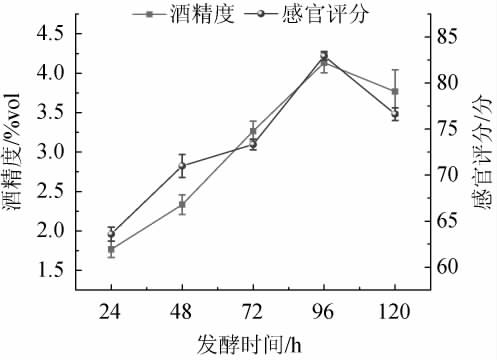
图5 发酵时间对低醇安梨果酒品质的影响
Fig.5 Effect of fermentation time on the quality of low-alcohol Anli wine
2.2.3 发酵温度对低醇安梨果酒品质的影响
由图6可知,当发酵温度为21~25 ℃时,低醇安梨果酒感官评分与酒精度随之增加;当发酵温度为25 ℃时,安梨果酒感官评分、酒精度最高,分别为83.12分、4.57vol;当发酵温度高于25 ℃之后,酒精度及感官评分有所下降。由于酵母菌的代谢效率提高,发酵过早进入稳定期从而结束时间早[23],导致挥发性风味物质形成量降低。因此,确定最佳发酵温度为25 ℃。
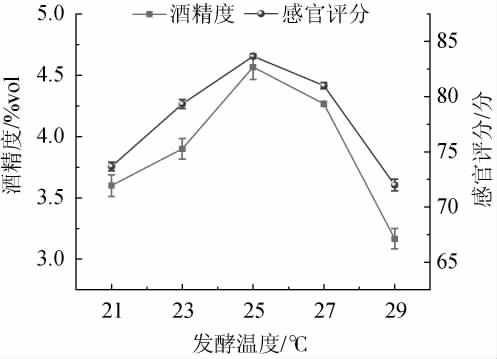
图6 发酵温度对低醇安梨果酒品质的影响
Fig.6 Effect of fermentation temperature on the quality of low-alcohol Anli wine
2.2.4 酵母菌接种量对低醇安梨果酒品质的影响
由图7可知,当酵母菌接种量为0.06%~0.10%时,低醇安梨果酒感官评分与酒精度随之增加;当酵母菌接种量为0.10%时,安梨果酒感官评分、酒精度最高,分别为84.12分、4.37%vol;当酵母菌接种量>0.10%之后,酒体内酵母菌大量繁殖消耗营养成分并产生大量代谢物造成碳源的过度消耗,感官评分和酒精度开始降低[24]。因此,确定酵母菌最佳接种量为0.10%。
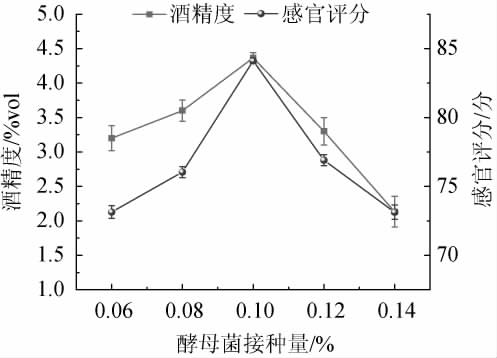
图7 酵母菌接种量对低醇安梨果酒品质的影响
Fig.7 Effect of yeast inoculum on the quality of low-alcohol Anli wine
2.2.5 响应面试验优化低醇安梨果酒发酵工艺
根据单因素试验结果,选择初始糖度(A)、发酵时间(B)、发酵温度(C)、酵母菌接种量(D)为自变量,以感官评分(Y)为响应值,设计4因素3水平响应面试验,确定低醇安梨果酒最佳发酵工艺条件,响应面试验设计结果见表5,回归模型方差分析结果见表6。
表5 响应面试验设计与结果
Table 5 Design and results of response surface tests
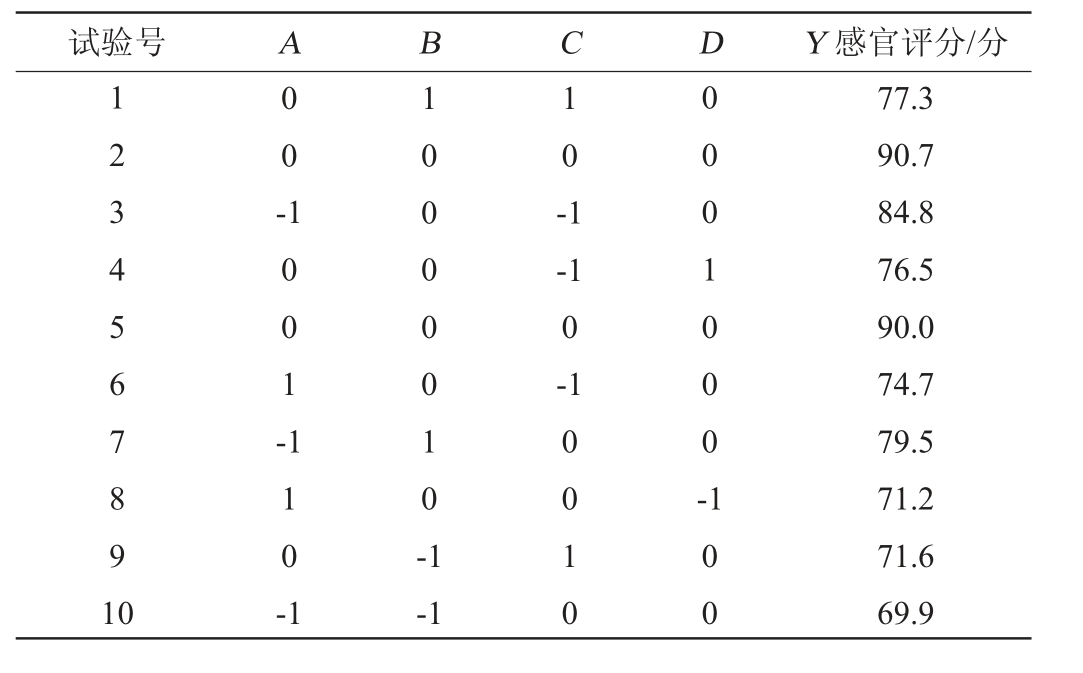
试验号 A B C D Y 感官评分/分1234567891 0 0 0 -1 0 0 1 -1 0 -1-1 0-1 1 1 0 -1 100000 10-1 0 0 0 1 0 0 0 --1 0010 100 77.3 90.7 84.8 76.5 90.0 74.7 79.5 71.2 71.6 69.9
续表
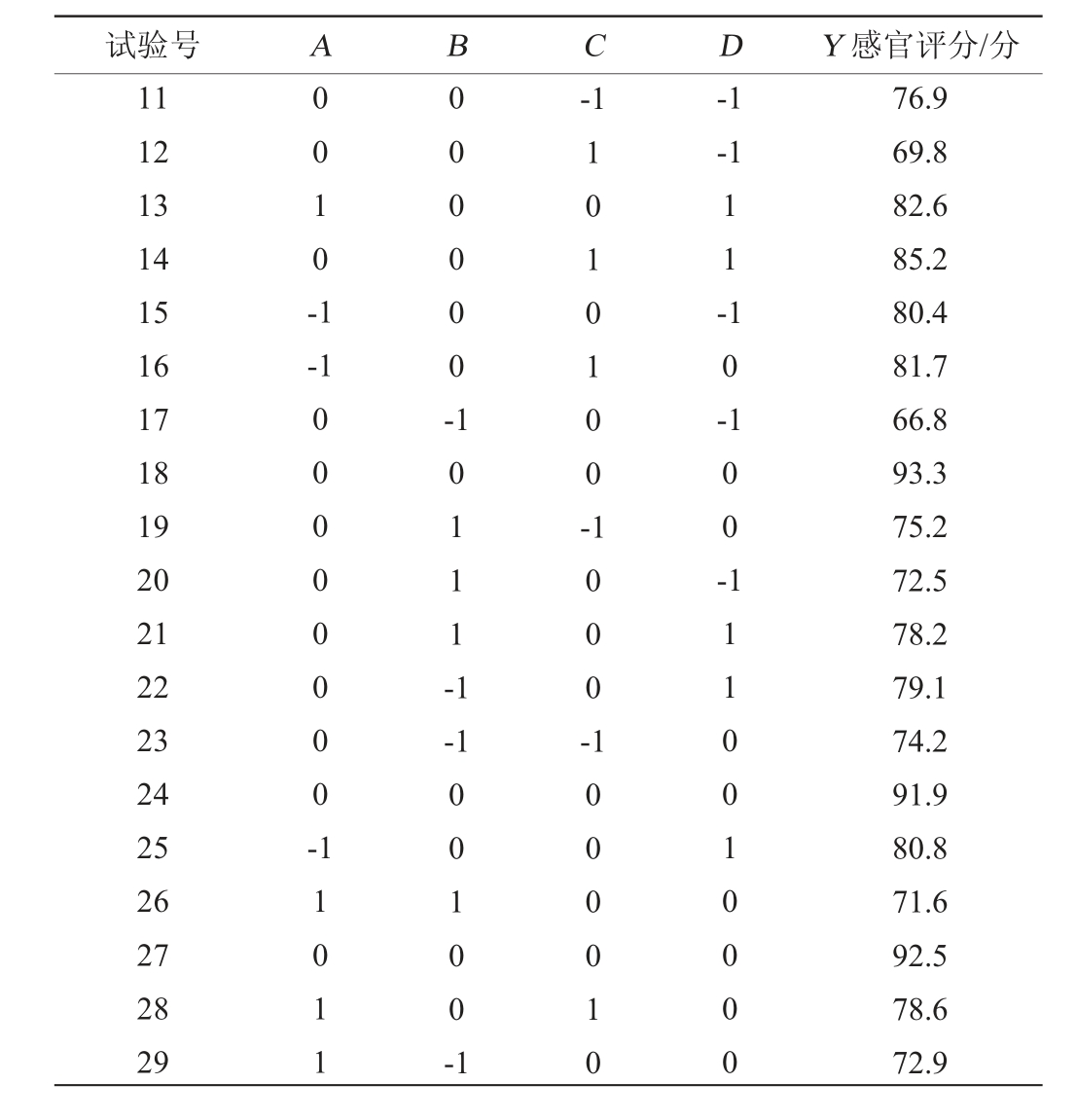
试验号 A B C 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 0010-1-1 D Y 感官评分/分-1-1 000000-1010100-11--1 00000000-10111-1 10-100--1 1000-11011 00100-1 1000010 1110010000 76.9 69.8 82.6 85.2 80.4 81.7 66.8 93.3 75.2 72.5 78.2 79.1 74.2 91.9 80.8 71.6 92.5 78.6 72.9
表6 回归模型方差分析
Table 6 Variance analysis of regression model
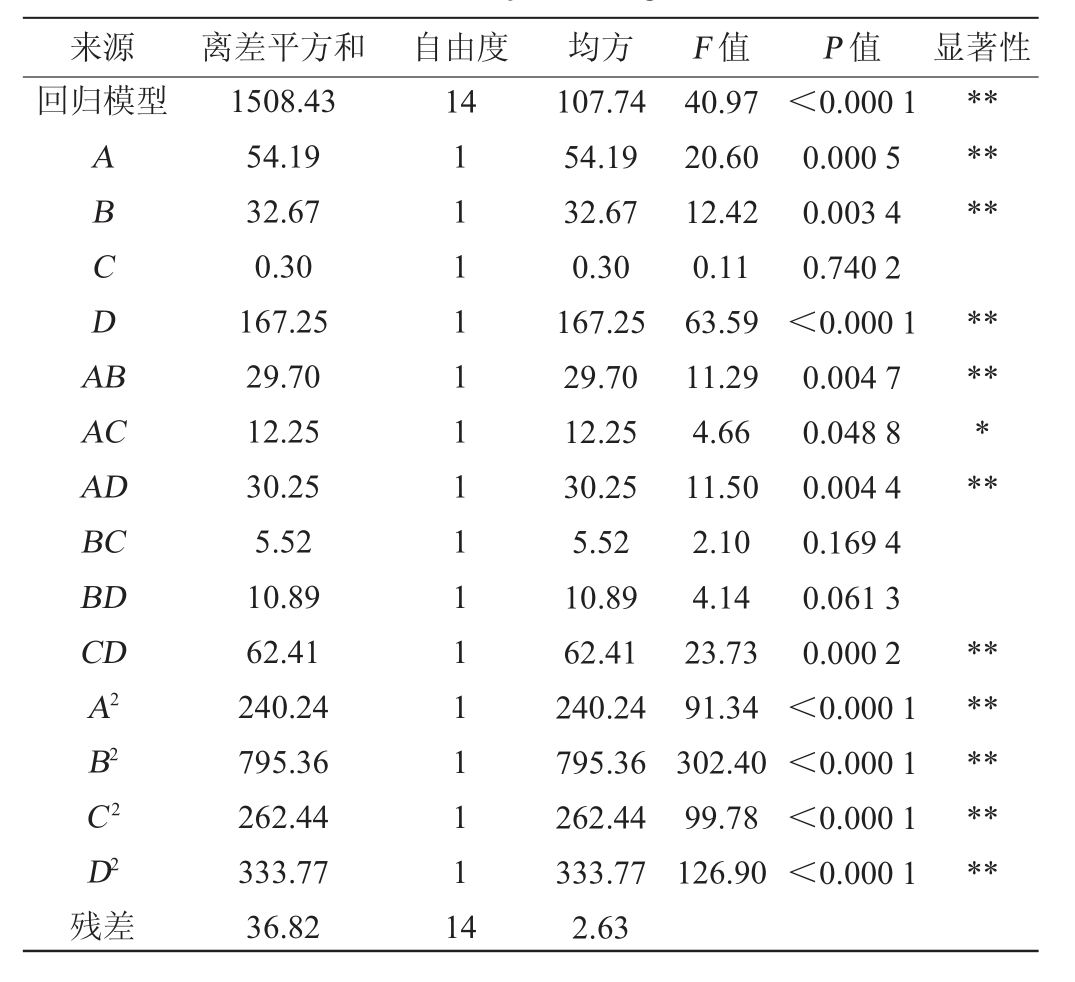
来源 离差平方和 自由度 均方 F 值 P 值 显著性回归模型14 ABCDA B******AC AD BC BD CD A2 B2 C2 D2残差1508.43 54.19 32.67 0.30 167.25 29.70 12.25 30.25 5.52 10.89 62.41 240.24 795.36 262.44 333.77 36.82 111111111111111 4 107.74 54.19 32.67 0.30 167.25 29.70 12.25 30.25 5.52 10.89 62.41 240.24 795.36 262.44 333.77 2.63 40.97 20.60 12.42 0.11 63.59 11.29 4.66 11.50 2.10 4.14 23.73 91.34 302.40 99.78 126.90<0.000 1 0.000 5 0.003 4 0.740 2<0.000 1 0.004 7 0.048 8 0.004 4 0.169 4 0.061 3 0.000 2<0.000 1<0.000 1<0.000 1<0.000 1*****************
续表
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
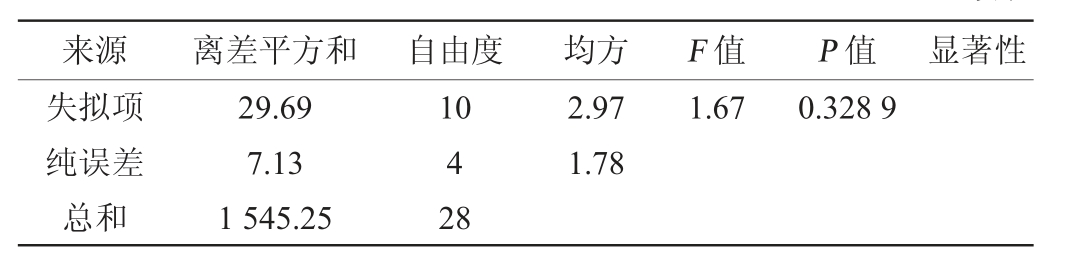
来源 离差平方和 自由度 均方 F 值 P 值 显著性失拟项纯误差总和29.69 7.13 1 545.25 10 4 28 2.97 1.78 1.67 0.328 9
以初始糖度(A)、发酵时间(B)、发酵温度(C)、酵母菌接种量(D)为自变量,以感官评分(Y)作为响应值,对响应面试验数据结果多元回归拟合,拟合方程如下:

由表6可知,回归模型极显著(P<0.01),失拟项P值为0.328 9>0.05,影响不显著,该模型决定系数R2为0.976 2,调整决定系数R2adj为0.952 3,能够解释95.23%的响应值变异,说明此响应面试验模型与数据拟合程度良好,具有较高的可靠性。由P值可知,一次项A、B、D,交互项AB、AD,二次项A2、B2、C2、D2对结果影响极显著(P<0.01);交互项AC对结果影响显著(P<0.05)。由F值可知,4个因素对结果影响顺序为酵母菌接种量(D)>初始糖度(A)>发酵时间(B)>发酵温度(C)。
各因素交互作用对低醇安梨果酒感官评分影响的响应面及等高线见图8。由图8可知,各因素交互作用中,AB、AD、CD、AC响应曲面陡峭,等高线为椭圆形,说明交互作用对结果影响显著;BC响应曲面平缓,等高近似圆形,说明交互作用对结果影响不显著,这与表6方差分析结果一致。
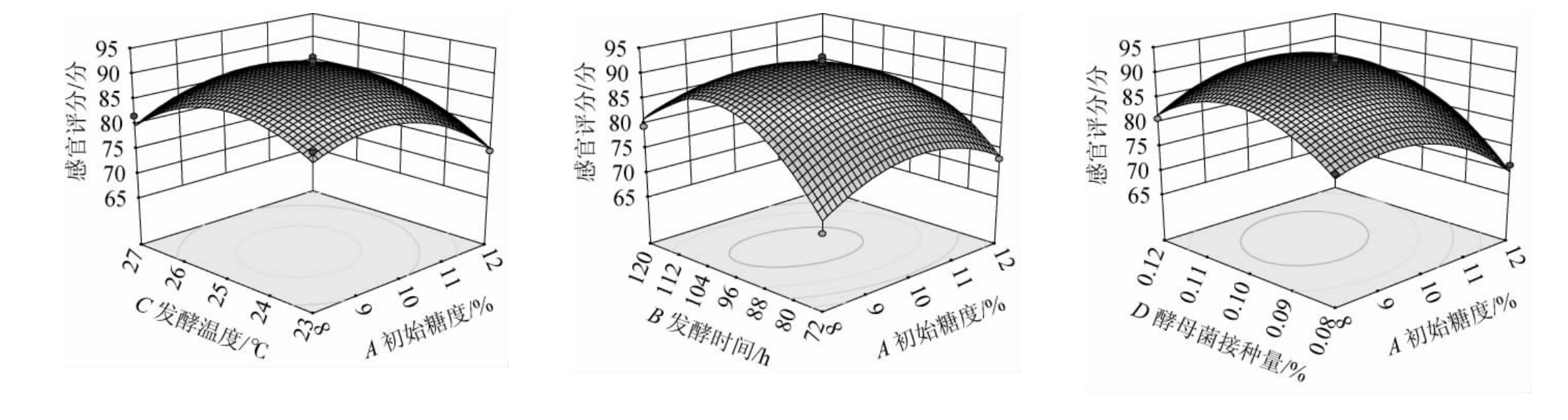
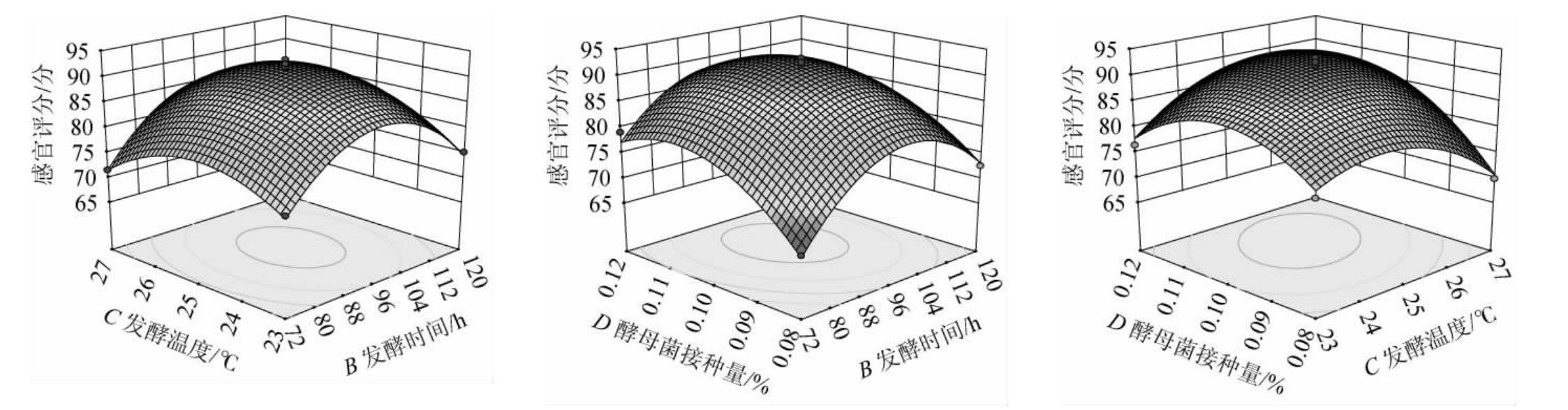
图8 各因素间交互作用对低醇安梨果酒感官评分影响的响应曲面及等高线
Fig.8 Response surface plots and contour lines of effects of interaction between various factors on sensory scores of low-alcohol Anli wine
利用软件Design-Expert 10.0.6对回归方程进行计算,预测低醇安梨果酒最佳发酵工艺条件为:初始糖度9.753%、发酵时间97.805h、发酵温度25.160℃、酵母菌接种量0.105%。在此条件下,感官评分预测值为92.346分。根据实际操作可行性,将低醇安梨果酒发酵工艺条件调整为初始糖度9.8%、发酵时间98 h、发酵温度25 ℃、酵母菌接种量0.1%。在此条件下进行3次平行验证试验,感官评分实际值为93.42分,与预测值相近。此工艺条件下,低醇安梨果酒总酸含量7.35 g/L、总糖含量0.26%、酒精度4.35%vol。低醇安梨果酒色泽金黄、入口润泽,具备低醇安梨果酒典型性。
2.3 低醇安梨果酒挥发性风味化合物HS-SPME-GC-MS分析
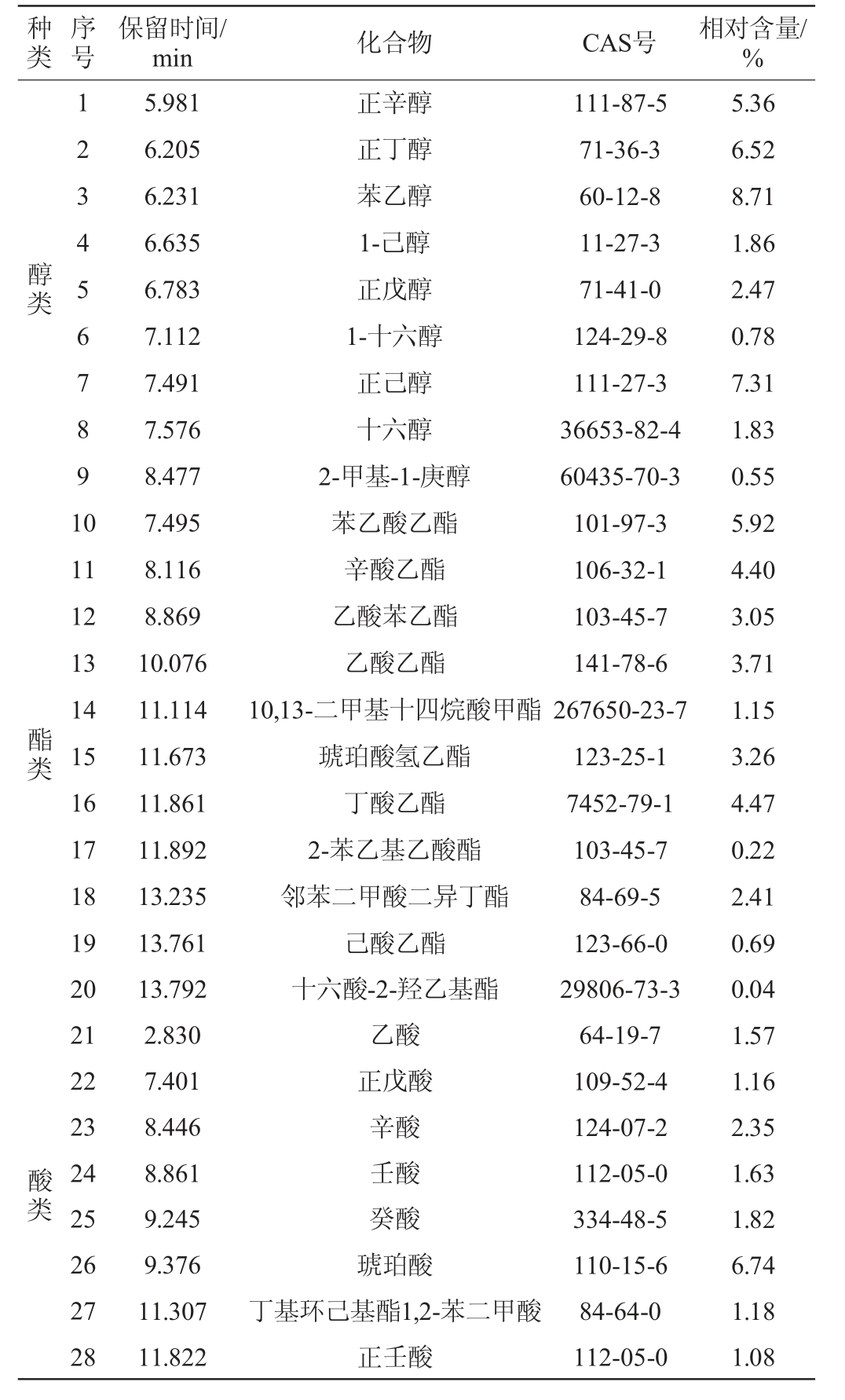
采用HS-SPME-GC-MS法对低醇安梨果酒的挥发性风味化合物含量进行分析,结果见表7。
表7 低醇安梨果酒挥发性风味化合物含量测定结果
Table 7 Determination results of volatile flavor compounds contents in low-alcohol Anli fruit wine
种类序号保留时间/min 化合物 CAS号 相对含量/%醇类1 2 3 4 5 6 7 8 9 1 0酯类酸类11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 5.981 6.205 6.231 6.635 6.783 7.112 7.491 7.576 8.477 7.495 8.116 8.869 10.076 11.114 11.673 11.861 11.892 13.235 13.761 13.792 2.830 7.401 8.446 8.861 9.245 9.376 11.307 11.822正辛醇正丁醇苯乙醇1-己醇正戊醇1-十六醇正己醇十六醇2-甲基-1-庚醇苯乙酸乙酯辛酸乙酯乙酸苯乙酯乙酸乙酯10,13-二甲基十四烷酸甲酯琥珀酸氢乙酯丁酸乙酯2-苯乙基乙酸酯邻苯二甲酸二异丁酯己酸乙酯十六酸-2-羟乙基酯乙酸正戊酸辛酸壬酸癸酸琥珀酸丁基环己基酯1,2-苯二甲酸正壬酸111-87-5 71-36-3 60-12-8 11-27-3 71-41-0 124-29-8 111-27-3 36653-82-4 60435-70-3 101-97-3 106-32-1 103-45-7 141-78-6 267650-23-7 123-25-1 7452-79-1 103-45-7 84-69-5 123-66-0 29806-73-3 64-19-7 109-52-4 124-07-2 112-05-0 334-48-5 110-15-6 84-64-0 112-05-0 5.36 6.52 8.71 1.86 2.47 0.78 7.31 1.83 0.55 5.92 4.40 3.05 3.71 1.15 3.26 4.47 0.22 2.41 0.69 0.04 1.57 1.16 2.35 1.63 1.82 6.74 1.18 1.08
续表
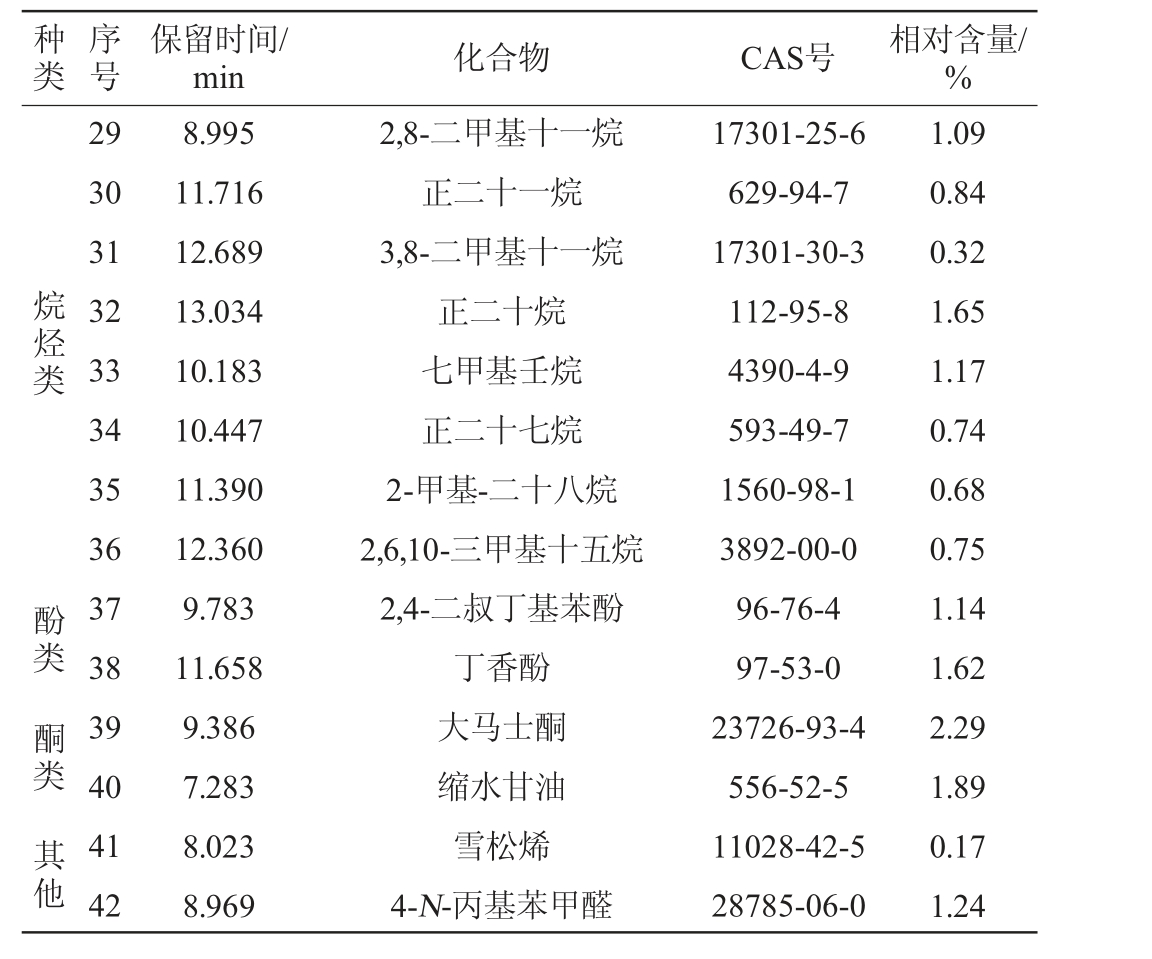
种类序号保留时间/min 化合物 CAS号 相对含量/%烷烃类 酚类 酮类 其他29 30 31 32 33 34 35 36 37 38 39 40 41 42 8.995 11.716 12.689 13.034 10.183 10.447 11.390 12.360 9.783 11.658 9.386 7.283 8.023 8.969 2,8-二甲基十一烷正二十一烷3,8-二甲基十一烷正二十烷七甲基壬烷正二十七烷2-甲基-二十八烷2,6,10-三甲基十五烷2,4-二叔丁基苯酚丁香酚大马士酮缩水甘油雪松烯4-N-丙基苯甲醛17301-25-6 629-94-7 17301-30-3 112-95-8 4390-4-9 593-49-7 1560-98-1 3892-00-0 96-76-4 97-53-0 23726-93-4 556-52-5 11028-42-5 28785-06-0 1.09 0.84 0.32 1.65 1.17 0.74 0.68 0.75 1.14 1.62 2.29 1.89 0.17 1.24
由表7可知,低醇安梨果酒酒精发酵后共检测出挥发性风味化合物42种,包括醇类9种(35.39%)、酯类11种(29.32%)、酸类8种(17.53%)、烷烃类8种(7.24%)、酚类2种(2.76%)、酮类1种(2.29%)、其他类3种(3.3%)。
果酒酿造的过程中由于酵母菌发酵以及糖代谢等微生物转化作用下生成醇类化合物,是影响果酒香气与口感表现的重要物质之一[25]。醇类物质是低醇安梨果酒酒精发酵后含量最高的挥发性物质,其中含量较高的主要包括苯乙醇(8.71%)、正己醇(7.31%)、正丁醇(6.52%)等化合物。其中苯乙醇是梨果中的天然香气成分,通过酵母发酵转化为挥发性化合物,具有玫瑰花香[26],正己醇和正丁醇赋予酒体果香和清香。酯类物质是低醇安梨果酒酒精发酵后种类最为丰富的化合物,是构成低醇安梨果酒香气成分的重要来源[27],能够赋予梨酒清爽宜人的酒香,主要包括苯乙酸乙酯(5.92%)、丁酸乙酯(4.47%)、辛酸乙酯(4.40%)等化合物,促使果酒香气更加温和,并且为发酵后的梨酒赋予果香、蜂蜜香、菠萝香以及白兰地酒香等香气特征[28]。酸类物质是水果本身及酵母菌代谢的次级产物,同时也是合成酯类的前体物质[29],其中低醇安梨果酒酒精发酵后含量较高的主要为琥珀酸(6.74%)、辛酸(2.35%)等化合物。适量的酸类物质在提升酒体后回味,平衡酒体刺激味道的同时,赋予酒体清爽的口感和一定的乳酪香气。另外低醇安梨果酒酒精发酵后酒体内少量的烷烃类化合物、醛酮类化合物、萜烯类化合物以及酚类化合物共同促进果酒的呈香表现更加的均衡立体。经过酒精发酵的低醇安梨果酒中挥发性化合物种类十分丰富,呈香效果更加协调,果酒感官品质较好。
3 结论
本研究通过单因素及正交试验确定低醇安梨果酒复合护色剂最佳配比为L-抗坏血酸0.36 g/100 mL、壳聚糖0.35 g/100 mL、EDTA-2Na 0.06 g/100 mL;通过单因素及响应面试验确定低醇安梨果酒酒精发酵最佳发酵工艺条件为初始糖度9.8%、发酵时间98 h、发酵温度25 ℃、酵母菌接种量0.1%。在此优化条件下,果酒酒精度为4.35%vol,感官评分为93.42分。通过HS-SPME-GC-MS法共检测出低醇安梨果酒中42种挥发性风味化合物,其中包括醇类9种、酯类11种、酸类8种、烷烃类8种、醛类2种、酮类1种、其他类3种。本研究拓展了安梨深加工领域,为低醇安梨果酒的高值工业化生产提供了理论前提与技术基础。
[1]高海生.安梨系列产品加工工艺研究[D].杨凌:西北农林科技大学,2007.
[2]任鑫,彭飞,陈丽楠,等.安梨果渣可溶性膳食纤维微波辅助酶法提取工艺优化及结构表征[J].食品工业科技,2022,43(7):191-198.
[3]BRAHEM M,BORNARD I,RENARD C M G C,et al.Multiscale localization of procyanidins in ripe and overripe perry pears by light and transmission electron microscopy[J].J Agr Food Chem,2020,68(33):8900-8906.
[4]曲建辉.安梨中三萜类化合物的分离提取与成分分析[D].秦皇岛:河北科技师范学院,2014.
[5]周云,张一凡,朱俊杰,等.安梨小米酒的研制[J].农业科技与装备,2020(5):40-43.
[6]杨冰峰.安梨膏工艺优化及其渣粉理化特性研究[D].秦皇岛:河北科技师范学院,2016.
[7]曹晓云,刘永富,石娟华,等.东北地区秋子梨果实糖酸、酚类成分及其生物活性分析[J].沈阳农业大学学报,2021,52(2):145-152.
[8]孔明明.安梨果酒的制备工艺优化[D].天津:天津中医药大学,2020.
[9]孙翠焕,陈丽媛,徐冲,等.安梨酒发酵菌株筛选及工艺优化[J].食品安全质量检测学报,2014,5(12):4026-4031.
[10]张大为,张洁,王能强,等.安梨果酒降酸工艺条件的研究及香气成分分析[J].酿酒科技,2015(8):74-82.
[11]高红芳.低醇果酒生产技术及微生物控制方法研究进展[J].农产品加工,2020(17):64-66,73.
[12]桂雪梅,张乐,焦士蓉.混菌发酵低醇菠萝果酒的研究[J].食品科技,2023,48(8):65-73.
[13] LOPEZ-TOLEDANO A,MAYEN M,MERIDA J, et al.Yeast-induced inhibition of(+)-catechin and(-)-epicatechin degradation in model solutions[J].J Agr Food Chem,2002,50(6):1631-1635.
[14]中华人民共和国国家卫生和计划生育委员会.GB 5009.225—2023食品安全国家标准酒中乙醇浓度的测定[S].北京:中国标准出版社,2023.
[15]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[16] YAQUB G, HAMID A, KHAN N, et al.Biomonitoring of workers exposed to volatile organic compounds associated with different occupations by headspace GC-FID[J].J Chem,2020,2020:1-8.
[17] GAY M,LEMPEREUR L,FRANCIS F,et al.Control of Dermanyssus gallinae(De Geer 1778)and other mites with volatile organic compounds,A review[J].Parasitology,2020,147(7):731-739.
[18]SHARMA T,KUMAR A,SHAH S S,et al.Analysis of interactions between streptomycin sulphate and aqueous food acids (L-ascorbic acid and citric acid):Physicochemical and spectroscopic insights[J].J Chem Thermodyn,2020,151:106207.
[19]LANDI M,DEGL'INNOCENTI E,GUGLIELMINETTI L,et al.Role of ascorbic acid in the inhibition of polyphenol oxidase and the prevention of browning in different browning-sensitive Lactuca sativa var.capitata(L.) and Eruca sativa (Mill) stored as fresh-cut produce[J].J Sci Food Agr,2013,93(8):1814-1819.
[20]MARTÍN-DIANA A B,RICO D,BARAT J M,et al.Orange juices enriched with chitosan:Optimisation for extending the shelf-life[J].Innov Food Sci Emerg,2009,10(4):590-600.
[21]王祖建,崔子玟,李柯凡.仙人掌果红色素的提取及在风味饮料中的应用研究[J].安徽农学通报,2023,29(5):129-130,142.
[22]张卓睿,孙冰瑶,夏明钰,等.刺玫果山荆子桤叶唐棣复合果酒的研制[J].中国酿造,2023,42(9):187-192.
[23]陈君蕊,苏良敏,成欣,等.桂花青脆李复合香型果酒的酿造工艺优化[J/OL].食品工业科技:1-17[2023-10-17].https://doi.org/10.13386/j.issn1002-0306.2023020302.
[24]罗玲,何静,徐丽萍,等.猕猴桃汁中酵母菌的分离鉴定及应用[J].中国酿造,2023,42(8):103-110.
[25] JIANG X H, LU Y Y, LIU S Q.Effects of pectinase treatment on the physicochemical and oenological properties of red dragon fruit wine fermented with Torulaspora delbrueckii[J].LWT-Food Sci Technol,2020,132:109929.
[26]马烁,赵华.不同发酵工艺对香水梨酒品质指标及香气成分的影响[J].中国酿造,2022,41(11):135-139.
[27] LU Y Y,CHAN L J,LI X,et al.Effects of different inoculation strategies of Saccharomyces cerevisiae and Williopsis saturnus onchemical components of mango wine[J].LWT-Food Sci Technol,2018,87:85-92.
[28] ZHONG S T, XIN A Z, BRENNANR M A, et al.Characterization of aroma profile and characteristic aromas during lychee wine fermentation[J].J Food Process Preserv,2019,43(8):e14003.
[29]JIANG B,XI Z M,LUO M J,et al.Comparison on aroma compounds in Cabernet Sauvignon and merlot wines from four wine grape-growing regions in China[J].Food Res Int,2013,51(2):482-489.