蓝莓是抗氧化性最高的水果之一,富含活性酶和各种酚类物质,包括花色苷、黄酮醇和原花青素[1]。然而,由于蓝莓容易受到机械损伤、微生物腐烂和水分流失的影响,因此极易变质,导致保质期短[2]。为了解决这些问题,将蓝莓鲜果进行益生菌发酵用于生产蓝莓酵素,可提高食品保质期、营养及感官品质,并去除食品基质中的不良化合物[3]。
随着人们养生意识的增强,酵素因其较高的营养价值和保健功能逐渐出现在大众的视野中[4]。酵素是指以动物、植物、菌类等为原料,经微生物发酵制得的含有特定生物活性成分的产品[5]。蓝莓浆果经过微生物发酵不仅可以提高蓝莓浆果的利用率,还能提高原料营养多样性和生物活性[6-7]。而益生菌发酵菌种对蓝莓酵素的品质和口感密切相关。益生菌的定义为“当摄入足够量时,为宿主提供健康益处的活的微生物”[8]。基于乳酸菌的发酵有助于提高食物的营养价值和消化率,控制潜在感染,还与功能性生物活性物质有关[9]。植物乳杆菌(Lactobacillus plantarum)是最常用于发酵植物性食品的菌种[10]。干酪乳杆菌(Lactobacillus casei)可以产生各种活性酶,将原料基质转化为功能性成分[11]。酵母菌能够促进乳酸菌等有益菌群繁殖,抑制病原微生物生长,提高食物消化率及增强人体免疫力[12]。利用益生菌在水果基质中发酵比乳制品更复杂,并且生长受其他微生物和发酵条件的影响,例如pH、温度、时间等[13-14]。目前,已有关于发酵菌种制备蓝莓酵素的研究报道[15-16]。LI S J等[17]从水果中筛选出植物乳杆菌和发酵乳杆菌,发现其在蓝莓汁中具有良好的发酵能力,活菌数超过10.0 lg CFU/mL,同时提高了酚类含量和抗氧化能力。白琳等[18]利用植物乳杆菌、乳酸片球菌、嗜酸乳杆菌、副干酪乳杆菌、鼠李糖乳杆菌发酵蓝莓果汁,均匀设计确定其最佳接种体积比例分别为22.45%、42.86%、14.29%、16.33%、4.10%,响应面优化最佳发酵工艺为发酵时间36 h,发酵温度37 ℃,初始接种量5.5×106 CFU/mL,初始总可溶性固形物(total soluble solid,TSS)含量为11°Bx,发酵后蓝莓酵素的超氧化物歧化酶(superoxide dismutase,SOD)活力达87.45 U/g。李虹甫等[19]选择植物乳杆菌J26对蓝莓果汁在发酵温度37 ℃、发酵时间24 h、发酵剂接种量3%的条件下进行发酵,活菌数可达1×109 CFU/mL。然而,我国的蓝莓酵素还处于初步阶段,其生产研究和产业化都不完善[20-23]。此外,发酵工艺还存在原料利用率低;发酵参数变化复杂、难以控制且发酵周期较长;营养成分损失大、成本高、品质低、效率差等问题。
本研究以蓝莓为主要原料,以酵母菌、植物乳杆菌(Lactobacillus plantarum)、干酪乳杆菌(Lactobacillus casei)为发酵菌种制备蓝莓酵素,以SOD酶活性为考察指标,首先通过均匀设计试验确定复合菌种的最佳体积接种比例;其次通过单因素试验,考察发酵时间、发酵温度、初始总可溶性固形物含量及料液比对超氧化物歧化酶(SOD)活力的影响;最后通过响应面试验获得最佳发酵工艺条件。以期生产具有高抗氧化能力的新型发酵非乳制饮料,为生产品质优良、营养丰富的蓝莓酵素提供理论依据和技术支持,提高蓝莓的利用率和附加值。
1 材料与方法
1.1 材料与试剂
新鲜蓝莓:产自陕西汉中;葡萄酒果酒专用酵母:安琪酵母股份有限公司;白砂糖:西安沣东新城永胜食品厂;植物乳杆菌(Lactobacillus plantarum)21809、干酪乳杆菌(Lactobacillus casei)6104:中国工业微生物菌种保藏管理中心;果胶酶(30 000 U/g)、纤维素酶(100 000 U/g)、半纤维素酶(50 000 U/g):山东隆科特酶制剂有限公司;MRS肉汤培养基:北京奥博星生物技术有限公司;总超氧化物歧化酶(T-SOD)测定试剂盒:南京建成生物工程研究所;冰乙酸(分析纯):成都市科隆化学品有限公司;无水乙醇(分析纯):天津市富宇精细化工有限公司;氯化钠(分析纯):天津市天力化学试剂有限公司。
1.2 仪器与设备
T6紫外可见分光光度计:北京普析通用仪器有限公司;DSX-18L高压蒸汽灭菌锅:上海博讯医疗生物仪器有限公司;TDZ4A-WS台式低速离心机:湖南湘仪实验室仪器开发有限公司;HH-4数显恒温水浴锅:上海浦东物理光学仪器厂;NR-EW63WXA-H冰箱:中国海尔公司;CP114电子天平:奥豪斯仪器(常州)有限公司;PHS-3C pH计:上海仪电科学仪器有限公司;JYL-C50T打浆机:九阳股份有限公司;DH3600BⅡ电热恒温培养箱:天津市泰斯特仪器公司;SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;手持式折光仪:艾普计量仪器有限公司。
1.3 方法
1.3.1 蓝莓酵素加工工艺流程及操作要点
蓝莓预处理→清洗、打浆→酶解→调整糖度→灭菌→接种→发酵→静置→过滤→蓝莓酵素成品
操作要点:
酵母菌活化:将葡萄酒果酒专用酵母用10倍蒸馏水搅拌均匀至溶解,放置在30~35 ℃恒温水浴锅中活化30 min,当出现大量泡沫即表明活化完毕,取出备用。植物乳杆菌(干酪乳杆菌)活化:将斜面保藏的植物乳杆菌(干酪乳杆菌)在MRS肉汤培养基中活化,两次继代培养后,36 ℃条件下静置培养48 h,备用。
将冷冻的蓝莓(-20 ℃)在4 ℃解冻后清洗晾干,用榨汁机破碎得到蓝莓果浆,在55 ℃条件下加入0.8%的果胶酶、纤维素酶、半纤维素酶(2∶1∶1)酶解3 h[18]。酶解结束后向蓝莓果浆中加入一定量的白砂糖,调整初始TSS含量为12°Bx。采用巴氏杀菌法杀菌(85 ℃、15 min)。将活化完成的酵母菌、植物乳杆菌及干酪乳杆菌接种发酵(采用血球计数板在显微镜下计数保证菌种的活菌数达到109 CFU/mL,体积比为0.1%、2%、0.47%),在31 ℃发酵40 h,4 ℃条件下静置2 h、使用纱布对其过滤,获得蓝莓酵素成品。
1.3.2 复合菌种接种量优化均匀设计试验
根据成福等[24-25]的方法进行3因素8水平的试验设计。均匀设计试验中,以SOD酶活性、pH值为响应值,以3种复合菌种(酵母菌、植物乳杆菌、干酪乳杆菌)的接种体积比例为影响因素。在温度为31 ℃,初始TSS含量为12 °Bx,料液比为1∶5的条件下发酵40 h,均匀设计试验因素与水平见表1。
表1 复合菌种接种量优化均匀设计试验因素及水平
Table 1 Factors and levels of uniform design tests for inoculum optimization of mixed strains
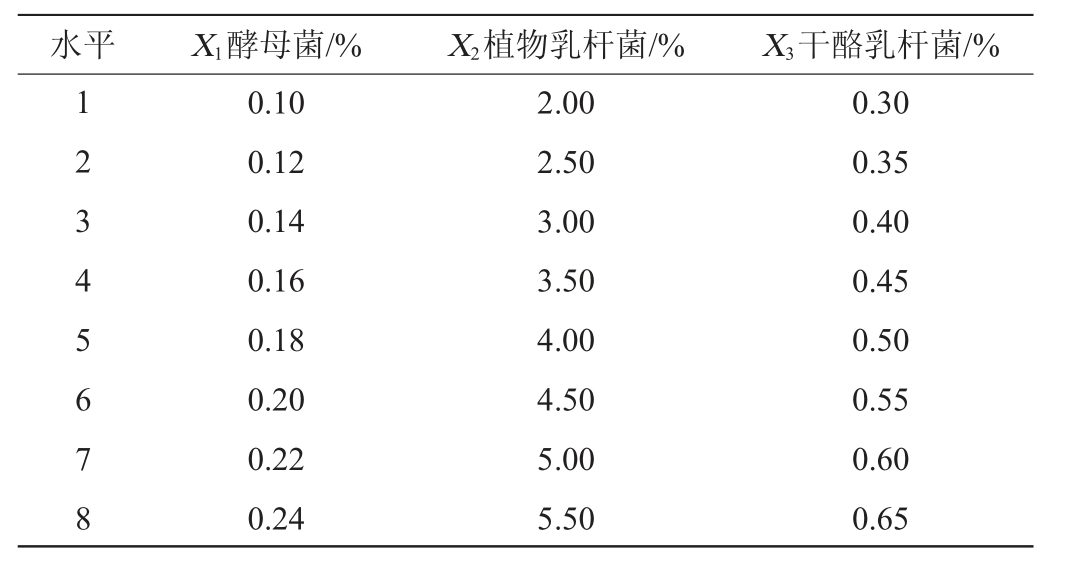
水平 X1酵母菌/% X2植物乳杆菌/% X3干酪乳杆菌/%1 2 3 4 5 6 7 8 0.10 0.12 0.14 0.16 0.18 0.20 0.22 0.24 2.00 2.50 3.00 3.50 4.00 4.50 5.00 5.50 0.30 0.35 0.40 0.45 0.50 0.55 0.60 0.65
1.3.3 发酵条件优化单因素试验
固定各菌种初始接种量为109 CFU/mL,参考上述工艺固定其他指标,考察发酵时间(32 h、36 h、40 h、44 h、48 h)、发酵温度(28 ℃、31 ℃、34 ℃、37 ℃、40 ℃)、料液比(1∶4、1∶5、1∶6、1∶7、1∶8(g∶mL))、初始TSS含量(9°Bx、10°Bx、11°Bx、12°Bx、13°Bx)4个因素对SOD酶活力的影响。
1.3.4 发酵条件优化响应面试验
在单因素试验结果的基础上,以SOD酶活(Y)为响应值,根据Box-Behnken中心组合试验设计原理,选择发酵时间(A)、发酵温度(B)、初始TSS含量(C)、料液比(D)4个因素为自变量,采用4因素3水平的响应面试验,优化蓝莓酵素发酵的最佳工艺条件。发酵条件优化响应面试验因素与水平见表2。
表2 发酵条件优化响应面试验因素与水平
Table 2 Factors and levels of response surface tests for fermentation conditions optimization

水平 A 发酵时间/h D 料液比(g∶mL)-1 B 发酵温度/℃C 初始TSS含量/°Bx 0 1 36 40 44 28 31 34 11 12 13 1∶4 1∶5 1∶6
1.3.5 分析检测
pH值的测定:采用pH计;SOD酶活力的测定:采用SOD酶试剂盒;总可溶性固形物含量的测定:采用折光计法;乳酸菌活菌数的测定:参照GB 4789.35—2016《食品微生物学检验乳酸菌检验》。总花色苷含量的测定:采用pH示差法[26]。酒精度的测定:参照GB 5009.225—2023《酒中乙醇浓度的测定》;总酚含量的测定:采用福林酚法[27]。
1.3.6 数据处理
试验均重复3次,结果以“平均值±标准差”表示,采用SPSS 24.0软件进行统计分析和处理,Origin 2021进行绘图,Design-Expert 13.0进行响应面分析。
2 结果与分析
2.1 复合菌种接种量优化均匀设计试验结果与分析
均匀设计试验优化复合菌种接种量的结果与分析见表3。
表3 复合菌种接种量优化均匀设计试验结果与分析
Table 3 Results and analysis of uniform design tests for inoculum optimization of mixed strains
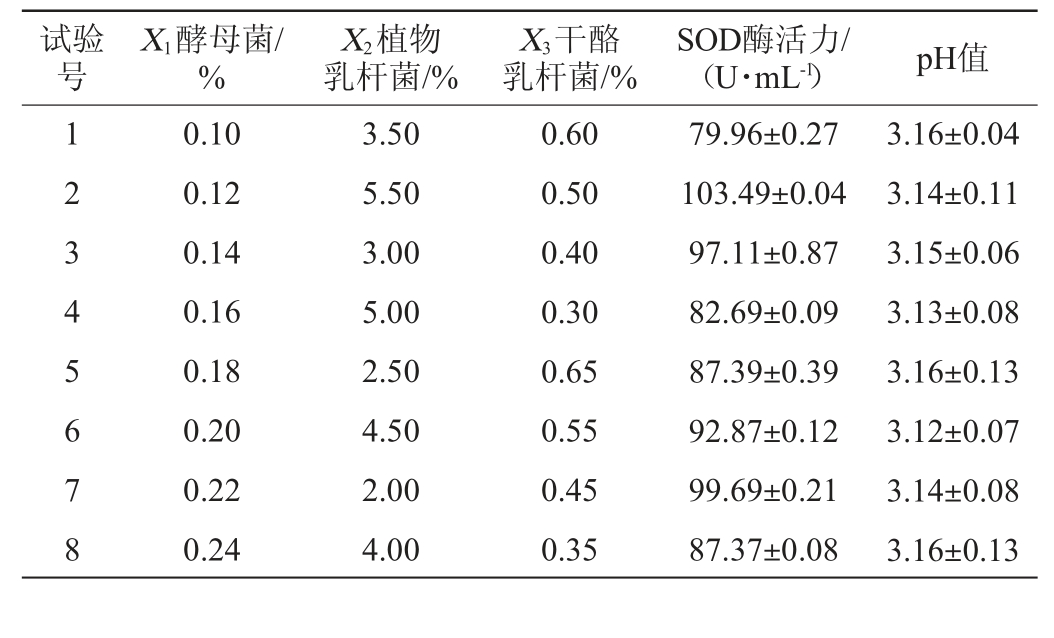
试验号X1酵母菌/%X2植物乳杆菌/%X3干酪乳杆菌/%SOD酶活力/(U·mL-1) pH值1 2 3 4 5 6 7 8 0.10 0.12 0.14 0.16 0.18 0.20 0.22 0.24 3.50 5.50 3.00 5.00 2.50 4.50 2.00 4.00 0.60 0.50 0.40 0.30 0.65 0.55 0.45 0.35 79.96±0.27 103.49±0.04 97.11±0.87 82.69±0.09 87.39±0.39 92.87±0.12 99.69±0.21 87.37±0.08 3.16±0.04 3.14±0.11 3.15±0.06 3.13±0.08 3.16±0.13 3.12±0.07 3.14±0.08 3.16±0.13
由表3可知,在8组试验中,各组试验的pH值差异不明显,SOD酶活显示出较大不同。故以SOD酶活(Y)为响应值,运用SPSS 24.0软件建立二次多项式回归方程如下:
Y=18.756-32.227X2+561.391X3-8.976X1X2+4.393X22-587.476X3X2
对回归方程进行方差分析,决定系数R2=0.96,调整决定系数R2adj=0.92,F值为11.77,P值为0.01<0.1,达到极显著水平,证明该回归方程可以较准确地预测最佳接种量。运用Excel 2016预测蓝莓酵素的最佳接种量分别为酵母菌0.1%、植物乳杆菌2%、干酪乳杆菌0.47%,在此条件下,SOD酶活达105 U/mL。根据预测出的最佳条件进行3次平行验证试验,得出蓝莓酵素的SOD酶活为101 U/mL。
2.2 发酵条件优化单因素试验结果
发酵温度、发酵时间、初始可溶性固形物和料液比对蓝莓酵素SOD酶活力的影响见图1。
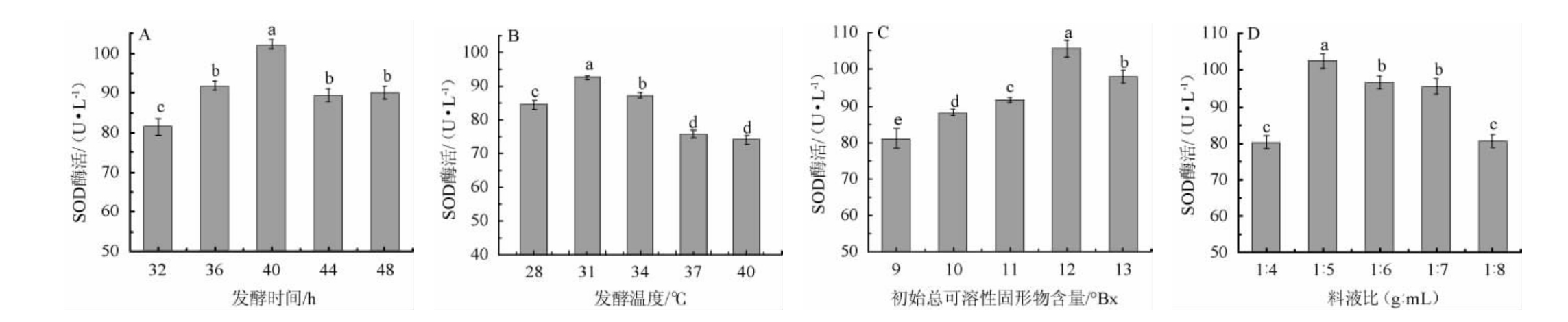
图1 发酵时间(A)、发酵温度(B)、初始总可溶性固形物含量(C)和料液比(D)对蓝莓酵素SOD酶活的影响
Fig.1 Effects of fermentation time (A), temperature (B), initial total soluble solid content (C), and solid and liquid ratio (D) on SOD activity of blueberry Jiaosu
由图1A可知,随着发酵时间在32~40 h范围内延长,SOD酶活逐渐增加;发酵时间为40h时,SOD酶活达到最大,为102 U/mL;发酵时间>40 h,SOD酶活力降低。因此,确定最佳发酵时间为40 h。由图1B可知,随着发酵温度在28~31 ℃的升高,SOD酶活逐渐增加;发酵温度为31 ℃时,SOD酶活达最高值,为92 U/mL;当发酵温度高于31 ℃时,SOD酶活力逐步下降。因此,确定最佳发酵温度为31℃。由图1C可知,随着初始TSS含量的升高,SOD酶活力逐渐增加;当初始TSS含量为12°Bx时,SOD酶活力达最大值,为105 U/mL;当初始TSS含量>12°Bx时,SOD酶活力逐渐下降。因此,确定最佳初始TSS含量为12°Bx。由图1D可知,当料液比为1∶4、1∶5(g∶mL)时,SOD酶活力逐渐增加;当料液比为1∶5(g∶mL)时,SOD酶活达最高值,为102 U/mL;当料液比为1∶5、1∶6、1∶7、1∶8(g∶mL)时,SOD酶活逐渐下降。因此,确定最佳料液比为1∶5(g∶mL)。
2.3 发酵条件优化响应面试验结果与分析
在单因素试验结果的基础上,以SOD酶活(Y)为响应值,根据Box-Behnken中心组合试验设计原理,选择发酵时间(A)、发酵温度(B)、初始TSS含量(C)、料液比(D)4个因素为自变量进行4因素3水平的响应面试验,优化蓝莓酵素发酵的最佳工艺条件。发酵条件优化响应面试验设计及结果见表4,方差分析见表5。
表4 发酵条件优化响应面试验设计与结果
Table 4 Design and results of response surface tests for fermentation conditions optimization
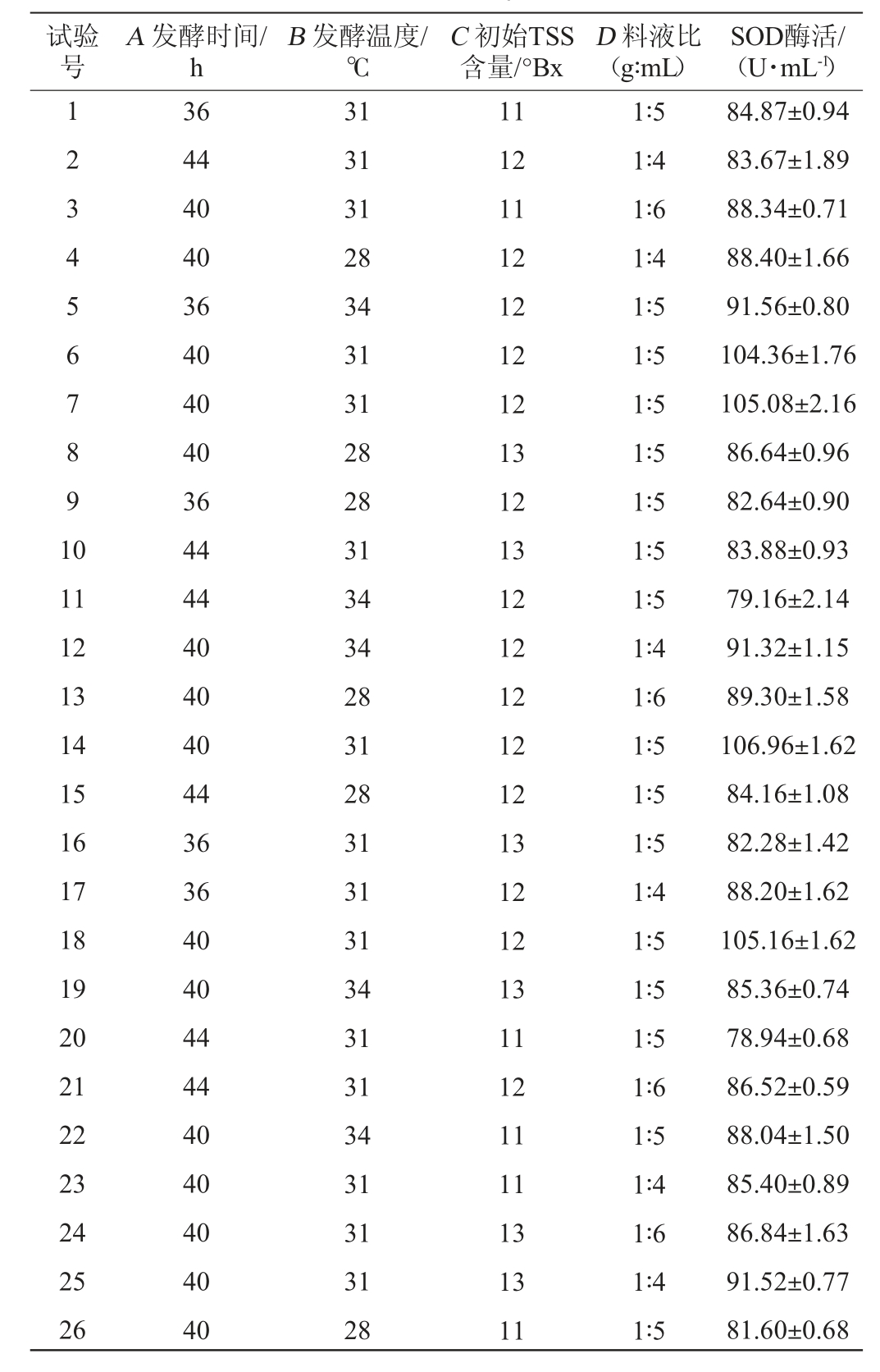
试验号A 发酵时间/h B 发酵温度/℃C 初始TSS含量/°Bx D 料液比(g∶mL)SOD酶活/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 36 44 40 40 36 40 40 40 36 44 44 40 40 40 44 36 36 40 40 44 44 40 40 40 40 40 31 31 31 28 34 31 31 28 28 31 34 34 28 31 28 31 31 31 34 31 31 34 31 31 31 28 11 12 11 12 12 12 12 13 12 13 12 12 12 12 12 13 12 12 13 11 12 11 11 13 13 11 1∶5 1∶4 1∶6 1∶4 1∶5 1∶5 1∶5 1∶5 1∶5 1∶5 1∶5 1∶4 1∶6 1∶5 1∶5 1∶5 1∶4 1∶5 1∶5 1∶5 1∶6 1∶5 1∶4 1∶6 1∶4 1∶5 84.87±0.94 83.67±1.89 88.34±0.71 88.40±1.66 91.56±0.80 104.36±1.76 105.08±2.16 86.64±0.96 82.64±0.90 83.88±0.93 79.16±2.14 91.32±1.15 89.30±1.58 106.96±1.62 84.16±1.08 82.28±1.42 88.20±1.62 105.16±1.62 85.36±0.74 78.94±0.68 86.52±0.59 88.04±1.50 85.40±0.89 86.84±1.63 91.52±0.77 81.60±0.68
续表
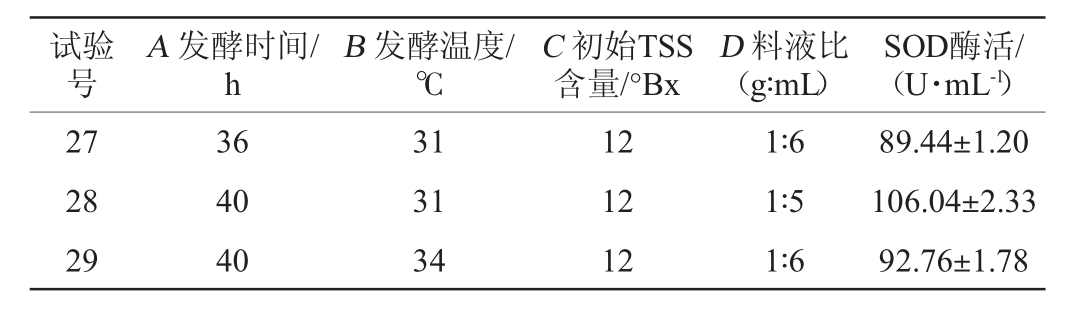
试验号A 发酵时间/h B 发酵温度/℃C 初始TSS含量/°Bx D 料液比(g∶mL)SOD酶活/(U·mL-1)27 28 29 36 40 40 31 31 34 12 12 12 1∶6 1∶5 1∶6 89.44±1.20 106.04±2.33 92.76±1.78
表5 回归模型方差分析
Table 5 Variance analysis of regression model

注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型*******14 ABCDA B AC AD BC BD CD A2 B2 C2 D2残差失拟项总利差1 853.37 42.79 19.92 7.25 1.83 48.44 14.18 0.648 0 14.90 0.072 9 14.52 954.40 516.97 796.50 260.01 15.87 11.86 1 869.24 111111111111111 4 116.77 37.74 17.57 6.40 1.62 42.73 12.50 0.571 6 13.14 0.064 3 12.80 841.81 455.99 702.54 229.34<0.000 1<0.000 1 0.000 9 0.024 1 0.224 3<0.000 1 0.003 3 0.462 2 0.002 8 0.803 5 0.003 0<0.000 1<0.000 1<0.000 1<0.000 1****************10 28 132.38 42.79 19.92 7.25 1.83 48.44 14.18 0.648 0 14.90 0.0729 14.52 954.40 516.97 796.50 260.01 1.13 1.19 1.18 0.472 7
通过Design-Expert 13.0软件对表4结果进行方差分析和二元多次回归拟合,获得SOD酶活与发酵时间、发酵温度、初始TSS含量、料液比的二次多项式回归方程如下:
Y=105.52-1.89A+1.29B+0.78C+0.39D-3.48AB+1.88AC+0.4AD-
1.93BC+0.14BD-1.91CD-12.13A2-8.93B2-11.08C2-6.33D2
由表5可知,该模型极显著(P<0.000 1),失拟项P值为0.472 7>0.05,即失拟项不显著,决定系数R2=0.991,调整决定系数R2Adj=0.983,说明此模型拟合效果良好,能够分析预测蓝莓酵素的发酵工艺参数。由P值可知,一次项A、B,交互项AB、AC、BC、CD,二次项A2、B2、C 2、D2对结果影响极显著(P<0.01);一次项C对结果影响显著(P<0.05);其他项对结果影响不显著(P>0.05)。由F值可知,各因素对SOD酶活影响大小顺序为A>B>C>D。
响应面的等高线形状及响应面坡度可以反映自变量之间的交互影响,响应面坡面越陡,表明因素之间的相互作用越显著。由图2可知,发酵时间(A)与发酵温度(B)、发酵时间(A)与初始TSS值(C)、发酵温度(B)与初始TSS(C)、初始TSS含量(C)与料液比(D)之间存在交互作用,且这些因素的相互作用对SOD酶活力影响极显著(P<0.01)。
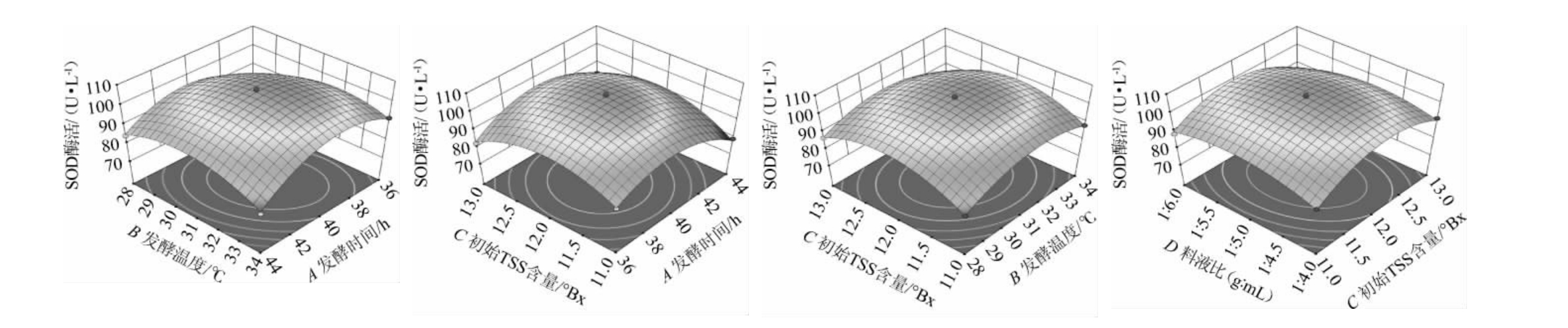
图2 各因素间交互作用对蓝莓酵素SOD酶活影响的响应曲面及等高线
Fig.2 Response surface plots and contour lines of effect of interaction between various factors on SOD activity of blueberry Jiaosu
根据响应面试验结果得到蓝莓酵素的最佳发酵工艺条件为发酵时间41.43 h,发酵温度31.09 ℃,初始TSS含量12.04 °Bx,料液比1∶4.99(g∶mL)。在此优化条件下,蓝莓酵素的SOD酶活力预测值可达103.29 U/mL。为方便实际操作,将最佳发酵工艺条件修正为发酵时间41.5 h,发酵温度31 ℃,初始TSS含量12°Bx,料液比1∶5(g∶mL),在此条件下进行3次平行验证试验,得到SOD酶活实际值为103.01 U/mL,与预测值相差不大。
2.4 蓝莓酵素的品质评价
蓝莓酵素成品呈深紫红色,色泽均匀,果香浓郁,口感酸甜适宜,无外来杂质。制备的蓝莓酵素pH值为3.14,酒精度为0.2%vol,总酚含量为3.14 mg/mL,花色苷含量为26.06 mg/mL,乳酸菌活菌数为1.01×107CFU/mL,SOD酶活性为103.01 U/mL,符合行业标准QB/T 5323—2018《植物酵素》要求。
3 结论
该研究以蓝莓为主要原料,以酵母菌、植物乳杆菌、干酪乳杆菌为发酵菌种制备蓝莓酵素,确定酵母菌、植物乳杆菌、干酪乳杆菌三种菌株的最佳接种体积比分别为0.1%、2%、0.47%,蓝莓酵素的最佳发酵工艺条件为发酵时间41.5 h,发酵温度31 ℃,初始总可溶性固形物含量12°Bx,料液比1∶5(g∶mL)。在此优化条件下,蓝莓酵素的SOD酶活力可达103.01 U/mL,pH值为3.14,酒精度为0.2%vol,总酚含量为3.14 mg/mL,花色苷含量为26.06 mg/mL,乳酸菌活菌数为1.01×107CFU/mL。本研究开发出一款具有高SOD酶活力的蓝莓酵素产品,今后可进一步研究酵素制品对人类健康的益处。
[1]TOBAR-BOLAÑOS G,CASAS-FORERO N,ORELLANA-PALMA P,et al.Blueberry juice:Bioactive compounds,health impact,and concentration technologies-A review[J].J Food Sci,2021,86(12):5062-5077.
[2]刘宇航,陈影影,曹玉婷,等.蓝莓鲜果采后病害类型及保鲜技术研究进展[J].保鲜与加工,2021,21(11):144-150.
[3] MAURO C S I, GUERGOLETTO K B, GARCIA S.Development of blueberry and carrot juice blend fermented by Lactobacillus reuteri LR92[J].Beverages,2016,2(4):37.
[4] SHAHBAZI R, SHARIFZAD F, BAGHERI R, et al.Anti-inflammatory and immunomodulatory properties of fermented plant foods[J].Nutrients,2021,13(5):1516.
[5]中国生物发酵产业协会.T/CBFIA 08001—2016 酵素产品分类导则[S].北京:中国标准出版社,2016.
[6]VALERO-CASES E,CERDÁ-BERNAD D,PASTOR J J,et al.Non-dairy fermented beverages as potential carriers to ensure probiotics,prebiotics,and bioactive compounds arrival to the gut and their health benefits[J].Nutrients,2020,12(6):1666.
[7]吴彩云,张晓荣,徐怀德,等.益生菌发酵果蔬汁生物活性成分及功能特性研究进展[J].中国食品学报,2021,21(12):323-334.
[8]中国食品科学技术学会益生菌分会.益生菌“量效关系”的科学综述[J].中国食品学报,2022,22(7):443-454.
[9]VIJAYA KUMAR B,VIJAYENDRA S V N,REDDY O V S.Trends in dairy and non-dairy probiotic products-a review[J].J Food Sci Technol,2015,52(10):6112-6124.
[10]赵沁雨,兰天,袁取予,等.植物乳杆菌发酵对果汁品质的影响研究概述[J].食品与发酵工业,2021,47(16):300-307.
[11] MOJIKON F D, KASIMIN M E, MOLUJIN A M, et al.Probiotication of nutritious fruit and vegetable juices: An alternative to dairy-based probiotic functional products[J].Nutrients,2022,14(17):3457.
[12]马路凯,卢晓丽,何秋璇,等.发酵果汁的研究进展与展望[J].食品研究与开发,2021,42(18):182-189.
[13]朱丹实,吴逗逗,沈雨思,等.多菌种混合发酵果蔬汁的研究进展[J].中国食品学报,2021,21(10):343-352.
[14]关倩倩,熊涛,谢明勇.植物基食品乳酸菌发酵技术研究进展[J].食品与生物技术学报,2022,41(7):1-11.
[15]刘鑫,朱丹,牛广财,等.蓝莓酵素发酵工艺优化[J].中国酿造,2018,37(3):171-175.
[16]杨培青,李斌,颜廷才,等.蓝莓果渣酵素发酵工艺优化[J].食品科学,2016,37(23):205-210.
[17]LI S J,TAO Y,LI D D,et al.Fermentation of blueberry juices using autochthonous lactic acid bacteria isolated from fruit environment: Fermentation characteristics and evolution of phenolic profiles[J].Chemosphere,2021,276:130090.
[18]白琳,茹先古丽·买买提依明,丁帅杰,等.蓝莓酵素中复合菌种添加比例的确定及发酵工艺优化[J].现代食品科技,2021,37(5):91-99,37.
[19]李虹甫,杨鑫焱,刘昕宇,等.植物乳杆菌发酵蓝莓果汁工艺优化及其抗氧化能力[J].食品工业科技,2019,40(17):127-133.
[20]易媛,左勇,黄雪芹,等.食用植物酵素开发关键技术研究进展[J].食品与发酵工业,2021,47(7):316-321.
[21]索婧怡,朱雨婕,陈磊,等.食用酵素的研究及发展前景分析[J].食品与发酵工业,2020,46(19):271-283.
[22]饶智,陈彦坤,刘斌,等.“药食同源”植物酵素研究进展[J].食品与发酵工业,2020,46(9):290-294.
[23]蔡丽琴,王伟军,李延华,等.食用酵素发酵代谢及功能特性研究进展[J].食品工业科技,2021,42(20):408-414.
[24]成福,肖洋,王婷,等.均匀设计优化生香酵母产酯发酵工艺[J].中国酿造,2020,39(12):91-94.
[25]陈家兰,林芳花,曹泽粼,等.羊栖菜多糖提取工艺的均匀设计法优选及含量测定[J].时珍国医国药,2021,32(1):54-57.
[26]仇小妹,王英,董明盛,等.复合酶酶解对蓝莓出汁率及总抗氧化能力的影响[J].食品科学,2013,34(24):25-29.
[27]姚沛琳,蒋家璇,武进雨,等.无花果酵素自然发酵过程中代谢产物与抗氧化活性的相关性研究[J].天然产物研究与开发,2022,34(3):427-435.