猕猴桃(Actinidia chinensis),富含丰富的维生素、氨基酸和矿物质等多种营养成分,常有“水果之王”和“维生素果”之称[1],但由于猕猴桃鲜果贮藏成本高,运输过程等原因,猕猴桃的深加工产品逐渐被人们所研发[2]。猕猴桃果酒作为猕猴桃深加工产品之一,其营养价值丰富,有较强的抗氧化等功能[3]。单一发酵猕猴桃果酒存在风味单一,酒体不够圆润等问题,且维生素C(vitamin C,VC)作为猕猴桃主要的营养物质,猕猴桃果酒在常温发酵时VC会遭到较大的破坏,猕猴桃的风味也会因常温发酵存在一定的损失。
苹果在我国种植面积广泛,因其脆甜可口,食用方便而受到人们的青睐,且苹果中含糖量较高,含多种维生素、有机酸等营养成分。苹果在我国主要以鲜果的方式售出,由于产量大,供过于求,为保证苹果资源的高效利用,有效地提高苹果精深加工的技术水平具有一定的意义[4-6]。果酒常温发酵温度范围一般为20~30 ℃,发酵温度低于17 ℃则可认为是低温发酵[7]。为了改善猕猴桃果酒上述的问题,在以猕猴桃为主料的基础上添加苹果为辅料进行低温发酵制备猕猴桃-苹果复合果酒,苹果的加入不但可以丰富果酒的香气,还能弥补单一果酒口感上的不足,苹果中的糖分能够弥补猕猴桃酸涩的口感,同时还可以丰富果酒的营养价值[8];低温发酵能一定程度上保留猕猴桃和苹果中的VC,减少发酵过程中风味的损失。
本研究以猕猴桃和苹果为原料,以常温发酵为对照,采用低温发酵制备猕猴桃-苹果复合果酒,并采用常规方法及顶空固相微萃取结合气相色谱-质谱联用(headspace solid-phase microextraction gas chromatography-mass spectrometry,HS-SPME-GC-MS)技术对其理化指标、挥发性风味成分进行测定。在单因素试验结果基础上,通过响应面试验分析优化其发酵工艺条件。通过分析低温发酵与常温发酵复合果酒挥发性风味物质的差异,为低温发酵猕猴桃苹果复合果酒的实际生产应用提供科学依据。
1 材料与方法
1.1 材料与试剂
徐香猕猴桃:陕西省宝鸡市;昭通苹果:云南省昭通市;葡萄酒、果酒专用酵母SY、绵白糖:安琪酵母股份有限公司;果胶酶(酶活10万U/g):北京索莱宝科技有限公司;偏重亚硫酸钾(分析纯):郑州盛义宏生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、福林酚:上海源叶生物科技有限公司;2-辛醇(色谱纯):美国Sigma公司。
1.2 仪器与设备
岛津QP2020 NX气相色谱-质谱联用仪:日本岛津公司;固相微萃取手柄、75 μm(carboxen/polydimethyl siloxane,CAR/PDMS)固相微萃取头:美国Supelco公司;V201手持糖度仪:上海智城分析仪器制造有限公司;UV-2800型紫外可见分光光度计:尤尼柯(上海)仪器有限公司;FYL-YS-128L恒温培养箱:北京福意联电器有限公司;1384型生物安全柜:中国赛默飞世尔科技有限公司。
1.3 试验方法
1.3.1 猕猴桃-苹果复合果酒低温发酵工艺流程及操作要点
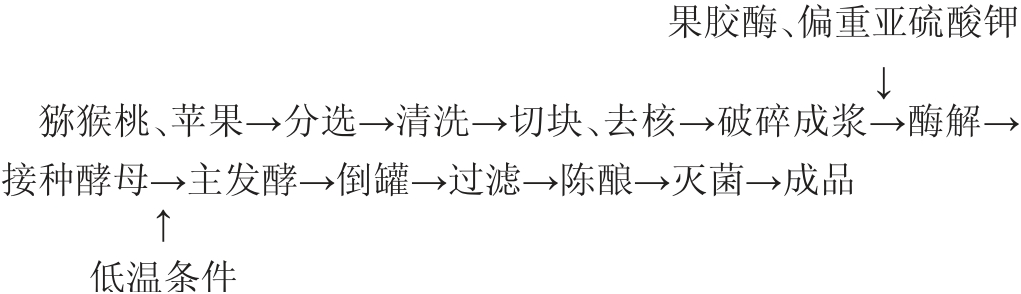
操作要点:
猕猴桃果浆、苹果果浆的制备:挑选大小均匀、无腐烂、无损坏的猕猴桃及苹果,用水洗去果实表面杂物,将苹果及猕猴桃削皮,切块放入榨汁机中破碎打浆,得到猕猴桃果浆及苹果果浆。
酶解:在猕猴桃果浆、苹果果浆中分别加入60 mg/kg的果胶酶及60 mg/kg的偏重亚硫酸钾,室温下静置酶解18 h。
酿酒酵母活化:取2g/L的酵母倒入约为37~40℃、50mL的温水中,搅拌至溶解,放入39 ℃电热恒温培养箱中,待温水上出现小气泡为活化成功。
主发酵:将猕猴桃果浆和苹果果浆按一定质量比倒入发酵罐内,加入绵白糖调整果浆混合液初始糖度22%,同时倒入活化酿酒酵母,在15 ℃温度条件下发酵至可溶性固形物连续4 d不变,即为主发酵阶段结束。期间每隔1 d排气一次并测定可溶性固形物。
倒罐:采取虹吸法将罐内的主发酵结束的酒液移入无菌酒瓶中,并加入30 mg/kg的偏重亚硫酸钾使果酒停止发酵。
过滤:采取虹吸法将上清液酒吸入酒瓶中,采取纱布过滤下层带酒渣果酒。
陈酿:将果酒置于常温下进行陈酿40 d。
灭菌:巴氏灭菌(70 ℃,30 min)后得猕猴桃-苹果复合果酒成品。
1.3.2 猕猴桃果浆与苹果果浆质量比的确定
猕猴桃果浆与苹果果浆质量比分别为1.0∶1.0、1.5∶1.0、2.0∶1.0、2.5∶1.0、3.0∶1.0,接种安琪酵母SY,调整发酵母液的初始糖度为22%,干酵母接种量为2 g/L,于15 ℃条件下恒温发酵,发酵至可溶性固形物含量连续4 d基本不变,终止发酵。测定酒精度、总酸、挥发酸、pH、总酚、还原糖并进行感官评定,考察猕猴桃果浆与苹果果浆质量比对复合果酒品质的影响。
1.3.3 猕猴桃苹果复合果酒低温发酵工艺优化
(1)单因素试验
初始糖度的影响:添加绵白糖使发酵原液初始糖度分别为18%、20%、22%、24%、26%,酵母接种量为2 g/L,于15 ℃发酵14 d。考察不同的初始糖度对复合果酒酒精度和总酯含量的影响。
发酵温度的影响:添加绵白糖使发酵原液初始糖度为22%,酵母接种量为2 g/L,分别于发酵温度9 ℃、12 ℃、15 ℃、18℃、21 ℃条件下发酵14 d。考察不同的发酵温度对复合果酒酒精度和总酯含量的影响。
酵母的影响:添加绵白糖使发酵原液初始糖度为22%。酵母接种量分别为1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L,于15 ℃条件下发酵14 d。考察不同的酵母添加量对复合果酒酒精度和总酯含量的影响。
(2)响应面试验
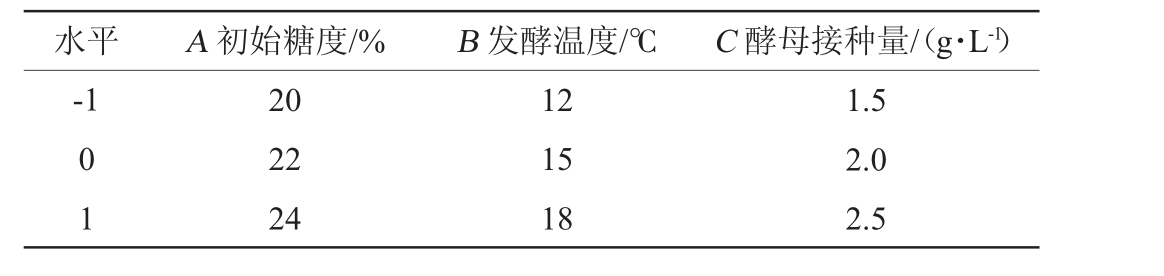
在单因素试验基础上,选取初始糖度(A)、发酵温度(B)、酵母接种量(C)为自变量,以总酯含量(Y)为响应值,通过Design Expert V 8.0.6软件进行3因素3水平响应面分析,Box-Behnken试验因素与水平见表1。
表1 低温发酵工艺优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments for low-temperature fermentation technology optimization
水平 A 初始糖度/% B 发酵温度/℃ C 酵母接种量/(g·L-1)-1 0 1 20 22 24 12 15 18 1.5 2.0 2.5
1.3.4 分析检测
(1)理化指标
酒精度、总酸、挥发酸、VC含量:参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的方法;还原糖采用3,5-二硝基水杨酸(DNS)法测定[9];总酚:福林酚法[10];可溶性固形物:手持糖度计测定;总酯:回流皂化法测定[11]。
(2)微生物指标
菌落总数:参考国标GB 4789.2—2022《食品微生物学检验菌落总数测定》中的方法测定;大肠菌群数:参考国标GB 4789.3—2016《食品微生物学检验大肠菌群计数》中的方法测定。
(3)感官评价
感官评价由10名本专业同学经过培训后来完成的,其中男生5名,女生5名,评定标准见表2。分别从色泽、香气、滋味和典型性四方面对猕猴桃苹果复合果酒进行评分,分设优、良、中、差四个等级,指标集U=(色泽、香气、滋味、典型性),评价集X=(优、良、中、差)。根据各指标在复合果酒评价中的作用,本次评价中果酒的色泽、香气、滋味、典型性四个因素各占的权重为0.2、0.3、0.4、0.1,即权重集A=(0.2,0.3,0.4,0.1)。
表2 猕猴桃苹果复合果酒感官评价标准
Table 2 Sensory evaluation standards of kiwi-apple compound fruit wine

等级 得分/分 色泽(20%) 香气(30%) 滋味(40%) 典型性(10%)优良中差90~100 75~90 60~75 0~60澄清透明、有光泽、无明显悬浮物澄清、无明显夹杂物、色泽较好浑浊、有沉淀、失光无色泽极不均匀、自然,昏暗果香、酒香浓馥幽雅,协调悦人果香、酒香良好,尚悦怡果香、酒香较少,但无异香无香味,有异味酒体协调,香甜醇厚,口感细腻圆润,酸甜爽口酒体平衡,特征味不明显,口感略粗糙无特征味,口感较粗糙,略苦涩酒味、果味平淡,略苦涩,过酸甜风格独特、典型完美风格良好、典型明确有典型性、不够怡雅失去本品典型性
(4)挥发性风味物质的测定
顶空固相微萃取条件:参照赵宁等[12]的方法稍作修改,量取15 mL酒样装入40 mL的顶空萃取瓶中,加入4.5 g NaCl,同时加入20 μL 2-辛醇(质量浓度为0.4 mg/mL)作为内标物,加盖密封,将顶空萃取瓶放置于60 ℃恒温水浴锅中平衡30 min,然后将老化的萃取头插入顶空萃取瓶,顶空萃取30 min,萃取结束后,取出萃取头插入进样口解吸5 min,进行GC-MS检测。
气相色谱条件:DB-5MS色谱柱(32m×2.5mm×0.25μm);升温程序为40 ℃保持5 min,以5 ℃/min 升至200 ℃,保持10 min;载气为高纯氦气(He),流速1 mL/min;进样口温度230℃;不分流进样。质谱条件:电子电离(electronionization,EI)源;电子能量70 eV;连接杆温度200 ℃;离子源温度250 ℃;质谱扫描范围50~350 m/z。
定性定量分析:采用保留指数(retention index,RI),与系统自带的标准质谱库美国国家标准技术研究所(national institute of standards and technology,NIST)-11、Wiley及香精香料库检索比对进行定性,选取相似度>85%的物质进行分析定性。选取2-辛醇为内标物,采用内标法对复合果酒香气成分进行定量分析,各香气成分含量计算公式如下:
式中:X为香气物质的质量浓度,μg/L;f0为内标物的校正因子,f0=1;A0为测得内标物的峰面积;Ai为测得香气物质的峰面积;m0为内标物的质量,μg;Vi为样品量,L。
1.3.5 数据处理
所有数据处理采用利用Excel 2010 软件,并利用SPSS 26.0对数据进行统计分析,利用Design Expert V 8.0.6进行响应面试验设计和分析,Origin 2021进行绘图。结果以“平均值±标准差”表示。
2 结果与分析
2.1 猕猴桃果浆与苹果果浆质量比的确定
不同猕猴桃果浆与苹果果浆质量比发酵的复合果酒感官评分和理化指标的测定结果见表3。
表3 不同猕猴桃果浆与苹果果浆质量比对复合果酒感官评分和理化指标的影响
Table 3 Effects of different mass ratio of kiwi pulp and apple pulp on sensory evaluation and physicochemical indexes of compound fruit wine
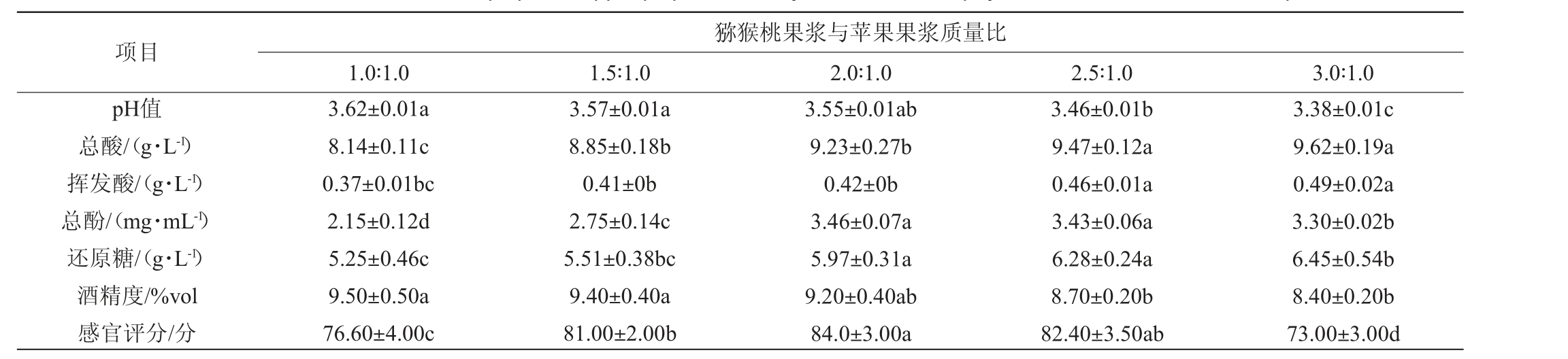
注:小写字母不同表示差异显著(P<0.05)。
项目pH值总酸/(g·L-1)挥发酸/(g·L-1)总酚/(mg·mL-1)还原糖/(g·L-1)酒精度/%vol感官评分/分猕猴桃果浆与苹果果浆质量比1.0∶1.0 1.5∶1.0 2.0∶1.0 2.5∶1.0 3.0∶1.0 3.62±0.01a 8.14±0.11c 0.37±0.01bc 2.15±0.12d 5.25±0.46c 9.50±0.50a 76.60±4.00c 3.57±0.01a 8.85±0.18b 0.41±0b 2.75±0.14c 5.51±0.38bc 9.40±0.40a 81.00±2.00b 3.55±0.01ab 9.23±0.27b 0.42±0b 3.46±0.07a 5.97±0.31a 9.20±0.40ab 84.0±3.00a 3.46±0.01b 9.47±0.12a 0.46±0.01a 3.43±0.06a 6.28±0.24a 8.70±0.20b 82.40±3.50ab 3.38±0.01c 9.62±0.19a 0.49±0.02a 3.30±0.02b 6.45±0.54b 8.40±0.20b 73.00±3.00d
由表3可知,总酸在猕猴桃果浆与苹果果浆质量比为3∶1时最高(9.62 g/L),总酸随着猕猴桃果浆质量的不断增大而升高,苹果的加入能够缓解单一发酵猕猴桃果酒带来的酸涩的口感,并且增加一定的甜度,使得猕猴桃苹果复合果酒酸度降低;pH值随着猕猴桃果浆质量占比不断增大而下降,各酒样总体pH在3.4~3.6之间。果酒发酵最佳pH值在3.5~4.2之间,因此对于不耐酸的酵母菌种而言,较低的pH可能会抑制其生长,不利于发酵[13]。总酚随着猕猴桃果浆与苹果果浆质量比的增加呈先上升后下降的趋势,在猕猴桃果浆与苹果果浆质量比为2∶1时,总酚含量最大(3.46 g/L),可能是由于随着猕猴桃果浆质量的增加酸度上升,不利于酵母菌发酵;还原糖随着猕猴桃苹果质量比的增加而增大,酒精度含量则随着猕猴桃果浆与苹果果浆质量比的增加而减小,说明还原糖结果与酒精度的结果具有互为反比关系。当猕猴桃果浆与苹果果浆质量比为2∶1,感官评分最高(84.0分)。因此,猕猴桃果浆与苹果果浆最佳质量比为2∶1。
2.2 低温发酵工艺优化单因素试验
2.2.1 初始糖度对复合果酒发酵的影响
酒精度、总酯随着初始糖度在18%~22%范围内的增加而增大;初始糖度为22%时,酒精度、总酯达到最大值,分别为9.26%vol、3.47 g/L;初始糖度>22%之后,酒精度、总酯随之下降。糖为酵母代谢提供主要能量,并且其次生代谢产物也可丰富果酒的香气[14]。初始糖度过低,糖类物质的含量不足以用于酵母的生长繁殖,酵母转化酒精的效率降低,使得酒香味过低,酒味过淡,进而影响果酒的口感;初始糖度过高,罐内发酵母液处于高渗透压状态,不利于酵母发酵,使得发酵液中的糖无法有效的转化为酒精,进而导致果酒的口感变差[15]。因此,最适初始糖度为22%。
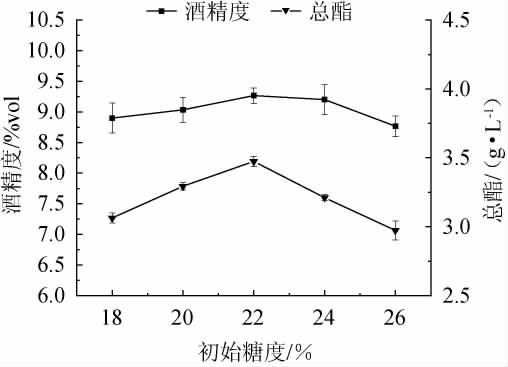
图1 不同的初始糖度对复合果酒酒精度及总酯含量的影响
Fig.1 Effects of different initial sugar contents on alcohol content and total ester contents of compound fruit wine
2.2.2 酵母接种量对复合果酒发酵的影响
酒精度、总酯随着酵母接种量在1.0~2.0 g/L范围内增加而增加;酵母接种量在2.0 g/L时,酒精度、总酯含量最大,分别为9.12%vol、3.43 g/L;酵母接种量>2.0 g/L之后,酒精度、总酯随之下降,酵母接种量越大,则酵母将发酵母液中的糖分解的效率就越高,即酒精度就越高;但当酵母接种量过高时,发酵母液中的糖消耗过快、用于转化酒精的糖分会相应减少;且发酵罐中的营养物质有限,因此会降低总酯和酒精度的产生[16]。因此,最适酵母接种量为2.0 g/L。
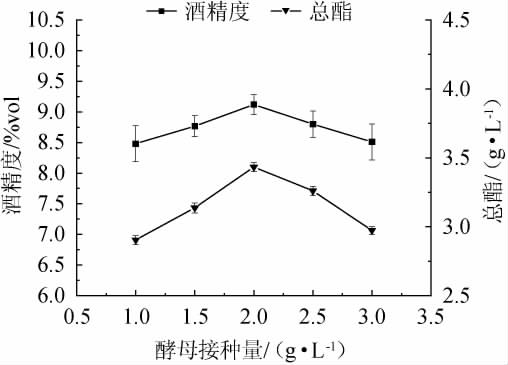
图2 不同的酵母接种量对复合果酒酒精度及总酯含量的影响
Fig.2 Effects of different yeast inoculum on alcohol content and total ester contents of compound fruit wine
2.2.3 发酵温度对复合果酒发酵的影响
酒精度、总酯含量随着发酵温度在9~15 ℃范围内的升高而增大;发酵温度在15 ℃时,总酯含量最高,为3.48 g/L,此时酒精度为9.23%vol;发酵温度高于15 ℃之后,酒精度随之增加,但总酯含量随之下降。温度过低时酵母处于休眠状态,会导致发酵缓慢甚至停止,影响发酵效果,最终导致酵母无法将发酵罐中的糖分转化为酒精,进而使总酯和酒精度偏低;而发酵温度偏高时,发酵罐内小分子运动加快,不利于香气物质的保留;且低温发酵保留的初级和次级风味物质比正常温度发酵的高[17]。因此,最适发酵温度为15 ℃。
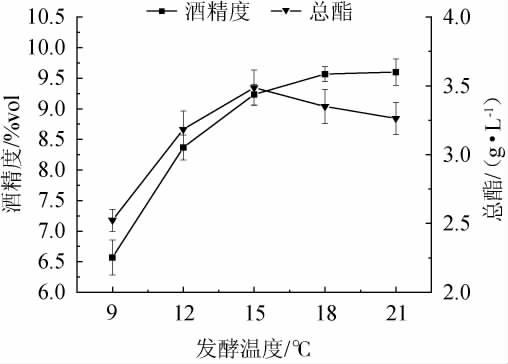
图3 不同的发酵温度对复合果酒酒精度及总酯含量的影响
Fig.3 Effects of different fermentation temperature on alcohol content and total ester contents of compound fruit wine
2.3 低温发酵工艺优化响应面试验
2.3.1 Box-Benhnken 试验设计及结果
依据单因素试验结果,利用Design Expert V8.0.6进行响应面试验设计和分析,以初始糖度(A)、发酵温度(B)、酵母接种量(C)3个因素为自变量,以总酯含量(Y)为响应值,进行发酵工艺响应面优化,Box-Behnken试验结果见表4,方差分析见表5。
表4 低温发酵工艺优化Box-Behnken试验设计及结果
Table 4 Design and results of Box-Behnken experiments for low-temperature fermentation technology optimization
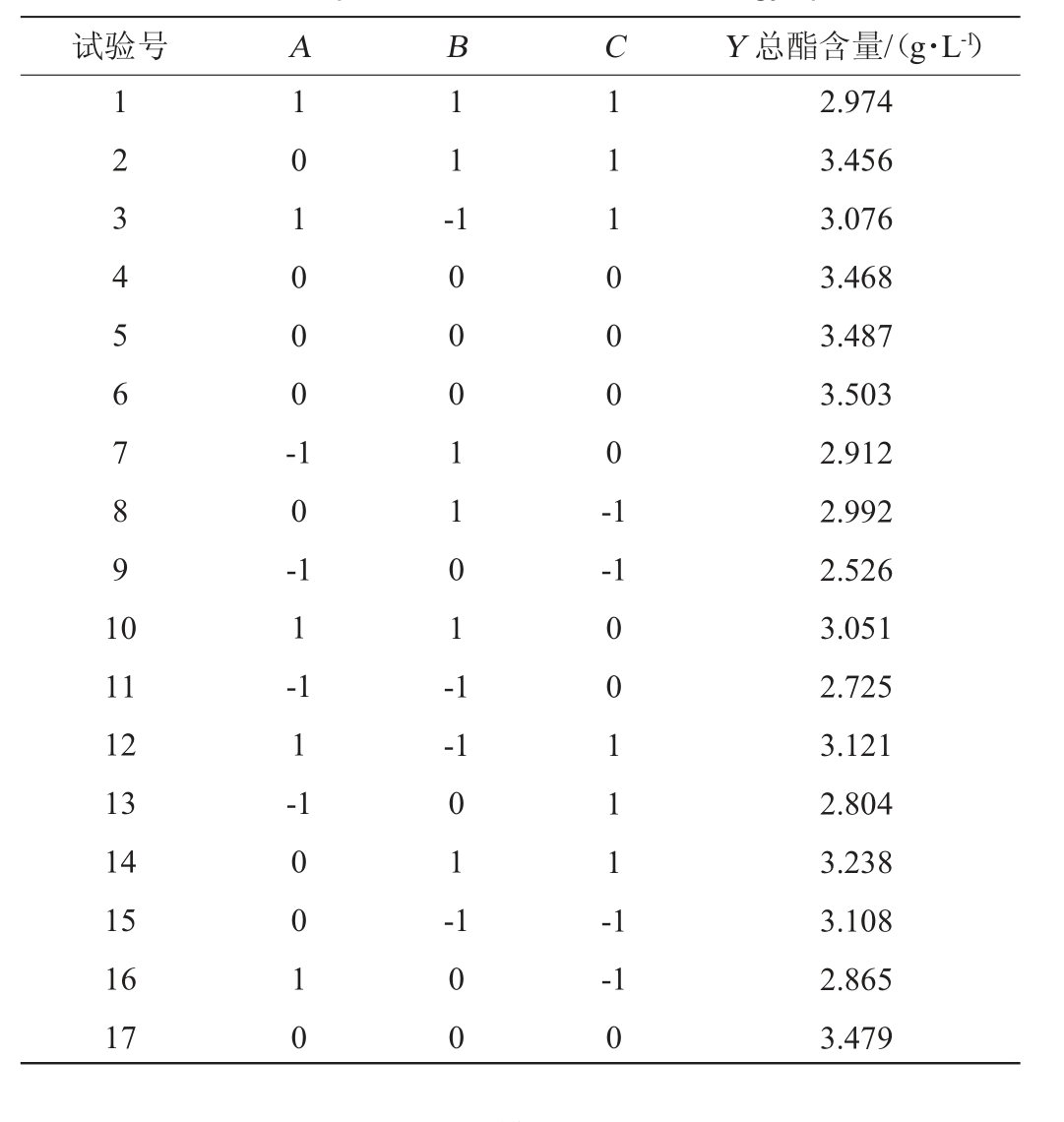
试验号 A B C Y 总酯含量/(g·L-1)1 2 3 4 5 6 7 8 9 1 0 1 0 1 0 0 0 -1 1 -1 0 -1 1 1 0 0 0 0 -1-1 11 12 13 14 15 16 17 1 1 -1 1 -1 0 0 0 1 1 0 1 -1-1 1 0 0 1 0 0 1 -1 0 0 0 0 1 1 1 -1-1 0 2.974 3.456 3.076 3.468 3.487 3.503 2.912 2.992 2.526 3.051 2.725 3.121 2.804 3.238 3.108 2.865 3.479
表5 回归模型方差分析
Table 5 Variance analysis of regression model
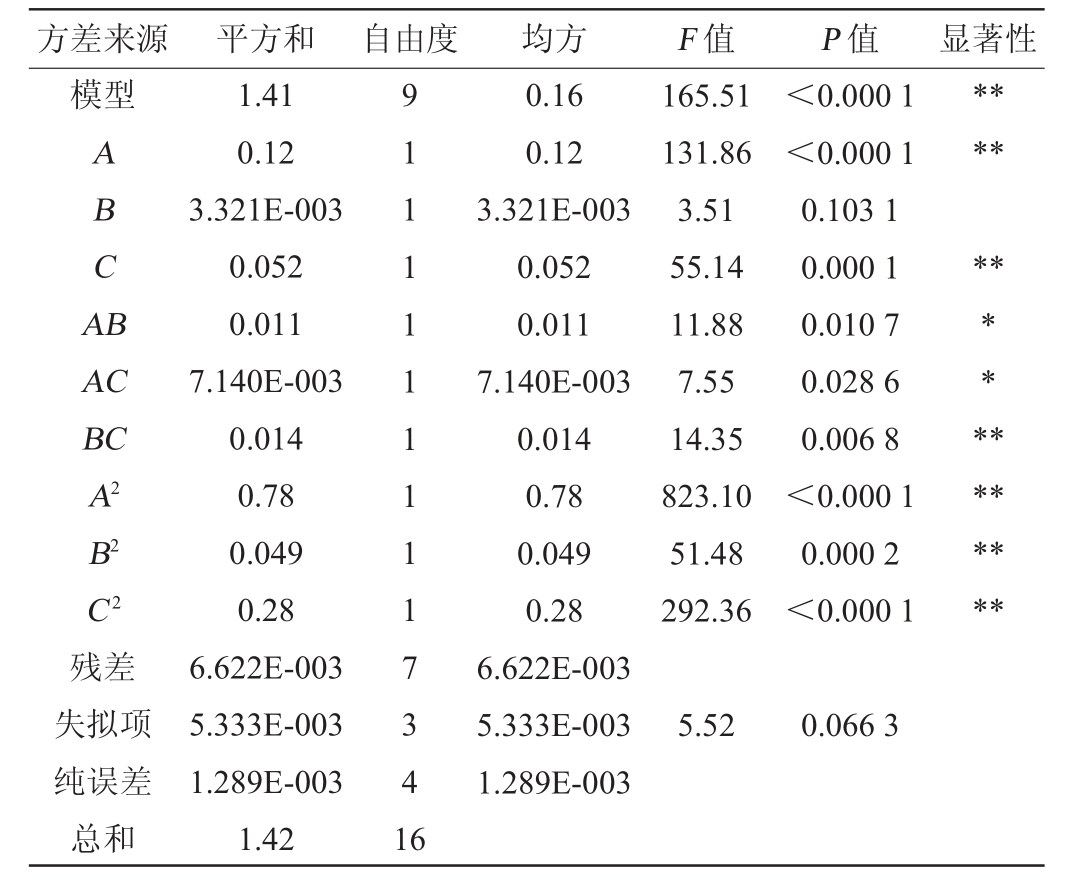
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
?
通过软件Design Expert V 8.0.6对表4试验结果进行多元回归拟合,得到总酯含量(Y)与3个因素初始糖度(A)、发酵温度(B)、酵母接种量(C)的回归模型为:
由表5可知,回归模型极显著(P<0.000 1),回归模型的决定系数R2=0.995 3,调整决定系数R2Adj=0.989 3,说明该回归模型拟合较好,自变量与响应值之间线性关系显著;失拟项不显著(P>0.05),可以用于对低温发酵猕猴桃苹果复合果酒工艺进行预测。
由P值可知,一次项A、C,交互项BC和二次项A2、B2、C2对Y值影响极显著(P<0.01),交互项AB、AC对Y值影响显著(P<0.05)。由F值可知,各因素对结果影响的强弱次序为:初始糖度>酵母接种量>发酵温度。
2.3.2 各因素交互作用分析
响应曲面及等高线的形状可以反映出各因素交互作用的强弱,响应曲面越陡、等高线形状越接近椭圆形则表示两两因素交互作用显著[18]。
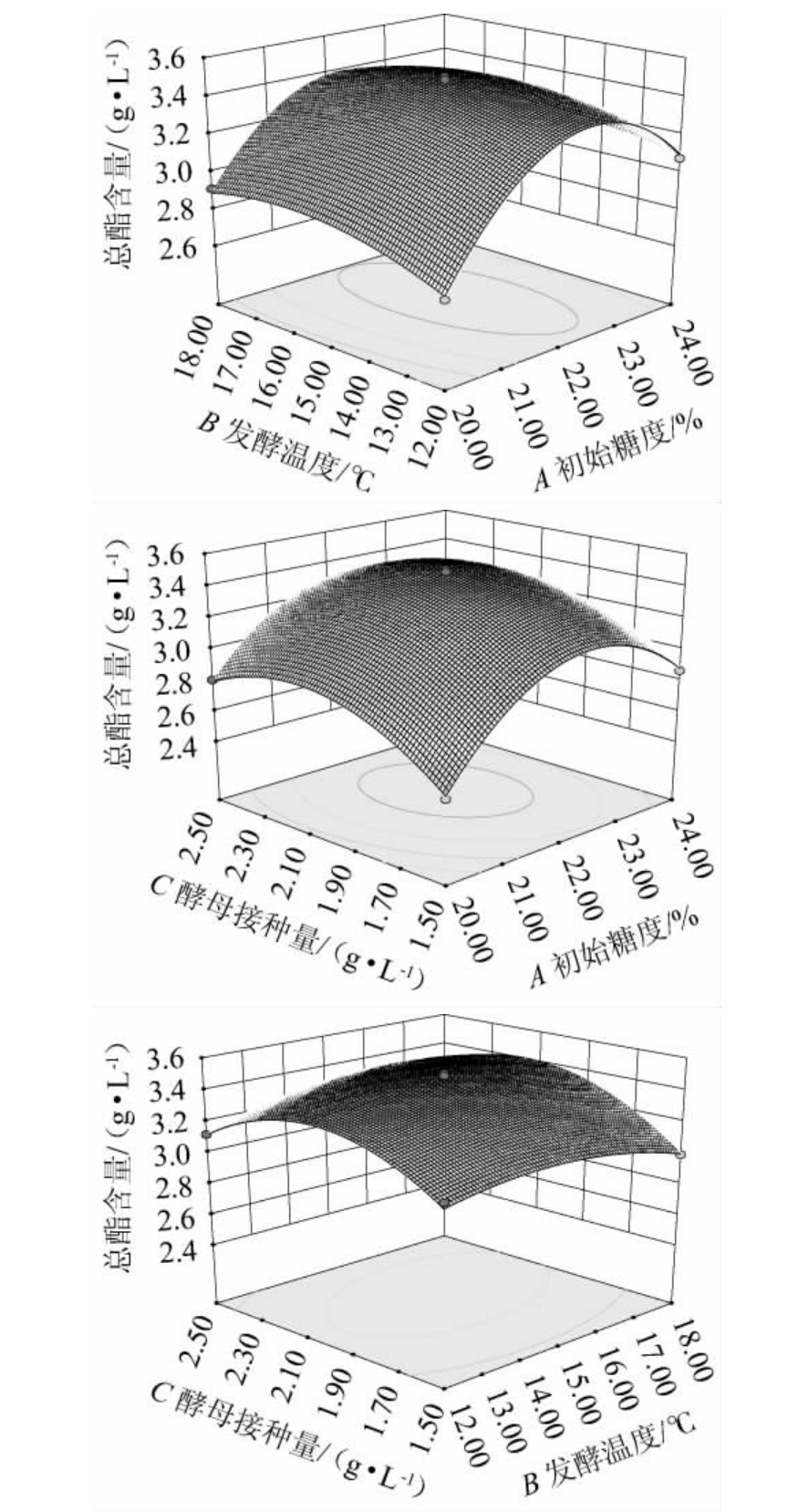
图4 初始糖度、发酵温度和酵母接种量交互作用对总酯含量影响的响应面及等高线
Fig.4 Response surface plots and contour lines of effects of interaction between initial sugar contents, fermentation temperature and yeast inoculum on total ester contents
由图5可知,在两两因素的交互作用中,初始糖度和发酵温度、初始糖度和酵母接种量、发酵温度和酵母接种量两两交互作用对总酯含量的影响均显著。这与方差分析结果一致。
2.3.3 验证试验
通过响应面分析得到猕猴桃-苹果复合果酒的最佳低温发酵工艺条件为:初始糖度22.26%,发酵温度15.31 ℃,酵母接种量2.08 g/L;在此优化条件下,总酯含量预测值3.494 g/L。考虑到实际操作性,调整发酵工艺参数为初始糖度22%,发酵温度为15 ℃,酵母接种量为2.0 g/L;在此条件下经过3次平行验证试验,得到复合果酒总酯含量实际值为3.489 g/L,理论值与预测值接近,说明通过响应面优化后得到的复合果酒工艺参数准确可靠,可行性较高。
2.4 低温发酵与常温发酵制备复合果酒品质对比
在优化后发酵工艺条件下,分别采用低温(15 ℃)和常温(25 ℃)进行发酵,低温发酵与常温发酵制备猕猴桃-苹果复合果酒品质对比见表6。由表6可知,在其他发酵条件相同的情况下,低温与常温发酵对于pH值和总酸含量影响较小,总酚、还原糖均略高于常温发酵。低温条件下,酵母生命周期更长,发酵平稳,不进入明显的对数发酵阶段,酸类物质保留较少,果酒口感更为怡人;在常温发酵条件下,由于温度较高,提升了罐内酵母菌的发酵效率,酵母菌将糖转化为酒精效率随之升高,故常温发酵下酒精度(11.5%vol)高于低温发酵(8.9%vol);温度升高,罐内小分子运动加快,不利于香气物质的保留,低温发酵使得构成猕猴桃苹果复合果酒特殊的风味物质酯类物质得以保存,因此低温发酵条件下总酯含量(3.49 g/L)高于常温发酵;此外,果酒在发酵过程中VC造成一定的损失,低温发酵条件下维生素C(vitamin C,VC)损失会一定程度的降低,从而使酒营养价值更高。张建萍等[19]通过低温发酵紫薯酒,最终感官评分为87分,高于常温发酵。结果表明,低温发酵猕猴桃-苹果复合果酒品质优于常温发酵。
表6 低温发酵与常温发酵猕猴桃-苹果复合果酒品质对比
Table 6 Comparison of quality of kiwi-apple compound fruit wine with low-temperature and room temperature fermentation
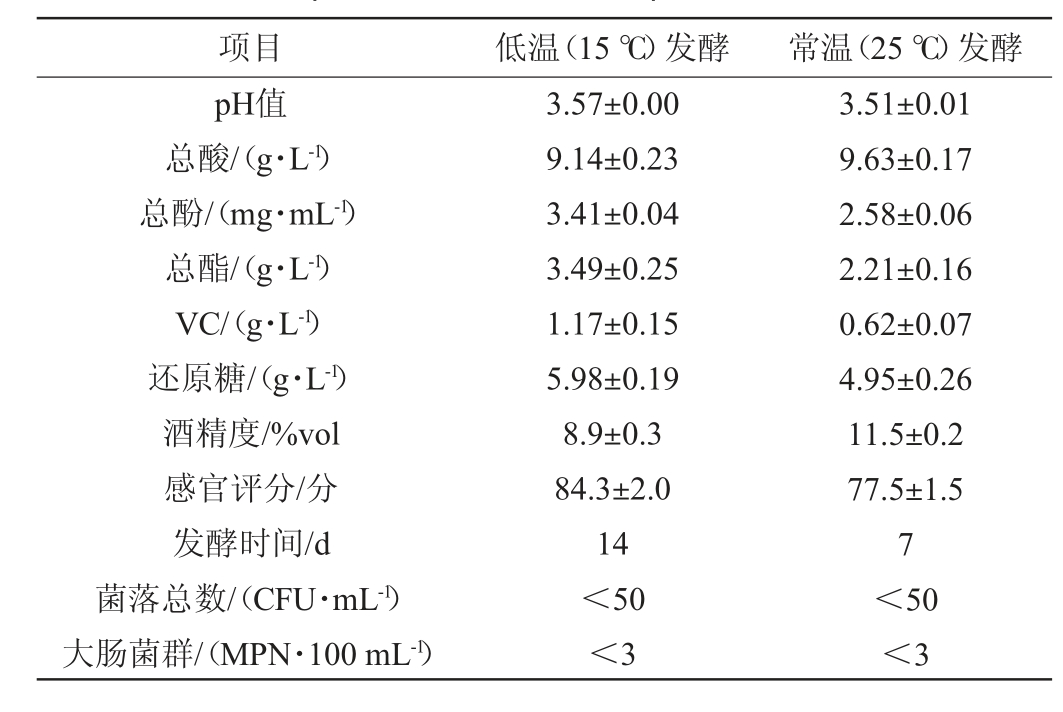
项目 低温(15 ℃)发酵 常温(25 ℃)发酵pH值总酸/(g·L-1)总酚/(mg·mL-1)总酯/(g·L-1)VC/(g·L-1)还原糖/(g·L-1)酒精度/%vol感官评分/分发酵时间/d菌落总数/(CFU·mL-1)大肠菌群/(MPN·100 mL-1)3.57±0.00 9.14±0.23 3.41±0.04 3.49±0.25 1.17±0.15 5.98±0.19 8.9±0.3 84.3±2.0 14<50<3 3.51±0.01 9.63±0.17 2.58±0.06 2.21±0.16 0.62±0.07 4.95±0.26 11.5±0.2 77.5±1.5 7<50<3
2.5 低温发酵与常温发酵制备复合果酒挥发性风味物质对比
采用顶空固相微萃取-气相色谱-质谱联用技术(HSSPME-GC-MS)对低温发酵与常温发酵制备复合果酒风味物质进行检测,结果见表7。由表7可知,低温和常温发酵制备复合果酒中分别共检测出挥发性风味物质55种、51种,低温发酵条件下复合果酒挥发性风味物质总含量为38.269 mg/L,其中醇类物质9种(3.241 mg/L)、酯类物质25种(30.761 mg/L)、醛酮类物质8种(0.185 mg/L)、萜烯,其他类物质7种(0.728 mg/L)、酸类物质6种(3.354 mg/L);常温条件下复合果酒挥发性风味物质总含量为34.408 mg/L,其中醇类物质9种(5.668 mg/L)、酯类物质23种(24.062 mg/L)、醛酮类物质8种(0.423 mg/L)、萜烯及其他类物质5种(0.488 mg/L)、酸类物质6种(3.867 mg/L);酯类物质、醇类物质、酸类物质为两种发酵酒的挥发性风味物质提供了较大的贡献。
表7 低温发酵和常温发酵猕猴桃苹果复合果酒挥发性风味物质HS-SPME-GC-MS分析比较
Table 7 Comparison of volatile flavor substances in kiwi-apple compound fruit wine with low-temperature and room temperature fermentation analysis by HS-SPME-GC-MS

序号 CAS号 化合物含量/(mg·L-1)低温15 ℃ 常温25 ℃123456789 1234567891 0 111-27-3 123-51-3 111-87-5 60-12-8 505-10-2 928-97-2 78-83-1 71-41-0 100-51-6 0.254±0.018 1.268±0.086 0.116±0.088 0.830±0.054 0.645±0.082 0.085±0.010 0.028±0.008 0.009±0.003 0.006±0.001 3.241 0.434±0.051 1.751±0.047 0.119±0.028 1.697±0.092 1.437±0.039 0.096±0.012 0.107±0.14 0.003±0 0.024±0.004 5.668 11 12 13 505-10-2 123-66-0 142-92-7 141-78-6 106-30-9 105-79-3 2198-61-0 623-42-7 105-54-4 103-45-7 2035-99-6 123-29-5 110-42-9醇类正己醇异戊醇正辛醇苯乙醇3-甲硫基丙醇反式-3-己烯-1-醇异丁醇正戊醇苯甲醇合计酯类乙酸异戊酯己酸乙酯乙酸己酯乙酸乙酯庚酸乙酯己酸异丁酯己酸异戊酯丁酸甲酯丁酸乙酯乙酸苯乙酯辛酸异戊酯壬酸乙酯癸酸甲酯2.982±0.184 4.406±0.390 0.745±0.016 1.013±0.032 ND 0.015±0.003 0.037±0.014 2.746±0.492 0.476±0.083 3.149±0.704 0.044±0.013 0.018±0.004 0.014±0.002 3.109±0.251 1.683±0.054 1.201±0.078 0.930±0.065 0.005±0 0.009±0.001 ND 1.290±0.517 0.267±0.017 3.547±0.594 0.031±0.007 ND 0.008±0
续表
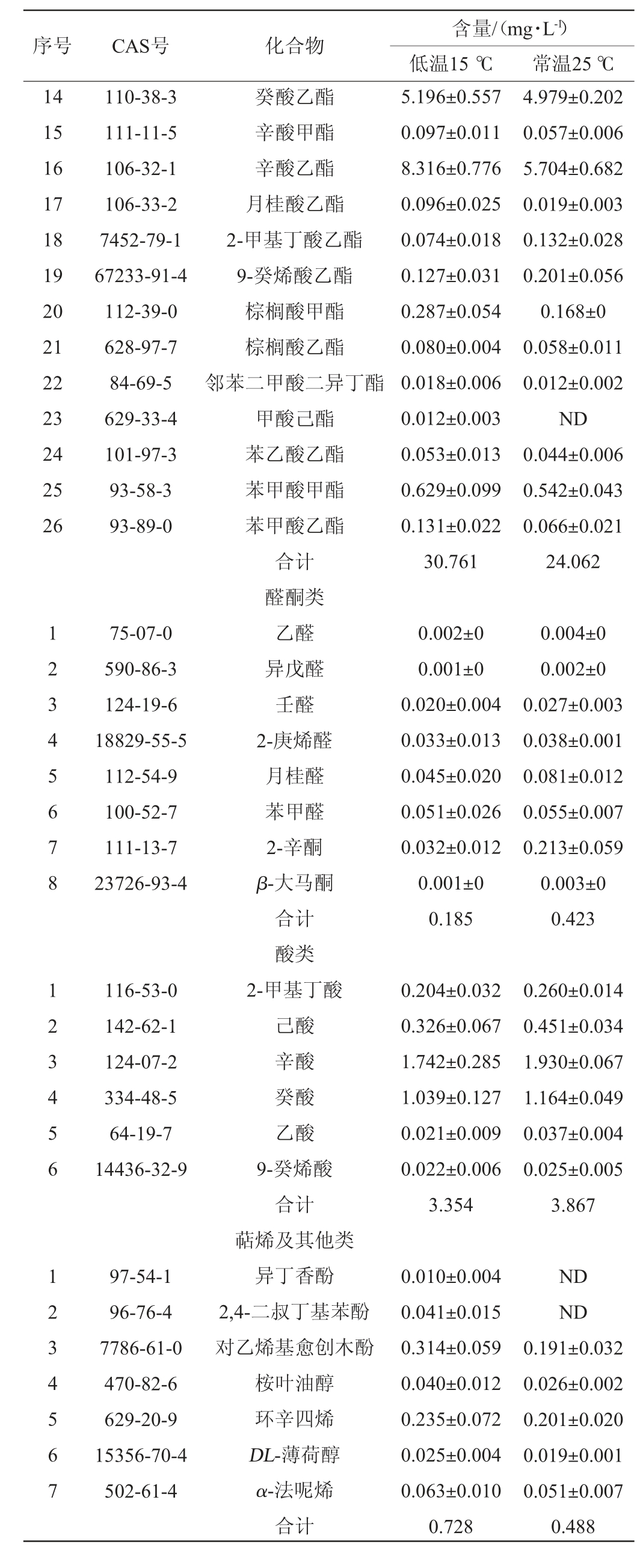
序号 CAS号 化合物14 15 16 17 18 19 20 21 22 23 24 25 26含量/(mg·L-1)低温15 ℃ 常温25 ℃110-38-3 111-11-5 106-32-1 106-33-2 7452-79-1 67233-91-4 112-39-0 628-97-7 84-69-5 629-33-4 101-97-3 93-58-3 93-89-0 5.196±0.557 0.097±0.011 8.316±0.776 0.096±0.025 0.074±0.018 0.127±0.031 0.287±0.054 0.080±0.004 0.018±0.006 0.012±0.003 0.053±0.013 0.629±0.099 0.131±0.022 30.761 4.979±0.202 0.057±0.006 5.704±0.682 0.019±0.003 0.132±0.028 0.201±0.056 0.168±0 0.058±0.011 0.012±0.002 ND 0.044±0.006 0.542±0.043 0.066±0.021 24.062 1 2 3 4 5 6 7 8 1 2 3 4 5 6 1 2 3 4 5 6 7 75-07-0 590-86-3 124-19-6 18829-55-5 112-54-9 100-52-7 111-13-7 23726-93-4 0.002±0 0.001±0 0.020±0.004 0.033±0.013 0.045±0.020 0.051±0.026 0.032±0.012 0.001±0 0.185 0.004±0 0.002±0 0.027±0.003 0.038±0.001 0.081±0.012 0.055±0.007 0.213±0.059 0.003±0 0.423 116-53-0 142-62-1 124-07-2 334-48-5 64-19-7 14436-32-9 0.204±0.032 0.326±0.067 1.742±0.285 1.039±0.127 0.021±0.009 0.022±0.006 3.354 0.260±0.014 0.451±0.034 1.930±0.067 1.164±0.049 0.037±0.004 0.025±0.005 3.867 97-54-1 96-76-4 7786-61-0 470-82-6 629-20-9 15356-70-4 502-61-4癸酸乙酯辛酸甲酯辛酸乙酯月桂酸乙酯2-甲基丁酸乙酯9-癸烯酸乙酯棕榈酸甲酯棕榈酸乙酯邻苯二甲酸二异丁酯甲酸己酯苯乙酸乙酯苯甲酸甲酯苯甲酸乙酯合计醛酮类乙醛异戊醛壬醛2-庚烯醛月桂醛苯甲醛2-辛酮β-大马酮合计酸类2-甲基丁酸己酸辛酸癸酸乙酸9-癸烯酸合计萜烯及其他类异丁香酚2,4-二叔丁基苯酚对乙烯基愈创木酚桉叶油醇环辛四烯DL-薄荷醇α-法呢烯合计0.010±0.004 0.041±0.015 0.314±0.059 0.040±0.012 0.235±0.072 0.025±0.004 0.063±0.010 0.728 ND ND 0.191±0.032 0.026±0.002 0.201±0.020 0.019±0.001 0.051±0.007 0.488
酯类物质是为果酒提供香气最主要的化合物,能够为果酒赋予果香花香属性[20]。与低温发酵相比,常温发酵复合果酒酯类物质相对减少,其中乙基酯类物质在常温发酵时减少较多。这与MOLINA A M等[21]研究结果一致。根据低温发酵有关报道表明,低温环境下能检测到乙基酯的产量大于常温发酵的原因与酰基转移酶有关,低温条件下该酶活性更强,有利于酯类物质的产生,还有助于萜烯类物质的保留[22];乙酸异戊酯、乙酸己酯、乙酸苯乙酯这三种乙酸酯类物质及2-甲基丁酸乙酯在常温发酵条件下高于低温发酵。这与GAMERO A等[23]研究结果一致。
适量的高级醇同样能够为果酒提供果香及花香的特征。常温发酵果酒的醇类物质含量高于低温发酵果酒,由于在低温条件下,酵母菌处于胁迫状态,发酵途径会发生改变,从而减少了高级醇的产生[24]。高级醇浓度的降低,能够丰富果酒的营养价值且对果酒品质的提升有积极影响。
果酒中的酸类物质能够为果酒带来清爽口感,使果酒酸甜可口。同时酸类物质在低浓度的情况下,可以呈出奶油或奶酪的香味,然而当其浓度过高时则会呈出腐臭味道,对果酒的品质有负面作用[12]。低温发酵条件下,酸类物质低于常温发酵,而酸类物质的降低可以防止其含量过高对果酒产生不利影响[25]。
综上,低温发酵猕猴桃苹果复合果酒挥发性风味物质优于常温发酵。
3 结论
通过试验分析对比猕猴桃与苹果不同质量比的理化指标,确定了最佳猕猴桃果浆与苹果果浆最佳质量比为2∶1;通过单因素及响应面试验优化确定了猕猴桃-苹果复合果酒最佳低温发酵工艺为初始糖度22%,发酵温度15 ℃,酵母接种量2.0 g/L。在此优化条件下,酿造的猕猴桃-苹果复合果酒总酯为3.49 g/L,其他理化指标均符合果酒或行业相关标准。猕猴桃-苹果复合果酒感官评分为84分,酒体清澈透明,口感圆润、酸甜可口,果香更为浓郁,具有猕猴桃及苹果特有香气且营养价值丰富。在常温的条件下,以相同的发酵工艺条件酿制复合果酒,通过对比常温和低温条件下发酵果酒的理化指标,低温发酵条件下,会为果酒保留更多的VC和总酯,且酒精度较低,使得果酒的营养物质得到了一定的提升,感官评价也较常温发酵高。通过HSSPME-GC-MS对常温和低温两种发酵酒进行分析鉴定,低温和常温发酵酒中分别共检测出挥发性风味物质55种、51种,两种发酵酒中酯类、醇类及酸类为发酵酒提供了主要的香气成分,低温条件下发酵制备猕猴桃-苹果复合果酒,具有更高的酯类物质含量,改善了复合果酒的品质。
[1]衣海龙,仝欣.蓝莓——猕猴桃果酒酿造工艺的研究[J].酿酒,2017,44(3):67-70.
[2]宋艺君,庞来祥,袁筱,等.GC-IMS法比较不同酒龄猕猴桃酒特征香气物质差异[J].食品与生物技术学报,2023,42(2):58-65.
[3]LIU D,QI Y M,ZHAO N,et al.Multivariate analysis reveals effect of glutathione-enriched inactive dry yeast on amino acids and volatile components of kiwi wine[J].Food Chem,2020,329:127086.
[4]王璇,刘军弟,邵砾群,等.我国苹果产业年度发展状况及其趋势与建议[J].中国果树,2018(3):101-104,108.
[5]王正荣,马汉军.火龙果苹果复合果酒发酵工艺的研究[J].酿酒科技,2016(3):96-99.
[6]张永茂.研发苹果高度蒸馏酒化解苹果产业潜在危机[J].中国农村科技,2016(8):43-45.
[7]毛春兰.不同底物浓度下初始pH值影响厌氧发酵效果的研究[D].杨凌:西北农林科技大学,2015.
[8]王珊珊,齐悦,韩薇,等.苹果猕猴桃复合果酒发酵工艺的研究[C].第十七届沈阳科学学术年会,2020:1222-1229
[9]周春丽,钟贤武,范鸿冰,等.果蔬及其制品中可溶性总糖和还原糖的测定方法评价[J].食品工业,2012,33(5):89-92.
[10]郑万明.蓝莓果酒制备工艺优化研究[D].哈尔滨:黑龙江大学,2018.
[11]叶萌祺.苹果酒酿造过程香气物质调控及FT-NIRS分析方法研究[D].杨凌:西北农林科技大学,2015.
[12]赵宁,魏新元,樊明涛,等.SPME-GC-MS结合电子鼻技术分析不同品种猕猴桃酒香气物质[J].食品科学,2019,40(22):249-255.
[13]黎星辰.猕猴桃酒酿酒菌种性能分析、优选与混合发酵工艺优化研究[D].成都:西华大学,2017.
[14]田怀香,熊娟涓,于海燕,等.果酒中香气化合物的生物转化与调控机制研究进展[J].食品科学,2022,43(19):36-47.
[15]董赛君,赵廷彬,李天瑜,等.枸杞果酒低温发酵工艺优化及挥发性风味物质分析[J].中国酿造,2019,38(6):103-107.
[16]苏伟,邓山鸿,陈钢.脐橙果酒低温发酵工艺优化及挥发性风味物质分析[J].中国酿造,2021,40(1):133-137.
[17] CAO Y X, WU Z F, WENG P F.Comparison of bayberry fermented wine aroma from different cultivars by GC-MS combined with electronic nose analysis[J].Food Sci Nutr,2020,8(2):830-840.
[18]李佳,杨晓丽,杨小丹,等.响应面法优化铁皮石斛多糖的提取及其成分分析[J].热带农业科学,2021,41(10):39-49.
[19]张建萍,江润生,巫永华,等.紫薯酒低温发酵工艺及酚类物质动态变化分析[J].食品工业,2020,41(1):167-171.
[20]韦璐,杨昌鹏,孙钦菊,等.香蕉果酒低温发酵过程中挥发性香气成分的变化[J].食品工业科技,2020,41(18):231-238.
[21] MOLINA A M,SWIEGERS J H, VARELA C, et al.Influence of wine fermentation temperature on the synthesis of yeast-derived volatile aroma compounds[J].Appl Microbiol Biot,2008,77(3):675-687.
[22] CHEN Y F,LI F, GUO J, et al.Enhanced ethyl caproate production of Chinese liquor yeast by overexpressing EHT1 with deleted FAA1[J].J Ind Microbiol Biot,2014,41(3):563-572.
[23]GAMERO A,TRONCHONI J,QUEROL A,et al.Production of aroma compounds by cryotolerant Saccharomyces species and hybrids at low and moderate fermentation temperatures[J].J Appl Microbiol,2013,114(5):1405-1414.
[24]原苗苗,赵新节,孙玉霞.低温对葡萄酒香气成分和酵母代谢的影响[J].食品与发酵工业,2017,43(12):268-276.
[25]郑淑丹.脐橙全果酒的混合发酵及风味物质的研究[D].南昌:南昌大学,2019.