淀粉酶和蛋白酶是国内国际市场上应用广泛的两种重要的工业酶[1-2],被广泛应用于纺织、食品、洗涤剂、医药、饲料加工和化工等领域[3]。淀粉酶可催化水解淀粉、糖原和糊精中的糖苷键,主要包括α-淀粉酶和β-淀粉酶等,而芽孢杆菌属(Bacillus)微生物是α-淀粉酶最主要的工业生产菌属[4]。蛋白酶能切断蛋白质分子内部的肽键,使蛋白质分子变成小分子多肽和氨基酸,主要包括酸性、中性和碱性蛋白酶等,目前工业上2/3以上的蛋白酶由微生物发酵产生[2],发酵生产蛋白酶的微生物菌种主要有细菌、霉菌和放线菌等,其中芽孢杆菌属主要用于发酵生产中性和碱性蛋白酶制剂[5]。
芽孢杆菌属(Bacillus)是一类好氧或兼性厌氧的、能够产生抗逆性芽孢的细菌,在环境中广泛存在,可分泌多种水解酶类。国内外对产淀粉酶的芽孢杆菌菌株研究报道较多,如ABO-KAMER A M 等[6]从土壤中分离得到的可产α-淀粉酶的蜡样芽孢杆菌(Bacillus cereus)、DUAN X G等[7]分离得到的产β-淀粉酶的阿氏芽孢杆菌(Bacillus aryabhattai)GEL-09菌株等,除此之外,已报道的产淀粉酶的芽孢杆菌还有枯草芽孢杆菌(Bacillus subtilis)[8]、地衣芽孢杆菌(Bacillus licheniformis)[9-10]、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[11-12]、弯曲芽孢杆菌(Bacillus flexus)[13]等。同时,研究者们对产蛋白酶的芽孢杆菌属也进行了很多相关的研究报道,如KESHAPAGA U R等[14]分离得到的高产半胱氨酸蛋白酶的枯草芽孢杆菌A4;JAYAKUMAR D等[15]从土壤中分离得到的可产具有热稳定性的碱性蛋白酶的蜡样芽孢杆菌KM05;YU P等[16]分离得到的可产中性蛋白酶的芽孢杆菌(Bacillus)ZG20等。此外,已报道的产中性或碱性蛋白酶的芽孢杆菌还有解淀粉芽孢杆菌[17]等,其中枯草芽孢杆菌AS1.398、地衣芽孢杆菌2709是我国较早用于工业化发酵生产中性蛋白酶的菌株[18-20]。
本研究从本实验室前期分离保存的61株芽孢杆菌菌株中筛选产淀粉酶和蛋白酶的菌株,采用菌株形态学观察、生理生化试验和分子生物学鉴定方法对筛选菌株进行鉴定,并研究温度、pH和金属离子等对其所产淀粉酶和蛋白酶催化活性的影响,以期为后续酶促反应特异性分析、酶促动力学分析以及该菌株在食品饮料、医药等生产中的应用提供一定的依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种芽孢杆菌菌株(共61株,编号CX-1~CX-61):前期从土壤中分离得到,本实验室保藏。
1.1.2 化学试剂
干酪素、酪氨酸、可溶性淀粉、麦芽糖、脱脂奶粉、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)、胰蛋白胨、蛋白胨、酵母浸出粉、牛肉浸膏、酒石酸钾钠、苯酚、三氯乙酸、乙酸、乙酸钠、氯化钠、盐酸、二水合磷酸二氢钠、十二水合磷酸氢二钠、硼酸、硼砂、亚硫酸钠、氯化钾、氯化钙、氯化锂、氯化锰:国药集团化学试剂有限公司;福林-酚:南京奥多福尼生物科技有限公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
种子液体培养基和发酵培养基采用LB液体培养基:氯化钠10.0 g/L,胰蛋白胨10.0 g/L,酵母浸出粉5.0 g/L,用1 mol/L的氢氧化钠调节pH值为7.0。121 ℃灭菌20 min。
LB固体培养基:LB液体培养基中加入琼脂粉15.0 g/L。121 ℃灭菌20 min。
淀粉酶筛选培养基:可溶性淀粉2.0 g/L,牛肉膏3.0 g/L,蛋白胨10.0 g/L,氯化钠5.0 g/L,琼脂粉15.0 g/L。121 ℃灭菌20 min。
蛋白酶筛选培养基:牛肉膏3.0 g/L,蛋白胨10.0 g/L,氯化钠5.0 g/L,脱脂奶粉15.0 g/L,琼脂粉15.0 g/L。121 ℃灭菌20 min。
1.2 仪器与设备
732C可见分光光度计、JY4001电子天平:上海精密科学仪器有限公司;SX500立式高压蒸汽灭菌锅:日本Tomy Digital Biology公司;HWS-80B恒温培养箱:北京恒诺利兴科技有限公司;NRY-100C恒温摇床:上海南荣实验设备有限公司;HH-S恒温水浴锅:常州市亿能实验仪器厂;SW-CJ-2D超净工作台:上海苏净净化有限公司;Centrifuge5418R冷冻离心机:德国Eppendorf公司;PHS-3E pH计:上海雷磁仪器厂;MiniAmp聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Applied Biosystems公司;DYY-8C电泳仪、DYCP-31E脱氧核糖核酸(deoxyribonucleic acid,DNA)水平电泳槽:北京六一仪器厂;JS-8000全自动凝胶成像仪:上海培清科技有限公司。
1.3 实验方法
1.3.1 菌株筛选
(1)初筛
取1 mL待测菌液接入20 mL种子液体培养基,37 ℃、180 r/min条件下振荡培养24 h,吸取富集菌液0.5 mL按10倍梯度稀释至10-6,取0.1 mL稀释液涂布于LB固体培养基上,37 ℃倒置培养24 h后,用无菌牙签挑取单菌落,分别点接种于淀粉酶筛选培养基和蛋白酶筛选培养基上,37 ℃倒置培养48 h,观察菌落透明圈,计算透明圈直径(H)/菌落直径(C)值,挑选同时具有较大淀粉酶和蛋白酶H/C值的菌落为初筛菌株。
(2)复筛
挑取初筛得到的目的菌株接种于20 mL发酵培养基中,于37 ℃、180 r/min条件下振荡培养48 h后,4 ℃、5 000 r/min条件下离心10 min,弃菌体,取上清液,分别测定淀粉酶和蛋白酶活力,选择淀粉酶和蛋白酶活力高的菌株。
1.3.2 淀粉酶和蛋白酶酶活力测定
(1)种子液制备
挑取复筛得到的目的菌株接种于20 mL发酵培养基中,于37 ℃、180 r/min条件下振荡培养48 h,即为筛选菌株种子液。
(2)粗酶液制备
按照1%(V/V)的接种量取5 mL种子液接种于装液量为50 mL/250 mL的发酵培养基中,37 ℃、180 r/min培养48 h后,4 ℃、5 000 r/min离心10 min,上清液即为粗酶液。
(3)淀粉酶酶活测定
采用DNS比色法测定淀粉酶酶活[21]。淀粉酶活力单位定义:在40 ℃、pH 6.0的条件下,每分钟从1%(质量分数)的可溶性淀粉中水解释放出1 μmol还原糖的酶量定义为1个酶活力单位(U)。
(4)蛋白酶酶活测定
采用Folin-酚法测定蛋白酶酶活[22]。蛋白酶活力单位定义:在40 ℃、pH 7.5的条件下,每分钟将酪蛋白水解产生1 μg酪氨酸的酶量定义为1个酶活力单位(U)。
1.3.3 菌株鉴定
(1)形态学观察
将菌株CX-47接种于LB固体培养基,37 ℃倒置培养48 h后,参考文献[23]对菌株CX-47进行形态学观察。
(2)生理生化试验
参考文献[24]对菌株CX-47进行革兰氏染色、V.P试验、水解试验、接触酶试验等生理生化试验。
(3)分子生物学鉴定
挑取少量待测菌株于20 mL LB液体培养基中,28 ℃、180 r/min培养12 h,取2 μL菌液,用细菌16S rDNA通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGYTACCTTGTTACGACTT-3')为引物,进行菌落PCR扩增。PCR扩增体系(50 μL):2 μL DNA模板,2 μL引物27F,2 μL引物1492R,5 μL 10×PCR Buffer,4 μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/each),34.5 μL双蒸水(ddH2O),0.5 μL Taq DNA聚合酶(5 U/L)。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸90 s,35个循环;72 ℃后延伸10 min。PCR扩增产物交由生工生物工程(上海)有限公司进行测序。将菌落PCR的16S rDNA测序结果提交至美国国家生物技术信息中心(national center of biotechnology infor mation,NCBI)中的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,利用MEGA 7.0软件采用邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 酶学性质
(1)反应温度对淀粉酶和蛋白酶活性影响
反应温度分别设定为20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃,以最高酶活定义为100%,分别计算不同反应温度条件下淀粉酶和蛋白酶的相对酶活。
(2)反应pH值对淀粉酶和蛋白酶活性影响
在反应温度40 ℃条件下,分别测定反应pH值为4.0、5.0、6.0、7.0、8.0和9.0时的酶活,以最高酶活定义为100%,分别计算不同反应pH值条件下淀粉酶和蛋白酶的相对酶活。
(3)金属离子对淀粉酶和蛋白酶活性影响
粗酶液中分别加入K+、Ca2+、Li+和Mn2+,使金属离子终浓度为20 mmol/L,4 ℃条件下放置1 h,测定酶活力,以不添加金属离子的酶活定义为100%,分别计算不同金属离子条件下淀粉酶和蛋白酶的相对酶活。
1.3.5 数据处理
每组进行3次平行实验,结果以“平均值±标准差”表示,数据分析采用Excel 2016,并用Origin 9.0绘制图表。
2 结果与分析
2.1 产酶菌株筛选
将实验室保藏的61株土壤源芽孢杆菌分别在淀粉酶筛选培养基和蛋白酶筛选培养基上进行培养,利用目的菌株能产生淀粉酶水解淀粉产生透明圈、产生蛋白酶水解脱脂奶粉产生透明圈等特性进行初筛,其中代表菌株在培养基上淀粉酶、蛋白酶水解圈及菌落形态见图1。由图1a和图1b可知,能够产生淀粉酶、蛋白酶的菌株分别在淀粉酶筛选培养基和蛋白酶筛选培养基上产生了清晰、较大的透明圈。由图1c可知,菌落形态为圆形或椭圆形,有褶皱、表面粗糙、无光泽,呈白色不透明状、边缘整齐。分别测量记录61株供试菌株透明圈直径(H)和菌落直径(C),计算H/C值,选出9株H/C值较大的菌株CX-3、CX-7、CX-16、CX-23、CX-35、CX-41、CX-47、CX-50和CX-58进行复筛。

图1 代表菌株淀粉酶(a)、蛋白酶(b)水解圈及菌落形态(c)
Fig.1 Hydrolysis circles of amylase (a) and protease (b) and colony morphology (c) of representative strain
对初筛得到的9株菌株进行摇瓶发酵培养,测定其发酵所产淀粉酶和蛋白酶活性,结果见表1。由表1可知,菌株CX-47产淀粉酶、蛋白酶H/C值均最高,分别为4.47、3.35,该菌株发酵液中淀粉酶和蛋白酶活性也最高,分别为10.24 U/mL、249.42 U/mL。因此,确定菌株CX-47为筛选目的菌株。
表1 筛选菌株产淀粉酶和蛋白酶活力比较
Table 1 Comparison of amylase and protease activities of screened strains
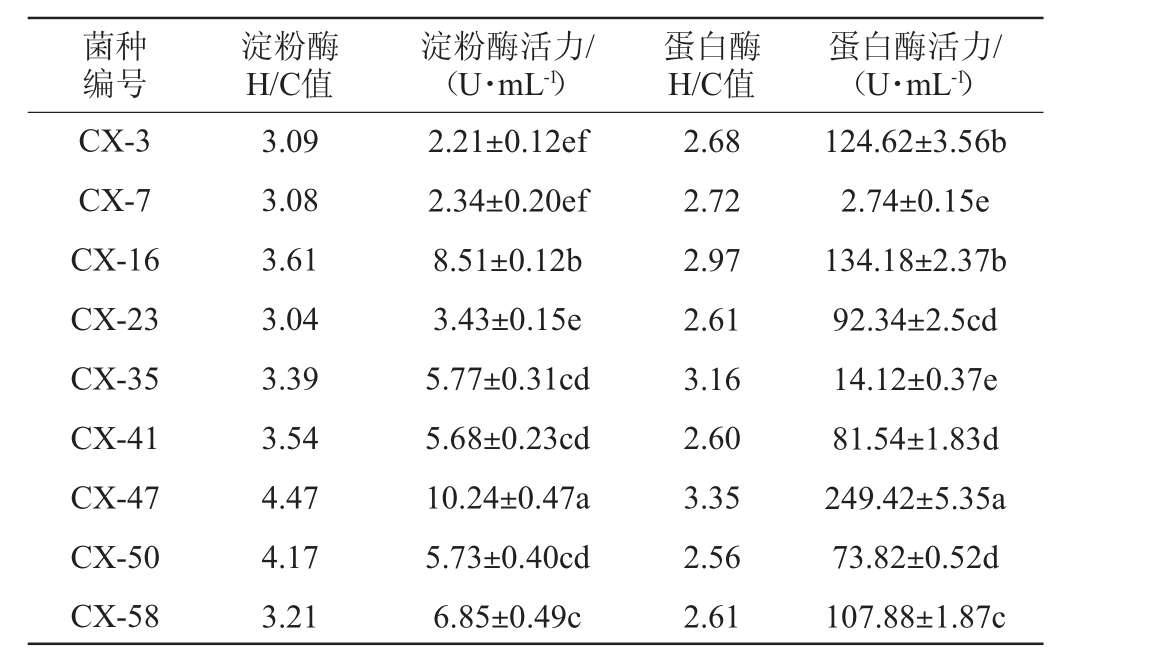
注:同列数据字母不同表示差异显著(P<0.05)。
菌种编号淀粉酶H/C值淀粉酶活力/(U·mL-1)蛋白酶H/C值蛋白酶活力/(U·mL-1)CX-3 CX-7 CX-16 CX-23 CX-35 CX-41 CX-47 CX-50 CX-58 3.09 3.08 3.61 3.04 3.39 3.54 4.47 4.17 3.21 2.21±0.12ef 2.34±0.20ef 8.51±0.12b 3.43±0.15e 5.77±0.31cd 5.68±0.23cd 10.24±0.47a 5.73±0.40cd 6.85±0.49c 2.68 2.72 2.97 2.61 3.16 2.60 3.35 2.56 2.61 124.62±3.56b 2.74±0.15e 134.18±2.37b 92.34±2.5cd 14.12±0.37e 81.54±1.83d 249.42±5.35a 73.82±0.52d 107.88±1.87c
2.2 菌株CX-47鉴定
2.2.1 形态学观察
菌株CX-47在LB固体培养基上形成圆形或椭圆形菌落,菌落有褶皱、表面粗糙、无光泽,呈白色不透明状、边缘整齐。
2.2.2 生理生化试验
菌株CX-47主要生理生化特征见表2。由表2可知,菌株CX-47属革兰氏阳性菌,可厌氧生长,能水解淀粉、酪蛋白和明胶,能分解过氧化氢,能发酵葡萄糖产酸,能利用硝酸盐、柠檬酸,能耐受10%NaCl和pH 8.5的培养条件,但不能耐受55 ℃的高温培养,V.P试验和吲哚试验结果呈阳性,氧化酶试验结果呈阴性。参照《伯杰氏系统细菌学手册》中相关菌属的描述特征,初步鉴定菌株CX-47为芽孢杆菌(Bacillus)。
表2 菌株CX-47的生理生化特征
Table 2 Physiological and biochemical characteristics of strain CX-47

注:“+”表示结果呈阳性;“-”表示结果呈阴性。
项目 结果 项目 结果革兰氏染色V.P试验淀粉水解试验酪蛋白水解试验明胶水解试验接触酶氧化酶吲哚试验葡萄糖产酸++++++-++硝酸盐还原利用柠檬酸37 ℃培养55 ℃培养2%NaCl培养10%NaCl培养pH 5.5培养pH 8.5培养厌氧生长+++-+++++
2.2.3 分子生物学鉴定
以菌株CX-47的基因组DNA为模板,PCR扩增16SrDNA基因序列,PCR扩增产物经过琼脂糖凝胶电泳检测,结果见图2。由图2可知,在1 500 bp左右出现条带,说明PCR成功扩增出了目标序列。
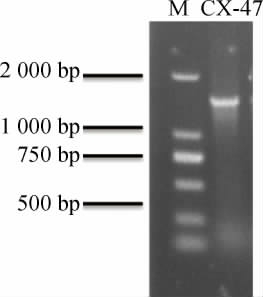
图2 菌株CX-47 16S rDNA基因序列的PCR扩增产物电泳结果
Fig.2 Electrophoresis results of PCR amplification products of 16S rDNA gene sequence for strain CX-47
M:DL2 000 DNA marker。
采用MEGA7.0软件以NJ法构建菌株CX-47系统发育树,结果见图3。
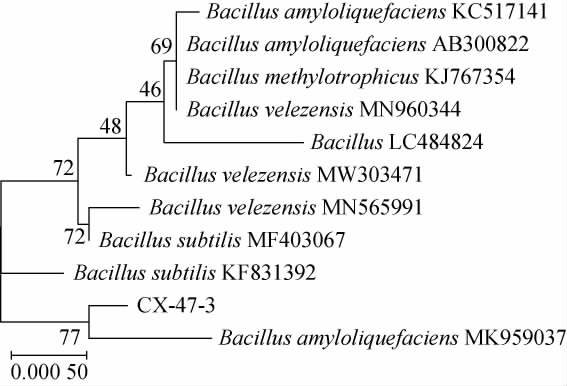
图3 基于16S rDNA基因序列菌株CX-47的系统发育树
Fig.3 Phylogenetic tree of strain CX-47 based on 16S rDNA gene sequence
由图3可知,将基因测序结果进行BLAST分析,发现菌株CX-47的16S rDNA基因序列与解淀粉芽孢杆菌属同源性最高,达99%以上。菌株CX-47与Bacillus amyloliquefaciens(MK959037)进化亲缘关系最近。因此,菌株CX-47被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
2.3 淀粉酶和蛋白酶酶学性质
2.3.1 反应温度对淀粉酶和蛋白酶催化活性的影响
根据最适反应温度的不同,可将淀粉酶分为低温淀粉酶(低于30 ℃)、中温淀粉酶(30~60 ℃)和高温淀粉酶(最适催化温度60 ℃以上)[25]。反应温度对菌株CX-47所产淀粉酶和蛋白酶催化活性的影响结果见图4。由图4可知,在反应温度在20~50 ℃时,菌株CX-47发酵产生的淀粉酶催化活性随着温度的升高而升高;在反应温度50 ℃时,淀粉酶催化水解淀粉的能力最强,其催化能力是20 ℃时的5倍多;之后,随着反应温度的继续升高,淀粉酶催化活力快速下降,当反应温度为80 ℃时,其酶活性仅为50 ℃时的约10%。结果表明,菌株CX-47所产淀粉酶的最适温度为50 ℃,为中温淀粉酶。
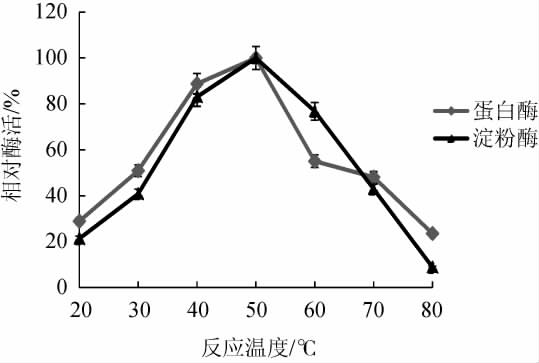
图4 反应温度对菌株CX-47产淀粉酶和蛋白酶活性的影响
Fig.4 Effect of reaction temperature on activities of amylase and protease produced by strain CX-47
根据最适催化反应温度的不同,蛋白酶也可分为嗜热、中温和嗜冷蛋白酶,其中嗜热蛋白酶的最适反应温度通常在60 ℃以上[26],嗜冷蛋白酶最适反应温度一般在40 ℃以下[27],由图4可知,在20~50 ℃反应温度范围内,随着酶促反应温度的升高,蛋白酶催化反应活性逐步增加;在温度为50 ℃时达到最高,之后,随着反应温度的继续升高,蛋白酶催化活性迅速降低。结果表明,菌株CX-47发酵所产蛋白酶最适催化反应温度为50 ℃,为中温蛋白酶。
2.3.2 反应pH对淀粉酶和蛋白酶催化活性的影响
根据最适反应pH值不同,可将淀粉酶分为碱性淀粉酶、中性淀粉酶和酸性淀粉酶等,其中碱性淀粉酶最适反应pH值>8.0、中性淀粉酶最适反应pH值为6.0~8.0、酸性淀粉酶最适反应pH值<6.0[25]。反应pH对淀粉酶和蛋白酶催化活性的影响结果见图5。由图5可知,随着反应pH值在4.0~7.0范围内增加,菌株CX-47产淀粉酶酶促反应活性随之增加;反应pH值为7.0时,淀粉酶活性最高;反应pH值>7.0之后,淀粉酶活性随之下降。因此,菌株CX-47所产淀粉酶最适反应pH值为7.0,属于中性淀粉酶。
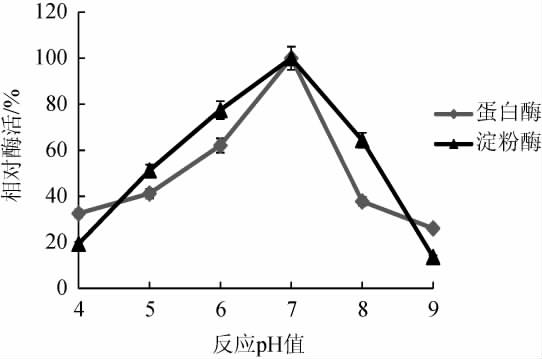
图5 反应pH值对菌株CX-47产淀粉酶和蛋白酶活性的影响
Fig.5 Effect of reaction pH on activities of amylase and protease produced by strain CX-47
根据蛋白酶作用的最适pH不同,可将其分为碱性蛋白酶、中性蛋白酶和酸性蛋白酶,其中碱性蛋白酶的最适作用pH为9~11,中性蛋白酶的最适作用pH为6.0~7.5,酸性蛋白酶的最适作用pH值为2.0~4.0[28]。由图5可知,随着pH值在4.0~7.0范围内增加,菌株CX-47产蛋白酶活性随之增加;在pH值7.0时,蛋白酶活性最高;pH>7.0之后,蛋白酶活性随之下降。因此,菌株CX-47产蛋白酶的最适反应pH值为7.0,属中性蛋白酶。
综上所述,CX-47菌株所产淀粉酶和蛋白酶均为中温中性酶。
可同时发酵产生多种活性成分的微生物越来越受到研究者们的重视,到目前为止已有较多相关的研究报道。ZHANG A D等[29]采用ARTP法诱变具有产淀粉酶和蛋白酶的特性地衣芽孢杆菌XS-4,得到了淀粉酶和酸性蛋白酶活性极显著提高的mut80突变株,该突变株可显著提升传统的酱油发酵工艺水平。BHANGE K等[30]研究发现,枯草芽孢杆菌PF1菌株可发酵产生淀粉酶、蛋白酶和表面活性剂等成分,其发酵所产淀粉酶与蛋白酶的最适pH/最适温度分别为6.0/70 ℃、9.0/60 ℃,分别属于高温中性淀粉酶、中温碱性蛋白酶,该淀粉酶、蛋白酶和表面活性剂等作为洗涤剂添加剂的去污能力极强,表明PF1菌株在发酵生产洗涤剂添加剂方面具有重要的应用价值。RAI A K等[31]研究发现,枯草芽孢杆菌KN12C菌株、解淀粉芽孢杆菌KN2G菌株和地衣芽孢杆菌KN13C菌株等3株芽孢杆菌均可同时发酵产生α-淀粉酶、β-葡萄糖苷酶和蛋白酶等3种水解酶,分别利用这3个菌株发酵水解大豆均获得了具有较高生物活性的大豆水解产物,表明这3个菌株在大豆加工等行业具有重要的应用价值。本试验中,菌株CX-47所产淀粉酶在温度40~60 ℃/pH 6.0~8.0范围内、所产蛋白酶在温度40~50 ℃/pH6.0~7.0范围内均具有相对较高的水解活性,可在酶催化反应最容易达到的反应条件范围内将淀粉等大分子糖类物质水解成小分子糖类、将动植物蛋白水解成为小分子的氨基酸或者多肽等,因此,推测菌株CX-47在食品加工、皮革加工、酿造、洗涤等行业具有潜在应用价值。
2.3.3 金属离子对淀粉酶和蛋白酶催化活性的影响
金属离子对淀粉酶和蛋白酶催化活性的影响见图6。由图6A可知,K+和Ca2+对菌株CX-47所产淀粉酶催化活性具有一定的促进作用,而Li+和Mn2+则对其有一定程度的抑制作用。
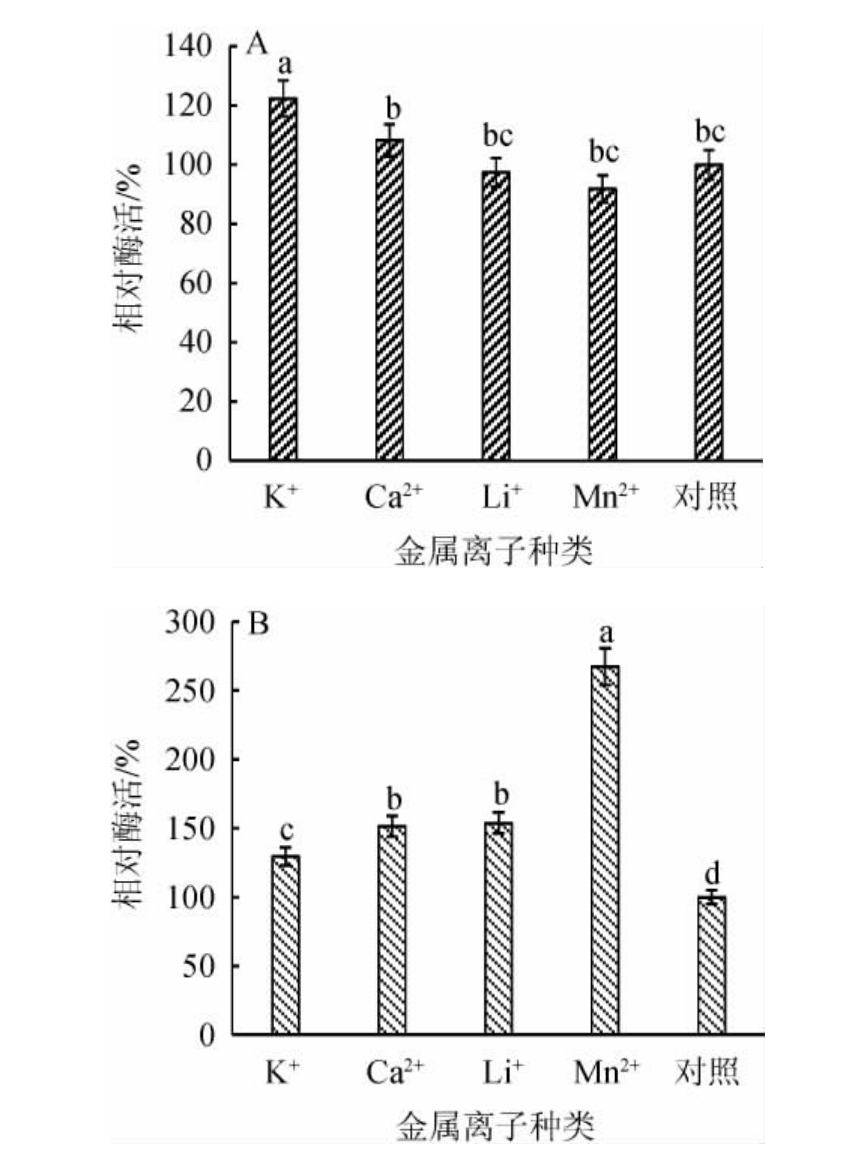
图6 金属离子对菌株CX-47产淀粉酶(A)和蛋白酶(B)活性的影响
Fig.6 Effect of metal ions on activities of amylase (A) and protease(B) produced by strain CX-47
不同字母代表组间差异显著(P<0.05)。
淀粉酶根据水解产物异头碳的不同,可分为α-淀粉酶、β-淀粉酶等,其中多数α-淀粉酶结构中含有钙离子结合域,属钙离子依赖型淀粉酶[32]。ABD-ELAZIZ A M等[9]研究发现,Ca2+、Mg2+和Ba2+等可显著促进萎缩芽孢杆菌NRC1菌株α-淀粉酶活性,而K+、Ni2+、Zn2+、Na+和Cu2+等则可抑制其催化活性;张巧格[33]研究发现,Na+和Ca2+等可显著促进解淀粉芽孢杆菌BH072菌株α-淀粉酶催化活性,而K+和Mn2+等则抑制其水解活性。本试验中Ca2+仅可轻微程度促进淀粉酶催化活性,分析其原因,可能是因为本试验中所使用的金属氯化物浓度高(40 mmo/L)导致氯离子浓度过高而引起的。HAN N等[34]研究发现,氯离子可通过改变解淀粉芽孢杆菌α-淀粉酶结构而影响其活性,当氯离子浓度低于20 mmo/L时,可促进其催化活性,而当氯离子浓度高于20 mmo/L时,则会抑制其催化活性。本试验中高浓度的氯离子可能较大程度地抵消了Ca2+对CX-47菌株α-淀粉酶的催化促进作用,从而使得Ca2+对总淀粉酶活性增幅较小。
由图6B可知,经40 mmo/L金属离子处理后菌株CX-47蛋白酶催化活性较对照组均有较大提高,K+、Ca2+、Li+和Mn2+分别提高了约1.3倍、1.5倍、1.5倍和2.7倍,均可显著提高菌株CX-47蛋白酶催化活性(P<0.05)。
PATHAK A P等[35]研究发现,Mn2+、K+、Ca2+、Mg2+等可促进阿氏芽孢杆菌P1菌株蛋白酶的催化活性;PRIHANTO A A等[36]研究发现,枯草芽孢杆菌UBT7菌株产中性蛋白酶可被K+、Fe2+等提高其催化活性;AO X L等[37]研究发现,Mn2+、Ca2+、Li+、Na+、Sn2+、Cu2+、Pb2+、Fe2+和Al3+等多种金属离子均可促进米曲霉Y1菌株产中性蛋白酶催化活性,Mg2+、Ba2+和Zn2+等则可抑制其活性。本研究结果与他们的研究报道内容基本相同,但菌株CX-47蛋白酶在Mn2+存在条件下的相对酶活远高于阿氏芽孢杆菌P1菌株、枯草芽孢杆菌UBT7菌株和米曲霉Y1菌株等的相对酶活。
3 结论
本研究筛选到一株产淀粉酶和蛋白酶的土壤源菌株CX-47,其被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。酶学性质分析结果表明,菌株CX-47所产淀粉酶和蛋白酶最适水解反应温度均为50 ℃、最适反应pH值均为7.0;K+和Ca2+对菌株CX-47所产淀粉酶具有一定的激活作用;K+、Ca2+、Li+和Mn2+均可显著提高菌株CX-47蛋白酶催化活性(P<0.05)。综上所述,菌株CX-47发酵产物具有较高的淀粉酶和蛋白酶活性,后续有望通过传统育种或基因工程育种等手段进一步优化其所产两种酶的性能,为我国酶制剂的发展应用提供一定的依据。
[1]AHMED S A,ABDELLA M A A,EL-SHERBINY G M,et al.Application of one-factor-at-a-time and statistical designs to enhance α-amylase production by a newly isolate Bacillus subtilis strain-MK1[J].Biocatal Agr Biotech,2019,22(6):101397.
[2]GURUMALLESH P,ALAGU K,RAMAKRISHNAN B,et al.A systematic reconsideration on proteases[J].Int J Biol Macromol, 2019, 128:254-267.
[3]林楚迎.关于工业酶制剂的发展与应用研究[J].工业微生物,2023,53(1):64-66.
[4]徐挺亮,唐诗哲,彭晶,等.芽孢杆菌属产α-淀粉酶的研究进展[J].生命科学研究,2019,23(1):65-72.
[5] SHAKIL A, ZUNARA Z, AZEEM H, et al.Isolation and screening of protease producing bacterial species[J].Mycopath,2013,11(1):51-54.
[6] ABO-KAMER A M, ABD-EL-SALAM I S, MOSTAFA F A, et al.A promising microbial α amylase production,and purifcation from Bacillus cereus and its assessment as antibioflm agent against Pseudomonas aeruginosa pathogen[J].Microb Cell Fact,2023,22(1):141.
[7]DUAN X G,ZHU Q Y,ZHANG X Y,et al.Expression,biochemical and structural characterization of high-specific-activity β-amylase from Bacillus aryabhattai GEL-09 for application in starch hydrolysis[J].Microb Cell Fact,2021,20(1):182.
[8]LIU Z X,LI J H,JIE C,et al.A multifunctional α-amylase BSGH13 from Bacillus subtilis BS-5 possessing endoglucanase and xylanase activities[J].Int J Biol Macromol,2021,171:166-176.
[9]ABD-ELAZIZ A M,KARAM E A,GHANEM M M,et al.Production of a novel α-amylase by Bacillus atrophaeus NRC1 isolated from honey:purification and characterization[J].Int J Biol Macromol, 2020, 148: 292-301.
[10]SILVA-SALINAS A,RODRÍGUEZ-DELGADO M,GÓMEZ-TREVIÑO J,et al.Novel thermotolerant amylase from Bacillus licheniformis strain LB04: purification, characterization and agar-agarose[J].Microorganisms,2021,9(9):1857.
[11]PRAJAPATI V S,RAY S,NARAYAN J,et al.Draft genome sequence of a thermostable,alkaliphilic α-amylase and protease producing Bacillus amyloliquefaciens strain KCP2[J].3 Biotech,2017,7:1-3.
[12]MEIER M J,DODGE A,BEAUDETTE L A.Draft genome sequence of the industrially significant bacterium Bacillus amyloliquefaciens NRRL 942[J].Microbiol Resour Announc,2018,7(18):10.1128/mra.01374-18.
[13]SILANO V,BAVIERA J M B,BOLOGNESI C,et al.Safety evaluation of the food enzyme β-amylase from Bacillus flexus strain AE-BAF[J].EFSA J,2021,19(6):e06635.
[14] KESHAPAGA U R, JATHOTH K, SINGH S S, et al.Characterization of high-yield Bacillus subtilis cysteine protease for diverse industrial applications[J].Braz J Microbiol,2023,54:739-752.
[15]JAYAKUMAR D,SACHITH S K,NATHAN V K,et al.Statistical optimization of thermostable alkaline protease from Bacillus cereus KM 05 using response surface methodology[J].Biotechnol Lett, 2021, 43:2053-2065.
[16]YU P,WANG X X,HUANG X X,et al.Purification and characterization of a propanol-tolerant neutral protease from Bacillus sp.ZG20[J].Prep Biochem Biotechnol,2019,49(7):718-726.
[17]艾雨晴,陈松骏,秦娟,等.微生物产蛋白酶的研究进展[J].食品工业科技,2021,42(19):451-458.
[18]BAVARO T,CATTANEO G,SERRA I,et al.Immobilization of neutral protease from Bacillus subtilis for regioselective hydrolysis of acetylated nucleosides: application to capecitabine synthesis[J].Molecules, 2016,21(12):1621.
[19]马永强,尹永智,杨春华,等.地衣芽孢杆菌2709产碱性蛋白酶的发酵动力学研究[J].食品工业科技,2010,31(6):159-161,164.
[20]申培立.地衣芽胞杆菌工业酶制剂表达系统优化[D].天津:天津科技大学,2022
[21]曾东方,杨帆,聂欢欢.DNS法对食用菌发酵液淀粉酶活力的测定[J].现代农业科技,2011(11):16-18.
[22]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23527—2009 蛋白酶制剂[S].北京:中国标准出版社,2009.
[23]东秀珠,蔡秒英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-380.
[24]布坎南R E,吉本斯N E.伯杰细菌鉴定手册.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译[M].北京:科学出版社,1984:729-740.
[25]罗春雷,韦宇拓.淀粉酶的分类及应用研究进展[J].广西科学,2018,25(3):248-252.
[26]韩爽,张健,井月欣,等.微生物源蛋白酶研究进展[J].食品工业科技,2020,41(13):321-327.
[27] JOSHI S, SATYANARAYANA T.Biotechnology of cold-active proteases[J].Biology,2013,2(2):755-783.
[28]刘清兵.一株产蛋白酶解淀粉芽孢杆菌的筛选鉴定及其对污水净化作用研究[D].青岛:青岛科技大学,2016.
[29] ZHANG A D,MA Y D, DENG Y, et al.Enhancing protease and amylase activities in Bacillus licheniformis XS-4 for traditional soy sauce fermentation using ARTP mutagenesis[J].Foods,2023,12(12):2381.
[30] BHANGE K, CHATURVEDI V, BHATT R.Simultaneous production of detergent stable keratinolytic protease, amylase and biosurfactant by Bacillus subtilis PF1 using agro industrial waste[J].Biotechnol Rep,2016,10:94-104.
[31]RAI A K,SANJUKTA S,CHOURASIA R,et al.Production of bioactive hydrolysate using protease,β-glucosidase and α-amylase of Bacillus spp.isolated from kinema[J].Bioresource Technol,2017,235:358-365.
[32]JANECˇEK Š,SVENSSON B,MACGREGOR E A.α-Amylase: an enzyme specificity found in various families of glycoside hydrolases[J].Cell Mol Life Sci,2014,71(7):1149-1170.
[33]张巧格.解淀粉芽孢杆菌BH072 α-淀粉酶理化性质及基因克隆的研究[D].天津:天津大学,2017.
[34]HAN N,ZHANG Z K,LI Y H,et al.Spectroscopic analysis of chloride ion-induced structural change of Bacillus amyloliquefaciens α-amylase[J].Chinese J Anal Chem,2019,47(10):e19130-19138.
[35] PATHAK A P, RATHOD M G, MAHABOLE M P, et al.Enhanced catalytic activity of Bacillus aryabhattai P1 protease by modulation with nanoactivator[J].Heliyon,2020,6:e04053.
[36]PRIHANTO A A,JAZIRI A A,PERWIRA I Y.Purification and characterization of neutral protease from Bacillus substilis UBT7 isolated from terasi,Indonesian fermented fish[J].Biosci Biotech Res Asia,2016,13(2):1409-1413.
[37]AO X L,YU X,WU D T,et al.Purification and characterization of neutral protease from Aspergillus oryzae Y1 isolated from naturally fermented broad beans[J].AMB Express,2018,8:96.