宜宾酿酒专用糯红高粱为国家地理标志的保护农产品[1-2]。糯红高粱的熟期短,淀粉结构相对疏松,富含有较大部分未完全转化的中间物质,且蛋白、脂肪和单宁含量适中,适于酵母等发酵微生物生长,作为酿酒原料其在酿酒过程中表现出易糊化、易发酵的优势[3-4],是酿造优质白酒的主要原料之一[2]。关于糯红高粱内生酵母菌株应用于发酵行业的报道鲜见,糯红高粱中的内生酵母菌种类丰富,但在各行业中的开发率以及利用率则较低,因此研究糯红高粱内生酵母菌的种类、内生酵母菌株的发酵性能,为后续将其应用于发酵行业具有重要意义。
植物内生菌是指能够在健康的植物组织中定殖与植物和谐共生却又不产生明显症状的微生物共生体[5-6]。植物内生酵母为植物内生菌中的一个大类,其生命周期的一部分时间内定殖于健康植物组织中,且不会对寄主植物造成损害,它与寄主在长期进化过程中形成了相互依存、互惠互利的共生关系[7-8]。植物内生酵母可在生长过程中产生的一些植物激素与其他因子促进寄主植物的生长,并维持寄主植物的健康,其擅长利用植物的己糖和戊糖,并且植物内生酵母对植物化学物质的耐受性更强[9]。一些研究者将分离出的植物内生酵母应用于食品发酵行业,如从无花果[10]、葡萄[11]、枸杞[12]和桑葚[13]等果实中分离出可以用于酿酒的内生酵母菌株。普通的酿酒酵母菌仅能发酵六碳糖,而不能发酵由五碳糖组成的木质纤维素,而BURA R等[14]从杨树中分离的红酵母皆能发酵五碳糖木糖和六碳糖葡萄糖,因此其在该方面植物内生酵母优于工业酵母菌株。以往有关植物内生菌中的内生酵母的研究较少,大都多集中在对多年生木本植物的研究上,且分离出的植物内生酵母极少[15];对糯红高粱的研究也多集中在分类、种质资源收集评价、品种选育和栽培管理技术方面,而对其内生酵母的研究则鲜见,尤其是品种、器官组织对其菌群结构和多样性的影响。
本研究以宜宾地区酿酒专用的糯红高粱为试验材料,分析花期糯红高粱不同品种的不同组织中内生酵母多样性,并通过选择培养基筛选功能酵母,以揭示花期糯红高粱内生酵母多样性及群落结构变化规律,为更深入探究功能内生酵母在宿主生长发育上起何种作用提供基础支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 原料糯红高粱(杂交种金糯粱1号、地方品种青壳洋):宜宾市翠屏区农牧局农技推广中心。
1.1.2 试剂
Goldview I型核酸染色剂、2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、脱氧核糖核酸(deoxyribo nucleic acid,DNA)Maker、GoldView、Lysis Buffer Direct PCR裂解液:大连宝生物有限公司;引物NL1、NL2:由上海生工生物有限公司合成。
1.1.3 培养基
分离培养基为马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、酵母膏胨葡萄糖琼脂(yeast extract peptone dextrose agar,YEPD)培养基、酵母麦芽琼脂(yeast malt agar,YM)培养基;鉴定培养基为WL营养琼脂;选择培养基为淀粉琼脂培养基、脱脂乳培养基、三丁酸甘油酯琼脂培养基、果胶琼脂培养基、吐温-80琼脂培养基:成都新界实验器材有限公司。
1.2 仪器与设备
JJ060387超净工作台:吴江市净化设备总厂;LDZX-75KBS高温蒸汽灭菌锅:上海申安医疗器械厂;DHG-9620A电热恒温鼓风干燥箱、LRH-70恒温培养箱:上海一恒科技有限公司;UPT-Ⅰ-50优普超纯取水机:成都市超纯科技有限公司;HH-6恒温水浴锅、DYCR-8C恒温振荡器:上海高致精密仪器有限公司;Ks48+PCR仪:冠森生物科技(上海)有限公司;JS-2000凝胶电泳仪:上海培清科技有限公司;AR2130电子分析天平:德国赛多利斯集团。
1.3 方法
1.3.1 糯红高粱内生酵母的分离与保藏
表面消毒处理参考刘晓静等[16]的方法并进行一定的优化,糯红高粱各组织表面消毒的具体操作方法如下:根部按流水冲洗60 min,无菌水洗涤2次,体积分数75%无菌乙醇处理1 min,无菌水洗涤1次,5%NaClO处理3 min,体积分数75%无菌乙醇处理1 min;茎部按流水冲洗60 min,无菌水洗涤2次,体积分数75%无菌乙醇处理0.5 min,无菌水洗涤1次,4%NaClO处理4 min,体积分数75%无菌乙醇处理20 s;叶和花部按流水冲洗60 min,无菌水洗涤2次,体积分数75%无菌乙醇处理20 s,无菌水洗涤1次,3%NaClO处理3 min,体积分数75%无菌乙醇处理20 s,最后用无菌水冲洗3次完成表面无菌化处理。参照胡连清等[17]的方法用灭菌剪刀根据器官组织形状特点切割成小块,分别接种至PDA、YEPD和YM种分离培养基上,并将最后一次无菌水洗涤液涂布于相同培养基上作为空白对照,以检验消毒效果,然后将接种后的平板置于25 ℃恒温培养箱中培养3~5 d,当组织块伤口出现菌落时,及时用接种环挑取菌落,连续划线获得纯化菌株,最后进行YPD培养基的斜面和甘油管保藏。
1.3.2 糯红高粱内生酵母分类鉴定方法
将分离获得的菌株划线接种于WL培养基[18-19],25 ℃培养3 d,观察单菌落的形态特征。同时,在显微镜下观察酵母的细胞形态以此对分离到的酵母菌株进行初步的形态分类。从上述平板培养基上挑取单菌落酵母菌体,加入Lysis Buffer Direct PCR裂解液,水浴15 min后离心,取上清液直接用通用引物NL1和NL2对26S rDNA D1/D2区进行PCR扩增。PCR扩增体系:5 μL DNA模板、1 μL NL1(10 mmol/L)、1μLNL2(10 mmol/L)、25 μL 2×Taq PCR Master Mix、18 μL ddH2O;PCR扩增程序:94℃预变性4min,94℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,32个循环,72 ℃再延伸10 min[20]。PCR扩增目标产物1%琼脂糖凝胶电泳检测合格后送上海生工测序。用美国国立生物技术信息中心(national center for biotechnology information,NCBI)网站基于局部比对搜索工具(basic local alignment search tool,BLAST)程序进行序列比对。
1.3.3 酵母菌多样性指数和相似性指数计算
量化的多样性指数可反映植物生长过程中内生菌群落结构的演替变化规律[21]。根据鉴定的糯红高粱内生酵母菌和各测度指数的特点,应用生态学评价方法[22],计算不同组织中内生酵母的丰富度数、香农指数、均匀度指数和优势度指数。
1.3.4 糯红高粱内生酵母功能菌鉴定
将1.3.1中纯化得到的菌分别接种至淀粉琼脂培养基、脱脂乳培养基、三丁酸甘油酯琼脂培养基、果胶琼脂培养基以及吐温-80琼脂培养基等选择培养基上,置于28 ℃恒温培养箱中培养3~5 d,观察有无光(晕)圈产生,进而判断菌株的产酶功能。
1.3.5 糯红高粱内生酵母菌生化鉴定
采用杭州滨和微生物试剂有限公司生产的TH-15C生化管对分离得到的内生酵母菌进行生化鉴定。将分离纯化的内生酵母菌接种至YEPD液体培养基中,30 ℃条件下培养72 h,离心收集菌体,然后用0.85%的NaCl溶液稀释制备成0.5麦氏浊度的菌悬液,吸取10 μL菌悬液加至不同的酵母样真菌糖生化鉴定管中,同时做无糖阴性对照,在30 ℃条件下培养48~72 h,在电子放大镜下观察记录加入菌液浑浊程度的变化,判断分离内生酵母对不同糖的利用能力。
2 结果与分析
2.1 花期糯红高粱内生酵母菌的分离
采用传统的平板分离法,从2个糯红高粱花期的根、茎、叶和花组织中共分离到54株内生酵母,其中从根中分离到10株,占分离总数的18.51%;茎中分离到28株,占分离总数的51.85%;叶中分离得到7株,占分离总数的12.96%,花中分离得到9株,占分离总数的16.68%。
2.2 糯红高粱内生酵母形态
将上述分离的酵母菌划线接种至用WL营养琼脂培养基,根据菌落的颜色和形态将其聚类,结果见表1。由表1可知,分离的54株酵母共分为8种形态类型,菌落颜色有浅绿色、淡蓝色、乳白色、淡绿色、墨绿色、浅粉色、奶油色等,菌落质地有光滑、粘稠,菌落有的平伏,有的中间隆起,表面有的光滑反光,有的光滑黯淡,菌落边缘形态各异。
表1 糯红高粱花期内生酵母菌的形态
Table 1 Morphology of endophytic yeasts in waxy sorghum at flowering stage

编号 形态描述(颜色/表面光泽/质地/高度/边缘)I II III IV V VI VII VIII淡绿色中心淡黄色边缘/有光泽/光滑/隆起/全缘淡蓝色/有光泽/光滑/隆起/全缘乳白色/有光泽/粘稠/隆起/全缘浅绿色边缘/有光泽/不透明/隆起/全缘淡绿色/有光泽/不透明/扁平/全缘墨绿色中心淡黄色边缘/有光泽/不透明/扁平/全缘淡蓝色中心淡青色边缘/中间有白色丝状菌体/有光泽/透明/隆起/全缘浅绿色边缘/有光泽/不透明/隆起/全缘
2.3 糯红高粱内生酵母菌组成
从糯红高粱花期的根、茎、叶和花4个组织中分别分离出10、28、7、9株内生酵母菌(表2),对分离得到的该54株酵母通过26S rDNA D1/D2区基因序列测序鉴定为12个属17个种,分别为贝氏酵母(Begerowomyces)、粘质皮状新丝孢酵母(Cutaneotrichosporon)、隐球酵母(Cryptococcus)、镰刀菌属(Fusarium)、汉纳酵母(Hannaella)、微曲酵母(Microbotryozyma)、莫氏黑粉菌(Moesziomyces)、金黄色蝶形担孢酵母(Papiliotrema)、筑波拟酵母(Pseudozyma)、Symmetrospora、丝孢酵母菌(Trichosporon)与异常威克汉姆酵母(Wickerhamomyces),其中优势属为隐球酵母(Cryptococcus),占40.74%;优势种为黄色隐球酵母(Cryptococcus luteolus),占35.17%。该结果表明糯红高粱内生酵母种类丰富多样。
表2 糯红高粱花期内生酵母组成
Table 2 Composition of endophytic yeasts in waxy sorghum at flowering stage
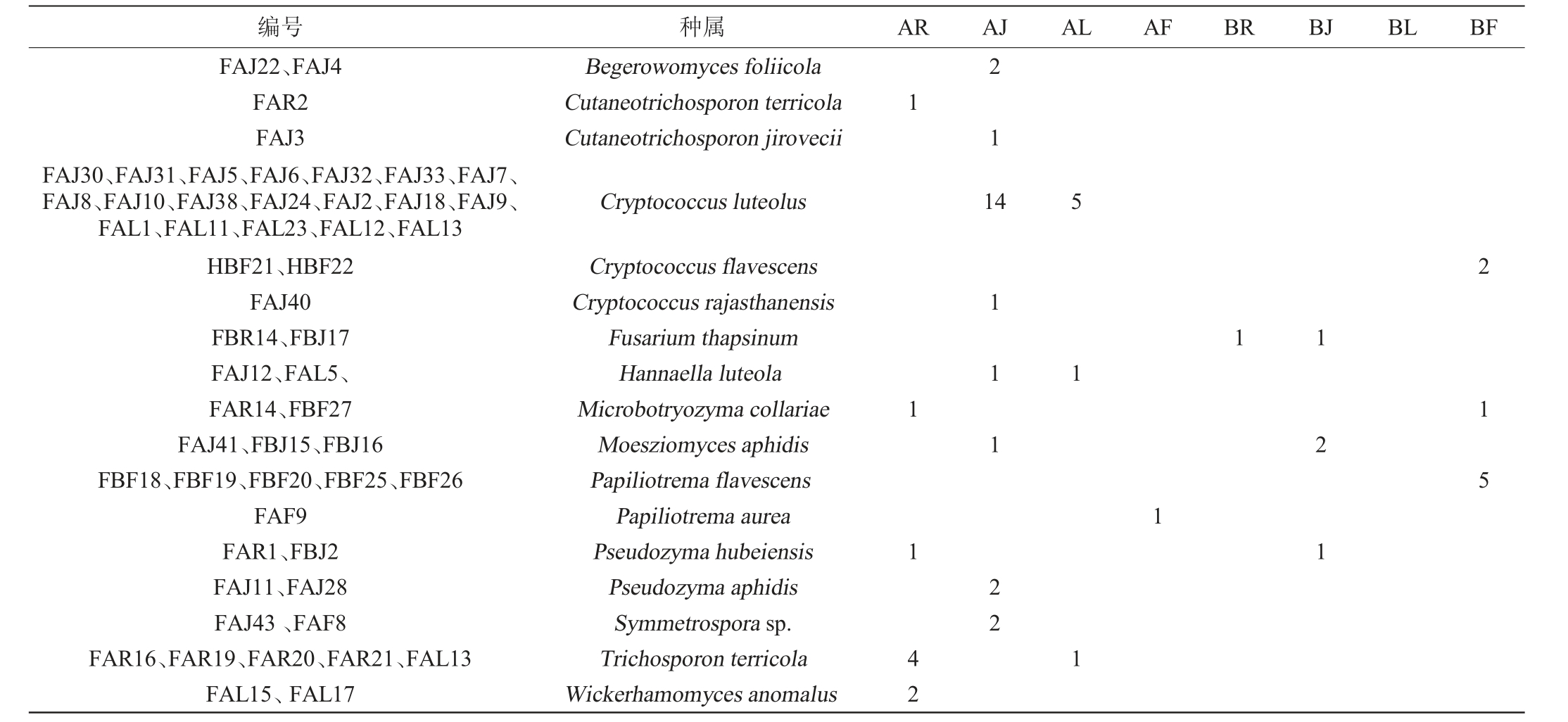
注:编号第一个字母F表示花期;A表示品种金糯粱1号;B:表示青壳洋;R表示糯红高粱根;J表示糯红高粱茎;L表示糯红高粱叶;最后字母F表示糯红高粱花。
编号 种属 AR AJ AL AF BR BJ BL BF FAJ22、FAJ4 FAR2 FAJ3 FAJ30、FAJ31、FAJ5、FAJ6、FAJ32、FAJ33、FAJ7、FAJ8、FAJ10、FAJ38、FAJ24、FAJ2、FAJ18、FAJ9、FAL1、FAL11、FAL23、FAL12、FAL13 HBF21、HBF22 FAJ40 FBR14、FBJ17 FAJ12、FAL5、FAR14、FBF27 FAJ41、FBJ15、FBJ16 FBF18、FBF19、FBF20、FBF25、FBF26 FAF9 FAR1、FBJ2 FAJ11、FAJ28 FAJ43、FAF8 FAR16、FAR19、FAR20、FAR21、FAL13 FAL15、FAL17 Begerowomyces foliicola Cutaneotrichosporon terricola Cutaneotrichosporon jirovecii Cryptococcus luteolus Cryptococcus flavescens Cryptococcus rajasthanensis Fusarium thapsinum Hannaella luteola Microbotryozyma collariae Moesziomyces aphidis Papiliotrema flavescens Papiliotrema aurea Pseudozyma hubeiensis Pseudozyma aphidis Symmetrospora sp.Trichosporon terricola Wickerhamomyces anomalus 1 1 1 42 2 1 1 4 1 1 1 22 5 1 1 1 1 1 2 1 2 1 5
糯红高粱为酿造白酒的优质原料[2],由此可推断,从糯红高粱中分离的内生酵母的生长性能以及发酵性能可能较为为优良。探索特定植物物种中内生酵母的多样性,对了解它们在植物中的功能提供了基础,而获得可培养植物内生酵母是对其进行全基因组测序、定殖特点分析、理化性质测定及其与植物互作机制解析的前提[23]。目前,有关植物内生酵母的研究鲜见且多集中于多年生木本植物上;ZHAO J H等[24]从30棵北京油松松枝中分离得到3株内生酵母;李亚辉等[25]从枸杞中分离得到6 株内生酵母菌;MIDDELHOVEN W J[26]从红杉的嫩枝中分离得到4种酵母菌种,表明其内生酵母丰富多样。
此外,从品种来分析,从金糯粱1号中分离得到41株内生酵母,鉴定为11属14种;从青壳洋中分离得到13株,鉴定为6属6种。该结果表明金糯粱1号的内生酵母多样性优于地方品种青壳洋,这可能是由于金糯粱1号为杂交新品种的缘故,相关内容还需更进一步的分析。金糯粱1号金糯粱1号与青壳洋两品中花期的优势内生酵母不一致且都为特有菌,金糯粱1号优势内生酵母为黄色隐球酵母(Cryptococcus luteolus),而青壳洋的优势内生酵母为Papiliotrema flavescens,说明不同糯红高粱品种的内生酵母菌组成存在一定的差异。该结果进一步表明糯红高粱中内生酵母在各组织以及不同品种间可能具有不同的传播机制。
2.4 糯红高粱内生酵母菌的多样性分析
由表3可知,茎内生酵母的丰富度指数表现为茎>根>花>叶;糯红高粱内生酵母的均匀度指数表现为根>花>叶>茎,糯红高粱内生酵母菌优质度指数表现为花>根>茎>叶。该结果表明糯红高粱根、茎、叶、花各部分的各项多样性指数存在差异。
表3 花期糯红高粱不同组织内生酵母菌多样性指数
Table 3 Diversity indexes of endophytic yeasts in different tissues of waxy sorghum at flowering stage
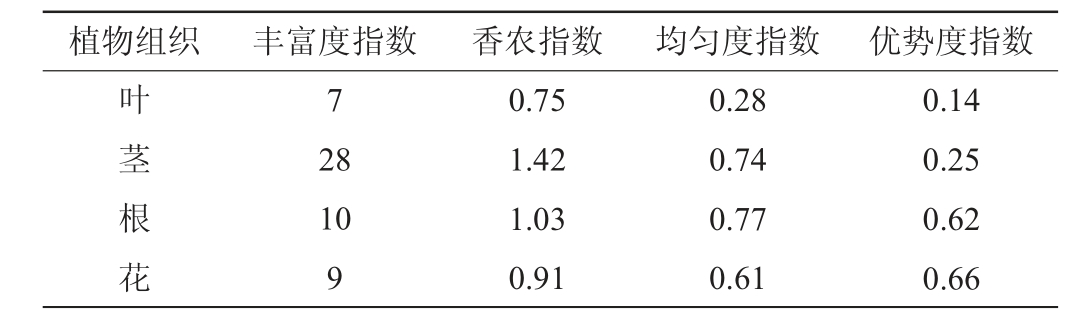
植物组织 丰富度指数 香农指数 均匀度指数 优势度指数叶茎根花7 28 10 9 0.75 1.42 1.03 0.91 0.28 0.74 0.77 0.61 0.14 0.25 0.62 0.66
2.5 糯红高粱内生酵母功能菌筛选
利用淀粉琼脂培养基、脱脂乳培养基、三丁酸甘油酯琼脂培养基、果胶琼脂培养基、吐温-80琼脂培养基等选择培养基对分离得到的54株内生酵母进行功能鉴定,结果见表4。由表4可知,筛选出的54株酵母中,其中29株内生酵母为功能酵母菌,FAJ28菌株的功能最为丰富,同时具有产淀粉酶、蛋白酶、脂肪酶、产酯酶与纤维素酶5种功能;产酯酶的菌株最多,包括FAJ30、FBR14、FBF20、HBF22、FAL13、FAJ9等15株;产纤维素酶的内生酵母菌较少,包括菌株FAL15、FAL17、FAJ18;另外结果还显示,菌株FBJ15产淀粉酶能力最强,菌株FAF8产蛋白酶能力最强,菌株FAJ43产脂肪酶能力最强;菌株HBF22产酯酶能力最强。
表4 花期糯红高粱功能内生酵母筛选
Table 4 Screening of functional endophytic yeasts in waxy sorghum at flowering stage

注:Y表示具有产酶活性。
菌株编号 淀粉酶 蛋白酶 脂肪酶 产酯酶 果胶酶 纤维素酶FAJ30 FBF18 FBR14 FAJ5 FBF19 FBF20 HBF21 HBF22 FAJ43 FAF8 FAL13 FBJ17 FAJ9 FAJ41 FAJ12 FAJ11 FBJ15 FBJ16 FAR2 FAR19 FAL15 FAR20 FAL17 FAR16 FAJ18 FAJ28 FAJ3 FAJ4 FAL5 YYYYY Y Y Y Y Y YY Y(强)Y(强)Y(强)Y YYY Y Y(强)YY Y Y Y Y Y Y YY YYYYYY Y Y YYY YY Y YY Y YY Y Y Y Y Y
植物内生酵母能产生植物激素以及分泌一些可作为生物催化剂和抗菌剂的生物化学品,这些分泌物植物生长方面也具有一定的促进作用,如VAZ A B M等[27]从西兰花中分离得到3株具有抗菌活性的内生酵母;NASSAR A H等[28]从玉米中分离得到8株产生长素IAA和IPYA的内生酵母菌,并从杨树中分离得到的内生酵母菌株WP1显著促进了甜椒的生长,促使甜椒根与芽质量的增加,并促使甜椒提前开花与结实,同时显著提高了果实的产量。本研究分离出的2株异常威克汉姆酵母(Wickerhamomyces anomalus)FAL15与FAL17,经鉴定为功能菌,有研究显示,异常威克汉姆酵母菌类在发酵行业应用广泛,如制备低温大曲[29]、酿造酒曲与酱油[30-31]、发酵面团[32]、制成冻干菌剂[33]等,除此之外,该菌类耐低温[34]、产酯[35]、产香[36]、产尿素[37]且产风味物质能力强[38]。糯红高粱又为酿造白酒的优质原料,因此推测从糯红高粱分离得到的异常威克汉姆酵母菌可能适用于酒曲发酵和酱曲发酵等食品发酵行业,后续将会对FAL15与FAL17两菌株的功能分析作更深入的研究。
2.6 糯红高粱不同部位内生酵母菌生化鉴定结果
糯红高粱不同部位内生酵母菌生化鉴定结果见表5。由表5可知,能够利用甘露醇的有11株,其中FAJ31、FBJ17、FAJ30、FAJ43、FBR14、FAL13利用效果较好;能够利用甘露醇的有16株,其中HBF22、FBJ17、FAJ41、FAJ30、FBR14、FBF20利用效果较好;能够利用水杨素的有6株,分别为FAJ11、FAR1、FBF19、FAJ31、FBJ17、FBR14;能够利用鼠李糖的有12株,其中HBF22、FAJ31、FBJ17、FBR14、FBF20、FAL13利用效果较好;能够利用葡萄糖的有12株,其中FBJ17、FBR14利用效果较好;能够利用蔗糖的有12株,其中FBJ17、FBR14利用效果较好;能够利用木糖醇的有15株,其中HBF22、FAJ31、FAJ41、FAJ43、FBJ17、FBR14利用效果较好;能够利用松三糖的有12株,其中FAJ31、FBJ17、FBF20利用效果较好;能够利用蕈糖的有10株,其中FAJ31、FBJ17、FBR14利用效果较好;能够利用麦芽糖的有13株,其中HBF22、FBJ17、FBR14利用效果较好;能够利用阿糖的有13株,其中FBJ17、FBR14利用效果较好;能够利用卫矛糖的有12株,其中HBF22、FAJ31、FBJ17、FAJ43利用效果较好;能够利用棉子糖的有13株,其中FAJ31、FBJ17、FAJ30、FBJ16利用效果较好;能够利用肌醇的有13株,其中FAJ31、FBJ17利用效果较好;能够利用N-乙酰葡胺的有13株,其中FAJ31、FAJ43、FBJ17、FBR14利用效果较好;能够利用乳糖的有8株,其中FAJ31、FBJ17、FBR14利用效果较好;能够利用纤维二糖的有13株,其中FBJ17、FBR14利用效果较好;能够利用半乳糖的有13株,其中FAJ31、FBJ17、FBR14利用效果较好;能够利用山梨醇的有12株,其中FAJ31、FBJ17、FAJ43利用效果较好;能够利用木梨糖的有16株,其中FAJ31、FAJ41、FAJ30、FBJ17、FBR14、FBF20利用效果较好。由此可见,糯红高粱中的内生酵母在其生长发育过程中发挥着重要作用,相关内容值得进一步的研究。
表5 花期糯红高粱内生酵母菌碳源同化实验结果
Table 5 Experimental results of carbon source assimilation of endophytic yeasts in waxy sorghum at flowering stage

注:“+”阳性,代表能利用此糖;“-”阴性,代表不能利用此糖;“++”强反应,代表能利用此糖,且效果显著。
碳源 FAJ11 FAJ41 HBF22 FAR1 FAF8 FBF19 FAJ6 FAJ31 FAJ31 FAJ41 FAG2 FAJ30 FAJ43 FBJ16 FBR14 FBF20 FAL13 FAJ12山梨糖甘露醇水杨素鼠李糖葡萄糖蔗糖木糖醇松三糖蕈糖麦芽糖阿糖卫矛糖棉子糖肌醇N-乙酰葡胺乳糖纤维二糖半乳糖山梨醇木梨糖-++ ++ +++-++- ++ +++++++- - - - - - - - - - - - - - - + - - ++++-++-++++-+++++++++++++-+++- ++- ++++++++++-- - - +-+ + - + + + - + + + - + - + - + + + +-+ - - - - + - + + - - + - + - + + - --+ + + + + - + + + + + + + - + + + + +-+ - + - + + + - - + + + + - - + + + +-- - - - +++++-+ + ++++++++++++++++++++++++++++++++++- +++- - - + ++++++++++++++++++++++++++++++++++++++++++++++++++++++++- - - - - - - - + - - - ++++ - + + - - - + + - + + + + + + + - +-++++++++++++ + - + - + +++- + +++--+ ++ +++++++- - - +++++++-++ ++ -+++++++++++++- - + - + - - - - - - +++++ ++ -+ ++-++ -+ +- +++ - + + + + + - + + + - + + - - + + +
3 结论
糯红高粱花期内生酵母种类组成丰富且功能多样,从糯红高粱根、茎、叶和花组织中分离得到54株可培养的内生酵母菌菌株,鉴定为12个属17个种,分别为贝氏酵母(Begerowomyces)、粘质皮状新丝孢酵母(Cutaneotrichosporon)、隐球酵母(Cryptococcus)、镰刀菌属(Fusarium)、汉纳酵母(Hannaella)、微曲酵母(Microbotryozyma)、莫氏黑粉菌(Moesziomyces)、金黄色蝶形担孢酵母(Papiliotrema)、筑波拟酵母(Pseudozyma)、Symmetrospora、丝孢酵母菌(Trichosporon)与异常威克汉姆酵母(Wickerhamomyces),其中优势属为隐球酵母(Cryptococcus),优势种为黄色隐球酵母(Cryptococcus luteolus)。糯红高粱根、茎、叶、花各组织中的内生酵母各项多样性指数均有明显差异,其丰富度指数表现为茎>根>花>叶;均匀度指数表现为根>花>叶>茎;优势度指数表现为花>根>茎>叶。通过选择培养基筛选出29株功能酵母菌,其中菌株FAJ28的功能最为丰富,产酯酶的菌株最多,产纤维素酶的内生酵母菌最少;另研究结果还显示,菌株FBJ15产淀粉酶能力最强,菌株FAF8产蛋白酶能力最强,菌株FAJ43产脂肪酶能力最强;菌株HBF22产酯酶能力最强。糯红高粱花期内生酵母菌生化功能丰富,对山梨糖、甘露醇等有一定的利用作用。
[1]殷勇,张林,毛思根,等.宜宾糯红高粱绿色生产技术规程[J].大麦与谷类科学,2021,38(4):43-46.
[2]四川省宜宾质量技术监督局.DB 511500/T 50—2014地理标志产品宜宾糯红高粱生产技术和质量规范[S].宜宾:宜宾人民出版社,2014.
[3]何诚,丁海龙,杨平,等.南北酿酒高粱蒸煮品质研究[J].酿酒科技,2012(8):68-70.
[4]闫松显,吕云怀,王莉,等.西南区酿酒高粱的种质形成和发展[J].中国酿造,2017,36(5):17-21.
[5]顾美英,古丽尼沙·沙依木,张志东,等.黑果枸杞不同组织内生细菌群落多样性[J].微生物学报,2021,61(1):152-166.
[6] YAN K, HE L M, ZHOU W H, et al.Determination of the community structure and diversity of endophytic bacteria from Alpinia zerumbet seeds[J].Int J Agr Biol,2020,24(3):420-428.
[7]徐易洁,张红玉,解修超,等.甘蔗内生酵母菌的分离鉴定及发酵性能[J].食品研究与开发,2023,44(1):159-166.
[8] ISAEVA O V, GLUSHAKOVA A M, GARBUZ S A, et al.Endophytic yeast fungi in plant storage tissues[J].Izvestiia Akademii Nauk Seriia Biologicheskaia,2010(1):34-43.
[9]慕丽琴,冯汉青.植物内生酵母研究简况[J].生物学通报,2021,56(2):1-4.
[10]董亚晨,戴忆宁,蔡瑾,等.无花果内源酵母的筛选、鉴定及发酵性能测试[J].中国食品学报,2014,14(8):240-247.
[11]冯炘,何凯翔,解玉红.葡萄中酵母菌的筛选及菌株鉴定[J].价值工程,2020,39(13):270-273.
[12]李亚辉,粱颖,王英,等.枸杞内生酵母菌的筛选及其发酵特性研究[J].中国酿造,2019,38(4):121-125.
[13]曹培杰,马剑,崔晋,等.桑葚果酒酵母菌的筛选及其发酵性能研究[J].食品研究与开发,2018,39(5):151-155.
[14] BURA R, VAJZOVIC A, DOTY S L.Novel endophytic yeast Rhoclotorula mucilaginasa strain PTD3 I:Production of xylitol and ethanol[J].J Ind Microbiol Biot,2012,39(7):1003-1011.
[15]胡连清,刘雯雯,刘婉茹,等.糯红高粱中产蛋白酶内生酵母筛选鉴定及发酵特性研究[J].食品与发酵工业,2023,49(5):74-80.
[16]刘晓静,朱静,楚敏,等.库车小白杏采后内生细菌群落代谢特征及结构组成的变化[J].食品科学,2018,39(22):141-146.
[17]胡连清,周万海,冯瑞章,等.油樟内生真菌有效分离和培养关键技术[J].宜宾学院学报,2022,22(6):100-105.
[18]杨莹,徐艳文,薛军侠,等.WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J].微生物学杂志,2007,29(5):75-78.
[19]巴尼特.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:140-174.
[20]胡连清,刘雯雯,刘婉茹,等.糯红高粱中产蛋白酶内生酵母筛选鉴定及发酵特性研究[J].食品与发酵工业,2023,49(5):74-80.
[21] STIRLING G, WILSEYY B.Empirical relationships between species richness,evenness and proportional diversity[J].Am Naturalist,2001,158(3):286-299.
[22]JOHNSON J A,WHITNEY N J.Isolation of fungal endophytes of black spruce(Picea mariana)dormant buds and needles from New-Brunswick Canada[J].Can J Bot,1992,70:1754-1757.
[23]陈丽莹,方荣祥,吴建祥,等.植物内生细菌测定方法的研究进展[J].微生物学通报,2022,49(3):1105-1119.
[24] ZHAO J H, BAI F Y, GUO L D, et al. Rhodotorula pinicola sp.nov., a basidiomycetous yeast species isolated from xylem of pine twigs[J].FEMS Yeast Res,2002,2(2):159-163.
[25]李亚辉,粱颖,王英,等.枸杞内生酵母菌的筛选及其发酵特性研究[J].中国酿造,2019,38(4):121-125.
[26] MIDDELHOVEN W J.The yeast flora of the coast redwood, Sequoia sempervirens[J].Folia Microbiol,2003,48(3):361-362.
[27]VAZ A B M,MOTA R C,BOMFIM M R Q,et al.Antimicrobial activity of endophytic fungiassociated with Orchidaceae in Brazil[J].Can J Microbiol,2009,55(12):1381-1391.
[28] NASSAR A H, EL-TARABILY K A, SIVASIT H K.Promotion of plantgrowth by an auxinproducing isolate of the yeast Williopsis saturnus endophytic in maize(Zea mays L.) roots[J].Biol Fert Soils,2005,42(2):97-108.
[29]董琪,汤有宏,李晓欢,等.异常威克汉姆酵母GJYD15及其在制备低温大曲中的应用:CN107488602A[P].2017-12-19.
[30]陈丽花,李东娜.异常威克汉姆酵母与酿酒酵母协同发酵银杏米酒的生产方法:CN111534407A[P].2020-08-14.
[31]宪斌,冯霞,张蓓蓓,等.异常威克汉姆酵母菌1027JM-2 在酱油酿造中的应用:CN110331102A[P].2019-10-15.
[32]邓璀.传统发酵剂中酵母多样性及其在馒头制作中的应用研究[D].郑州:河南工业大学,2016.
[33]王宪斌,冯霞,张蓓蓓,等.一株生香酵母冻干菌剂的制备研究[J].食品与发酵科技,2019,55(6):9-12.
[34]刘薇丛.抗冻酵母的筛选及其代谢物的研究[D].长沙:中南林业科技大学,2018.
[35]范光森,李秀婷,孙宝国,等.一株高产乙酸乙酯异常威克汉姆酵母及其培养方法与应用:CN109266562B[P].2020-03-20.
[36]李晨.一株产香酵母的筛选、鉴定及其产香条件的优化研究[D].武汉:武汉轻工大学,2019.
[37]吴群,徐岩,崔凯翔.一株低产尿素,产风味的异常威克汉姆酵母菌株及其在食品生产中的应用:CN105861346A[P].2016-08-17.
[38]刘同杰.传统酸面团中微生物多样性及其风味物质代谢研究[D].杭州:浙江大学,2018.