中医药宝库中有着大量可以药食两用的中药,不但可以作为食品长期服用,而且具有一定的临床效果。中药发酵是利用微生物的降解和催化作用改变药物的原有性质并增强或创造新的功效[1-2]。比如人参经过发酵后总皂苷的含量增加了40%,其中人参皂苷Rb1或Rb2随着发酵逐渐转化为稀有的人参皂苷Rg3[3]。中药经发酵后通过微生物的分解转化,可降低药物毒性,将毒性成分进行分解或结构上的修饰使其毒性降低或者消失[4]。潘扬等[5]研究发现,发酵后马钱子碱的成分在质量和数量上都发生了明显的变化。苦参在经过灵芝菌丝体发酵进行生物转化后,其毒性明显降低,且发酵液的抗乙型肝炎病毒的效果显著[6]。
六神曲是中国药典中记载最早的传统发酵药物之一,被广泛用作消化剂,治疗因饮食不良引起的低胃酸性消化不良、胃肠炎、呕吐和腹泻[7]。六神曲由赤小豆、苦杏仁、青蒿、苍耳草、辣蓼和面粉按一定比例混匀后自然发酵而成。在微生物群落演替和代谢过程中,微生物分泌各种水解酶[8],通过酶促分解作用,催化发酵基质合成生物活性成分,形成易于肠道吸收的小分子糖苷、脂肪酸、小肽等功能物质[9-10],达到健胃消食的作用[11]。因此解析六神曲的微生物结构并预测微生物群落的代谢功能对揭示六神曲的功效具有重要的意义。
传统的六神曲炮制在原料上可分别使用鲜药材和干药材,制备流程存在一定差别。使用鲜药材制备只进行一步发酵:赤小豆和苦杏仁粉碎成粗粉,与面粉混匀后,将鲜青蒿、鲜辣蓼和鲜苍耳秧的煎液加入其中,搅拌均匀,得到柔软的松散固体,将其揉搓成块状进行自然发酵。使用干药材需要两步发酵,取赤小豆加工成粗粉,加4倍左右的热水(60~80 ℃)搅拌均匀,自然环境中敞开发酵3 d成赤小豆粥;另取苦杏仁、干青蒿、干辣蓼和干苍耳秧分别粉碎成粉,加面粉后与赤小豆粥混匀,制成握之成团、掷之即散的软材,置适宜容器内再进行六神曲发酵。使用新鲜药材需要煎汤,且受季节限制,而使用干药材不受季节约束,更符合现代生产要求,本试验中采用干药材的炮制工艺进行发酵。
六神曲发酵是自然条件下多菌种混合发酵[12],在炮制过程中其原料主要依靠微生物对其进行降解转化,因此探究六神曲中存在的微生物菌群尤为重要。贾丹丹[13]在鲜药材制备的六神曲中,分离纯化到兼具淀粉酶和蛋白酶合成能力的菌种,包括枯草芽孢杆菌、蜡样芽孢杆菌、甲基营养型枯草芽孢杆菌等;且多数菌株的菌数在炮制过程中呈现先上升后下降趋势。邬吉野等[14]从六神曲中分离得到12株霉菌,并利用优势菌株进行纯菌发酵,发现黄曲霉显著提高了神曲淀粉酶和蛋白酶活性,杂色曲霉显著提高了蛋白酶产生的酶活力,提高了六神曲质量。目前干药材制备六神曲采用两步发酵的微生物菌群结构尚有待研究,且中药原料对六神曲发酵的影响尚不明确。
本研究利用基于扩增子的高通量测序技术,对干药材六神曲两步发酵过程的微生物多样性进行分析,明确其微生物的区系构成,并通过PICRUSt菌群代谢预测的工具推测六神曲发酵期间代谢功能的差异,为六神曲功效的作用机理提供理论参考;同时对发酵原料分别缺少青蒿、辣蓼、苍耳草和苦杏仁的六神曲进行微生物多样性研究,探究单一中药原料对六神曲发酵的影响。旨在为六神曲功效揭示提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料赤小豆、干青蒿、干辣蓼、干苍耳秧、苦杏仁:河北省安国市广盛商贸有限公司。
1.1.2 试剂
Fast 脱氧核糖核酸(deoxyribonucleic acid,DNA)Spin Kit for Soil:美国MP Biomedicals公司;琼脂糖:法国Biowest公司;TransStart Fast Pfu DNA聚合酶(250 U):北京全式金生物技术有限公司。
1.2 仪器与设备
FW-100粉碎机:北京中兴伟业仪器有限公司;PHS-3D pH计:上海精科实验设备有限公司;ABI GeneAmpR 9700聚合酶链式反应(polymerase chain reaction,PCR)仪:绍兴微泰生物科技有限公司;Nanodrop-2000分光光度计:美国Thermo Fisher Scientific公司;安捷伦2100生物分析仪:美国Agilent公司;Illumina MiSeq测序仪:美国Illumina公司。
1.3 方法
1.3.1 六神曲两步法发酵工艺流程及操作要点

赤小豆粥发酵:将赤小豆粉碎成粉,加入4倍左右的60~80 ℃热水,搅拌成粥状,在32 ℃水浴中敞开培养3 d,发酵得赤小豆粥。
固态发酵:取苦杏仁、干青蒿、干辣蓼和干苍耳秧分别粉碎成粗粉,按一定比例与面粉混合。加入上述发酵赤小豆粥,混匀并制成握之成团、掷之即散的软材,放入盘中,置于发酵箱32 ℃和85%湿度环境中培养3 d,即得六神曲。
1.3.2 样本采集
赤小豆粥发酵时,在发酵0 h、24 h、48 h、72 h时取样于无菌离心管中,编号分别为c0、c1、c2和c3。固态发酵时,在发酵0 h、48 h和72 h时取样,编号分别为b0、b2和b3。在原料缺失实验时,分别缺少干青蒿、干辣蓼、干苍耳秧和苦杏仁中的一种药材,进行固态发酵,在发酵72 h时取样,编号分别为B、C、D和E。所有样本均冻存于-80 ℃。三批发酵,每批发酵多点取样并混匀,为实验样本。
1.3.3 DNA提取
利用试剂盒FastDNA Spin Kit for Soil提取微生物基因组DNA,通过琼脂糖凝胶电泳检测DNA提取质量,并使用Nanodrop-2000分光光度计测定DNA纯度和浓度。
1.3.4 扩增子测序
使用通用引物338F和806R扩增原核微生物16S rRNA基因V3~V4区,用通用引物ITS1F和ITS2R扩增真菌ITS区。通用原核引物338F和806R的PCR扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),然后72 ℃稳定延伸10 min,最后在10 ℃进行保存。通用真菌引物ITS1F和ITS2R的PCR扩增程序如下:95 ℃预变性3 min,35个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),然后72 ℃稳定延伸10 min,最后在10 ℃进行保存。PCR扩增体系为:缓冲液4 μL,2.5mmol/L脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,超纯水补足至20 μL。纯化PCR产物,并通过安捷伦2100生物分析仪和Quantu Fluorometer评估最终产物的质量和数量。使用NEXTflex Rapid DNA-Seq Kit进行建库。
由上海美吉生物医药科技有限公司利用Illumina MiSeq测序平台进行双端测序(GenBank登录号PRJNA860715)。
1.3.5 高通量测序数据分析
使用Fastp软件[15]对原始测序序列进行质控,再通过FLASH[16]组装过滤后的序列;区分样本后使用UPARSE软件[17]进行序列分析,以97%[17-18]的相似度对序列进行操作分类单元(operational taxonomic unit,OTU)聚类并剔除嵌合体。利用核糖体数据库项目(ribosomal database project,RDP)分类器[19]进行注释(KEGG数据库v94.2版本)。对OTU进行多样性指数分析[20];基于分类学信息,在各个分类水平上进行群落结构的统计分析。
2 结果与分析
2.1 六神曲发酵的pH变化
环境是影响微生物存活的重要因素,分析制备过程pH变化,结果见图1。由图1可知,赤小豆粥发酵阶段第1天pH出现明显下降,从6.64下降至4.68,随后保持在4.1左右。在赤小豆粥发酵第3天,与适当比例的苦杏仁、干青蒿、干辣蓼、干苍耳秧和面粉混合,进行固态发酵,继续发酵3 d,pH从5.45逐渐下降至3.65。由此可知,发酵两阶段pH均下降至酸性,且范围相近。
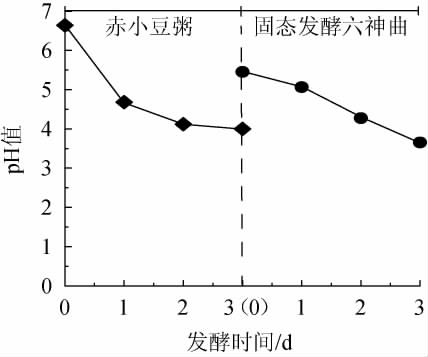
图1 六神曲发酵过程pH值变化
Fig.1 Changes of pH value during LiuShenqu fermentation
2.2 六神曲发酵细菌群落多样性变化
由表1可知,按1.3.2获得六神曲发酵过程的7个样本,进行测序,共得到462 819条序列,样本的覆盖率指数均达到96%以上,样本测序深度满足反映六神曲发酵微生物全部信息的要求。以Sobs指数、Shannon指数和Simpson指数评估的细菌群落的α-多样性变化,赤小豆粥样本的细菌多样性在发酵24 h后出现明显下降,固态发酵样本的细菌多样性在发酵48 h后出现明显的下降。六神曲样本细菌群落α-多样性的变化可能与发酵环境有关,微生物群落的多样性受酸度增加的影响,不耐酸的微生物随发酵环境酸度的提升而死亡[21],发酵过程中,优势菌群的生长也会降低赤小豆粥和固态发酵样本的细菌微生物多样性。
表1 赤小豆粥发酵及六神曲固态发酵过程的细菌Alpha多样性分析
Table 1 Alpha diversity analysis of bacteria during red bean porridge fermentation and solid-state fermentation of LiuShenqu
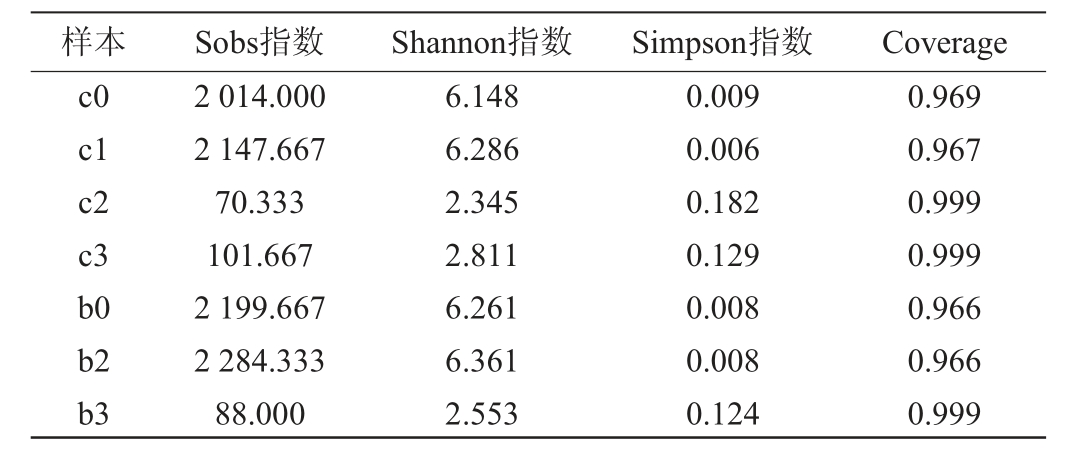
样本 Sobs指数 Shannon指数 Simpson指数 Coverage c0 c1 c2 c3 b0 b2 b3 2 014.000 2 147.667 70.333 101.667 2 199.667 2 284.333 88.000 6.148 6.286 2.345 2.811 6.261 6.361 2.553 0.009 0.006 0.182 0.129 0.008 0.008 0.124 0.969 0.967 0.999 0.999 0.966 0.966 0.999
2.3 六神曲发酵的细菌群落结构组成演替
对赤小豆粥和固态发酵过程的细菌群落结构进行分析,共检测到38个门,其中11个门的相对丰度>1%;共鉴定出836个属,其中38个属的相对丰度>1%。
由图2可知,在赤小豆粥发酵和六神曲固态发酵起始时,细菌的优势菌门基本一致,菌群的门水平相对丰度存在差别,丰度最高的5类细菌均依次为放线菌门(Actinobacteriota)(31.03%~34.81%)、变形菌门(Proteobacteria)(25.31%~25.87%)、酸杆菌门(Acidobacteriota)(10.82%~13.74%)、绿弯菌门(Chloroflexi)(8.54%~11.00%)和厚壁菌门(Firmicutes)(2.52%~5.93%),这5个门的相对丰度占总丰度的84.68%~84.92%。随着发酵的进行,放线菌门、变形菌门、酸杆菌门和绿弯菌门的相对丰度明显降低,厚壁菌门相对丰度均显著增加。在赤小豆粥发酵和固态发酵的第3天,厚壁菌门分别占总丰度的97.57%和99.53%。说明六神曲发酵过程中存在明显的细菌演替过程。
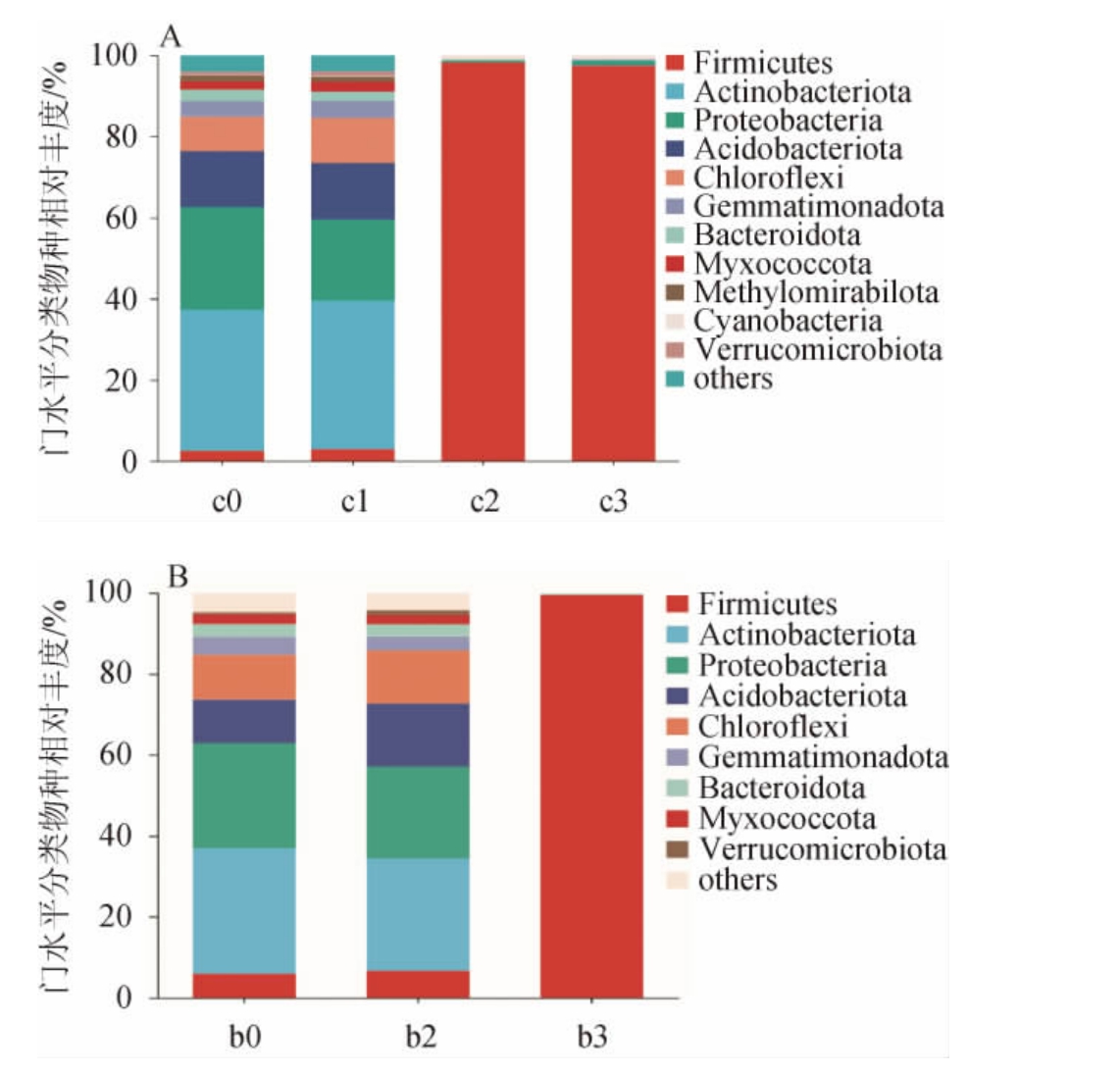
图2 基于门水平赤小豆粥(A)及六神曲固态发酵(B)过程中细菌群落结构
Fig.2 Bacterial community structure during red bean porridge (A)and Liushenqu solid-state fermentation (B) based on phylum level
在属水平上,对六神曲发酵样本的细菌菌群结构进行分析,揭示其组成差异。选取相对丰度>10%的属为优势菌群,筛选得到5个属,分别是魏斯氏菌属(Weissella)、链球菌属(Streptococcus)、乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)以及片球菌属(Pediococcus)。由7个样本的细菌菌群热图(图3)可见,发酵后的赤小豆粥以肠球菌属、链球菌属、乳杆菌属和片球菌属为主要菌属,占总丰度的76.03%。鉴于赤小豆粥发酵时,体系迅速变酸(图1),耐酸的乳酸菌逐渐成为优势菌属。将发酵后的赤小豆粥和药材混合后进行固态发酵,则仅乳杆菌属和片球菌属成为固态发酵的优势菌,总丰度占比达98.67%,尤其是乳杆菌属,占总丰度的85.01%,说明赤小豆粥发酵的优势菌群,在固态发酵时,仅乳杆菌属和片球菌属的生长优势更明显。魏斯氏菌属在赤小豆粥发酵24 h时相对丰度增加,72 h时相对丰度亦维持在较高水平,但在固态发酵过程中则直至72 h相对丰度才略上升,且相对丰度水平不高,因此魏斯氏菌属虽然在赤小豆粥发酵时具有一定的生长优势,但也不是固态发酵的优势菌。同处发酵后期的赤小豆粥样本(48h和72h)和固态发酵样本(72 h)细菌菌群结构较相似,说明赤小豆粥发酵起到富集优势细菌的作用,为后续固态发酵提供优势细菌。XU Y等[9]对六神曲一步发酵的微生物多样性采用变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)进行分析,扩增到的14个条带中包含乳酸杆菌科(Lactobacillaceae)形成的条带,与本研究结论相似。肠球菌属、乳杆菌属、链球菌属和片球菌属均为益生菌菌株属[22-23]。乳酸杆菌是有助于消食的益生菌,常在乳制品工业中用于制造发酵产品[24],其在防止乳制品中由于酸化而导致的腐败菌生长方面起到重要的作用[22],可维持肠道微生态平衡,促进消化,合成氨基酸和维生素,降低胆固醇,抑制内毒素的合成[25]。同时,乳酸杆菌属是兼性厌氧菌,广泛存在于白酒酿造过程,可将谷物中的淀粉通过自身代谢系统转化为乳酸[26-28],这可能会促使六神曲样本在发酵期间的酸度增加。片球菌属具有抗微生物和益生菌的特性,以产生细胞素的形式到达结肠,并可能发挥其潜在的有益作用[22,29]。
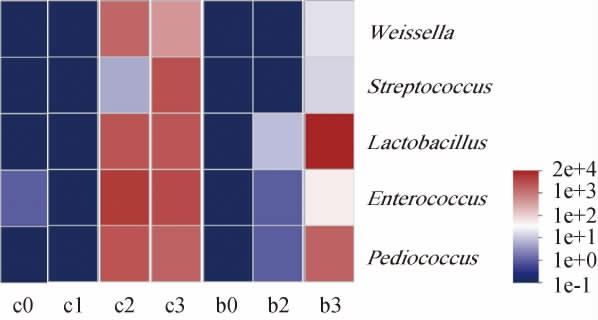
图3 基于属水平六神曲发酵过程中细菌相对丰度的动态变化
Fig.3 Dynamic changes of bacterial relative abundance during LiuShenqu fermentation based on genus level
2.4 六神曲发酵的真菌群落结构组成演替
按1.3.2获得六神曲发酵过程的7个样本,进行真菌核酸测序,共产出1 137 675条序列,样本的覆盖率指数均达到99%以上(表2),测序深度满足反映六神曲发酵微生物全部信息的要求。使用Sobs指数、Shannon指数和Simpson指数评估真菌微生物多样性,赤小豆粥样本的真菌多样性在发酵24 h后出现明显下降,固态发酵样本的真菌多样性在发酵48 h后出现明显的下降。发酵过程中,优势菌群的生长降低了赤小豆粥和六神曲样本的真菌微生物多样性。
表2 赤小豆粥发酵及六神曲固态发酵过程的真菌Alpha多样性分析
Table 2 Alpha diversity analysis of fungi during red bean porridge fermentation and solid-state fermentation of LiuShenqu
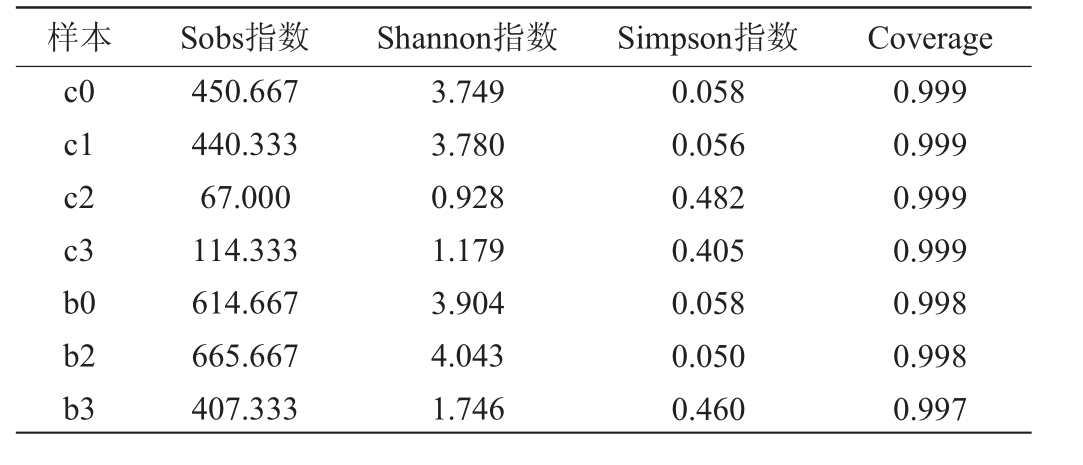
样本 Sobs指数 Shannon指数 Simpson指数 Coverage c0 c1 c2 c3 b0 b2 b3 450.667 440.333 67.000 114.333 614.667 665.667 407.333 3.749 3.780 0.928 1.179 3.904 4.043 1.746 0.058 0.056 0.482 0.405 0.058 0.050 0.460 0.999 0.999 0.999 0.999 0.998 0.998 0.997
对赤小豆粥和固态发酵时的真菌群落结构进行分析,共检测到15个门,其中5个门的相对丰度超过1%;共鉴定出573个属,其中39个属的相对丰度超过1%。
由图4可见,在相同发酵时期,赤小豆粥和固态发酵样本中真菌的优势菌门基本一致,但各菌群的相对丰度差异很大。其中,赤小豆粥和固态发酵在发酵起始时,子囊菌门(Ascomycota)(68.89%~74.55%)、孢霉菌门(Mortierellomycota)(10.55%~18.84%)和担子菌门(Basidiomycota)(9.87%~13.51%)相对丰度较高。赤小豆粥发酵第三天,担子菌门和子囊菌门的相对丰度接近,分别为50.57%和49.04%;而固态发酵末期的六神曲样本中担子菌门占优势,丰度达73.23%,子囊菌门的丰度次之,为26.52%。
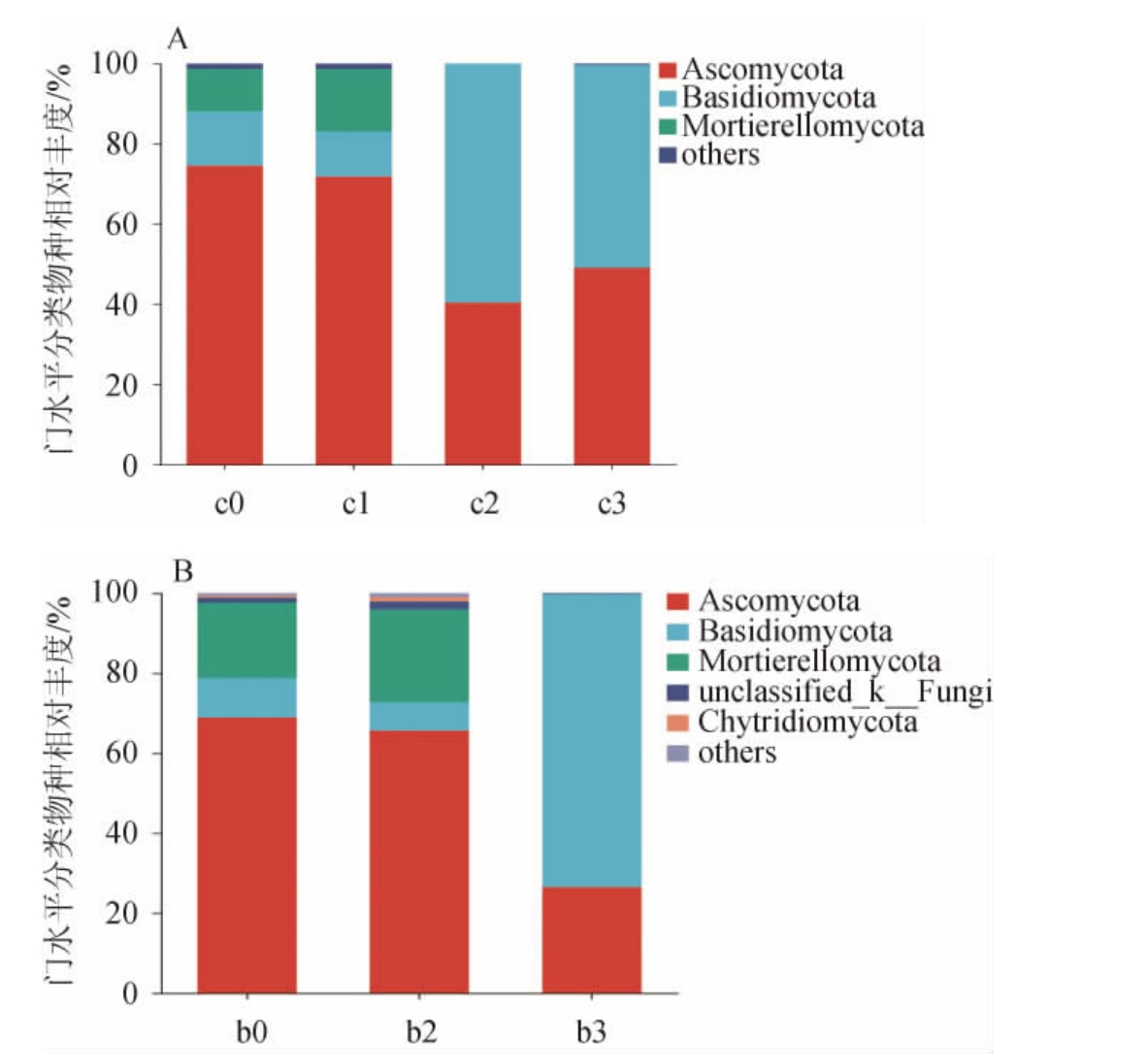
图4 基于门水平赤小豆粥(A)及六神曲固态发酵(B)过程中真菌群落结构
Fig.4 Fungal community structure during red bean porridge (A) and Liushenqusolid-state fermentation (B) based on phylum level
选取相对丰度>10%的属为优势菌群,筛选得到6个真菌属,分别为毛孢子菌属(Trichosporon)、Diutina、被孢霉属(Mortierella)、毛壳菌属(Chaetomium)、赤霉菌属(Gibberella)以及镰刀菌属(Fusarium)。六神曲发酵过程中7个样本的真菌群落结构见图5,发酵初期的赤小豆粥和固态发酵样本均以赤霉菌属、被孢霉属、毛壳菌属和镰刀菌属为主,占总丰度的31.24%~46.67%;发酵末期的赤小豆粥以毛孢子菌属(50.33%)和Diutina(39.40%)为主;六神曲固态发酵第3天结束时样本以毛孢子菌属为主,占总丰度的67.27%。赤小豆粥样本(48 h和72 h)和六神曲样本(72 h)真菌菌群结构相似,说明赤小豆粥富集发酵的真菌可为固态发酵提供优势菌种。
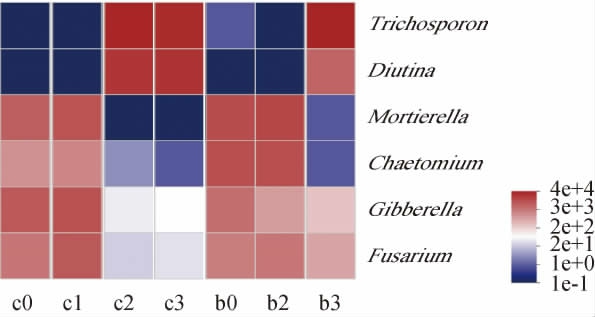
图5 基于属水平六神曲发酵过程中真菌的热图分析
Fig.5 Heat map analysis of fungi during LiuShenqu fermentation based on genus level
2.5 六神曲发酵的菌群功能预测分析
利用PICRUSt2软件将测序获得的基因序列在KEGG数据库中进行菌群代谢功能预测。六神曲发酵各阶段的菌群菌落丰度集中于代谢(图6),其中代谢途径(Metabolic pathways)、次级代谢产物的生物合成(Biosynthesis of secondary metabolites)、不同环境中的微生物代谢(Microbial metabolism in diverse environments)、氨基酸的生物合成(Biosynthesis of amino acids)和碳代谢(Carbon metabolism)的丰度最高。推测六神曲在发酵期间的菌群结构受代谢影响较为显著,产生各种酶类,促进六神曲功效的产生。
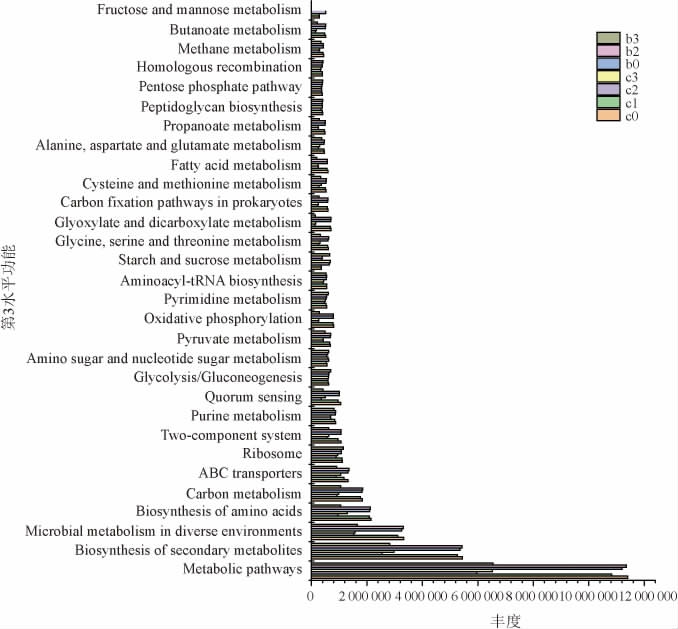
图6 六神曲发酵过程中菌群群落代谢功能第三级分布结果
Fig.6 The third order distribution results of microbial community metabolic function during LiuShenqu fermentation
进一步利用KEGG Enzyme注释,进行更详细的基因功能信息分析。对六神曲发酵过程中总丰度排名前50的酶进行分析,并绘制热图,结果见图7。由图7可知,7个样本在Enzyme水平存在显著差异。细菌群落功能预测结果如图7a所示,发酵期间的依赖于DNA的DNA聚合酶(EC 2.7.7.7)和DNA解旋酶(EC 3.6.4.12)丰度较高,说明菌群的DNA复制活跃。发酵后期,6-磷酸-β-葡萄糖苷酶(EC 3.2.1.86)基因丰度显著增加,有利于降解纤维二糖。此外,糖酵解通路中的磷酸甘油酸变位酶(EC 5.4.2.12)、蛋白质-N(pi)-磷酸组氨酸-糖磷酸转移酶(EC 2.7.1.69)、23S rRNA假尿苷合成酶(EC 5.4.99.23)和蛋白酪氨酸磷酸酶(EC 3.1.3.48)基因丰度明显升高,蛋白质酪氨酸磷酸酶被证实为肿瘤抑制基因的产物,具有抑制肿瘤发生的作用[30]。真菌群落功能预测结果如图7b所示,发酵后六神曲中葡聚糖1,4-α-葡糖苷酶(EC 3.2.1.3)基因丰度明显上升,说明六神曲具有淀粉酶和糖化酶活力,可产生助消化功效,该酶主要依赖于真菌合成。
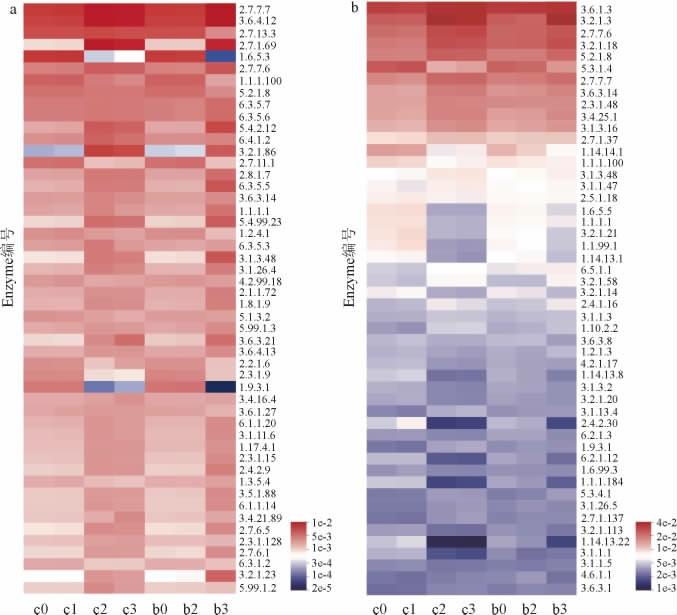
图7 六神曲发酵过程中细菌(a)、真菌(b)PICRUSt基因功能预测热图
Fig.7 Heatmap of bacterial (a) and fungal (b) gene function prediction by PICRUSt during LiuShenqu fermentation
2.6 药材缺失对六神曲发酵菌群结构及功能的影响
对分别缺少青蒿、辣蓼、苍耳草和苦杏仁药材之一的原料,按1.3.1节方法进行固态发酵,在发酵72 h时取样,编号分别为B、C、D和E,4个样本测序细菌共获得350 616条序列,真菌共获得363 264条序列,样本覆盖率指数均达到99%以上,样本测序深度满足反映微生物全部信息的要求。由表3和表4可知,缺少四种药材的任何一种,细菌的多样性降低,而真菌的多样性增加。
表3 药材缺失条件下六神曲固态发酵的细菌Alpha多样性分析
Table 3 Alpha diversity analysis of bacteria in LiuShenqu with medicinal materials deficiency during solid-state fermentation
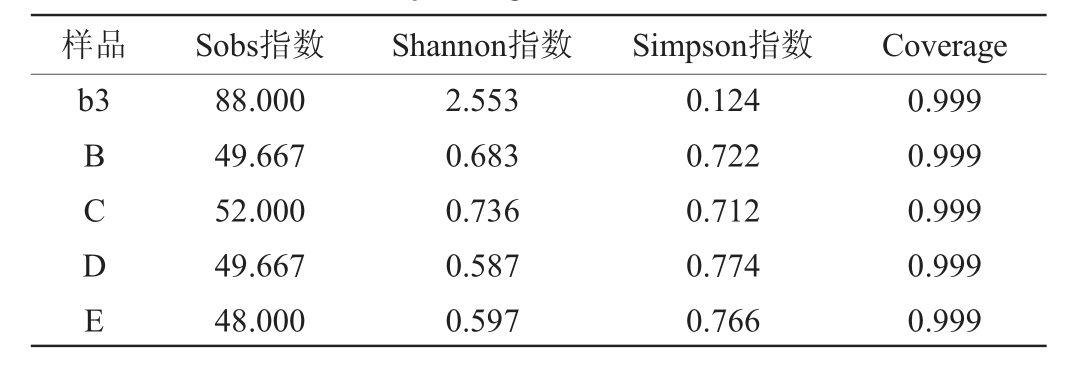
样品 Sobs指数 Shannon指数 Simpson指数 Coverage b3 BCDE 88.000 49.667 52.000 49.667 48.000 2.553 0.683 0.736 0.587 0.597 0.124 0.722 0.712 0.774 0.766 0.999 0.999 0.999 0.999 0.999
表4 药材缺失条件下六神曲固态发酵的真菌Alpha多样性分析
Table 4 Alpha diversity analysis of fungi in LiuShenqu with medicinal materials deficiency during solid-state fermentation
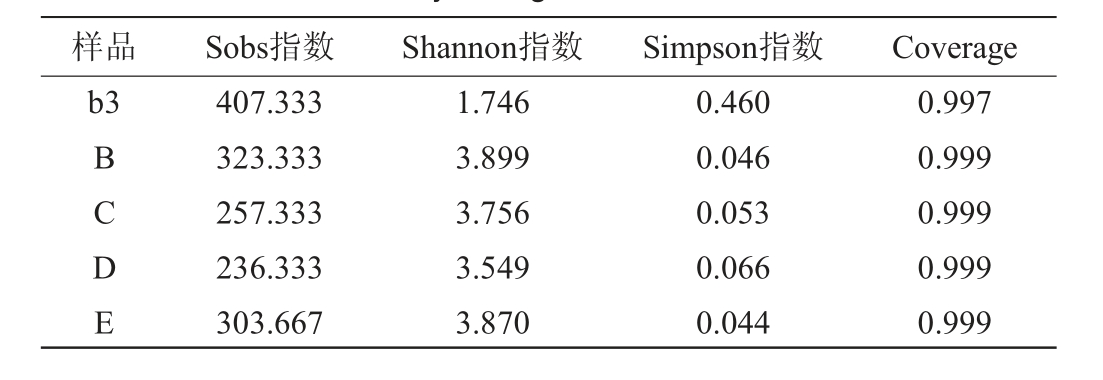
样品 Sobs指数 Shannon指数 Simpson指数 Coverage b3 BCDE 407.333 323.333 257.333 236.333 303.667 1.746 3.899 3.756 3.549 3.870 0.460 0.046 0.053 0.066 0.044 0.997 0.999 0.999 0.999 0.999
对b3、B、C、D、E五个样本进行OTU水平的Venn图分析,直观的展现不同样本中物种(OTU)组成相似性及重叠情况,结果见图8。由图8a知,5个样本细菌共有的OTU有25个,b3样本独有的OTU有53个;由图8b知,5个样本真菌共有的OTU有150个,b3样本独有的OTU有109个。而B、C、D和E样本的细菌和真菌的总OTU数目均低于b3,原料缺少青蒿、辣蓼、苍耳草和苦杏仁中的任何一种药材,均会对六神曲的微生物群落结构产生影响。
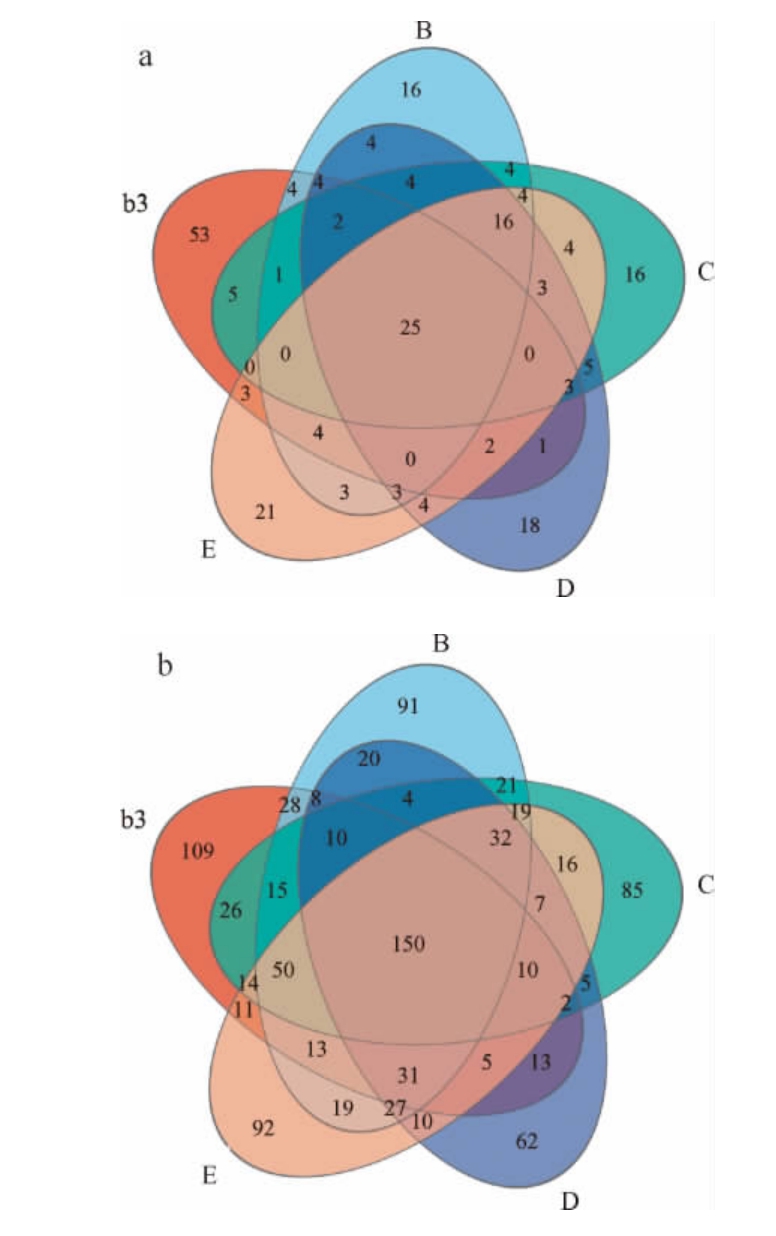
图8 操作分类单元水平细菌(a)、真菌(b)的Venn图
Fig.8 Venn diagram of bacteria (a) and fungi (b) based onoperational taxonomic unit level
对b3、B、C、D、E五个样本进行微生物群落结构分析,细菌共检测到6个门,其中3个门的相对丰度超过1%;真菌共检测到6个门,其中3个门的相对丰度超过1%。由图9a可知,发酵原料缺少青蒿、辣蓼、苍耳草和苦杏仁使发酵后的厚壁菌门(Firmicutes)的丰度明显降低,其中发酵原料缺少辣蓼的固态发酵后厚壁菌门降低最多,说明辣蓼对发酵细菌菌群结构影响最大。由图9b可知,各六神曲固态发酵样品在发酵后期均以子囊菌门(Ascomycota)和担子菌门(Basidiomycota)为优势菌门,但子囊菌门的丰度比担子菌门高,四种原料均可能对子囊菌门的生长存在抑制作用,并对担子菌门的生长存在促进作用,其中苍耳秧对两种真菌门的生长影响最大。
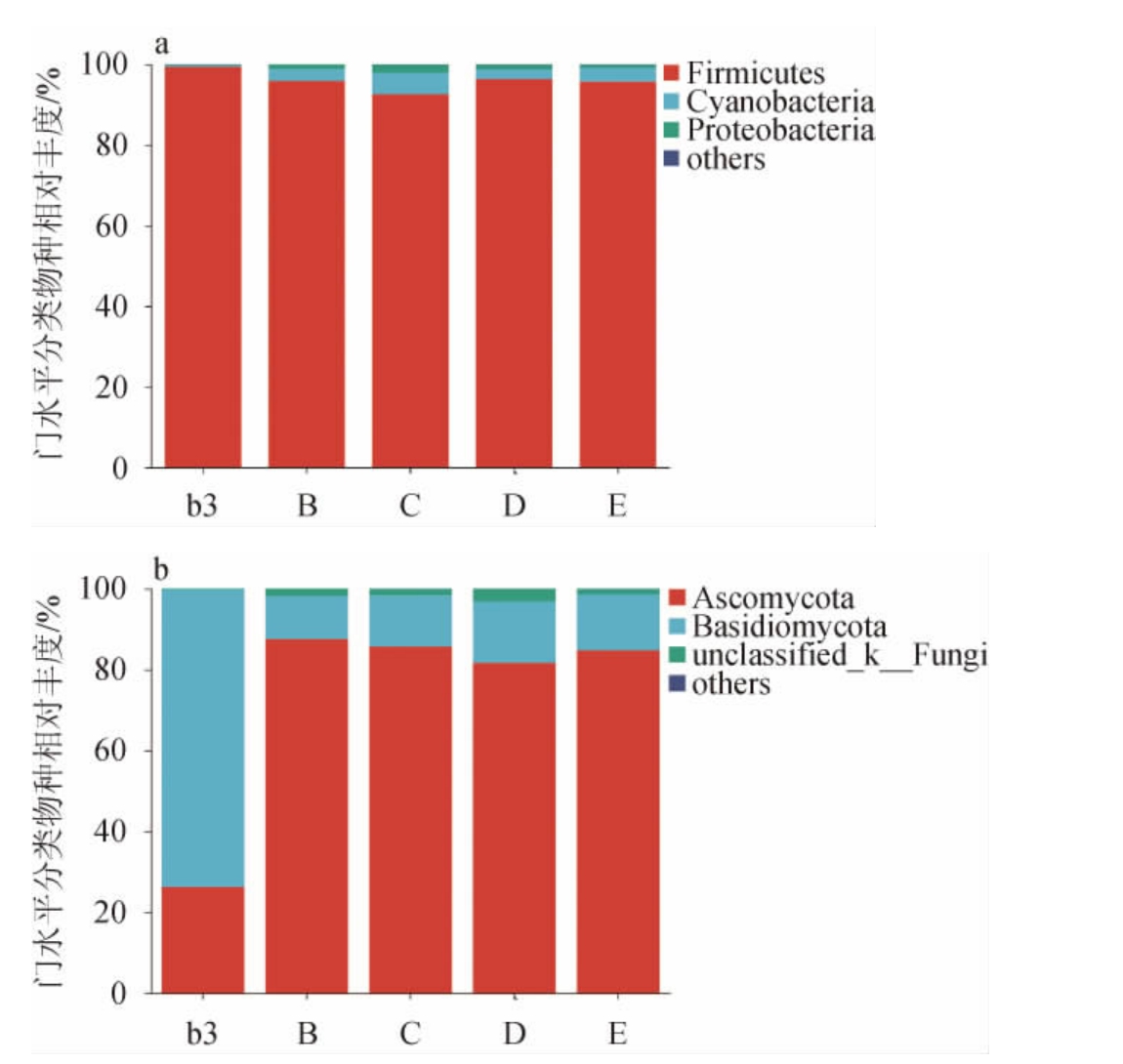
图9 药材缺失条件下六神曲基于门水平细菌(a)、真菌(b)的菌群结构
Fig.9 Microflora structure of bacteria (a) and fungi (b) of LiuShenqu with medicinal materials deficiency based on phylum level
进一步对属水平进行分析,由图10a和10b可知,发酵原料缺少四种药材任意一种,优势细菌均由乳杆菌属(Lactobacillus)转变为片球菌属(Pediococcus),而优势真菌毛孢子菌属(Trichosporon)的相对丰度也明显降低,不再成为优势菌。
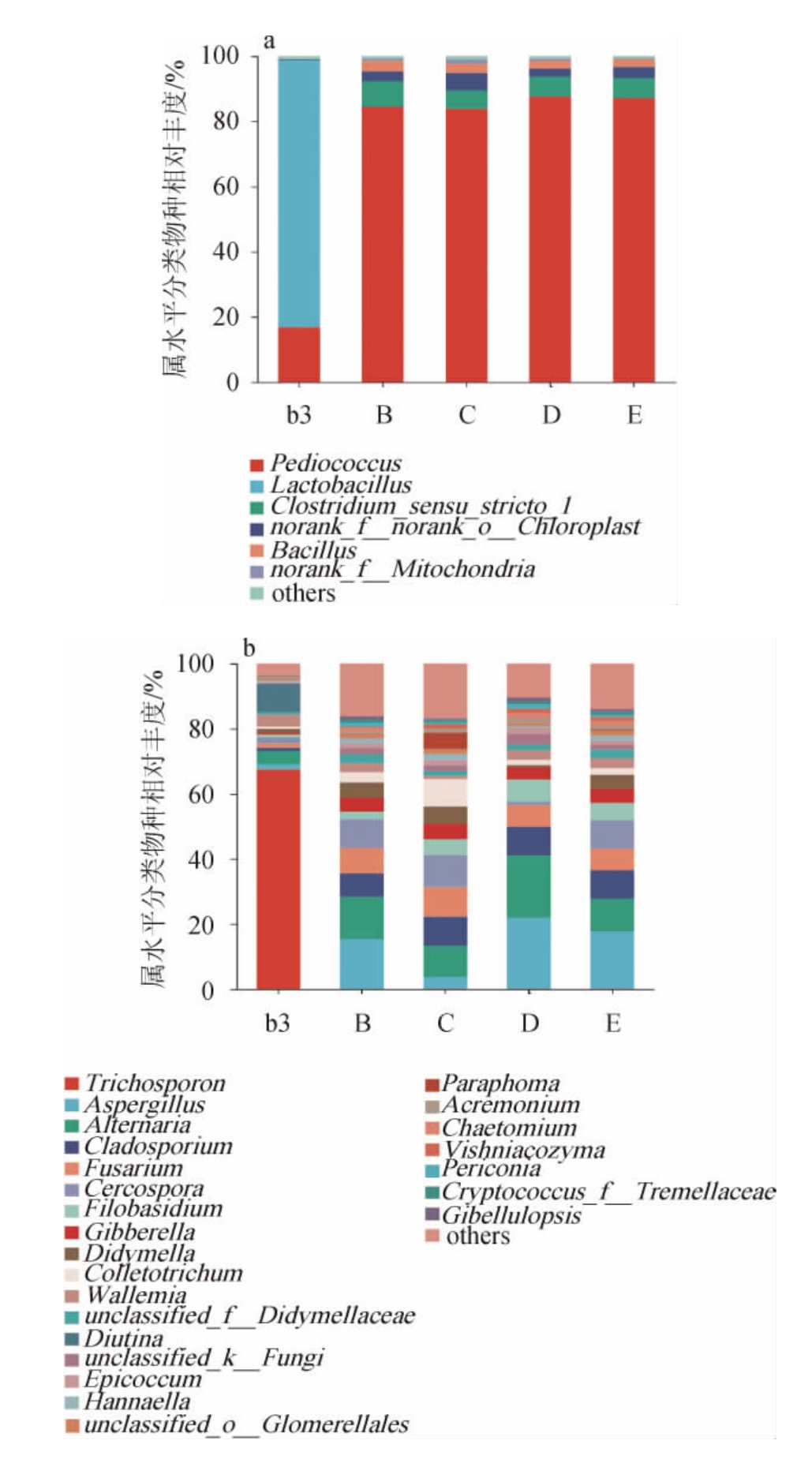
图10 药材缺失条件下六神曲基于属水平细菌(a)、真菌(b)的菌群结构
Fig.10 Microflora structure of bacteria (a) and fungi (b) of LiuShenqu with medicinal materials deficiency based on genus level
将b3、B、C、D、E五个样本的细菌和真菌基因序列在KEGG数据库中利用PICRUSt2软件进行菌群功能预测。对总丰度排名前50的酶进行分析,结果见图11。由图11a可知,细菌群落功能预测显示5种样本均以DNA解旋酶(EC 3.6.4.12)、脱氧核糖核酸指导的脱氧核糖核酸聚合酶(EC 2.7.7.7)、蛋白质-N(pi)-磷酸组氨酸-糖磷酸转移酶(EC 2.7.1.69)为主,其中发酵原料缺少某一种药材的样本发酵后的EC 3.6.4.12、EC 2.7.7.7的基因丰度降低。由图11b可知,b3样本中三磷酸腺苷酶(EC 3.6.1.3)和葡聚糖1,4-α-葡糖苷酶(EC 3.2.1.3)的丰度高于其他4种药材单一缺失样本,说明青蒿、辣蓼、苍耳草和苦杏仁四种药材均对提升六神曲中淀粉酶和糖化酶丰度具有促进作用,有助于六神曲功效的发挥。
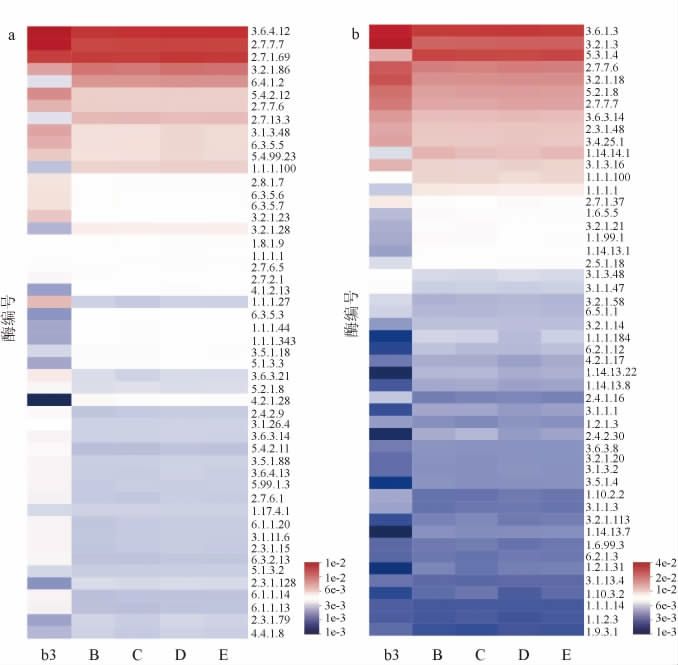
图11 药材缺失条件下六神曲细菌(a)、真菌(b)PICRUSt基因功能预测热图
Fig.11 Heat map of PICRUSt gene function prediction of bacteria (a)and fungi (b) in LiuShenqu with medicinal materials deficiency
将b3、B、C、D、E五个样本的细菌基因序列在KEGG数据库中利用PICRUSt2软件对菌群代谢途径进行功能预测。对总丰度排名前50的代谢途径(Pathway level3)进行分析。
由图12可知,细菌群落功能预测显示,5种发酵样本均以代谢途径(Metabolic pathways)、次级代谢产物的生物合成(Biosynthesis of secondary metabolites)和不同环境中的微生物代谢(Microbial metabolism in diverse environments)的影响为主,且五个样本的基因丰度没有明显差异,但在磷酸转移酶系统(Phosphotransferase system)、核糖体(Ribosome)、氨基酸生物合成(Biosynthesis of amino acids)、氨基糖和和核苷糖代谢(Amino sugar and nucleotide sugar metabolism)、ABC转运系统(ABC transporters)、糖酵解/糖异生(Glycolysis/Gluconeogenesis)、果糖和甘露糖代谢(Fructose and mannose metabolism)等途径存在基因丰度差异。
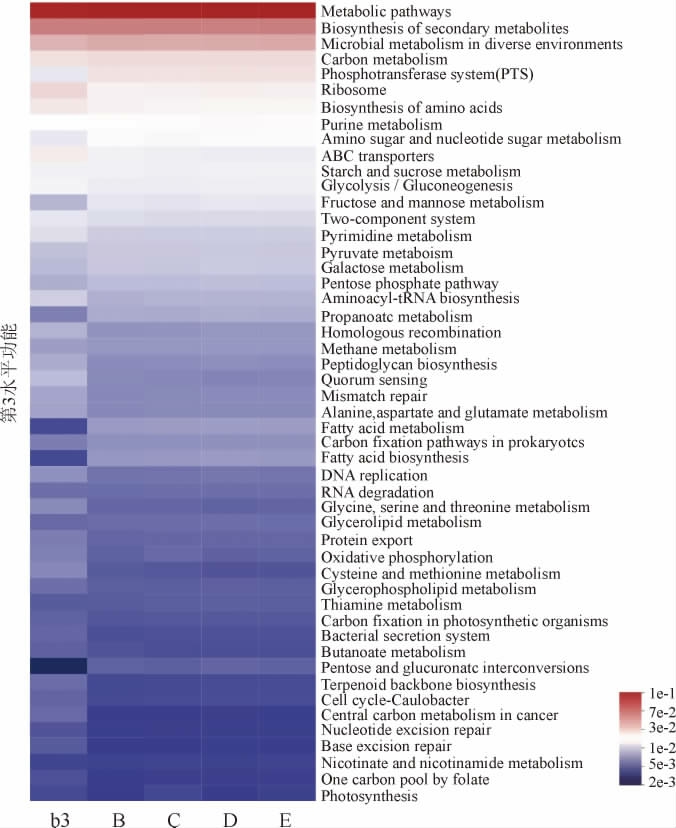
图12 药材缺失条件下六神曲PICRUSt代谢途径功能预测热图
Fig.12 Heat map of PICRUSt metabolic pathways function prediction of LiuShenqu with medicinal materials deficiency
3 结论
采用高通量测序技术对六神曲发酵过程中群落结构的演替变化进行分析,并结合PICRUSt2预测发酵期间菌群的功能变化。研究发现,在六神曲自然发酵过程中,菌群多样性和pH随发酵时间明显降低,后期菌群逐渐单一,细菌中的乳杆菌属、片球菌属和真菌中的毛孢子菌属成为发酵阶段明显的优势菌。发酵原料缺少四种药材之一,优势细菌均由乳杆菌属转变为片球菌属,优势真菌毛孢子菌属的相对丰度也明显降低。其中,辣蓼对发酵细菌菌群结构影响最大;苍耳草对子囊菌门和担子菌门的生长影响最大。本研究为后续六神曲的功效研究提供支撑。
[1]李艳凤,翟梦颖,李雨昕,等.发酵法在中药研究中的应用[J].医学综述,2020,26(4):753-757.
[2]董凡,李浩然,王少平,等.中药发酵的现代研究进展与展望[J].中华中医药杂志,2021,36(2):628-633.
[3]丛悦怡,孙佳,于恩,等.红曲霉发酵转化人参皂苷Rg3的研究[J].中草药,2018,49(6):1298-1303.
[4]陈健明.微生物技术在中药炮制工艺中的应用现状[J].中国民族民间医药,2016,25(5):20-21,24.
[5]潘扬,张弦,蒋亚平,等.双向发酵前后马钱子生物碱含量及其HPLC指纹谱的比较[J].南京中医药大学学报,2006(6):362-365.
[6]吴炳新,牛纪江,孙筱林,等.中药发酵制药技术[J].山东中医杂志,2001(3):179-180.
[7]庞思奇,马嘉擎,林家慧,等.中药“六神曲”发酵工艺研究进展[J].食品与发酵科技,2021,57(4):113-116.
[8]王丽芳,高文远.论六神曲中微生物、消化酶动态检测及整体性研究[J].时珍国医国药,2016,27(8):1896-1898.
[9]XU Y,XIE Y B,ZHANG X R,et al.Monitoring of the bacterial and fungal biodiversity and dynamics during Massa Medicata Fermentata fermentation[J].Appl Microbiol Biotechnol,2013,97(22):9647-9655.
[10]BOSE S,HAN K W,LEE M J,et al.Intestinal protective effects of herbalbased formulations in rats against neomycin insult[J].Evid-Based Compl Alt,2013,2013:161278.
[11]张红玲.六神曲消食化积药效及物质基础研究[D].成都:成都中医药大学,2019.
[12]宋予震,史洪涛,范明夏,等.微生物发酵中药研究进展[J].动物医学进展,2021,42(1):105-109.
[13]贾丹丹.六神曲和百药煎炮制过程中微生物分离、鉴定与特性分析[D].上海:中国医药工业研究总院,2016.
[14]邬吉野,李莹,王德馨,等.六神曲的发酵菌种分离及纯种发酵考察[J].中国实验方剂学杂志,2013,19(16):12-14.
[15]CHEN S F,ZHOU Y Q,CHEN Y R,et al.fastp:an ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[16]MAGOCˇT,SALZBERG S L.FLASH: Fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[17]EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nat Methods,2013,10:996-998.
[18] STACKEBRANDT E, GOEBEL B M.Taxonomic note: A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition inbacteriology[J].Int J Syst Bacteriol,1994,44(4):846-849.
[19]WANG Q,GARRITY G M,TIEDJE J M,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73(16):5261-5267.
[20]SHEN Y Y,WU Y Y,WANG Y Q,et al.Contribution of autochthonous microbiota succession to flavor formation during Chinese fermented mandarin fish(Siniperca chuatsi)[J].Food Chem,2021,348:129107.
[21] LIU P H, ZHANG L H, DU X W, et al.Dynamic analysis of physicochemical and biochemical indices and microbial communities of lightflavor Daqu during storage[J].J Am Soc Brew Chem,2019,77(4):287-294.
[22]FIJAN S.Microorganisms with claimed probiotic properties:an overview of recent literature[J].Int J Environ Res Public Health,2014,11(5):4745-4767.
[23]励建荣,檀茜倩,王丹,等.基于益生菌及其代谢物的食源性致病微生物控制技术研究进展[J].食品科学技术学报,2022,40(3):1-12.
[24]柳青,史迪,刘文俊,等.摩洛哥自然发酵驼乳中乳酸菌分离鉴定及特性研究[J].食品科学技术学报,2022,40(4):85-95,137.
[25]任大勇.益生乳酸杆菌的黏附及免疫调节作用研究[D].长春:吉林大学,2013.
[26] TAN Y W, ZHONG H P, ZHAO D, et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].Int J Food Microbiol,2019,311:108350.
[27]杭锋,陈卫.益生乳酸菌的生理特性研究及其在发酵果蔬饮料中的应用[J].食品科学技术学报,2017,35(4):33-41.
[28]王昌禄,刘彤,李王强,等.微生物对黄曲霉毒素的抑制机制研究进展[J].食品科学技术学报,2021,39(1):27-36.
[29]FERNANDEZ B,HAMMAMI R,SAVARD P,et al.Pediococcus acidilactici UL5 and Lactococcus lactis ATCC 11454 are able to survive and express their bacteriocin genes under simulated gastrointestinal conditions[J].J Appl Microbiol,2014,116(3):677-688.
[30]庄妍.SHP-1中药抑制剂的筛选及其降血糖作用的研究[D].长春:吉林大学,2008.