“曲乃酒之骨,好曲出好酒”,大曲是白酒酿造中的传统发酵剂,其是由多种微生物共同发酵谷物中的碳水化合物后得到的发酵产品,含有丰富的功能微生物群落和代谢酶,有利于白酒酿造过程的顺利进行和形成白酒特有的风味化合物[1]。
酶是大曲的重要组成部分,包括淀粉酶类、酯化酶类、蛋白酶类、脂肪酶类和单宁酶类等[2]。淀粉酶类是大曲中一类重要的酶,其与大曲糖化力、液化力息息相关[3]。在白酒酿造过程中,淀粉酶能够将谷物(淀粉)分解为糊精和一系列的低聚糖,对原料的转化、风味物质以及乙醇的生成有着重要的影响[4]。产淀粉酶的菌株包括放线菌、芽孢杆菌、霉菌和酵母菌等[5],其中芽孢杆菌(Bacillus sp.)是大曲中具有产淀粉酶能力的一类优势细菌[6],具有产酶量高、发酵周期短,对酸、热具有强耐受性的特点[7]。目前已报道的具有产淀粉酶能力的芽孢杆菌主要有贝莱斯芽孢杆菌(Bacillus velezensis)、枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformus)、蜡样芽孢杆菌(Bacillus cereus)以及解淀粉酶芽孢杆菌(Bacillus amyloliquefaciens)等[8]。近年来学者们已从大曲、糟醅、窖泥等来源中筛选出了许多株高产淀粉酶的芽孢杆菌,如胡晓龙等[9]从大曲中筛选出一株产淀粉酶枯草芽孢杆菌,经培养优化后其酶活达8 158.23 U/mL,毛祥等[10]从酱香型大曲中筛选得到一株具有产淀粉酶能力的枯草芽孢杆菌,经优化后其酶活可达8 667.79 U/mL。有研究报道,酒醅中添加产淀粉酶芽孢杆菌后能够提高基酒出酒率[11],因此,其在酿酒企业中具有极高的生物强化潜力和应用价值。
本研究采用稀释平板法和划线法从中温大曲中分离纯化芽孢杆菌,利用透明圈法初筛和3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法复筛以筛选高产淀粉酶的芽孢杆菌,并对其进行形态学观察和分子生物学鉴定。以淀粉酶活力为响应值,通过单因素试验、Plackett-Burman试验、最陡爬坡试验及Box-Behnken试验对筛选菌株的培养条件进行优化,为大曲质量的调控、酿酒原料利用率及白酒出酒率的提高提供理论指导和实践依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
中温大曲:泸州老窖制曲车间;蛋白胨、牛肉浸粉、胰蛋白胨、琼脂(均为生化试剂):北京奥博星生物技术有限责任公司;可溶性淀粉(生化试剂):天津恒兴化学试剂制造有限公司;葡萄糖(分析纯):天津市密欧化学试剂有限公司;蔗糖、麦芽糖、乳糖、(NH4)2SO4、NaCl、(NH4)2HPO4、(NH4)2CO3(均为分析纯):成都市科隆化学品有限公司;DNS(分析纯):广州和为医药科技有限公司;Plant Genomic脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit试剂盒:天根生化科技(北京)有限公司;Taq聚合酶链式反应(polymerase chain reaction,PCR)Mix预混液、PCR产物回收纯化试剂盒:生工生物工程(上海)股份有限公司。
1.1.2 培养基
发酵培养基[12]:蛋白胨10 g/L,NaCl 10 g/L,可溶性淀粉10 g/L,pH值7.0。
营养琼脂培养基[13]:蛋白胨10 g/L,牛肉浸粉5 g/L,NaCl 10 g/L,琼脂粉15 g/L,pH值7.0。
种子培养基[13]:蛋白胨10 g/L,牛肉浸粉5 g/L,NaCl 5 g/L,pH值7.0。
筛选培养基[14]:蛋白胨10 g/L,牛肉浸粉5 g/L,NaCl 5 g/L,可溶性淀粉10 g/L,琼脂粉15 g/L,pH值7.0。
以上培养基均于121 ℃下高压蒸汽灭菌15 min。
1.2 仪器与设备
SX-700E全自动高压灭菌锅:日本Tomy Digital Biology公司;BSC-1300ⅡB2生物安全柜:苏州赛鸿泰净化科技有限公司;IFA-110-8强制对流通用型培养箱:杭州诺丁科学器材有限公司;HYL-C组合式多功能摇床:太仓市强乐实验设备有限公司;Eppendorf 5804R台式低温高速离心机:北京阿拉斯加科技有限公司;JC-HH-6水浴锅:青岛精诚仪器仪表有限公司;Multiskan Sky全波长酶标仪:赛默飞科技有限公司;奥林巴斯BX53M正置金项显微镜:上海仪景通光学科技有限公司;JJ6000型电子天平:常熟市双杰测试仪器厂;T100 PCR仪、PathoMPS S1000水平电泳仪、Gel Doc Go全自动凝胶成像仪:美国BIO-RAD公司。
1.3 方法
1.3.1 芽孢杆菌的分离纯化[15]
称取10 g中温大曲样品放入无菌锥形瓶中,并与90 mL无菌水混合。将混合物以200 r/min振荡2 h,在80 ℃水中热处理30 min。将混合物梯度稀释10倍,吸取不同梯度的稀释液200 μL涂于营养琼脂培养基,于37 ℃条件下培养24 h,挑取具有芽孢杆菌形态特征的菌落进行划线和分离纯化。
1.3.2 高产淀粉酶芽孢杆菌的筛选
初筛:将纯化的芽孢杆菌菌株划线接种于筛选培养基上,于37 ℃条件下培养24 h,将数滴0.05%卢戈氏碘溶液添加到培养基中,并用棉签均匀涂抹,测定菌落周围透明圈的直径(D)和菌落直径(d),选择D/d值>1.5的菌株进行复筛。
复筛:将初筛D/d值较大的菌株划线接种于筛选培养基上,37 ℃条件下活化培养24 h后,用接种环挑取一环接种于装有100 mL种子培养基的250 mL锥形瓶中,37 ℃、150 r/min条件下富集培养24 h;调整菌液OD600 nm值为0.5±0.05,并以5%(V/V)的接种量接种于装有100 mL发酵培养基的250 mL锥形瓶中,37 ℃、150 r/min条件下发酵48 h;取发酵液30 mL于50 mL离心管中,在10 ℃条件下以8 000 r/min离心10 min,取上清液,使用DNS法测定淀粉酶活性[16],筛选高产淀粉酶的菌株。
1.3.3 高产淀粉酶芽孢杆菌的鉴定
形态学观察:参照《伯杰细菌鉴定手册》(第八版)[17]对菌株的菌落形态进行观察;革兰氏染色后镜检观察菌株细胞结构。
分子生物学鉴定:采用Plant Genomic DNA Kit提取复筛菌株的基因组DNA,以其为模板,采用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-CTACGGCTACCTTGTTACGA-3')进行PCR扩增[18],采用1%琼脂糖凝胶电泳对PCR扩增产物进行检测。将纯化后的PCR扩增产物送至上海派森诺生物科技有限公司进行DNA测序,将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,选取同源性较高的模式菌株的16S rDNA基因序列,使用MEGA11.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树[19]。
1.3.4 高产淀粉酶芽孢杆菌培养条件优化
(1)单因素试验
以发酵培养基为基础培养基,在接种量5%、初始pH值7.0、培养温度37 ℃、转速150 r/min、装液量100 mL/250 mL的条件下,以淀粉酶活力为筛选依据,探究碳源种类(蔗糖、可溶性淀粉、葡萄糖、麦芽糖、乳糖、高粱粉、小麦粉)及最佳碳源添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L)、氮源种类(蛋白胨、牛肉浸粉、胰蛋白胨、硫酸铵、氯化铵、磷酸氢二铵)及最佳氮源添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L)、接种量(1%、3%、5%、7%、9%、11%)、发酵温度(31℃、33℃、35℃、37℃、39℃、41℃)、转速(90 r/min、120 r/min、150 r/min、180 r/min、210 r/min、240r/min)、装液量(40mL/250mL、60mL/250mL、80mL/250mL、100mL/250mL、120mL/250mL、140mL/250mL、160 mL/250 mL)以及培养基初始pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、9.0)共9个因素对淀粉酶活力的影响。
(2)Plackett-Burman试验
在单因素试验结果的基础上,通过Plackett-Burman试验从7个因素(碳源添加量(X1)、氮源添加量(X2)、接种量(X3)、发酵温度(X4)、转速(X5)、装液量(X6)、初始pH值(X7))中筛选出对菌株淀粉酶活性具有显著影响的因子,试验因素与水平见表1。
表1 培养条件优化Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design for culture conditions optimization
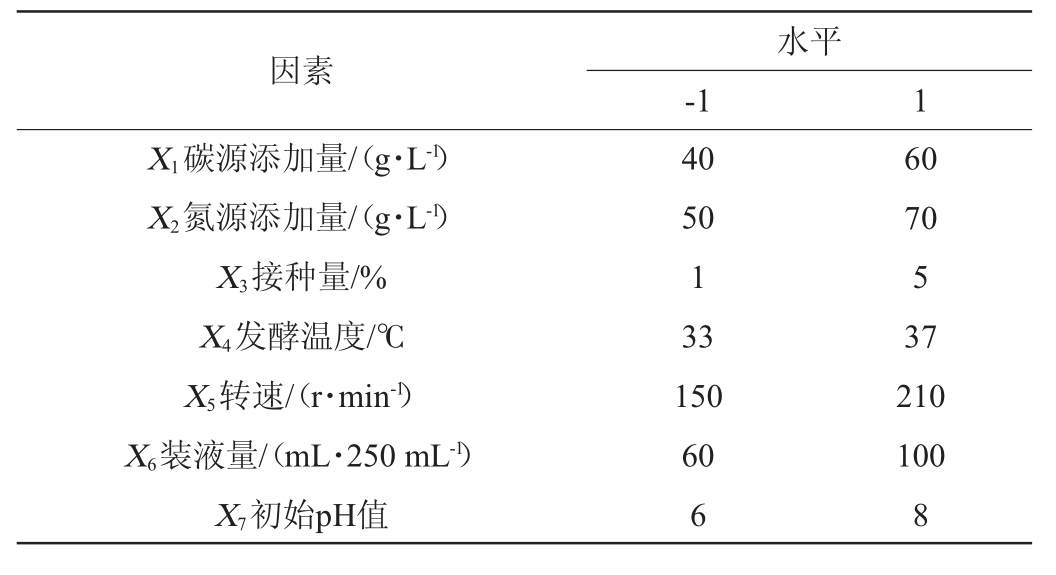
因素X1碳源添加量/(g·L-1)X2氮源添加量/(g·L-1)X3接种量/%X4发酵温度/℃X5转速/(r·min-1)X6装液量/(mL·250 mL-1)X7初始pH值水平-1 1 40 50 1 33 150 60 6 60 70 5 37 210 100 8
(3)最陡爬坡试验
根据Plackett-Burman试验结果,选择对淀粉酶活性具有显著影响的因素,利用最陡爬坡试验确定响应面中心点。
(4)Box-Behnken试验
在Plackett-Burman试验和最陡爬坡试验的基础上,以淀粉酶活力(Y)为响应值,接种量(A)、发酵温度(B)及装液量(C)为考察因素,通过Design-Expert 13软件设计Box-Behnken试验,试验设计因素与水平见表2。
表2 培养条件优化Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design for culture conditions optimization

因素A 接种量/%B 发酵温度/℃C 装液量/(mL·250 mL-1)水平-1 0 1 1 3 5 33 60 35 80 37 100
2 结果与分析
2.1 高产淀粉酶芽孢杆菌的分离纯化及筛选
通过稀释涂布和平板划线从中温大曲中共分离纯化出72株芽孢杆菌,通过初筛得到12株D/d值>1.5的菌株,进行淀粉酶活力测定,结果见表3。由表3可知,菌株ZTW17-6的淀粉酶活性显著高于其他菌株(P<0.05),为3 207.47 U/mL,因此,确定该菌株为高产淀粉酶活的菌株。
表3 高产淀粉酶芽孢杆菌菌株的筛选结果
Table 3 Screening results for high-yield amylase Bacillus sp.strains
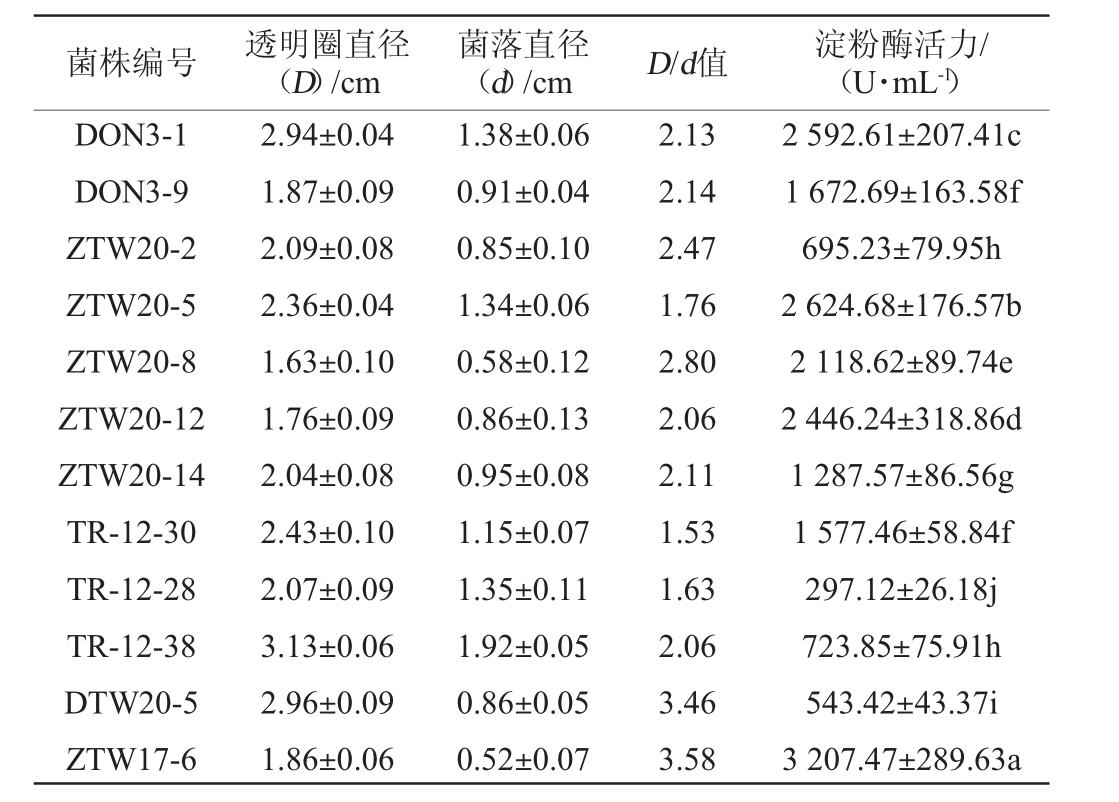
注:不同小写字母表示差异显著(P<0.05)。下同。
菌株编号 透明圈直径(D)/cm菌落直径(d)/cm D/d值 淀粉酶活力/(U·mL-1)DON3-1 DON3-9 ZTW20-2 ZTW20-5 ZTW20-8 ZTW20-12 ZTW20-14 TR-12-30 TR-12-28 TR-12-38 DTW20-5 ZTW17-6 2.94±0.04 1.87±0.09 2.09±0.08 2.36±0.04 1.63±0.10 1.76±0.09 2.04±0.08 2.43±0.10 2.07±0.09 3.13±0.06 2.96±0.09 1.86±0.06 1.38±0.06 0.91±0.04 0.85±0.10 1.34±0.06 0.58±0.12 0.86±0.13 0.95±0.08 1.15±0.07 1.35±0.11 1.92±0.05 0.86±0.05 0.52±0.07 2.13 2.14 2.47 1.76 2.80 2.06 2.11 1.53 1.63 2.06 3.46 3.58 2 592.61±207.41c 1 672.69±163.58f 695.23±79.95h 2 624.68±176.57b 2 118.62±89.74e 2 446.24±318.86d 1 287.57±86.56g 1 577.46±58.84f 297.12±26.18j 723.85±75.91h 543.42±43.37i 3 207.47±289.63a
2.2 菌株ZTW17-6的鉴定
2.2.1 形态学观察
菌株ZTW17-6的菌落形态及细胞形态见图1。由图1A可知,菌株ZTW17-6的菌落呈白色,四周粗糙,有沟壑,中间突起,顶端为圆环状,整体形状酷似火山;由图1B可知,菌体经革兰氏染色后呈蓝紫色,说明为革兰氏阳性菌,菌体呈杆状,参考《伯杰细菌鉴定手册》初步判定菌株ZTW17-6为芽孢杆菌属(Bacillus sp.)。
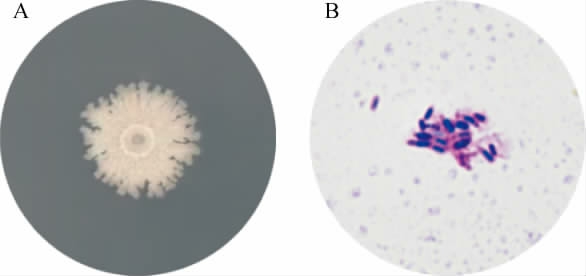
图1 菌株ZTW17-6的菌落形态(A)及细胞形态(B)
Fig.1 Colony morphology (A) and cell morphology (B) of strain ZTW17-6
2.2.2 分子生物学鉴定
基于16S rDNA基因序列构建菌株ZTW17-6的系统发育树,结果见图2。

图2 基于16S rRNA基因序列分析菌株ZTW17-6的系统发育树
Fig.2 Phylogenetic tree of strain ZTW17-6 based on 16S rRNA gene sequences analysis
由图2可知,菌株ZTW17-6与贝莱斯芽孢杆菌(Bacillus velezensis)FZB42聚于一支,亲缘关系最近,结合菌落形态观察,可鉴定菌株ZTW17-6为贝莱斯芽孢杆菌(Bacillus velezensis)。
2.3 菌株ZTW17-6产淀粉酶培养条件的优化
2.3.1 单因素试验
不同培养条件对菌株ZTW17-6产淀粉酶的影响见图3。

图3 不同培养条件对菌株ZTW17-6产淀粉酶的影响
Fig.3 Effect of different culture conditions on amylase produced by strain ZTW17-6
碳源可以为菌体合成提供碳骨架成分并为微生物生长提供能量,是微生物生长的必要元素之一[20]。由图3A可知,当以高粱粉和小麦粉为碳源时,淀粉酶活力处于较低水平,当乳糖为碳源时,淀粉酶活力最高,可达3 329.86 U/mL,显著高于可溶性淀粉(3 018.53 U/mL)(P<0.05),这可能是因为菌株ZTW17-6产β-半乳糖苷酶能力较强,将乳糖转化为葡萄糖的能力快于将淀粉转化为葡萄糖的能力,更利于菌株自身代谢产酶[21]。因此,确定乳糖为最佳碳源。
在菌体中,氮源参与了氨基酸、蛋白质、核酸及含氮代谢物的合成[22]。由图3B可知,相比于无机氮,有机氮更能促进菌体产淀粉酶,这可能是因为有机氮中含有丰富的氨基酸和生长因子,有助于菌体生长及蛋白质的合成[9]。蛋白胨有助于延长产物稳定期,促进产物代谢[23],当以蛋白胨为氮源时,淀粉酶活力最高,为3 186.36 U/mL,因此,确定蛋白胨为最佳氮源。
碳源和氮源是微生物生长的重要物质基础,过低的含量不利于微生物的生长,含量过高则会出现反馈抑制[24]。由图3C可知,当乳糖添加量为10~50 g/L时,淀粉酶活力呈上升趋势;当乳糖添加量为50 g/L时,淀粉酶活力最高,为6 185.24 U/mL;当乳糖添加量继续升高时,淀粉酶活力开始降低,因此,确定最适乳糖添加量为50 g/L。由图3D可知,当蛋白胨添加量为10~60 g/L时,淀粉酶活力随着蛋白胨添加量的升高而升高;当蛋白胨添加量为60 g/L时,淀粉酶活力最高,为5 298.38 U/mL;当蛋白胨添加量>60 g/L之后,淀粉酶活力开始下降,因此,确定最适蛋白胨添加量为60 g/L。
由图3E可知,当接种量<3%时,淀粉酶活力随着接种量的增加而升高;当接种量为3%时,淀粉酶活力最高,为5 645.50 U/mL;随后淀粉酶活力急剧下降,并在接种量为7%~11%时趋于稳定,这可能是由于接种量的增大缩短了停滞期,从而加快了微生物的繁殖和底物的消耗,使得后期淀粉酶的积累受到抑制。因此,确定最适接种量为3%。
不同微生物的最适生长温度不同,温度过高或过低都不利于酶的表达[25]。由图3F可知,当发酵温度为31~35 ℃时,淀粉酶活力随着发酵温度的升高而升高;当发酵温度为35 ℃时,淀粉酶活力最高,为5 787.48 U/mL,这与BHATT K等[26]的研究结果一致;当发酵温度>35 ℃时,淀粉酶活力开始受到抑制,随着发酵温度的升高而下降,因此,选择35 ℃作为该菌株发酵产酶的最适发酵温度。
由图3G可知,当转速在90~180 r/min时,淀粉酶活力随着转速的增加而提高;当转速为180 r/min时,淀粉酶活力最高,为4 825.85 U/mL;当转速>180 r/min时,淀粉酶活力随着转速的升高而降低。因此确定最适转速为180 r/min。
理论上装液量越少,体积溶氧系数越高,越有利于微生物与氧气接触,但装液量减少的同时也会使微生物所需的营养物质减少[27]。由图3H可知,当装液量为40~80 mL/250 mL时,淀粉酶活力随着装液量的增加而提高;当装液量为80 mL/250 mL时,淀粉酶活力最高,为4 483.72 U/mL;当装液量>80 mL/250 mL时,淀粉酶活力随着装液量的增加而降低。因此,确定最适装液量为80 mL/250 mL。
由图3I可知,在低初始pH值条件下,淀粉酶活力较低,可能是因为偏酸的发酵环境抑制了菌株的生物活性,从而降低了淀粉酶活力[28];当初始pH值为3~7时,淀粉酶活力随着初始pH值的升高而升高;当初始pH值为7时,淀粉酶活力达到最高值,为3 349.45 U/mL;当初始pH值>7时,淀粉酶活力随着初始pH值的升高而降低。因此,确定最适初始pH值为7。
2.3.2 Plackett-Burman试验结果
在单因素试验结果的基础上,采用Design-Expert 13软件设计Plackett-Burman试验,试验设计及结果见表4,方差分析见表5。
表4 Plackett-Burman试验设计及结果
Table 4 Design and results of Plackett-Burman experiments
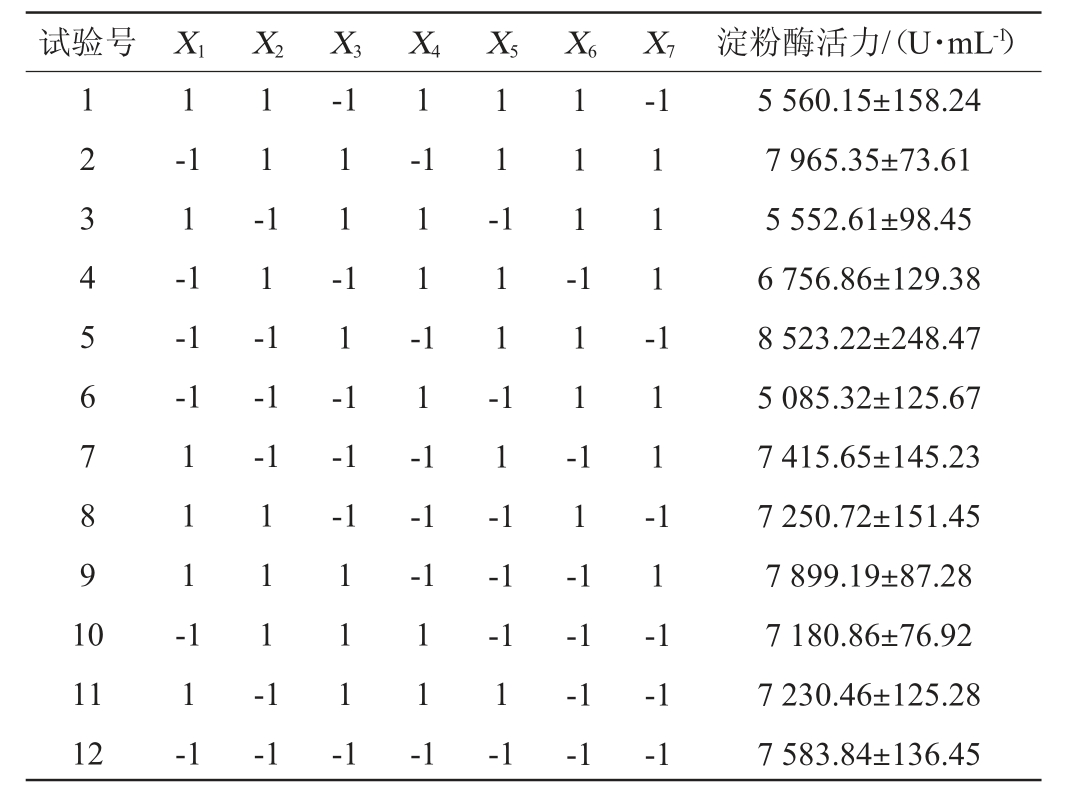
试验号 X1 X2 X3 X4 X5 X6 X7 淀粉酶活力/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0 1-1 1-1-1 1-1-1-1 1 1 --1 1 1 -1 1 1 -1 1 -1 1 -1 1 1 -1 1 -1 1 1 1 -1 1 1 -1 1 1 --1-1-1-1 1 1 -1 1 1 1 -1 1 1 -1 1 1 -1 1 1 -1-1-1 1 1 1 -1 1 -1 11 12 1 1-1-1 1 1 1 -1 1 1 -1-1-1 1-1-1-1-1-1-1 5 560.15±158.24 7 965.35±73.61 5 552.61±98.45 6 756.86±129.38 8 523.22±248.47 5 085.32±125.67 7 415.65±145.23 7 250.72±151.45 7 899.19±87.28 7 180.86±76.92 7 230.46±125.28 7 583.84±136.45
表5 Plackett-Burman试验方差分析结果
Table 5 Variance analysis results of Plackett-Burman experiments
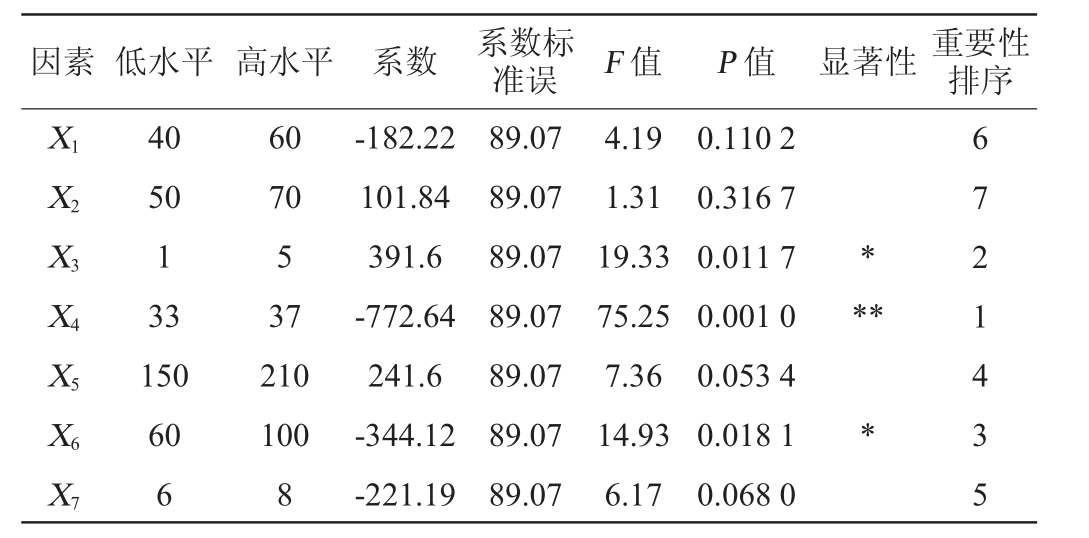
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
因素 低水平 高水平 系数 系数标准误 F 值 P 值 显著性 重要性排序X1 X2 X3*X4**X5 X6*X7 40 50 1 33 150 60 6 60 70 5 37 210 100 8-182.22 101.84 391.6-772.64 241.6-344.12-221.19 89.07 89.07 89.07 89.07 89.07 89.07 89.07 4.19 1.31 19.33 75.25 7.36 14.93 6.17 0.110 2 0.316 7 0.011 7 0.001 0 0.053 4 0.018 1 0.068 0 6 7 2 1 4 3 5
由表4及表5可知,各因素对菌株ZTW17-6产淀粉酶影响的先后顺序为X4>X3>X6>X5>X7>X1>X2,该模型的P值为0.006 8,极显著(P<0.01),决定系数R2为0.969 8,调整决定系数R2adj为0.917,表明该模型的拟合度较好。其中X3(接种量)、X4(发酵温度)、X6(装液量)对结果影响显著(P<0.05),为主要影响因素,且X3对结果的影响是正效应,X4及X6对结果的影响是负效应,因此,选择X3、X4和X6进行最陡爬坡试验,其余因素以单因素试验结果确定最佳水平。
2.3.3 最陡爬坡试验
为了逼近X3(接种量)、X4(发酵温度)和X6(装液量)的响应中心点,根据Plackett-Burman试验结果,采用Design-Expert 13设计最陡爬坡试验,试验设计及结果见表6。由表6可知,在试验号2的培养条件下,淀粉酶活力最高,可达8 132.46 U/mL。因此,选择试验号2的培养条件,即接种量3%、发酵温度35 ℃、装液量80 mL/250 mL为响应面试验的中心点。
表6 最陡爬坡试验设计及结果
Table 6 Design and results of the steepest climbing experiments
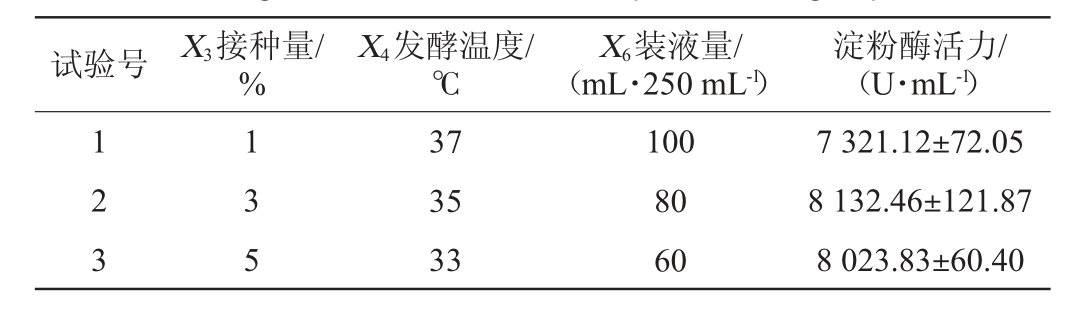
试验号 X3接种量/%X4发酵温度/℃X6装液量/(mL·250 mL-1)淀粉酶活力/(U·mL-1)1 2 3 1 3 5 37 35 33 100 80 60 7 321.12±72.05 8 132.46±121.87 8 023.83±60.40
2.3.4 Box-Behnken试验设计及结果
在Plackett-Burman试验和最陡爬坡试验的基础上,以淀粉酶活力(Y)为响应值,接种量(A)、发酵温度(B)及装液量(C)为考察因素,通过Design-Expert 13软件设计Box-Behnken试验,试验设计及结果见表7,方差分析结果见表8。
表7 培养条件优化Box-Behnken试验设计及结果
Table 7 Design and results of Box-Behnken experiments for culture conditions optimization
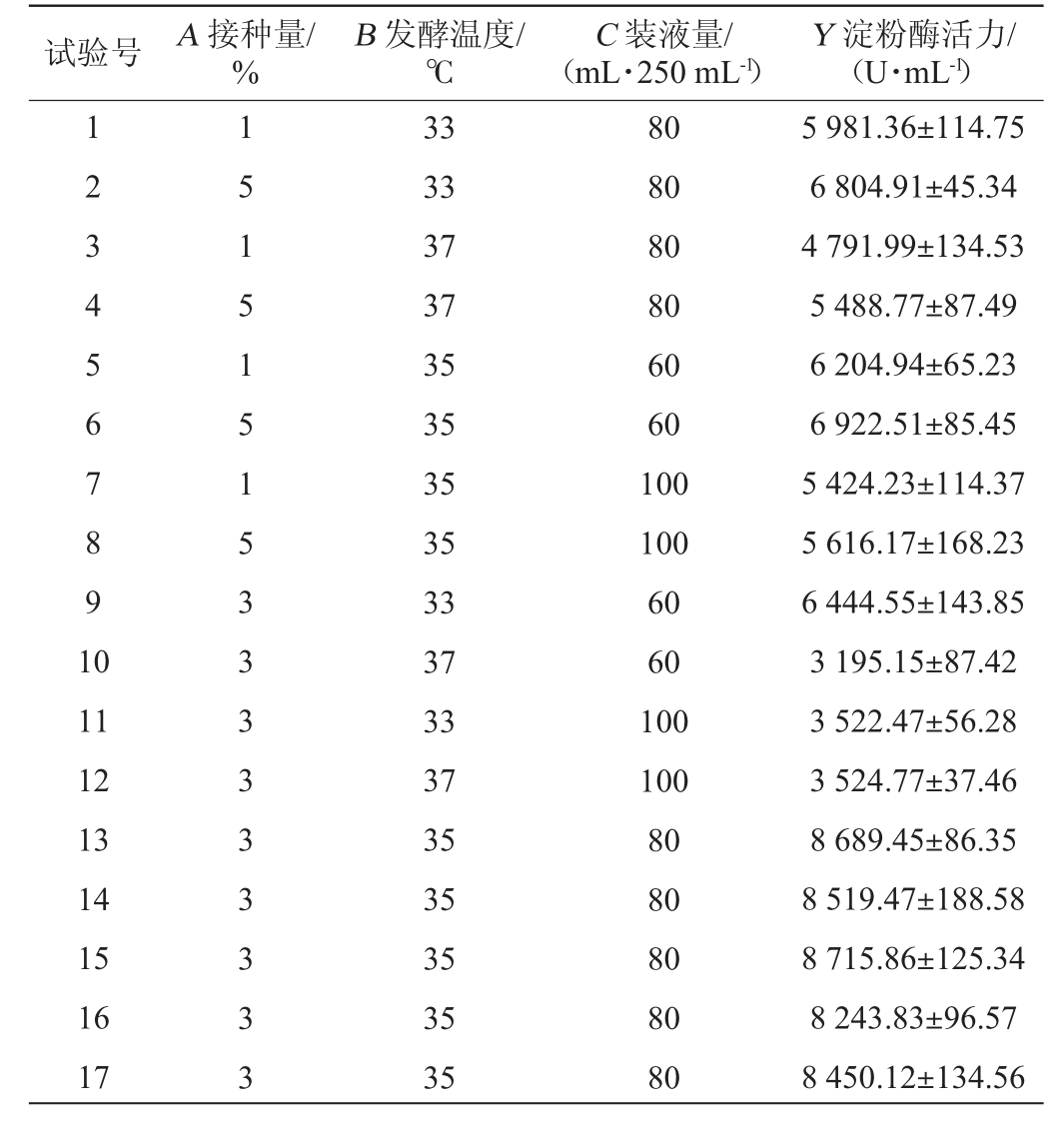
试验号 A 接种量/%B 发酵温度/℃C 装液量/(mL·250 mL-1)Y 淀粉酶活力/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 1 5 1 5 1 5 1 5 3 3 3 3 3 3 3 3 3 33 33 37 37 35 35 35 35 33 37 33 37 35 35 35 35 35 80 80 80 80 60 60 100 100 60 60 100 100 80 80 80 80 80 5 981.36±114.75 6 804.91±45.34 4 791.99±134.53 5 488.77±87.49 6 204.94±65.23 6 922.51±85.45 5 424.23±114.37 5 616.17±168.23 6 444.55±143.85 3 195.15±87.42 3 522.47±56.28 3 524.77±37.46 8 689.45±86.35 8 519.47±188.58 8 715.86±125.34 8 243.83±96.57 8 450.12±134.56
表8 回归模型方差分析
Table 8 Variance analysis of regression model
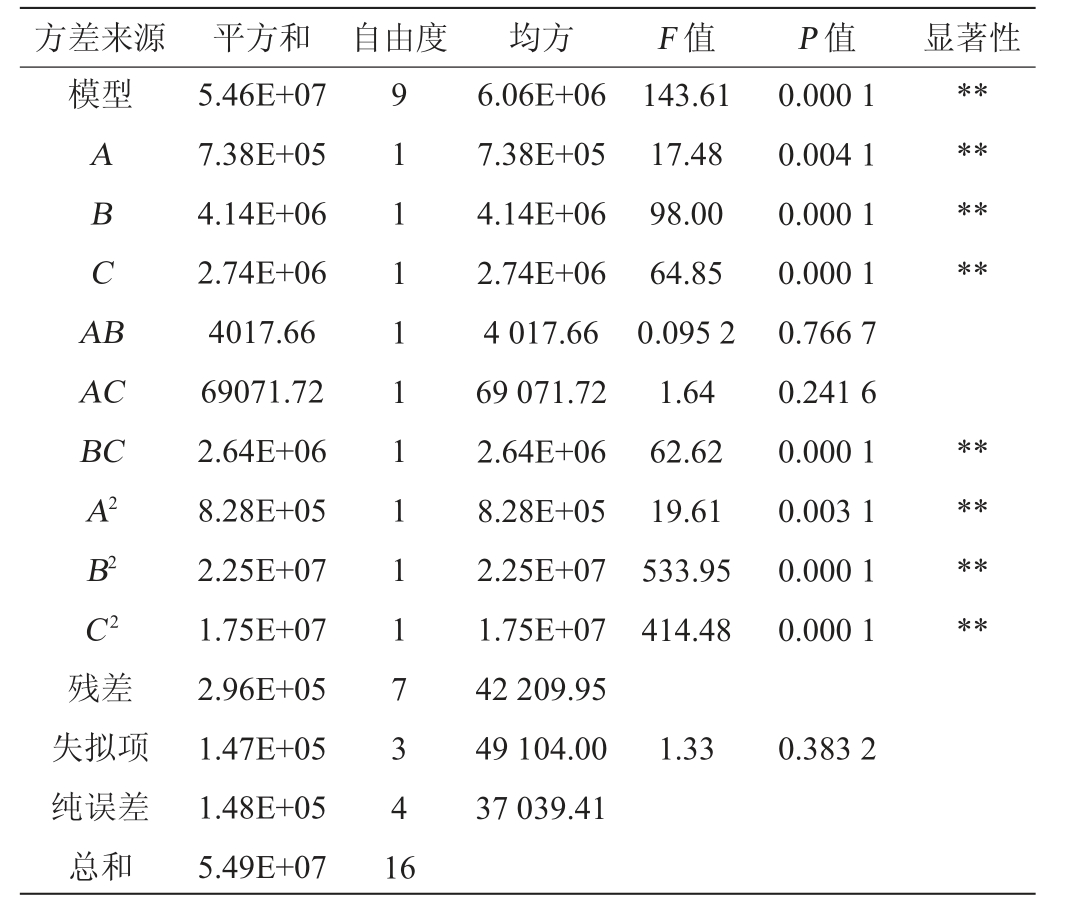
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B********AC BC A2 B2 C2残差失拟项纯误差总和5.46E+07 7.38E+05 4.14E+06 2.74E+06 4017.66 69071.72 2.64E+06 8.28E+05 2.25E+07 1.75E+07 2.96E+05 1.47E+05 1.48E+05 5.49E+07 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 6.06E+06 7.38E+05 4.14E+06 2.74E+06 4 017.66 69 071.72 2.64E+06 8.28E+05 2.25E+07 1.75E+07 42 209.95 49 104.00 37 039.41 143.61 17.48 98.00 64.85 0.095 2 1.64 62.62 19.61 533.95 414.48 0.000 1 0.004 1 0.000 1 0.000 1 0.766 7 0.241 6 0.000 1 0.003 1 0.000 1 0.000 1********1.33 0.383 2
采用Design-Expert 13软件对表7结果进行多元回归拟合分析,得到淀粉酶活力(Y)对接种量(A)、发酵温度(B)和装液量(C)的二次多元回归方程:Y=-663 878+1 357.06A+38 526.52B+84.66C-7.92AB-3.29AC+20.32BC-110.85A2-578.40B2-5.10C2。
由表8可知,模型极显著(P<0.001),失拟项不显著(P=0.383 2>0.05),表明该模型可靠。决定系数R2=0.994 6、调整决定系数R2adj=0.987 7,表明该模型精确度高,误差小,模型预测值与实际值的拟合度较高,能够对菌株ZTW17-6的淀粉酶活力进行预测。由P值可知,一次项A、B、C、交互项BC及二次项A2、B2和C2对结果影响极显著(P<0.01);由F值可知,影响淀粉酶活力的因素主次顺序为B(发酵温度)>C(装液量)>A(接种量)。交互项BC对结果影响的响应面及等高线见图4。
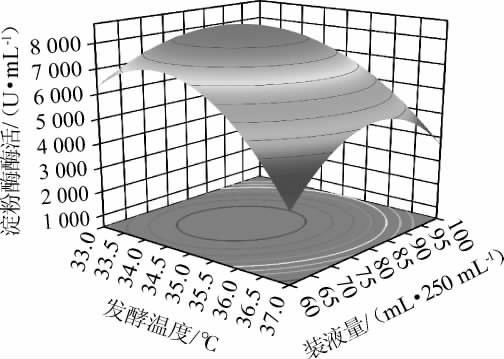
图4 发酵温度与装液量间交互作用对贝莱斯芽孢杆菌ZTW17-6产淀粉酶活力影响的响应面及等高线
Fig.4 Response surface plot and contour lines of effects of interaction between fermentation temperature and liquid volume on amylase activity of Bacillus velezensis ZTW17-6
由图4可知,发酵温度与装液量间交互作用对淀粉酶活力影响的响应面呈凸面,存在最高点,等高线呈椭圆形,说明两者间交互作用对贝莱斯芽孢杆菌ZTW17-6产淀粉酶活力的影响极显著,这与方差分析结果一致。
采用Design-Expert 13软件对二次多元回归方程进行最优求解,得到贝莱斯芽孢杆菌ZTW17-6产淀粉酶的最佳培养条件为接种量5%、发酵温度34.6℃、装液量75.69 mL/250mL,在此条件下,淀粉酶活力的预测值为8 536.45 U/mL。为便于实际操作,将培养条件修正为接种量5%、发酵温度35 ℃和装液量76 mL/250 mL。在该培养条件下重复3次试验,测得淀粉酶活力实际值为(8 352.95±78.94)U/mL,与预测值接近,说明该模型可行。
3 结论
本研究采用稀释平板法和划线法从中温大曲中分离纯化出72株芽孢杆菌,通过透明圈法初筛和3,5-二硝基水杨酸法(DNS)法复筛得到一株高产淀粉酶的细菌,编号为ZTW17-6,经形态学观察及分子生物学技术鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。通过单因素试验、Plackett-Burman试验、最陡爬坡试验以及响应面试验优化确定菌株ZTW17-6产淀粉酶的最优培养条件为乳糖添加量50 g/L、蛋白胨添加量60 g/L、接种量5%、发酵温度35 ℃、转速180 r/min、装液量76 mL/250 mL、初始pH值7。在此优化培养条件下,淀粉酶活力最高,可达8 352.95 U/mL,是优化前的2.61倍。在此基础上,后续将研究菌株对大曲糖化力以及液化力的影响,并将该大曲应用于酿酒生产中,研究其对白酒出酒率的影响,以期为大曲质量提升以及白酒出酒率的提高提供理论指导和实践依据。
[1]DU H,WANG X,ZHANG Y,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297(2):32-40.
[2]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[3]贾瑞博,胡荣康,周文斌,等.米曲霉(Aspergillus oryzae FAFU)淀粉酶的分离纯化及其酶学性质研究[J].食品与发酵工业,2016,42(11):71-76.
[4]王屈祎,钟倩,闫如玉,等.淀粉酶产生菌的筛选、鉴定及其发酵条件优化[J].微生物学通报,2022,49(1):173-188.
[5]王芙蓉.酱香型大曲中高温放线菌的筛选及其产酶条件的优化[D].贵阳:贵州大学,2017.
[6]李季鹏.淀粉酶、蛋白酶在芝麻香型白酒中的应用[D].济南:济南大学,2013.
[7]WANG S,JEYASEELAN J,LIU Y,et al.Characterization and optimization of amylase production in WangLB,a high amylase-producing strain of Bacillus[J].Appl Biochem Biotechnol,2016,180(1):136-151.
[8]FAROOQ M A,ALI S,HASSAN A,et al.Biosynthesis and industrial applications of alpha-amylase:A review[J].Arch Microbiol,2021,203(4):1281-1292.
[9]胡晓龙,冯大鸿,田瑞杰,等.中温大曲产淀粉酶菌株的筛选鉴定及培养条件优化[J].中国酿造,2023,42(1):78-85.
[10]毛祥,黄丹,沈才萍,等.酱香型大曲中产淀粉酶菌的分离鉴定及发酵特性研究[J].中国酿造,2015,34(12):24-27.
[11]黄晓宁,刘晶晶,韩北忠,等.基于酶学特性筛选大曲来源芽孢杆菌用于强化酿酒[J].食品科学,2021,42(10):218-224.
[12]游勇,吴晓玉,廖家富,等.特香型白酒大曲中一株耐热产淀粉酶地衣芽孢杆菌的分离和鉴定[J].酿酒科技,2022(3):17-24.
[13]张璋,赵腾飞,李红霞,等.产淀粉酶芽孢杆菌的分离鉴定、高温驯化及酶学性质研究[J].中国酿造,2023,42(9):79-84.
[14]陈家晖.内源性芽孢杆菌的生物强化对大曲的理化特性和微生物群落的影响[D].武汉:武汉轻工大学,2022.
[15]王庆,王超彦,徐海林,等.高温大曲中高产四甲基吡嗪芽孢杆菌的分离鉴定及发酵条件优化[J].中国酿造,2022,41(10):125-129.
[16]王传旭,赵爱华,于慧瑛,等.淀粉酶高产菌株的筛选、紫外诱变及产酶条件优化[J].微生物学通报,2022,49(5):1759-1773.
[17]布坎南R E,吉本斯N E.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984:729-732.
[18]孙佳,杜海,徐岩.高温大曲中大曲岩石芽孢杆菌的筛选及其特性分析[J].食品与发酵工业,2023,49(17):75-84.
[19]王晓丹,王婧,朱国军,等.酱香大曲中产四甲基吡嗪细菌的分离鉴定及其功能性研究[J].中国酿造,2017,36(1):55-60.
[20]李红芳,梁生康,段效辉,等.红平红球菌XH-1产海藻糖脂的培养条件优化及理化性质研究[J].中国酿造,2023,42(6):204-211.
[21] LIU Y, WU Z, ZENG X, et al.A novel cold-adapted phospho-betagalactosidase from Bacillus velezensis and its potential application for lactose hydrolysis in milk[J].Int J Biol Macromol,2021,166(3):760-770.
[22]许慧.地衣芽孢杆菌BF-002高产芽孢的氮源流加工艺研究[D].无锡:江南大学,2023.
[23]杜丽红,郝亚男,陈宁,等.有机氮源及其在微生物发酵中的应用[J].发酵科技通讯,2019,48(1):1-4.
[24]黄海洪,贺莉,类延菊,等.一株芽孢杆菌在低氮源浓度培养基中的生长与氨氮去除特性[J].环境科学学报,2018,38(1):183-192.
[25] ELYASI FAR B, DILMAGHANI A, YARI KHOSROUSHAHI A.In Silico study and optimization of Bacillus megaterium alpha-amylases production obtained from honey sources[J].Curr Microbiol,2020,77(10):2593-2601.
[26] BHATT K, LAL S, R S, et al.Bioconversion of agriculture wastes to produce α-amylase from Bacillus velezensis KB 2216: Purification and characterization[J].Biocatal Agr Biot,2020,28(101):70-75.
[27]陈尚里,于福田,沈圆圆,等.高产抗菌脂肽Fengycin芽孢杆菌的诱变育种和发酵条件优化[J].食品工业科技,2023,44(23):134-143.
[28]秦立芹,马景浩,李二浩,等.一株源于北派酱香白酒酿造环境中产淀粉酶细菌的筛选、鉴定及其特性研究[J].中国酿造,2021,40(11):154-160.