传统发酵食品大多以自然发酵为主,在长期发酵过程中引入了环境中的多种微生物,这些微生物菌群利用原料中的营养成分通过多种代谢途径改变产品的品质,激发独特风味[1]。但这些微生物复杂多变,随环境条件改变而发生动态变化,产品可能存在致病菌污染问题。
蜡样芽孢杆菌(Bacillus cereus)是一种食源性条件致病菌,通过产生腹泻型或呕吐型毒素影响人体健康[2-4]。目前研究表明,腐乳、豆酱等发酵食品中普遍存在蜡样芽孢杆菌污染,其中腐乳的污染率较高,并有超出限量标准的报道,具有食品安全隐患[5-7],但对于传统发酵食品毛豆腐、辣椒酱和酸汤中是否有蜡样芽孢杆菌污染尚鲜见报道。毛豆腐和腐乳的前期发酵工艺相近[8],均是豆浆经自然发酵的酸浆水凝乳压榨制成豆腐[9],再接种毛霉[10]发酵而成。如果原料、环境中有蜡样芽孢杆菌则可在发酵过程中大量繁殖而带来污染风险。此外,虽然目前关于辣椒酱产品污染蜡样芽孢杆菌的报道较少,但有报道表明新鲜辣椒、干辣椒、辣椒粉中存在蜡样芽孢杆菌污染,且分离菌株大多携带腹泻型毒力基因[11-13]。酸汤因发酵原料差异,分为白酸汤和红酸汤两种[14]。白酸汤的主要发酵基质为米汤,从成熟老酸汤中接种乳杆菌属、明串珠菌属、醋酸杆菌属等微生物菌群[15-17];而红酸汤的主要发酵基质为糯米、番茄、辣椒,优势菌群为乳杆菌属、德克酵母属、酿酒酵母属和毕赤酵母属等[18-19]。酸汤中的蜡样芽孢杆菌污染问题少见报道。传统发酵食品的蜡样芽孢杆菌污染问题应当引起重视,不管是原料中携带蜡样芽孢杆菌,还是发酵过程中环境引入蜡样芽孢杆菌,都可能导致终产品的污染菌数超过安全限量,消费者摄入后容易引发食品安全问题。
国内外相关研究显示,蜡样芽孢杆菌污染多发生在淀粉类食物、豆类制品、肉类制品、乳制品等产品中[20],对辣椒酱、酸汤、毛豆腐三类传统发酵食品的关注度较低。因此,本研究针对这三类产品,探究其蜡样芽孢杆菌污染状况,研究样品分离菌株的生理生化特征、毒力基因和多样性,以期为传统发酵食品的安全生产提供指导和控制依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
辣椒酱(瓶装密封)(5个样品编号分别为L、S、XP、J、XS)和酸汤(瓶装密封)(4个样品编号分别为MST、ST、YM、3Y)、毛豆腐(塑料盒装)(7个样品编号分别为HW、ML、BCT、LHZ、HA、HZ、HY):市售,低温保存;标准菌株蜡样芽孢杆菌(Bacillus cereus)ATCC14579:广东省微生物保藏中心。
1.1.2 试剂
革兰氏染色液、碱性复红(0.5%):广州环凯生物科技有限公司;硝酸盐还原试剂盒、溶菌酶溶液(0.1%):青岛海博生物技术有限公司;过氧化氢溶液(30%)、甲醇(99%):南京化学试剂有限公司;多粘菌素B硫酸盐(6 000 IU):瑞舒生物科技有限公司;核酸荧光定量染料(P7589):美国Invitrogen公司;聚合酶链式反应(polymerase chain reaction,PCR)Mix、Marker、脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:广州东盛生物科技有限公司。
1.1.3 培养基
甘露醇卵黄多黏菌素琼脂(mannitol yolk polymyxin agar,MYP)培养基、胰蛋白胨大豆肉汤(trypticase soy broth,TSB)培养基、营养琼脂培养基、硫酸锰营养琼脂培养基、血平板:广州环凯生物科技有限公司;脑心浸液肉汤(brain heart infusion broth,BHI)培养基、硝酸盐肉汤培养基、酪蛋白琼脂培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
POGSON-09X无菌均质机:南京普森仪器设备有限公司;SE-CJ-1FD超净工作台:苏州安泰空气技术有限公司;DHP-9052电热恒温培养箱:上海申贤恒温设备厂;MDF-86V340E医用低温冰箱:安徽中科都菱商用电器股份有限公司;XSP-BM-3CA显微镜:上海雷韵试验仪器制造有限公司;TC-96/G/H(b)C基因扩增仪:杭州柏恒科技有限公司;DYCP-31E电泳仪:北京六一生物科技有限公司;BG-gdsAUTO(130)凝胶成像系统:北京百晶生物技术有限公司。
1.3 方法
1.3.1 样品处理
将采集的样品使用灭菌研钵在无菌条件下研磨均匀,分装后液氮速冻,于-80 ℃冰箱保存备用。
1.3.2 蜡样芽孢杆菌的分离与计数
根据国标GB 4789.14—2014《食品安全国家标准食品微生物学检验蜡样芽孢杆菌检验》方法测定样品的污染菌数[21]。每个稀释梯度平行3份。在MYP平板中挑取疑似菌落,在营养琼脂平板划线分离,重复操作4~5次,直至获得单菌落。BHI液体培养后,取菌液于25%甘油条件下在-80 ℃冰箱中储存备用。
1.3.3 分离菌株的生理生化鉴定
根据国标GB 4789.14—2014《食品安全国家标准——食品微生物学检验蜡样芽孢杆菌检验》方法进行测定[21]。
1.3.4 分离菌株的毒力基因测定
根据参考文献[22]方法,适当修改。采用PCR方法检测7个肠毒素基因(hblA、hblC、hblD、nheA、nheB、nheC、cytK)、1个潜在毒力基因(entFM)和2个呕吐毒力基因(cesB、EM1)。以蜡样芽孢杆菌ATCC14579为对照菌株,并设置空白对照。
采用DNA提取试剂盒提取分离菌株DNA。分别配制25 μL PCR扩增体系(①hbl、nhe、entFM:提取DNA 2 μL、10 μmol/L引物各1 μL、PCR mix酶10 μL、超纯水11 μL;②cytK:提取DNA 2 μL、100 μmol/L引物各0.2 μL、PCR mix酶12.5 μL、超纯水10.5 μL;③cesB、EM1:提取DNA 2 μL、10 μmol/L引物各2.5 μL、PCR mix酶12.5 μL、超纯水5.5 μL)。根据引物条件(表1)进行PCR扩增。PCR扩增结束后,将PCR产物进行1.5%琼脂糖凝胶电泳,以2 000 bp Marker条带作为对照。
表1 蜡样芽孢杆菌毒力基因测定的引物及测定条件
Table 1 Primers and conditions for the determination of Bacillus cereus virulence genes

毒力基因 引物 寡核苷酸序列(5'-3') 碱基长度/bp退火温度/℃hblA 320 55 hblC 750 58 hbID 430 58 nheA 500 56 nheB 770 54 nheC 583 54 entFM 327 54 cytK 238 55 cesB hblA-F hblA-R hblC-F hblC-R hbID-F hblD-R nheA-F nheA-R nheB-F nheB-R nheC-F nheC-R entFM-F entFM-R cytK-F cytK-R cesB-F cesB-R GTGCAGATGTTGATGCCGAT ATGCCACTGCGTGGACATAT AATGGTCATCGGAACTCTAT CTCGCTGTTCTGCTGTTAAT AATCAAGAGCTGTCACGAAT CACCAATTGACCATGCTAAT TACGCTAAGGAGGGGCA GTTTTTATTGCTTCATCGGCT CTATCAGCACTTATGGCAG ACTCCTAGCGGTGTTCC CGGTAGTGATTGCTGGG CAGCATTCGTACTTGCCAA CCACTGCAGTCAAAACCAGC AGGCCCAGCTACATACAACG AAAATGTTTAGCATTATCCGCTGT ACCAGTTGTATTAATAACGGCAATC GGTGACACATTATCATATAAGGTG GTAAGCGAACCTGTCTGTAACAACA 1 271 49
续表
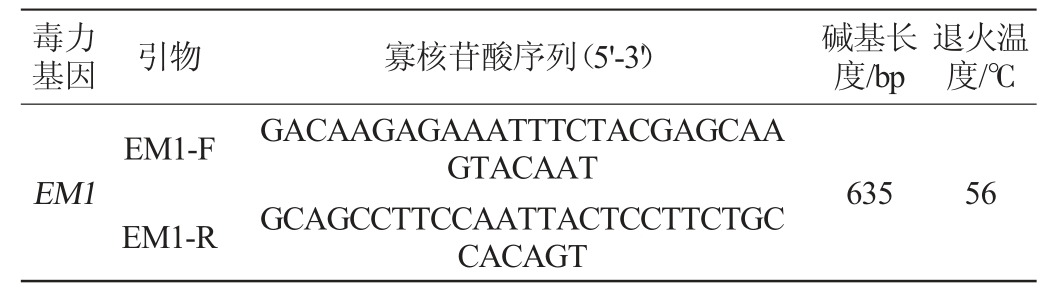
毒力基因 引物 寡核苷酸序列(5'-3') 碱基长度/bp退火温度/℃EM1 EM1-F EM1-R GACAAGAGAAATTTCTACGAGCAA GTACAAT GCAGCCTTCCAATTACTCCTTCTGC CACAGT 635 56
1.3.5 分离菌株的分型
分型采用随机扩增多态性DNA(random amplified polymorphic DNA,RAPD)技术。根据参考文献[23]方法,适当修改。DNA提取方法同1.3.4。配制25 μL体系(提取DNA 1 μL、引物各1 μL、PCR mix酶10 μL、超纯水12 μL)。采用引物HLWL85(序列5'-ACAACTGCTC-3')对细菌基因组DNA进行随机扩增,PCR扩增条件为:94 ℃预变性4 min;94 ℃变性1 min、34 ℃退火2 min、72 ℃延伸2 min,共45个循环;72 ℃再延伸10 min。PCR扩增结束后,将PCR产物进行1.5%琼脂糖凝胶电泳,分离扩增片段。
1.3.6 数据处理
数据分析使用Excel 2019、Origin 2018等软件。RAPD电泳条带经NTedit 软件识别转化为0/1矩阵,采用NTSYS PC 2.1软件计算遗传距离,使用MRGA11软件算术平均值未加权对组方法(UPGMA)绘图。
2 结果与分析
2.1 辣椒酱、酸汤和毛豆腐中蜡样芽孢杆菌的污染菌数
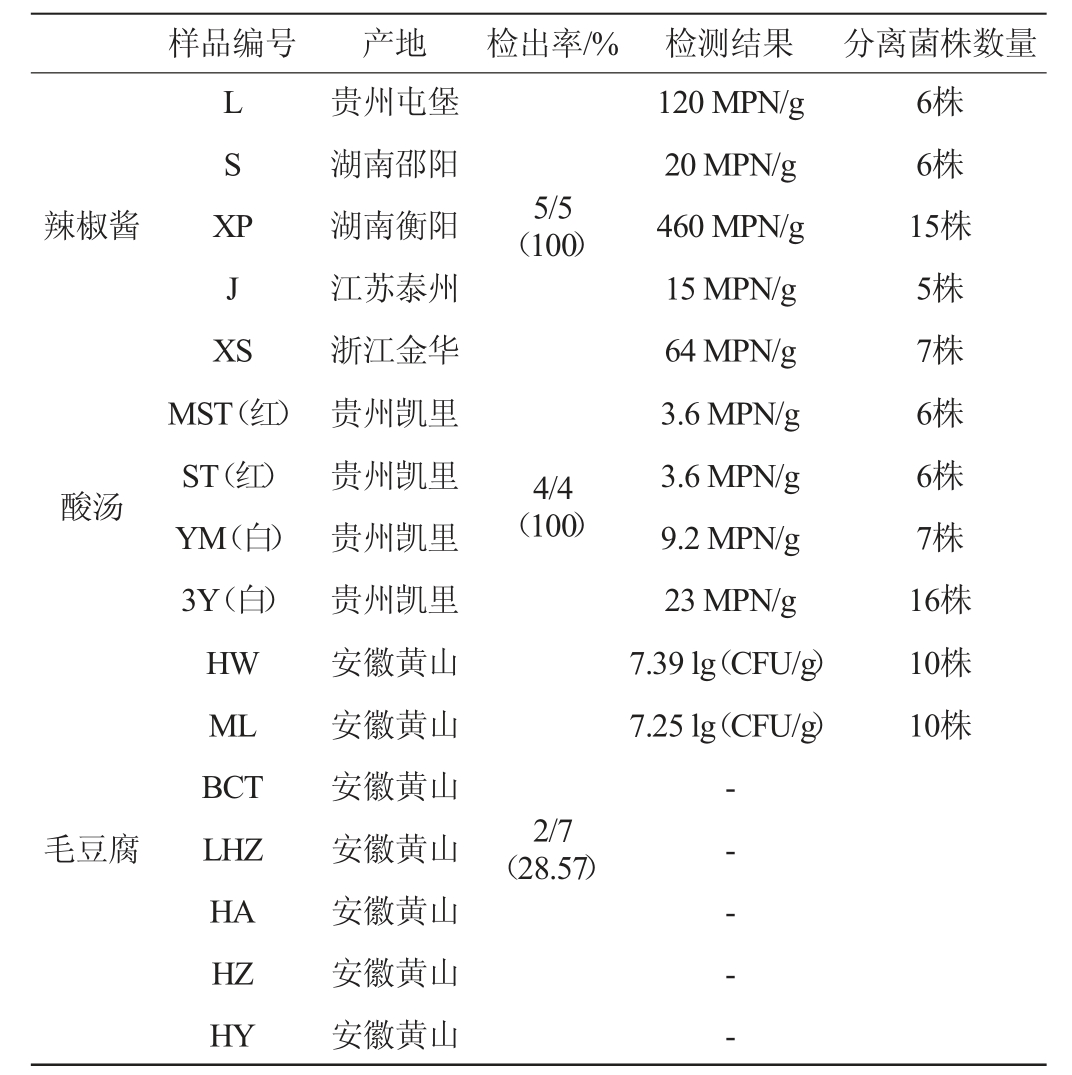
3类传统发酵食品的污染状况及菌株分离情况见表2。
表2 三类传统发酵食品中蜡样芽孢杆菌的污染状况
Table 2 Contamination status of Bacillus cereus in three types of traditional fermented food
注:“-”表示未检出。
样品编号 产地 检出率/% 检测结果 分离菌株数量辣椒酱LSX P J X S 5/5(100)酸汤4/4(100)120 MPN/g 20 MPN/g 460 MPN/g 15 MPN/g 64 MPN/g 3.6 MPN/g 3.6 MPN/g 9.2 MPN/g 23 MPN/g 7.39 lg(CFU/g)7.25 lg(CFU/g)6株6株15株5株7株6株6株7株16株10株10株毛豆腐MST(红)ST(红)YM(白)3Y(白)HW ML BCT LHZ HA HZ HY贵州屯堡湖南邵阳湖南衡阳江苏泰州浙江金华贵州凯里贵州凯里贵州凯里贵州凯里安徽黄山安徽黄山安徽黄山安徽黄山安徽黄山安徽黄山安徽黄山2/7(28.57)-- - - -
由表2可知,5个辣椒酱样品中蜡样芽孢杆菌的检出率为100%,污染菌数在15~460 MPN/g之间,污染菌数较低,与已有报道基本一致。向婧姝等[24]检测了贵阳市的120个市售糟辣椒样品,样品中蜡样芽孢杆菌的检出率为55.00%,污染菌数在0~100 CFU/g之间。辣椒酱的生产工艺比较简单,通常是将辣椒洗净晾干后切碎,再按一定比例拌入食盐及切碎的姜、蒜等,装坛密封后进行1~2月的自然发酵而成。虽然辣椒酱的生产过程没有灭菌工序,但原辅料中含有大量的辣椒素、大蒜素、姜辣素和肉桂酸等抑菌成分[25-27],因此对蜡样芽孢杆菌有较好的控制效果。
2个红酸汤和2个白酸汤共4个样品的分析结果显示,酸汤中的蜡样芽孢杆菌检出率为100%,污染菌数在3.6~23 MPN/g之间,污染程度不高。酸汤主要来源于贵州凯里,根据原料不同,有红酸汤、白酸汤两种产品。白酸汤是由糯米经清洗、磨碎后,接种老酸汤,再装坛密封进行自然发酵即为白酸汤而成[28]。红酸汤则是红辣椒、番茄、姜、糯米、木姜子等原料磨碎后放入坛中,再加入白酒、食用盐等进行调味,密封后进行自然发酵,制成半成品,然后再经二次发酵而成熟[15]。通常酸汤在罐装后会进行商业灭菌。酸汤中的优势菌群为乳杆菌属(Lactobacillus)、德克酵母属(Dekkera)等菌群[29-30],而芽孢杆菌属仅占比1%~2%,丰度较低。表明蜡样芽孢杆菌在酸汤样品中并不是优势菌,污染菌数较少。
7个毛豆腐样品的分析结果显示,毛豆腐中蜡样芽孢杆菌污染的情况差异较大。其中,2个购买于夏季(气温28~30 ℃)的样品污染菌数高达7 lg CFU/g,而另外5个购买于秋季(气温18~20 ℃)的样品未检出蜡样芽孢杆菌。这可能与购买样品期间的气温不同或商家运输产品的方式有关。蜡样芽孢杆菌的最适生长温度为30 ℃,夏季的温度更有利于其生长繁殖,而运输途中如果温度升高,也会加速菌株繁殖的速度。
为了获得蜡样芽孢杆菌更为详细的信息,进一步从以上样品的MYP平板上挑取了单菌落,经分离纯化,获得了94个分离菌株。其中,辣椒酱来源分离菌株39株、酸汤来源分离菌株35株、毛豆腐来源分离菌株20株。由于蜡样芽孢杆菌、苏云金芽孢杆菌、炭疽芽孢杆菌同属于蜡样芽孢杆菌族(Bacillus cereus sensu lato),许多表型特征及16S基因序列的同源性较高[32]。因此,需要进一步通过生理生化特征鉴定来判断菌株是否为蜡样芽孢杆菌。
2.2 分离菌株的生理生化鉴定
以蜡样芽孢杆菌ATCC14579为对照菌株,对三类样品分离的94个菌株分别进行了12项生理生化鉴定,结果见图1。
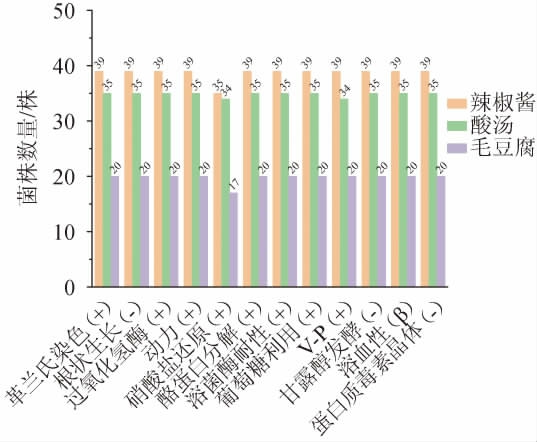
图1 分离菌株的生理生化鉴定结果
Fig.1 Physiological and biochemical identification results of isolated strains
由图1可知,94个菌株均具有完全溶血环,呈β溶血性。其中,86个菌株显示硝酸盐还原反应呈阳性,93个菌株显示VP反应呈阳性。说明大部分菌株具有硝酸盐还原能力,可将硝酸盐还原为亚硝酸盐、氨或氮气等物质,且在糖代谢过程中能分解葡萄糖生成丙酮酸,与发酵豆制品中的蜡样芽孢杆菌生理生化特性一致[5]。所有菌株均符合蜡样芽孢杆菌的生理生化特征。
2.3 蜡样芽孢杆菌分离菌株的毒力基因谱
蜡样芽孢杆菌可产生腹泻型或呕吐型毒素。肠毒素hbl、肠毒素nhe、肠毒素entFM、细胞毒素cytK是引起腹泻性疾病最主要的毒力因子,通过使细胞成孔作用引起疾病[2,4]。引起呕吐疾病的毒素主要是环状十二肽Cereulide,cesB与EM1是合成该毒素的相关基因,通过与5-HT3受体靶向结合刺激迷走神经引起疾病[3]。蜡样芽孢杆菌分离菌株的毒力基因谱结果见表3。
表3 分离菌株的毒力基因谱
Table 3 Virulence gene profile of isolated strains
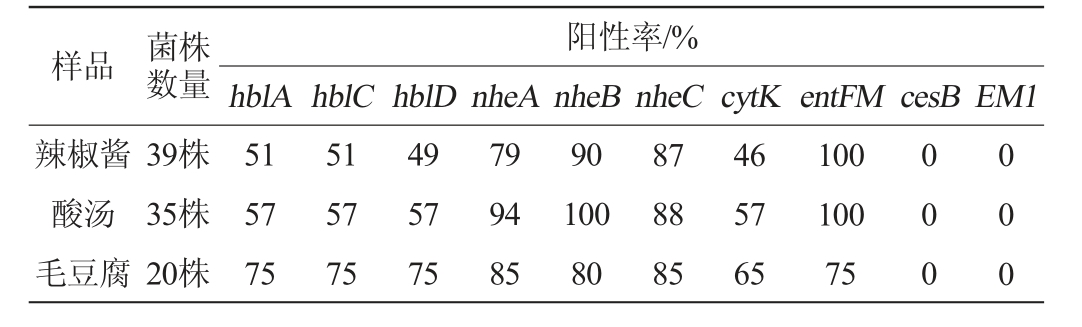
样品 菌株数量阳性率/%hblA hblC hblD nheA nheB nheC cytK entFM cesB EM1辣椒酱酸汤毛豆腐39株35株20株51 57 75 51 57 75 49 57 75 79 94 85 90 100 80 87 88 85 46 57 65 100 100 75 0 0 0 0 0 0
由表3可知,94个分离菌株都具有腹泻型毒力基因,且所有菌株均无呕吐毒素相关的合成基因。其中,5个辣椒酱样品分离的39个菌株的毒力基因nheA(79%)、nheB(90%)、nheC(87%)、entFM(100%)的阳性率较高,与向婧姝等[24]所述结果一致。4个酸汤样品分离的35个菌株的毒力基因及nheA(94%)、nheB(100%)、nheC(88%)、entFM(100%)阳性率较高,与辣椒酱样品检测结果一致。而2个毛豆腐样品分离的20个菌株的毒力基因肠毒素hbl、nhe及entFM阳性率均较高,与发酵豆制品中的蜡样芽孢杆菌的毒力基因阳性率较相似[5]。
蜡样芽孢杆菌的毒力基因谱具有样品差异性,大多分离菌株具有多重腹泻毒力基因。肠毒素容易引发人体腹泻、腹痛等症状,应当同时关注污染菌数及毒素产生量,预防食品中毒事件发生。粮食加工制品中容易存在呕吐型蜡样芽孢杆菌污染问题,尤其是米饭及其制品(米饭、米糕、米粉等),而辣椒酱、酸汤、毛豆腐产品的生产发酵环境并不适宜呕吐型蜡样芽孢杆菌生长。
2.4 分离菌株的RAPD分型
将94个分离菌株进行RAPD分型,结果见图2。由图2可知,94株菌株按聚类分析结果划分A、B、C三大集群。A集群主要是辣椒酱样品分离的菌株,B集群主要是辣椒酱样品和白酸汤样品分离的菌株,C集群主要是红酸汤样品和毛豆腐样品分离的菌株。同一种类样品的菌株聚类在同一集群中,说明蜡样芽孢杆菌的多样性与样品差异性有关。辣椒酱样品分离菌株多样性较强,不同样品分离的菌株相似度较低,分布在不同的集群。红酸汤样品和白酸汤样品分离菌株的相似度较低,说明酸汤的原料、发酵条件差异可能导致污染的蜡样芽孢杆菌不同。
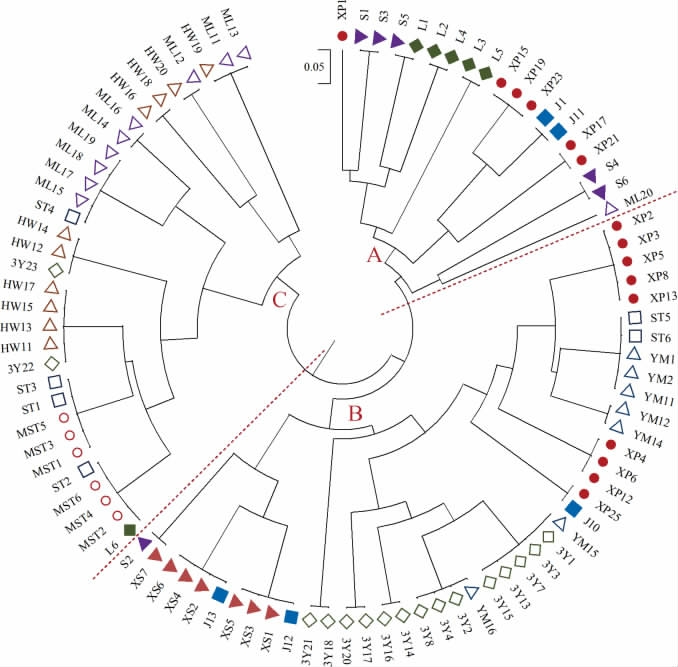
图2 分离菌株的RAPD模式树状图
Fig.2 RAPD pattern tree diagram of isolated strains
3 结论
本实验研究了辣椒酱、酸汤、毛豆腐三类传统发酵食品的蜡样芽孢杆菌污染状况,并分析了样品分离菌株的生理生化特征、毒力基因和多样性。辣椒酱样品和酸汤样品的蜡样芽孢杆菌的检出率均为100%,但污染菌数不高,菌数在3.6~460 MPN/g之间。毛豆腐样品的蜡样芽孢杆菌的检出率为28.57%,其中夏季样品的蜡样芽孢杆菌菌数在7.25~7.39 lg(CFU/g)之间,秋季样品经GB 4789.14—2014《蜡样芽孢杆菌检验》中的第一法及第二法均未检出。毛豆腐样品的蜡样芽孢杆菌污染菌数差异较大,可能与样品发酵条件、运输方式有关,需要实地采样并进行季节性分析。
从辣椒酱、酸汤和毛豆腐样品中分离获得94个菌株,经生理生化鉴定均具有蜡样芽孢杆菌(Bacillus cereus)特征。毒力基因分析显示,来自于辣椒酱样品和酸汤样品的74个分离菌株的毒力基因均为腹泻型,其中肠毒素nhe及entFM阳性率较高;来自于毛豆腐样品的20个分离菌株,毒力基因均为腹泻型,其中肠毒素hbl、nhe及entFM阳性率较高。RAPD分型结果显示,蜡样芽孢杆菌的多样性与样品差异性有关。辣椒酱样品的分离菌株多样性较强,不同样品之间具有较大差异。红酸汤样品和白酸汤样品分离菌株的相似度较低,表明酸汤的原料、发酵条件差异可能导致污染的蜡样芽孢杆菌不同,而毛豆腐样品的分离菌株相似度较高。
[1]KARLUND A,GOMEZ-GALLEGO C,KORHONEN J,et al.Harnessing microbes for sustainable development:food fermentation as a tool for improving the nutritional quality of alternative protein sources[J].Nutrients,2020,12(4).1020-1024.
[2] LUND T, GRANUM P E.Characterisation of a non-haemolytic enterotoxin complex from Bacillus cereus isolated after a foodborne outbreak[J].FEMS Microbiol Lett,1996,141(2-3):151-156.
[3]MAGARVEY N A,EHLING-SCHULZ M,WALSH C T.Characterization of the cereulide NRPS alpha-hydroxy acid specifying modules:Activation of alpha-keto acids and chiral reduction on the assembly line[J].J Am Chem Soc,2006,128(33):10698-10699.
[4] LUND T, DE BUYSER M L, GRANUM P E.A new cytotoxin from Bacillus cereus that may cause necrotic enteritis[J].Mol Microbiol,2000,38(2):254-261.
[5]刘琪,陈静,张佩娜,等.发酵豆制品中蜡样芽孢杆菌的调查分析[J].农产品加工,2018(8):56-59.
[6]周婷婷,易敏英,相大鹏,等.白腐乳及其生产过程中蜡样芽孢杆菌的污染及防治[J].中国酿造,2014,33(5):77-80.
[7]WAN H,LIU T,SU C,et al.Evaluation of bacterial and fungal communities during the fermentation of Baixi sufu,a traditional spicy fermented bean curd[J].J Sci Food Agr,2020,100(4):1448-1457.
[8]ZHAO X,ZHENG X.A primary study on texture modification and proteolysis of mao-tofu during fermentation[J].Afr J Biotechnol,2009,8(10):2294-2300.
[9] YAN S, LIU H, ZHANG J, et al. Lactobacillus delbrueckii is the key functional microorganism of natural fermented tofu sour water involved in the traditional coagulation of Chinese Huizhou Mao-tofu[J].LWTFood Sci Technol,2020,doi:10.1016/j.lwt.2020.109706.
[10]YAN S,DONG D.Main parameters and the dynamics of volatile compounds during the fermentation of Chinese Mao-tofu from Huangshan region[J].Food Sci Biotechnol,2019,28(5):1315-1325.
[11]CHOO E,JANG S S,KIM K,et al.Prevalence and genetic diversity of Bacillus cereus in dried red pepper in Korea[J].J Food Protect,2007,70(4):917-922.
[12]OH S-W,KOO M,KIM H J.Contamination patterns and molecular typing of Bacillus cereus in red pepper powder processing[J].J Korean Soc Appl Biol Chem,2012,55(1):127-131.
[13]KIM S K,KIM K-P,JANG S S,et al.Prevalence and toxigenic profiles of Bacillus cereus isolated from dried red peppers, rice, and sunsik in Korea[J].J Food Protect,2009,72(3):578-582.
[14]袁野,李云成,孟凡冰,等.贵州红酸汤研究进展[J].粮食与油脂,2022,35(6):19-23.
[15]万宁威,雷帮星,李彪,等.白酸汤发酵过程中微生物多样性及有机酸动态变化研究[J].食品与发酵工业,2022,48(9):65-70.
[16]王琪琪,田界先,潘宗东,等.基于Illumina MiSeq分析贵州凯里酸汤独特风味的优势菌群[J].食品与发酵工业,2020,46(14):40-47.
[17]肖甜甜,冯子娟,邱树毅,等.苗家白酸汤中微生物群落多样性研究及其优势微生物的筛选[J].食品与发酵科技,2021,57(1):1-11,45.
[18]何扬波,李国林,李咏富,等.红酸汤发酵过程中微生物区系及挥发性物质组成变化分析[J].食品工业科技,2022,43(19):177-190.
[19]LIN L J,DU F M,ZENG J,et al.Deep insights into fungal diversity in traditional Chinese sour soup by Illumina MiSeq sequencing[J].Food Res Int,2020,137(1):137-139.
[20] JESSBERGER N, DIETRICH R, GRANUM P E, et al.The Bacillus cereus food infection as multifactorial process[J].Toxins,2020,12(11):701-703.
[21]国家卫生和计划生育委员会.GB 4789.14—2014 食品安全国家标准食品微生物学检验蜡样芽孢杆菌检验[S].北京:中国标准出版社,2014.
[22]YIM J H,KIM K Y,CHON J W,et al.Incidence,antibiotic susceptibility,and toxin profiles of Bacillus cereus sensu lato isolated from Korean fermented soybean products[J].J Food Sci,2015,80(6):1266-1270.
[23] HALL A, GRIFFITHS H, SALTMARSH M, et al.Profiling Bacillus cereus populations in a traditional style, hot-drinks vending machine and vended hot chocolate drink using polymerase chain reaction (PCR)and random amplified polymorphic DNA (RAPD) techniques[J].Food Control,2012,27(1):127-131.
[24]向婧姝,周藜,周倩,等.贵阳市市售糟辣椒微生物污染状况调查分析[J].食品安全质量检测学报,2020,11(24):9371-9376.
[25]JIN Z,LI L,ZHENG Y,et al.Inhibition of Bacillus cereus by garlic(Allium sativum) essential oil during manufacture of white sufu, a traditional Chinese fermented soybean curd[J].LWT-Food Sci Technol,2020,130(1):130-133.
[26]DORANTES L,COLMENERO R,HERNANDEZ H,et al.Inhibition of growth of some foodborne pathogenic bacteria by Capsicum annum extracts[J].Int J Food Microbiol,2000,57(1-2):125-128.
[27]HU X,SARAVANAKUMAR K,JIN T,et al.Effects of yellow and red bell pepper(paprika)extracts on pathogenic microorganisms,cancerous cells and inhibition of survivin[J].J Food Sci Technol, 2021, 58(4):1499-1510.
[28]石庆楠,刘桂琼,张建炀.凯里白酸汤的研究进展[J].黑龙江粮食,2021(10):98-99.
[29]王若曦.贵州省传统发酵酸汤中的微生物群落结构特征及功能微生物的发掘[D].昆明:昆明理工大学,2021.
[30]管庆林,周笑犁,赵姗,等.番茄自然发酵液中酵母菌的分离鉴定及其特性研究[J].食品工业科技,2021,42(3):96-100,7.
[31]张继辉,赵丹丹.传统发酵毛豆腐的研究进展[J].现代食品,2022,28(20):32-36.
[32] ASH C, FARROW J A, DORSCH M, et al.Comparative analysis of Bacillus anthracis, Bacillus cereus, and related species on the basis of reverse transcriptase sequencing of 16S rRNA[J].Int J Syst Bacteriol,1991,41(3):343-346.