复合微生物菌剂是一种具有多种功能的生物活菌制剂,其不仅可以分泌抑菌物质防治植物病害,还可以通过溶磷、固氮、解钾等特性,提升土壤养分,提高作物产量[1-2]。由于农田环境复杂、气候多变,单一菌剂的促生功能难以发挥理想效果[3],而多菌株构建的复合菌剂种类多样、功能齐全、效果良好[4-5]。耐盐碱菌剂可以有效调节细胞生理和分子机制,缓解盐碱对植物的胁迫,改善土壤结构和保水能力,提升土壤有机质,促进植物根系生长[6]。王海霞等[7]研究表明,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)制剂对燕麦炭疽病的田间防治效果高达75.27%,同时促进燕麦株高增加22%,鲜质量增加47%。DENG L等[8]研究表明,采用微生物菌剂和植被联合改良的手段,可以显著提高有机质、碱解氮、速效磷及速效钾含量,促进了紫花苜蓿和黑麦草的生长。因此,耐盐碱、防病、促生菌剂的开发具有广泛的应用价值。
微生物菌剂大面积推广需要具备活性高、储存久的特点,优化发酵条件及培养基成分可以提高菌剂的生物量和活性,降低生产成本[9-10]。不同环境中分离筛选到的微生物对营养成分及生长条件的要求不同,将菌株混合时难以控制培养条件、碳源、氮源等因素。而正交试验将多因素多水平的复杂问题简单化,从而高效筛选出最优条件[11]。李彩联等[12]通过正交试验优化得到高产漆酶菌株的发酵条件为5%接种量、15%通氧量、培养温度30 ℃、培养时间120 h,菌株漆酶活性达9 522 U/g,是优化前的2.06倍。黎燕珊等[13]对贝莱斯芽孢杆菌(Bacillus velezensis)HC-8发酵培养基及发酵条件进行优化,结果表明,在pH 6.0、转速180 r/min、装液量20 mL/300 mL的条件下,菌株HC-8对白粉病菌分生孢子萌发的抑制作用显著提升。CHEN Z M等[14]研究表明,改良培养基成分为16.18 g/L玉米浸膏、17.53 g/L大豆粉、8.14 g/L酵母浸膏时,枯草芽孢杆菌(Bacillus subtilis)孢子数显著提升。
我国盐碱土面积广泛,土壤盐碱化问题日益加剧[15]。同时由尖孢镰刀菌(Fusarium oxysporum)和腐皮镰孢菌(Fusarium solani)引起的根腐病等土传病害导致番茄[16]、辣椒[17]、枸杞[18]等经济作物严重减产。因此,本研究针对前期分离、组合、优化的具有耐盐碱、防病、促生的复合微生物菌剂A8(4%枯草芽孢杆菌F14、6%高地芽孢杆菌MX27、8%高地芽孢杆菌MX38、2%枯草芽孢杆菌MX50、2%解淀粉芽孢杆菌MX66、2%解淀粉芽孢杆菌MX69)为研究对象,采用单因素试验和正交试验对复合微生物菌剂培养基成分及发酵工艺进行优化,以复合菌剂生物量、固氮量、解钾量、溶有机磷量、溶无机磷量和抑菌率为考察指标,采用Topsis综合评价法确定最佳培养条件,以期为新型复合微生物菌剂的生产实际应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
复合菌剂A8(4%枯草芽孢杆菌、6%高地芽孢杆菌、8%高地芽孢杆菌、2%枯草芽孢杆菌、2%解淀粉芽孢杆菌、2%解淀粉芽孢杆菌)、腐皮镰孢菌3-4、尖孢镰刀菌45-3:本实验室保藏。供试菌株特性见表1。
表1 供试菌株特性
Table 1 Characteristics of the tested strain
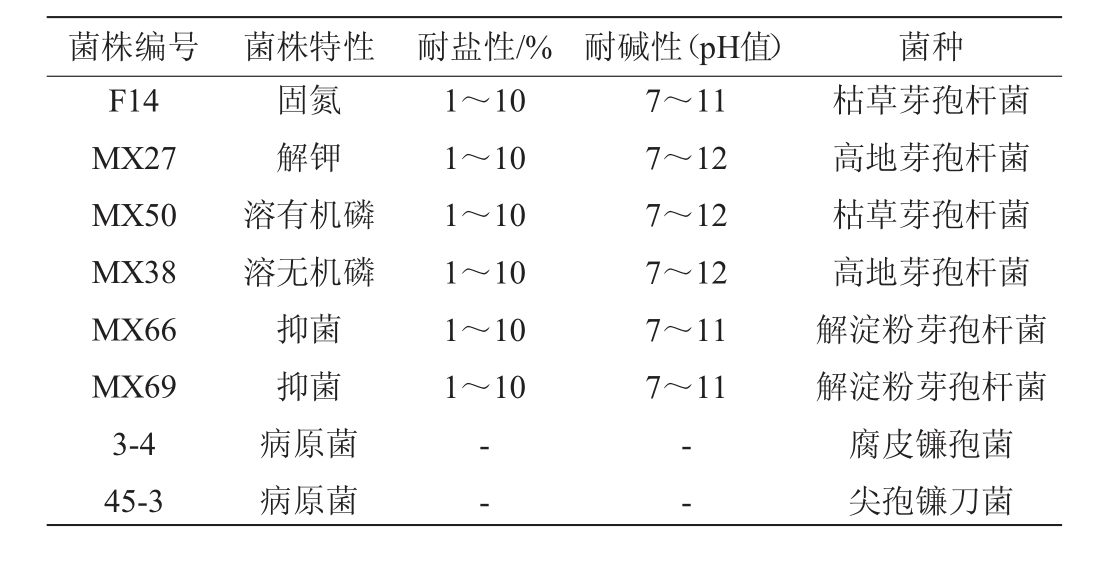
菌株编号 菌株特性 耐盐性/% 耐碱性(pH值) 菌种F14 MX27 MX50 MX38 MX66 MX69 3-4 45-3固氮解钾溶有机磷溶无机磷抑菌抑菌病原菌病原菌1~10 1~10 1~10 1~10 1~10 1~10 7~11 7~12 7~12 7~12 7~11 7~11——枯草芽孢杆菌高地芽孢杆菌枯草芽孢杆菌高地芽孢杆菌解淀粉芽孢杆菌解淀粉芽孢杆菌腐皮镰孢菌尖孢镰刀菌
表2 种子培养基组分优化正交试验因素与水平
Table 2 Factors and levels of orthogonal experiments for seed medium compositions optimization
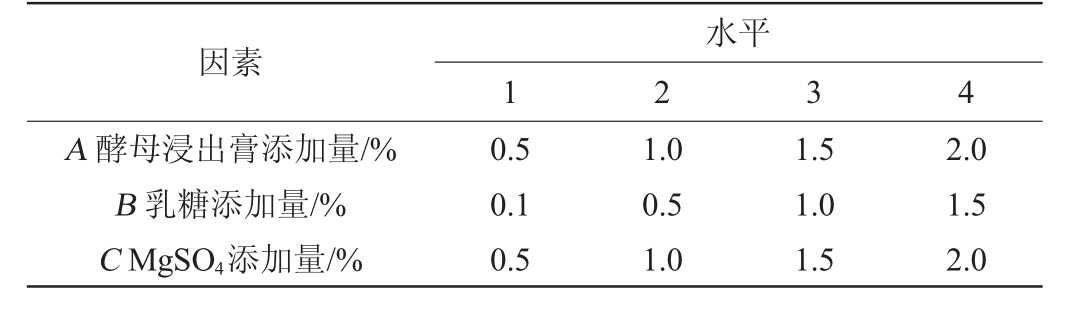
因素A 酵母浸出膏添加量/%B 乳糖添加量/%C MgSO4添加量/%水平1 2 3 4 0.5 0.1 0.5 1.0 0.5 1.0 1.5 1.0 1.5 2.0 1.5 2.0
表3 发酵培养基组分优化正交试验因素与水平
Table 3 Factors and levels of orthogonal experiments for fermentation medium compositions optimization
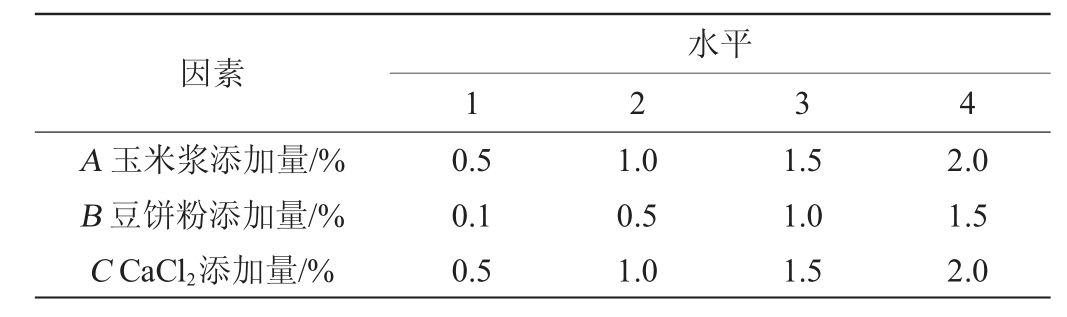
因素A 玉米浆添加量/%B 豆饼粉添加量/%C CaCl2添加量/%水平1 2 3 4 0.5 0.1 0.5 1.0 0.5 1.0 1.5 1.0 1.5 2.0 1.5 2.0
1.1.2 试剂
Ca3(PO4)2、NaCl、KCl和MnSO4·4H2O:上海启仁化工有限公司;胰蛋白胨、酵母提取物、CaCO3、(NH4)2SO4、MnSO4、KH2PO4和KNO3:浙江联硕生物科技有限公司;CaCl2·2H2O、MgSO4·7H2O、K2HPO4、NaMoO4·2H2O、NaH2PO4、FeSO4·7H2O、MnSO4·7H2O:武汉卡洛斯科技有限公司;琼脂、蔗糖、酵母粉、钾长石、葡萄糖、酵母膏、牛肉膏、蛋白胨:阿勒山生物科技有限公司;生物素、溴百里酚蓝、孟加拉红、可溶性淀粉、硝酸钾、卵磷脂、链霉素和苹果酸:上海源叶生物科技有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 供试培养基[19]
LB培养基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,NaCl 10.0 g/L,琼脂15~20 g/L,蒸馏水1 000 mL,pH 7.0。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂15~20 g/L,蒸馏水1 000 mL,pH 7.0。
蒙金娜无机磷培养基:葡萄糖10 g/L,(NH4)2SO40.5 g/L,NaCl 0.2 g/L,KCl 0.2 g/L,MgSO4·7H2O 0.03 g/L,MnSO4 0.03 g/L,FeSO4 0.003 g/L,Ca3(PO4)2 5 g/L,酵母膏0.5 g/L,琼脂10 g/L,蒸馏水1 000 mL,pH 7.0。
蒙金娜有机磷培养基:葡萄糖10 g/L,(NH4)2SO40.5 g/L,KCl 0.3 g/L,NaCl 0.3 g/L,FeSO4·7H2O 0.03 g/L,MgSO4·7H2O 0.3 g/L,MnSO4·4H2O 0.03 g/L,Ca3(PO4)2 10 g/L,琼脂粉15~18 g/L,蒸馏水1 000 mL,pH 7.0~7.5。
无氮培养基:苹果酸5 g/L,K2HPO4 0.5 g/L,MgSO4·7H2O 0.2 g/L,CaCl2·2H2O 0.02 g/L,NaCl 0.1 g/L,Na2MoO4·2H2O 0.002 g/L,溴百里酚蓝5 mL/L,KOH 4.5 g/L,生物素10 μg/L,琼脂20 g/L,蒸馏水1 000 mL,pH 7.0。
钾长石培养基:葡萄糖10.0 g/L,钾长石2.5 g/L,Na2HPO4 0.2 g/L,MgSO4·7H2O 0.2 g/L,NaCl 0.2 g/L,CaCO3 5.0 g/L,CaSO4·7H2O 0.1 g/L,琼脂20.0 g/L,蒸馏水1 000 mL,pH 7.0。
所有培养基均于115 ℃蒸汽灭菌20 min。
1.2 仪器与设备
5804R型离心机:德国Eppendorf公司;RXZ型智能人工气候箱、CXZ型智能光照培养箱:宁波江南仪器厂;LabTech型紫外可见分光光度计:北京普析通用仪器有限责任公司;HZQ-F100型全温振荡培养箱:苏州培英实验设备有限公司;SpectraMax Plus384 型单功能光吸收酶标仪:美谷分子仪器(上海)有限公司;Azure C300型化学发光成像系统:美国Azure公司;6400A型火焰光度计:上海精密仪器仪表有限公司;QSY-1型凯氏定氮仪:北京晨曦勇创科技有限公司。
1.3 方法
1.3.1 种子培养基成分优化
单因素试验:将LB培养基中的酵母提取物替换成不同的碳源(0.5%乳糖、0.5%蔗糖、0.5%可溶性淀粉、0.5%麦芽糖)、将胰蛋白胨替换成不同氮源(1%酵母浸出膏、1%NaNO3、1%(NH4)2SO4、1%NH4Cl)、将NaCl替换成不同无机盐(1%CaCl2、1%MgSO4、1%MnSO4、1%CuSO4),每个处理3次重复。在优化的发酵条件下培养后,测定复合菌液的OD600nm值、固氮量、解钾量、溶磷量和抑菌率,测定方法参考许世洋等[20],进行Topsis综合分析,根据综合得分指数(composite score index,CI)确定种子培养基的最佳碳源、氮源和无机盐。
正交试验:根据单因素试验结果,以综合得分指数(CI)为考察指标,以酵母浸出膏添加量(A)、乳糖添加量(B)和MgSO4添加量(C)为考察因素,进行3因素4水平(L16(43))的正交试验设计,确定最佳种子培养基组分。
1.3.2 发酵培养基成分优化
单因素试验:将LB培养基中的酵母提取物替换成不同的碳源(0.5%土豆淀粉、0.5%玉米淀粉、0.5%豆饼粉、0.5%甘露醇)、将胰蛋白胨替换成不同氮源(1%酵母粉、1%玉米浆、1%尿素、1%花生饼粉)、将NaCl替换成不同无机盐(1%CaCl2、1%MgSO4、1%MnSO4、1%CuSO4),每个处理3次重复。在优化的发酵条件下培养后,计算综合得分指数(CI),确定发酵培养基最佳碳源、氮源和无机盐。
正交试验:根据单因素试验结果,以综合得分指数(CI)为考察指标,以玉米浆添加量(A)、豆饼粉添加量(B)和CaCl2添加量(C)为考察因素,进行3因素4水平(L16(43))的正交试验设计,确定最佳发酵培养基成分。
1.3.3 发酵工艺优化
在pH为7、接种量为1%、转速160 r/min、温度30 ℃、发酵时间36 h的基础上[19-20],以综合得分指数(CI)为考察指标,以pH(A)、接种量(B)、转速(C)、培养温度(D)和培养时间(E)为考察因素,进行5因素4水平(L16(45))的正交试验设计,确定最佳发酵工艺,试验因素与水平见表4。
表4 发酵工艺优化正交试验因素与水平
Table 4 Factors and levels of orthogonal experiments for fermentation process optimization
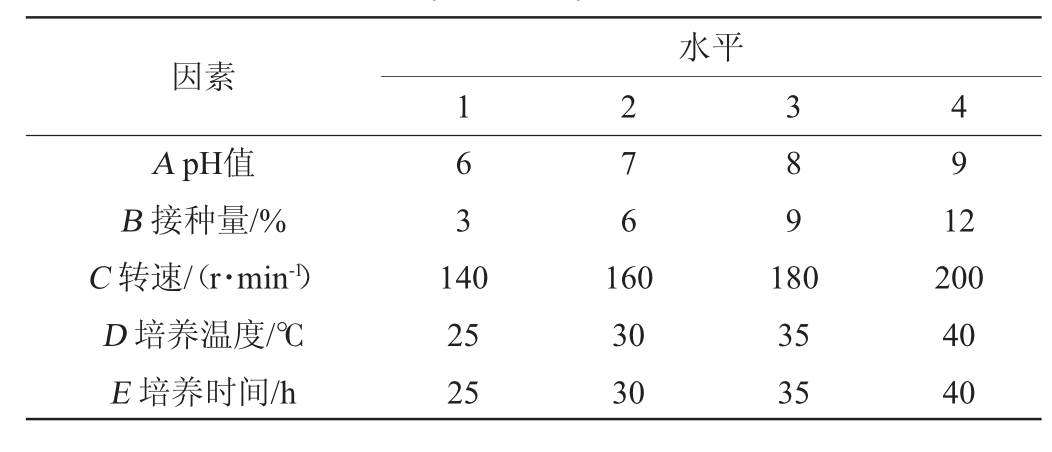
因素A pH值B 接种量/%C 转速/(r·min-1)D 培养温度/℃E 培养时间/h水平1 2 3 4 63 7 6 8 9 9 140 25 25 160 30 30 180 35 35 12 200 40 40
1.3.4 分析检测
菌株生长特性:采用酶标仪测定培养液的OD600nm值[29];固氮量:采用凯氏定氮法测定[20];解钾量:采用火焰光度计法测定[20];溶磷量:采用钼锑抗比色法[20];抑菌率:采用牛津杯法[20]。
1.3.5 数据分析
采用Excel 2016进行原始数据整理,SPSS 24.0进行方差分析,DPS 15.10进行Topsis综合评价分析。
2 结果与分析
2.1 种子培养基优化
2.1.1 碳源的确定
碳源直接影响菌株生长和代谢产物的积累,是菌株生长所需的主要营养物质[21]。种子培养基碳源对各指标的影响见图1。由图1可知,乳糖作为单一碳源时,复合菌系生长浓度、固氮量、溶磷量及抑菌率显著高于其他处理(P<0.05);可溶性淀粉作为单一碳源时,复合菌系解钾量最高,组间差异显著(P<0.05)。由此可见,不同碳源下复合菌系各能力有所差异,究其原因可能与碳源的物理性质及微生物代谢途径的多样性有关[22]。通过Topsis综合分析,乳糖作为单一碳源时,其综合得分指数(CI)为0.92,综合能力最强。因此,选用乳糖为种子培养基碳源。
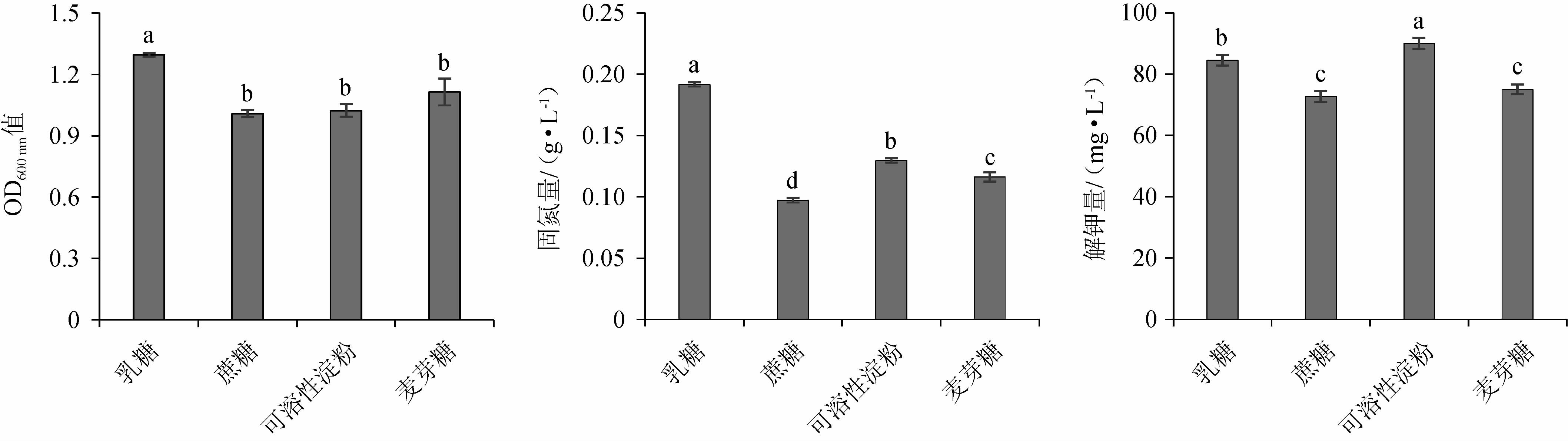
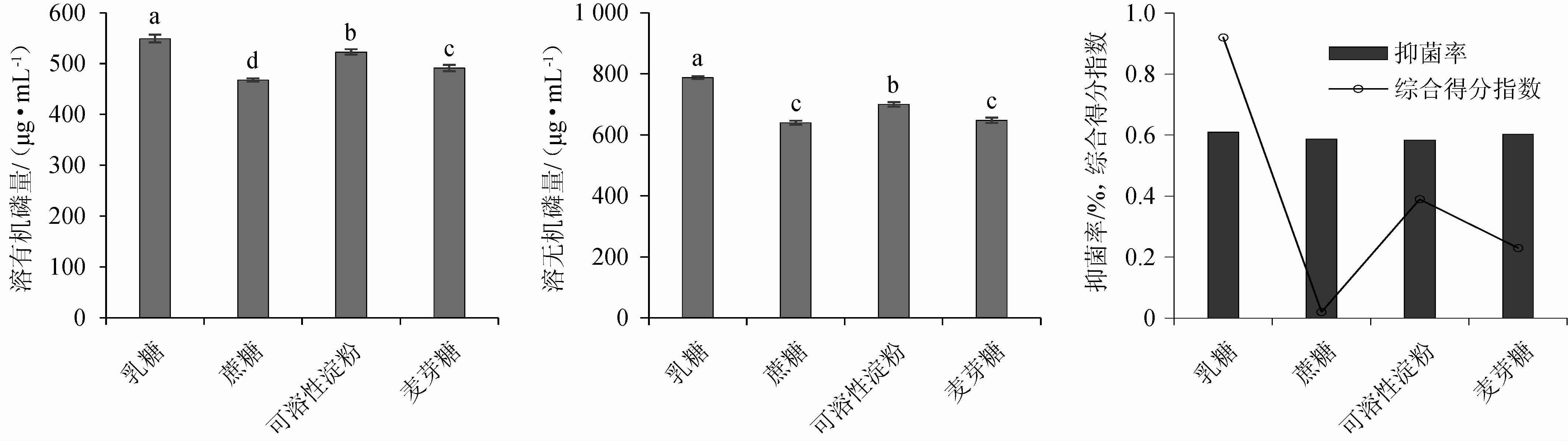
图1 种子培养基中碳源对各指标的影响
Fig.1 Effect of carbon source of seed medium on each indexes
不同小写字母表示差异显著(P<0.05)。下同。
2.1.2 氮源的确定
不同的微生物对氮源的需求不同[23],种子培养基氮源对各指标的影响见图2。由图2可知,以酵母浸出膏作为氮源时,复合菌系固氮量最高,组间差异显著(P<0.05);以NaNO3作为氮源时,复合菌系抑菌率最高;以(NH4)2SO4作为氮源时,复合菌系溶无机磷量最高,但与酵母浸出膏、(NH4)2SO4、NH4Cl组间差异不显著(P>0.05);以NH4Cl作为氮源时,复合菌系OD600nm值、解钾量及溶有机磷量最高,且显著高于其余处理(P<0.05)。通过Topsis综合分析,酵母浸出膏为氮源时,综合得分指数(CI)最高,为0.81,其综合能力最强。由此可见,复合菌系选用有机氮源的效果显著优于无机氮源[24],因此,选用酵母浸出膏为种子培养基氮源。
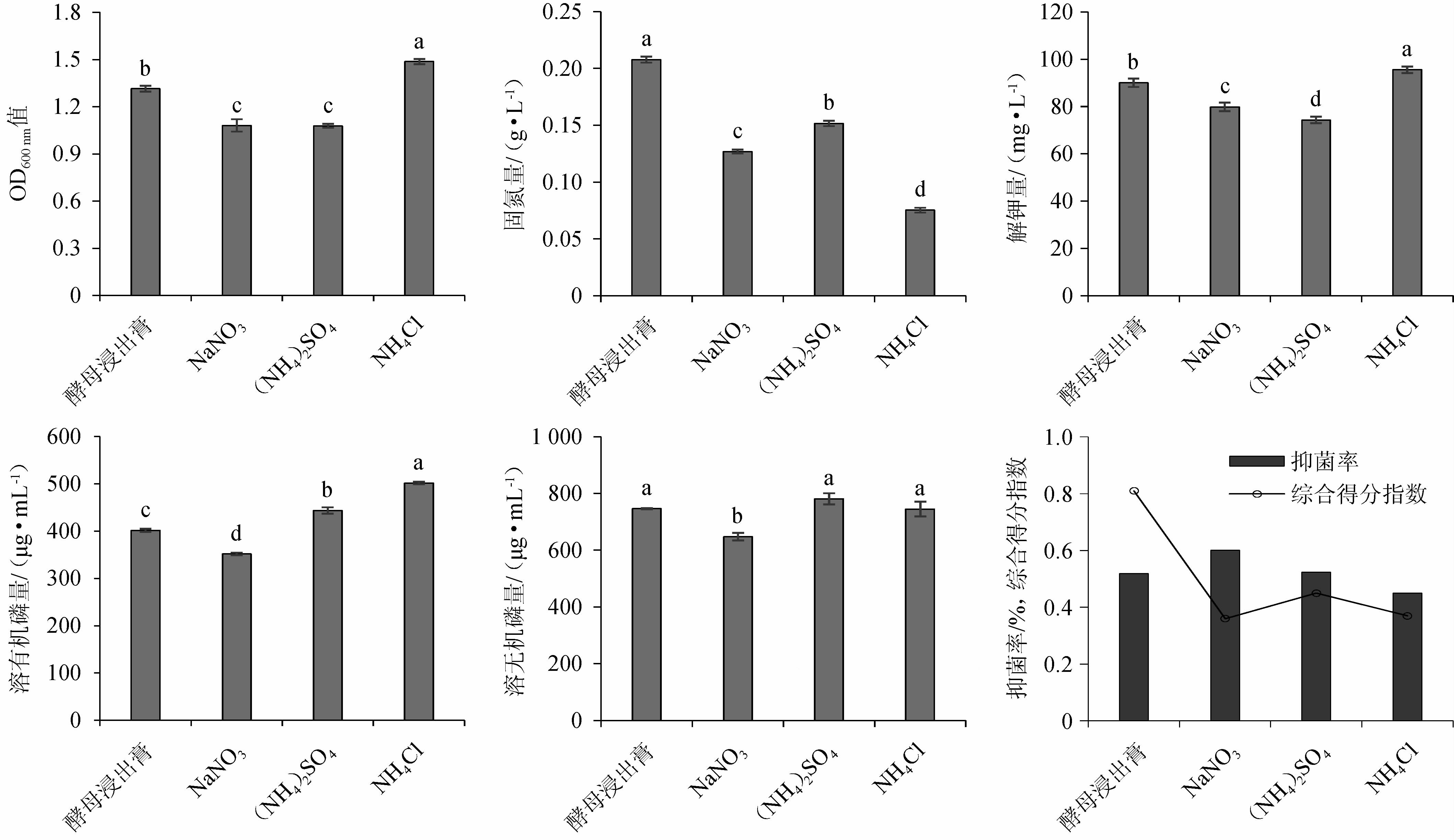
图2 种子培养基氮源对各指标的影响
Fig.2 Effect of nitrogen source of seed medium on each indexes
2.1.3 无机盐的确定
无机盐可以影响孢子的形成,间接影响菌剂功能特性[25],种子培养基氮源对各指标的影响见图3。由图3可知,当无机盐选用MgSO4时,复合菌系OD600nm值、解钾量、溶有机磷量及溶无机磷量高于其他处理;当无机盐选用MnSO4时,复合菌系固氮量高于其他处理,组间差异显著(P<0.05);当无机盐选用CaCl2时,复合菌系抑菌率最高。通过Topsis综合分析,种子培养基无机盐为MgSO4时,综合得分指数(CI)为0.73,其综合能力最强。因此,选用MgSO4为种子培养基无机盐。
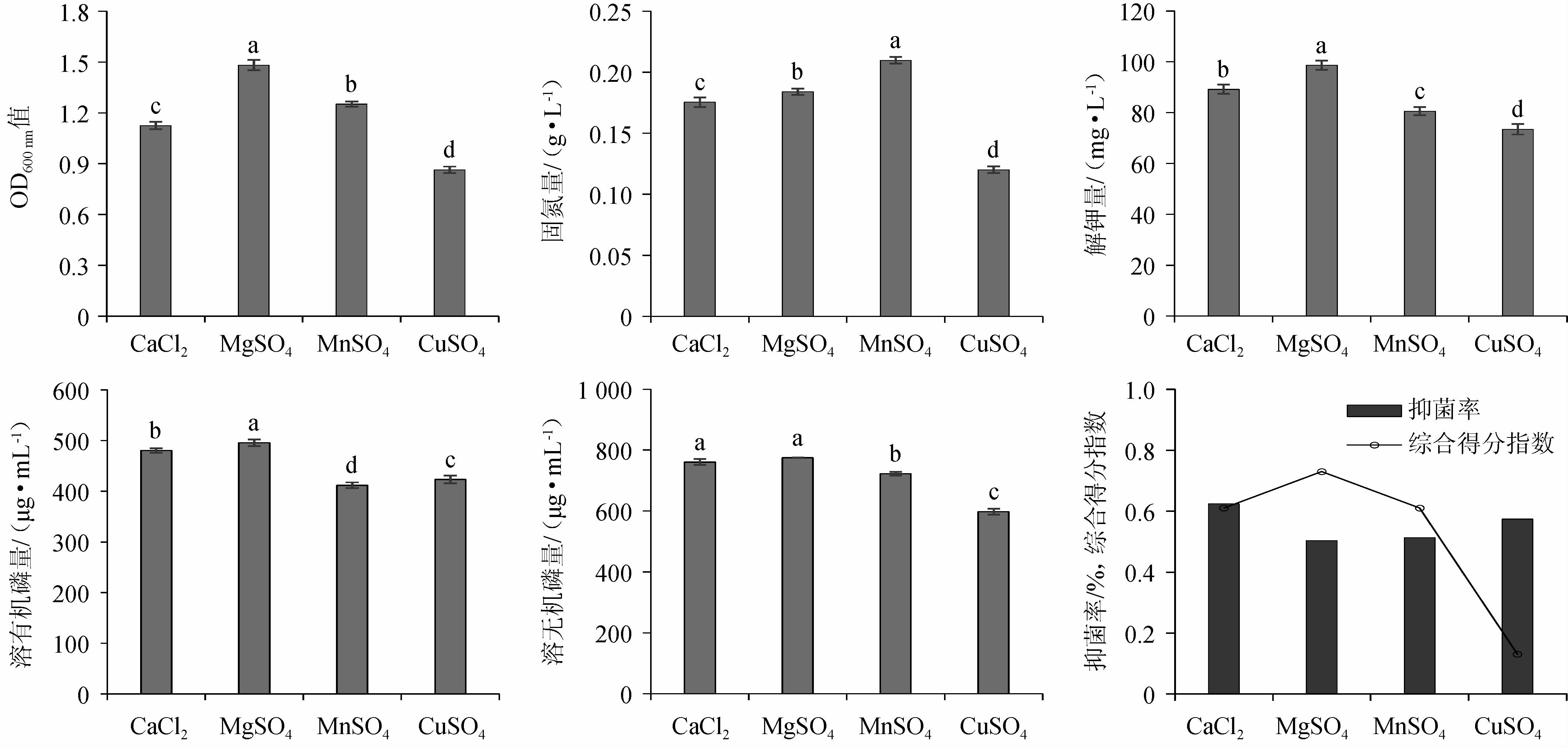
图3 种子培养基无机盐对各指标的影响
Fig.3 Effect of inorganic salot of seed medium on each indexes
2.1.4 种子培养基成分优化正交试验结果
种子培养基各成分含量不同将直接影响发酵液的溶氧量及细胞渗透压失衡,抑制细胞生长[26-27]。种子培养基成分优化正交试验结果与分析见表5。由表5可知,B8处理溶有机磷能力最强,溶磷量高达517.30 μg/mL;B12处理溶无机磷能力最佳,溶磷量高达777.63 μg/mL;B15处理固氮能力最好,固氮量高达0.26 g/L,且解钾能力最强,解钾量高达122.24 mg/L;B16处理生长浓度最高,OD600 nm值达到1.72,且抑菌能力最强,抑菌率高达63.54%。通过Topsis综合分析,B15处理以0.79的综合得分指数(CI)排名第一,其综合能力最强。因此,种子培养基选用2%酵母浸出膏、1%乳糖、1%MgSO4。
表5 种子培养基组分优化正交试验结果与分析
Table 5 Results and analysis of orthogonal experiments for seed medium compositions optimization

注:不同小写字母表示不同试验组间差异显著(P<0.05)。下同。
序号 OD600 nm值 固氮量/(g·L-1) 解钾量/(mg·L-1) 溶有机磷量/(μg·mL-1) 溶无机磷量/(μg·mL-1) 抑菌率/% 综合得分指数B1 B2 B3 B4 B5 B6 B7 B8 B9 B10 B11 B12 B13 B14 B15 B16 1.09±0.02f 1.19±0.02ef 1.33±0.02de 1.67±0.02a 1.06±0.01f 1.62±0.15ab 1.40±0.06cd 1.64±0.05ab 1.07±0.07f 1.43±0.03cd 1.67±0.03a 1.48±0.02bc 1.10±0.03f 1.28±0.10de 1.70±0.03a 1.72±0.02a 0.17±0.002e 0.11±0.002i 0.15±0.001g 0.11±0.002i 0.16±0.001f 0.11±0.002i 0.17±0.001e 0.19±0.002d 0.12±0.002h 0.11±0.002i 0.18±0.002d 0.10±0.002j 0.16±0.002f 0.22±0.001b 0.26±0.001a 0.20±0.002c 92.34±0.77d 86.84±0.87e 108.86±0.79c 113.58±0.78b 77.40±0.69g 83.69±0.33f 71.89±1.36h 78.18±0.15g 79.76±0.79g 54.58±0.57j 70.32±0.79h 109.65±1.36c 67.17±1.36i 70.32±0.39h 122.24±0.47a 87.62±0.39e 372.22±0.38k 434.91±0.33h 453.87±0.19f 455.56±0.68f 371.47±0.50k 494.97±0.19c 429.84±1.13ij 517.30±0.50a 431.34±0.19i 485.96±0.19d 434.16±0.38h 440.17±0.50g 436.04±0.33h 427.97±0.38j 502.85±1.47b 458.75±1.85e 716.07±21.01bc 501.35±0.65fg 630.86±9.66e 709.50±2.12bc 718.69±7.64bc 541.89±3.25ef 684.72±15.74cd 643.06±28.63de 726.95±14.88b 710.81±8.36bc 671.40±4.52cd 777.63±45.54a 576.24±0.65e 646.81±10.53de 528.19±2.46ef 458.00±0.86g 45.59 55.80 55.32 47.31 42.51 43.23 52.36 41.47 58.58 30.04 56.46 52.00 44.81 52.44 59.51 63.56 0.46 0.36 0.53 0.49 0.38 0.36 0.47 0.52 0.41 0.28 0.53 0.48 0.33 0.54 0.79 0.60
2.2 发酵罐培养基优化
2.2.1 碳源优化
发酵培养基中碳源对各指标的影响见图4。由图4可知,甘露醇作为单一碳源时,复合菌系生长浓度最好,组间差异显著(P<0.05);豆饼粉作为单一碳源时,发酵复合菌系固氮、解钾、溶有机磷、溶无机磷能力均优于其他处理,组间差异显著(P<0.05);玉米淀粉作为单一碳源时,发酵复合菌系抑菌特性最优。通过Topsis综合分析,豆饼粉以0.70的综合得分指数(CI)排名第一,其综合能力最强。因此,选用豆饼粉为发酵培养基碳源。
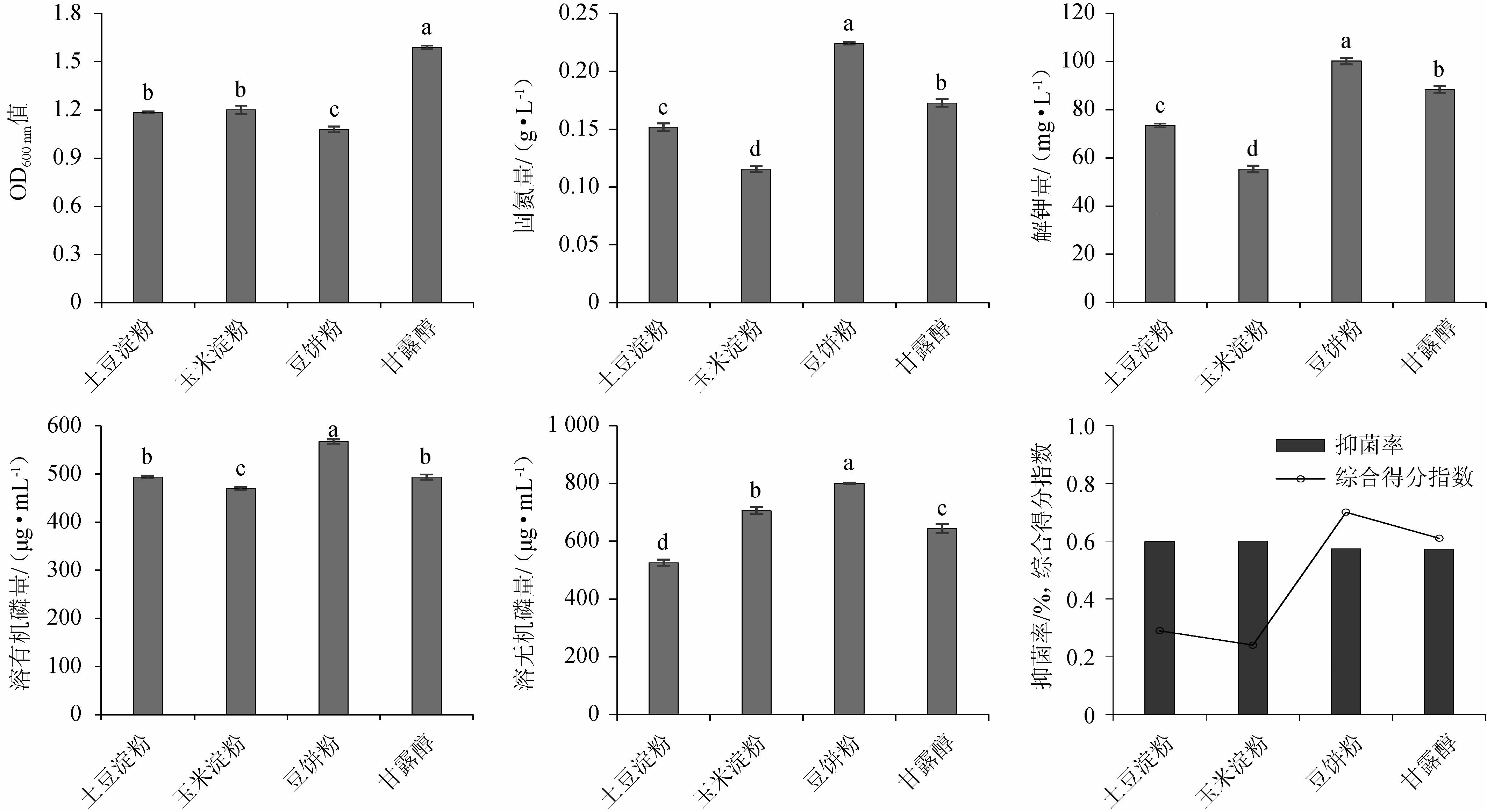
图4 发酵培养基中碳源对各指标的影响
Fig.4 Effect of carbon source of fermentation medium on each indexes
2.2.2 氮源优化
如图5所示,以玉米浆作为氮源时,发酵复合菌系OD600nm值最高,且溶无机磷能力及抑菌功能最优,组间差异显著(P<0.05);以酵母粉作为氮源时,发酵复合菌系固氮量及解钾量最高,组间差异显著(P<0.05);以尿素作为氮源时,发酵复合菌系溶有机磷能力最强,组间差异不显著(P<0.05)。通过Topsis综合分析,玉米浆以0.72的综合得分指数(CI)排名第一,其综合能力最强。因此,选用玉米浆为发酵培养基氮源。
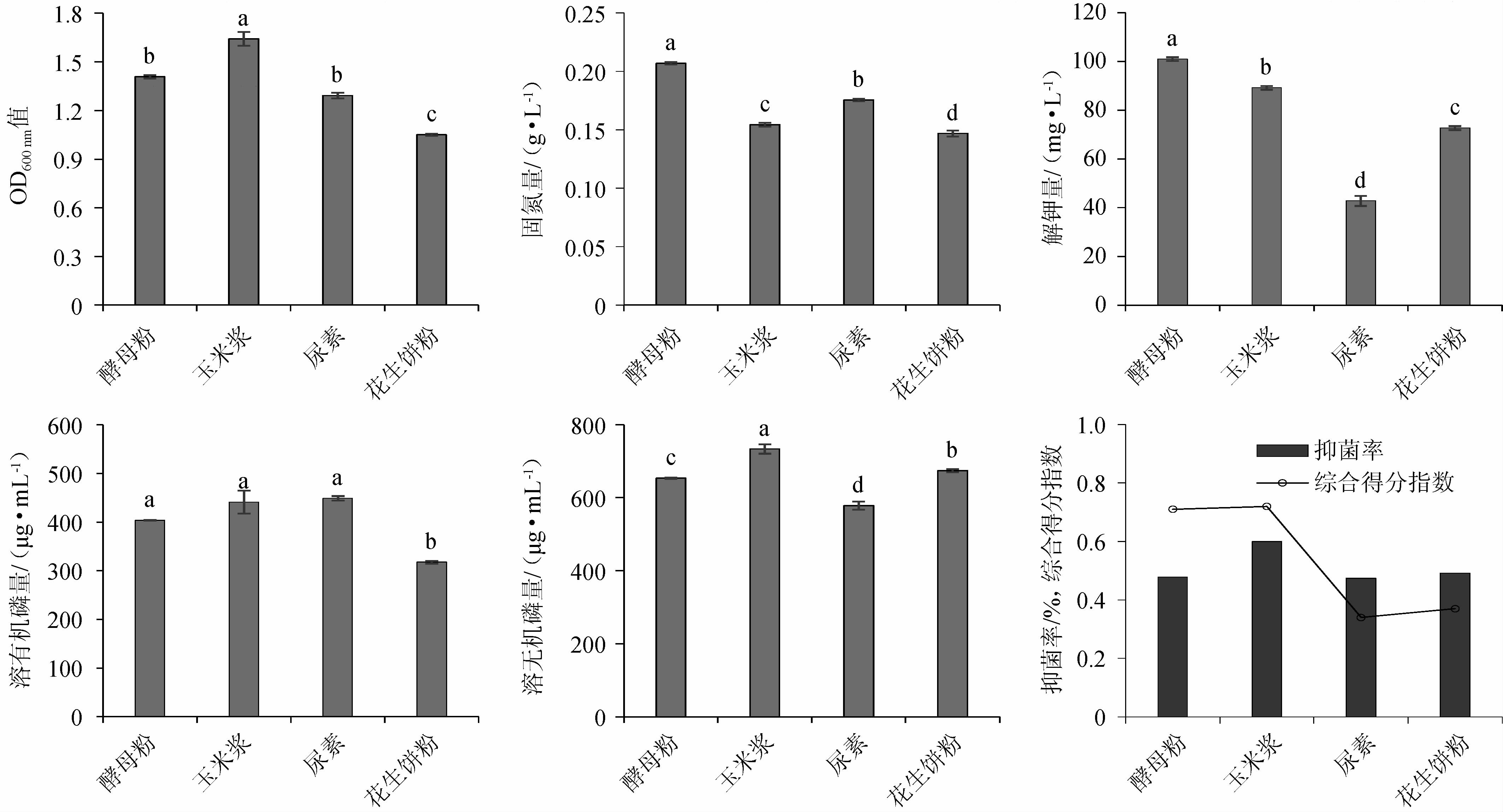
图5 发酵培养基中氮源对各指标的影响
Fig.5 Effect of nitrogen source of fermentation medium on each indexes
2.2.3 无机盐筛选
如图6所示,当无机盐选用MgSO4时,发酵复合菌系OD600 nm值最高,组间差异显著(P<0.05);当无机盐选用CaCl2时,发酵复合菌系固氮、解钾、溶磷及抑菌特性均最优,组间差异显著(P<0.05)。通过Topsis综合分析,CaCl2以0.95的综合得分指数(CI)排名第一,其综合能力最强。因此,选用CaCl2为发酵培养基无机盐。
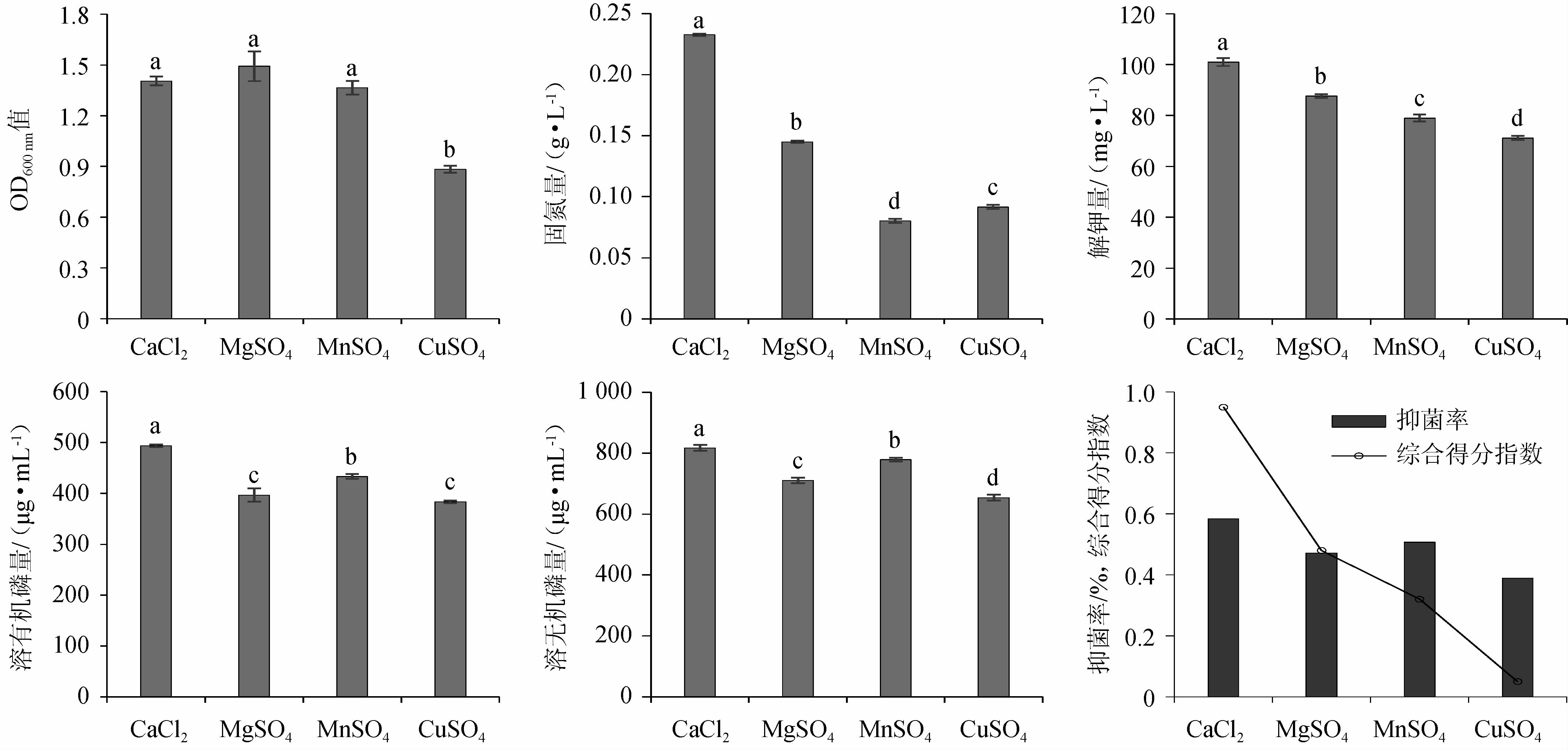
图6 发酵培养基中无机盐对各指标的影响
Fig.6 Effect of inorganic salt of fermentation medium on each indexes
2.2.4 发酵培养基优化正交试验
如表6所示,不同含量的玉米浆、豆饼粉、CaCl2对发酵复合菌系的特性均有影响,各处理之间差异显著(P<0.05)。C9处理固氮能力、溶有机磷、抑菌能力均最好,其固氮量为0.23 g/L,溶磷量为504.54 μg/mL,抑菌率达60.97%;C11处理解钾能力最好,解钾量达105.72 mg/L;C13处理溶无机磷能力最好,溶磷量达728.64 μg/mL;C16处理生长浓度最高,OD600 nm值达到1.77。由此可见,不同含量的玉米浆、豆饼粉、CaCl2对复合菌系特性均有影响,通过Topsis综合分析,C9处理以0.84的综合得分指数(CI)排名第一,其综合能力最强。因此,发酵培养基选用0.1%豆饼粉、1.5%玉米浆、1.5%CaCl2。
表6 发酵培养基组分优化正交试验结果与分析
Table 6 Results and analysis of orthogonal experiments for fermentation medium compositions optimization
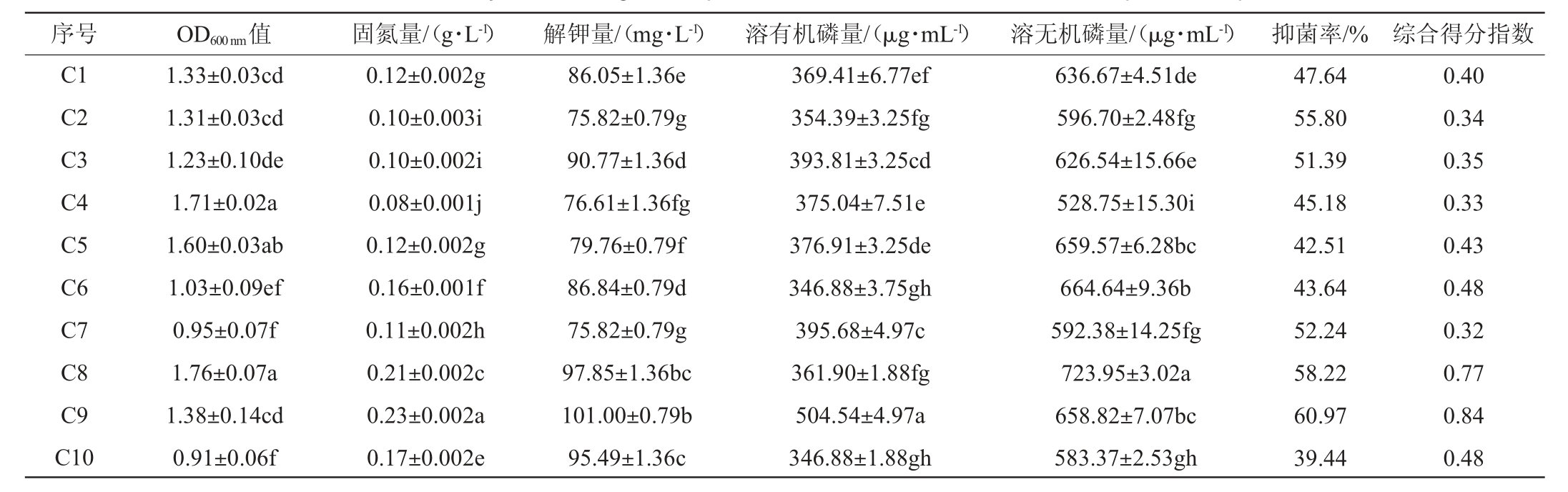
序号 OD600 nm值 固氮量/(g·L-1) 解钾量/(mg·L-1) 溶有机磷量/(μg·mL-1) 溶无机磷量/(μg·mL-1) 抑菌率/% 综合得分指数C1 C2 C3 C4 C5 C6 C7 C8 C9 C10 1.33±0.03cd 1.31±0.03cd 1.23±0.10de 1.71±0.02a 1.60±0.03ab 1.03±0.09ef 0.95±0.07f 1.76±0.07a 1.38±0.14cd 0.91±0.06f 0.12±0.002g 0.10±0.003i 0.10±0.002i 0.08±0.001j 0.12±0.002g 0.16±0.001f 0.11±0.002h 0.21±0.002c 0.23±0.002a 0.17±0.002e 86.05±1.36e 75.82±0.79g 90.77±1.36d 76.61±1.36fg 79.76±0.79f 86.84±0.79d 75.82±0.79g 97.85±1.36bc 101.00±0.79b 95.49±1.36c 369.41±6.77ef 354.39±3.25fg 393.81±3.25cd 375.04±7.51e 376.91±3.25de 346.88±3.75gh 395.68±4.97c 361.90±1.88fg 504.54±4.97a 346.88±1.88gh 636.67±4.51de 596.70±2.48fg 626.54±15.66e 528.75±15.30i 659.57±6.28bc 664.64±9.36b 592.38±14.25fg 723.95±3.02a 658.82±7.07bc 583.37±2.53gh 47.64 55.80 51.39 45.18 42.51 43.64 52.24 58.22 60.97 39.44 0.40 0.34 0.35 0.33 0.43 0.48 0.32 0.77 0.84 0.48
续表
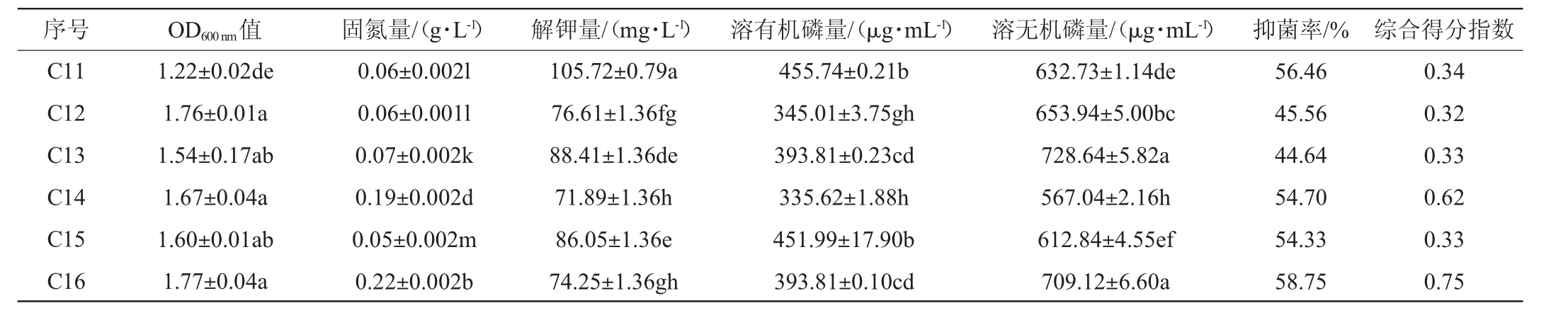
序号 OD600 nm值 固氮量/(g·L-1) 解钾量/(mg·L-1) 溶有机磷量/(μg·mL-1) 溶无机磷量/(μg·mL-1) 抑菌率/% 综合得分指数C11 C12 C13 C14 C15 C16 1.22±0.02de 1.76±0.01a 1.54±0.17ab 1.67±0.04a 1.60±0.01ab 1.77±0.04a 0.06±0.002l 0.06±0.001l 0.07±0.002k 0.19±0.002d 0.05±0.002m 0.22±0.002b 105.72±0.79a 76.61±1.36fg 88.41±1.36de 71.89±1.36h 86.05±1.36e 74.25±1.36gh 455.74±0.21b 345.01±3.75gh 393.81±0.23cd 335.62±1.88h 451.99±17.90b 393.81±0.10cd 632.73±1.14de 653.94±5.00bc 728.64±5.82a 567.04±2.16h 612.84±4.55ef 709.12±6.60a 56.46 45.56 44.64 54.70 54.33 58.75 0.34 0.32 0.33 0.62 0.33 0.75
2.3 发酵条件优化正交试验
微生物发酵过程较为复杂,次级代谢物质的合成容易受温度、pH、转速、接菌量等因素的影响[28]。如表7所示,其中,D1处理溶有机磷能力最强,其溶磷量为553.74 μg/mL;D2处理生长浓度最高,其OD600 nm值为1.06,且溶无机磷能力最强,其溶磷量为822.67 μg/mL;D3处理固氮能力最强,其固氮量为0.24 g/L;D8处理抑菌能力最强,其抑菌率为58.44%;D12处理解钾能力最强,其解钾量为121.45 mg/L。由此可见,复合菌系功能特性在不同的发酵条件下各不相同,究其原因可能与菌剂中各菌株的种属及生存环境有关[29]。通过Topsis综合分析,D3处理的综合得分指数(CI)为0.89,综合能力最强。因此,确定复合菌系的最佳发酵条件为pH 6、接种量9%、转速180 r/min、温度35 ℃、发酵时间35 h。
表7 发酵工艺优化正交试验结果与分析
Table 7 Results and analysis of orthogonal experiments for fermentation process optimization

序号 OD600 nm值 固氮量/(g·L-1) 解钾量/(mg·L-1) 溶有机磷量/(μg·mL-1) 溶无机磷量/(μg·mL-1) 抑菌率/% 综合得分指数D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 D15 D16 0.81±0.007d 1.06±0.046a 1.05±0.008ab 0.78±0.005de 0.92±0.007c 0.88±0.008c 1.03±0.010ab 0.65±0.005g 0.81±0.007d 0.83±0.008d 1.02±0.005ab 0.80±0.006de 0.75±0.002ef 1.00±0.009b 0.61±0.002g 0.72±0.041f 0.07±0.002k 0.14±0.003f 0.24±0.003a 0.13±0.001g 0.06±0.002l 0.20±0.002b 0.08±0.002jk 0.18±0.001d 0.10±0.001i 0.11±0.001h 0.19±0.001c 0.08±0.001j 0.23±0.002a 0.04±0.002m 0.15±0.002e 0.06±0.001l 80.54±0.79g 71.10±2.08h 113.58±0.79b 104.14±0.79c 57.73±1.36i 78.97±1.36g 93.13±1.36e 87.62±0.79f 93.13±1.36e 100.21±1.36d 104.14±0.79c 121.45±1.36a 86.05±1.36f 81.33±1.36g 97.06±0.79d 86.05±1.36f 553.72±2.60a 319.48±5.20ef 504.17±5.20b 292.46±9.38gh 337.50±7.80e 286.45±17.32gh 236.90±3.00i 307.47±1.50fg 393.06±1.50c 482.39±13.03b 235.40±3.97i 272.94±14.32h 193.36±2.60j 304.47±1.50fg 366.03±5.41d 191.85±1.50j 687.54±3.28c 822.67±10.60a 710.53±6.45bc 600.26±2.05fg 619.97±7.29f 650.94±13.41d 605.89±10.23f 624.19±8.69ef 564.60±5.29h 703.96±7.37bc 722.26±14.75b 577.74±2.48gh 606.83±4.48f 704.43±9.24bc 645.78±6.94de 520.03±6.15i 48.23 44.05 56.21 49.46 49.97 47.28 42.81 58.44 49.92 32.64 41.91 42.09 35.13 31.75 45.68 37.68 0.47 0.49 0.89 0.45 0.31 0.55 0.32 0.54 0.43 0.50 0.55 0.36 0.51 0.28 0.50 0.17
3 结论
本研究以具有耐盐碱、防病、促生的复合微生物菌剂为研究对象,通过单因素试验和正交试验对复合微生物菌剂发酵条件、培养基成分及含量进行优化。结果表明,复合微生物菌剂最适种子培养基为2%酵母浸出膏、1%乳糖、1%MgSO4;最适发酵培养基为0.1%豆饼粉、1.5%玉米浆、1.5%CaCl2;最佳发酵条件为pH 6、接种量9%、转速180 r/min、发酵温度35 ℃、发酵时间35 h。此优化培养条件下,复合菌系的OD600nm值为1.38、固氮量为0.23 g/L、解钾量为101.00 mg/L、溶有机磷量为504.54 μg/mL、溶无机磷量为658.82 μg/mL、抑菌率为60.97%。本研究为复合菌系工业化生产及推广提供理论和技术支撑。
[1]OLANREWAJU O S,AYILARA M S,AYANGBENRO A S,et al.Genome mining of three plant growth-promoting Bacillus species from maize rhizosphere[J].Appl Biochem Biotechnol,2021,193(12):3949-3969.
[2] HASAN N, KHAN I U, FARZAND A, et al. Bacillus altitudinis HNH7 and Bacillus velezensis HNH9 promote plant growth through upregulation of growth-promoting genes in upland cotton[J].J Appl Microbiol,2022,132(5):3812-3824.
[3]周静,黄文茂,秦利军,等.四株PGPR菌株混菌发酵体系的构建及促生效应评价[J].生物技术通报,2021,37(4):116-126.
[4] TSUDA K, TSUJI G, HIGASHIYAMA M, et al.Biological control of bacterial soft rot in Chinese cabbage by Lactobacillus plantarum strain BY under field conditions[J].Biol Control,2016,100:63-69.
[5]ROMERA F J,GARCÍA M J,LUCENA C,et al.Induced systemic resistance (ISR) and Fe deficiency responses in dicot plants[J].Front Plant Sci,2019,10:287.
[6]ARORA N K,FATIMA T,MISHRA J,et al.Halo-tolerant plant growth promoting rhizobacteria for improving productivity and remediation of saline soils[J].J Adv Res,2020,26:69-82.
[7]王海霞,郑成忠,东保柱,等.燕麦内生细菌YN-J3的分离鉴定及防病促生作用研究[J].中国生物防治学报,2022,38(2):447-457.
[8]DENG L,WANG T,LUO W,et al.Effects of a compound microbial agent and plants on soil properties,enzyme activities,and bacterial composition of Pisha sandstone[J].Environ Sci Pollut Res, 2021, 28(38): 53353-53364.
[9]王继雯,岳丹丹,赵俊杰,等.两株芽孢杆菌混菌发酵产芽孢条件的优化[J].中国酿造,2017,36(5):95-99.
[10]MANDER P,CHOI Y H,SEONG J H,et al.Statistical optimization of a multivariate fermentation process for enhancing antibiotic activity of Streptomyces sp.CS392[J].Arch Pharmacal Res,2013,36:973-980.
[11]XIA S,LIN R,CUI X,et al.The application of orthogonal test method in the parameters optimization of PEMFC under steady working condition[J].Int J Hydrogen Energy,2016,41(26):11380-11390.
[12]李彩联,郭艳丽,张铁鹰,等.高产漆酶菌株的筛选、鉴定和固态发酵条件优化[J].动物营养学报,2021,33(11):6501-6509.
[13]黎燕珊,崔文艳,张陈芳,等.抗金银花白粉病菌贝莱斯芽孢杆菌HC-8菌株培养基及发酵条件优化[J].南方农业学报,2021,52(8):2148-2157.
[14]CHEN Z M,LI Q,LIU H M,et al.Greater enhancement of Bacillus subtilis spore yields in submerged cultures by optimization of medium composition through statistical experimental designs[J].Appl Microbiol Biotech,2010,85(5):1353-1360.
[15]胡炎,杨帆,杨宁,等.盐碱地资源分析及利用研究展望[J].土壤通报,2023,54(2):489-494.
[16]刘印来,王国动.番茄根腐病的发生与防治[J].吉林农业,2016(8):97.
[17]李盼亮.我国蔬菜根部病原镰孢菌鉴定和新病害发现[D].北京:中国农业科学院,2018.
[18]李捷,冯丽丹,王有科,等.甘肃枸杞镰孢菌根腐病病原鉴定及优势病原菌生物学特性[J].干旱区研究,2017,34(5):1093-1100.
[19]李雪萍,张怡忻,李建军,等.兰州百合防病促生细菌筛选及其效果评价[J].中国生物防治学报,2022,38(5):1296-1307.
[20]许世洋,范雨轩,汪学苗,等.辣椒镰孢根腐病防病促生细菌的筛选及其效应[J].微生物学报,2022,62(7):2735-2750.
[21]上官玲玲,卢慧芳,张辉燕,等.基于响应面法优化谷氨酸棒杆菌发酵条件[J].中国酿造,2023,42(3):202-208.
[22]韦宜慧,陈嘉琪,董玉红,等.杉木人工林土壤溶磷细菌筛选及培养条件优化[J].林业科学研究,2020,33(4):83-91.
[23]AHSAN T,LIANG C,YU S,et al.Screening and optimization of fermentation medium for Bacillus velezensis BP-1 and its biocontrol effects against Peyronellaea arachidicola[J].Appl Sci,2023,13(8):4653.
[24]邱露,彭帅英,李昆太.发酵乳杆菌C6全细胞催化剂的制备及产D-塔格糖催化条件优化[J].中国酿造,2023,42(3):179-186.
[25]TIAN Z,HOU L,HU M,et al.Optimization of sporulation conditions for Bacillus subtilis BSNK-5[J].Processes,2022,10(6):1133.
[26] PENG Y, HE Y, WU Z, et al.Screening and optimization of low-cost medium for Pseudomonas putida Rs-198 culture using RSM[J].Brazil J Microbiol,2014,45:1229-1237.
[27]李春雨,杨棒棒,周佳,等.红杆菌NBS58-1产胞外多糖发酵条件优化及其保湿性研究[J].中国酿造,2022,41(11):155-160.
[28]COTÂRLET,M,MAFTEI N M,BAHRIM G E.Increasing the fermentation efficiency of Lactobacillus paracasei ssp.paracasei MIUG BL6 in a rye flour sourdough[J].Turkish J Biochem,2019,44(3):307-315.
[29]杨晓蕾,李建宏,姚拓,等.复合促生菌剂发酵条件优化及其对青稞促生效果评价[J].草地学报,2022,30(1):212-219.