银叶金合欢(Acacia podalyriifolia)是蔷薇目金合欢属植物,又名珍珠相思、真珠相思、昆士兰银条等[1],在我国主要分布于浙江、广东、广西、云南、四川等地[2]。银叶金合欢的使用价值较高,本种多枝、多刺,可植作绿篱;木料坚固,可做为名贵工具;根及荚果含丹宁,可作为黑色着色汁,做药服用能够收敛清热解毒;在冬天和早春有金黄色的球形状的小花会盛开,花带有清香,可以提炼香料;枝茎流出的树脂,可以供美工用及药用[3]。同时,银叶金合欢具备四季长绿,叶子多、生长较快的特点,可以提供充足的实验原材料。
目前,关于合欢属植物的研究主要集中在化学成分和药理活性方面的研究[4],但银叶金合欢植物有效化学成分的提取及提取液的药理研究鲜见报道。植物多酚类化合物具有抑菌[5]、抗肿瘤[6-7]及抗氧化[8]等多种作用,且不同植物中多酚含量及活性存在一定差异[9-12]。植物多酚具体应用研究主要集中在植物多酚对畜禽肉品质调控作用[13-15]、调节糖脂代谢作用[16-17]、抗炎机制[18-20]等方面的研究。植物多酚目前常用的绿色提取方法主要是微波辅助提取和超声波辅助提取,与传统的提取方法对比,具有提取时间短、操作简单、提取率高等特点[21-23],但是由于实验条件和成本的限制,并不能大规模实施,因此进一步开发高效、绿色、安全且能大规模实施的新型多酚提取方法是科学工作者们努力的重要方向。
为提高银叶金合欢植物的综合利用,本研究采用超声波辅助提取法提取银叶金合欢叶中的多酚,经单因素试验和正交试验确定最佳提取工艺条件,并探究银叶金合欢叶多酚的抗氧化活性,以期为银叶金合欢叶中有效成分的提取,为后期开发应用于天然食品抗氧化剂和天然多酚类药物提供理论和实验依据。
1 材料与方法
1.1 材料与试剂
银叶金合欢叶:2021年12月采摘于广西崇左市江州区广西民族师范学院,洗净,恒温60 ℃烘干,粉碎(60目筛)备用。
石油醚、乙醇、盐酸、抗坏血酸、丙酮、碳酸钠、30%过氧化氢、七水合硫酸亚铁、水杨酸、亚硝酸钠、盐酸萘乙二胺、对氨基苯磺酸、甲醛、三氯化铁、单宁酸(纯度>98%)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(均为分析纯):成都市科隆化学品有限公司;福林酚(分析纯):上海宝曼生物科技有限公司。
1.2 仪器与设备
722型紫外可见光分光光度计:上海舜宇恒平科学仪器有限公司;SB-120DT超声清洗机:宁波新芝生物科技股份有限公司;FW100型高速万能粉碎机:天津市泰斯特仪器有限公司;DF-101S磁力搅拌器:河南省予华仪器有限公司;80-2离心沉淀器:金坛市医疗仪器厂;RE3000C旋转蒸发器:上海亚荣生化仪器厂;DGH-9143BS恒温(鼓风)干燥箱:宁波杨辉仪器有限公司。
1.3 实验方法
1.3.1 银叶金合欢叶多酚的提取
原料的制备:称取适量已粉碎并过60目筛的银叶金合欢叶的粉末,放入圆底烧瓶中,按照固液比为1∶4(g∶mL)加入石油精,在70 ℃左右油浴锅中回流4 h,对银叶金合欢叶进行脱脂、脱色,趁热减压过滤去除滤液,放入50 ℃电烘箱中烘干,获得脱脂脱色的银叶金合欢叶粉。
多酚的提取:称取银叶金合欢叶粉末原料1.000 0 g,加入体积分数为70%丙酮溶液20 mL,在提取温度为50 ℃,时间为20 min的情况下,进行超声波辅助提取(提取功率60 W),离心(2 500 r/min、10 min)取上清液,即为银叶金合欢叶多酚的提取液,注意避光保存。
1.3.2 银叶金合欢叶多酚的检测
采用福林酚试剂显色法[24],分别移取0.8 mL、1.2 mL、1.6 mL、2.0 mL、2.4 mL质量浓度为0.137 mg/mL的单宁酸标准溶液于25 mL的容量瓶中,每个容量瓶中先后加入福林酚溶液1.3 mL、饱和碳酸钠溶液5 mL,均摇匀静置6 min,最后用蒸馏水定容至刻度线,得到质量浓度分别为0.004 mg/mL、0.006 mg/mL、0.008 mg/mL、0.010 mg/mL、0.012 mg/mL的单宁酸标准溶液,摇匀避光静置30 min,测定波长760 nm处测相应浓度的吸光度值[25]。以单宁酸标准溶液的质量浓度(x)为横坐标,以吸光度值(y)为纵坐标绘制单宁酸标准曲线,得到其标准曲线回归方程为y=92.2x+0.183 8,相关系数R2=0.999 1。多酚得率的测定:根据标准曲线回归方程,计算多酚的质量浓度,多酚得率的计算公式如下:
式中:W为银叶金合欢叶多酚的得率,%;c为提取液质量浓度,mg/mL;V为提取液的体积,mL;N为提取液稀释的倍数;m为脱脂原料的质量,g。
1.3.3 多酚提取条件优化的单因素试验
准确称取银叶金合欢叶粉末原料1 g,加入体积分数70%丙酮溶液20 mL,料液比为1∶20(g∶mL),进行超声波辅助提取,提取温度为50 ℃,提取时间为20 min,经离心(2 500 r/min、10 min)后取上清液,分别考察提取溶剂(体积分数70%丙酮溶液、体积分数70%乙醇溶液、体积分数70%乙醇(1%盐酸)溶液、蒸馏水)、丙酮体积分数(50%、60%、70%、80%、90%)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL))、提取温度(45 ℃、50 ℃、55 ℃、60 ℃、65 ℃)、提取时间(5 min、10 min、15 min、20 min、25 min)对银叶金合欢叶多酚得率的影响。
1.3.4 多酚提取工艺条件优化的正交试验
根据单因素试验结果,以多酚得率为评价指标,以丙酮体积分数(A)、料液比(B)、提取温度(C)和提取时间(D)为影响因素,进行L9(34)正交试验设计,正交试验因素与水平见表1。
表1 多酚提取条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for polyphenols extraction conditions optimization
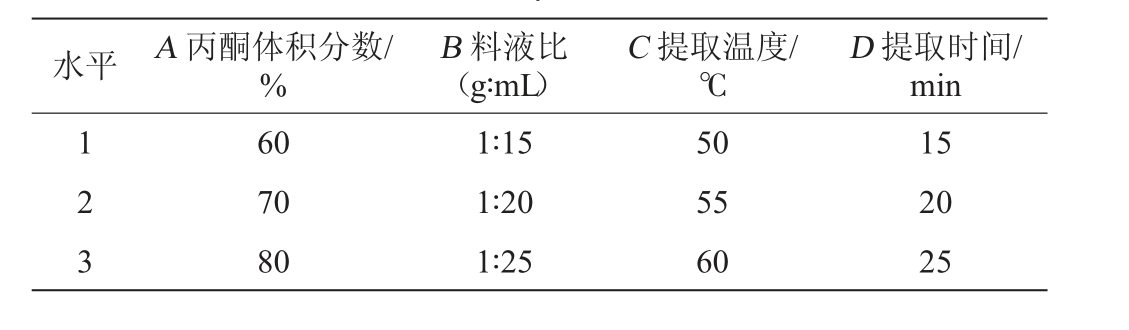
水平 A 丙酮体积分数/%B 料液比(g∶mL)C 提取温度/℃D 提取时间/min 1 2 3 60 70 80 1∶15 1∶20 1∶25 50 55 60 15 20 25
1.3.5 抗氧化性能测定
测定最优条件下提取的银叶金合欢叶多酚对DPPH·、·OH、NO·3种自由基的清除能力,以对应的清除率评价银叶金合欢叶多酚的抗氧化活性。
DPPH·清除能力的测定:采用无水乙醇配制0.1 mg/mL的DPPH溶液,分别取质量浓度为0.2 mg/mL、0.25 mg/mL、0.30 mg/mL、0.35 mg/mL、0.4 mg/mL的银叶金合欢叶多酚2 mL,再分别加入0.1 mg/mL的DPPH溶液2 mL,摇匀,避光放置30 min。用无水乙醇做为空白调零,在波长517 nm的条件下测定其吸光度值Ai。采用相同方法用无水乙醇替换DPPH溶液,记为Aj。取0.1 mg/mL的DPPH溶液2 mL和无水乙醇2 mL,反应30 min,测定吸光度值记为A0。以与样品溶液浓度相同的抗坏血酸溶液作阳性对照[26]。试验平行3次,取平均值。多酚对DPPH·的清除率的计算公式如下:
·OH清除能力的测定:分别于五支10 mL比色管中加入2.0 mL质量浓度为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL的银叶金合欢叶多酚溶液,然后依次加入浓度均为6 mmol/L的FeSO4和H2O2溶液各2.0 mL并摇匀,避光静置15 min,然后加入2.0 mL的6 mmol/L水杨酸乙醇溶液且加水定容至刻度线摇匀,避光静置30 min,在波长510 nm处测其吸光度值A1,不加水杨酸乙醇溶液的吸光度值记为A2,按照上述步骤,用蒸馏水取代样品溶液作为空白对照,在波长510 nm处测其吸光度值记为A0,以与样品溶液浓度相同的抗坏血酸作为阳性对照[27]。试验平行测定3次取平均值,多酚对·OH的清除率计算公式如下:
NO·清除能力测定:分别移取质量浓度为0.25 mg/mL、0.50 mg/mL、0.75 mg/mL、1.00 mg/mL、1.25 mg/mL的银叶金合欢叶多酚溶液2 mL于10 mL比色管中,加入10 μg/mL的亚硝酸钠溶液1.0 mL,摇匀避光条件下反应30 min,后加入4 g/L对氨基苯磺酸1.0 mL,摇匀避光静置5 min,再加入2 g/L的盐酸萘乙二胺溶液1.0 mL,用去离子水定容至刻度线,摇匀避光静置15 min,在波长540 nm处测其吸光度值Ai,其中没有加亚硝酸钠溶液的吸光度值记为Aj,按照相同的实验步骤,用蒸馏水取代银叶金合欢叶多酚溶液作为空白对照,在波长540 nm处测其吸光度值记为A0,同时以与样品溶液浓度相同的抗坏血酸溶液对NO·的清除率作为阳性对照[28]。试验平行测定3次取平均值,多酚对NO·的清除率计算公式如下:
1.3.6 数据处理
所有实验数据平行测定3次取平均值,采用Origin8.5软件进行数据处理和图形绘制。
2 结果与分析
2.1 多酚提取条件优化单因素试验结果
2.1.1 提取溶剂的确定
由图1可知,不同的提取溶剂对银叶金合欢叶多酚提取率不同,当以体积分数70%丙酮溶液作为提取溶剂时,得到的多酚提取率最高,为15.93%。其以相似相溶原理为依据,多酚物质和丙酮溶液的极性相似[29],因此,确定银叶金合欢叶多酚的提取溶剂为体积分数70%丙酮。
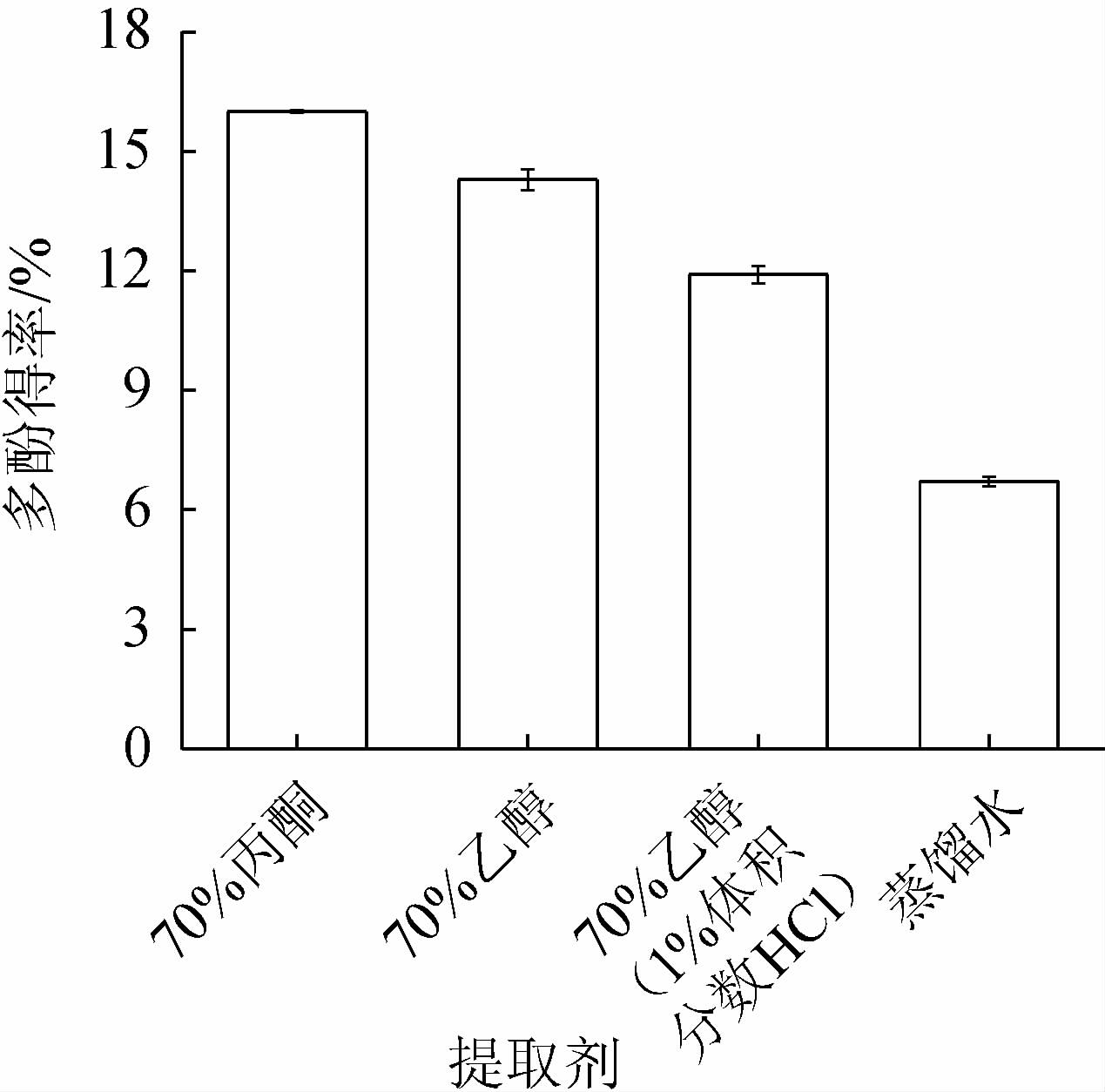
图1 不同提取溶剂对银叶金合欢叶多酚得率的影响
Fig.1 Effect of different extraction solvent on polyphenols yield from Acacia podalyriifolia leaves
2.1.2 丙酮体积分数的确定
由图2可知,随着丙酮体积分数在50%~70%范围内的增加,银叶金合欢叶多酚的得率呈增加趋势;当丙酮体积分数为70%时,银叶金合欢叶多酚得率最高,为15.97%;丙酮体积分数>70%,银叶金合欢叶多酚得率逐渐降低,其原因可能是,提取剂的体积分数过大,脂溶性物质也逐渐增多[30]。因此,确定丙酮体积分数为70%。
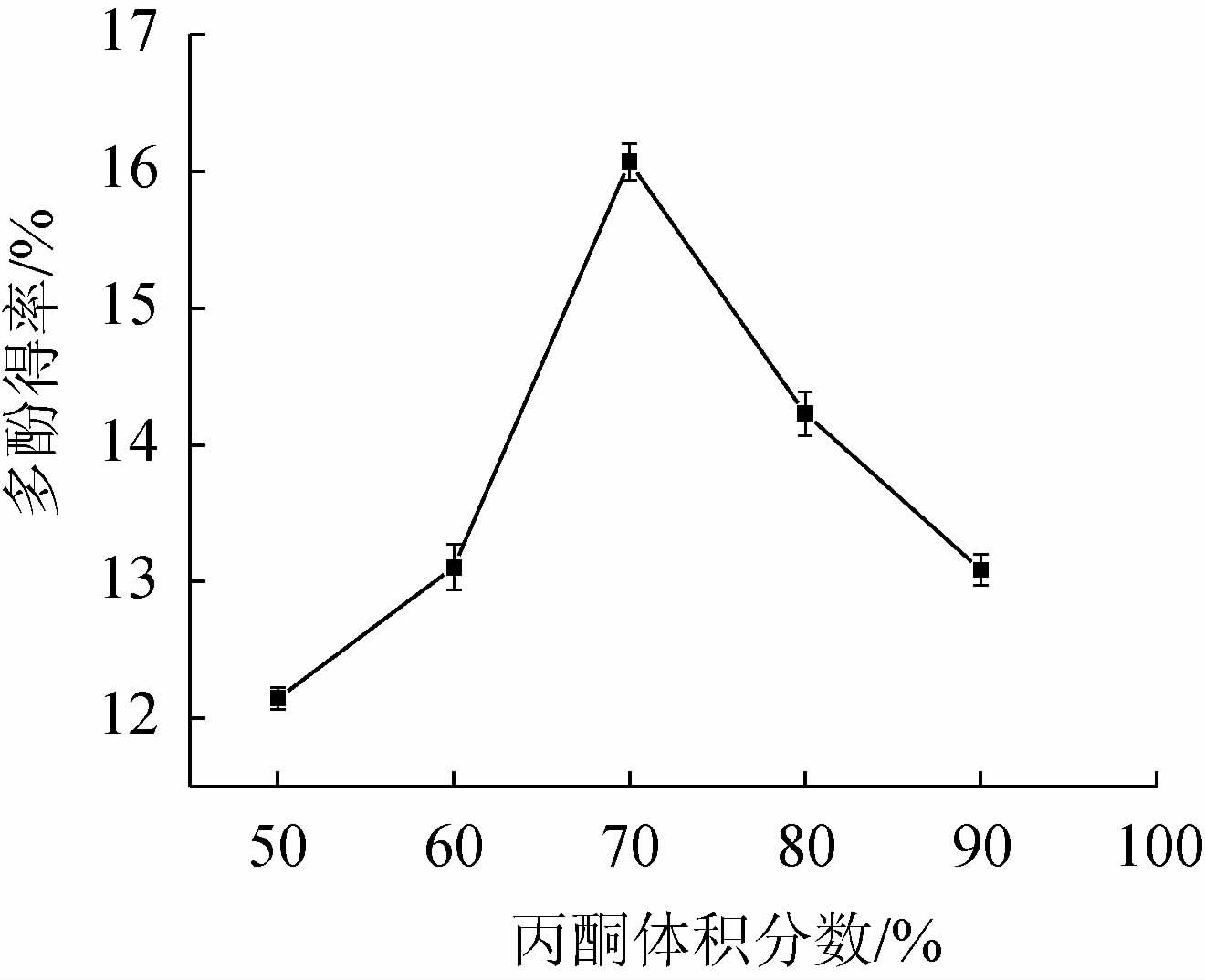
图2 丙酮体积分数对银叶金合欢叶多酚得率的影响
Fig.2 Effect of acetone volume fraction on polyphenols yield from Acacia podalyriifolia leaves
2.1.3 料液比的确定
由图3可知,当料液比为1∶5、1∶10、1∶15、1∶20、1∶25(mg∶mL)时,多酚得率逐渐增加;当料液比为1∶20(g∶mL)时,多酚得率最高,为15.63%;料液比为1∶20、1∶25(g∶mL)时,多酚得率逐渐降低。其原因可能是,其他杂质随着溶剂量增大而溶出增多[31]。因此,确定料液比为1∶20(g∶mL)。
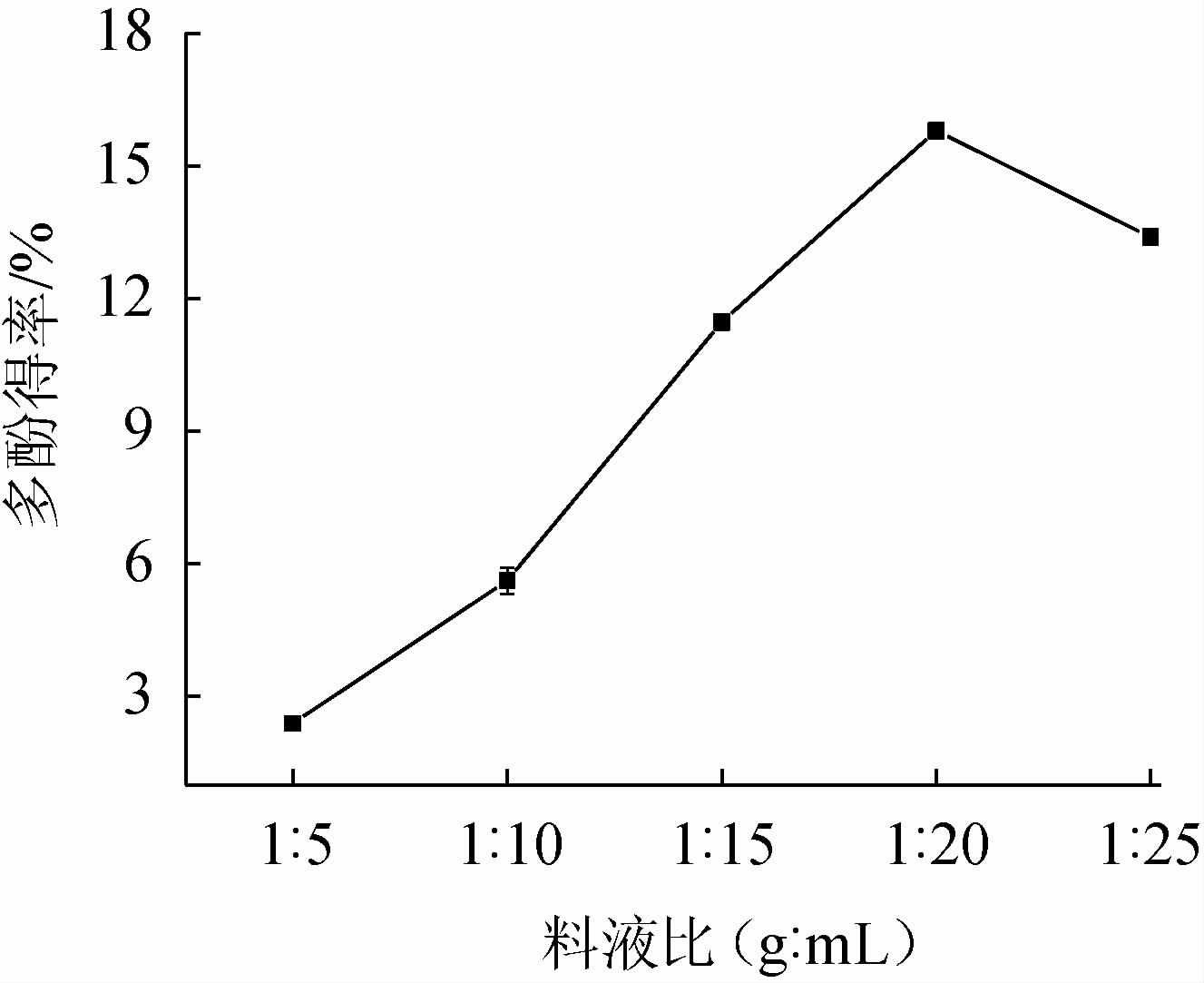
图3 料液比对银叶金合欢叶多酚得率的影响
Fig.3 Effect of material-to-liquid ratio on polyphenols yield from Acacia podalyriifolia leaves
2.1.4 提取时间的确定由图4可知,当提取时间为5~20 min时,银叶金合欢叶
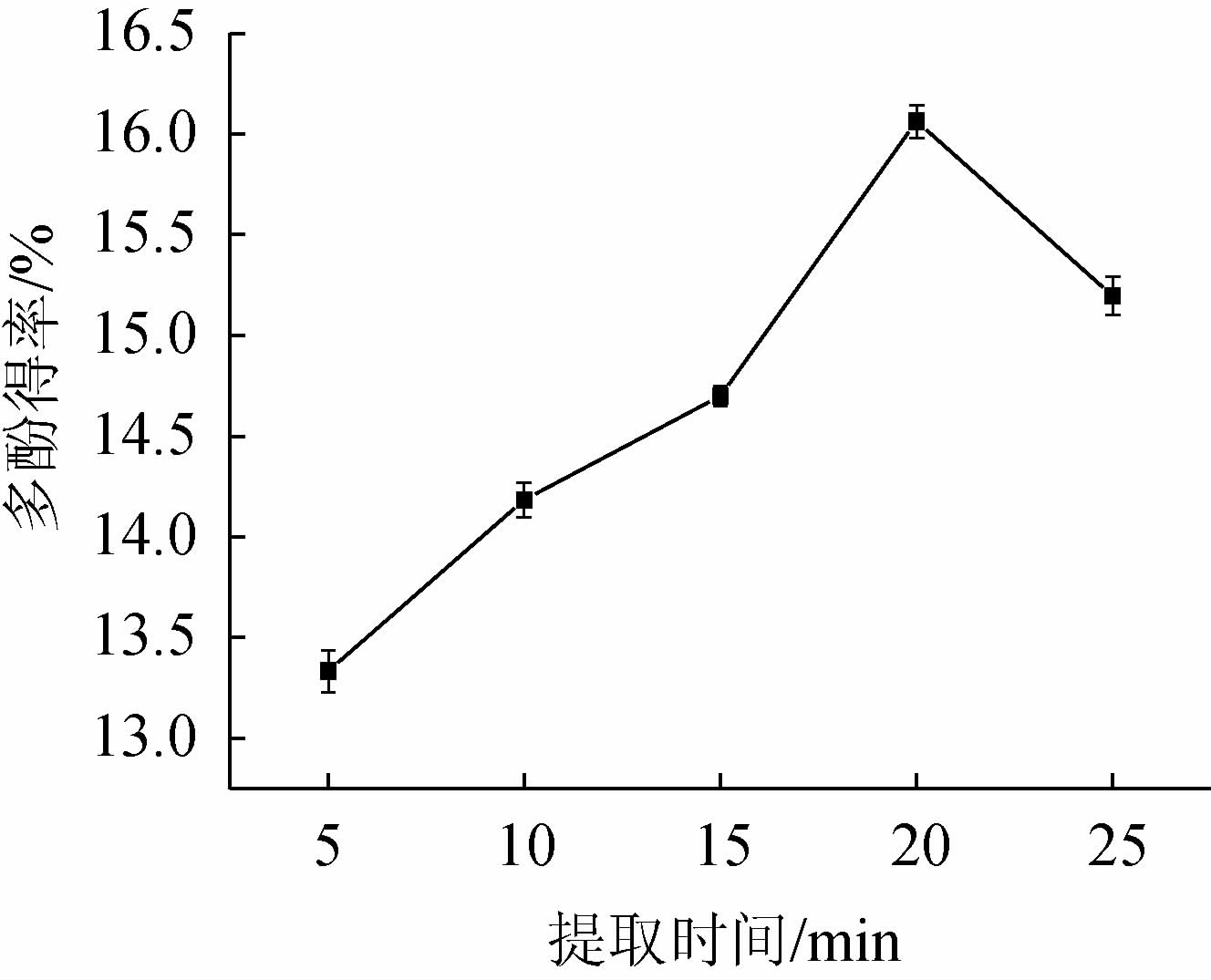
图4 提取时间对银叶金合欢叶多酚得率的影响
Fig.4 Effect of extraction time on polyphenols yield from Acacia podalyriifolia leaves
多酚得率呈增加趋势;提取时间为20 min时;银叶金合欢叶多酚得率达到最高值,为15.97%;当提取时间>20 min时,多酚得率下降,其原因可能是,多酚被氧化分解导致多酚得率降低[32]。因此,确定提取时间为20 min。
2.1.5 提取温度的确定
由图5可知,当提取温度为45~55 ℃时,多酚得率逐渐增加;当提取温度55 ℃时,银叶金合欢叶多酚得率最高,为16.35%,其原因可能是,渗透和扩散作用随温度升高而加快,多酚溶出增多而得率增大[33];当提取温度高于55 ℃时,多酚得率逐渐下降。因此,确定提取时间为55 ℃。
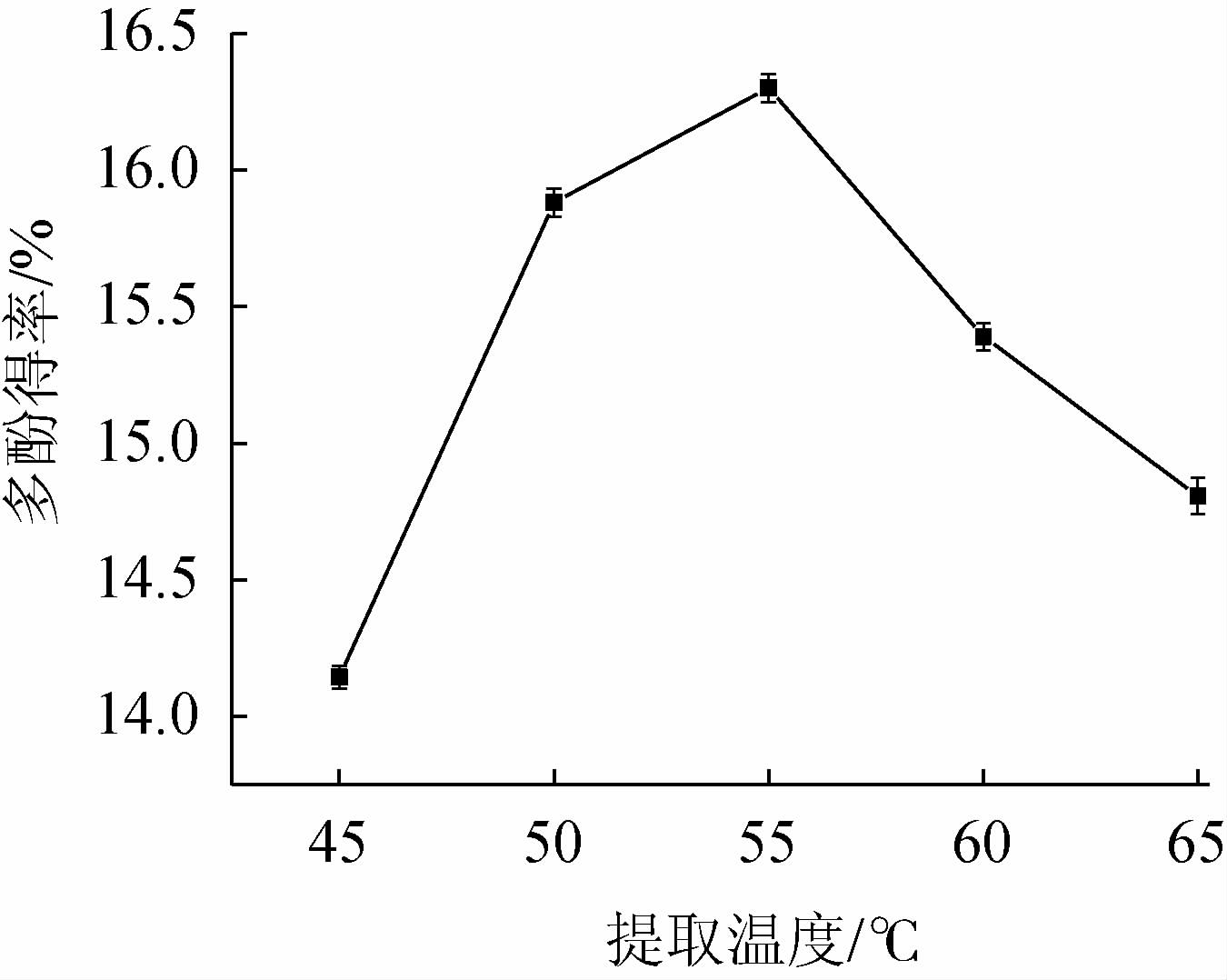
图5 提取温度对银叶金合欢叶多酚得率的影响
Fig.5 Effect of extraction temperature on polyphenols yield from Acacia podalyriifolia leaves
2.2 提取条件优化正交试验结果
根据单因素试验结果,以多酚得率为评价指标,以丙酮体积分数(A)、料液比(B)、提取温度(C)和提取时间(D)为影响因素,进行L9(34)正交试验设计,多酚提取条件优化正交试验结果与分析见表4。
表4 多酚提取条件优化正交试验结果与分析
Table 4 Results and analysis of orthogonal experiment for polyphenols extraction conditions optimization
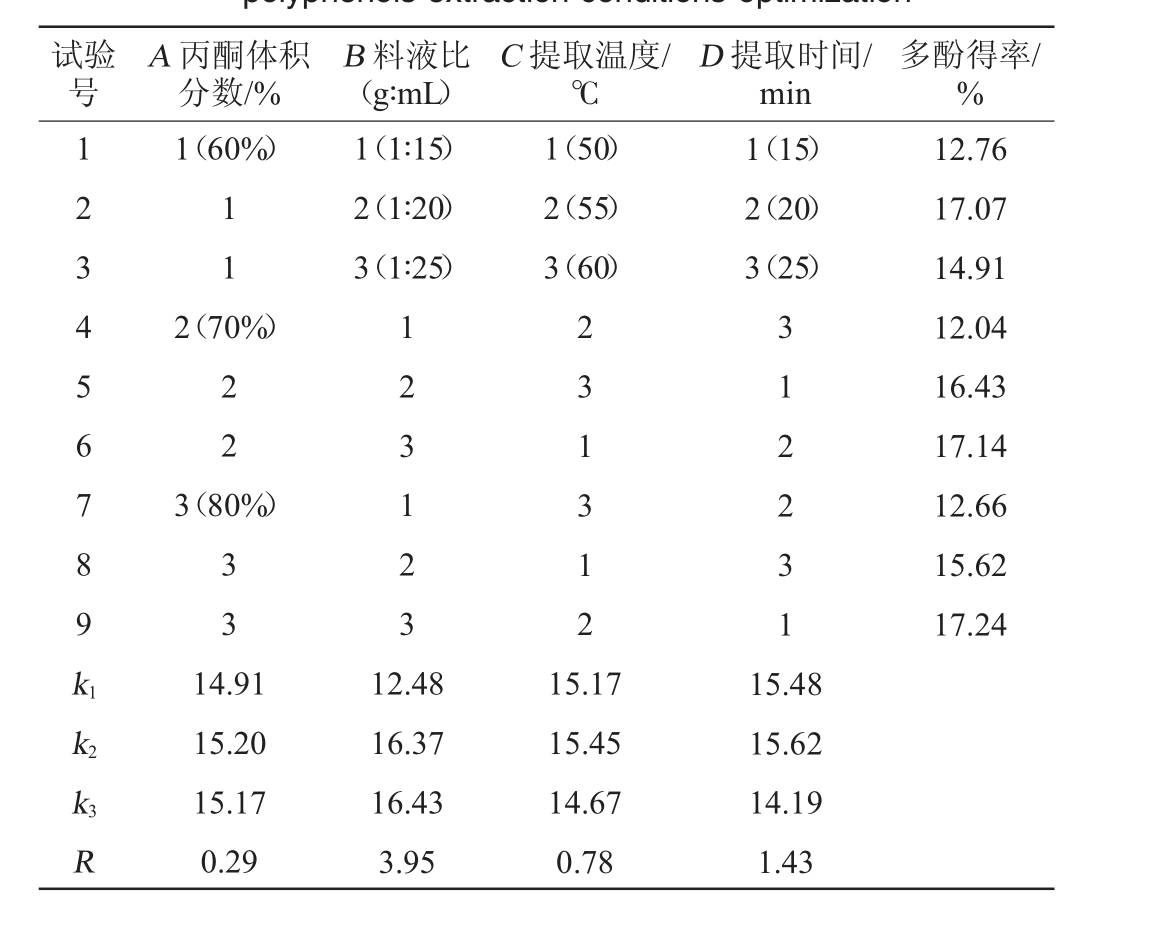
试验号A 丙酮体积分数/%B 料液比(g∶mL)C 提取温度/℃D 提取时间/min多酚得率/%1 2 3 4 5 6 7 8 9 k1 1(60%)1 1 1(1∶15)2(1∶20)3(1∶25)1(50)2(55)3(60)1(15)2(20)3(25)2(70%)2 2 3(80%)3 3 1 2 3 1 2 3 2 3 1 3 1 2 3 1 2 2 3 1 12.76 17.07 14.91 12.04 16.43 17.14 12.66 15.62 17.24 k2 k3R 14.91 15.20 15.17 0.29 12.48 16.37 16.43 3.95 15.17 15.45 14.67 0.78 15.48 15.62 14.19 1.43
由表4可知,影响银叶金合欢叶多酚得率的4个因素的强弱顺序为B>D>C>A,即料液比>提取时间>提取温度>丙酮体积分数。正交试验得到银叶金合欢叶多酚提取工艺的最佳组合A2B3C2D2。即丙酮体积分数70%、料液比1∶25(g∶mL)、提取温度为55 ℃和提取时间20 min。在此最佳提取工艺条件进行3次平行验证试验,获得多酚得率为17.65%。
2.3 银叶金合欢叶多酚的抗氧化活性测定结果
2.3.1 银叶金合欢叶多酚对DPPH·的清除能力
由图6可知,当银叶金合欢叶多酚和抗坏血酸(vitamin C,VC)溶液质量浓度为0.2~0.4 mg/mL时,对DPPH·的清除率逐渐增加,当质量浓度为0.4 mg/mL时,多酚溶液对DPPH·的清除率达到最高值,为91.06%,VC溶液对DPPH·的清除率为95.28%。结果表明,银叶金合欢叶多酚对DPPH·具有一定清除能力。
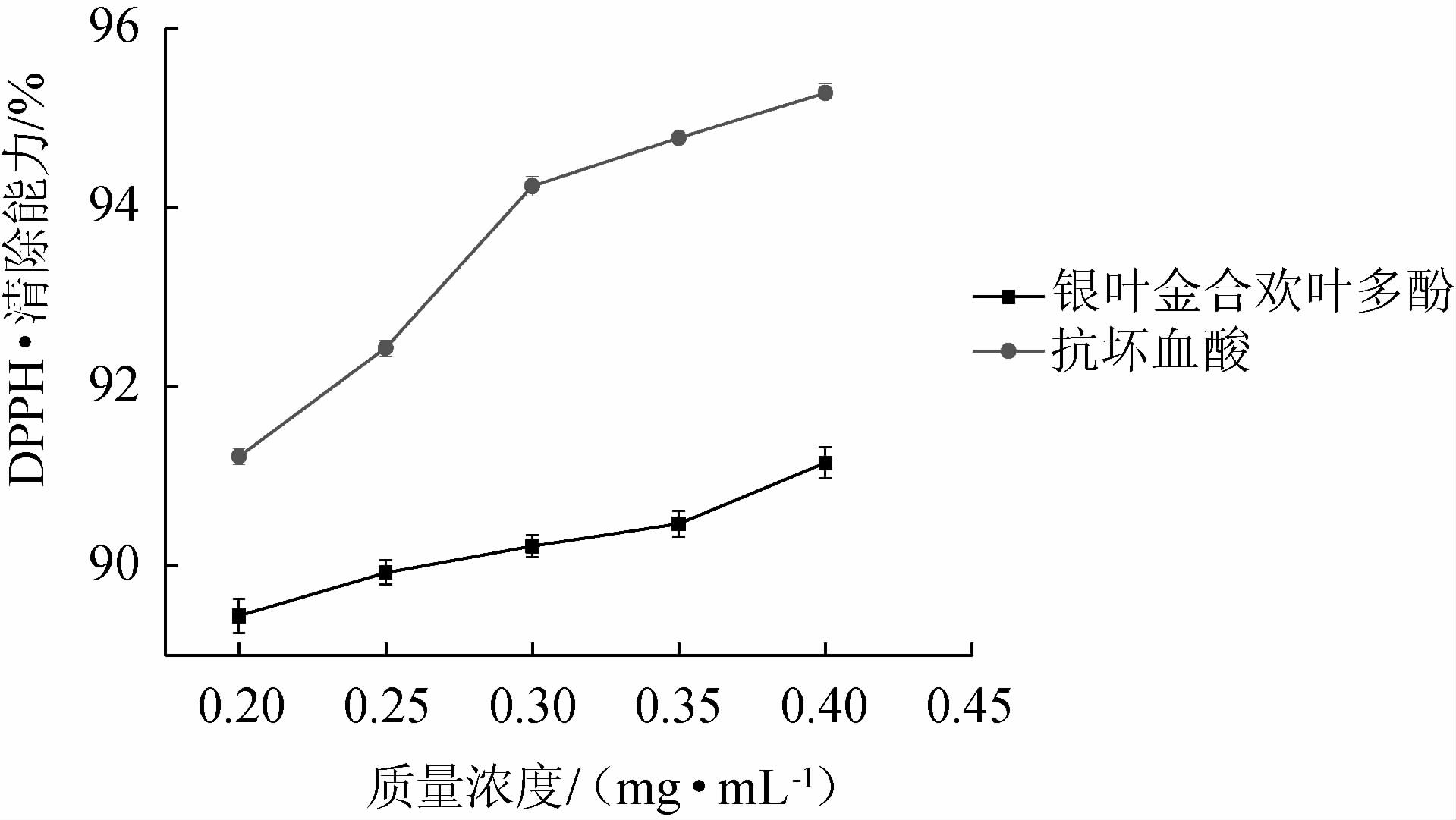
图6 银叶金合欢叶多酚对DPPH·的清除能力
Fig.6 Effect of polyphenols from Acacia podalyriifolia leaves on the scavenging capacity of DPPH·
2.3.2 银叶金合欢叶多酚对·OH的清除能力
由图7可知,当VC溶液的质量浓度为0.5~1.5 mg/mL时,对·OH的清除能力上升最快;当VC溶液的质量浓度>1.5 mg/mL时,对·OH的清除能力的变化趋势趋于平稳;当银叶金合欢叶多酚质量浓度为0.5~2.5 mg/mL时,其对·OH的清除率逐渐上升,当多酚质量浓度为2.5 mg/mL时,其对·OH的清除率达到最高值,为89.27%。表明银叶金合欢叶多酚对·OH具有一定的清除能力。
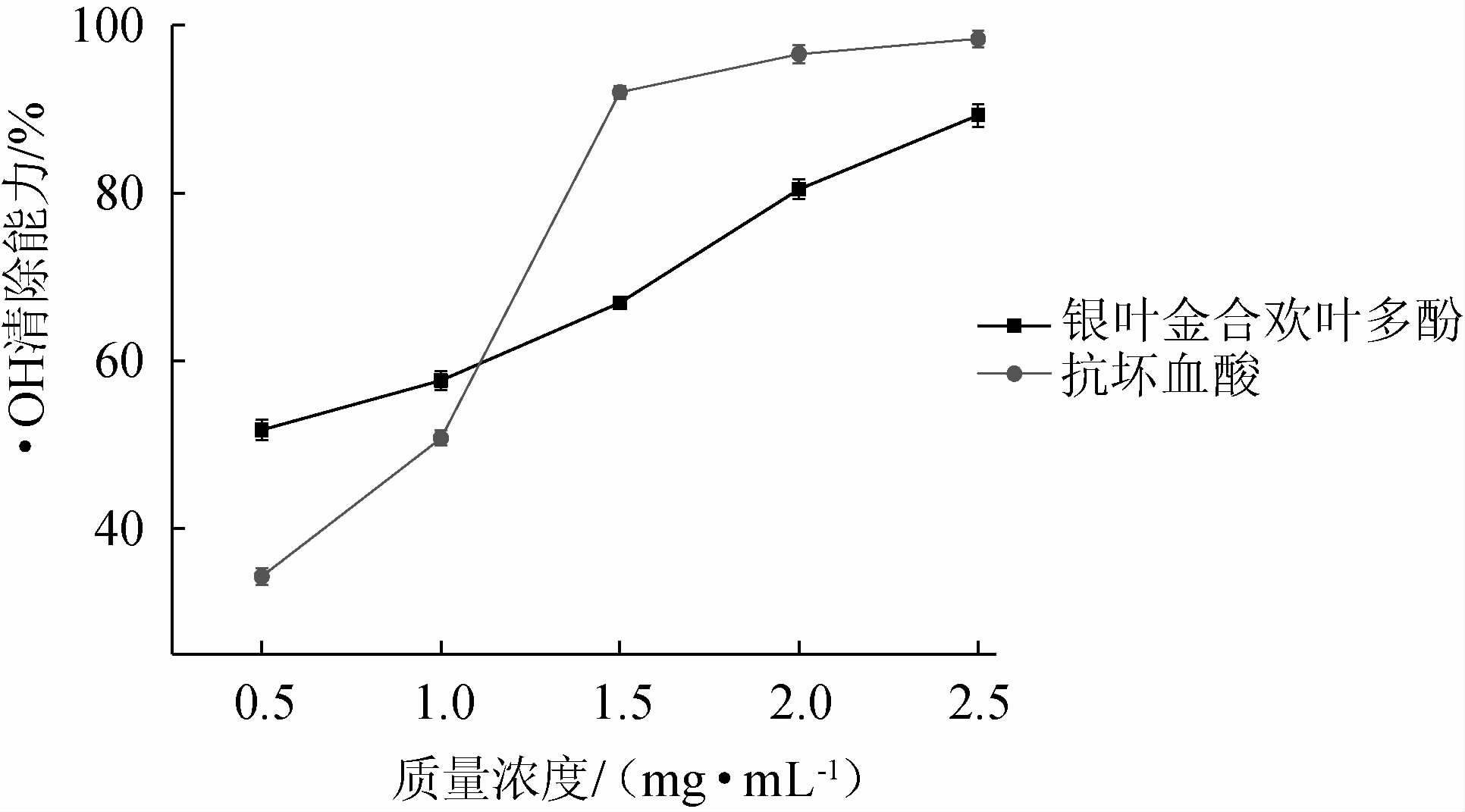
图7 银叶金合欢叶多酚对·OH的清除能力
Fig.7 Effect of polyphenols from Acacia podalyriifolia leaves on the scavenging capacity of·OH
2.3.3 银叶金合欢叶多酚对NO·的清除能力
由图8可知,随着两种溶液的质量浓度在0.25~1.25 mg/mL的范围内增加,其对NO·清除能力逐渐增加;当两种溶液质量浓度为1.25 mg/mL时,其对NO·的清除能力均达到最大值,银叶金合欢叶多酚对NO·的清除率达57.51%,VC溶液对NO·的清除率达73.33%。结果表明,银叶金合欢叶多酚对NO·具有一定的清除能力。
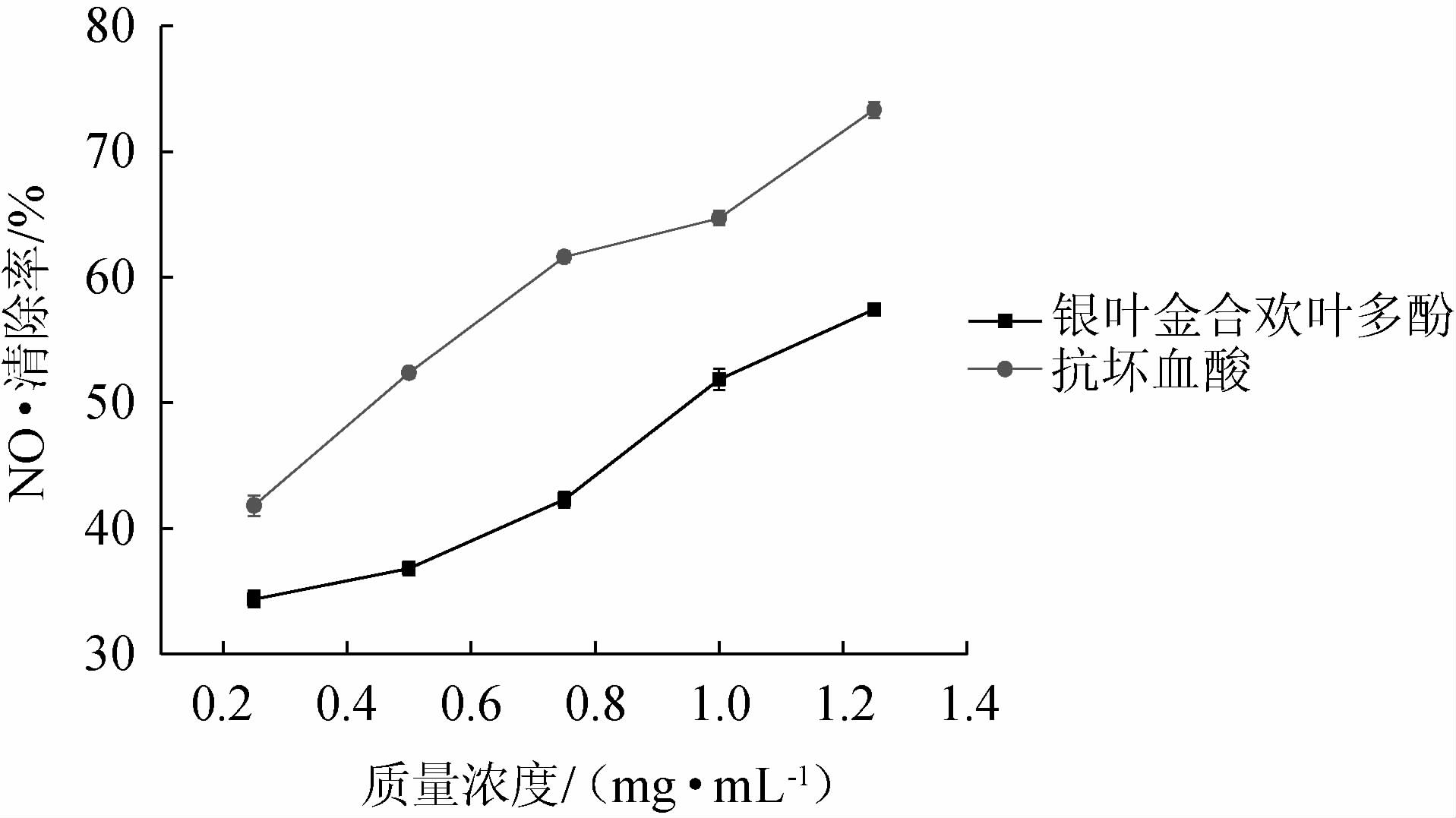
图8 银叶金合欢叶多酚对NO·的清除能力
Fig.8 Effect of polyphenols from Acacia podalyriifolia leaves on the scavenging capacity of NO·
3 结论
本研究采用超声辅助提取法确定银叶金合欢叶多酚的最佳提取工艺条件为丙酮体积分数70%、料液比1∶25(g∶mL)、提取温度55 ℃、提取时间20 min。在此优化条件下,银叶金合欢叶多酚得率为17.65%。银叶金合欢叶多酚具有较好的抗氧化性,其对DPPH·、·OH及NO·的清除率分别为91.06%、89.27%和57.51%,清除效果较好。因此,银叶金合欢叶在抗氧化功能食品和药品研发方面具备很好应用价值。后续会对银叶金合欢叶的其他活性成分进行提取以及对多酚成分进行分离鉴定,探究各有效成分与抗氧化活性的关系,为后续银叶金合欢多酚作为天然食品及药品添加剂的具体应用提供基础和依据。
[1]武爱龙,潘浩汉,吴建阳,等.响应面法优化银叶金合欢组培快繁体系[J].福建农业科技,2022,53(8):40-49.
[2]代色平,朱纯,赖晋灵,等.园林植物新树种-银叶金合欢[J].广东园林,2007(4):40-42.
[3]端木炘.中国金合欢属资源利用[J].林产化工通讯,2002(3):29-31.
[4]吕金顺,左国防,王缠定.合欢属植物的化学成分及药用价值研究[J].天水师范学院学报,2003(5):23-25.
[5]OTHMAN L,SLEIMAN A,ABDEL-MASSIH R M.Antimicrobial actvity of polyphenols and alkaloids in middle eastern plants[J].Front Microbiol,2019,10(5):911-925.
[6]WANG D X,ZHANG M,WANG T T,et al.Green tea polyphenols mitigate the plant lectins-induced liver inflammation and immunological reaction in C57BL/6 mice via NL-RP3 and Nrf2 signaling pathways[J].Food Chem Toxicol,2020,144(10):111576-111588.
[7] DAVIS D W, NAVALTA J W, MCGINNIS G R, et al.Effects of acute dietary polyphenols and post-meal physical activity on postprandial metabolism in adults with features of the metabolic syndrome[J].Nutrients,2020,12(4):1120-1143.
[8]LI T,LI Q L,WU W G,et al.Lotus seed skin proan-thocyanidin extract exhibits potent antioxidant property via activation of the Nrf2-ARE pathway[J].Acta Bioch et Bioph Sin,2019,51(1):31-40.
[9]段笑影,曹冬冬,崔强,等.狗尾草多酚的提取工艺及抗氧化活性研究[J].中国酿造,2019,38(7):168-173.
[10]费鹏,赵胜娟,陈曦,等.植物多酚抑菌活性、作用机理及应用研究进展[J].食品与机械,2019,35(7):226-230.
[11]伊娟娟,王振宇,曲航,等.植物多酚抗肿瘤活性及其机制研究进展[J].食品工业科技,2016,37(18):391-395.
[12]王慧竹,李新胜,王亮,等.金樱子总多酚提取工艺优化及抗氧化活性研究[J].中国酿造,2023,42(7):190-195.
[13] ORZUNA-ORZUNA J F, DORANTES-ITURBIDE G, LARA-BUENO A,et al.Growth performance,meat quality and antioxidant status of sheep supplemented with tannins:a meta-analysis[J].Animals,2021,11(11):3184.
[14] LI D M,CUI Y,WANG X J,et al.Apple polyphenol extract alleviates lipid accumulation in free-fatty-acid-exposed HepG2 cells via activating autophagy mediated by SIRT1/AMPK signaling[J].Phytother Res,2021,35(3):1416-1431.
[15] XU M, CHEN X L, HUANG Z Q, et al.Effects of dietary grape seed proanthocyanidin extract supplementation on meat quality,muscle fiber characteristics and antioxidant capacity of finishing pigs[J].Food Chem,2022,367(1):130781.
[16]GUO Q W,MA Q Q,XUE Z H,et al.Studies on the binding characteristics of three polysaccharides with different molecular weight and flavonoids from corn silk(Maydis stigma)[J].Carbohyd Polym,2018,198(10):581-588.
[17]TUDORACHE M,BORDENAVE N.Phenolic compounds mediate aggregation of water-soluble polysaccharides and change their rheological properties:Effect of different phenolic compounds[J].Food Hydrocoll,2019,97(12):105193.
[18]张啸怡,李忠海,任佳丽.食用菌中多酚抗炎功能研究进展[J].食品工业科技,2018,39(17):342-346,351.
[19]BURGOS-EDWARDS A,MARTIN-PEREZ L,JIMENEZ-ASPEE F,et al.Anti-inflammatory effect of polyphenols from Chilean currants(Ribes magellanicum and R.punctatum)after in vitro gastrointestinal digestion on Caco-2 cells:Anti-inflammatory activity of in vitro digested Chilean currants[J].J Funct Foods,2019,59(8):329-336.
[20] LI Y, RAHMAN S U, HUANG Y Y, et al.Green tea polyphenols decrease weight gain,ameliorate alteration of gut microbiota,and mitigate intestinal inflammation in canines with high-fat-diet-induced obesity[J].J Nutr Biochem,2020,78(4):108324.
[21] LAZZE M C, PIZZALA R, PECHARROMA F J G, et al.Grape waste extract obtained by supercritical fluid extraction contains bioactive antioxidant molecules and induces antiproliferative effects inhuman colon adenocarcinoma cells[J].J Med Food,2019,12(3):561-568.
[22]周婉,魏婉倩,李猛,等.植物多酚绿色提取技术研究进展[J].农产品加工,2023(7):74-77.
[23]田富林,黄文晶,王展,等.植物多酚提取研究进展[J].食品与机械,2020,36(9):211-216.
[24]郑燕菲,张强,蓝亮美,等.单性木兰枝多酚提取工艺及抗氧化性研究[J].食品与机械,2020,36(5):175-181.
[25]郑燕菲,张强,廖晓斓.巨尾桉叶中多酚的抗氧化性及稳定性的研究[J].食品科技,2019,44(9):243-247.
[26]史娟,葛红光.艾草多酚的提取纯化及抗氧化性能研究[J].粮食与油脂,2021,34(4):108-113.
[27]孔方南,李文砚,韦优,等.刺果番荔枝叶多酚提取工艺优化及其体外抗氧化活性[J].食品工业科技,2020,41(20):162-168.
[28]田成.桂花果实多酚的超声波提取及抗氧化活性研究[J].食品科学,2011,32(24):106-110.
[29]黄秋萍,黄秋婵,郑燕菲,等.余甘子果核多酚提取工艺优化及抗氧化性研究[J].中国酿造,2021,40(10):210-213.
[30]王彦阳,张中润,郑晓瑞,等.腰果叶多酚超声波辅助提取工艺及其抗氧化能力测定[J].食品研究与开发,2020,41(3):53-58.
[31]张林,袁佳璐,王志磊,等.超微粉碎辅助超声波提取葡萄酒泥多酚条件优化[J].中国酿造,2023,42(5):220-225.
[32]胡会刚,赵巧丽.菠萝皮渣多酚的提取分离及其抗氧化活性评价[J].食品科技,2020,45(1):286-293.
[33]张怡评,杨婷,洪专,等.青钱柳多酚提取工艺及抗氧化活性[J].食品工业,2021,42(6):212-216.