生物防治技术是减少真菌及其毒素污染的最有前途和最有效的方法[1],其中利用具有抑菌活性的微生物来抑制食品、饲料、医药等行业原料生产和储藏过程中微生物的污染,从源头控制产毒微生物的增殖,是最大程度的减少真菌及毒素危害的有效途径[2]。动物饲料中添加抗生素会给环境和人类健康带来无法过量的危害,为了人类食品安全,我国《饲料和饲料添加剂管理条例》规定从2020年起饲料中全面禁止添加抗生素,寻找合适的抗生素替代品对饲料工业至关重要[3]。发酵饲料是指饲料原料中添加具有抑菌活性的微生物品种,饲料原料经过微生物发酵处理后,可有效增加营养价值,发酵饲料中添加具有抑菌活性的微生物可以抑制动物肠道内的有害微生物的繁殖与生产,起到替代抗生素的效果[4]。在饲料中添加具有抑菌活性的微生物菌种,可以提高动物免疫力,改善动物肠道菌群、促进动物生长[5-6]。
当前可用于发酵饲料的微生物种类主要包括真菌和细菌两类[7]。细菌是重要的工业用菌种,其中发酵乳杆菌(Lactobacillus fermentans)、植物乳杆菌(Lactobacillus plantarum)也可用于发酵饲料[8-9]。酵母菌(yeast)属于真菌,广泛添加在动物饲料剂中[10]。芽孢杆菌(Bacillus)通过发酵可产生纤维素酶、脂肪酶和淀粉酶等酶活较高的酶,也被用于发酵饲料[11-12]。放线菌是生产抗生素的主要菌种,在饲料、医药、食品等行业具有广泛应用[13]。天然生物防腐剂在抑制食品微生物生长的同时,又不会影响食品的营养和品质特性,防止化学防腐剂的污染,安全有效的延长食品的保质期[14]。对天然生物防腐剂在食品中的应用,也成为了研究热点[15]。因此菌种的合理选择是提高发酵效率的关键,也是发酵饲料品质的前提与关键[16]。因此有必要筛选在饲料中添加的具有抑菌作用的菌株。
本研究开展对致病菌具有较好抑菌作用的菌株筛选工作,并通过形态特征及生理生化特征观察,结合分子生物学对菌株进行鉴定。曲霉是饲料中常见的微生物污染物,本研究利用米曲霉(Aspergillus oryzae)作为指示菌种,利用单因素试验及正交试验设计优化菌种产抑菌物质的发酵条件,旨在分离筛选出能在饲料中添加的具有抑菌作用的菌种,以替代抗生素在饲料中的作用。
1 材料与方法
1.1 材料与试剂
1.1.1 指示菌种
金黄色葡萄球菌(Staphylococcus aureus)、米曲霉(Aspergillus oryzae)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli):保存于河池学院微生物及植物资源开发利用广西高校重点实验室。
1.1.2 培养基
高氏一号培养基[17](用于放线菌培养):可溶性淀粉20 g、KNO3 1 g、K2HPO4 0.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O0.01g、琼脂20g,pH值7.4~7.6,蒸馏水1000mL。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[19](用于真菌培养):马铃薯200 g,葡萄糖20 g,琼脂20 g,蛋白胨5 g,磷酸二氢钾3 g,硫酸镁1.5 g,蒸馏水1 000 mL,pH自然。
牛肉膏蛋白胨培养基[17](用于细菌培养):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15 g,蒸馏水1 000 mL,pH 7.4~7.6,121 ℃高压蒸汽灭菌20 min。
LB培养基[18](用于大肠杆菌培养):胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1 000 mL,pH 7。
发酵培养基[19]:NaCl0.2g,葡萄糖1.0g,可溶性淀粉5.0 g,MgSO4 0.5 g,K2HPO4 0.5 g,玉米粉20 g,蒸馏水1 000 mL,pH 7.2~7.4。
察氏培养基[20]:0.05% MgSO4·7H2O、0.2% NaNO3、2%琼脂粉、0.05%KCl、0.1%K2HPO4、3%蔗糖、0.01%FeSO4·7H2O、蒸馏水1 000 mL。
淀粉铵琼脂培养基[21]:(NH4)2SO4 2.0 g,CaCO3 3.0 g,K2HPO4 1.0 g,可溶性淀粉10.0 g,MgSO4 7H2O 1.0 g,NaCl 1.0 g,琼脂15.0 g,蒸馏水1 000 mL。
Emerson培养基[22]:葡萄糖20 g,牛肉膏4.0 g,NaCl 2.5 g,酵母膏10.0 g,蛋白胨4.0 g,琼脂15.0 g,蒸馏水1 000 mL,pH 7.2~7.4。
以上培养基均于121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
氯化钠、磷酸二氢钾、可溶性淀粉、硫酸镁、七水硫酸镁、葡萄糖(均为分析纯)、蛋白胨(生化试剂):天津光复精细化工研究所;酵母膏(生化试剂):广东环凯微生物科技有限公司;琼脂(生化试剂):上海润捷化学制剂有限公司;七水硫酸铁、磷酸二氢钾、磷酸氢二钾(均为分析纯):国药集团化学试剂有限公司;重铬酸钾(分析纯):汕头市西陇化工有限公司;牛肉膏(生化试剂):北京奥博生物科技有限公司。
1.2 仪器与设备
BX51显微镜:日本奥林巴斯公司;Infinite M200PRO全波长酶标仪、PHS-3B型pH仪:上海精密科学仪器有限公司;AvantiJE落地式离心机、Microfuge 20R高速冷冻离心机:美国贝克曼库尔特公司;ZXSD-A1160生化培养箱、ZWY-2102双层恒温培养振荡器:上海智城分析仪器制造有限公司;SW-CJ-IF超净工作台:苏净集团苏州安泰空气技术有限公司;HVE-50高压灭菌锅:日本Hirayama公司;HH-6型数显恒温水浴锅:常州国华电器有限公司;JM-B5107电子天平:余姚市纪铭称重校验设备有限公司;G100M25 MSL-W1格兰仕微波炉:广东格兰仕微波生活电器制造公司。
1.3 方法
1.3.1 土样采集及预处理
土样采集[23-24]:在广西宜州的流河寨、会仙山、枫树林等不同地点,采集离地面下5~15 cm处的土壤,每个不同地点分别采集3份土样,共9份土样。
土样预处理:采集的土壤放于通风处自然风干,每份各100 g左右,放进烘箱120 ℃烘2 h,除去大部分杂菌[23-25]。
1.3.2 菌株分离与纯化
称取经过预处理的土样10 g放入三角瓶中,加90 mL无菌水,参照徐麓凯等[26]的方法,分别制成10-3~10-6的稀释液。向高氏一号培养基中加入质量浓度为50 μg/mL的K2Cr2O7,121 ℃高压蒸汽灭菌20 min,取0.1 mL稀释度为10-4、10-5、10-6的稀释液,涂布高氏一号培养基培养,培养条件为:温度28 ℃,时间7 d,待长出菌后,对单菌落进行反复平板划线纯化得到单菌落。
1.3.3 菌株的筛选[26]
将指示菌金黄色葡萄球菌、米曲霉、枯草芽孢杆菌、大肠杆菌分别涂布接种到牛肉膏蛋白胨培养基、PDA培养基、牛肉膏蛋白胨培养基、LB培养基上,28 ℃进行活化培养2 d。将纯化好的菌株接在平板上,置于培养箱中28 ℃培养7 d,待其生长好后,挑取7 mm×7 mm菌块,接到带有指示菌的平板上。于28 ℃培养1~2 d,观察有无抑菌圈出现,采用游标卡尺测量抑菌圈直径大小,抑菌圈直径越大说明抑菌效果越强。
1.3.4 菌株的鉴定
(1)菌株形态学观察
配制高氏一号培养基,经过灭菌后,在无菌环境下倒平板,平板凝固后,每皿接种培养好的目的菌株,放入培养箱培养15 d,观察菌株生长情况、革兰氏染色情况以及菌株显微形态[24,27-29]。
(2)生理生化鉴定
依据参考文献[25-26],完成吲哚试验、V.P试验、甲基红试验硫化氢产生试验、淀粉水解试验、接触酶反应、碳源利用试验、明胶液化试验。
(3)分子生物学鉴定[30]
菌体总脱氧核糖核酸(deoxyribonucleic acid,DNA)的提取:新鲜培养的菌丝加入液氮,在研钵中充分研磨变成粉末,总DNA的提取参照MICHAELSON L V等[31]的方法进行。以菌株Ls2的基因组总DNA为模板,使用通用引物进行聚合酶链反应(polymerase chain reaction,PCR)扩增内源转录间隔区(internally transcribed spacer,ITS)序列。PCR引物按WHITE T J等[32]报道设计,引物ITS1的序列:5'-TCCGTAGGTGAACCTGCGG-3',引物ITS4的序列:5'-TCCTCCGCTTATTGATATGC-3'。PCR扩增体系为:10×Ex Taq buffer(TaKaRa Bio)5 μL,菌体总DNA2 ng,10 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)1 μL,20 μmol/L的ITS1引物和ITS4引物各0.5 μL,Ex TaqTM聚合酶(TaKaRa Bio)2 μL,加去离子水补足至50 μL。PCR扩增条件为:95 ℃预变性5 min,95 ℃变性50 s,52 ℃退火40 s,72 ℃延伸50 s,30个循环后72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳,回收纯化PCR产物,对ITS基因片段测序,将测序结果登录美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站用GenBank数据库基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比较。检索得到的同源性较高的序列,使用MEGA 5.0软件邻位连接法(neighbor-joining,NJ)构建系统发育树。
1.3.5 发酵工艺优化[35]
(1)单因素试验
设置基础培养条件为2.0%玉米粉、发酵温度27 ℃、发酵时间8 d、初始pH 7、装液量100 mL/250 mL、培养转速200 r/min,通过改变单一变量在不同发酵条件下培养,考察2.0%氮源(酵母膏、玉米粉、黄豆饼粉、蛋白胨)、发酵时间(2d、5d、8d、11 d、14d)、发酵温度(21℃、24℃、27℃、30℃、33 ℃)、初始pH(5、6、7、8、9)、装液量(50 mL/250 mL、75 mL/250 mL、100 mL/250 mL、125 mL/250 mL、150 mL/250 mL)、转速(160 r/min、180 r/min、200 r/min、220 r/min、240 r/min)等不同发酵条件下对米曲霉的抑菌圈直径大小的影响。
(2)正交试验
在单因素试验的基础上,选择对试验结果影响较大的因素,利用正交设计助手Ⅱv3.1,设计3因素3水平的正交试验L9(34)并进行数据分析,对菌株的发酵条件进行优化,正交试验因素与水平见表1。
表1 发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization

因素A 发酵时间/d B 发酵温度/℃C 初始pH 1水平2 3 2 5 8 27 6 30 7 33 8
1.3.6 数据与分析
单因素试验数据采用Excel 2016绘图,正交试验利用正交设计助手Ⅱv3.1进行直观分析和方差分析。
2 结果与分析
2.1 菌株分离筛选结果
从广西宜州的流河寨、会仙山、枫树林等地方共采集9份土样,通过平板法筛选出对4种指示菌具有明显抑菌作用的3株菌,分别命名为Ls2、Hw3、Fh7,对这3株菌的抑菌作用进行测定,结果见表2。
表2 筛选菌株对四株指示菌的抑菌作用
Table 2 Antibacterial effect of screened strains on four indicator strains
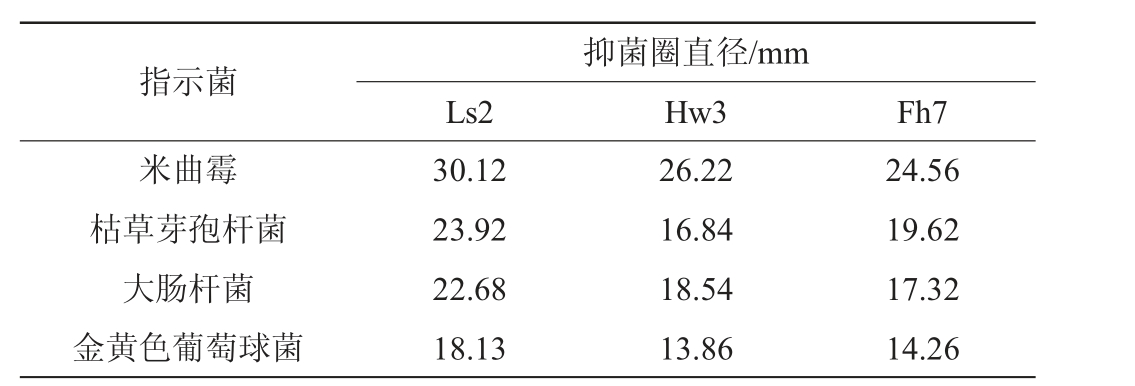
指示菌米曲霉枯草芽孢杆菌大肠杆菌金黄色葡萄球菌抑菌圈直径/mm Ls2 Hw3 Fh7 30.12 23.92 22.68 18.13 26.22 16.84 18.54 13.86 24.56 19.62 17.32 14.26
由表2可知,3株菌对金黄色葡萄球菌的抑制效果最弱,而对其他3种病原菌的抑制效果较强。其中菌株Ls2对4种指示菌的抑菌圈较大,其发酵上清液对米曲霉生成的抑菌圈直径为30.12 mm,是3株菌中抑菌效果最好的,对枯草芽孢杆菌、大肠杆菌和金黄色葡萄球菌也有抑菌作用,抑菌直径分别为23.92 mm,22.68 mm和18.13 mm,因此选择菌株Ls2开展试验,该菌株对金黄色葡萄球菌的抑制效果最弱,对米曲霉的抑菌圈的直径最大,因此后续选择对米曲霉的抑菌圈直径为评价指标。
2.2 菌株Ls2鉴定结果
2.2.1 形态学观察结果
菌株Ls2在高氏一号培养基上观察结果见图1。由图1可知,表面生长紧密,呈乳白色、菌落比较干燥、表面粗糙、边缘整齐、微隆起,有色素产生。经革兰氏染色呈紫色,为革兰氏阳性菌。在光学显微镜下,菌体呈菌丝状,气生菌丝丰富,且不易断裂。
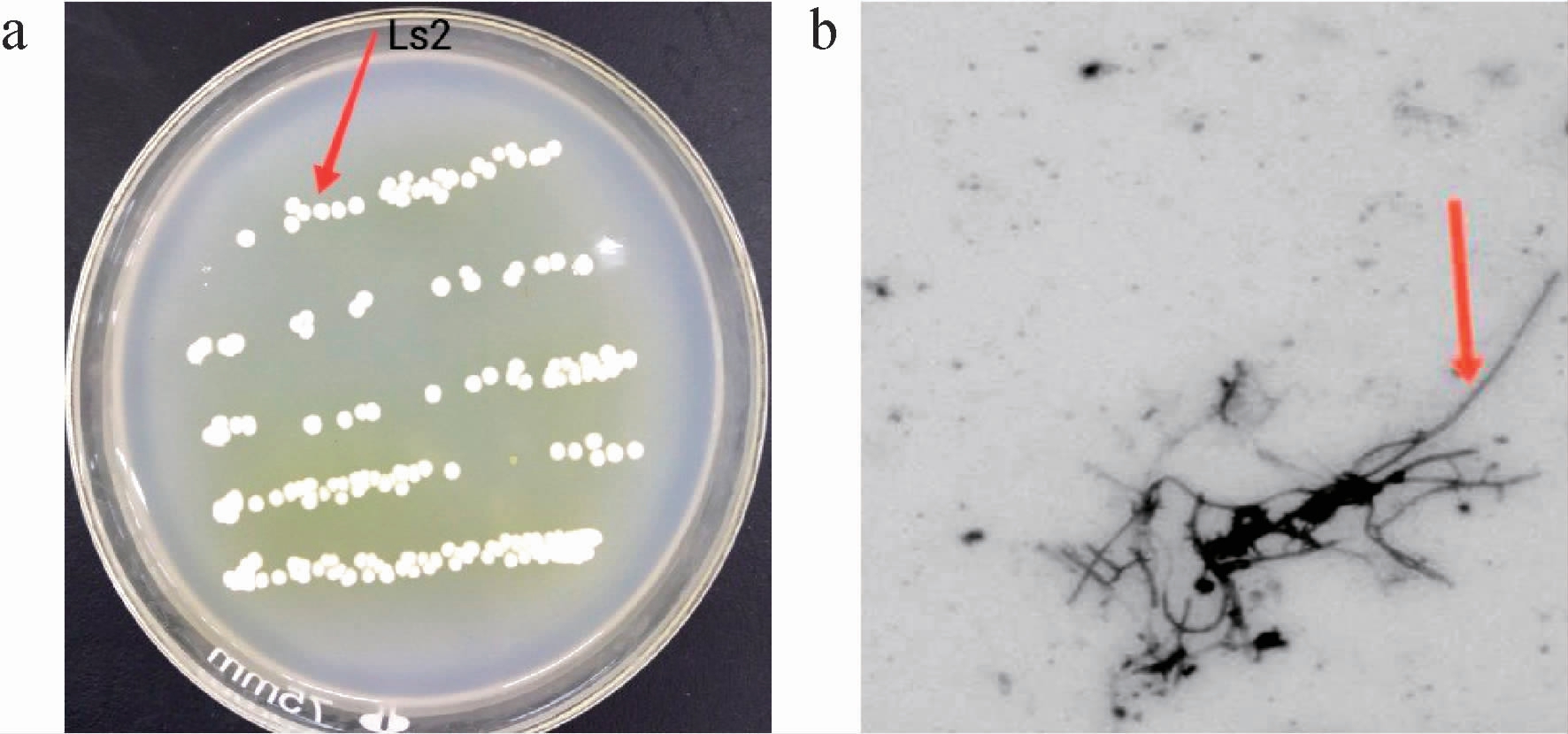
图1 菌株Ls2的菌落(a)和菌丝(b)形态
Fig.1 Colony (a) and mycelium (b) morphology of strain Ls2
2.2.2 菌株Ls2的生理生化试验结果
菌株Ls2的生理生化试验结果见表3。由表3可知,甲基红试验接触酶实验、明胶液化试验结果为阳性,能够利用麦芽糖、甘露醇、葡萄糖、可溶性淀粉。吲哚试验无红色现象出现,菌株不能产生硫化氢和淀粉酶。根据培养特征、形态特征、生理生化试验判断该菌为链霉菌类的球孢类群[36]。
表3 菌株Ls2的生理生化鉴定及碳源利用结果
Table 3 Results of physiological and biochemical identification and carbon source utilization of strain Ls2

注:“+”表示结果为阳性;“-”表示结果为阴性。
项目 结果 项目 结果吲哚V.P甲基红硫化氢碳源利用麦芽糖葡萄糖-- + - + +淀粉水解接触酶明胶液化甘露醇可溶性淀粉-+ + - +
2.2.3 菌株Ls2的分子生物学鉴定
以菌株Ls2的基因组总DNA为模板,使用通用引物进行PCR扩增,得到约1 388 bp的PCR产物片段。将测序结果结果提交至NCBI网站BLAST比对,下载序列相近的菌种,通过Mega7软件采用邻近法构建菌株Ls2的系统发育树,结果见图2。由图2系统进化树表明,菌株Ls2和青蓝链霉菌(Streptomyces caeruleus)在处于同一分支,同源性为92%。依据培养特征、形态特征、生理生化试验及分子生物学鉴定,确定菌株Ls2为青蓝链霉菌(Streptomyces caeruleus)。

图2 基于ITS基因序列菌株Ls2的系统进化树
Fig.2 Phylogenetic tree of strain Ls2 based on ITS gene sequence
2.3 菌株发酵工艺优化单因素试验
2.3.1 不同氮源对菌株Ls2发酵产抑菌物质的影响
考察2%添加量的不同氮源对发酵液抑菌作用的影响,结果见图3。由图3可知,以黄豆饼粉作为氮源时,菌株产对米曲霉的抑菌活性物质最多,发酵效果最好,对米曲霉的抑菌圈直径达到最大,为32.56 mm,玉米粉次之,蛋白胨和酵母膏抑菌作用较差。因此选择最佳氮源为2%黄豆饼粉。
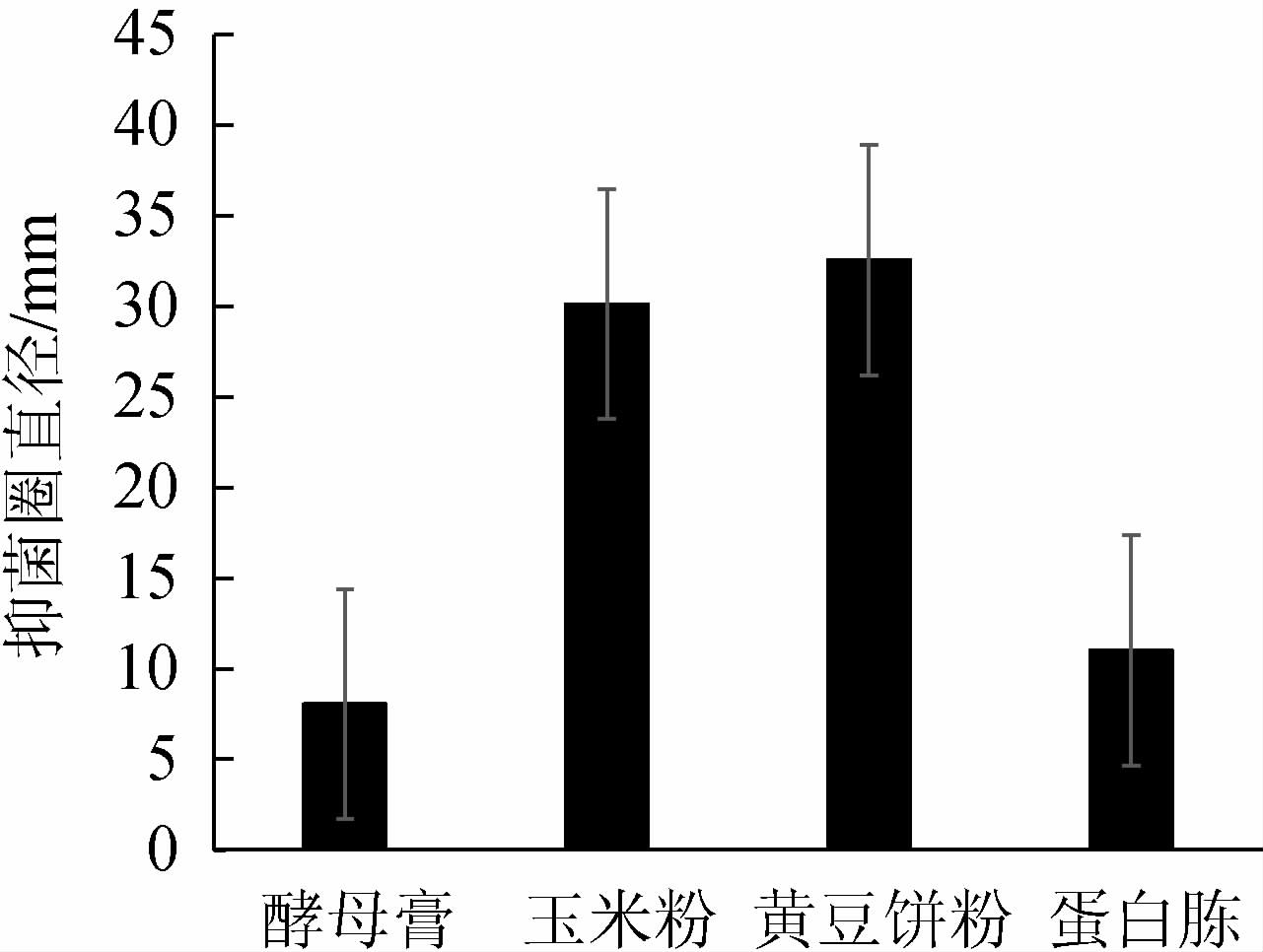
图3 不同的氮源对发酵液抑菌作用的影响
Fig.3 Effect of different nitrogen source on bacteriostasis of fermentation broth
2.3.2 不同发酵时间对菌株Ls2发酵产抑菌物质的影响
发酵时间对菌株产抑菌物质的影响见图4。由图4可知,菌株Ls2第1天没有抑菌活力,在发酵第2天开始具有抑菌活力,随着发酵时间增加,抑菌能力逐步加强,发酵到第5天菌株抑菌能力最强,对米曲霉的抑菌圈直径为33.12 mm。5 d后抑菌能力开始有较明显的下降趋势,在11 d后趋于平缓。培养时间长碳源、氮源等营养物质消耗多,营养物质缺乏影响菌体生长,导致抑菌活性物质减少。因此,最佳发酵时间为5 d。
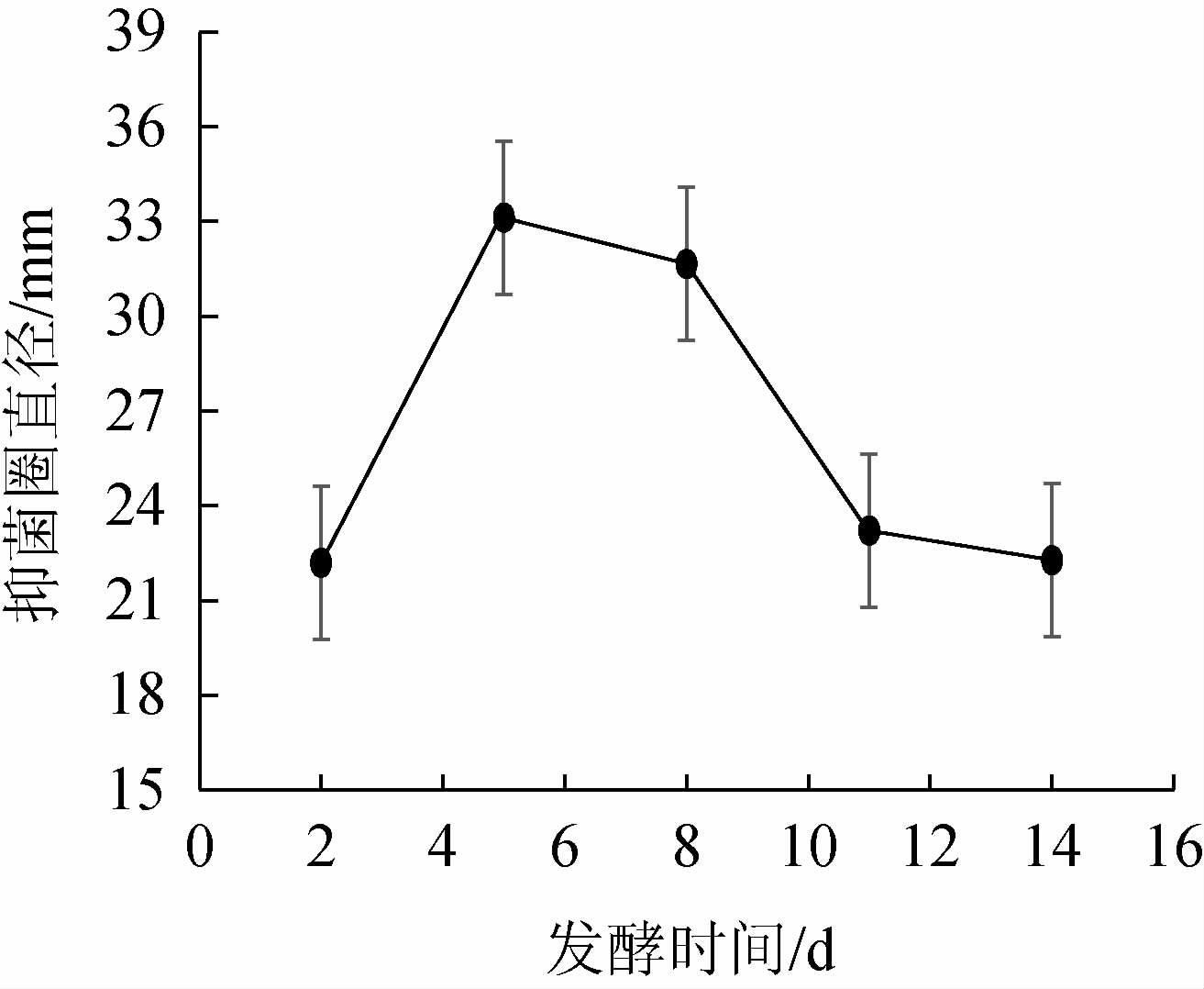
图4 发酵时间对发酵液抑菌作用的影响
Fig.4 Effect of fermentation time on bacteriostasis of fermentation broth
2.3.3 不同发酵温度对菌株Ls2发酵产抑菌物质的影响
发酵温度对菌株Ls2产抑菌物质的影响结果见图5。由图5可知,发酵温度21~27 ℃时,会延长菌体发酵时间,菌种生长受到影响,严重影响到发酵的效率,从而对抑菌物质的合成有一定的影响;随发酵温度增高,菌种生长逐渐变好,发酵温度为30 ℃时,菌种生长良好,抑菌能力最强,抑菌圈直径为31.08 mm;发酵温度超过30 ℃时,会导致微生物体内的酶失活,对菌种生长有不良影响,导致抑菌物质合成的产量降低或改变其抑菌性能,随着温度的升高,抑菌能力明显降低[37]。因此,最佳发酵温度为30 ℃。
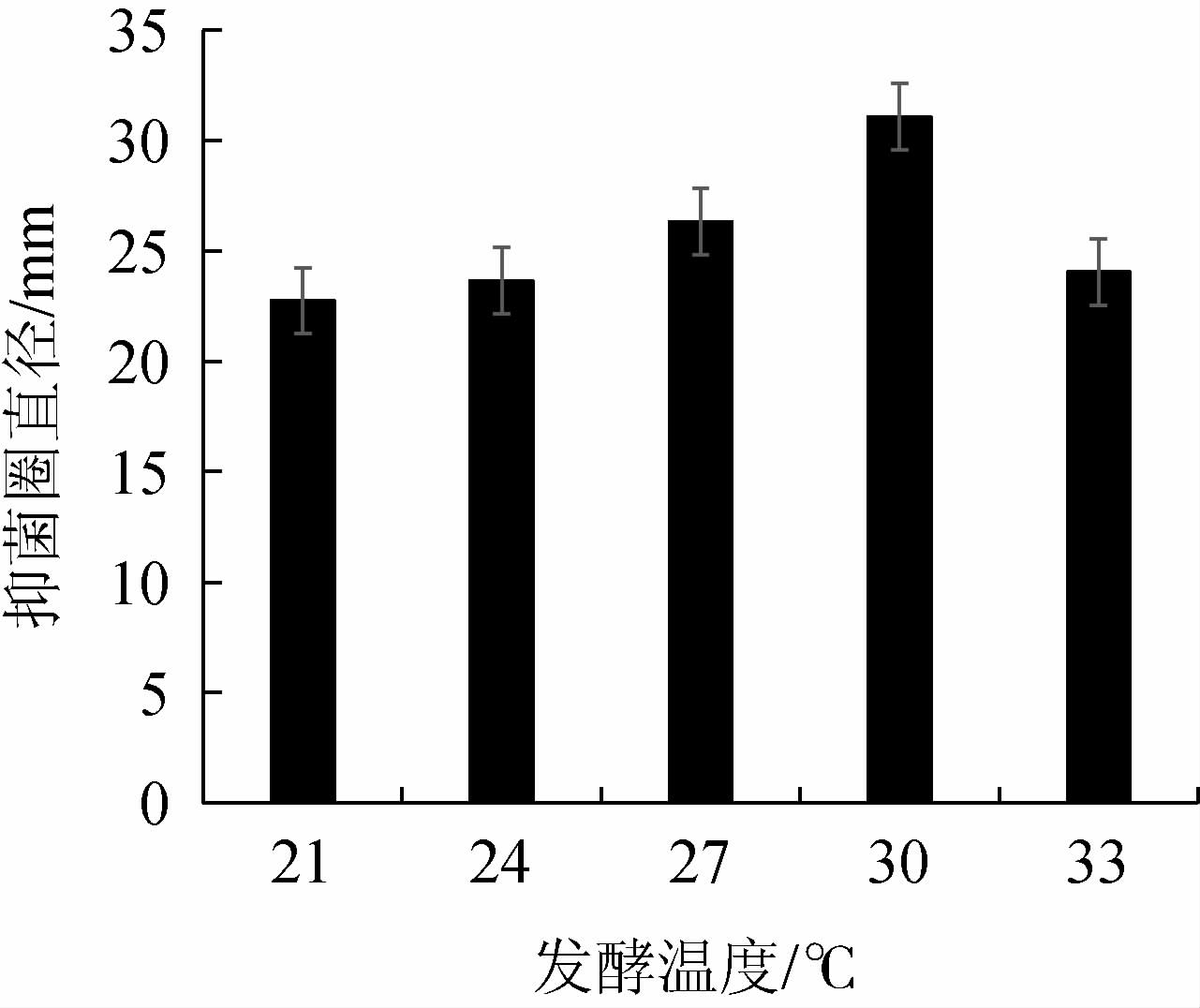
图5 发酵温度对发酵液抑菌作用的影响
Fig.5 Effect of fermentation temperature on bacteriostasis of fermentation broth
2.3.4 不同初始pH值对菌株Ls2发酵产抑菌物质的影响
初始pH值对菌株Ls2产抑菌物质的影响结果见图6。由图6可知,如果发酵液初始pH值>7,发酵液整体的内环境呈碱性,降低了菌株Ls2对营养物质的吸收及利用率,pH值过大或过小,生产的抑菌物质越少,导致菌体多种酶的活性降低,从而影响菌体的生长状况,导致产生的抑菌物质降低[37]。当pH为7时菌种生长良好,所产发酵液抑菌能力最好,抑菌圈直径最大,达到32.13 mm。因此,发酵液最佳初始pH值为7。
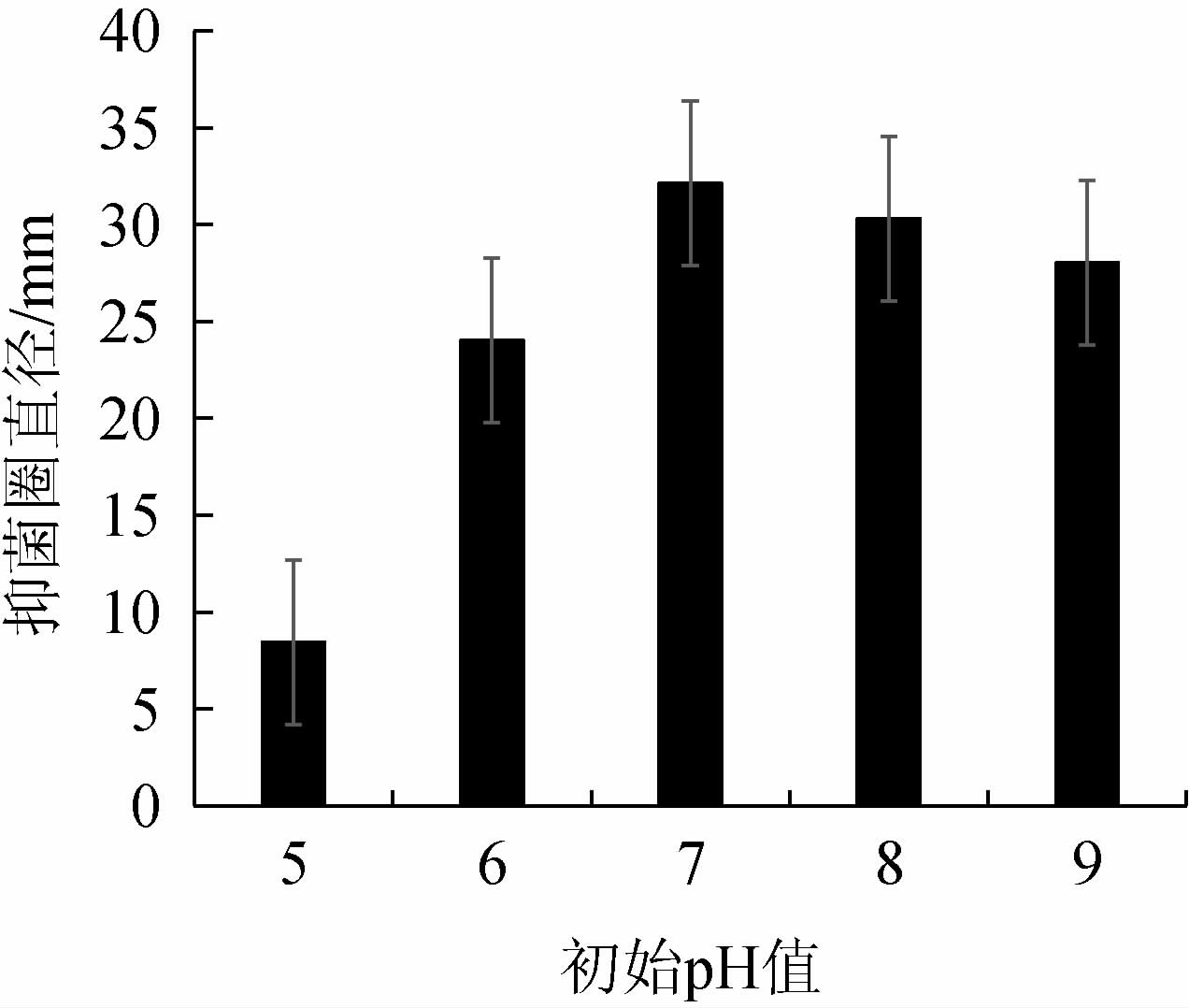
图6 初始pH值对发酵液抑菌作用的影响
Fig.6 Effect of initial pH on bacteriostasis of fermentation broth
2.3.5 不同装液量对Ls2菌株发酵产抑菌物质的影响
不同装液量对菌株Ls2发酵产抑菌物质的影响见图7。由图7可知,随着装液量的增加,抑菌圈直径呈先上升后下降的趋势,装液量少时营养物质不足,将影响菌种生长及抑菌物质合成。当装液量为125 mL/250 mL时,菌种将获得较充足氧气及生长饲料,菌种生长良好,所产发酵液抑菌能力最好,抑菌圈直径为32.74 mm,如果装液量超过125 mL/250 mL,导致氧气供给不足,将影响菌种生长及抑菌物质合成。因此,最佳装液量为125 mL/250 mL。
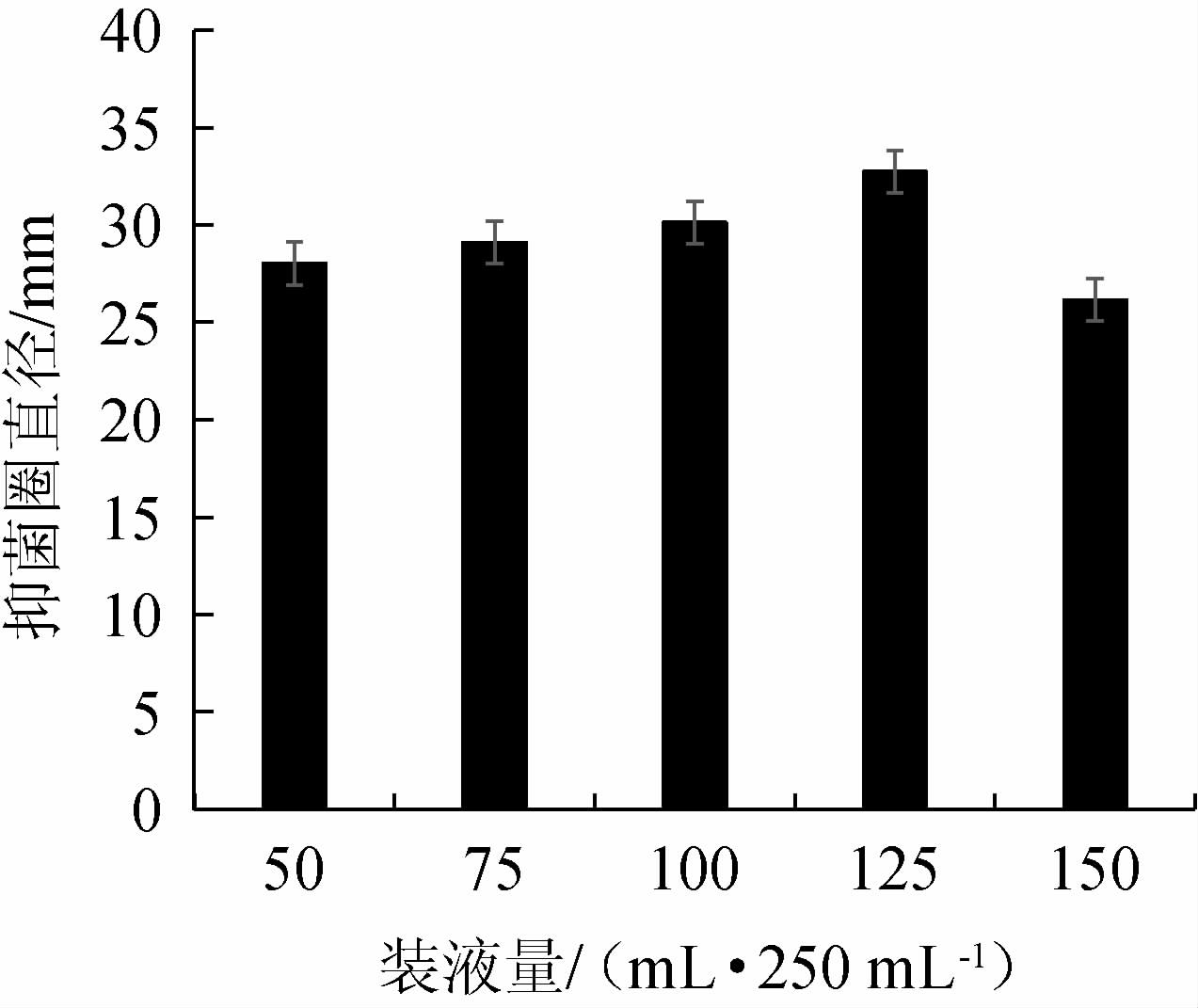
图7 装液量对发酵液抑菌作用的影响
Fig.7 Effect of liquid loading volume on bacteriostasis of fermentation broth
2.3.6 不同转速对菌株Ls2发酵产抑菌物质的影响
不同转速对菌株Ls2发酵产抑菌抑菌物质的影响见图8。由图8可知,抑菌圈随着转速的增加呈现先上升后下降的趋势,转速为220r/min时,提供氧气较充足,菌株Ls2生长良好,发酵液抑菌能力最好,抑菌圈直径为32.65 mm。如果转速低于220 r/min,转速慢,供氧不足,将影响菌种生长及抑菌物质合成。如果转速高于220 r/min,过快转速导致菌种破裂死亡,将影响菌种生长及抑菌物质合成。因此,菌株Ls2培养的最佳转速为220 r/min。
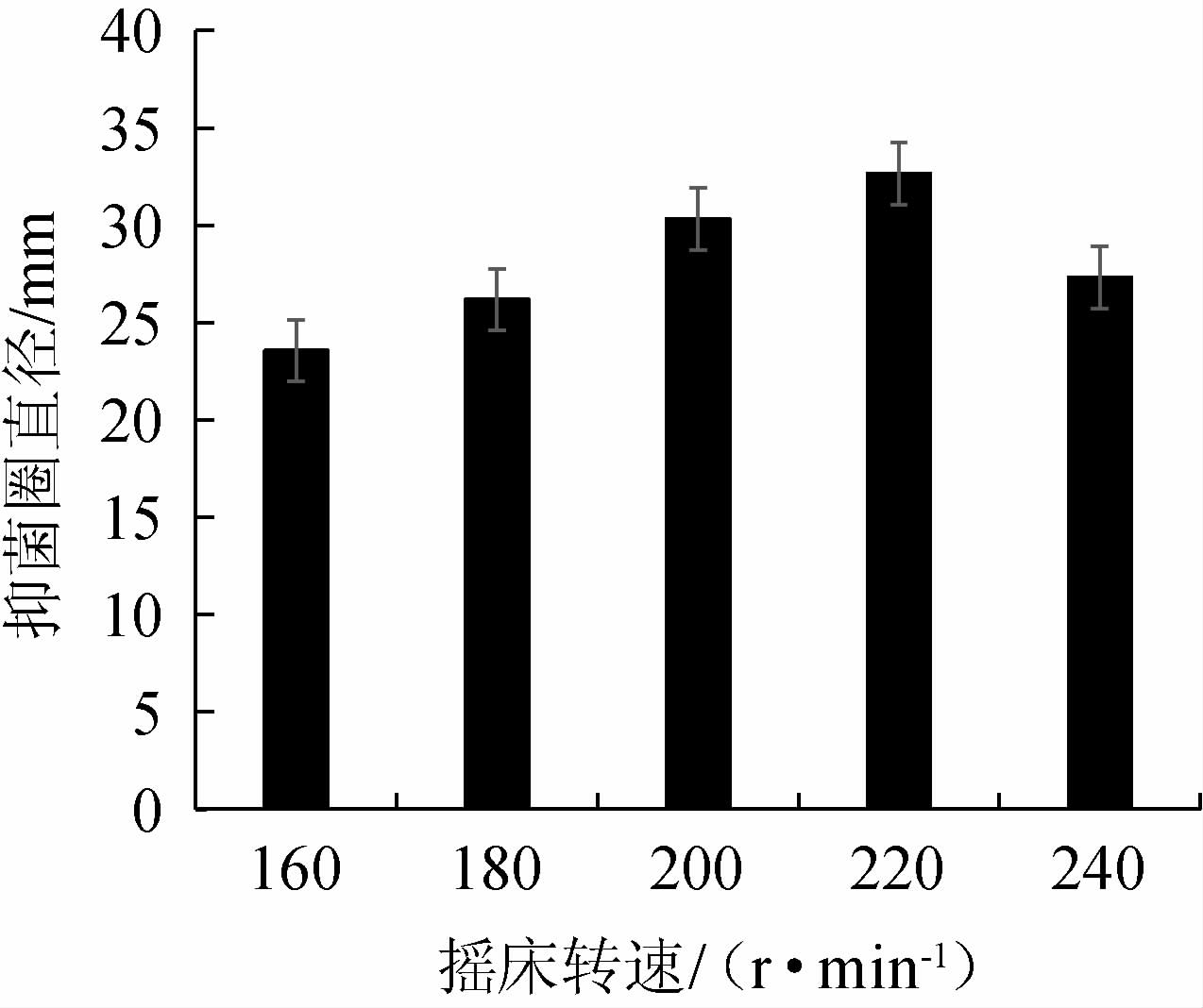
图8 转速对发酵液抑菌作用的影响
Fig.8 Effect of rotating speed on bacteriostasis of fermentation broth
2.4 发酵工艺优化正交试验结果
在单因素试验的基础上,选择影响结果比较大的发酵时间(A)、发酵温度(B)、初始pH(C)为试验因素,设置(D)为空白,以抑菌圈直径为评价指标开展正交试验,试验结果及方差分析分别见表4和表5。
表4 发酵条件优化正交试验结果与分析
Table 4 Results and analysis of orthogonal experiments for fermentation conditions optimization
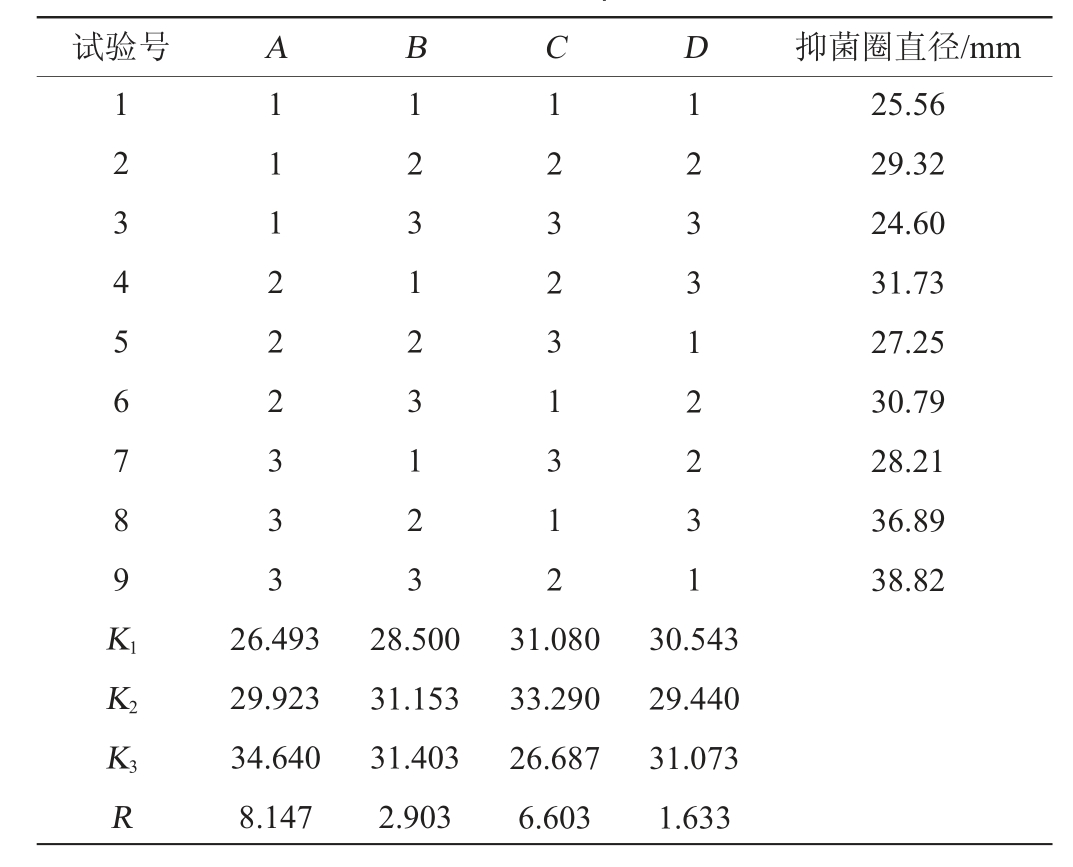
试验号 A B C D 抑菌圈直径/mm 1 2 3 4 5 6 7 8 9 K1 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 1 2 3 3 1 2 2 3 1 25.56 29.32 24.60 31.73 27.25 30.79 28.21 36.89 38.82 K2 K3R 26.493 29.923 34.640 8.147 28.500 31.153 31.403 2.903 31.080 33.290 26.687 6.603 30.543 29.440 31.073 1.633
表5 正交试验结果方差分析
Table 5 Variance analysis of orthogonal experiments results
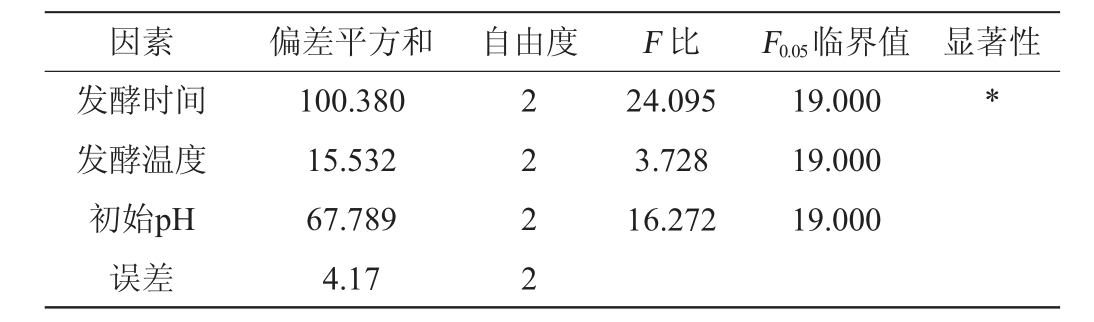
注:“*”表示对结果影响显著(P<0.05)。
因素 偏差平方和 自由度 F 比 F0.05临界值 显著性发酵时间发酵温度初始pH误差100.380 15.532 67.789 4.17 2 2 2 2 24.095 3.728 16.272 19.000 19.000 19.000*
由表4可知,RA>RC>RB,可以看出影响菌株发酵的3个因素中,对发酵影响的顺序为发酵时间>初始pH>发酵温度。A3B3C2为最优发酵组合,即发酵时间为8 d,发酵温度为33 ℃,初始pH为7在此条件下,发酵液抑菌圈直径由优化前的30.12 mm扩大到38.82 mm。
由表5可知,3个因素中发酵时间对抑菌效果的影响显著(P<0.05)。其余两个因素对抑菌效果的影响未达到显著水平(P>0.05)。
3 结论
本文对宜州的流河寨采集的9份土样进行筛选分离,分离筛选得到3株对4种病原菌的有抑制效果的菌株,分别命名为Ls2、Hw3、Fh7,3株菌对金黄色葡萄球菌的抑制效果最弱,而对其他3种病原菌的抑制效果较强,其中菌株Ls2对4种指示菌的抑菌圈较大。经过形态特征、培养特征、生理生化特性观察以及分子生物学鉴定,鉴定菌株Ls2为青蓝链霉菌(Streptomyces caeruleus)。确定最优发酵条件为:发酵培养基添加2%黄豆饼粉,发酵时间8 d,初始pH7,发酵温度33 ℃,装液量125 mL/250 mL,摇床转速220 r/min。在此发酵条件下,菌株Ls2对米曲霉的抑菌圈直径为38.82 mm,青蓝链霉菌Ls2对一些致病菌具有较好抑菌效果,具有添加生产发酵饲料的潜能。
[1]鄢贵龙.黄曲霉毒素的生物学去除方法[J].中国饲料,2006(5):29-31.
[2]刘端木,吴怿,刘沄,等.一株产毒曲霉拮抗细菌的筛选、鉴定及抑菌活性研究[J].生物技术通报,2019(8):42-50.
[3]饲料和饲料添加剂管理条例,行政法规库,中国政府网,[EB/OL].http://www.gov.cn/zhengce/2020-12/26/content_5574205.htm.
[4] JIN W, ZHANG Z, ZHU K, et al.Comprehensive understanding of the bacterial populations and metabolites profile of fermented feed by 16S rRNA gene sequencing and liquid chromatography-mass spectrometry[J].Metabolites,2019,9(10):239.
[5]秦红,赵燕,车向荣,等.乳酸片球菌对肥育猪生长性能及肠道抗氧化能力、形态结构和菌群的影响[J].动物营养学报,2017,29(8):2953-2960.
[6]LEE S H,INGALE S L,KIM J S,et al.Effects of dietary supplementation with Bacillus subtilis LS 1-2 fermentation biomass on growth performance,nutrient digestibility,cecal microbiota and intestinal morphology of weanling pig[J].Animal Feed Sci Technol,2014,188:102-110.
[7]YANG L J, ZENG X F, QIAO S Y.Advances in research on solid-state fermented feed and its utilization: The pioneer of private customization for intestinal microorganisms[J].Anim Nutr,2021,7(4):905-916.
[8]晨曦.中草药菌酶协同发酵及在中华鳖养殖中的应用[D].镇江:江苏大学,2022.
[9]赵超.豆渣与玉米秸秆混合发酵制备及饲喂奶牛效果的研究[D].哈尔滨:东北农业大学,2021.
[10]EICHER S D,MCKEE C A,CARROLL J A,et al.Supplemental vitamin C and yeast cell wall beta-glucan as growth enhancers in newborn pigs and as immunomodulators after an endotoxin challenge after weaning[J].J Anim Sci,2006,84(9):2352-2360.
[11] MAZOTTO A M, COELHO R R, CEDROLA S M, et al.Keratinase production by three Bacillus spp.using feather meal and whole feather as substrate in a submerged fermentation[J].Enzyme Res,2011,2011:523780.
[12]YING W,ZHU R,LU W,et al.A new strategy to apply Bacillus subtilis MA139 for the production of solid-state fermentation feed[J].Lett Appl Microbiol,2009,49(2):229-234.
[13]MISSOTTEN J A,MICHIELS J,DEGROOTE J,et al.Fermented liquid feed for pigs:an ancient technique for the future[J].J Anim Sci Biotechnol,2016,7(1):1-9.
[14]高乾坤,杜贺超,赵云飞,等.不同生物保鲜剂对带鱼冷藏保鲜效果的比较[J].食品工业科技,2018(22):270-275.
[15]王雅妮,孙畅,赵汉青,等.复配生物防腐剂对面包防腐效果[J].食品工业,2023(1):63-66.
[16]冯定远.酶制剂在饲料养殖中发挥替代抗生素作用的领域及其机理[J].饲料工业,2020,41(12):1-10.
[17]王聪,韩兴,刘海涛,等.不同农用抗生素诱导烟草灰霉病抗性的研究[J].农药,2021(11):825-828.
[18]萨姆布鲁克.分子克隆实验指南[M].3版.黄培堂译.北京:科学出版社,2002:87-100.
[19]王聪,王坤,姜明国,等.广西北部湾放线菌的分离筛选及活性产物的鉴定[J].天然产物研究与开发,2019,31(7):1170-1176.
[20]韩秀芳.土壤放线菌分离菌株的分类鉴定与拮抗性筛选[D].北京:北京理工大学,2015.
[21]张晓伟,解修超,张曼,等.2株三尖杉内生放线菌的分离鉴定与活性研究[J].江苏农业科学,2012,40(5):296-299.
[22]闫坤.海洋微生物TXC6-6次级代谢产物中活性组分的分离纯化[D].上海:上海师范大学,2014.
[23]季文平.番茄枯萎病菌拮抗放线菌筛选及其代谢产物研究[D].扬州:扬州大学,2020.
[24]张轩.矿区复合重金属污染杨树生态区细菌多样性及重金属耐受内生菌筛选[D].长沙:湖南大学,2019.
[25]宋红丽,杨佳夷,郑立,等.抗铜绿假单胞菌南极微生物的筛选、鉴定及其抑菌谱研究[J].中国酿造,2022,41(11):108-112.
[26]徐麓凯,刘一平,韩袁彤,等.抗副溶血弧菌海洋微生物的筛选、鉴定及抑菌谱研究[J].中国酿造,2022,41(11):61-65.
[27]崔佳佳,张雪洪.微生物源农用抗生素的研发与高产策略[J].生物工程学报,2021(3):1032-1041.
[28]何海燕,方晓欣,梁榕,等.水中农用抗生素产生菌的筛选鉴定及耐药性的诱变育种[J].饲料研究,2019(8):50-54.
[29]李培谦,药震,邵元元,等.黄瓜枯萎病拮抗放线菌的筛选及防治效果[J].江苏农业科学,2022,(17):115-121.
[30]马妍,孙长坡,王峻,等.T-2毒素降解菌株的筛选、鉴定与降解机制研究[J].食品科学,2022,33(12):1-15.
[31]MICHAELSON L V,LAZARUS C M,GRIFFITHS G,et al.Isolation of a Deta-5-fatty acid desaturase gene from Mortierella alpine[J].J Biol Chem,1998,273(30):19055-19059.
[32]WHITE T J,BRUNS T,LEE S,et al.Amplification and direct sequencing of fungal ribosoma genes for phylogenetics//[M].PCR protocols:a guide to methods and applications.New York:Academic Press,1990:315-322.
[33]刘闰,赵国先,刘观忠,等.菌酶协同发酵饲料对蛋鸡生产性能、养分表观消化率和粪中氨气排放的影响[J].饲料研究,2022,45(18):29-33.
[34]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975:72-95.
[35]任玉文,任媛媛,刘雅祯.抗植物软腐病枯草芽孢杆菌的高密度发酵优化[J].河北科技大学学报,2020,41(5):433-441.