几丁质(聚β-1,4-N-乙酰-D-葡糖胺)是一种β-1,4-N-乙酰氨基葡萄糖的聚合物,也称甲壳素,是自然界中仅次于纤维素存在的第二大多糖[1],其主要来源于真菌细胞壁、昆虫外骨骼和甲壳类动物[2]。据估计,在自然界几丁质每年产量约为1 010~1 011 t,是地球上最丰富的未被充分开发的生物质资源之一[3]。在原生状态下,几丁质以有序的晶体微纤维形式存在,不溶于水、稀酸、碱和其他有机溶剂,在浓酸中不稳定,易发生糖苷键的断裂[4]。采用适当的方法降解几丁质,可得到不同聚合度的水溶性几丁寡糖(chitin oligosaccharides,NACOS)或壳寡糖(chitosan oligosaccharide,COS)及其衍生物。作为一种功能性生物聚合物,几丁质降解产物具有抗氧化、抗菌、抗肿瘤、保湿补水及增强机体免疫功能等多种生物活性,因其生物相容性、细胞膜渗透性和可生物降解等独特特性,受到了广泛的关注[5],被应用于医药、化妆品、食品和农业等多个行业[6-9]。
目前,制备几丁寡糖的方法主要有化学法、物理法和生物法[10],这些方法各有优点和局限性。不同水解方法提供了不同分子质量和脱乙酰程度的壳聚糖,影响其组成、收率和功能[11]。化学法以酸水解为主,简单、高效,但是壳聚糖颗粒中的刚性结晶区域会抑制酸的渗透。因此,在大多数研究中使用的是5~12 mol/L的高浓度酸。过多的酸负荷会导致葡萄糖胺降解,从而显著降低产量,导致产品品质不均、副产物多,另外还会造成严重的设备腐蚀和环境污染问题[12]。物理法有超声、微波[13]、伽马辐射[14]等方式,缺点是能耗高。生物法主要是生物酶法,利用专一性几丁质酶或非专一性酶对几丁质进行水解,其具有聚合程度可控、副产物少、反应条件温和、绿色环保等优点[10]。
几丁质酶来源十分广泛,多种产几丁质酶的菌株已被报道,主要包括曲霉属(Aspergillus)[15]、链霉菌属(Streptomyces)、沙雷菌属(Serratia)、假单胞菌属(Pseudomonas)、弧菌属(Vibrio)、芽孢杆菌属(Bacillus)和类芽孢杆菌属(Paenibacillus)[16-17],还包括粘球菌属(Mucococcus)[18]、发光杆菌属(Photobacterium)和希瓦氏菌属(Shewanella)[19]等,但这些菌株所产几丁质酶存在酶活力不高、生产周期长、成本高等问题。近年来,国内产几丁质酶菌株的研究多集中在海洋微生物资源的发掘[20-23],对于内陆土壤尤其是高原菌开展的研究较少。“世界屋脊”青藏高原地形及环境特殊,有大量特色微生物资源亟待挖掘。因此,本研究采用透明圈法及酶活力测定从日喀则地区采集的土壤样品中分离、筛选高产几丁质酶的菌株,并对所获得的菌株进行鉴定及酶学性质研究,以期发现所产几丁质酶的特性,为后期利用其几丁质酶基因构建工程菌并在生产上应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
土壤样品:采自西藏日喀则地区(北纬29°14′11″,东经88°53′59″,海拔3 685 m)。
1.1.2 溶液及培养基
5%的胶体几丁质溶液:称取10 g粉末几丁质加入到200 mL浓盐酸中,盖保鲜膜,于磁力搅拌器搅拌过夜;将酸解后的液体倒入预冷的2.5 L蒸馏水中,搅拌均匀,4 ℃静置过夜;8 000 r/min离心10 min,将上清液倒出,加入预冷的蒸馏水重悬,再静置,多次反复,直到悬浊液pH为5.0;最后将离心后的胶体加入200 mL去离子水。
初筛培养基[22]:胶体几丁质1%,K2HPO4 0.07%,KH2PO4 0.03%,MgSO4·7H2O 0.05%,ZnSO4 0.001%,琼脂2%,pH自然。121 ℃高压蒸汽灭菌20 min。
复筛培养基(发酵培养基)[22]:胶体几丁质1%,K2HPO4 0.07%,KH2PO4 0.03%,MgSO4·7H2O 0.05%,ZnSO4 0.001%,pH自然。121 ℃高压蒸汽灭菌20 min。
营养琼脂(nutrient agar,NA)培养基:青岛海博生物技术有限公司。
1.1.3 试剂
革兰氏染色试剂盒、几丁质、几丁质酶活检测试剂盒(微量法):北京索莱宝科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Omega Bio-Tek公司;2×Taq 聚合酶链式反应(polymerase chain reaction,PCR)StarMix:北京康润诚业生物科技有限公司;菌株16S rDNA基因PCR扩增通用引物27F、1492R、D2000 Plus DNALadder:北京六合华大基因科技有限公司;GF254薄层层析(thin layer chromatography,TLC)板:德国Merck公司;几丁寡糖(≥98%):青岛和海生物科技有限公司。
1.2 仪器与设备
DRP-9052型电热恒温培养箱:上海森信实验仪器有限公司;QYC-2012C恒温摇床:上海福玛实验设备有限公司;Multifuge X1R离心机:德国Thermo公司;Thermoblock PCR扩增仪:德国Biometra公司;System蛋白质双向电泳系统、ChemiDoc XRS+化学发光成像分析系统:美国Bio-Rad公司;Axio Image M2全电动正置荧光显微镜:德国Zeiss公司。
1.3 方法
1.3.1 产几丁质酶菌株的筛选
初筛:采用梯度稀释法分离菌株。称取10 g土样加入90 mL放有玻璃珠的蒸馏水中,打散后涂布于初筛培养基平板,28 ℃培养至透明圈产生,挑选透明圈直径(D)与菌落直径(d)比值大的菌株作为初筛菌株。
复筛:将初筛获得的菌株接种于复筛培养基中,28 ℃、180 r/min摇床培养36~48 h,8 000 r/min离心10 min后取上清获得粗酶液,37 ℃测定粗酶液中几丁质酶活性,比较酶活力大小,选取酶活最高的菌株。
1.3.2 几丁质酶活力的测定
参照几丁质酶活检测试剂盒说明书测定几丁质酶活性。几丁质酶活力定义为:在一定的反应条件下,每毫升液体每小时分解几丁质产生1 μg N-乙酰氨基葡萄糖的酶量为1个酶活性单位(U/mL)。
1.3.3 高产几丁质酶菌株的鉴定
形态学观察:将分离纯化的单菌落接种到NA培养基平板上,28 ℃倒置培养24~48 h,观察菌落特征;对细菌进行染色,通过光学显微镜观察形态。
生理生化鉴定:参照《常见细菌系统鉴定手册》[24]对菌株进行生理生化鉴定。
分子生物学鉴定:使用Omega细菌基因组提取试剂盒获得筛选菌株的基因组DNA,以其为模板,采取通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增16S rDNA基因序列片段。PCR扩增体系:2×Taq PCR StarMix 12.5 μL,模板DNA 1 μL,上、下游引物各1 μL,超纯水9.5 μL。PCR扩增条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,30个循环;72 ℃再延伸10 min。将PCR扩增产物用1%琼脂糖凝胶电泳检测后送北京六合华大基因科技有限公司测序。测序结果在ezbiocloud网站中进行比对分析,利用MEGA6.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 粗酶液酶学性质初步研究
最适温度以及温度稳定性:在不同温度(30 ℃、40 ℃、50 ℃、60 ℃)下测定粗酶液的酶活力,确定最适反应温度。将粗酶液在不同温度(30 ℃、40 ℃、50 ℃、60 ℃)下保温2 h后测定剩余酶活。以最大酶活力值计为100%,计算出其余处理的相对酶活。
最适pH以及pH稳定性:在不同pH值(4.0、5.0、6.0、7.0、8.0、9.0、10.0)条件,最适反应温度下测定酶活力,确定最适反应pH。将粗酶液在不同pH(4.0、5.0、6.0、7.0、8.0、9.0、10.0)缓冲液体系中4 ℃放置2 h,最适反应温度条件下测定剩余酶活。以最大酶活力值计为100%,计算出其余处理的相对酶活。
不同金属离子及化合物对酶活力的影响:在不同处理中加入Mg2+、Ba2、Zn2+、Mn2+、Fe2+、K+、Ca2+、Cr2+、Ag+、Co2+、Na+、Tween-80、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF),使其在反应体系中终浓度为2 mmol/mL,在最适反应温度、pH条件下测定酶活力。以未加金属离子及化合物的酶活力为100%,计算出其余处理的相对酶活。
1.3.5 粗酶液对几丁质的降解产物分析
将粗酶液与底物胶体几丁质以1∶1比例混合,分别在30 ℃、40 ℃、50 ℃、60 ℃条件下反应12 h,沸水浴5 min终止反应,离心,取上清液进行薄层层析[25],上样量5 μL,以几丁单糖和几丁寡糖(N-乙酰氨基葡萄糖、几丁二糖、几丁三糖、几丁四糖)含量分别为10 mg/mL的混合溶液为标样,阴性对照为缓冲液代替底物反应的上清液。展层剂为正丁醇-乙酸-水(2∶1∶1,V/V),展层结束后吹干,均匀喷洒显色剂(二苯胺1 g、苯胺1 mL、丙酮50 mL、磷酸5 mL),85 ℃条件下显色10 min。
2 结果与分析
2.1 高产几丁质酶菌株的筛选
采用透明圈法从日喀则地区土壤中分离筛选到16株产透明圈的菌株,进一步经酶活测定复筛,最终获得5株产几丁质酶菌株,其几丁质酶活力见图1。由图1可知,5株菌株的几丁质酶活力为49.77~242.36 U/mL,其中菌株RGZ2-4-5的几丁质酶活力最高,为242.36 U/mL。因此,选择菌株RGZ2-4-5为高产几丁质酶的菌株。
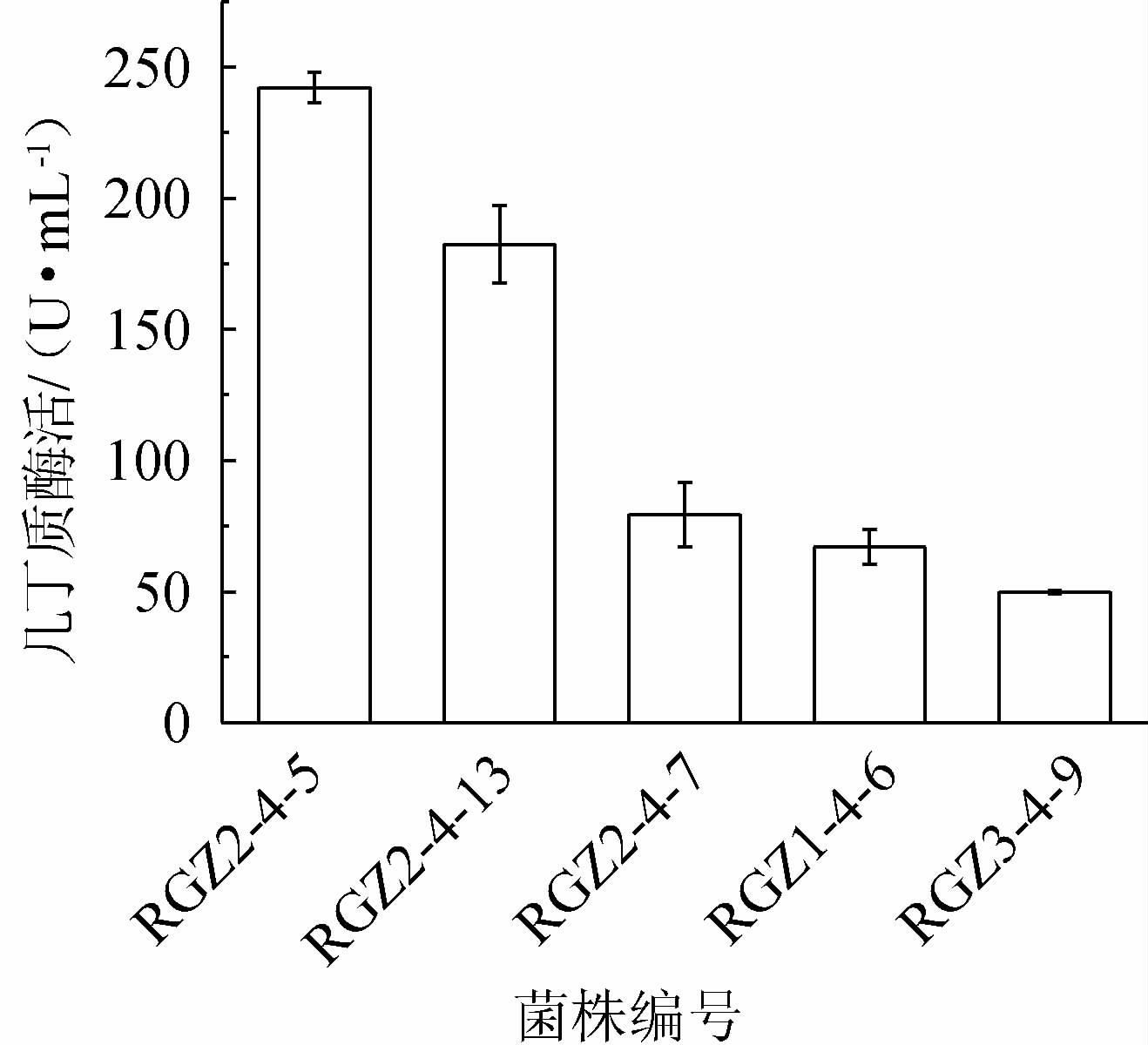
图1 产几丁质酶菌株筛选结果
Fig.1 Screening results of chitinase-producing strains
2.2 菌株RGZ2-4-5的鉴定
2.2.1 形态学观察
菌株RGZ2-4-5的菌落及细胞形态见图2。由图2可知,菌株RGZ2-4-5的菌落呈乳白色,半透明状,为边缘规则的圆形,表面光滑、湿润,革兰氏染色为阴性,细胞呈棒状。

图2 菌株RGZ2-4-5的菌落(a)及细胞(b)形态特征
Fig.2 Colony (a) and cell (b) morphological characteristics of strain RGZ2-4-5
2.2.2 生理生化试验
菌株RGZ2-4-5的生理生化鉴定结果见表1。由表1可知,菌株RGZ2-4-5的氧化酶、接触酶试验结果呈阳性,能使明胶液化、Tween-80水解。结合形态观察,参照《常见细菌系统鉴定手册》初步鉴定菌株RGZ2-4-5为马赛菌属(Massilia sp.)。
表1 菌株RGZ2-4-5的生理生化试验结果
Table 1 Physiological and biochemical test results of strain RGZ2-4-5
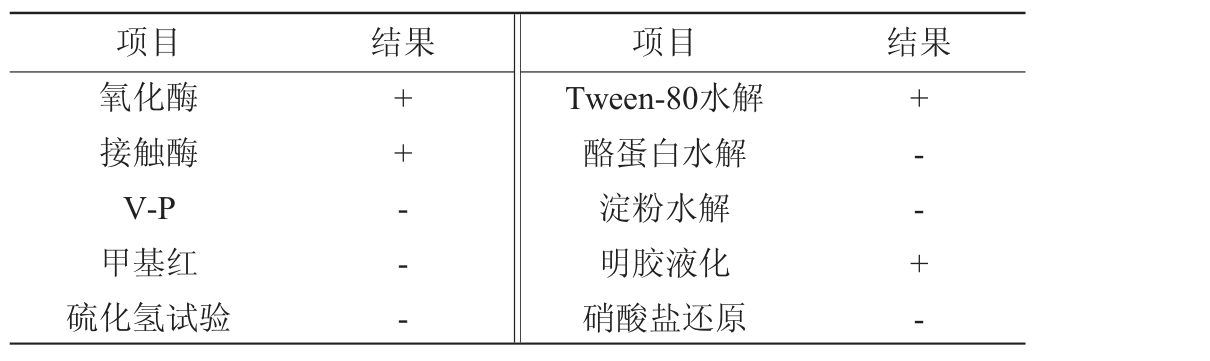
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
项目 结果 项目 结果氧化酶接触酶V-P甲基红硫化氢试验++---Tween-80水解酪蛋白水解淀粉水解明胶液化硝酸盐还原+--+-
2.2.3 分子生物学鉴定
基于16S rDNA基因序列构建菌株RGZ2-4-5的系统发育树,结果见图3。

图3 基于16S rDNA基因序列菌株RGZ2-4-5的系统进化树
Fig.3 Phylogenetic tree of strain RGZ2-4-5 based on 16S rDNA gene sequences
由图3可知,菌株RGZ2-4-5的16S rDNA基因序列与Massilia aquatica FT 127WT聚于同一分支,亲缘关系最近。基于形态学观察、生理生化试验和分子生物学技术,最终鉴定菌株RGZ2-4-5为Massilia aquatica。
2.3 菌株RGZ2-4-5产几丁质酶酶学性质初步研究
2.3.1 温度对几丁质酶活力的影响及温度稳定性
由图4可知,在30~60 ℃之间,几丁质酶活力随反应温度的升高呈先升高后下降的趋势,当反应温度为50 ℃时,酶活力最高,为223.06 U/mL。因此,确定最适反应温度为50 ℃。由图4亦可知,温度越低,几丁质酶越稳定,40 ℃以下保温处理2 h,酶活力能保持在60%以上,高于40 ℃后迅速失活,50 ℃保温2 h后相对酶活力仅为24.21%。结果表明,菌株RGZ2-4-5所产的几丁质酶不耐高温,属于中低温几丁质酶。
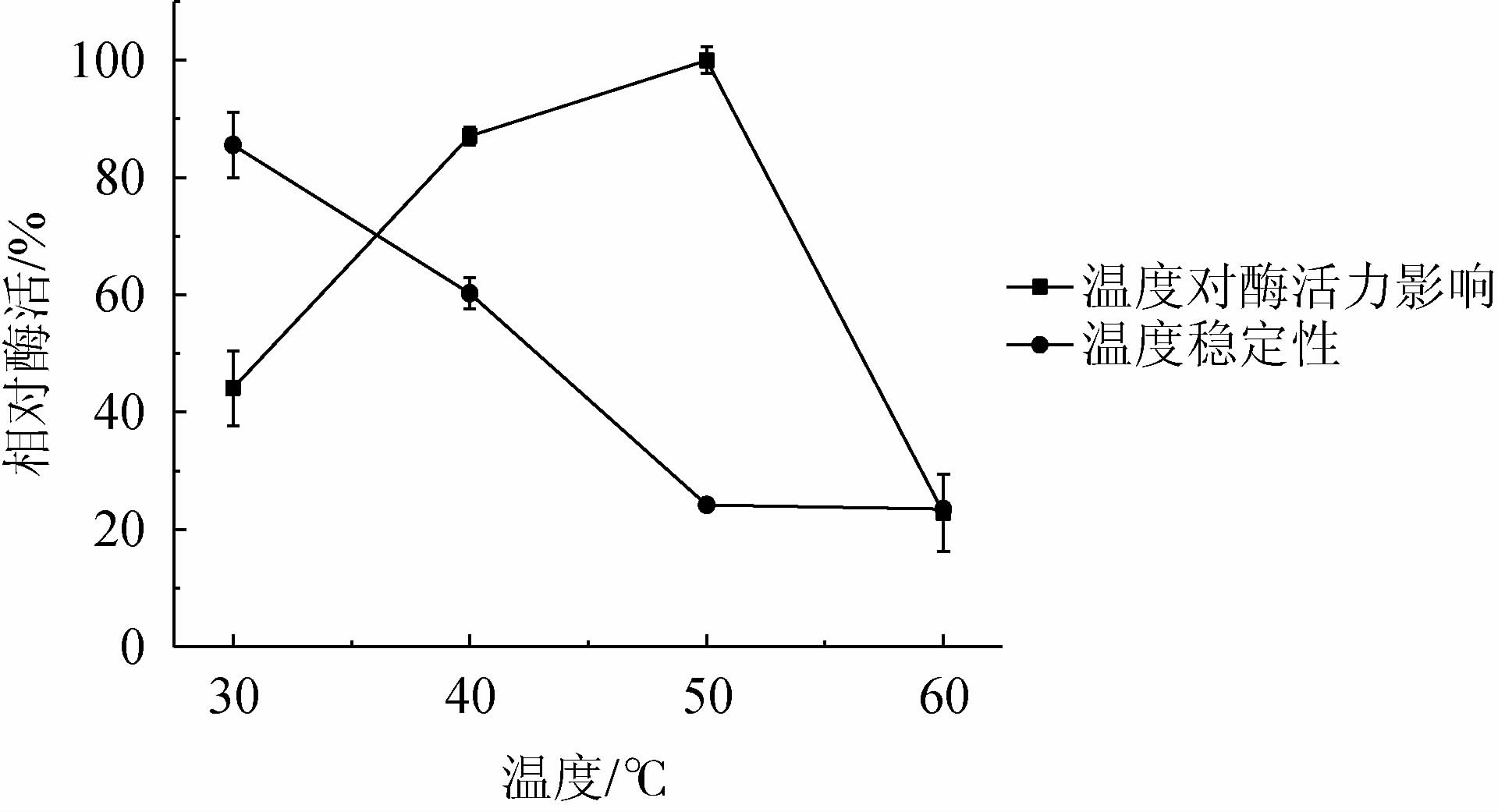
图4 温度对菌株RGZ2-4-5所产几丁质酶活力和稳定性的影响
Fig.4 Effect of temperature on the activity and stability of chitinase produced by strain RGZ2-4-5
2.3.2 pH对几丁质酶活力的影响及pH稳定性
由图5可知,菌株RGZ2-4-5所产的几丁质酶粗酶液在pH为4.0~10.0范围内酶活力较高,且随着pH的升高,酶活力呈先升高后下降的趋势,当pH为5.0时,酶活达到最高,为259.69 U/mL,说明该酶的最适反应pH为5.0。由图5亦可知,粗酶液在pH5.0~7.0条件下处理后仍保持70%以上酶活;pH>7.0以后酶活下降迅速,pH为8.0时相对酶活为36.41%,pH为10.0时相对酶活仅为5.15%。结果表明,该酶pH适应范围广,在酸性条件下比较稳定。
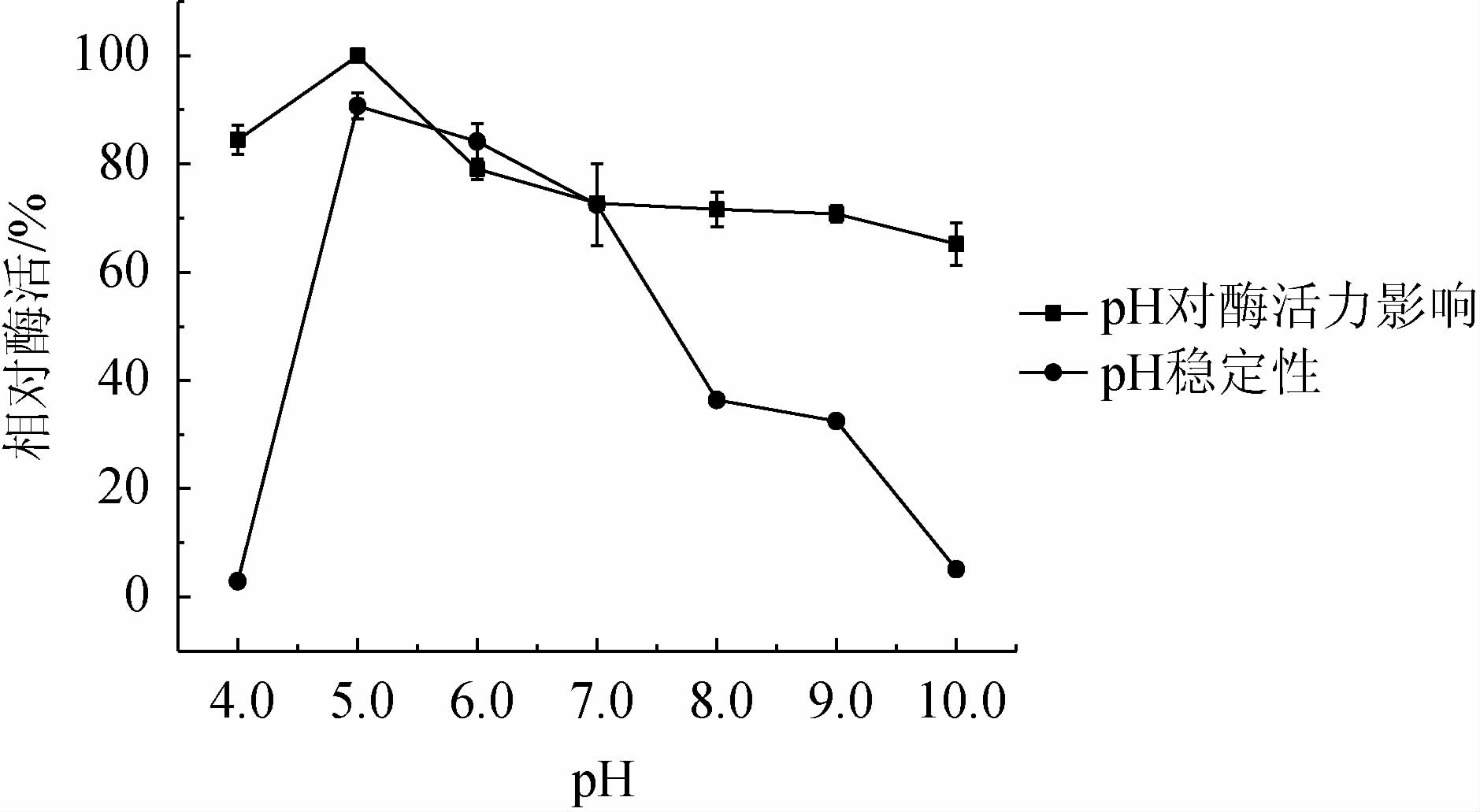
图5 pH对菌株RGZ2-4-5所产几丁质酶活力及稳定性的影响
Fig.5 Effect of pH on the activity and stability of chitinase produced by strain RGZ2-4-5
2.3.3 金属离子及化合物对几丁质酶活力的影响
由图6可知,与CK相比,Zn2+、Mn2+、Fe2+、Cr2+、Ag+、Co2+及PMSF处理的相对酶活显著降低(P<0.05),说明这几种金属离子对该酶有显著的抑制作用,其中,Zn2+、Mn2+、Fe2+、Ag+处理的相对酶活<80%,而其他金属离子对酶活无显著的促进或抑制作用(P>0.05)。
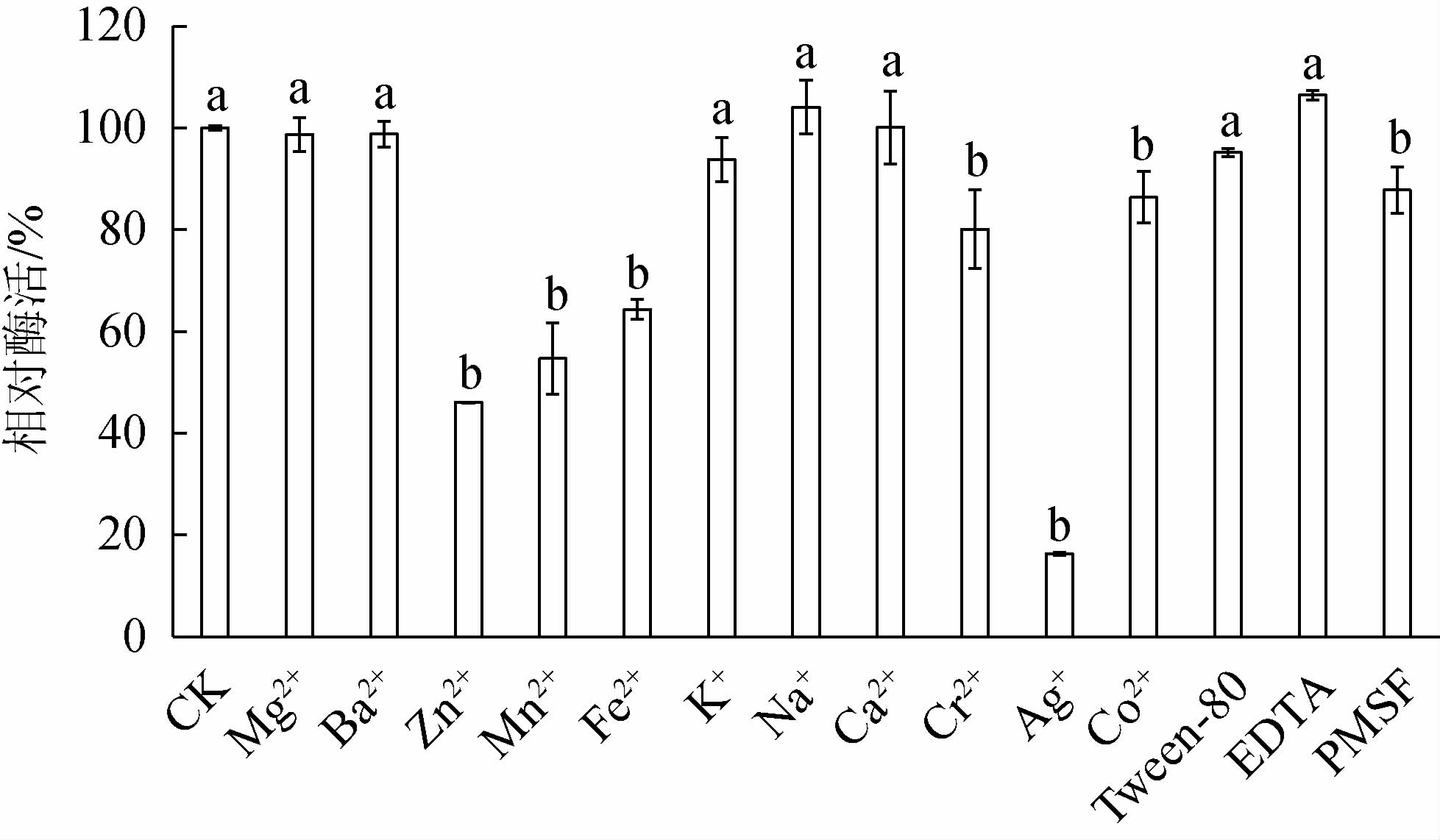
图6 金属离子及化合物对菌株RGZ2-4-5所产几丁质酶活力的影响
Fig.6 Effect of metal ions on the activity and stability of chitinase produced by strain RGZ2-4-5
不同小写字母表示与CK相比差异显著(P<0.05)。
本研究菌株RGZ2-4-5产生的几丁质酶最适反应温度为50 ℃,低于RAY L等[3,15]报道的耐热几丁质酶,高于国内报道的海洋菌产几丁质酶的结果[21-22]。几丁质酶的最适反应pH多为7.0左右[3,10,22],菌株RGZ2-4-5所产几丁质酶的最适pH为5.0,在pH5.0~7.0的范围内稳定性均在70%以上,宽泛的反应温度范围和酸碱适应范围使其有利于在工业发酵中应用。
2.4 菌株RGZ2-4-5所产几丁质酶对几丁质降解产物分析
采用TLC分析菌株RGZ2-4-5所产几丁质酶对几丁质的降解产物,结果见图7。
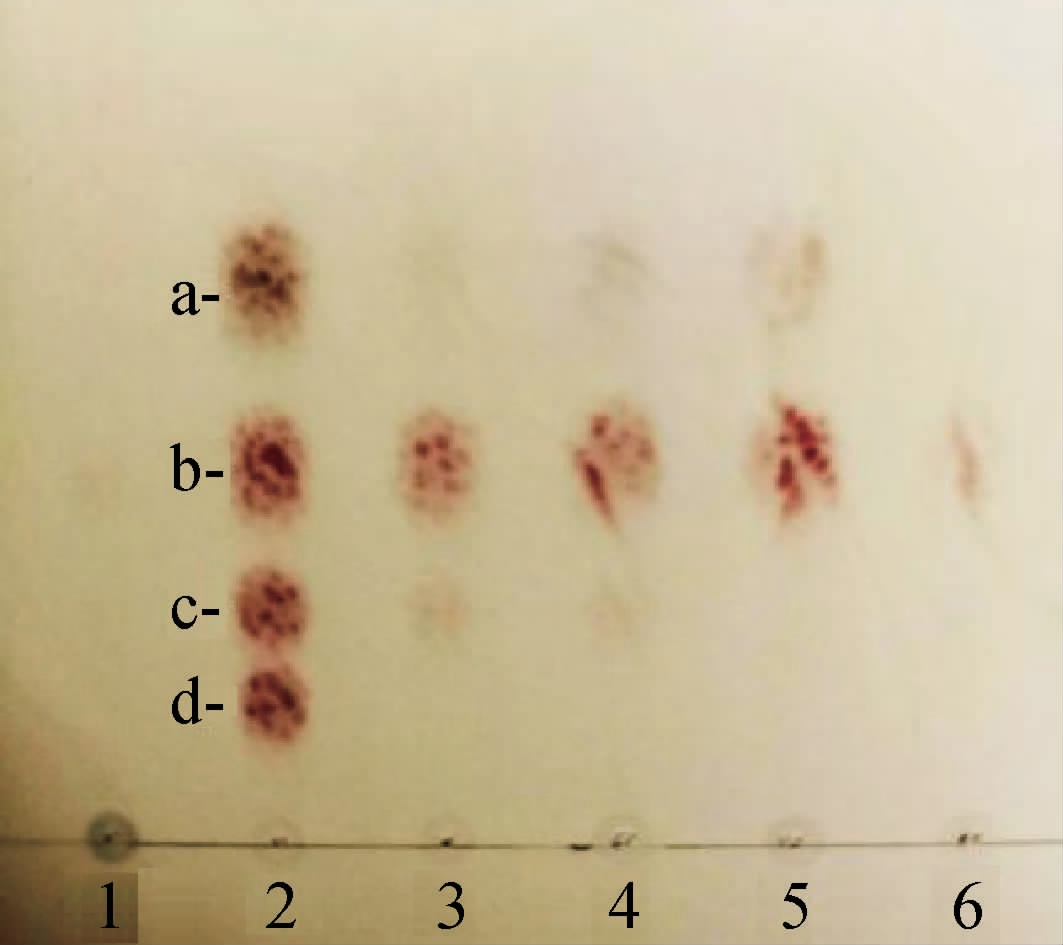
图7 菌株RGZ2-4-5所产几丁质酶对几丁质的降解产物的分析结果
Fig.7 Analysis results of chitin degradation products by chitinase produced by strain RGZ2-4-5
1 为阴性对照;2为几丁糖标样;3、4、5、6分别为几丁质在30 ℃、40 ℃、50 ℃、60 ℃酶解反应12 h的产物。a为N-乙酰氨基葡萄糖;b为几丁二糖;
c为几丁三糖;d为几丁四糖。
由图7可知,该菌株所产几丁质酶可水解几丁质,主要产物为几丁二糖[(GlcNAc)2],还有少量的几丁单糖(GlcNAc)和几丁三糖。不同温度处理的产物量有所不同,在30~50 ℃范围内,随着温度的增加,几丁三糖含量从少量到几乎不产,然而几丁单糖和几丁二糖含量有所增加,在50 ℃时达到最高。分析原因可能是在最适反应温度下,底物充分水解,因此单糖和二糖产量高,60 ℃酶活力迅速减弱,反应最终产物只有少量的几丁二糖。
内切几丁质酶(EC 3.2.1.14)从几丁质多糖链的内部随机水解几丁质,生成几丁寡糖((GlcNAc)n,n>2),几丁质先是被降解成分子质量不一的寡糖,随着时间的延长,最终被水解成(G1cNAc)2及少量的GlcNAc[12,26]。根据水解产物判断菌株RGZ2-4-5所产几丁质酶为内切几丁质酶。在最适反应温度下,酶能更充分的分解底物,最终产物为(GlcNAc)2和少量的GlcNAc。
3 结论
本研究采用透明圈法和酶活力测定从西藏日喀则土壤样品中筛选获得的一株高产几丁质酶的菌株RGZ2-4-5,其在以1%胶体几丁质作为唯一碳、氮源条件下发酵,几丁质酶活力达到242.36 U/mL。通过形态观察、生理生化特征及16S rDNA序列分析鉴定该菌株为Massilia aquatica。菌株RGZ2-4-5所产几丁质酶的最适反应温度为50 ℃,最适反应pH为5.0,在温度30~40 ℃,pH 5.0~7.0的条件下粗酶液具有较好的稳定性,金属离子Zn2+、Mn2+、Fe2+、Cr2+、Ag+、Co2+、PMSF对几丁质酶活具有显著的抑制作用(P<0.05)。TLC结果显示,该酶水解几丁质的最终产物为(GlcNAc)2和GlcNAc。
[1]袁源,宿玲恰,张康,等.地衣芽孢杆菌几丁质酶在枯草芽孢杆菌中的重组表达及其制备氨基寡糖的研究[J].南方水产科学,2022,18(2):39-47.
[2]SUN X,LI Y,TIAN Z,et al.A novel thermostable chitinolytic machinery of Streptomyces sp.F-3 consisting of chitinases with different action modes[J].Biotechnol Biofuels,2019,12:136.
[3]RAY L,PANDA A N,MISHRA S R,et al.Purification and characterization of an extracellular thermo-alkali stable,metal tolerant chitinase from Streptomyces chilikensis RC1830 isolated from a brackish water lake sediment[J].Biotechnol Rep,2019,21:e00311.
[4]易凡琪,郑军平,李琼瑜,等.几丁寡糖对脂肪酸代谢紊乱的抑制作用及分子机制[J].生物工程学报,2017,33(4):630-641.
[5] TABASSUM N, AHMED S, ALI M A.Chitooligosaccharides and their structural-functional effect on hydrogels:A review[J].Carbohydr Polym,2021,261:117882.
[6]ANIL S.Potential medical applications of chitooligosaccharides[J].Polymers,2022,14(17):3558.
[7] SATITSRI S,MUANPRASAT C.Chitin and chitosan derivatives as biomaterial resources for biological and biomedical applications[J].Molecules,2020,25(24):5961.
[8]高兆建,丁飞鸿,陈欢,等.产黄青霉抗真菌几丁质酶的纯化及特性分析[J].食品科学,2021,42(14):129-136.
[9]COPE K R,IRVING T B,CHAKRABORTY S,et al.Perception of lipochitooligosaccharides by the bioenergy crop Populus[J].Plant Signal Behav,2021,16(6):1903758.
[10]丁志雯,刘耀东,黄志发,等.产几丁质酶海洋细菌Dyadobacter sp.CZW019的筛选、鉴定及酶学性质研究[J].江苏海洋大学学报(自然科学版),2021,30(2):22-29.
[11] GONÇALVES C, FERREIRA N, LOURENÇO L.Production of low molecular weight chitosan and chitooligosaccharides (COS): A review[J].Polymers,2021,13(15):2466.
[12]周玉玲,蒋思婧,贺妮莎,等.微生物几丁质酶研究进展及其在N-乙酰氨基葡萄糖制备中的应用[J].微生物学报,2021,61(8):2192-2204.
[13]HE Y,ZHANG M,SHAN M,et al.Optimizing microwave-assisted hydrolysis conditions for monosaccharide composition analyses of different polysaccharides[J].Int J Biol Macromol,2018,15,118(Pt A):327-332.
[14] MULEY A B, SHINGOTE P R, PATIL A P, et al.Gamma radiation degradation of chitosan for application in growth promotion and induction of stress tolerance in potato(Solanum tuberosum L.)[J].Carbohydr Polym,2019,210:289-301.
[15]ALVES T B,DE OLIVEIRA ORNELA P H,DE OLIVEIRA A H C,et al.Production and characterization of a thermostable antifungal chitinase secreted by the filamentous fungus Aspergillus niveus under submerged fermentation[J].3 Biotech,2018,8(8):369.
[16] DU J, DUAN S, MIAO J, et al.Purification and characterization of chitinase from Paenibacillus sp.[J].Biotechnol Appl Biochem, 2021,68(1):30-40.
[17] ASMANI K L, BOUACEM K, OUELHADJ A, et al.Biochemical and molecular characterization of an acido-thermostable endo-chitinase from Bacillus altitudinis KA15 for industrial degradation of chitinous waste[J].Carbohydr Res,2020,495:108089.
[18] SHAHBAZ U, YU X.Cloning, isolation, and characterization of novel chitinase-producing bacterial strain UM01(Myxococcus fulvus)[J].J Genet Eng Biotechnol,2020,18(1):45.
[19]ALI M H,ALJADAANI S,KHAN J,et al.Isolation and molecular identification of two chitinase producing bacteria from marine shrimp shell wastes[J].Pak J Biol Sci,2020,23(2):139-149.
[20]章晓洋,张译文,朱思瑶,等.三株产几丁质酶菌株的筛选、产酶条件优化及水解虾壳的研究[J].食品工业科技,2023,44(5):98-106.
[21]吴丽双,王芙蓉.一株海洋来源的产几丁质酶的沙雷氏菌株及其应用:CN202310627856.0[P].2023-11-16.
[22]宋阳,陈梦,吴新财,等.产几丁质酶菌株Acinetobacter sp.CZW011的筛选鉴定与酶学性质研究[J].中国食品添加剂,2022,33(11):1-8.
[23]张奇,王一兵,申乃坤,等.产几丁质酶菌株GXUN-20的筛选、鉴定及其产酶条件优化[J].食品工业科技,2021,42(24):119-127.
[24]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:81-90.
[25]陈晓飞,孙玉飞,李珊珊,等.产β-甘露聚糖酶菌株HTGC-10对豆粕抗营养因子改性的实时监测分析[J].饲料研究,2023,46(5):82-85.
[26]YANG S,FU X,YAN Q,et al.Cloning,expression,purification and application of a novel chitinase from a thermophilic marine bacterium Paenibacillus barengoltzii[J].Food Chem,2016,192:1041-1048.