作为中国市场销售量最高的白酒,浓香型白酒因其独特的酿造工艺和醇厚的口感而享有良好的声誉[1]。在浓香型白酒生产中,中高温大曲是不可缺少的糖化发酵剂,是一个富含多酶、多菌和多物质的微型资源库,具有糖化发酵生香的作用[2]。大曲在制作过程中采用开放式发酵,使其充分网罗了制曲周围环境中的各种微生物,主要包括细菌和真菌[3]。在大曲发酵过程中,真菌能够产酯、产酶和生香[4],其中霉菌为大曲提供糖化力、液化力、蛋白质分解能力以及多种有机酸等物质[5],而酵母菌为大曲提供发酵力,不仅主导了酒精的产生,而且产生大量风味化合物[6]。杨少勇等[7]采用Illumina MiSeq高通量测序技术对湖北襄阳地区中高温大曲的真菌群落结构进行研究,发现该地区大曲真菌属以嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)和曲霉菌属(Aspergillus)为主。李静心等[8]采用MiSeq高通量测序技术对安徽省北部地区大曲的真菌群落结构进行研究,发现该地区中高温大曲真菌属以Aspergillus、伊萨酵母属(Issatchenkia)和覆膜孢酵母属(Saccharomycopsis)为主。吴树坤等[9]采用MiSeq高通量测序技术对四川地区浓香型大曲的真菌群落结构进行研究,发现该地区大曲真菌属以Thermomyces、Aspergillus、Thermoascus、丝衣霉属(Byssochlamys)和节担菌属(Wallemia)为主。由此可见,不同地域环境会对大曲内部所含真菌的类群产生一定影响,因而增加中高温大曲的采集来源并积极探索不同地区大曲真菌类群结构的差异是极为必要的。
Illumina MiSeq高通量测序技术因其具有通量高、成本低和一次运行反应能完成几十万条至几百万条核酸序列测定的特点[10],近年来被广泛应用于解析不同香型白酒大曲微生物群落结构组成和动态演替规律[11-12],为多方位了解白酒大曲中微生物的多样性及基因功能提供了技术支持。LIANG F等[13-14]研究发现,不同气候条件和地理位置均会导致大曲内部微生物类群产生一定差异,继而影响白酒风味品质。因此,本研究采用Illumina MiSeq高通量测序技术对临沂和周口地区中高温大曲真菌群落结构进行比较分析,继而对2个地区中高温大曲中的生物标志物进行甄别,以期为后续黄淮流域超级产区酿酒微生物资源的挖掘提供数据支撑。
1 材料与方法
1.1 材料与试剂
中高温大曲:山东省临沂市兰陵县(E117°41′~118°18′,N34°37′~35°06′)和河南省周口市鹿邑县(E115°02′~115°37′,N33°43′~34°05′)2个某知名酒厂曲库;QIAGEN DNeasy mericon Food Kit试剂盒:德国QIAGEN公司;5×聚合酶链式反应(polymerase chain reaction,PCR)缓冲液、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)混合物、脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶:北京全式金生物技术有限公司;引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')、ITS4(5'-TCCTCCGCTTATTGATATGC-3'):上海桑尼生物科技有限公司;MiSeq高通量测序配套试剂:美国Illumina公司。
1.2 仪器与设备
Vetiri梯度基因扩增仪:美国AB公司;DYY-12电泳仪:北京六一仪器厂;Fluor Chem FC3化学发光凝胶成像系统:美国Protein Simple公司;ND-2000C微量紫外分光光度计:美国Nano Drop公司;PE300 Illumina MiSeq高通量测序平台:美国Illumina公司;Power Edge R930机架式服务器:美国DELL公司。
1.3 方法
1.3.1 样品采集
于2021年7月从山东临沂地区和河南周口地区分别采集中高温大曲样品13份和15份,所有大曲均以小麦为原材料,经润粮、定型、入库发酵、翻曲和贮存成熟等工艺制作而成。样品采集时曲块已经在曲房成熟了约60 d,所采集的样品无霉斑和异味且曲块完整,样品粉碎后封存于无菌自封袋中,置于-20 ℃低温条件下贮存备用。
1.3.2 DNA提取、PCR扩增和Illumina MiSeq高通量测序
按照试剂盒的操作步骤对中高温大曲真菌菌群基因组DNA进行提取,并使用分光光度法检测其OD260 nm值/OD280 nm值。参照陈怡等[15]的方法使用引物ITS1/ITS4 PCR扩增真菌ITS区基因序列,通过1%琼脂糖凝胶电泳法对PCR扩增产物进行检测,将检测合格的PCR扩增产物寄送至上海美吉生物医药科技有限公司进行Illumina MiSeq高通量测序。
1.3.3 序列质控及生物信息学分析
根据CAI W等[16]的质控条件对测序平台产生的原始序列进行高质量控制和筛选,基于QIIME(v1.9.2)平台对保留序列进行生物信息学分析[17]。首先按照97%的相似度使用UCLUST划分操作分类单元(operational taxonomic units,OTU)[18],继而使用UCHIME去除嵌合体,然后基于UNITE数据库对OTU代表性序列进行物种注释[19],最终计算样品中真菌类群的α多样性指数。
1.3.4 数据处理
使用两独立样本的非参数(Mann-Whitney)检验和多元方差分析(multivariate analysis of variance,MANOVA)解析2个地区中高温大曲真菌类群的差异。使用R软件(v4.1.3)绘制小提琴图、箱型图、主坐标分析(principal coordinate analysis,PCoA)图。2个地区中高温大曲间的生物标志物通过线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)算法在Galaxy服务器的在线网页(http://huttenhower.sph.harvard.edu/galaxy/)进行分析。
2 结果与分析
2.1 两个地区中高温大曲样品真菌类群α多样性比较分析
通过Illumina MiSeq高通量测序技术,从纳入本研究的中高温大曲样品中共获得1 409 343条高质量ITS序列,平均每份样品50 334条,经97%相似度进行聚类后共划分得到3 520个OTU。2个地区中高温大曲样品真菌类群的α多样性比较分析结果见图1。

图1 两个地区中高温大曲样品超1指数(a)和香农指数(b)比较分析
Fig.1 Comparative analysis of Chao 1 index (a) and Shannon index (b) of medium-high temperature Daqu in two region
由图1a可知,临沂和周口地区中高温大曲样品的平均超1指数分别为839和1 111,经Mann-Whitney检验分析发现,两者真菌类群在超1指数上差异极显著(P<0.01)。由图1b可知,临沂和周口地区中高温大曲样品的平均香农指数分别为0.90和0.85,经Mann-Whitney检验分析发现,两者真菌类群在香农指数上差异不显著(P>0.05)。由此可见,临沂地区中高温大曲样品真菌类群丰富度极显著低于周口地区(P<0.01)。
2.2 两个地区中高温大曲样品真菌类群结构分析
经序列比对发现,2个地区中高温大曲样品中共鉴定到11个门、25个纲、46个目、91个科和133个属。本研究基于门和属水平对2个地区中高温大曲样品真菌类群结构进行解析,结果见图2。将平均相对丰度≥1.00%的真菌门或属定义为优势真菌门或属。

图2 基于门和属水平2个地区中高温大曲样品真菌类群结构分析
Fig.2 Analysis of fungal community structure of medium-high temperature Daqu in two regions at the phylum and genus levels
由图2①~④可知,纳入本研究的所有中高温大曲样品中共检测到4个优势真菌门,分别为子囊菌门(Ascomycota)(57.16%)、担子菌门(Basidiomycota)(22.84%)、毛霉门(Mucoromycota)(18.42%)和接合菌门(Zygomycota)(1.22%)。在临沂和周口地区中高温大曲样品中,Basidiomycota的平均相对丰度分别为31.70%和15.17%,经Mann-Whitney检验分析发现两者差异显著(P<0.05)。由此可见,虽然2个地区中高温大曲真菌类群在门水平上种类相似,但其相对丰度存在一定差异。
由图2⑤~17○可知,纳入本研究的所有中高温大曲样品中共检测到13个优势真菌属,分别为弯曲假丝酵母属(Apiotrichum)(16.39%)、根霉属(Rhizopus)(12.83%)、双足囊菌属(Dipodascus)(9.71%)、曲霉属(Aspergillus)(9.21%)、嗜热真菌属(Thermomyces)(8.69%)、季也蒙酵母属(Meyerozyma)(8.18%)、嗜热子囊菌属(Thermoascus)(5.61%)、毕赤酵母菌属(Pichia)(4.37%)、根毛霉属(Rhizomucor)(3.74%)、丝孢酵母属(Trichosporon)(3.21%)、横梗霉属(Lichtheimia)(2.66%)、耶氏酵母属(Yarrowia)(2.23%)和马拉色氏霉菌属(Malassezia)(1.45%)。在临沂和周口地区中高温大曲样品中,Thermomyces的平均相对丰度分别为13.56%和4.47%,Malassezia的平均相对丰度分别为2.93%和0.17%,经Mann-Whitney检验分析发现,两者差异均显著(P<0.05);Rhizopus的平均相对丰度分别为6.81%和18.04%,Pichia的平均相对丰度分别为7.93%和1.28%,Trichosporon的平均相对丰度分别为4.98%和1.66%,Meyerozyma的平均相对丰度分别为1.36%和14.09%,经Mann-Whitney检验分析发现,两者差异均极显著(P<0.01)。
存在于28份中高温大曲样品中的优势真菌属在白酒酿造过程中对白酒风味品质的生成均具有积极作用。有研究报道,Thermomyces和Thermoascus具有产纤维素酶、蛋白酶、淀粉酶和脂肪酶等酶类的能力,对白酒产香具有促进作用,且其具有较强的热稳定性,能够在白酒发酵过程中温度较高的条件下保持稳定的催化效率[20]。Aspergillus是大曲和糟醅中的重要微生物,能够在酒醅发酵过程中代谢产生白酒呈香呈味的重要风味物质或者风味前体物质[9]。Apiotrichum、Pichia、Trichosporon和Yarrowia等酵母属代谢可生成多种有机酸、高级醇和酯类物质,这些物质参与白酒风味物质的合成并发挥着积极作用[21]。亦有研究指出,Trichosporon能够在生成酒精的同时通过发酵还原糖生成多元醇,使白酒具备醇甜味[22]。CHEN B等[23]研究发现,Rhizopus、Rhizomucor、Lichtheimia和Malassezia等霉菌属可以代谢产生大量的高活性蛋白酶和葡糖淀粉酶,被视为大曲糖化降解动力的主要来源。Rhizomucor具有糖化发酵能力,能形成大量乳酸,为发酵提供了酸性环境[24]。Dipodascus不仅是氨基酸生产者,还是潜在风味贡献者,该菌属的代谢可促进3-甲基丁酸、庚酸和2,3-丁二醇等风味物质的产生[25]。
除此之外,枝孢菌属(Cladosporium)、罗萨氏菌属(Rasamsonia)、单孢酵母属(Kazachstania)、念珠菌属(Candida)和镰刀菌属(Fusarium)在周口地区中高温大曲样品中的平均相对丰度仅为0.46%、0.01%,0.01%、0.36%和0.61%,而这些菌属在临沂地区中高温大曲样品中为优势真菌属,平均相对丰度分别为1.54%、1.33%、1.32%、1.14%和1.06%。皮状丝孢酵母属(Cutaneotrichosporon)虽为周口地区中高温大曲样品中的优势真菌属,平均相对丰度为1.27%,但其在临沂地区中高温大曲样品中的平均相对丰度仅为0.01%。由此可见,2个地区中高温大曲样品真菌类群在属水平上存在明显差异。
2.3 两个地区中高温大曲真菌类群β多样性比较分析
基于门和属水平研究发现,2个地区中高温大曲真菌类群组成结构存在一定的差异。为进一步展示其群落之间物种组成异同,基于UniFrac距离进行PCoA,结果见图3。
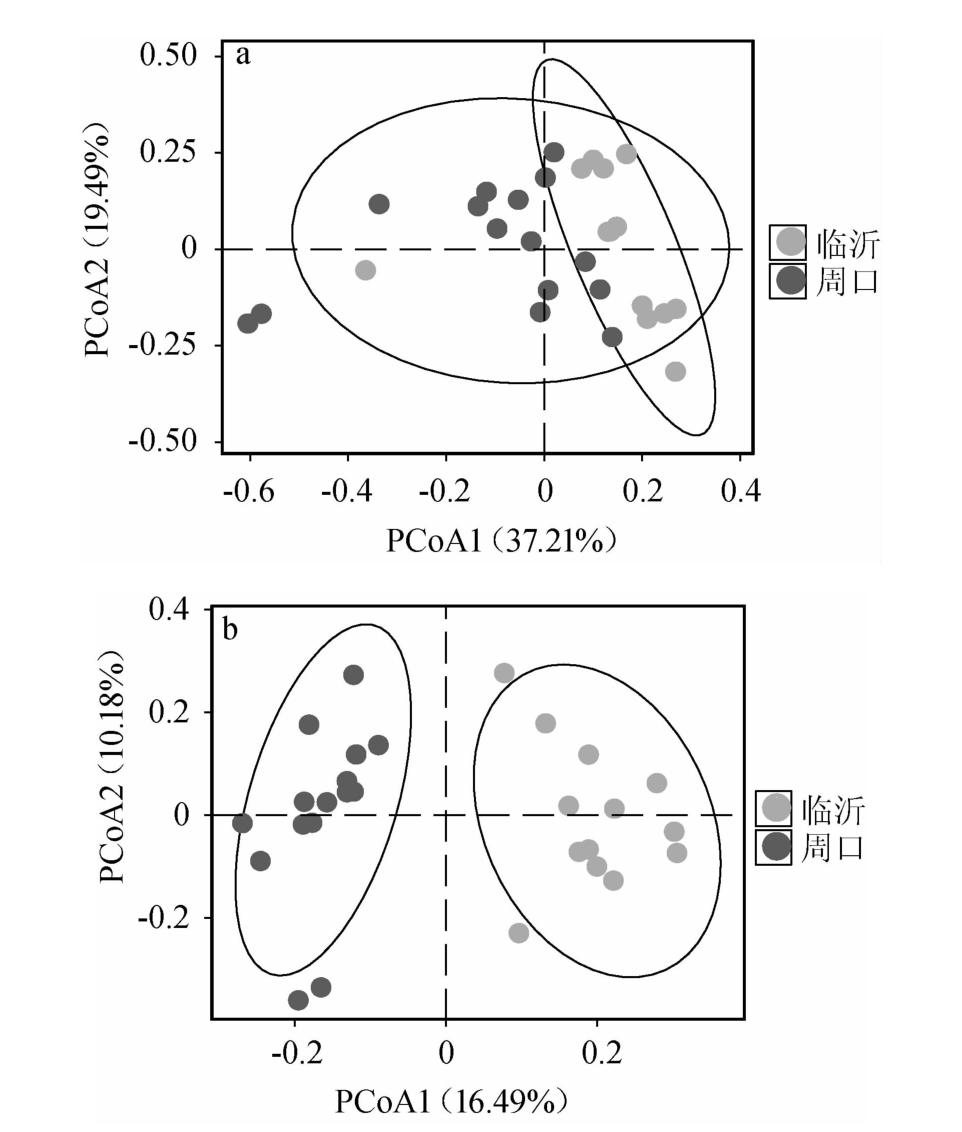
图3 基于加权(a)和非加权(b)UniFrac距离2个地区中高温大曲样品真菌类群PCoA结果
Fig.3 PCoA results of fungal community based on weighted (a) and unweighted (b) UniFrac distance of medium-high temperature Daqu in two regions
由图3可知,2个地区中高温大曲样品中真菌类群结构差异具有统计学意义[26]。由图3a可知,2个地区中高温大曲样品间虽存在明显的重叠现象,但亦具有一定的分离趋势。由图3b可知,临沂地区中高温大曲样品均分布于X轴正方向,周口地区中高温大曲样品均分布于X轴负方向,2个地区中高温大曲样品间存在明显的分离现象。经MANOVA分析发现,2个地区中高温大曲样品间真菌群落结构差异极显著(P<0.01)。由此可见,2个地区中高温大曲样品间真菌类群在整体上存在明显差异。
2.4 两个地区中高温大曲真菌类群差异菌群分析
线性判别分析常用于揭示不同环境下两个或两个以上类群间的差异物种特征[27]。为进一步明确2个地区中高温大曲真菌类群结构的差异,本研究采用LDA阈值评分4.0进行线性判别分析,结果见图4。
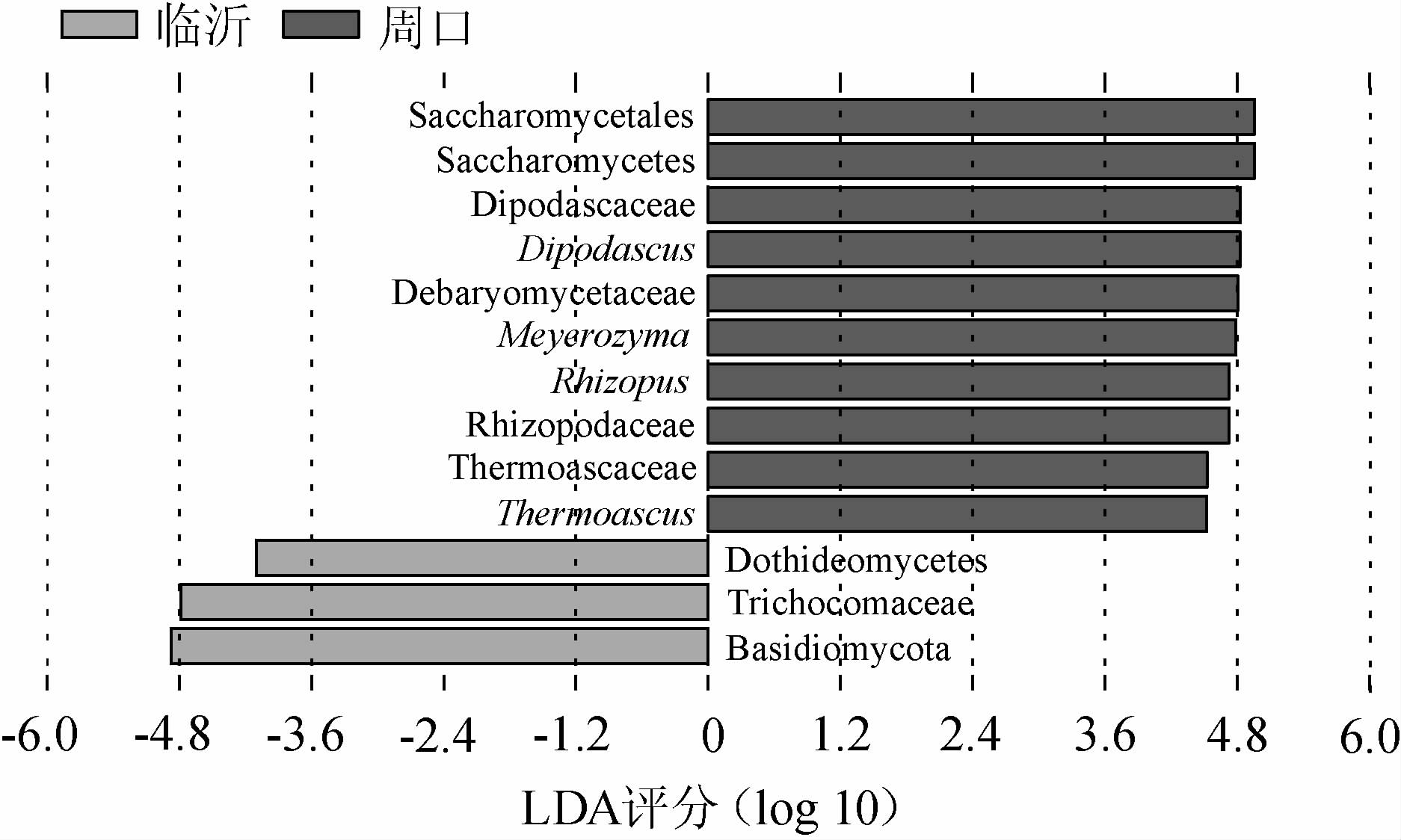
图4 2个地区中高温大曲样品真菌类群线性判别分析结果
Fig.4 Linear discriminant analysis effect size results of fungal community of medium-high temperature Daqu in two regions
由图4可知,在纳入本研究的中高温大曲样品中共鉴定出13个相对丰度差异显著的真菌类群(P<0.05)。其中对临沂地区中高温大曲样品影响显著的真菌类群有3个,均各有1个分别体现在门、纲和科水平;对周口地区中高温大曲样品影响显著的有10个,各有1个、1个、4个和4个,分别体现在纲、目、科和属水平。由图4亦可知,Dipodascus、Meyerozyma、Rhizopus和Thermoascus这4个优势真菌属在周口地区中高温大曲样品中富集,而没有真菌属在临沂地区中高温大曲样品中富集。由此可见,在属水平上,Dipodascus、Meyerozyma、Rhizopus和Thermoascus可作为造成临沂和周口地区中高温大曲样品中真菌类群结构差异的主要菌群。
3 结论
本研究通过Illumina MiSeq高通量测序技术对临沂和周口地区中高温大曲样品真菌类群结构进行比较分析,结果发现,2个地区中高温大曲样品真菌类群结构存在明显差异。相较于周口地区中高温大曲样品,临沂地区中高温大曲样品真菌类群丰富度明显偏低,其中真菌类群Thermomyces、Malassezia、Pichia和Trichosporon平均相对丰度明显偏高,Rhizopus和Meyerozyma平均相对丰度明显偏低,且Dipodascus、Meyerozyma、Rhizopus和Thermoascus为造成2个地区大曲中真菌类群结构差异的主要菌群。
[1] ZHENG X W, HAN B Z. Baijiu, Chinese liquor: history, classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[2]YANG J G,DOU X,HAN P J,et al.Microbial diversity in Daqu during production of Luzhou flavored liquor[J].J Am Soc Brew Chem,2017,75(2):136-144.
[3]DU H,WANG X,ZHANG Y,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297(5):32-40.
[4]SAKANDAR H A,HUSSAIN R,KHAN Q F,et al.Functional microbiota in Chinese traditional Baijiu and mijiu Qu(starters):a review[J].Food Res Int,2020,138(12B):109830.
[5]程伟,陈雪峰,陈兴杰,等.基于高通量测序解析浓香型大曲真菌群落结构及其与质量指标的关联性分析[J].食品与发酵工业,2022,48(22):194-200,212.
[6]周天慈,孙佳,朱雨婕,等.中高温大曲制作过程中火圈真菌菌群演替规律及其风味功能[J].微生物学通报,2021,48(11):4178-4189.
[7]杨少勇,黎婷玉,蔡文超,等.襄阳地区高温大曲和中高温大曲真菌多样性解析[J].中国酿造,2021,40(5):76-80.
[8]李静心,王艳丽,何宏魁,等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业,2018,44(12):52-59.
[9]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[10] VILLAMOR D E V, HO T, Al RWAHNIH M, et al.High throughput sequencing for plant virus detection and discovery[J].Phytopathology,2019,109(5):716-725.
[11]LIU Y,LI X,LI H,et al.Taorong-type Baijiu starter:analysis of fungal community and metabolic characteristics of middle-temperature Daqu and high-temperature Daqu[J].Plos One,2022,17(10):e0274881.
[12]ZENG H,JIANG X,WANG Z,et al.Environmental and physicochemical characterization and fungal community of two batches of Chinese Luzhou-flavored Daqu[J].J Am Soc Brew Chem, 2023, 81(1): 190-197.
[13] LIANG F, BAN S, HUANG H, et al.Predicting the effect of climatic factors on diversity of flavor compounds in Daqu fermentation[J].LWTFood Sci Technol,2022,169(6):113984.
[14]WANG L,HUANG Y,HU X,et al.The impact of environmental factors on the environmental bacterial diversity and composition in the Jiangflavoured Baijiu production region[J].LWT-Food Sci Technol,2021,149(2):111784.
[15]陈怡,刘洋,蒋立文,等.基于高通量测序分析不同浏阳豆豉中真菌的多样性[J].中国酿造,2020,39(11):66-70.
[16]CAI W,WANG Y,NI H,et al.Diversity of microbiota,microbial functions, and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150(12):110734.
[17] DU R, GE J, ZHAO D, et al.Bacterial diversity and community structure during fermentation of Chinese sauerkraut with Lactobacillus casei 11MZ-5-1 by Illumina Miseq sequencing[J].Lett Appl Microbiol,2018,66(1):55-62.
[18] WEI Z G, ZHANG X D, CAO M, et al.Comparison of methods for picking the operational taxonomic units from amplicon sequences[J].Front Microbiol,2021,12(3):644012.
[19]KÕLJALG U,NILSSON R H,ABARENKOV K,et al.Towards a unified paradigm for sequence-based identification of fungi[J].Mol Ecol,2013,22(21):5271-5277.
[20]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[21]唐清兰,周利,徐姿静.浓香型白酒大曲制曲过程真菌群落结构变化的研究[J].酿酒科技,2021(9):27-30.
[22]王晓丹,白晓燕,朱国军,等.产多元醇酵母对酱香型白酒发酵的强化应用[J].食品工业,2021,42(2):162-166.
[23] CHEN B, WU Q, XU Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotaiflavor liquor[J].Int J Food Microbiol,2014,179(7):80-84.
[24]左乾程,黄永光,郭敏,等.酱香型白酒机械化制曲发酵细菌群落的演替[J].食品科学,2021,42(18):150-156.
[25] ZHENG X, LIU F, LI K, et al.Evaluating the microbial ecology and metabolite profile in Kazak artisanal cheeses from Xinjiang, China[J].Food Res Int,2018,111(9):130-136.
[26] CAI W, WANG Y, HOU Q, et al.PacBio sequencing combined with metagenomic shotgun sequencing provides insight into the microbial diversity of Zha-chili[J].Food Biosci,2021,40(7346):100884.
[27]WANG Y,HOU Q,GUO Z,et al.Bacterial community structure in acidic gruel from different regions and its influence on quality[J].Food Res Int,2021,141(11):110130.