脐橙(Citrus sinensis Osb.),芸香科柑橘属,因其富含维生素、黄酮类化合物、柠檬苦素类似物和类胡萝卜素等生物活性物质,具有分解脂肪、清火养颜、减少有色金属和放射性元素在人体内积累、防癌抗癌等功效而备受大众青睐。近几十年来,我国柑橘产业发展稳步增长,柑橘产量呈明显上升趋势,已从2017年的3 816.78万t增长到2021年的5 595.61万t,产量稳居世界第一[1]。同时,随着人民美好生活需要日益广泛,健康的生活方式引导酒类生产由粮食酒向果酒发生转型[2]。柑橘酒的研发和生产,顺应了新形势,增加了柑橘的附加值,也解决了季节性过剩和不易储存等产业问题。
目前的柑橘酒生产企业,多选择葡萄酒活性干酵母进行柑橘酒的酿制,虽然工艺可控、产品质量稳定,但是所酿柑橘酒同质化严重,且无法展示原料带给酒体特有的理化特性、风味和口感,以至于丧失其在果酒市场上本应具有的优势和竞争力。因此,适宜于柑橘果酒本土酿酒酵母(Saccharomyces cerevisiae)的筛选工作,就显得尤为重要。罗佳丽等[3]以甜橙果皮和甜橙果园土壤为分离源,共分离得到138株酵母菌,其中酵母菌S017和F076适合酿造甜橙果酒,经鉴定均为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum);刘瑞等[4]从柑橘园土壤、柑橘果皮和自然发酵的柑橘汁中分离到160株酵母菌株,经形态学、分子生物学方法将其归为10个酵母菌种;熊元林等[5]从橙汁发酵醪液中分离出4株酵母菌,鉴定为酵母属的绮丽酵母,是适合作为橙汁低纯果酒的酿造酵母;游见明[6]从腐烂桔子中分离得到35株酿酒酵母,其中3株发酵性能较优良,F16菌株可作为桔子酒发酵用菌种或桔子酒专用菌种选育的出发菌株;陈清婵等[7]从橘子果肉中分离筛选出4株酵母菌,均具有典型圆形酵母属特征,其中菌株JZ-1所酿橘子酒具有较好橘子果酒的典型性。以上分离纯化所得柑橘酒酿酒酵母,主要以发酵力及所酿橘子酒香气、色泽、风味等感官指标及维生素C(vitamin C,VC)含量、产酒精能力、降糖是否彻底等指标进行综合评价[7]。
本研究以四川渠县柑橘园土壤、果树枝叶和果实外果皮为分离源,通过富集培养、纯化、分子生物学鉴定、耐受性及酿酒性能等试验筛选出适宜酿造脐橙果酒的本土专属酿酒酵母,以期为脐橙果酒综合品质的提升提供应用基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酿造原料脐橙:2020年12月底采自四川渠县柑橘园(可溶性固形物含量11.76%,总糖(以葡萄糖计)59.12 g/L,总酸(以柠檬酸计)7.29 g/L,pH 3.66,出汁率48.72%)。
果园土壤(S)、果树枝叶(T)和脐橙果实外果皮(F):来自四川渠县柑橘园;商业酿酒酵母BV818:安琪酵母股份有限公司;酿酒酵母F5:法国LAFFORT公司。
1.1.2 试剂
100.00 mg/L氯霉素:生工生物工程(上海)股份有限公司;琼脂(生化试剂):北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖琼脂培养基(yeast extract peptone dextrose,YEPD)培养基:北京奥博星生物技术有限责任公司;WLN营养琼脂培养基:海博生物技术有限公司;Biggy Agar培养基:上海冠导生物工程有限公司;富集培养基:YEPD液体培养基+100.00 mg/L氯霉素;鉴定培养基:WLN营养琼脂培养基+100.00 mg/L氯霉素。
2,3,5-氯化三苯四氮唑(2,3,5-triphenyltetrazolium chlo ride,TTC)培养基[8]:由上层培养基与下层培养基组成。其中TTC上层培养基:TTC 0.5 g/L、葡萄糖5 g/L、琼脂15 g/L、现配现用;TTC下层培养基:葡萄糖10 g/L、蛋白胨2 g/L、酵母膏1.5 g/L、磷酸氢二钾1 g/L、硫酸镁0.4 g/L、柠檬酸0.3 g/L、琼脂30 g/L。
产酯固体培养基[9]:溴甲酚紫0.04 g/L,三丁酸甘油脂15 mL/L,酵母浸粉10.00 g/L,蛋白胨20.00 g/L,葡萄糖20.00 g/L,琼脂20.00 g/L。
发酵培养基(模拟柑橘汁)[10]:蔗糖5.20 g/100 mL、葡萄糖2.15 g/100 mL、果糖2.50 g/100 mL、柠檬酸0.75 g/100 mL、苹果酸0.25 g/100 mL,使用6 mol/L食品级NaOH将pH调节至3.90。
以上培养基均在121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
HVE-50高压蒸汽灭菌锅:日本HIRAYAMA公司;SWCJ-IF型洁净工作台:苏净集团苏州安泰空气技术有限公司;DH6000B电热恒温培养箱:天津市泰斯特仪器有限公司;HT-211B型培养摇床:上海赫田科学仪器有限公司;Mulstiskan GO酶标仪:美国Thermo Electron公司;UVmini-1280紫外分光光度计:日本岛津公司;WD-9402B/D非医用基因扩增仪:北京六一生物科技有限公司;Gel Doc XR+凝胶成像仪、Sub-Cell GT电泳仪:美国Bio-Rad公司;TRACE DSQ气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪:美国Thermo Finnigan公司;DB-Wax色谱柱(30 m×0.25 mm,0.25 μm):美国J&W pharmlab公司。
1.3 方法
1.3.1 酵母菌的分离、纯化和WLN鉴定
分别称取5.00 g果园土壤、果树枝叶和脐橙果实外果皮,装有100 mL富集培养基的锥形瓶中,28 ℃恒温振荡培养24~48 h。分别取富集后的母液1.0 mL,用无菌水按10倍梯度稀释至10-8。选择适当梯度样液,均匀涂布于鉴定培养基平板上,28 ℃倒置培养5 d。分别挑选不同形态单菌落,通过划线稀释法在鉴定培养基上进行划线,于28 ℃倒置培养10 d。根据WLN平板上酵母菌落特征(菌落的颜色和形态,表面及边缘特征),对各菌落进行WLN培养类型分类。
1.3.2 酵母菌的分子生物学鉴定与分型
酿酒酵母菌株基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)的提取及检测:采用杨慧敏等[11]的方法提取DNA,微量紫外分光光度计检测其纯度和浓度。
26S核糖体核糖核酸(ribosomal ribonucleic acid,rRNA)基因D1/D2区测序鉴定:WLN培养类型为酿酒酵母的52株菌中,随机选取20株。使用通用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')对其进行26S rRNA D1/D2区基因序列扩增,聚合酶链式反应(polymerase chain reaction,PCR)产物送往上海生工技术有限责任公司测序,测序结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)进行基本局部比对搜索工具(basic local alignment search tool,BLAST)搜索比对。
Interdelta分型:经26S rRNA基因D1/D2区测序鉴定的20株酿酒酵母菌种进行Interdelta 指纹图谱分析,使用引物delta12(5'-TCAACAATGGAATCCCAAC-3')和delta21(5'-CATCTTAACACCGTATATGA-3')进行PCR扩增,对所得电泳图进行对比,找出相同的分型进行汇总[12-13]。
1.3.3 酿酒酵母菌株酿造学特性的测定
(1)酿酒酵母菌株发酵力的测定
将1.3.2所得酿酒酵母菌株接入放有倒置杜氏管的YEPD液体培养基试管中,28 ℃培养,每隔12 h观察其产气情况,记录杜氏管内气体体积[14]。
(2)酿酒酵母菌株凝聚性测定
对1.3.2所得酿酒酵母菌株,采用本斯值测定其凝聚性[15],该值大于2 mL为凝聚性强,小于0.5 mL为凝聚性弱。凝聚性是果酒酵母筛选的一项重要指标,强凝聚性酵母不仅有利于生产工艺的优化,而且有利于改善果酒风味。
(3)酿酒酵母菌株耐受性的测定
对以上实验所得起酵速度快,产气量大、强凝聚性的酵母菌株,进行耐乙醇、耐SO2和高糖耐受性能试验。将YEPD液体培养基分装于试管中,再放入倒置、管内不含空气的杜氏管。121 ℃灭菌20 min,冷却至室温(25 ℃),按照(a~c)条件分别调整培养基。
(a)不同乙醇体积分数(10%、12%、14%、16%、18%);(b)不同SO2质量浓度(60mg/L、100mg/L、150mg/L、200mg/L、300 mg/L);(c)不同糖含量(20%、30%、40%、50%、60%)。(a)和(b)先121 ℃灭菌20 min后调整,(c)先调整后灭菌。待测酿酒酵母菌株接种2%,每个处理平行3次,28 ℃培养1~3 d,观察产气状况,以判断耐受性。
(4)酿酒酵母菌株产乙醇能力的测定
通过TTC显色法,将筛选所得酵母菌株划线接种到TTC下层培养基上,28 ℃培养1~3 d后,在菌落上覆盖一层TTC上层培养基,28 ℃遮光培养。菌落呈现的颜色越深,表明菌株产酒精能力越强[8]。
(5)酿酒酵母菌株产H2S能力的测定
采用Biggy Agar培养基显色法,将高产酒精酵母菌株点种到Biggy Agar培养基上,28 ℃培养1~3 d,菌株菌落颜色越深,代表菌株产H2S的量越多[16]。
(6)酿酒酵母菌株产酯能力的测定
采用产酯培养基显色法,将低产H2S的酵母菌株划线接种到产酯培养基上,菌落黄色越浓,表明菌株的产酯量越多[17]。
1.3.4 优良酿酒酵母菌株酿造脐橙果酒及感官评价
将1.3.3筛选所得酵母菌株分别接种到YEPD液体培养基中,于28 ℃、100 r/min条件下恒温振荡培养24 h后,以107 CFU/mL的接种量接入含有4 L脐橙果汁的5 L广口瓶中[18],参照毕静莹等[19]的方法进行脐橙果酒的酿造。以商业菌株BV818和F5及空白试验作为对照,对脐橙果酒的理化指标、挥发性香气成分及感官品质进行分析。每个实验组设置3个生物学重复。
1.3.5 数据分析
利用Excel 2016、SPSS Statistics 24.0软件对理化参数、挥发性化合物等进行分析,酿酒酵母进化树利用MEGA11(11.0.13)分析绘制,挥发性物质热图使用迈维代谢云平台(https://cloud.metware.cn)进行绘图。
2 结果与分析
2.1 酵母菌的WLN培养鉴定
本研究共分离纯化得到90株酵母菌株,将其在WLN培养基培养后,根据菌落形态初步将菌株分成8个WLN培养类型。根据PALLMANN C L等[20]的描述及其他研究者的实验结果[21-23],用CT表示不同类型的菌株,判定结果见表1。
表1 酵母菌在WLN培养基上的形态分型结果
Table 1 Morphological typing results of yeasts on WLN nutrient medium
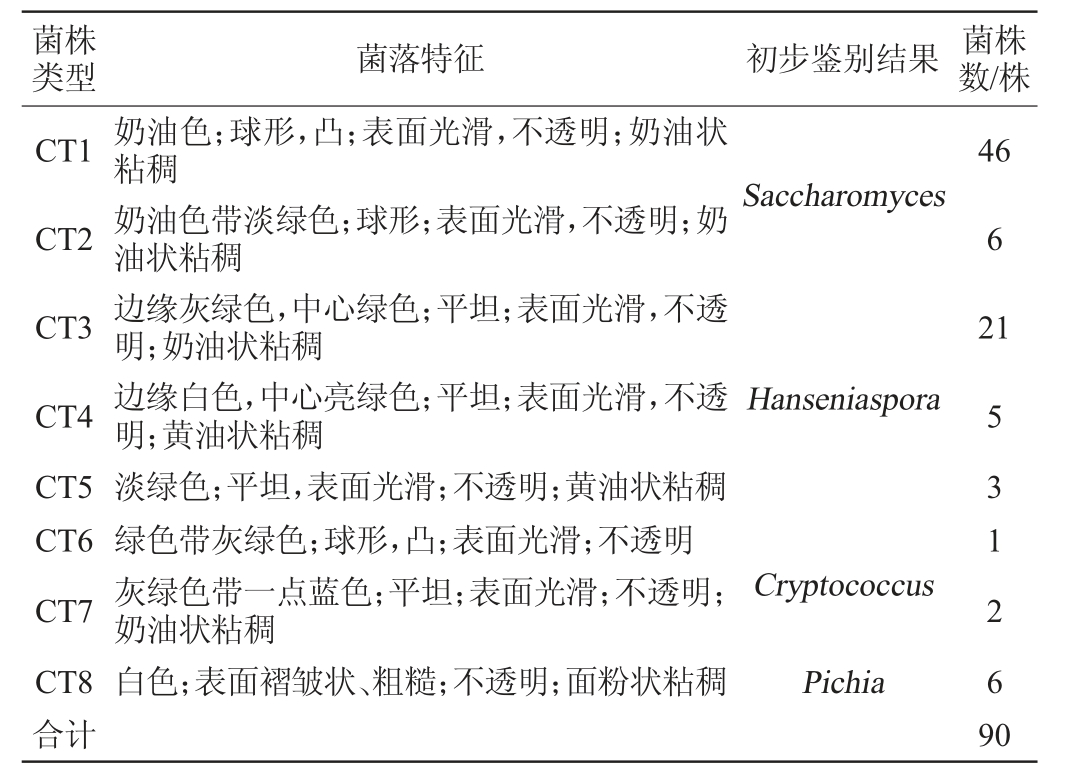
菌株类型 菌落特征 初步鉴别结果 菌株数/株CT1 CT2 CT3 CT4 CT5 CT6 CT7 CT8合计奶油色;球形,凸;表面光滑,不透明;奶油状粘稠奶油色带淡绿色;球形;表面光滑,不透明;奶油状粘稠边缘灰绿色,中心绿色;平坦;表面光滑,不透明;奶油状粘稠边缘白色,中心亮绿色;平坦;表面光滑,不透明;黄油状粘稠淡绿色;平坦,表面光滑;不透明;黄油状粘稠绿色带灰绿色;球形,凸;表面光滑;不透明灰绿色带一点蓝色;平坦;表面光滑;不透明;奶油状粘稠白色;表面褶皱状、粗糙;不透明;面粉状粘稠Saccharomyces 46 6 21 Hanseniaspora Cryptococcus Pichia 5 31 2 69 0
由表1可知,初步鉴别CT1和CT2可能为酿酒酵母属(Saccharomyces),占总数的57.78%;CT3、CT4和CT5可能为有孢汉逊属酵母属(Hanseniaspora),占总数的32.22%;CT6、CT7可能为隐球酵母属(Cryptococcus),占总数的3.33%;CT8可能为毕赤酵母属(Pichia),占总数的6.67%。
2.2 酵母分子生物学鉴定与酿酒酵母基因分型
将鉴定为酿酒酵母的菌株进行Interdelta指纹图谱分型,共获得3种不同的电泳图谱,即该20株菌株分属于3种基因型,代表菌株的电泳图谱结果见图1。从WLN培养菌株类型CT1和CT2组中,将初步鉴定为酿酒酵母的菌株随机挑选20株进行26S rRNA分子生物学鉴定,结果见图2。由图2可知,20株菌株均为酿酒酵母(Saccharomyces cerevisiae)。
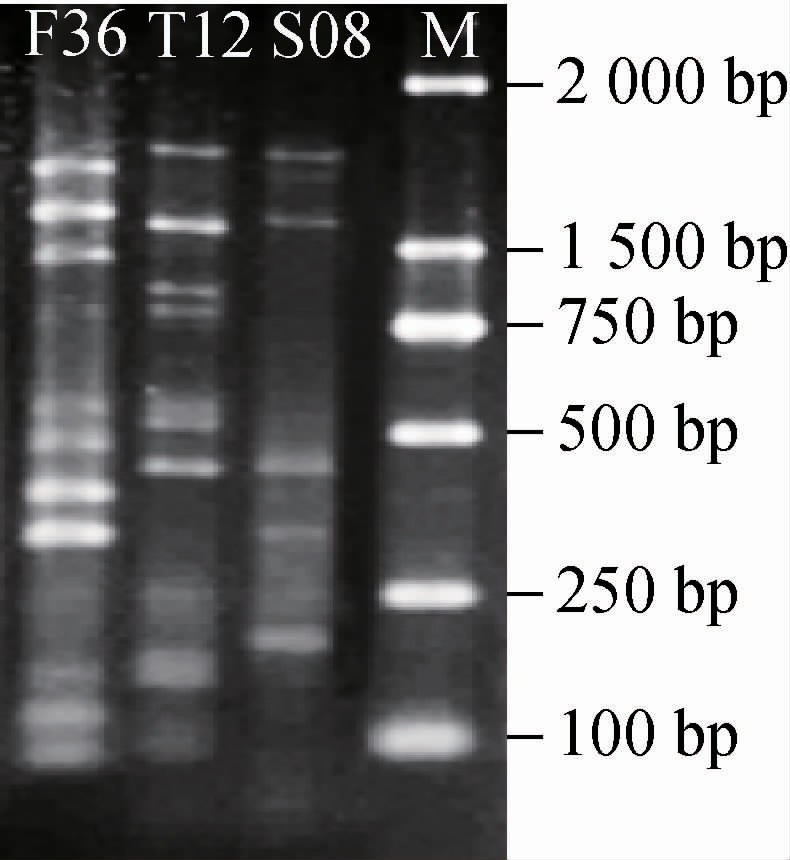
图1 四川渠县本土野生酿酒酵母Interdelta分析结果
Fig.1 Interdelta analysis results of native wild Saccharomyces cerevisiae in Quxian county, Sichuan province
M为DL 2 000 bp DNA marker。
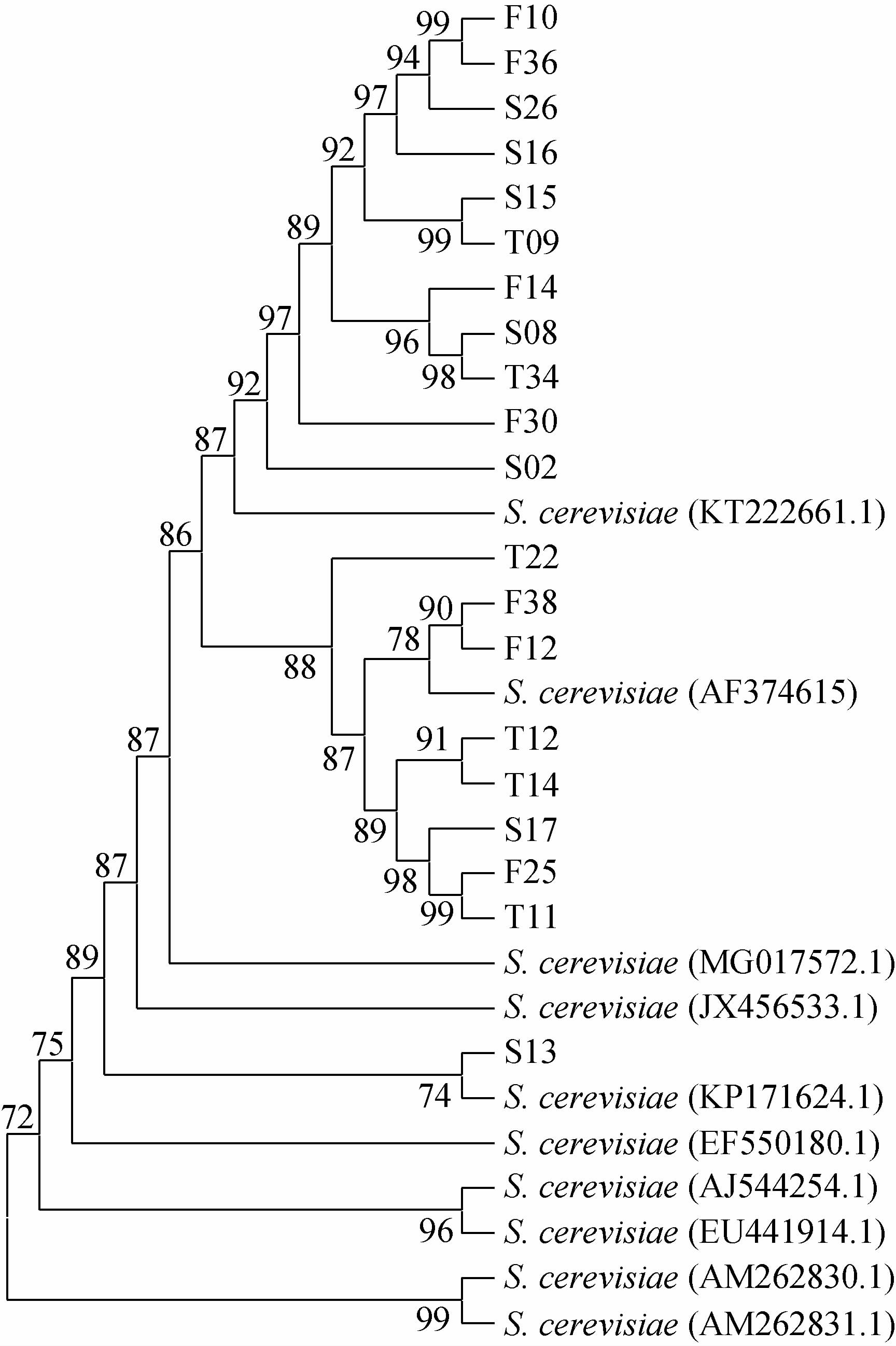
图2 基于26S rRNA基因序列四川渠县本土野生菌株的系统发育树
Fig.2 Phylogenetic tree of native wild strains from Quxian county,Sichuan province based on 26S rRNA gene sequences
2.3 酿酒酵母菌株的发酵力
通常认为基因型一样的菌株,其酿造学特性基本一致,因此只需要从不同基因型菌株中,随机挑取2~4个菌株开展后续试验[11];随后,从3个不同基因型中随机挑选4个菌株,共计12个菌株,进行菌株酿造学评价,结果见表2。
表2 代表酿酒酵母菌株的发酵力
Table 2 Fermentation power of representative Saccharomyces cerevisiae strains
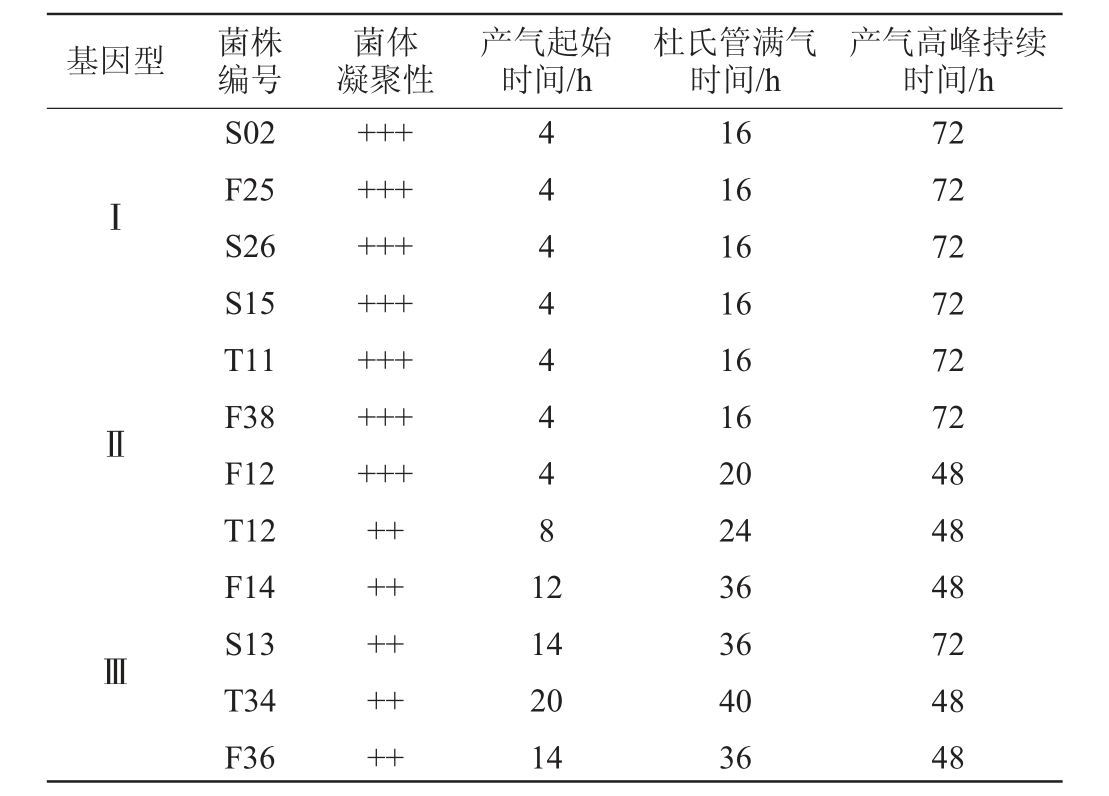
注:“+”表示凝聚性较差;“++”表示凝聚性一般;“+++”表示凝聚性较好。
基因型 菌株编号菌体凝聚性产气起始时间/h杜氏管满气时间/h产气高峰持续时间/hⅠⅡ444444481 2ⅢS02 F25 S26 S15 T11 F38 F12 T12 F14 S13 T34 F36+++++++++++++++++++++++++++++++14 20 14 16 16 16 16 16 16 20 24 36 36 40 36 72 72 72 72 72 72 48 48 48 72 48 48
由表2可知,菌株S02、S15、S26、T11、F12、F25和F38凝聚性能最好;菌株S02、S15、S26、T11、F12、F25和F38产气最早,在培养4 h即开始产气;菌株S02、S13、S15、S26、T11、F25和F38的发酵高峰持续时间最久,达72 h左右;菌株S02、S15、S26、T11、F25和F38发酵最为迅速,杜氏小管满气时间为16 h。综合以上结果,选取菌株S02、S15、S26、T11、F25和F38进行后续耐受性测试。
2.4 酿酒酵母菌株的耐受性
2.4.1 乙醇耐受性
酿酒酵母菌对乙醇耐受力的强弱,可以充分判断果酒酿造过程中酒精发酵是否彻底。以商业酿酒酵母BV818作为对照菌株,对2.3筛选获得的6株酿酒酵母菌株的乙醇耐受性进行测定,结果见表3。
表3 筛选菌株乙醇耐受性测定结果
Table 3 Determination results of ethanol-tolerance of screened strains
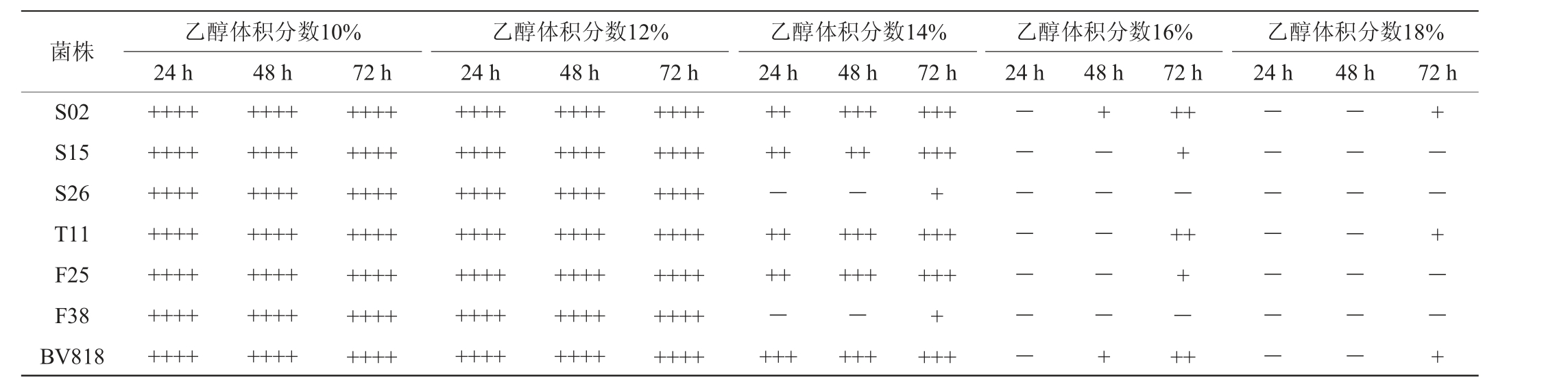
注:“++++”表示杜氏管满气体;“+++”表示杜氏管3/4气体;“++”表示杜氏管1/2气体;“+”表示杜氏管1/4气体;“-”表示不产生气体。
菌株S02 S15 S26 T11 F25 F38 BV818乙醇体积分数10%24 h 48 h乙醇体积分数12%24 h 48 h乙醇体积分数14%24 h 48 h乙醇体积分数16%24 h 48 h++++++++++++++++++++++++++++++++++++++++++++++++++++++++72 h 72 h 72 h 72 h++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++-++++-++++++++-++++++-++++++++++++++++++++-------+-----++++-+++-++乙醇体积分数18%24 h 48 h 72 h--------------+--+--+
由表3可知,7株酵母菌均能在乙醇体积分数为10%和12%的培养基中生长、产气;当乙醇体积分数为14%时,所有菌株发酵产气均明显减弱,菌株S26和F38尤其明显;当乙醇体积分数为16%时,仅菌株S02、S15、T11、F25和BV818还有轻微发酵及少量产气;当乙醇体积分数增加到18%时,仅菌株S02、T11和BV818在超过48 h后才有少量产气外,其余菌株均停止发酵产气,菌体浓度急剧减少基本未检测到。可见,野生酿酒酵母乙醇耐受性较低,与吴启凤等[24]研究结果相一致。若要酿造酒精度较高的脐橙果酒,还需对分离得到的野生酵母菌株做进一步驯化和培育。
2.4.2 SO2耐受性
果酒酿造过程中,一定量的SO2能够起到杀菌、抗氧化和增加酸度等作用,因此优良酿酒酵母需要具有较高的耐受SO2能力。选取具有较强乙醇耐受性的菌株S02、S15、T11、F25和BV818进行SO2耐受性测定,结果见表4。由表4可知,菌株S15、T11、F25和BV818对SO2均有较高的耐受性,在SO2含量为300 mg/L的培养基中,仍能保持微弱发酵和生长,而菌株S02对SO2非常敏感,在SO2质量浓度为100 mg/L时便无法生长。
表4 筛选菌株的SO2耐受性试验结果
Table 4 SO2 tolerance test results of screened strains

注:“++”表示产气或生长旺盛;“+”表示产气或生长较少;“(+)”表示微量产气或生长;“(-)”表示菌体浓度少量减少;“-”表示停止产气或菌体浓度显著减少。
菌株S02 S15 T11 F25 BV818 SO2质量浓度/(mg·L-1)60 100 150 200 300+---++++++++++++++++++++++++-++ ++(-)(-)(+)(+)
2.4.3 糖耐受性
选取具有较强SO2耐受性的S15、T11、F25和BV818进行糖耐受性测定,结果见表5。由表5可知,所有菌株在糖含量20%的培养基中均能正常发酵和生长,菌体数量增长明显;在糖含量30%时,S15菌体生长量最低;在40%糖含量时,各菌株发酵产气迅速下降;当糖含量达到60%时,只有菌株T11、F25和BV818能够进行微弱发酵产气,菌体数量无明显变化。结果表明,菌株T11、F25和商业酿酒酵母BV818具有较高的糖耐受性。
表5 筛选菌株的糖耐受性试验结果
Table 5 Sugar tolerance test results of screened strains
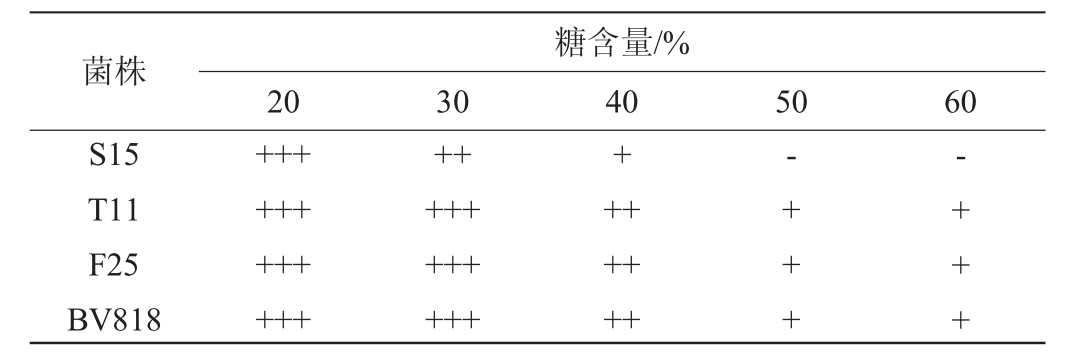
注:“+++”表示产气旺盛或菌体生长多;“++”表示产气较强或菌体生长一般;“+”表示产气弱或菌体生长少;“-”表示不产气或菌体减少;“--”表示菌体明显减少。
菌株S15 T11 F25 BV818糖含量/%20 30 40 50 60++++++++++++++++++++++++++++++-+++-+++
2.5 酿酒酵母菌株的显色筛选结果
以商业酿酒酵母BV818、F5和空白组为对照,对菌株T11和F25进行产乙醇、产H2S和产酯能力显色检测,结果见表6。由表6可知,四株菌的TTC显色均呈现深红色,Biggy Agar培养基均呈现浅棕褐色,产酯培养基均呈现深黄色。说明菌株T11、F25和对照商业酿酒酵母菌株BV818、F5相似,属于具有较强产乙醇、产酯且低产H2S的菌株,符合生产对酿酒酵母的基本要求。
表6 筛选菌株在TTC、Biggy Agar和产酯培养基上的显色结果
Table 6 Chromogenic results of screened strains on TTC, Biggy Agar and ester-producing medium

菌株编号 TTC显色 Biggy Agar培养基显色 产酯培养基显色对照BV818对照F5 T11 F25深红深红深红深红浅棕褐色浅棕褐色浅棕褐色浅棕褐色深黄色深黄色深黄色深黄色
2.6 酵母菌株酿造脐橙果酒
2.6.1 酵母菌株酿酒性能的测定
将T11、F25和商业酵母BV818、F5分别应用于脐橙果酒的酿造,按照GB/T 15038—2006《葡萄酒、果酒通用分析方法》对所酿脐橙果酒进行色度、还原糖、总酸、挥发酸、酒精度、pH和总酚等指标进行检测,结果见表7。
表7 筛选菌株酿酒性能的对比
Table 7 Comparison of brewing performance of screened strains
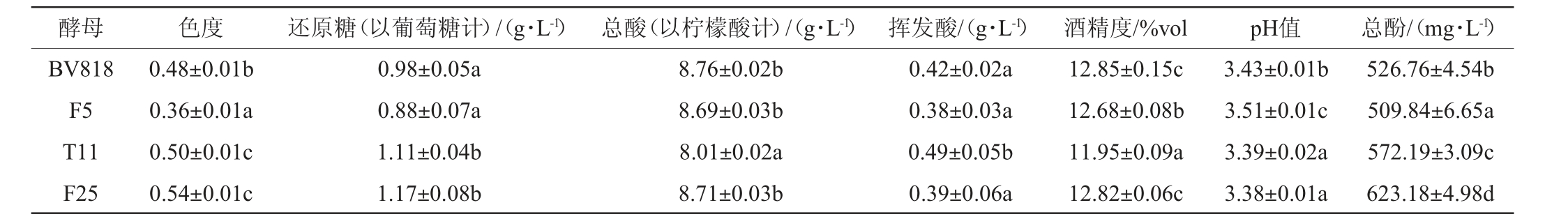
酵母 色度 还原糖(以葡萄糖计)/(g·L-1) 总酸(以柠檬酸计)/(g·L-1) 挥发酸/(g·L-1) 酒精度/%vol pH值 总酚/(mg·L-1)BV818 F5 T11 F25 0.48±0.01b 0.36±0.01a 0.50±0.01c 0.54±0.01c 0.98±0.05a 0.88±0.07a 1.11±0.04b 1.17±0.08b 8.76±0.02b 8.69±0.03b 8.01±0.02a 8.71±0.03b 0.42±0.02a 0.38±0.03a 0.49±0.05b 0.39±0.06a 12.85±0.15c 12.68±0.08b 11.95±0.09a 12.82±0.06c 3.43±0.01b 3.51±0.01c 3.39±0.02a 3.38±0.01a 526.76±4.54b 509.84±6.65a 572.19±3.09c 623.18±4.98d
由表7可知,菌株T11和F25所酿脐橙果酒均符合GB 15037—2006《葡萄酒》要求,并且其还原糖、总酸、挥发酸、酒精度和总酚等指标均接近商业酵母。
2.6.2 脐橙果酒挥发性香气成分分析
利用顶空固相微萃取结合GC-MS技术对菌株T11、F25和商业菌株BV818、F5所酿造的脐橙果酒挥发性风味成分进行检测,挥发性成分差异分析热图见图3。由图3可知,不同酵母酿造的脐橙原酒样品可以聚为3类:两株商业酵母菌株BV818和F5酿造酒样聚为一类,T11和F25酿造酒样分别单独聚为一类。在脐橙果酒中共检测到37种挥发性风味成分,包括酯类18种,醇类3种,酸类7种,醛、酮类3种,萜烯类和降异戊二烯类6种。
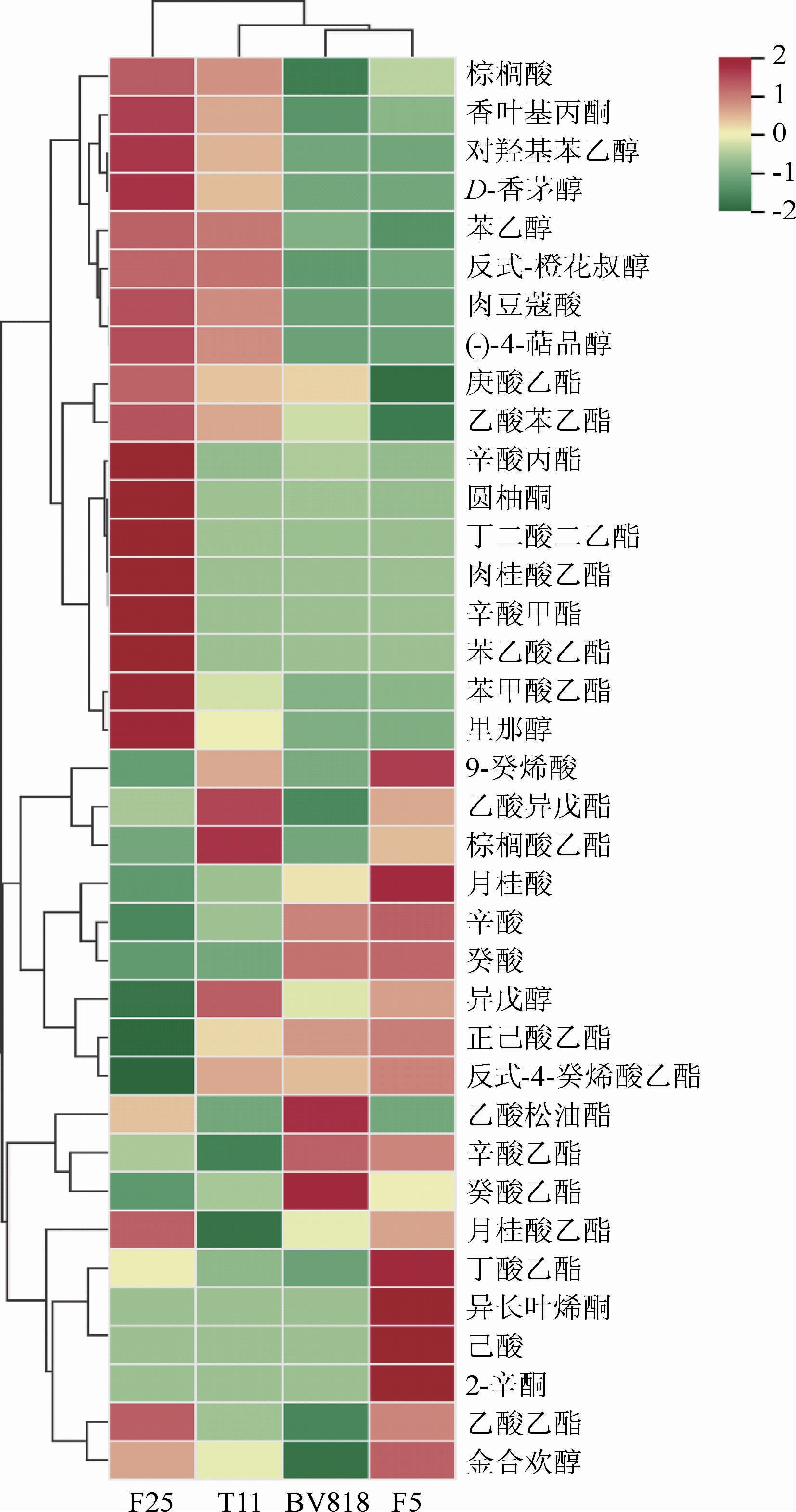
图3 不同酵母所酿脐橙果酒挥发性成分差异分析热图
Fig.3 Differences analysis heatmap of volatile components of navel orange wine brewed by different yeast strains
不同酵母酿造脐橙果酒挥发性风味成分含量对比结果见图4。由图4可知,不同酵母酿造脐橙果酒挥发性风味成分含量不同,其中,酯类BV818>F5>F25>T11,醇类T11>F25>F5>BV818,酸类F5>BV818>T11>F25,醛酮类F25>F5>BV818>T11,萜烯类和降异戊二烯类F25>T11>F5>BV818。相较商业酵母,T11酿造酒样的醇类挥发性成分含量最高,醇类物质含量也最高,为2 226.65 mg/L,F25酒样的醛酮类、萜烯类和降异戊二烯类含量较高,醛酮类物质含量达1 196.07 mg/L,酯类种类虽然最多,但是其含量却低于对照两株商业酵母。
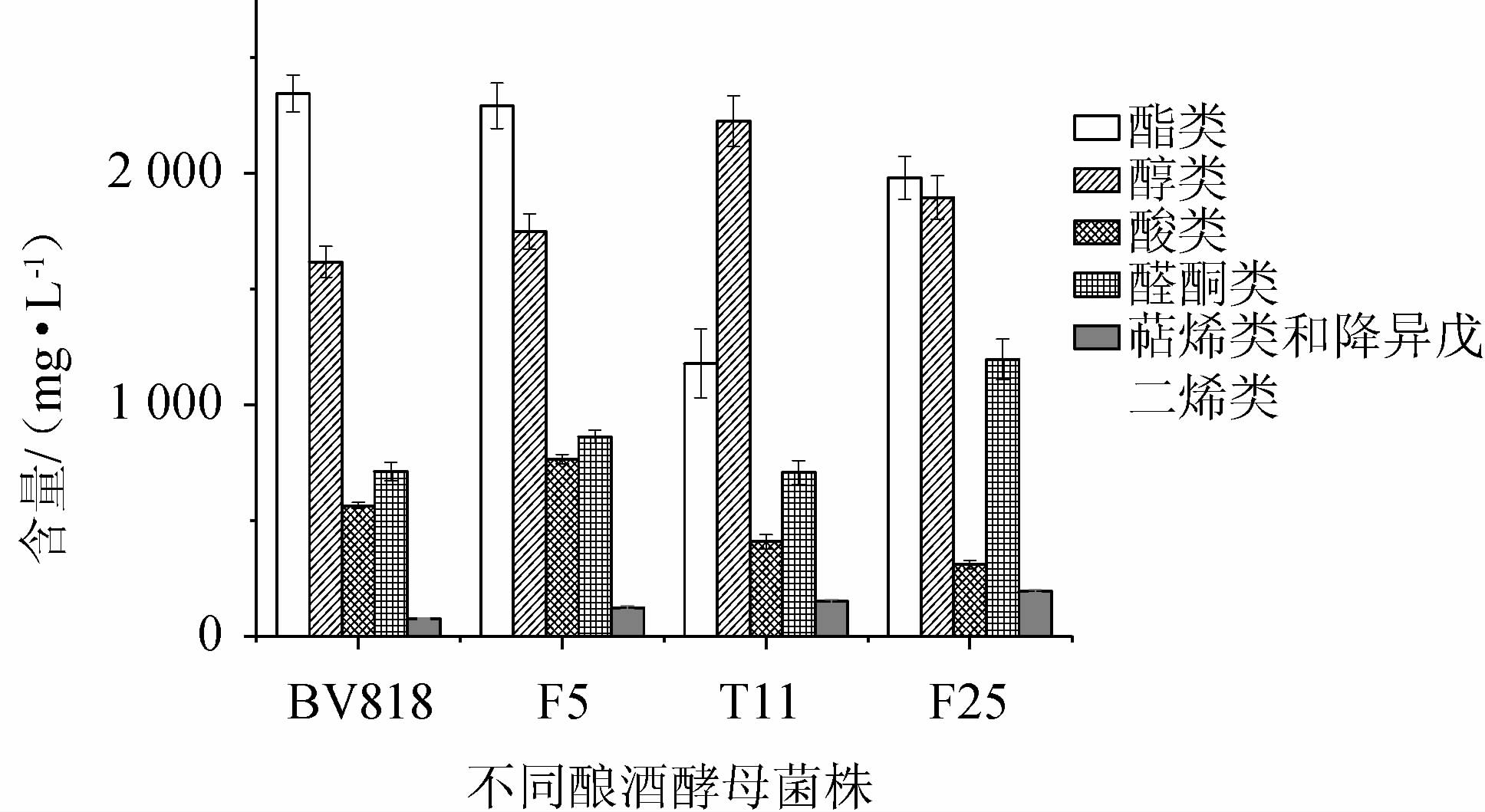
图4 不同酵母酿造脐橙果酒挥发性风味成分含量对比
Fig.4 Comparison of volatile flavor components in navel orange wine brewed by different yeasts
F25酿造酒样的20种香气成分含量较高,分别是棕榈酸、香叶基丙酮、对羟基苯乙醇、D-香茅醇、苯乙醇、反式-橙花叔醇、肉豆蔻酸、(-)-4-萜品醇、庚酸乙酯、乙酸苯乙酯、辛酸丙酯、圆柚酮、丁二酸二乙酯、肉桂酸乙酯、辛酸甲酯、苯乙酸乙酯、苯甲酸乙酯、里那醇、月桂酸乙酯和乙酸乙酯;T11酿造酒样的乙酸异戊酯、棕榈酸乙酯和异戊醇含量较高。F25酿造酒样因为独有的香气成分辛酸甲酯、辛酸丙酯、苯乙酸乙酯和肉桂酸乙酯,使其表现出甜美的花香和果香;F25和T11酒样较商业酵母BV818和F5酿造酒样,因为对羟基苯乙醇、肉豆蔻酸、里那醇、(-)-4-萜品醇和D-香茅醇等成分的存在,萜烯类和降异戊二烯类物质所特有花的清香会更浓一些。通过与商业酵母酒样挥发性成分的对比可知,菌株F25和T11酒样在花香、果香呈现上,均具有一定的优势。
2.6.3 脐橙果酒感官评价分析
不同酵母酿造脐橙果酒感官评价结果见图5。
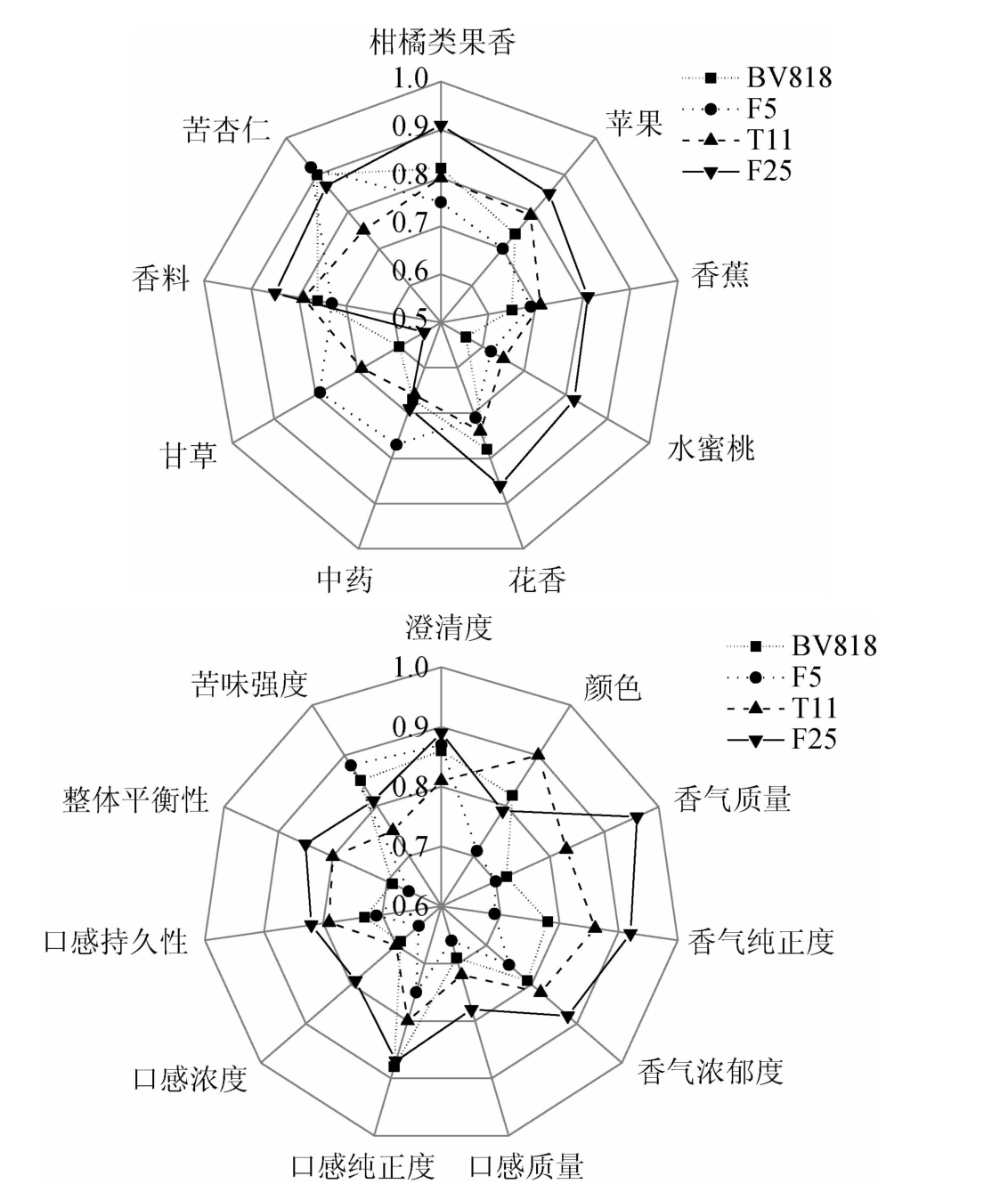
图5 不同酵母酿造脐橙果酒感官评价结果
Fig.5 Sensory evaluation results of navel orange wine brewed by different yeasts
由图5可知,4株酵母菌发酵酿造脐橙果酒,感官整体可接受度得分依次为:F25>T11>BV818>F5。F25所酿脐橙果酒香气评价总体优于T11和两株商业酵母。F25酒样的果香、花香等感官得分均最高,与GC-MS测定结果中F25的苯乙酸乙酯、肉桂酸乙酯、里那醇、(-)-4-萜品醇、D-香茅醇和香叶基丙酮等含量相对较高相对应,这与ESCUDERO A等[25-26]研究发现酯类和烯萜类化合物可增强发酵果酒中果香、花香相一致。同时,F25含有较高的正戊醇和对羟基苯乙醇,有助于提升脐橙果酒的香气质量、纯正度和浓郁度,这与STYGER G等[27]研究发现发酵酒中风味强度与醇类化合物种类、质量浓度关系密切相符合。菌株F25与T11两株对照商业酵母菌株相比,酿造果酒的香气评价更好,其中F25酿造脐橙果酒具有更大优势。
3 结论
本研究以四川渠县脐橙园土壤、果树枝叶和脐橙果实外果皮为分离源,分离筛选出两株性能优良的酿酒酵母菌F25和T11。该两株酿酒酵母菌具有发酵启动早、产气速度快、发酵高峰持续时间久和良好凝聚性等优良特性。两株菌对乙醇、SO2和糖均具有较强耐受性,均能在体积分数16%乙醇、300 mg/L SO2及60%糖含量的培养基中生长,且均表现出较强的产乙醇、产酯能力和低产H2S能力。同时,菌株F25和T11均具有优良的脐橙果酒酿酒性能,其中F25酿造的脐橙果酒在香气成分及感官品鉴方面明显优于两株商业酵母菌。本研究的结果显示,本土酿酒酵母F25和T11具有应用于脐橙果酒工业生产的潜力和价值。
[1]沈兆敏.二十年来我国柑橘产业的十大变化[J].果农之友,2021(6):1-3.
[2]李世琦.猕猴桃酒增香型非酿酒酵母筛选及混菌发酵特性研究[D].杨凌:西北农林科技大学,2022.
[3]罗佳丽,王雪莹,王孝荣,等.甜橙果酒酵母筛选及发酵性能[J].食品科学,2013,34(11):222-227.
[4]刘瑞,陈福生,张秀艳.橘园分离的非酿酒酵母的耐受性分析[J].中国酿造,2015,34(3):20-23.
[5]熊元林,李晓宇.橙汁果酒绮丽酵母的筛选及耐受性[J].贵州农业科学,2014,42(10):213-216.
[6]游见明.桔子果酒酵母的分离筛选[J].中国酿造,2009,28(4):55-57.
[7]陈清婵,孙爱红,简清梅,等.适用于橘子酒发酵的野生酵母初步筛选[J].中国酿造,2017,36(5):128-131.
[8]岑涛,岳田利,袁亚宏,等.云南芒果中酵母菌分离鉴定及在芒果酒发酵中的应用[J].食品科学,2015,36(11):119-124.
[9]张会娟,张首玉,邱聪,等.一株产酯酵母的鉴定及发酵性能研究[J].河南工业大学学报(自然科学版),2015,36(2):23-25.
[10] BALDWIN E, PLOTTO A, MANTHEY J, et al.Effect of Liberibacter infection (Huanglongbing disease) of citrus on orange fruit physiology and fruit/fruit juice quality:chemical and physical analyses[J].J Agr Food Chem,2010,58(2):1247-1262.
[11]杨慧敏,任晓娜,秦义.四川甘孜州高山葡萄酒产区酵母菌多样性分析[J].微生物学通报,2022,49(7):2673-2685.
[12]裴颖芳,王国平,刘延琳.赤霞珠葡萄酒自然发酵中酿酒酵母的菌株区分[J].微生物学通报,2009,36(10):1532-1535.
[13]孙悦,张方方,褚遂兴,等.接种不同嗜杀特性的酿酒酵母对赤霞珠发酵中酵母多样性的影响[J].食品科学,2020,41(2):166-172.
[14]赵雪平,温雅娇,李正英,等.内蒙古乌海地区沙漠葡萄发酵醪液中酿酒酵母菌的筛选与鉴定[J].食品研究与开发,2020,41(5):164-170.
[15]赵前.姜汁啤酒酿造菌株的筛选及酿造工艺的研究[D].银川:宁夏大学,2023.
[16]乔喜玲.干红葡萄酒酿酒酵母的优选及其酿酒特性研究[D].呼和浩特:内蒙古农业大学,2020.
[17]忻胜兵.优质特性酿酒酵母的选育及直投式发酵菌剂研发[D].呼和浩特:内蒙古农业大学,2018.
[18]张鸣宇,罗莉莎,高特,等.本土美极梅奇酵母对玫瑰香葡萄酒降醇及香气的影响[J].中国酿造,2023,42(1):133-141.
[19]毕静莹,李华,王华.发酵温度对柑橘酒品质的影响[J].食品科学,2019,40(6):209-216.
[20]PALLMANN C L,BROWN J A,OLINEKA T L,et al.Use of WL medium to profile native flora fermentations[J].Am J Enol Viticult,2001,52(3):198-203.
[21]杨莹,徐艳文,薛军侠,等.WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J].微生物学杂志,2007,27(5):75-78.
[22]王冠群.新疆葡萄酒相关酵母菌菌群结构分析及优良株酿造干化酒的研究[D].阿拉尔:塔里木大学,2018.
[23]姜蕾.焉耆葡萄产区非酿酒酵母菌的筛选及呈香效应研究[D].石河子:石河子大学,2019.
[24]吴启凤,李红梅,杨胜涵,等.水晶葡萄酿酒酵母菌的分离筛选及酿酒性能研究[J].中国酿造,2019,38(7):65-69.
[25] ESCUDERO A, CAMPO E, FARIÑA L, et al.Analytical characterization of the aroma of five premium red wines.Insights into the role of odor families and the concept of fruitiness of wines[J].J Agr Food Chem,2007,55(11):4501-4510.
[26]PUŠKAŠ V S,MILJIC'U D,DJURAN J J,et al.The aptitude of commercial yeast strains for lowering the ethanol content of wine[J].Food Sci Nutr,2020,8(3):1489-1498.
[27]STYGER G, PRIOR B, BAUER F F.Wine flavor and aroma[J].J Ind Microbiol Biot,2011,38(9):1145.