酱油是一种传统调味品,在中国、韩国和日本广受欢迎[1]。目前,高盐稀态发酵工艺仍是我国酱油酿造的主要方法,其主要的工艺特征是在较高盐浓度(20%)下进行控温或非控温发酵2~6个月[2]。酱油发酵机理是一个错综复杂的生物化学反应过程,发酵过程中环境中的微生物,如芽孢杆菌(Bacillus)、酵母菌和乳酸菌等,会产生许多特征性风味化合物[3]。
目前,从酱油中发现的特征性风味化合物主要有4-乙基愈创木酚(4-ethylguaiacol,4-EG)、4-乙烯基愈创木酚(4-vinylguaiacol,4-VG)、5-乙基-4-羟基-2-甲基-3(2H)-呋喃酮、苯乙醛、3-甲硫基丙醇、吡嗪类化合物等[4-6]。其中,4-EG是一种挥发性酚类化合物,呈发酵香气,具有烟熏味、丁香味和辛香味,属酱香型香气,其作为酱油关键风味成分,具有缓和咸味作用[7-8]。此外,4-EG可以对抗人体异常氧化应激,具有保护细胞和抑制炎症免疫反应的作用[9-10]。4-EG风味阈值极低,0.5 mg/L的质量浓度就能被感官识别,1~2 mg/L的质量浓度便可明显改善酱油的风味品质[11]。目前,报道能够产4-EG的微生物菌株比较少,大部分菌株是以4-VG为前体合成4-EG,然而能直接利用阿魏酸(ferulic acid,FA)合成4-EG的微生物却鲜有报道[12-13]。
本研究采用传统培养分离方法结合耐盐性及4-EG生产能力测定,从广式高盐稀态酱油发酵酱醪中分离筛选能代谢FA合成4-EG的微生物,通过形态观察、分子生物学技术对分离菌株进行鉴定,同时对其生长特性进行研究,并将其应用于酱油生产,为改善提升酱油品质奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株豆粕、炒麦、麦麸、米曲霉(Aspergillus oryzae)3.042的孢子粉、生酱油、酱醪:山东玉兔食品股份有限公司。
1.1.2 试剂
食盐(未加碘):济南家家悦购物超市;大豆蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;酵母浸出物(生化试剂):安琪酵母股份有限公司;葡萄糖(分析纯):山东西王糖业有限公司;FA、4-乙烯基愈创木酚(4-VG)、4-乙基愈创木酚(4-EG)(均为色谱纯):上海麦克林生化科技有限公司;甲醇(色谱纯):国药集团化学试剂有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
MRS肉汤:北京奥博星生物技术有限责任公司。
麦芽汁培养基:青岛高科技工业园海博生物技术有限公司。
分离培养基[14]:30%生酱油,20%麦芽汁,15%MRS肉汤,2%琼脂,10%氯化钠,0.01%氯霉素,pH为7.1。
LB液体培养基[15]:1%大豆蛋白胨,1%氯化钠,0.5%酵母浸粉。固体培养基中添加2%琼脂。
筛选培养基:LB液体培养基中添加0.01%FA。
高盐LB培养基:LB固体培养基中添加10%氯化钠。
以上培养基均在121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
7200分光光度计:上海尤尼科仪器有限公司;SBA-40D生物传感分析仪:山东科学院生物研究所;PB-10 pH计:德国赛多利斯集团;Diane Utimate3000高效液相色谱(high performance liquid chromatography,HPLC)仪、U3000紫外检测器、ProFlexTM 96孔聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技有限公司;FlavourSpecR风味分析仪:山东海能科学仪器有限公司。
1.3 方法
1.3.1 菌株的分离
在无菌条件下将酱醪用10%的盐水稀释1倍制成悬浮液,再用10%的盐水进行梯度稀释后涂布于分离培养基平板,37 ℃培养24~48 h。挑取单菌落接种于高盐LB培养基,37 ℃培养24~48 h,经多次分离纯化得到单菌落。
1.3.2 高产4-乙基愈创木酚菌株的筛选
将分离纯化的菌株接种于筛选培养基中,在37 ℃、150 r/min条件下摇瓶培养72 h,测定发酵液中的4-EG含量,筛选4-EG产量高的菌株。
1.3.3 筛选菌株的鉴定
形态观察:挑取筛选菌株的单菌落接种于LB固体培养基,37 ℃培养24~48 h,观察记录培养基上菌落的质地和形态等特征,用接种环挑取典型菌落进行镜检,观察菌体形态。
分子生物学鉴定:将纯化的单菌落接种到LB液体培养基,37 ℃培养24 h,离心弃去上清液,采用0.9%生理盐水洗涤菌体,将菌体送到青岛生物工程有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basiclocalalignmentsearch tool,BLAST)序列同源性比对,选取同源性较高的模式菌株的16S rDNA基因序列,利用MEGA 11.0中的邻接(neigh bor-joining,NJ)法构建系统发育树,并进行1 000次bootstraps检验计算支持率。
1.3.4 筛选菌株生长性能测试
培养温度的影响:将纯化的单菌落接种到LB液体培养基,37 ℃培养24 h制备种子液,按照5%(V/V)的接种量将种子液接种到LB液体培养基中,在不同的培养温度(37 ℃、45 ℃、52 ℃)条件下静置培养24 h,测定培养液菌体浓度(OD600nm值),根据菌体浓度确定菌株的最佳生长温度。
转速的影响:按照5%(V/V)的接种量将种子液接种到LB液体培养基中,在最佳生长温度条件下,在不同转速(0、40 r/min、80 r/min、120 r/min、160 r/min)条件下培养24 h,测定培养液菌体浓度(OD600nm值),确定最佳转速。
盐含量的影响:按照5%(V/V)的接种量将种子液接种到不同盐含量(0、5%、10%、15%、20%)的LB液体培养基中,在最适条件下培养24 h,测定培养液菌体浓度(OD600nm值),考查菌株的耐盐性。
1.3.5 高盐含量下筛选菌株转化FA进程
将种子液按5%(V/V)的接种量接种至盐含量为20%的LB液体培养基中,其中添加初始质量浓度为100 mg/L的FA。在45 ℃、160 r/min条件下培养,分别在培养5 d、10 d、15 d时取样,测定发酵液中的FA、4-VG、4-EG含量。
1.3.6 筛选菌株在酱油发酵中的应用
采用高盐稀态法酿造酱油[16]。将纯化的单菌落接种到盐含量为5%的LB液体培养基中,45 ℃、160 r/min条件下培养,待菌液浓度达2×108 CFU/mL时,停止培养。实验组按5%(V/V)的接种量接种产4-EG菌株,对照组加入5%(V/V)的LB液体培养基,45 ℃发酵。发酵前5 d,每天搅拌一次,之后间隔5 d搅拌一次,取发酵0、5 d、10 d、15 d、30 d、60 d的样品,测定酱油发酵液中FA、4-EG、氨基酸、有机酸和葡萄糖含量,选取发酵15 d和30 d的样品测定挥发性风味物质,并对发酵结束的酱油进行感官品评。
1.3.7 测定方法
菌体浓度的测定:将菌体培养液适当稀释,采用UNICO 7200分光光度计在波长600 nm处测定吸光度值。FA、4-VG、4-EG含量的测定:按照文献[17]的HPLC法。氨基酸含量的测定:按照文献[18]的HPLC法。有机酸和葡萄糖含量的测定:按照文献[19]的HPLC法。挥发性风味物质的测定:按照文献[20-21]的气相色谱-离子迁移谱(gas chromatographyion mobility spectrometry,GC-IMS)法。感官评价:选取7位受到系统培训的品评员按照文献[22-23]对灭菌的酱油发酵液的滋味和香气进行盲评。
1.3.8 数据处理
每个实验均设置3次平行,实验数据使用Origin2019和SPSS 26处理,实验结果用“平均值±标准差”的形式表示。
2 结果与分析
2.1 高产4-EG菌株的分离筛选
将酱醪样品进行多次稀释涂布培养和划线分离,根据菌落特征初步分离筛选获得6株耐高盐的菌株,编号为XJB-1、XJB-2、XJB-3、JLB30-1、JLB30-2、JLB30-3。6株菌株发酵液中的4-EG含量见表1。由表1可知,菌株JLB30-1、JLB30-2、JLB30-3可利用筛选培养基中的FA产生4-EG,且菌株JLB30-2产4-EG的能力最强,4-EG含量可达15.67mg/L。
表1 初筛菌株的4-EG产量测定结果
Table 1 Determination result of 4-EG yield of the initial screening strain
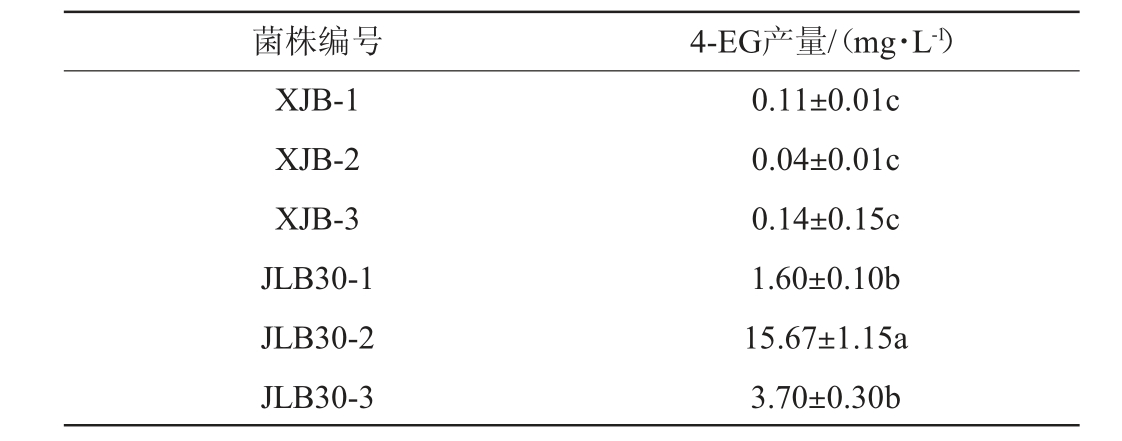
注:不同小写字母表示差异显著(P<0.05),下同。
菌株编号 4-EG产量/(mg·L-1)XJB-1 XJB-2 XJB-3 JLB30-1 JLB30-2 JLB30-3 0.11±0.01c 0.04±0.01c 0.14±0.15c 1.60±0.10b 15.67±1.15a 3.70±0.30b
2.2 菌株JLB30-2的鉴定
2.2.1 形态观察
菌株JLB30-2在LB固体培养基上的菌落形态及细胞形态见图1。
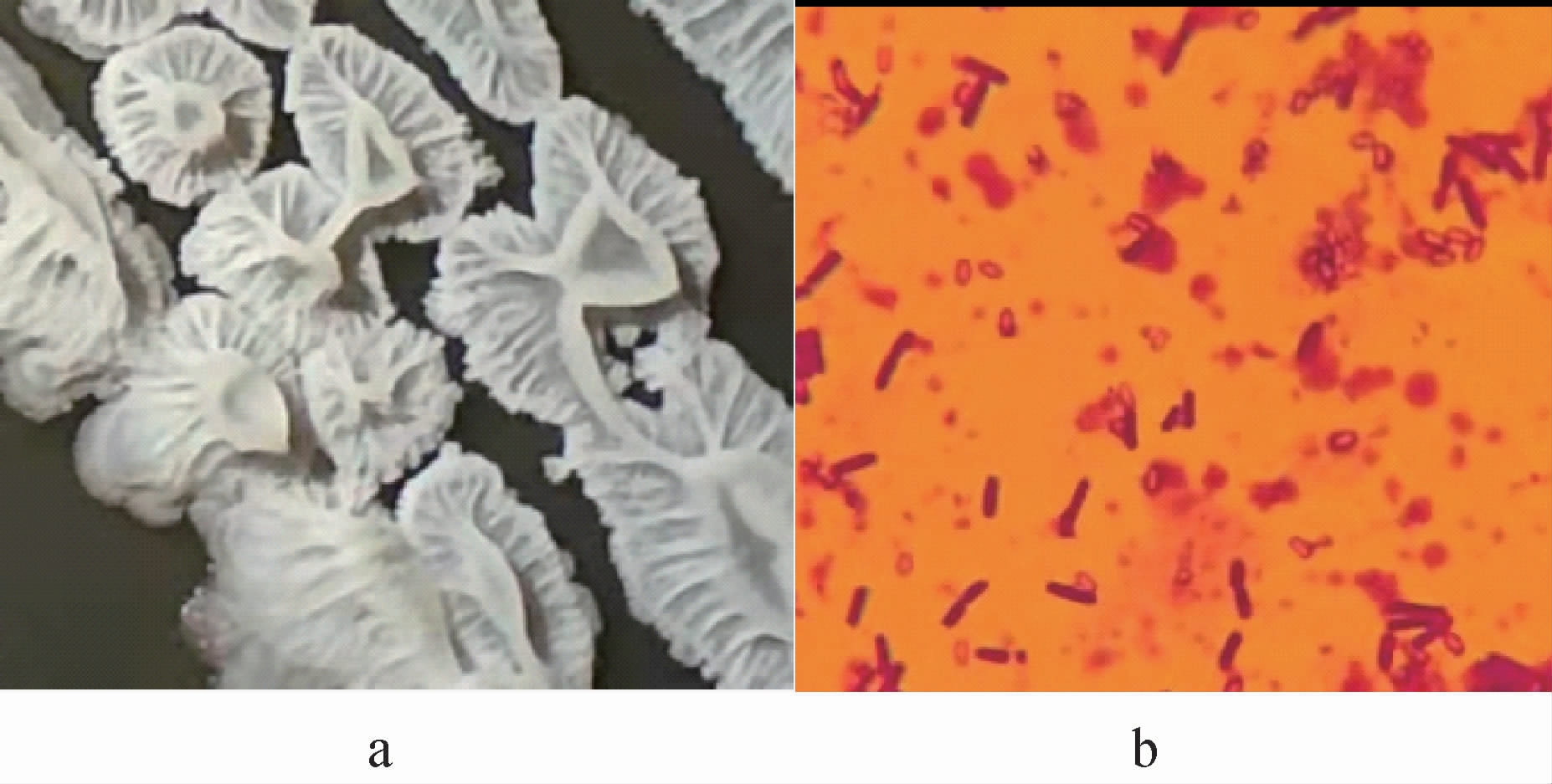
图1 菌株JLB30-2的菌落形态(a)与细胞形态(b)
Fig.1 Colony morphology (a) and cell morphology (b) of strain JLB30-2
由图1可知,菌株JLB30-2的菌落白色不透明,形状不规则,中央隆起,表面粗糙有皱褶,边缘不规则,湿润粘稠且易挑起;在显微镜下菌体呈长杆状。
2.2.2 分子生物学鉴定
基于16S rDNA基因序列构建菌株JLB30-2的系统进化树,结果见图2。由图2可知,菌株JLB30-2与枯草芽孢杆菌(Bacillus subtilis)聚于同一分支,综合该菌株的形态特征,鉴定该菌株为枯草芽孢杆菌(Bacillus subtilis)。

图2 基于16S rDNA基因序列菌株JLB30-2的系统发育树
Fig.2 Phylogenetic tree of strain JLB30-2 based on 16S rDNA gene sequence
2.3 枯草芽孢杆菌JLB30-2的生长特性
2.3.1 培养温度对枯草芽孢杆菌JLB30-2生长的影响
枯草芽孢杆菌JLB30-2在不同培养温度条件下的生长情况见图3。由图3可知,B.subtilis JLB30-2在37~52 ℃条件下均能生长,且在45 ℃条件下OD600nm值最高。说明该菌株最佳生长温度为45 ℃,适合高温发酵。目前,酱油发酵工艺主要有两大类:以高盐稀态和低盐固态发酵工艺为代表的高温发酵工艺,发酵的温度在45 ℃左右;以日式酱油为代表的常温发酵,发酵温度在30 ℃左右[24-25]。B.subtilisJLB30-2的生长温度与高温发酵工艺相适应,因此,可以作为产香菌株添加到酱油中发挥作用。
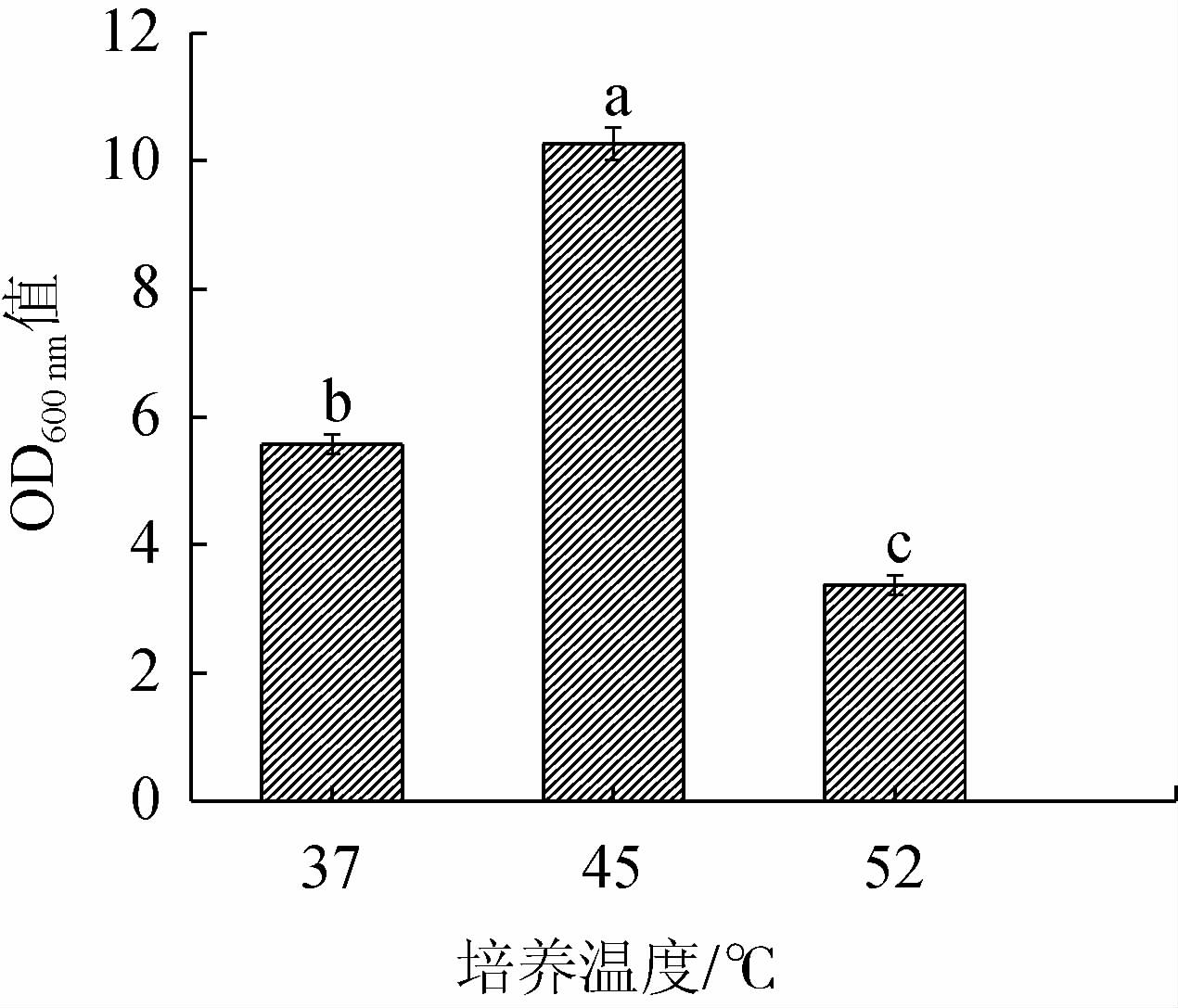
图3 培养温度对菌株JLB30-2生长的影响
Fig.3 Effect of culture temperature on the growth of strain JLB30-2
不同字母代表差异性显著(P<0.05)。
2.3.2 转速对菌株JLB30-2生长的影响
菌株JLB30-2在不同转速条件下的生长情况见图4。由图4可知,菌体OD600nm值随摇床转速的升高呈上升趋势,在低氧条件下,B.subtilis JLB30-2仍能较好生长,并且随着发酵时间的延长,发酵液菌体OD600nm值逐渐变大,静置培养6 d时,发酵液的菌体OD600 nm值可达12.93。表明B.subtilis JLB30-2能在溶氧较少的酱醪中生长,为其作为产香菌株添加到酱油中应用提供了可能。
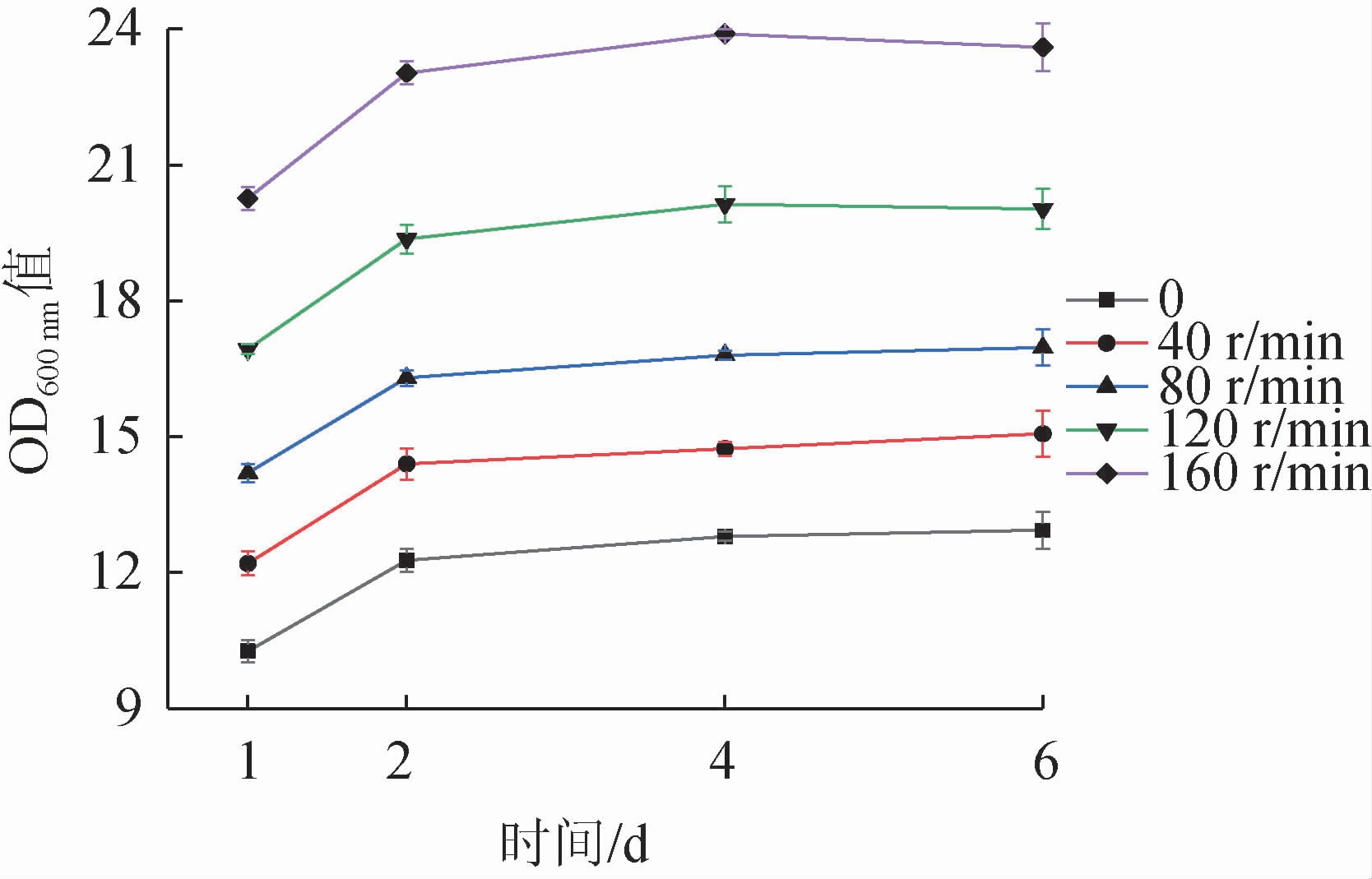
图4 转速对菌株JLB30-2生长的影响
Fig.4 Effect of rotational speed on the growth of strain JLB30-2
2.3.3 盐含量对枯草芽孢杆菌JLB30-2生长的影响
酱油酿造所需的高盐浓度影响微生物的生长和繁殖,能在这种环境下生存的微生物必须具有一定的耐盐特性。因此,对枯草芽孢杆菌JLB30-2的耐盐性进行分析,结果见图5。由图5可知,在相同培养条件下,随着盐含量的增加,B. subtilis JLB30-2的生长受到抑制,但随着培养时间的延长,OD600 nm值仍呈缓慢增加态势,在20%的高盐含量下B. subtilis JLB30-2仍能缓慢生长。由此可知,B. subtilis JLB30-2能耐受酱油的高盐环境。
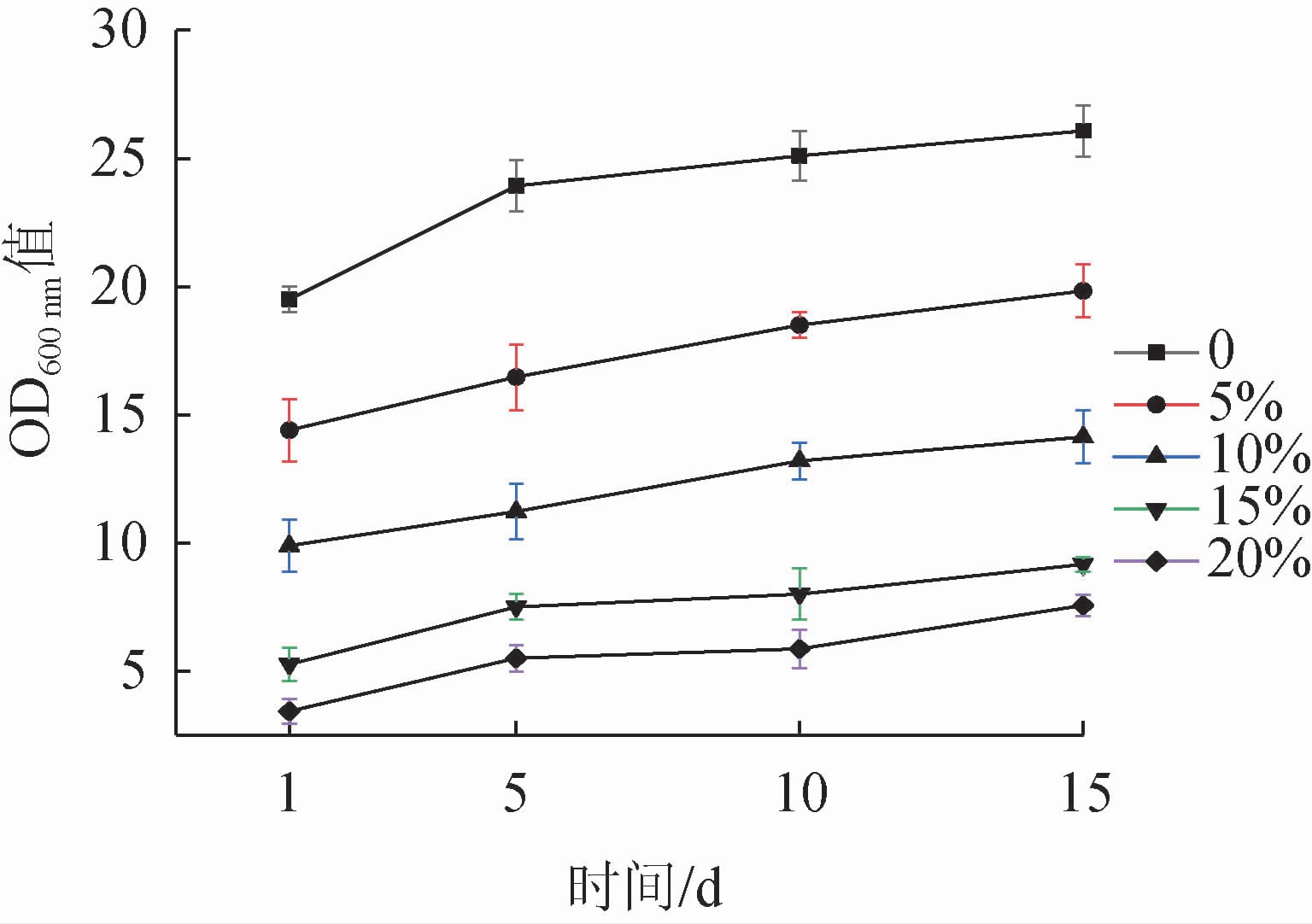
图5 盐含量对菌株JLB30-2生长的影响
Fig.5 Effect of salt concentration on the growth of strain JLB30-2
2.4 高盐环境对枯草芽孢杆菌JLB30-2转化FA的影响
高盐环境(20%盐含量)对枯草芽孢杆菌JLB30-2转化FA生产4-VG和4-EG的影响见图6。由图6可知,在20%盐含量条件下,随着发酵时间的延长,FA含量逐渐下降,4-VG和4-EG含量逐渐升高,发酵15 d后发酵液中FA含量降至47.00 mg/L,4-VG含量及4-EG含量均达到最高,分别为34.20 mg/L、21.00 mg/L。在整个发酵过程中FA的利用量与4-EG的生成量呈负相关。由此可知,B.subtilis JLB30-2可以适应高盐条件,具有优越的代谢功能,在高盐环境下发酵可以产生大量的4-EG,使得发酵液香气浓郁,适合增强酱油的风味,因此,选择B.subtilis JLB30-2作为产香菌株添加到酱油中。
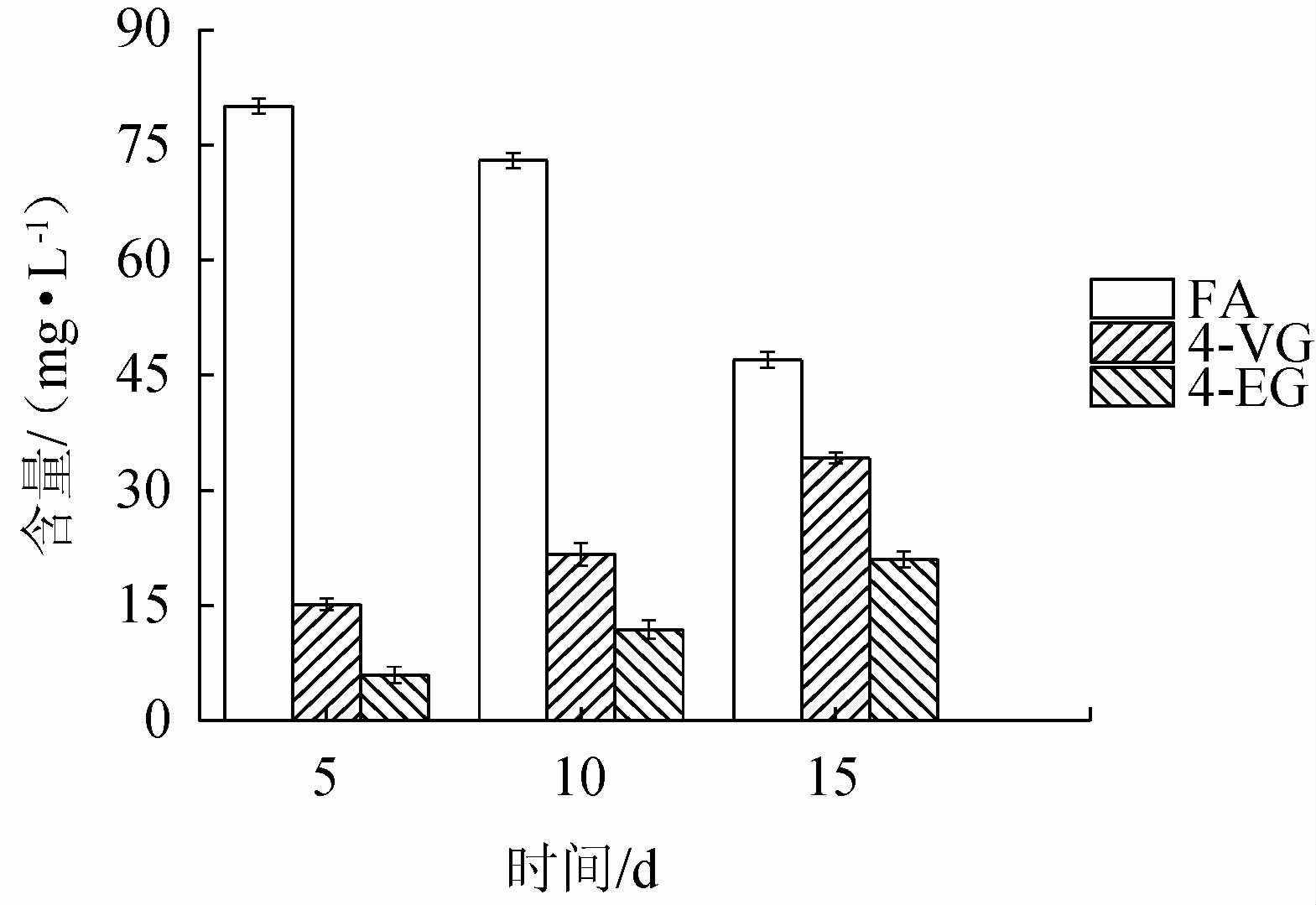
图6 高盐环境对菌株JLB30-2转化阿魏酸的影响
Fig.6 Effect of high salt environment on converting ferulic acid of strain JLB30-2
2.5 枯草芽孢杆菌JLB30-2在酱油发酵中的应用
2.5.1 强化枯草芽孢杆菌JLB30-2对酱油中4-EG含量的影响酱油中的阿魏酸主要存在于谷物原料(大豆、小麦和麸皮)的细胞壁中,其单体以及二聚体主要以酯键结合到阿拉伯糖残基上或醚键结合到木质素表面[26]。在酱油发酵过程中,细胞壁中的FA需要被微生物产生的阿魏酸酯酶水解才能释放[27]。酱油发酵过程中,FA及4-EG含量的变化见图7。由图7可知,随着发酵时间的延长,对照组和实验组FA的含量逐渐降低,4-EG含量逐渐升高。发酵60 d时,实验组FA含量降到17.5 mg/L,4-EG产量达到29.75 mg/L,而未强化枯草芽孢杆菌JLB30-2的对照组FA含量为55.5 mg/L,4-EG含量为6.85 mg/L,所以在酱醪中强化B.subtilis JLB30-2能明显提高FA到4-EG转化效率,提高酱油中的4-EG含量。
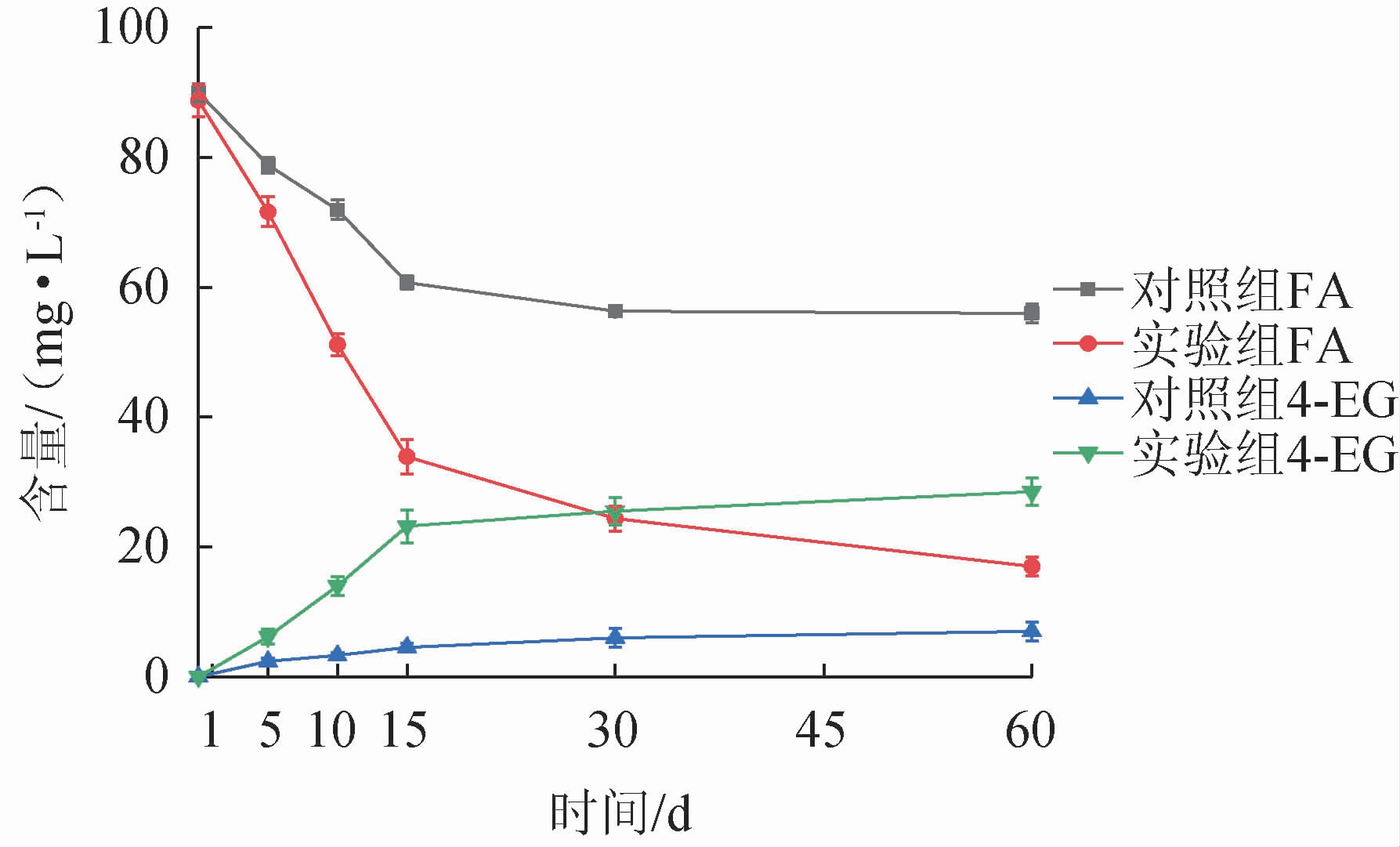
图7 菌株JLB30-2对酱油发酵中生成4-EG的影响
Fig.7 Effect of strain JLB30-2 on 4-EG production in soy sauce fermentation
2.5.2 强化枯草芽孢杆菌JLB30-2对酱油中挥发性风味物质的影响
采用GC-IMS分析强化枯草芽孢杆菌JLB30-2实验组和对照组酱油发酵15 d和30 d的挥发性风味物质组成,指纹图谱见图8。由图8可知,随着发酵时间延长,挥发性风味物质的组成变化比较明显,且实验组和对照组之间也有差异。发酵15 d时,对照组中含量多的挥发性风味物质主要是醛类,如糠醛、苯甲醛、苯乙醛等,呈杏仁味香气[28],实验组中含量多的挥发性风味物质主要是酮类,如3-羟基-2-丁酮、2,3-丁二酮、1-辛烯-3-酮等,呈花果香和奶油香气[29]。发酵30 d时,对照组中苯乙醛、己醛、壬醛等物质含量比发酵15 d的变多,实验组中2-己酮、2-丁酮、3-辛酮等物质含量比发酵15 d的变多。由图8亦可知,对照组和实验组中含量多的挥发性风味物质以醛类和酮类物质为主,随着发酵时间的增加,醛类物质含量逐渐减少,而酮类物质含量不断增加,其中实验组中的酮类物质含量高于对照组的酮类物质含量,说明菌株JLB30-2能够促进酱油中酮类物质的产生,有助于酱香风味的形成。
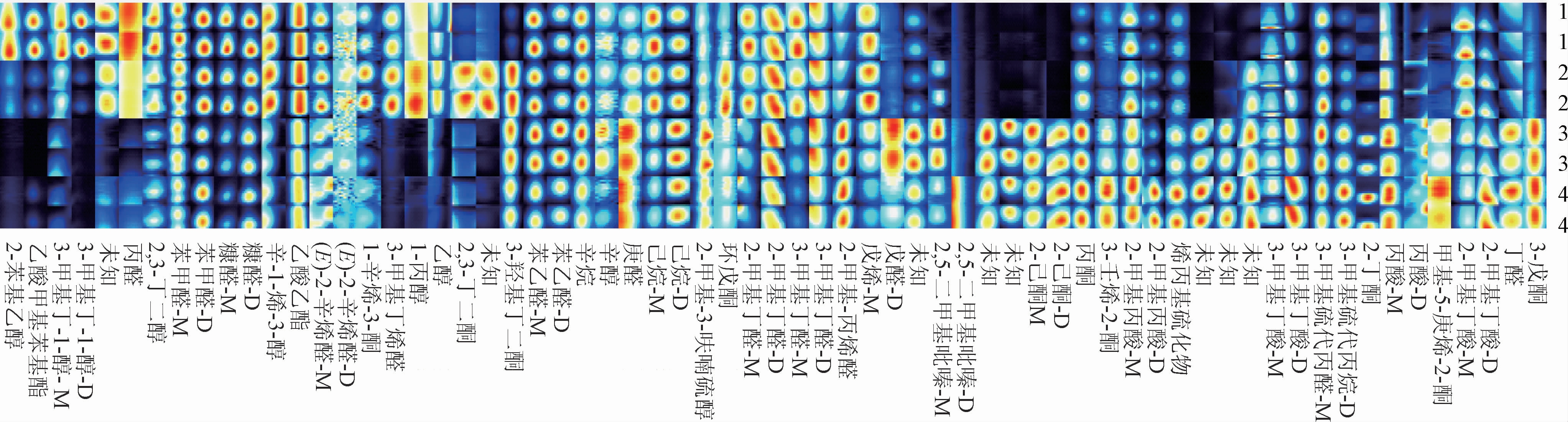
图8 菌株JLB30-2对酱油挥发性风味物质的影响
Fig.8 Effect of strain JLB30-2 on the volatile flavor substances in soy sauce
1是发酵15 d的对照组,2是发酵15 d的实验组,3是发酵30 d的对照组,4是发酵30 d的实验组;图中一列代表某种挥发性物质在不同样品中的信号峰,信号峰的颜色明暗代表该物质的浓度高低,红色越深,说明对应物质浓度越多;蓝色越深则反之;M代表单体化合物,D代表二聚体化合物。
2.5.3 强化枯草芽孢杆菌JLB30-2对酱油中氨基酸、有机酸及葡萄糖的影响
酱油发酵过程中游离氨基酸、有机酸及葡萄糖含量的变化见图9。游离氨基酸是酱油鲜味的主要来源,另外,氨基酸可以通过酶催化和非酶催化生成各类呈香物质,丰富酱油的香气[30-31]。由图9a可知,随着发酵时间的延长,醪液中氨基酸含量也逐步增加,前期增速较快,后期增速变慢,这主要是蛋白酶的作用。值得注意的是,强化枯草芽孢杆菌JLB30-2实验组的氨基酸含量明显高于对照组,这可能与枯草芽孢杆菌JLB30-2可以分泌少量蛋白酶有关。

图9 菌株JLB30-2对酱油发酵过程中氨基酸(a)、有机酸(b)及葡萄糖(c)含量的影响
Fig.9 Effect of strain JLB30-2 on the contents of amino acids (a), organic acids (b), and glucose (c) in soy sauce fermentation process
D代表对照组,S代表实验组,数字代表发酵时间。
有机酸和葡萄糖对酱油的风味形成也发挥重要作用[32],由图9b可知,在酱油发酵过程中,实验组和对照组的有机酸组成相似,主要为乳酸、草酸、乙酸、苹果酸、琥珀酸、柠檬酸,含量也没有明显的区别,说明枯草芽孢杆菌JLB30-2对有机酸的合成影响较小。由图9c可知,酱油发酵过程中葡萄糖含量始终处于较低水平,实验组发酵初期葡萄糖有快速下降阶段,说明枯草芽孢杆菌JLB30-2在醪液中有较高的活性,增加了糖消耗。
2.5.4 强化枯草芽孢杆菌JLB30-2对酱油感官品质的影响
对两组酱油的滋味和香气特征进行感官评分,结果见图10。由图10可知,在滋味方面,实验组的鲜味、烟熏味、厚味、甜味、酸味、综合口感和偏爱程度均高于对照组;在香气方面,实验组的花果香、焦香、醇香、酱香、麦芽香、大豆香、综合香气和偏爱程度均高于对照组,说明强化B. subtilis JLB30-2后可以提升成品酱油的感官品质,这与文献[33]报道添加B.subtilis或其他产香细菌可以改善酱油的感官品质的研究结果相似,说明B.subtilis JLB30-2在改善酱油风味和感官方面有较好的应用前景。
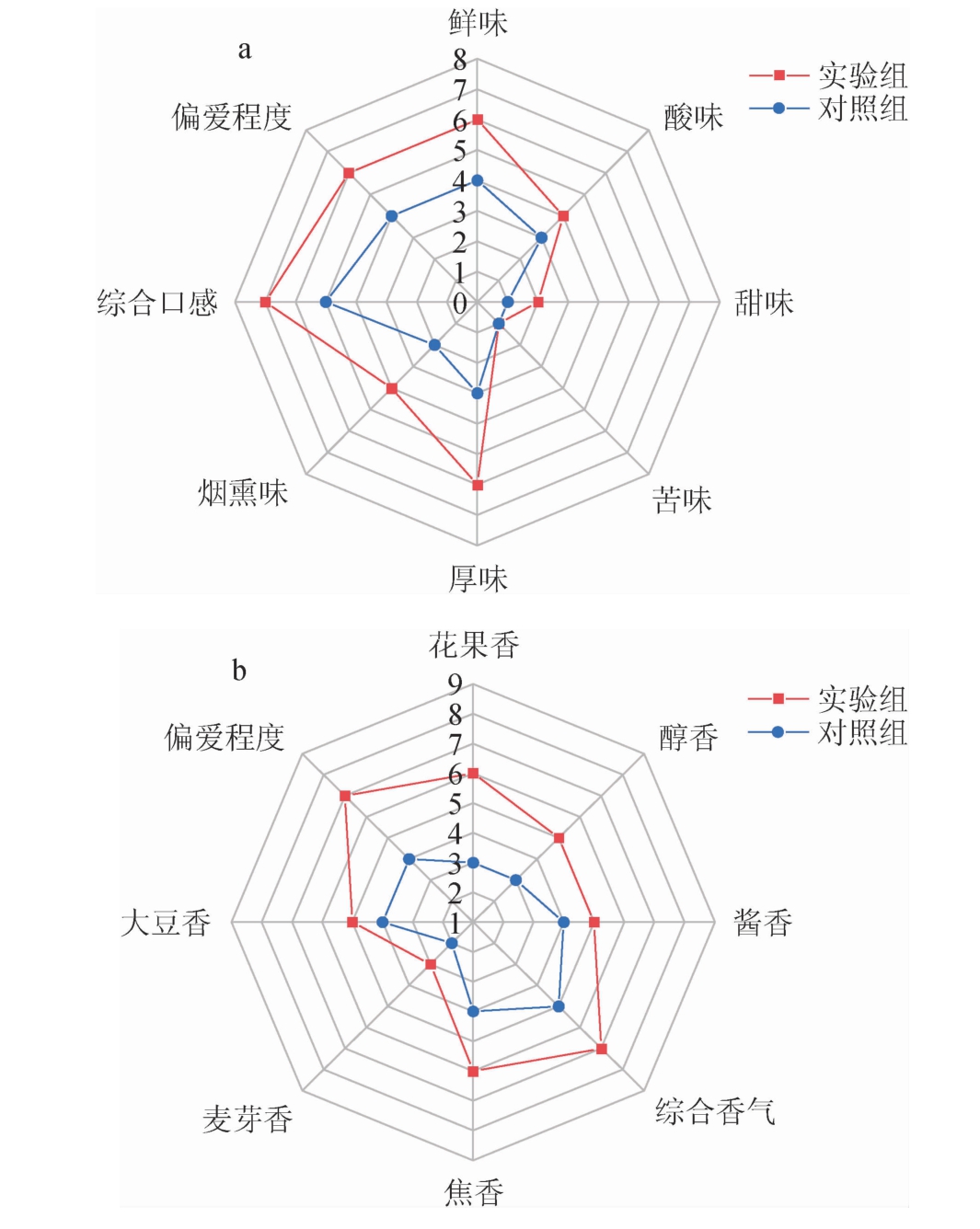
图10 菌株JLB30-2对酱油滋味(a)和香气(b)的影响
Fig.10 Effect of strain JLB30-2 on taste(a)and aroma(b)of soy sauce
3 结论
本研究从广式高盐稀态酱油的酱醪中分离筛选到1株能够将FA高效转化为4-EG的细菌JLB30-2,经形态观察及分子生物学技术鉴定其为枯草芽孢杆菌(Bacillus subtilis),该菌株在45 ℃、160 r/min、20%盐含量环境下,能将发酵液中的FA转化为4-EG,说明其能够很好地适应广式高盐稀态酱油酿造过程中高盐、高温、低氧环境。在酱油酿造过程强化菌株JLB30-2,发酵60 d时,酱油中4-EG含量为29.75 mg/L,是对照组(6.85 mg/L)的3.34倍,同时增加了酱油中氨基酸、酮类化合物的含量,强化了酱油醇香和酱香,提高了酱油的感官品质,对提升酱油品质具有重要实用价值。
[1]张凤英.酱油发酵工艺分析[J].现代食品,2017,4(7):86-87.
[2]符姜燕.酱油发酵工艺及改善酱油风味的方法探讨[J].食品安全导刊,2020(12):148,150.
[3] INOUE Y, KATO S, SAIKUSA M, et al.Analysis of the cooked aroma and odorants that contribute to umami aftertaste of soy miso (Japanese soybean paste)[J].Food Chem,2016,213(12):521-528.
[4]YAN Y H,ZHANG M,ZHANG Y C,et al.Correlation between bacterial diversity and flavor substances in Longgang soy sauce[J].Biosci Biotech Bioch,2023,87(5):541-554.
[5]KANEKO S,KUMAZAWA K,NISHIMURA O.Studies on the key aroma compounds in raw(unheated)and heated Japanese soy sauce[J].J Agr Food Chem,2013,61(14):3396-3402.
[6]康文丽,陈亮,贺博.高盐稀态酿造酱油中香气活性成分在灭菌前后的变化[J].食品科学,2019,40(18):253-258.
[7] FENG Y Z, CAI Y, SU G W, et al.Evaluation of aroma differences between high-salt liquid-state fermentation and low-salt solid-state fermentation soy sauces from China[J].Food Chem,2014,145(2):126-134.
[8]KANEKO S,KUMAZAWA K,NISHIMURA O.Comparison of key aroma compounds in five different types of Japanese soy sauces by aroma extract dilution analysis(AEDA)[J].J Agric Food Chem,2012,60(15):3831-3836.
[9]ZHAO D R,SHI D M,SUN J Y,et al.Quantification and cytoprotection by vanillin,4-methylguaiacol and 4-ethylguaiacol against AAPH-induced abnormal oxidative stress in HepG2 cells[J].RSC Adv,2018,8(62):35474-35484.
[10]ZHAO D R,JIANG Y S,SUN J Y,et al.Anti-inflammatory mechanism involved in 4-Ethylguaiacol-Mediated inhibition of LPS-Induced inflammation in THP-1 cells[J].J Agr Food Chem, 2019, 67(4): 1230-1243.
[11]WANG Z,WANG S,LIAO P F,et al.HS-SPME combined with GC-MS/O to analyze the flavor of strong aroma Baijiu Daqu[J].Foods,2022,11(1):116.
[12]邹谋勇,何理琴,孙启星.产4-乙基愈创木酚酵母的鉴定及其在酱油中的应用[J].食品科学,2021,42(12):138-144.
[13]郭明威,耿予欢.酱油发酵过程中一株4-乙基愈创木酚转化菌的筛选及鉴定[J].食品与发酵工业,2021,47(21):18-23.
[14]赵祥颖,张颖超,于鑫,等.一种产4-乙基愈创木酚枯草芽孢杆菌及其在酱油酿造中的应用CN116478885A[P].2023-07-25.
[15]JIANG X W,XU Y T,YE J,et al.Isolation,identification and application on soy sauce fermentation flavor bacteria of CS1.03[J].J Food Sci Tech Mys,2019,56(4):2016-2026.
[16]华媛媛.高盐稀态发酵酱油生产工艺[J].城市建设理论研究,2014(20):924-925.
[17]DETERING T,MUNDRY K,BERGER R G.Generation of 4-vinylguaiacol through a novel high-affinity ferulic acid decarboxylase to obtain smoke flavours without carcinogenic contaminants[J].Plos One,2020,15(12):e0244290.
[18]CHEN X Q,LI C W,LIU X F,et al.Near-infrared spectroscopy of Chinese soy sauce for quality evaluation[J].Qual Assur Saf Crop Foods,2023,15(1):139-151.
[19] ZHAO G Z, DING L L, HADIATULLAH H, et al.Characterization of the typical fragrant compounds in traditional Chinese-type soy sauce[J].Food Chem,2020,312(5):126054.
[20]WANG J,WEI B C,WANG X,et al.Aroma profiles of sweet cherry juice fermented by different lactic acid bacteria determined through integrated analysis of electronic nose and gas chromatography-ion mobility spectrometry[J].Front Microbiol,2023,14(1):1113594.
[21] SLAMA N, MANKAI H, LIMAM F.Streptomyces tunisiensis DSM 42037 mediated bioconversion of ferulic acid released from barley bran[J].World J Microb Biot,2021,37(4):70.
[22]ZHAO G Z,FENG Y X,HADIATULLAH H,et al.Chemical characteristics of three kinds of Japanese soy sauce based on electronic senses and GC-MS analysis[J].Front Microbiol,2021,11(1):579808.
[23]IMAMURA M,MATSUSHIMA K.Suppression of umami aftertaste by polysaccharides in soy sauce[J].J Food Sci,2013,78(8):1136-1143.
[24]MOGI R,WATANABE J.Identification of SFL1 as a positive regulator for flor formation in Zygosaccharomyces rouxii[J].Biosci Biotech Bioch,2020,84(6):1291-1298.
[25]SHIRAKAWA D,WAKINAKA T,WATANABE J.Identification of the putative N-acetylglucosaminidase CseA associated with daughter cell separation in Tetragenococcus halophilus[J].Biosci Biotech Bioch,2020,84(8):1724-1735.
[26] FENG J C, XU B M, JIANG X L, et al.Distribution of phenolic compounds and antioxidant activities in layered grinding wheat flour and the regulation effect of nitrogen fertilizer application[J].Acta Agronomica Sinica,2022,48(3):704-715.
[27]KOSEKI T,HORI A,SEKI S,et al.Characterization of two distinct feruloyl esterases,AoFaeB and AoFaeC,from Aspergillus oryzae[J].Appl Microbiol Biot,2009,83(4):689-696.
[28] ZHU X P, SUN-WATERHOUSE D X, CHEN J H, et al.Comparative study on the novel umami-active peptides of the whole soybeans and the defatted soybeans fermented soy sauce[J].J Sci Food Agr,2021,101(1):158-166.
[29]SASSI S,WAN-MOHTAR W A A Q I,JAMALUDIN N S,et al.Recent progress and advances in soy sauce production technologies: A review[J].J Food Process Pres,2021,45(10):e15799.
[30]SUGAWARA T,SARAPRUG D,SAKAMOTO K.Soy sauce increased the oxidative stress tolerance of nematode via p38 MAPK pathway[J].Biosci Biotech Bioch,2019,83(4):709-716.
[31]NISHIMURA I,SHINOHARA Y,OGUMA T,et al.Survival strategy of the salt-tolerant lactic acid bacterium, Tetragenococcus halophilus, to counteract koji mold,Aspergillus oryzae,in soy sauce brewing[J].Biosci Biotech Bioch,2018,82(8):1437-1443.
[32]KONG Y,ZHANG L L,ZHANG Y Y,et al.Evaluation of non-volatile taste components in commercial soy sauces[J].Int J Food Prop,2018,21(1):1854-1866.
[33] JIANG X W, PENG D, ZHANG W, et al.Effect of aroma-producing yeasts in high-salt liquid-state fermentation soy sauce and the biosynthesis pathways of the dominant esters[J].Food Chem,2021,344(5):128681.