生物活性多糖因其治疗特性和相对较低的副作用而被广泛研究和用于食品和药品行业。多糖的抗肿瘤[1]、免疫调节[2]和抗菌[3]活性已在生化和医学领域得到充分研究和应用,植物和藻类作为人类多糖的重要来源,需求压力越来越大,这使得生物聚合物的全球市场价格被推高,同时过度依赖地球上的水生和陆地绿植来满足人类的经济、能源、食品与医学等需求是全球变暖和气候变化挑战的直接原因[4]。因此,寻找到无需进行耕地或光合生产的替代品至关重要[5]。
植物内生菌种类繁多,广泛分布在植物的根茎叶中,而且在与宿主植物长期共存中,产生了一系列有活性的次生代谢产物,如抗菌物质、抗肿瘤物质、抗病虫害物质等,是天然药物的重要来源。半夏(Pinellia ternata)含有丰富的内生菌菌种资源,且多株菌具有代谢抑菌活性物质的特性,在获取天然药用生物活性成分方面存在很大潜能。刘建玲等[6]从半夏的根茎叶中分离出多株内生真菌,证明了半夏内生真菌的多样性与分布差异性。黄筱钧等[7]对分离得到的半夏内生菌进行初步鉴定,对研究制备半夏益生菌制剂提供了重要的理论依据。
胞外多糖(exopolysaccharides,EPS)作为与适应、存活和功能相关生物体(植物,动物,藻类,细菌和真菌)的细胞外代谢物,具有短时间内可大量生产、易于分离和纯化等优点[8],属于无毒天然产物,是生物活性多糖替代品的首选。此外,这些多糖还具有抗氧化、降血糖、抗肿瘤等[9-11]多种药理活性,并且含有不同的反应基团,如羟基、羧基等可进行化学修饰[12],在生物材料和制药工业方面潜力巨大,是合成聚合物的绿色替代品[13-14]。EPS在结构、性能和生产方面的优势使其受到广泛关注,成为目前研究和应用较多的一类微生物多糖。目前,对EPS的研究主要集中在乳酸菌与细菌上,对于从药用植物中分离得到的内生真菌产生的胞外多糖的研究仅有些许报道,且主要集中于对胞外多糖的生物活性进行研究。如黑板树内生真菌镰刀菌SD5的胞外多糖对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)表现出显著的清除活性[15];红树林内生真菌胞外多糖具有良好的抗氧化活性[16]。但对于从药用植物中分离得到的内生真菌产生的胞外多糖的研究仅有些许报道,药用植物内生菌作为一种新型的微生物资源,具有重大的研究意义和潜在的应用价值。
因此,本研究从本实验室分离的药用植物半夏内生真菌中筛选出高产胞外多糖的菌株,通过形态学观察与分子生物学技术进行菌种鉴定;以EPS产量为评价指标,采用单因素与正交试验对菌株的发酵条件进行优化;并通过扫描电镜以及抗氧化与降血糖试验对EPS的结构与活性进行研究,以期为开发新型活性多糖、药物和功能性食品提供新的菌株来源。
1 材料与方法
1.1 材料与试剂
半夏内生真菌:42株,实验室分离并保藏;氯仿、正丁醇、苯酚、浓硫酸、无水乙醇、α-葡萄糖苷酶、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline)-6-sulfonic acid,ABTS):合肥千盛生物科技有限公司;所有试剂均为分析纯。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1 000 mL;马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:PDA培养基内不添加琼脂,高压蒸汽灭菌121 ℃、20 min。
1.2 仪器与设备
UV-1800-DS2紫外可见分光光度计:北京普析通用仪器有限责任公司;WT-3003型电子天平:杭州万特衡器有限公司;RE-3000型旋转蒸发器:上海荣亚生化仪器厂;S-3400N扫描电子显微镜:日本日立有限公司。
1.3 方法
1.3.1 粗胞外多糖的制备与提取
将菌株接种在PDA培养基中,28 ℃培养5 d后得活化菌株。挑取菌丝体于PDB培养基中,28 ℃、120 r/min条件下振荡培养5 d得种子液。将种子液按4%的接种量接种于PDB培养基中,同等条件下培养7 d得发酵液。参照YUAN P等[9]的方法进行粗胞外多糖的提取,采用苯酚-硫酸法[17]测定多糖产量,以葡萄糖含量(x)为横坐标,以波长490 nm条件下的吸光度值(y)为纵坐标,建立葡萄糖标准曲线回归方程:y=23.749x+4.107 5,相关系数R2=0.995 1。
1.3.2 高产胞外多糖菌株的筛选
高产胞外多糖菌株的初筛与复筛参考陆娟等[18]的方法。首先以菌落周围是否有粘稠分泌物为标准进行初筛,然后采用1.3.1所述的粗胞外多糖的提取方法制备初筛菌株的粗胞外多糖,通过苯酚-硫酸法测定菌株胞外多糖产量,选取胞外多糖产量最高的菌株进行后续鉴定与分析。
1.3.3 高产胞外多糖菌株的鉴定
形态学观察:采用插片法[19]培养菌株,28 ℃倒置培养96 h,每隔24 h观察并记录菌落的形态变化。将插片经草酸铵结晶紫染色后,置于载玻片上,然后在显微镜下观察并记录菌丝与孢子的形态特征。
分子生物学鉴定:菌株的分子生物学鉴定参考段鸿斌等[20]的方法。
1.3.4 高产胞外多糖菌株发酵条件优化
(1)单因素试验
为提高胞外多糖产量,在原发酵条件为28 ℃、发酵时间120 h、接种量4%、转速120 r/min的基础上,选择发酵温度,发酵时间与接种量3个因素进行单因素试验,每个因素水平设置条件如下:发酵温度为25 ℃、28 ℃、31 ℃、34 ℃、37 ℃;发酵时间为100 h、110 h、120 h、130 h、140 h;接种量为4%、6%、8%、10%、12%。
(2)正交试验
在单因素试验结果的基础上,分别选取发酵温度(A),发酵时间(B)与接种量(C)为评价因素进行3因素3水平的正交试验,试验因素与水平见表1。
表1 发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization

水平 A 发酵温度/℃ B 发酵时间/h C 接种量/%1 2 3 28 31 34 100 110 120 6 8 1 0
1.3.5 抗氧化能力测定
DPPH自由基清除能力测定:参考莫宏辉等[21]的方法;ABTS自由基清除能力测定:采用ABTS自由基清除法[22];羟基自由基清除能力测定:参考刘娜等[23]的方法。
1.3.6 抑制α-葡萄糖苷酶活性测定
采用对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenylα-D-galactopyranoside,PNPG)法[24-25]进行测定。以阿卡波糖作为阳性对照,将粗胞外多糖和阿卡波糖分别配制成质量浓度为0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL、1.2 mg/mL的样品溶液。向96孔酶标板中加入80 μL磷酸缓冲液(pH6.8),16 μL样液和16 μL α-葡萄糖苷酶溶液(0.2 U/mL),37 ℃反应15 min;加入16 μL浓度为2.5 mmol/L的PNPG溶液,37 ℃反应30 min;最后加入100 μL浓度为1.0 mol/L的Na2CO3溶液终止反应,用酶标仪测定波长405 nm处的吸光度值。按下式计算α-葡萄糖苷酶抑制率。
式中:A0为磷酸缓冲溶液代替样品吸光度值;Ai为样品吸光度值;Aj为磷酸缓冲溶液代替α-葡萄糖苷酶溶液的吸光度值。
1.3.7 表面形态观察
将样品固定在导电胶上,镀金后,利用扫描电镜(scanning electron microscopy,SEM)在电压为10 kV,放大倍数为×5 000和×10 000条件下,观察EPS的表面结构。
1.3.8 数据分析
每组试验重复3次,分别使用SPSS 26.0、Origin2018进行数据分析与绘图。
2 结果与分析
2.1 高产胞外多糖菌株筛选
对42株内生真菌进行初筛,得到7株粘稠拉丝的菌株,表明其可能分泌粘性多糖,测定7株菌株的EPS产量,结果见图1。由图1可知,菌株BX-2产胞外多糖产量最高,为6.14 mg/mL,明显高于其他菌株。因此,选择菌株BX-2进行后续试验。
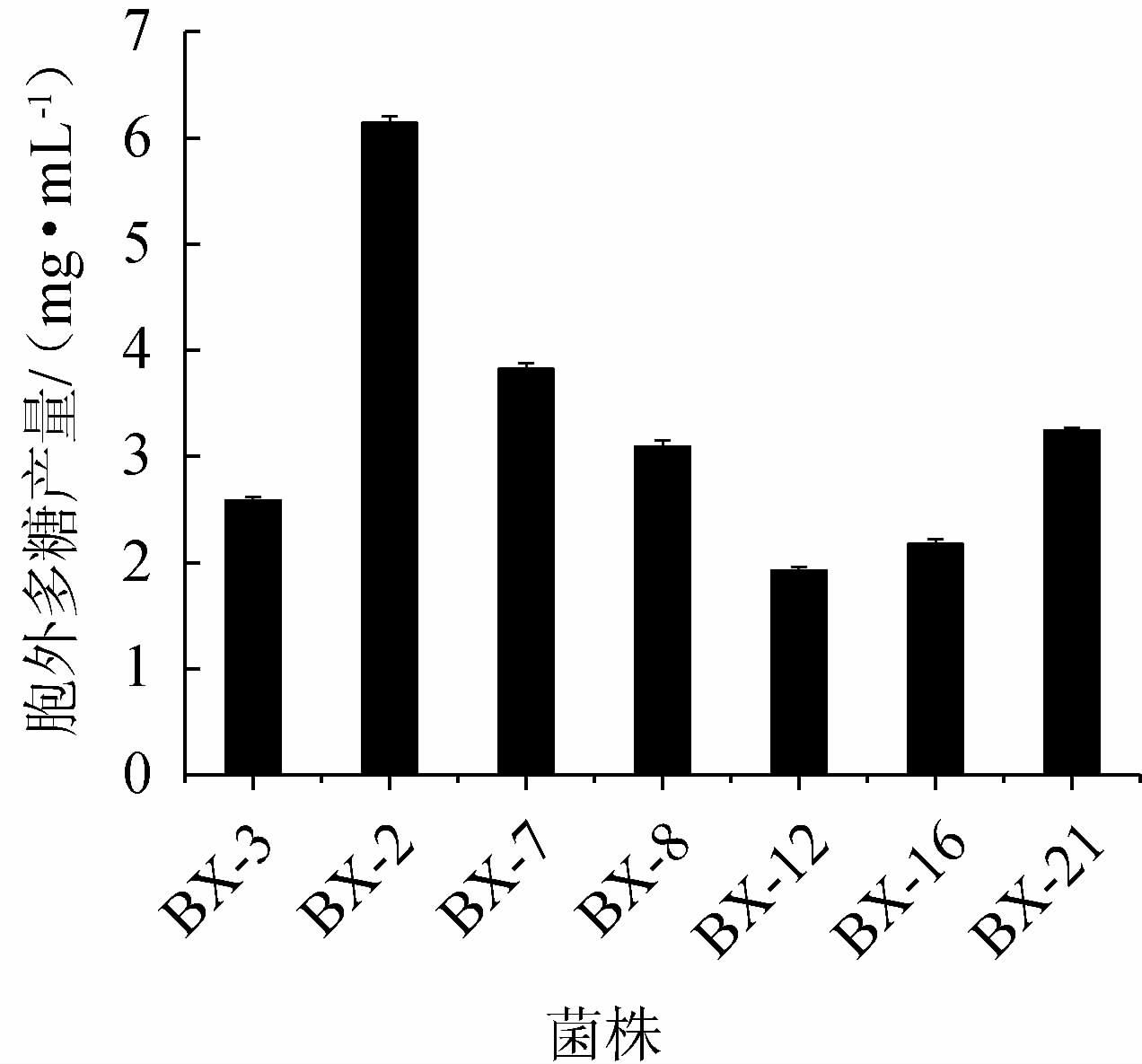
图1 复筛菌株的胞外多糖产量
Fig.1 Exopolysaccharides production of re-screened strains
2.2 菌株BX-2的鉴定
2.2.1 形态学观察
菌株BX-2的菌落形态与孢子形态见图2。由图2可知,其菌丝发达,边缘偏乳白色,内部呈黄色,且有淡黄色色素沉积,可能是内生菌分泌的次级代谢产物。光学显微镜下,菌株BX-2的孢子呈长椭状,簇生或单生,排列较为规整,大小为(7.5~12.1)×(2.8~4.7)μm。根据菌落形态与显微观察,并结合《真菌鉴定手册》进行比对,初步判断该菌株是曲霉属(Aspergillus sp.)真菌。
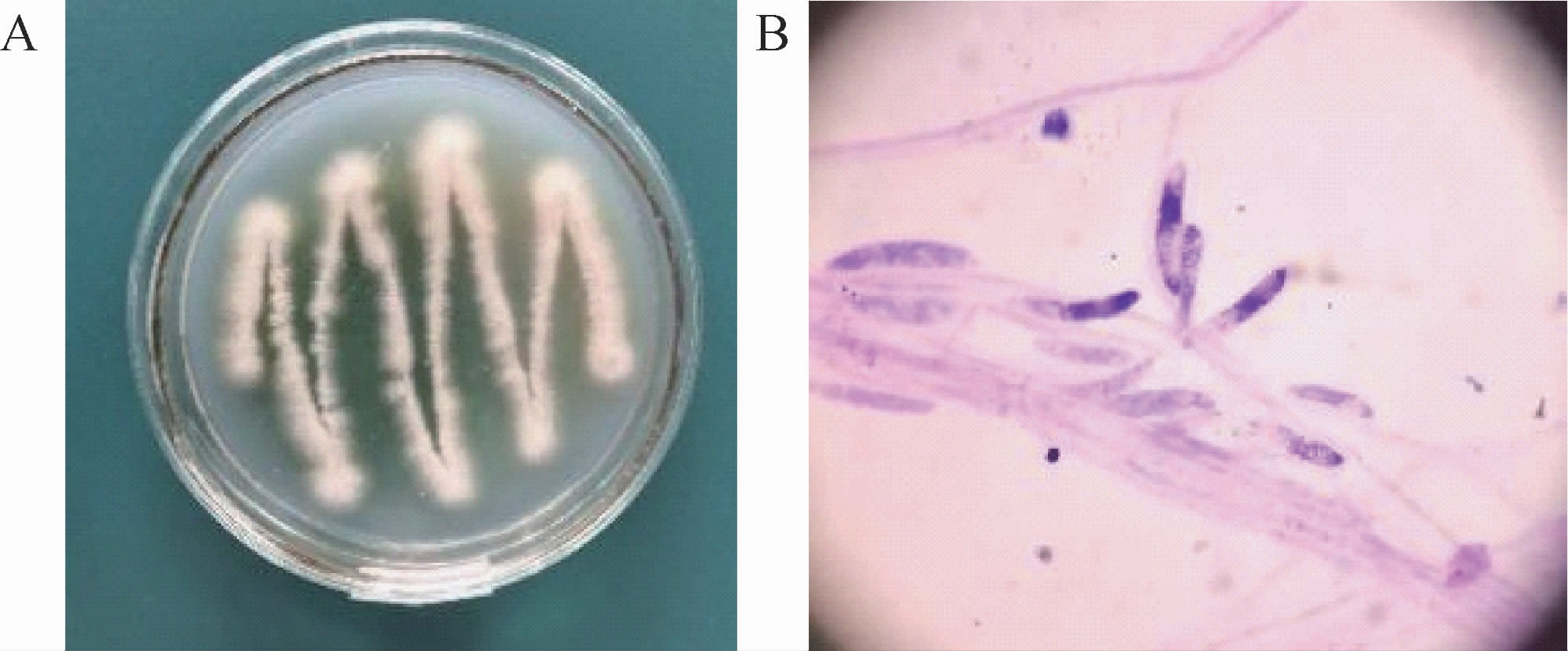
图2 菌株BX-2的菌落形态(A)与孢子形态(B)
Fig.2 Colony morphology(A)and spore morphology(A)of strain BX-2
2.2.2 分子生物学鉴定
对来自菌株BX-2的16S rDNA基因片段进行测序,并存放在美国国家生物技术信息中心(national center for biotechnologyinformation,NCBI)的GenBank数据库中。在MEGA 5.0软件中使用具有1 000个自举重复的邻居连接方法构建了具有该序列的系统发育树[26],结果见图3。由图3可知,菌株BX-2序列与土曲霉(Aspergillus terreus)MT558939.1序列之间的遗传距离值较小,同源性>99%,亲缘关系最近。结合其形态观察和分子生物学鉴定结果,最终鉴定菌株BX-2为土曲霉(Aspergillus terreus)。

图3 基于16S rDNA基因序列菌株BX-2的系统发育树
Fig.3 Phylogenetic tree of strain BX-2 based on 16S rDNA gene sequence
2.3 发酵条件优化单因素试验结果与分析
2.3.1 发酵温度对菌株BX-2胞外多糖产量的影响
真菌细胞内的酶活力受温度的影响,进而影响体内的生长与代谢,在一定温度范围内,酶活力随着温度的升高先增加后降低[27],结果见图4。
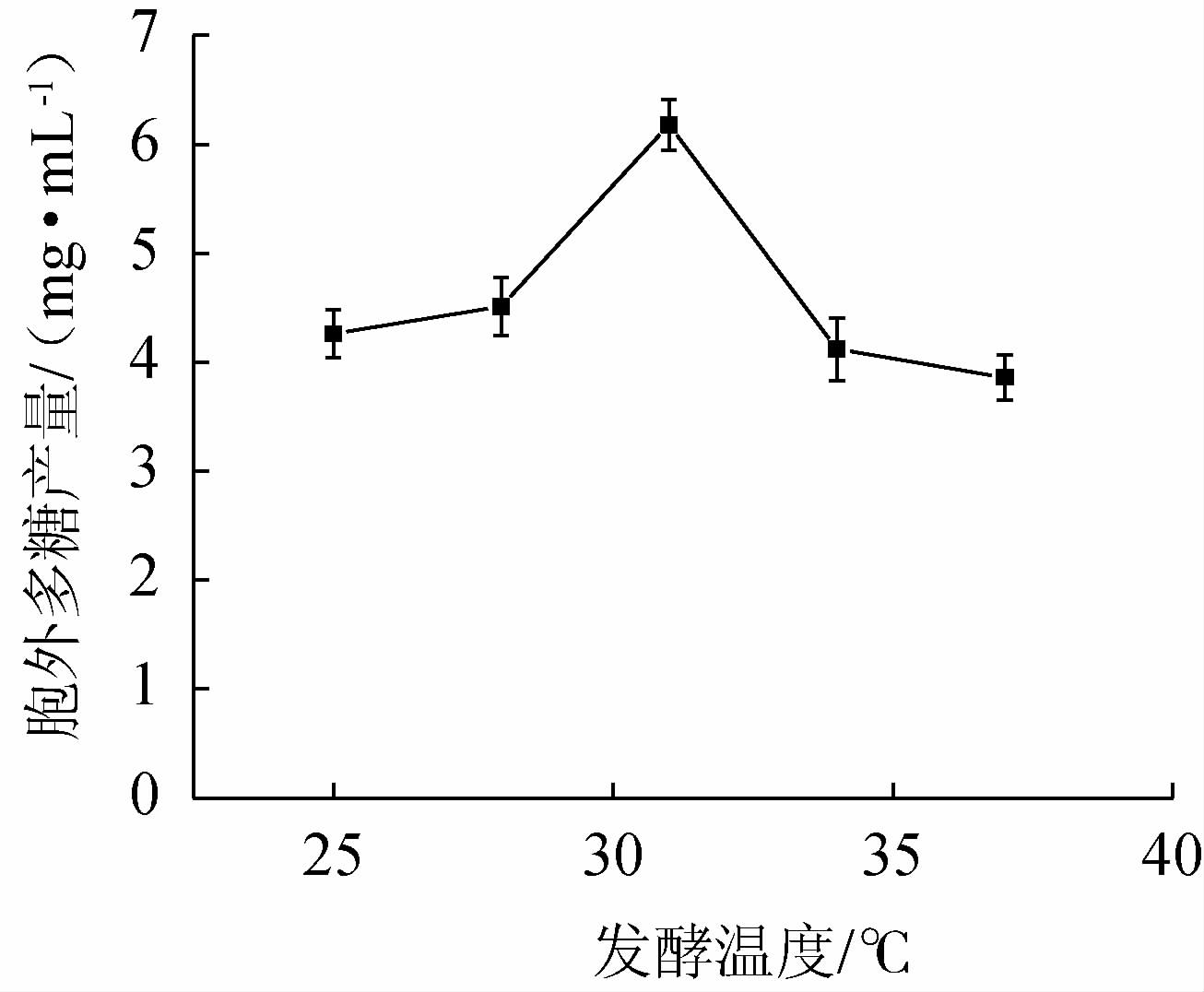
图4 发酵温度对菌株BX-2胞外多糖产量的影响
Fig.4 Effect of fermentation temperature on exopolysaccharides production of strain BX-2
由图4可知,在发酵温度25~31 ℃时,EPS产量随着发酵温度的上升而增加,在发酵温度31 ℃时达到最高水平,为6.18 mg/mL,当发酵温度超过31 ℃时,EPS产量急剧下降,可能是因为酶活力降低导致胞外多糖产量下降。综上,选取发酵温度28 ℃、31 ℃、34 ℃进行正交试验。
2.3.2 发酵时间对菌株BX-2胞外多糖产量的影响
不同发酵时间对菌株BX-2胞外多糖产量的影响见图5。
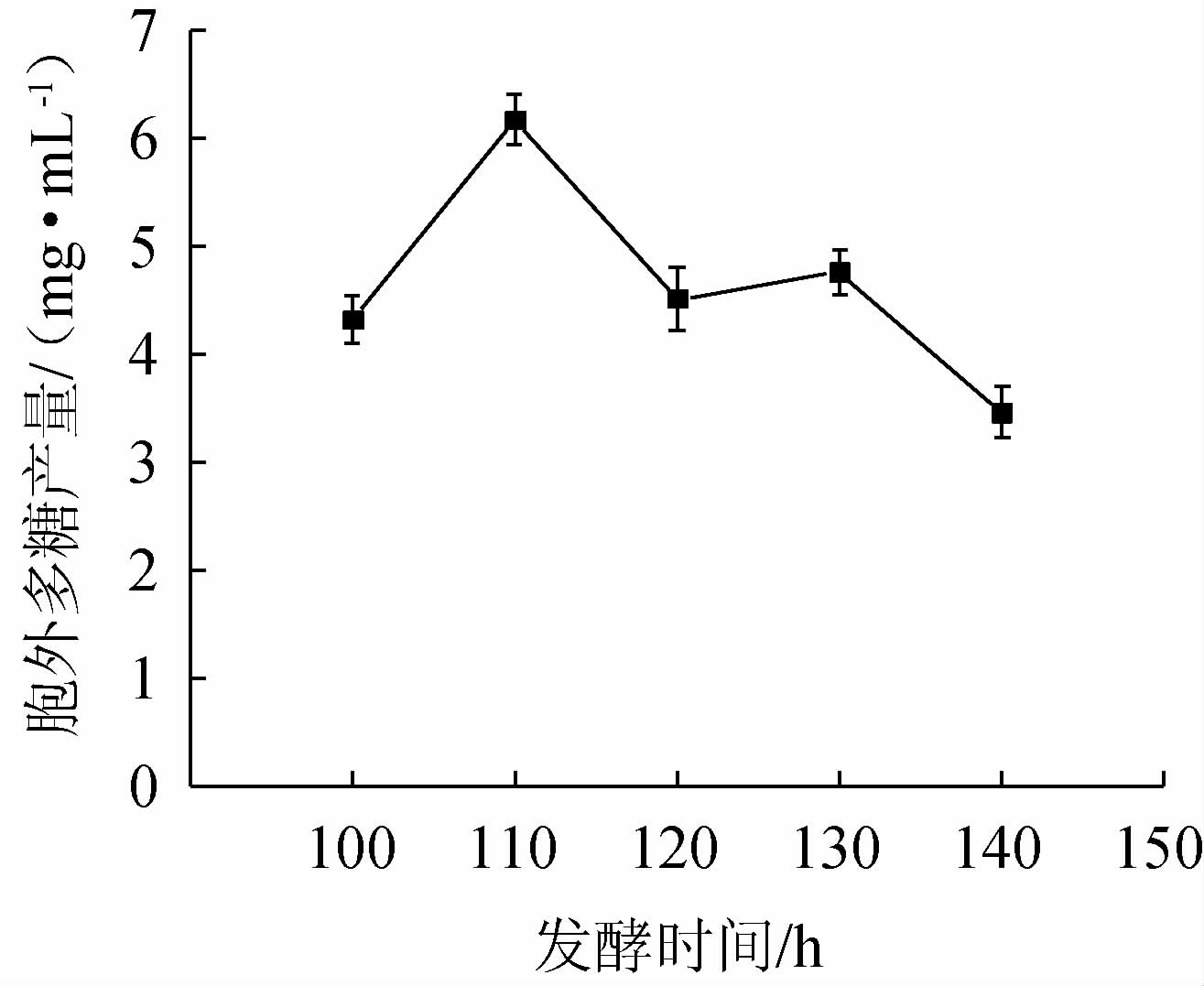
图5 发酵时间对菌株BX-2胞外多糖产量的影响
Fig.5 Effect of fermentation time on exopolysaccharides production of strain BX-2
由图5可知,当发酵时间为110 h时,EPS产量最高,随着发酵时间的延长,EPS产量呈阶梯状减少,可能是由于发酵后期营养物质消耗和菌体产生降解多糖的酶[28],这与IBRAHIM S等[29]的研究结果相一致。综上,选取发酵时间100 h、110 h、120 h进行正交试验。
2.3.3 接种量对菌株BX-2胞外多糖产量的影响
接种量对菌株BX-2胞外多糖产量的影响见图6。
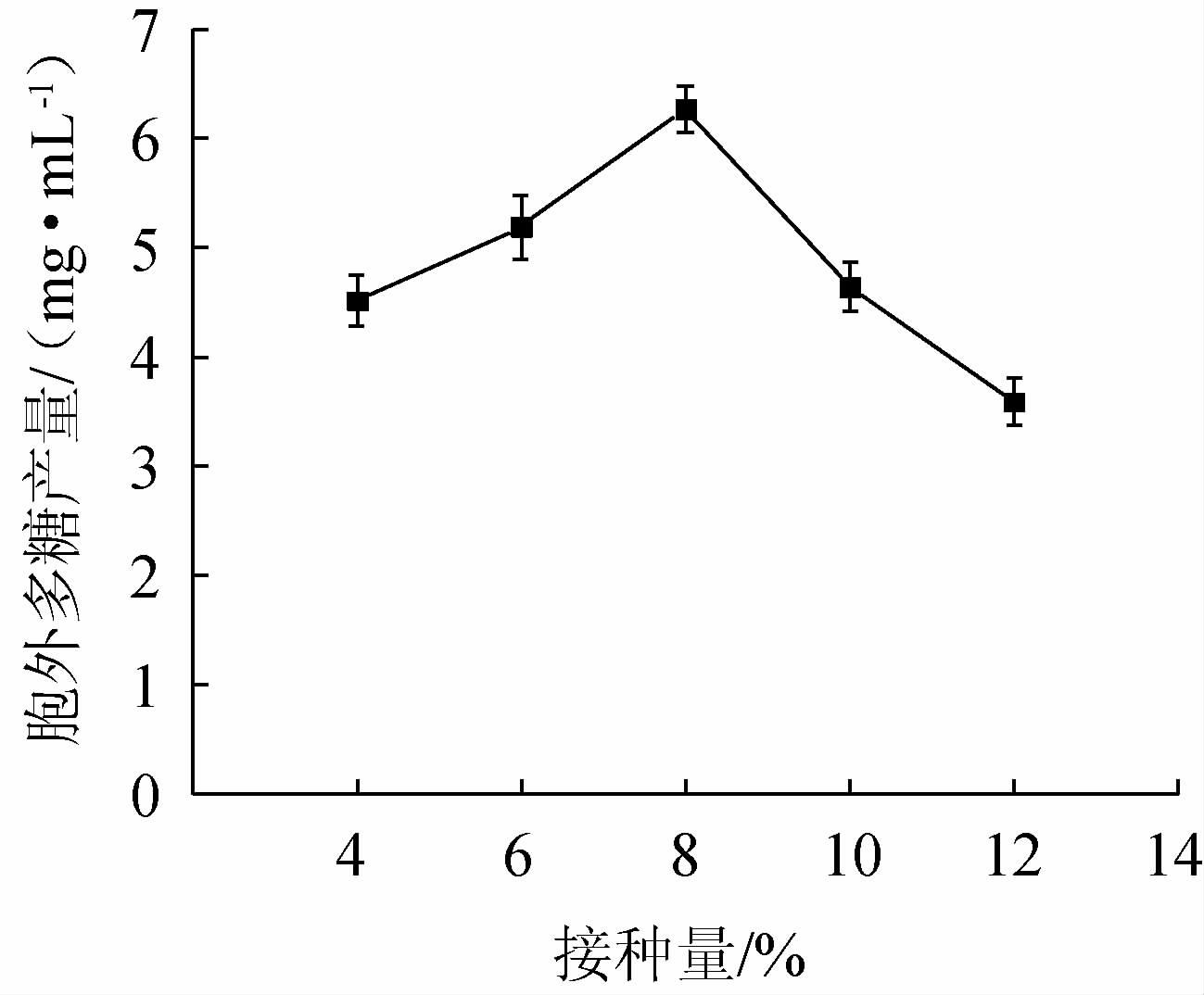
图6 接种量对菌株BX-2胞外多糖产量的影响
Fig.6 Effect of inoculum on exopolysaccharides production of strain BX-2
由图6可知,其对菌株BX-2的胞外多糖产量影响较大。EPS产量在接种量为4%~8%内稳步增加,在8%达到最高水平,为6.27 mg/mL,然后逐渐下降,当接种量为12%时,EPS产量最低,仅为3.59 mg/mL。可能是由于接种量过少时,菌种数量太少,EPS产量被限制;而接种量的增加又会使碳源过早被消耗,无法维持菌株丰富的营养,菌体过早进入衰亡期,发酵能力下降,从而影响菌株的EPS产量[30]。综上,选取接种量6%、8%、10%进行正交试验。
2.4 发酵条件优化正交试验结果与分析
以发酵温度(A)、发酵时间(B)、接种量(C)为评价因素,以菌株的EPS产量为评价指标,进行正交试验,所得正交试验设计及结果,试验结果及方差分析见表2和表3。
表2 发酵条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for fermentation conditions optimization
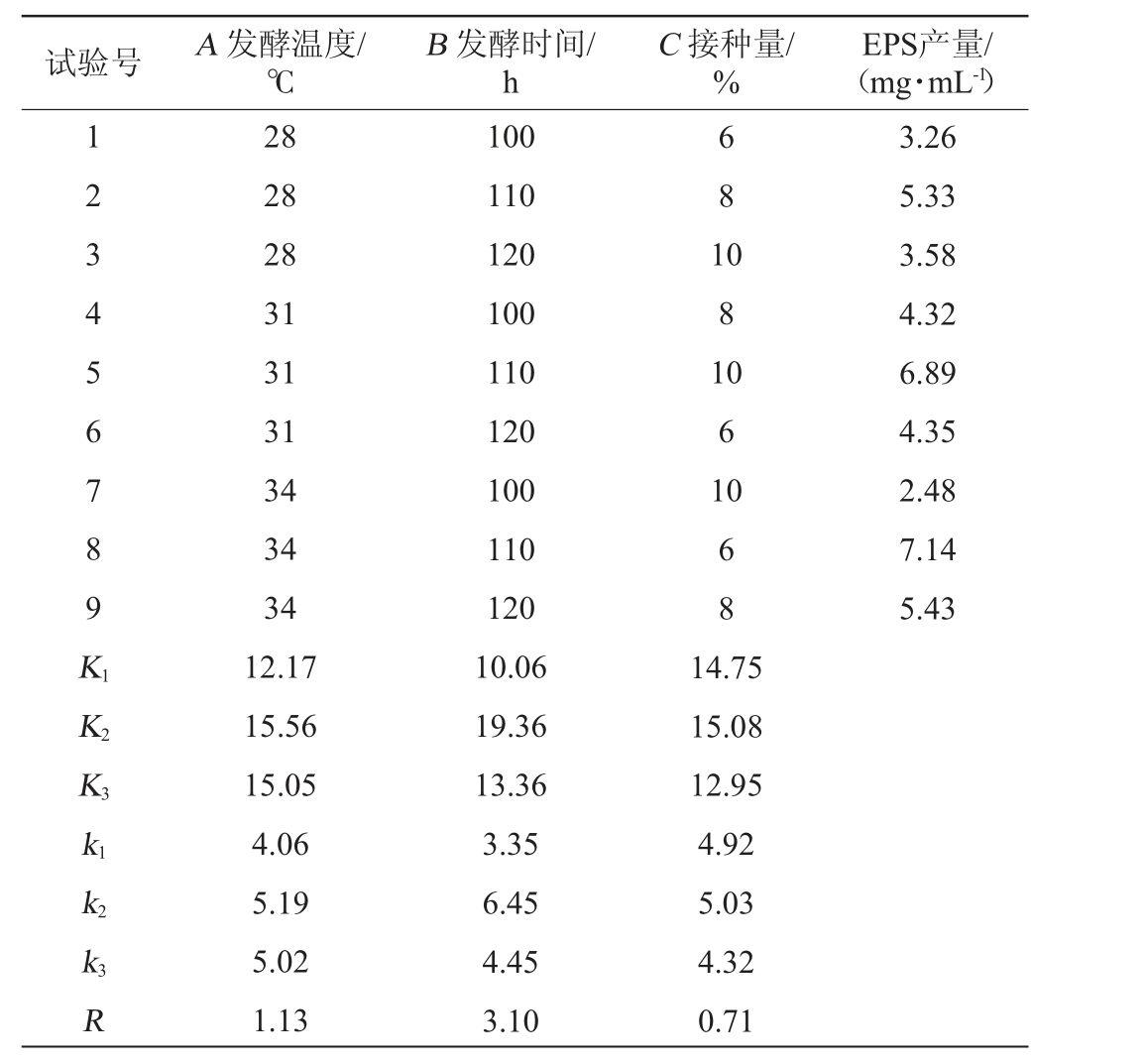
试验号 A 发酵温度/℃B 发酵时间/h C 接种量/%EPS产量/(mg·mL-1)1 2 3 4 5 6 7 8 9 K1 6 8 1 0 8 1 0 6 1 0 6 8 3.26 5.33 3.58 4.32 6.89 4.35 2.48 7.14 5.43 K2 K3 k1 k2 k3R 28 28 28 31 31 31 34 34 34 12.17 15.56 15.05 4.06 5.19 5.02 1.13 100 110 120 100 110 120 100 110 120 10.06 19.36 13.36 3.35 6.45 4.45 3.10 14.75 15.08 12.95 4.92 5.03 4.32 0.71
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results
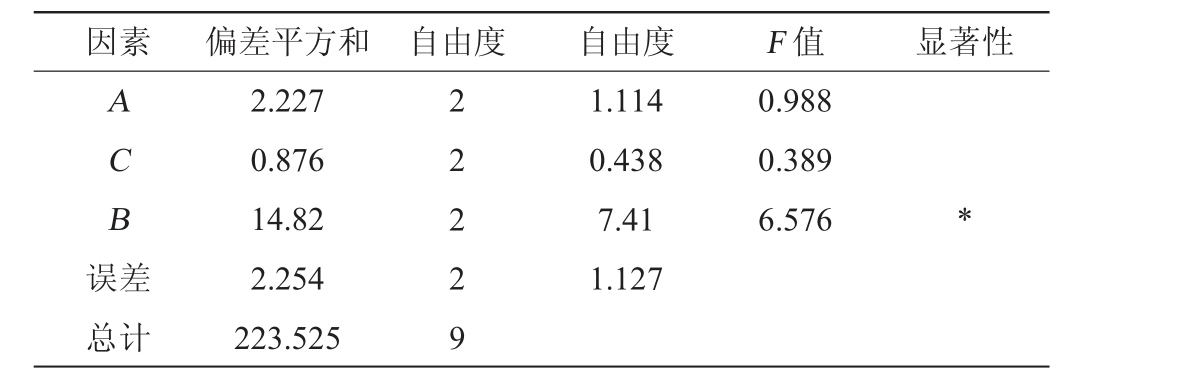
注:“*”表示对结果影响显著(P<0.05)。
因素 偏差平方和 自由度 自由度 F 值 显著性ACB误差1.114 0.438 7.41 1.127 0.988 0.389 6.576 *总计2.227 0.876 14.82 2.254 223.525 2 2 2 2 9
由表2和表3可知,影响EPS产量的主次因素为:发酵时间(B)>发酵温度(A)>接种量(C),其中发酵时间对结果影响显著(P<0.05)。高产胞外多糖菌株BX-2产EPS的最佳发酵条件为A2B2C2,即发酵温度31 ℃、发酵时间110 h、接种量8%。按上述发酵条件进行3次重复验证试验,最终EPS产量为7.38 mg/mL,相较于优化前提高了63.64%。
2.5 抗氧化试验结果与分析
不同质量浓度菌株BX-2胞外多糖与维生素C对3种自由基的清除率测定结果见图7。
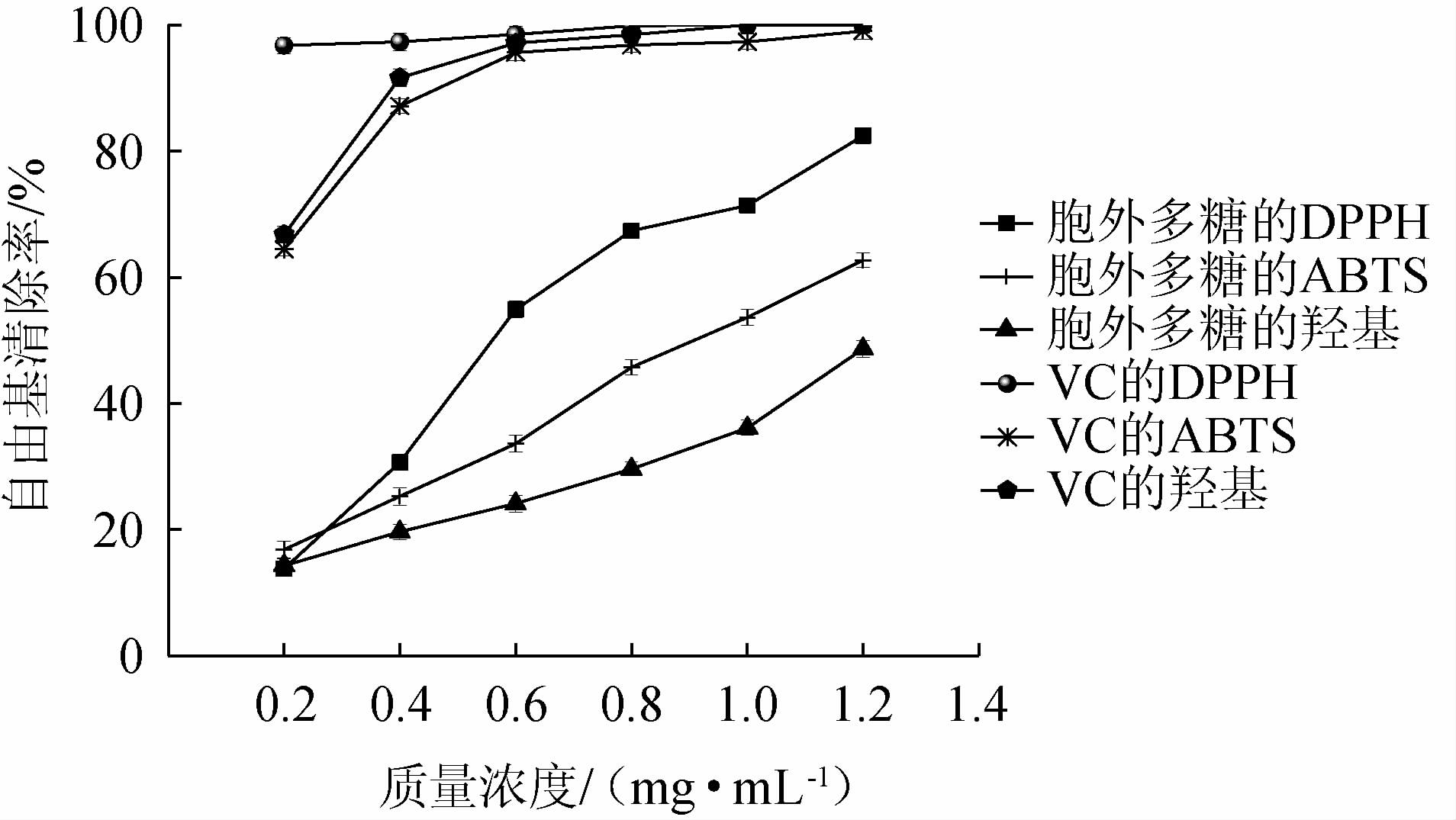
图7 菌株BX-2胞外多糖的抗氧化能力
Fig.7 Antioxidant capacity of exopolysaccharides of strain BX-2
由图7可知,虽然总体而言菌株BX-2胞外多糖的清除率远小于VC,但均具有一定的清除能力,其清除作用均随着质量浓度的增加而逐渐增强。当菌株BX-2胞外多糖质量浓度<0.4 mg/mL时,其对3种自由基的清除作用相差较小,随着质量浓度不断上升,它对DPPH、ABTS自由基的清除作用随之急剧上升,而对于羟基自由基的清除作用的增长则相对缓慢。其中,菌株BX-2胞外多糖对DPPH自由基的清除作用最强,对ABTS自由基的清除作用次之,羟基自由基最弱;当菌株BX-2胞外多糖质量浓度为1.2 mg/mL时,其对DPPH、ABTS、羟基自由基的清除率分别为82.43%、62.71%、48.63%,相较于叶兆伟等[31]所测DPPH和羟基自由基清除率数据更高,这可能与环境等因素有关。BX-2胞外多糖对DPPH、ABTS、羟基3种自由基清除作用的IC50分别为0.565 mg/mL、0.895 mg/mL、1.677 mg/mL,它对DPPH与ABTS两种自由基具有一定的清除能力。
2.6 抑制α-葡萄糖苷酶活性结果与分析
不同质量浓度菌株BX-2胞外多糖与阿卡波糖对α-葡萄糖苷酶的抑制率结果见图8。
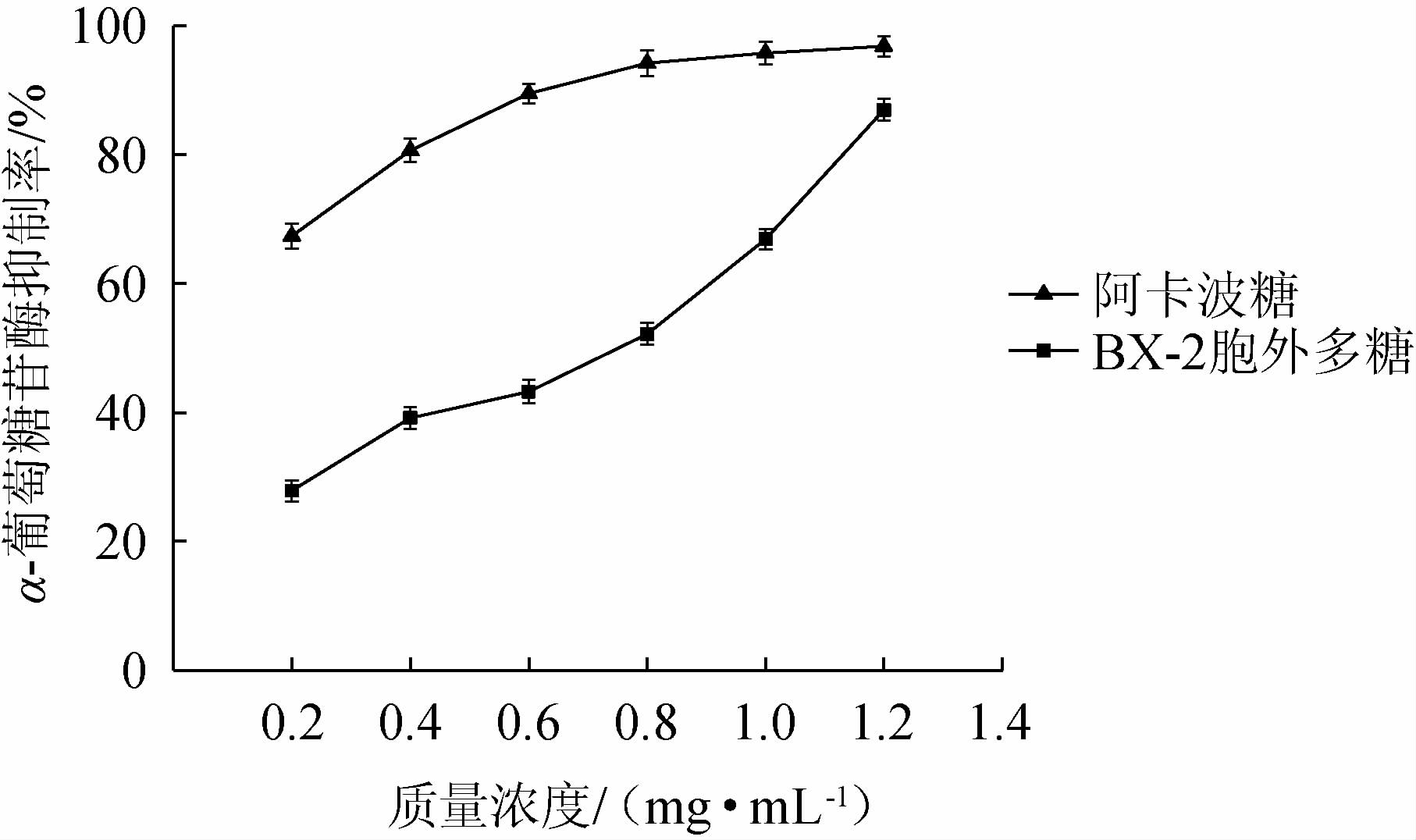
图8 菌株BX-2胞外多糖对α-葡萄糖苷酶的抑制率
Fig.8 Inhibition rate of α-glucosidase by exopolysaccharides of strain BX-2
由图8可知,在0.2~1.2 mg/mL的质量浓度范围内,菌株BX-2胞外多糖对α-葡萄糖苷酶的抑制率与浓度呈正相关。当菌株BX-2胞外多糖的质量浓度为1.2 mg/mL时,其抑制率达到86.96%,此时阿卡波糖的抑制率为96.84%,二者相差小于10%;菌株BX-2胞外多糖抑制α-葡萄糖苷酶的IC50为0.553 mg/mL,这说明菌株BX-2产的胞外多糖具有良好的体外降血糖能力。
2.7 扫描电镜结果
对菌株BX-2胞外多糖进行表面微观形貌观察的电镜图见图9。由图9a可以观察到BX-2胞外多糖表面存在明显的断裂;扫描电镜的原理是电子成像,亮的区域高,暗的区域低,图9b中所呈样品图像亮度相差不大,说明BX-2胞外多糖的厚度相对均一。

图9 菌株BX-2胞外多糖的扫描电镜观察结果
Fig.9 Scanning electron microscope observation results of exopolysaccharides of strain BX-2
3 结论
本研究从42株半夏内生真菌中筛选出1株高产胞外多糖菌株BX-2。基于形态学观察与分子生物学鉴定其为土曲霉(Aspergillus terreus)。由单因素试验与正交试验得到菌株BX-2的最佳发酵条件为发酵温度31 ℃、发酵时间110 h、接种量8%。此条件下菌株BX-2的EPS产量为7.38 mg/mL,相较于优化前提高了63.64%。体外抗氧化与降血糖试验表明,菌株BX-2胞外多糖具有良好的抗氧化与体外降血糖能力。本研究丰富了产胞外多糖内生菌的来源,为利用菌株BX-2生产胞外多糖作为天然抗氧化剂、降血糖剂提供了试验基础。
[1]王歆彤,李朋月,吴兰芳,等.知母多糖复合酶提取工艺优化及其免疫活性[J].食品工业科技,2022,43(11):218-227.
[2]LI W,HU X,WANG S,et al.Characterization and anti-tumor bioactivity of astragalus polysaccharides by immunomodulation[J].Int J Biol Macromol,2020,145(15):985-997.
[3] MENG Y, ZHANG H, HU N, et al.Construction of silver nanoparticles by the triple helical polysaccharide from black fungus and the antibacterial activities[J].Int J Biol Macromol,2021,182(1):1170-1178.
[4]RODRIGUEZ-CARMONA E,VILLAVERDE A.Nanostructured bacterial materials for innovative medicines[J].Trends Microbiol, 2010, 18(9):423-430.
[5]KARANA E,BLAUWHOFF D,HULYINK E J,et al.When the material grows:a case study on designing(with)mycelium-based materials[J].Int J Des,2018,12(2):119-136.
[6]刘建玲,陈宝宝,刘永红,等.半夏内生菌的分离与初步鉴定[J].中国中药杂志,2009,34(18):2305-2307.
[7]黄筱钧,唐由凯,杜银香,等.半夏内生菌的分离培养与鉴定[J].湖北民族学院学报(医学版),2010,27(4):20-22.
[8]ROBYT J F.Essentials of carbohydrate chemistry[M].Berlin: Springer,1998.
[9]YUAN P,FANG F,SHAO T,et al.Structure and anti-tumor activities of exopolysaccharides from Alternaria mali roberts[J].Molecules,2019,24(7):1345.
[10]李兴恺,张耀根,姚皓昱,等.毛韧革菌胞外多糖的结构表征、抗氧化活性研究及发酵条件优化[J].食品与发酵工业,2022,48(21):36-41.
[11]YU Z,SUN Q,LIU J,et al.Polysaccharide from Rhizopus nigricans inhibits the invasion and metastasis of colorectal cancer[J].Biomed Pharmacother,2018,103:738-745.
[12]HAMIDI M,OKORO O V,MILAN P B,et al.Fungal exopolysaccharides:Properties,sources,modifications,and biomedical applications[J].Carbohydr Polym,2022,284:119152.
[13]MEHTA K,SHUKLA A,SARAF M.Articulating the exuberant intricacies of bacterial exopolysaccharides to purge environmental pollutants[J].Heliyon,2021,7(11):e08446.
[14] ANDREW M, JAYARAMAN G.Structural features of microbial exopolysaccharides in relation to their antioxidant activity[J].Carbohydr Res,2020,487:107881.
[15]MAHAPATRA S,BANERJEE D.Evaluation of in vitro antioxidant potency of exopolysaccharide from endophytic Fusarium solani SD5[J].Int J Biol Macromol,2013,53:62-66.
[16]CHEN Y L,MAO W J,TAO H W,et al.Preparation and characterization of a novel extracellular polysaccharide with antioxidant activity,from the mangrove-associated fungus Fusarium oxysporum[J].Mar Biotechnol,2015,17(2):219-228.
[17]蔡月琴,刘艺敏,凡莉莉,等.响应面法优化巴戟天多糖提取工艺[J].森林与环境学报,2019,39(3):303-309.
[18]陆娟,周慧,王贵生,等.一株胞外多糖产生菌的筛选鉴定及其多糖成分研究[J].天然产物研究与开发,2020,32(9):1484-1490,1528.
[19]王维.半夏内生菌的分离及其内生真菌对宿主生长影响的研究[D].杨凌:西北农林科技大学,2010.
[20]段鸿斌,杨立军,罗伟,等.一株铁线蕨内生真菌tg-1的分离鉴定及其生物活性研究[J].信阳师范学院学报(自然科学版),2022,35(4):543-548.
[21]莫宏辉,邓国卫,李珊.牛大力叶中总多糖、总黄酮、总皂苷含量及其抗氧化活性的研究[J].湖北农业科学,2021,60(19):88-91,94.
[22]赵丹,曹慧莹,孙梦,等.假肠膜明串珠菌HDL-3胞外多糖的分离纯化及结构性质分析[J].食品工业科技,2022,43(21):115-122.
[23]刘娜,范明君,安晓萍,等.灵芝发酵麸皮粗多糖的组成及抗氧化活性分析[J].食品工业科技,2022,43(20):45-50.
[24] GHANUI U, NUR-E-ALAM M, YOUSAF M, et al.Natural flavonoid α-glucosidase inhibitors from Retama raetam: Enzyme inhibition and molecular docking reveal important interactions with the enzyme active site[J].Bioorg Chem,2019,87:736-742.
[25]华露霞.天然β-葡萄糖醛酸苷酶抑制剂的筛选及构效关系研究[D].杭州:浙江工业大学,2020.
[26] YUN T Y, FENG R J, ZHOU D B, et al.Optimization of fermentation conditions through response surface methodology for enhanced antibacterial metabolite production by Streptomyces sp.1-14 from cassava rhizosphere[J].PLoS One,2018,13(11):e0206497.
[27]JING K Y,WEN Q W,JIAN Y W.Recent advances in Cordyceps sinensis polysaccharides: Mycelial fermentation, isolation, structure, and bioactivities:A review[J].J Funct Food,2014,6:33-47.
[28]张文平,赵英杰,罗晟,等.高产胞外多糖植物乳杆菌筛选及其发酵工艺优化[J].食品与发酵工业,2019,45(21):38-45.
[29] IBRAHIM S, BANKEEREE W, PRASONGSUK S, et al.Production and characterization of thermostable acidophilic β-mannanase from Aureobasidium pullulans NRRL 58524 and its potential in mannooligosaccharide production from spent coffee ground galactomannan[J].3 Biotech,2022,12(9):237.
[30]王夫杰,赵金杨,张金兰,等.响应面法优化食用菌农平1号固态发酵豆渣的条件[J].食品科学,2015,36(9):89-96.
[31]叶兆伟,叶润,赫丁轩,等.息半夏多糖提取工艺优化及其抗氧化活性研究[J].中国食品添加剂,2022,33(1):90-98.