传统白酒发酵是我国非常重要的工业领域,其中浓香型白酒作为最畅销的白酒,约占中国白酒总消费量的70%。而窖池作为发酵容器,在浓香型白酒生产中起着十分关键的作用。窖池内部覆盖着一种被称为窖泥的特定发酵粘土,蕴含着丰富的酿酒功能微生物,包括芽孢杆菌属(Bacillus)和甲烷杆菌属(Methanobacterium)等,这些微生物都是发酵过程的关键介质,也是浓香型白酒特有的芳香化合物的来源[1]。而优质的窖泥一般需要土壤微生物在窖池中经过多年发酵才能形成,其中一些知名的浓香型白酒企业,如五粮液、泸州老窖等,其窖泥已经使用了上百年[2],且其对窖泥的养护非常重视。鉴于窖泥的重要性,目前大量的研究集中在窖泥微生物群落鉴定及分析方向[3-7],以此探究窖泥微生物对白酒生产过程的贡献机制。
然而,自然形成的优质窖泥的量与行业发展的需求不均衡,且人工窖泥在浓香型白酒生产中的应用非常广泛[8-10]。人工窖泥通常以接种培养为主,将富含大量微生物的优质老窖泥或者从老窖泥中分离出的复合菌液与新鲜土壤、水进行混合,在厌氧容器中发酵结束后取出使用[11]。发酵完成的人工窖泥被用于新窖的发酵,可以在短时间内成功培养出生产浓香型白酒的有益微生物群落,从而提高浓香型白酒的质量[12]。但人工窖泥在使用过程中会老化,老化人工窖泥最明显的特点是形成大量由结晶乳酸钙和乳酸亚铁组成的白色团聚体[12-13]。目前,大多数白酒企业对人工窖泥的需求都非常大,因此大量的研究主要聚焦于优质人工窖泥的培养方法上[14-15],但对人工窖泥中微生物群落变化的研究却鲜有报道。
利用传统的分离法研究窖泥微生物局限性较大,少数研究采用聚合酶链反应(polymerase chain reaction,PCR)-变性梯度凝胶电泳和定量聚合酶链式反应检测相结合的方法研究窖泥中微生物群落的差异[16]。但高通量测序技术是目前研究窖泥微生物使用最广泛的方法,它能够同时对大量的脱氧核糖核酸(deoxyribonucleic acid,DNA)样品进行分析,具有高通量、高准确性等特点,还可以全面的揭示窖泥微生物群落的变化信息[17-18]。
金徽酒股份有限公司位于甘肃省陇南徽县境内,气候温暖湿润,地处北亚热带湿润气候向北暖温带过渡区,这种独特的气候环境使得大量微生物可以被富集[19],且其传承400多年低温入窖、低温发酵、低温蒸馏的独特工艺,年份悠久的窖泥拥有丰富的微生物[20-21],其窖池有着“西北浓香第一窖”之称,但对于人工窖泥的研究起步较晚。因此,本研究基于高通量测序技术对金徽酒股份有限公司培养的成熟人工窖泥进行了详细的微生物菌群分析,通过与优质老窖泥微生物菌群进行对比,揭示人工窖泥和老窖泥微生物菌群差异,探究窖泥快速老熟机制。
1 材料和方法
1.1 材料与试剂
1.1.1 窖泥样品
以五点取样法采集甘肃省金徽酒厂窖龄30年以上的优质老窖泥以及成熟人工窖泥。将样品置于密封袋中,取样完成后快速将所取样品保存在-20 ℃冰箱中备用。将优质老窖泥样品标记为JH01、JH02、JH03和JH04,人工窖泥样品标记为APM1、APM2、APM3和APM4。
1.1.2 试剂
PowerSoil DNA分离试剂盒:美国MoBio实验室;BIOWEST西班牙琼脂糖:上海联硕宝为生物科技有限公司;AxyPrep DNA Gel Extraction Kit试剂盒:美国Axygen Biosciences公司;NEXTFLEX Rapid DNA-Seq Kit建库试剂盒:美国Bioo Scientific公司;MiSeq Reagent Kit测序试剂盒v3:美国llumina公司。
1.2 仪器与设备
5424R高温台式冷冻离心机:德国Eppendorf公司;TL-48R粉碎研磨仪:上海万柏生物科技有限公司;QL-901旋涡混合器:海门其林贝尔仪器制造有限公司;NanoDrop2000超微量分光光度计:美国Thermo Fisher Scientific公司;QuantusTM Fluorometer微型荧光计:美国Promega公司;DYY-6C电泳仪:北京市六一仪器厂;GeneAmpR9700型PCR仪:美国ABI公司。
1.3 方法
1.3.1 DNA提取和PCR扩增
根据PowerSoil DNA分离试剂盒说明书进行窖泥样品微生物群落总DNA提取,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用超微量分光光度计测定DNA 浓度和纯度;使用引物对357F和806R对16S rRNA基因V3-V4可变区进行PCR扩增[22-23]。PCR扩增程序:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存。PCR扩增体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mmol/L 脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,双蒸水(ddH2O)补足至20 μL。
1.3.2 Illumina Miseq测序
将同一窖泥样品的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit试剂盒进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用微型荧光计对回收产物进行检测定量。使用建库试剂盒进行建库。利用Illumina公司的Miseq PE250平台交由苏州态和生物科技有限公司进行测序。
1.3.3 数据分析
测序得到的PE reads首先根据barcode区分每个样本,而后对序列质量进行质控和过滤,再根据overlap关系进行拼接,拼接后的序列再次进行质控和过滤,最后得到优化序列。优化序列进行操作分类单元(operational taxonomic units,OTU)聚类分析和物种分类学分析,基于OTU聚类分析结果,对窖泥样品的OTU进行Alpha多样性指数分析,使用SPSS 20.0进行数据差异性分析,并使用R软件进行绘图。
2 结果与分析
2.1 测序结果统计
通过Illumina MiSeq PE250测序平台对收集到的窖泥样品进行测序,分析人工窖泥和优质老窖泥中的细菌群落,结果见表1。
表1 窖泥样品测序序列信息统计
Table 1 Statistics of sequencing information of pit mud samples
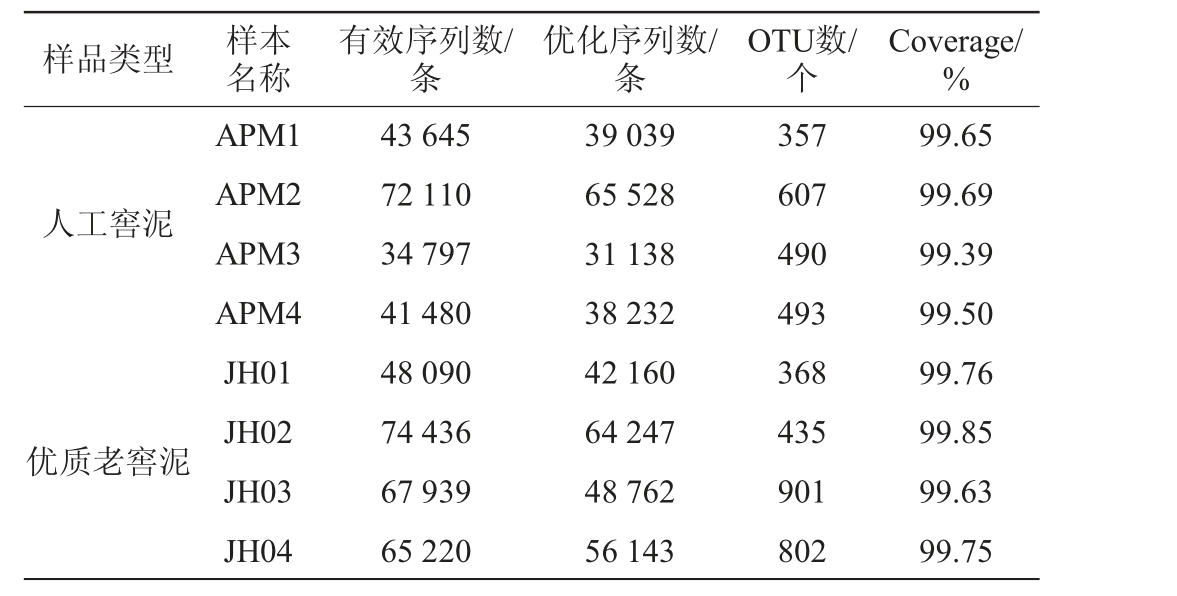
样品类型 样本名称有效序列数/条优化序列数/条OTU数/个Coverage/%人工窖泥优质老窖泥APM1 APM2 APM3 APM4 JH01 JH02 JH03 JH04 43 645 72 110 34 797 41 480 48 090 74 436 67 939 65 220 39 039 65 528 31 138 38 232 42 160 64 247 48 762 56 143 357 607 490 493 368 435 901 802 99.65 99.69 99.39 99.50 99.76 99.85 99.63 99.75
由表1可知,8个窖泥样品共获得447 717个有效序列;基于16S rRNA序列97%的同源性对优化序列进行分组,共获得385 249个有效序列;每个窖泥样品包含31 138~65 528条序列数,序列平均长度为410 bp;各个窖泥样品的优化序列长度分布在222~449 bp;共得到4 453个OTU,各样本的OTU分布介于357~901之间。每个样品的测序深度指数均大于99%,表明测序深度基本覆盖到每个窖泥样品中的所有物种,即测序序列可以代表每个窖泥样品的微生物菌群组成。
2.2 老窖泥和人工窖泥细菌菌群Alpha多样性分析
Alpha多样性是目前微生物多样性研究中的主流分析方法,其主要用来分析局域生境下物种的多样性程度[24]。比较不同样本的α多样性指数可以看出不同样本的多样性差异[25]。Alpha多样性指数主要包括:Chao1指数、ACE指数、Shannon指数、Simpson指数等。其中,Chao1指数和ACE指数代表群落中物种的数量,而不考虑群落中每个物种的丰度情况;其指数值越大,表明样品中丰富度越高。而Shannon指数以及Simpson指数反映群落的多样性,在相同物种丰富度的情况下,群落中物种均匀度越大,其多样性越高。Shannon指数越大、Simpson指数越小,表明样品中微生物群落多样性高[26]。本研究选择Chao1指数、ACE指数、Shannon指数和Simpson指数作为多样性指标,比较人工窖泥和优质老窖泥细菌群落多样性之间的差异,结果见图1。
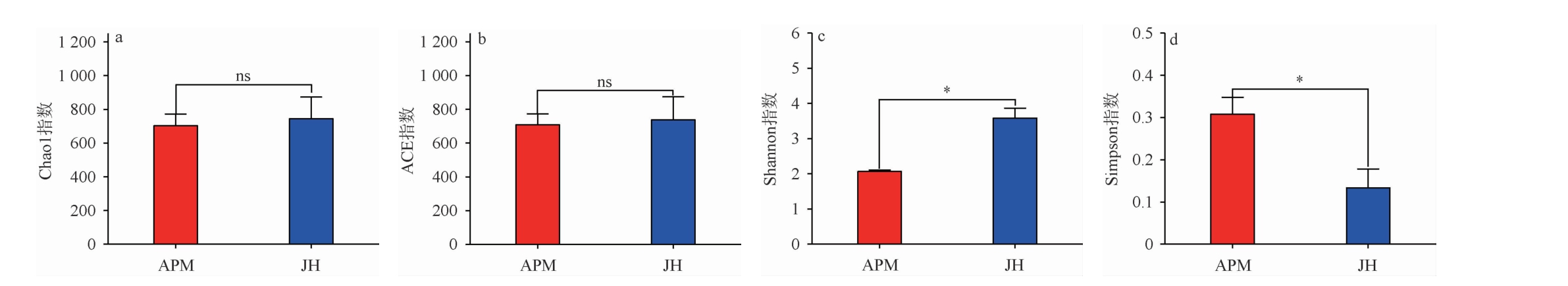
图1 人工窖泥和老窖泥细菌菌群Alpha多样性指数比较
Fig.1 Comparison of bacterial community Alpha diversity indexes between artificial and old pit muds
“ns”表示两组之间差异不显著(P>0.05);“*”表示两组之间差异显著(P<0.05)。下同。
由图1可知,老窖泥Chao1指数为743.97±259.14,高于人工窖泥(702.59±136.93),但差异不显著(P>0.05);老窖泥ACE指数为737.14±277.01,高于人工窖泥(707.78±129.82),无显著差异(P>0.05);说明人工窖泥和老窖泥之间丰富度相同。通过比较人工窖泥和老窖泥Shannon指数和Simpson指数发现,老窖泥的Shannon指数为3.58±0.55,高于人工窖泥(2.06±0.09),两者之间差异显著(P<0.05);而老窖泥的Simpson指数为0.13±0.09,低于人工窖泥(0.31±0.08),两者之间同样差异显著(P<0.05);表明老窖泥中细菌群落多样性高于人工窖泥。
2.3 老窖泥和人工窖泥细菌菌群β多样性分析
2.3.1 老窖泥和人工窖泥门水平细菌组成和丰度差异
根据OTU统计分析,8个窖泥样品共统计出15个细菌门,老窖泥中检测出15个细菌门,而人工窖泥中检测出14个细菌门。由图2可知,人工窖泥样品中的细菌主要来自厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),在人工窖泥中的细菌丰度达到92.03%和5.59%;而老窖泥中的细菌主要来自厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria),其在老窖泥中的细菌丰度分别达到70.59%、17.13%、5.84%。大多厚壁菌门的细菌可以产生芽孢,而芽孢可以抵抗脱水和其他极端环境[27],这种特性能够让窖泥在窖池环境中生存。而变形菌门中存在很多可以进行固氮的细菌,大多数可以进行厌氧生存[28]。拟杆菌门被认为是促进窖泥老熟特征的关键微生物群,它能够将窖泥中的Fe3+转化成Fe2+,从而使得窖泥的颜色出现老熟特征(由红黄棕色转变为灰白青色)[28]。变形菌门通常被认为是新窖窖泥的优势菌门[29],在研究中,新窖窖泥和老窖泥中变形菌门的相对丰度并无显著差异(P>0.05)。但由于每个酿酒企业所属的地理环境、气候的差异,这可能会导致窖泥微生物种类上的差异。
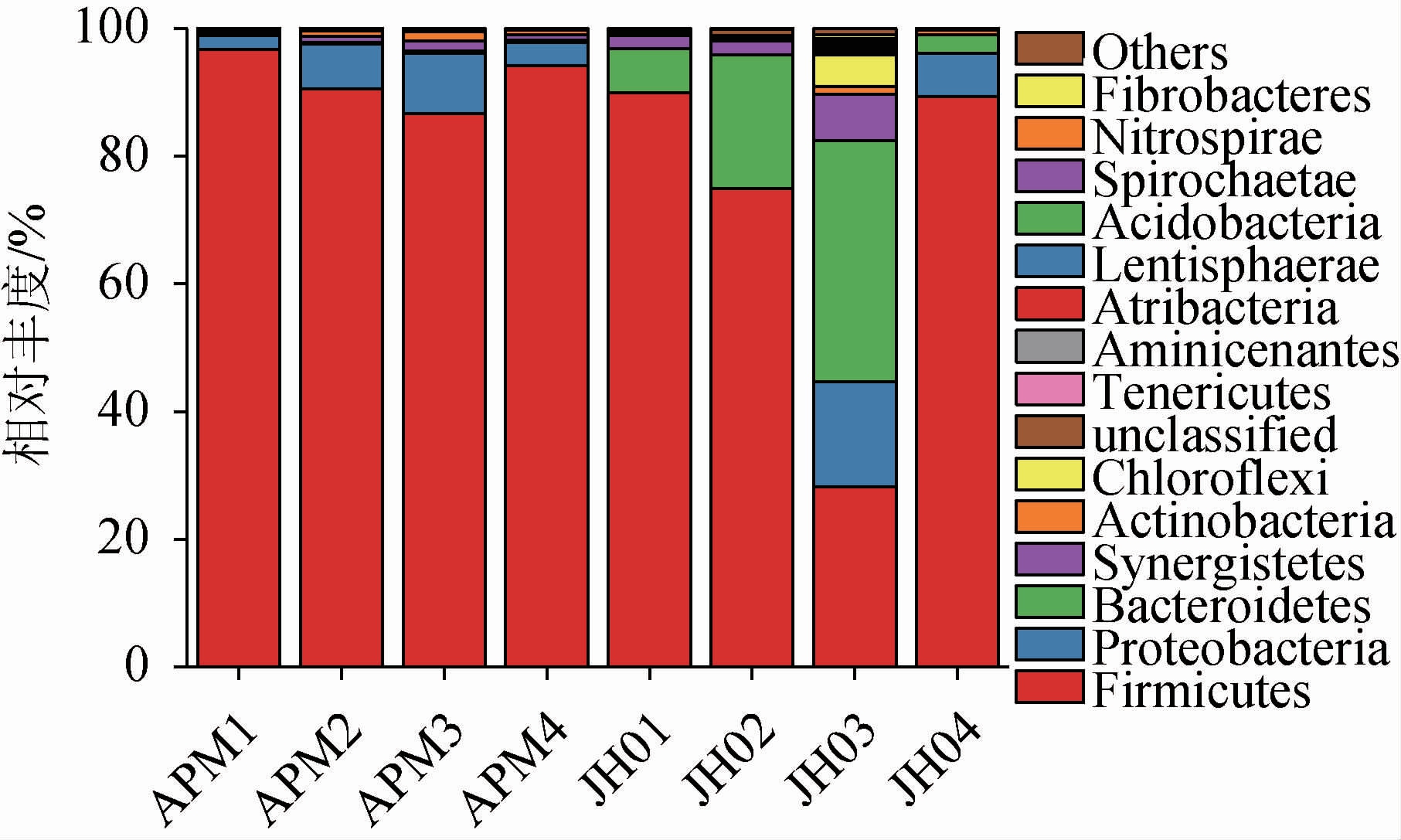
图2 人工窖泥与老窖泥门水平细菌组成差异
Fig.2 Differences in bacterial compositions between artificial and old pit muds at the phylum level
根据得到的群落丰度数据,采用组间差异分析方法比较了人工窖泥和老窖泥在细菌门水平上优势门的群落丰度差异,选择的优势门包括厚壁菌门、拟杆菌门和变形菌门,结果见图3。由图3可知,人工窖泥在厚壁菌门的相对丰度显著高于老窖泥(P<0.05),其变化程度高于老窖泥,说明人工窖泥的厚壁菌门细菌群落丰度相比于老窖泥较高,且其群落丰度变化较大。而在变形菌门中,人工窖泥和老窖泥的群落相对丰度并无显著差异(P>0.05),但人工窖泥的变化程度显著低于老窖泥。在拟杆菌门中,人工窖泥的群落丰度显著低于老窖泥(P>0.05),其变化程度也显著低于老窖泥(P<0.05)。人工窖泥在门水平上的细菌群落结构不稳定,且拟杆菌门和厚壁菌门的相对丰度差异可能是人工窖泥与老窖泥在细菌门水平上的主要差异。拟杆菌门作为促进窖泥老熟的重要微生物菌群[30],在窖泥微生物生态中主导碳循环的过程中有着非常关键的作用[28]。金徽酒人工窖泥中缺乏拟杆菌门的微生物群,对其促进人工窖泥老熟有着不利的影响。因此在后续的人工窖泥培养中,应注重拟杆菌门微生物菌群的培养。其次,微生物相对丰度的变化程度也可能是人工窖泥与老窖泥之间的主要区别,老窖泥微生物在门水平上的相对丰度的弹性远远大于人工窖泥,说明老窖泥中的微生物群落在几十年的长期驯化中已经形成了内部的稳态,可以面对各种复杂的外部环境作出调整,而人工窖泥在短期内可能达不到相应的指标,这可能也是人工窖泥和老窖泥在门水平上微生物差异的另一个重要原因。
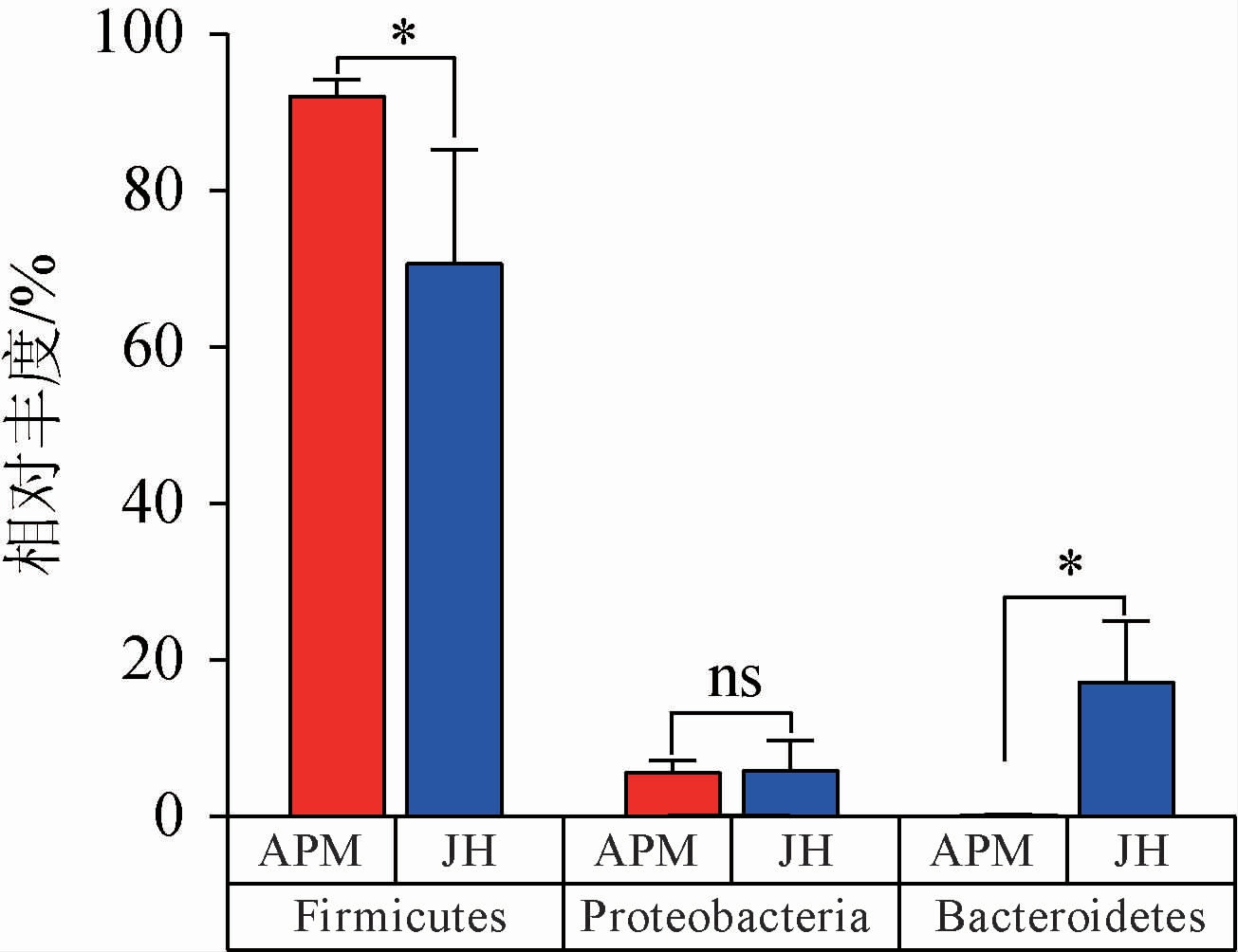
图3 人工窖泥与老窖泥细菌门水平关键微生物丰度差异
Fig.3 Differences in abundance of key microorganisms between old pit mud and artificial pit mud at the phylum level
2.3.2 老窖泥和人工窖泥属水平细菌组成和丰度差异
由于16S rDNA在V3-V4可变区测得的物种分类数据在属水平上最为准确,因此分析了老窖泥和人工窖泥在属水平上的细菌组成和丰度差异,结果见图4。由图4可知,在所有的窖泥样品中共检测出了87个属,其中人工窖泥检测出细菌84属,老窖泥检测出细菌86属,人工窖泥和老窖泥在属水平组成上基本相似。然后将平均相对丰度>1%的属定义为优势微生物属,提取出14个优势菌属(包括一个未分类属和其他属),这14个优势属在人工窖泥和老窖泥中都存在。其中,Tepidanaerobacter,厌氧杆菌属(Anaerosalibacter),Caldicoprobacter是人工窖泥中的主要优势菌属,它们的相对丰度分别为44.44%,17.44%和13.14%。这与相邻的四川某酒厂培育的人工窖泥微生物菌属的差异较大[6],四川与西北地区的气候、环境差异较大,从而导致在培养人工窖泥时富集的微生物菌群不一致。其次,人工窖泥培养方式的差异也可能会导致微生物菌群的差异,比如人工窖泥在室外发酵,其菌种的分布随发酵层次的变化而变化。当投入到生产之后,人工窖泥中的厌氧优势菌群(如己酸菌等)会快速富集,从而生产高质量的浓香型白酒[6]。而老窖泥中的主要优势菌属为产己酸菌属(Caproiciproducens),乳杆菌属(Lactobacillus)和嗜蛋白菌属(Proteiniphilum),其相对丰度分别为18.55%,12.91%和7.62%。这与四川宜宾地区[6-7]、安徽[31-33]、河南[34]等地区的老窖泥微生物菌属的组成相一致,但同时窖泥微生物群落也具有明显的地域和企业特征。如TAO Y等[29]利用454扩增子测序技术揭示出绵竹地区某知名酒厂窖泥以理研菌属(Petrimonas)等属为优势类群。赵东等[35]采用Illumina 扩增子测序解析五粮液窖泥原核微生物群落多样性时发现粪球菌属(Coprococcus)和Soehngenia等是优势类群。以上结果均与本研究中检测出的窖泥微生物群落存在显著差异。复杂的地理气候环境以及酿酒原料和工艺之间的差异,是造成窖泥微生物群落结构具有地域和企业特征的主要原因。
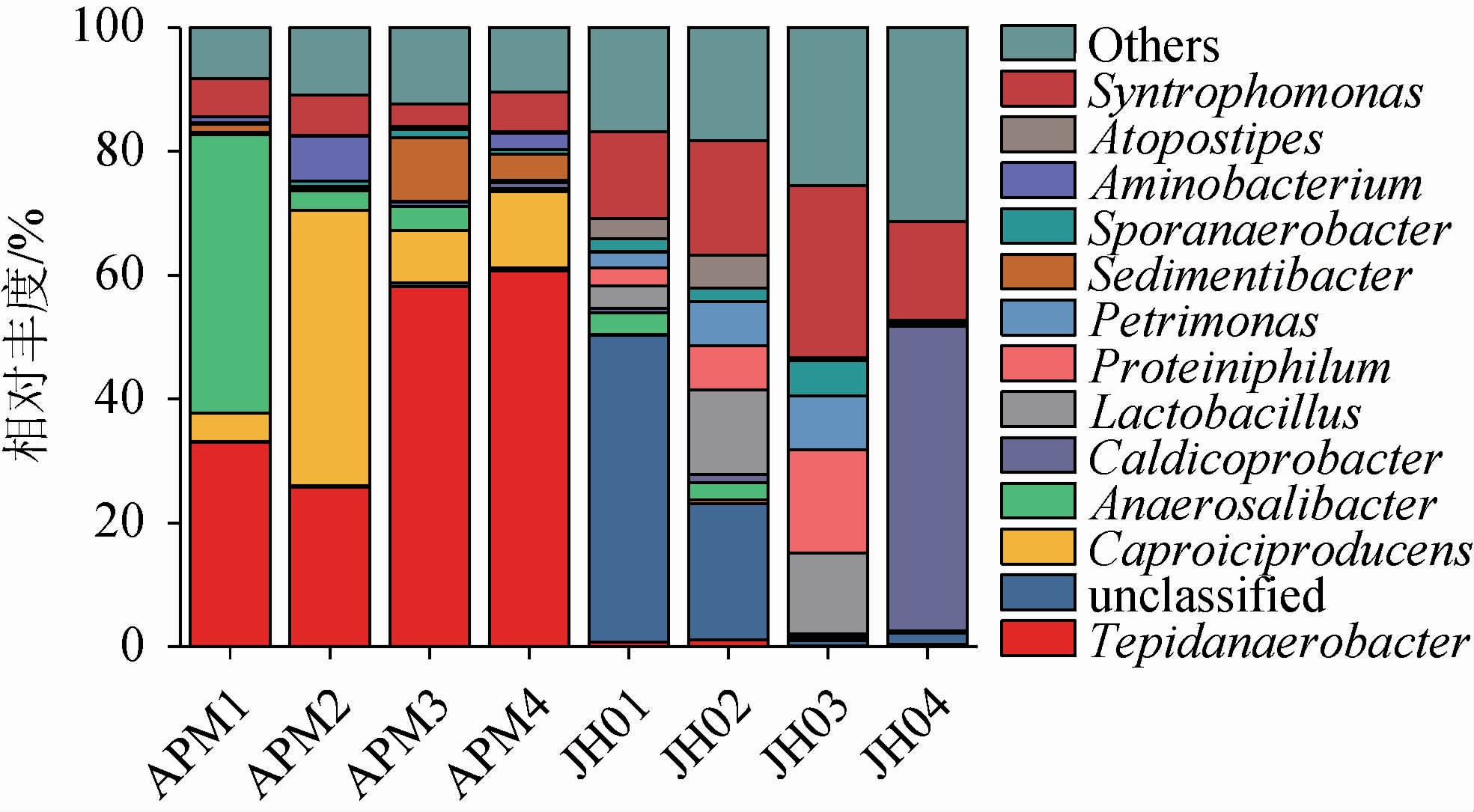
图4 老窖泥和人工窖泥属水平细菌组成差异
Fig.4 Differences in bacterial composition between old and artificial pit muds at the genus level
为了进一步探究浓香型白酒老窖泥和人工窖泥样品中潜在的关键微生物菌种,比较了6个相对丰度较大的微生物优势菌属在人工窖泥和老窖泥之间的平均相对丰度差异,探究人工窖泥和老窖泥之间的关键微生物差异,结果见表2。
表2 老窖泥和人工窖泥属水平关键微生物丰度差异
Table 2 Differences in the abundance of key microorganisms between old and artificial pit muds at the genus level
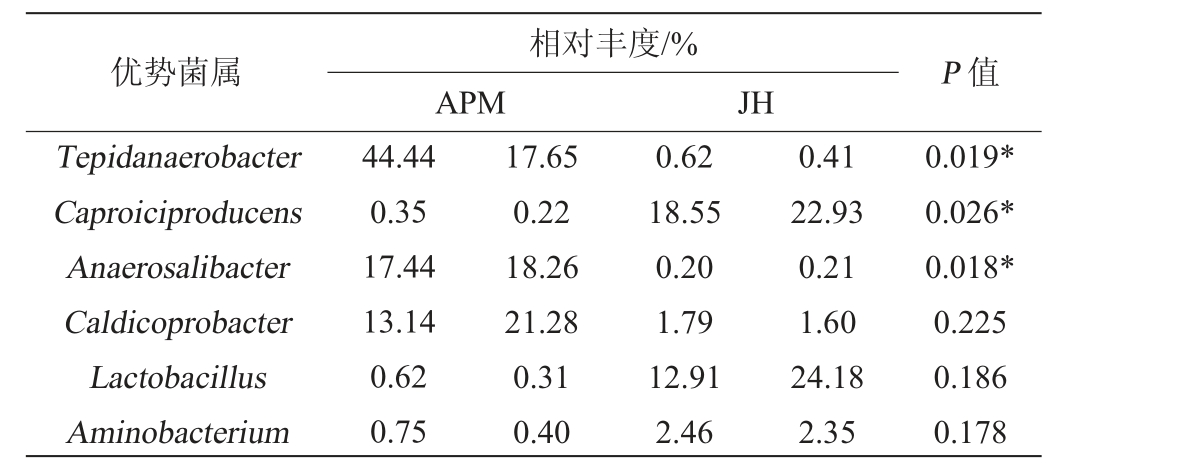
注:“*”代表差异显著(P<0.05)。
?
由表2可知,在6个主要的微生物优势菌属中,其相对丰度有显著差异的主要有3种:包括Tepidanaerobacter、产己酸菌属(Caproiciproducen)和厌氧杆菌属(Anaerosalibacters)。其中人工窖泥样品中的Tepidanaerobacter和厌氧杆菌属(Anaerosalibacters)的相对丰度含量显著高于老窖泥样品(P<0.05);而老窖泥中产己酸菌属的相对丰度含量显著高于人工窖泥(P<0.05)。产己酸菌属是浓香型白酒窖泥中能够影响白酒风味的重要微生物,由产己酸菌产生的己酸和乙醇相互作用生成的己酸乙酯是浓香型白酒的主要香气成分。老窖泥中己酸菌的相对丰度较高,可以使得生产的白酒香味更浓,质量更好[31-33]。而人工窖泥中的己酸菌相对丰度仅有0.3%,显著低于老窖泥。一方面由于人工窖泥是在窖外大批量进行发酵,其环境并不能达到完全厌氧条件,因此产己酸的厌氧菌群不能快速的富集起来,从而导致人工窖泥中己酸菌的含量低于老窖泥;另一方面在人工窖泥发酵过程中菌种分布不均匀,这也可能是老窖泥中优势微生物属存在差异的原因之一。
3 结论
本研究从Alpha多样性和细菌群落结构的分布特点阐述人工窖泥和老窖泥的差异。从丰富度指数来看,人工窖泥和老窖泥的指数并无显著性差异(P>0.05),但其群落多样性之间存在显著差异(P<0.05),老窖泥细菌群落多样性高于人工窖泥。从群落组成上看,人工窖泥中拟杆菌门的相对丰度显著低于老窖泥(P<0.05),且人工窖泥中的产己酸菌属同样显著低于老窖泥,而Tepidanaerobacter和Anaerosalibacters显著高于老窖泥(P<0.05)。本研究只考虑了人工窖泥和老窖泥之间的细菌群落结构差异,并未研究成熟的人工窖泥在入窖后微生物的群落动态变化。因此,未来还需要探究人工窖泥在窖池环境中的变化,才能更好的阐述人工窖泥和老窖泥之间的细菌群落差异。
[1] ZOU W, ZHAO C Q, LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:a review[J].Front Microbiol,2018,9:00671.
[2]SONG S.annual working report of Baijiu branch,market committee,famous Baijiu collection committee,and design&equipment committee of China alcoholic drinks association[J].Liquor Mak Sci Technol, 2016,6(264):17-28.
[3]曾波,邹永芳,饶家权,等.浓香型白酒窖底泥和窖壁泥细菌群落结构差异性分析[J].食品科学,2023,44(18):223-230.
[4]翟磊,刘瑞娜,张京涛,等.浓香型白酒窖池中细菌群落结构的研究[J].食品与发酵工业,2023,49(13):78-84.
[5]任海伟,孙一帆,王希,等.不同窖龄及位置浓香型白酒窖泥中细菌群落结构的差异性分析[J].食品与发酵工业,2022,8(1):1-12.
[6]唐云,姚海刚,李彦涛,等.不同窖龄浓香型白酒窖泥细菌群落结构及其多样性分析研究[J].酿酒科技,2022(7):93-98.
[7]周文,舒学香,张崇军,等.宜宾地区不同性状窖泥的细菌群落结构解析及代谢功能预测[J].中国酿造,2022,41(8):110-114.
[8]邓世彬.人工窖泥在浓香型白酒生产中的应用[J].酿酒科技,2021(3):73-74,77.
[9]何诚,任道群,唐玉明,等.浓香型白酒人工窖泥培养过程中微生物变化研究[J].酿酒,2011,38(1):16-18.
[10]姜雨函,王西,王久明,等.不同配方人工窖泥的理化性质比较分析[J].酿酒科技,2021(5):70-76.
[11] TSAO G T, OUYANG P, CHEN J, et al.Biotechnology in China II:chemicals,energyand environment[M].New York:Springer,2010:189-233.
[12]张家庆,宋瑞滨,曹敬华,等.人工老窖窖泥结晶初步分析[J].中国酿造,2014,33(3):21-23.
[13]ZHANG Y G,CONG J,LU H,et al.An integrated study to analyze soil microbial community structure and metabolic potential in two forest types[J].PloS One,2014,9(4):e93773.
[14]崔世亮,卢杰,杨晓丽.北方地区人工窖泥的培养及养护[J].酿酒科技,2003(5):49-51.
[15]冯小进,陈周,董孝元,等.土质对人工窖泥培养的影响研究[J].酿酒,2022,49(4):77-79.
[16]DING X F,WU C D,HUANG J,et al.Eubacterial and archaeal community characteristics in the man-made pit mud revealed by combined PCR-DGGE and FISH analyses[J].Food Res Int,2014,62:1047-1053.
[17]LIU C J,DU Y F,ZHENG J,et al.Production of caproic acid by Rummeliibacillus suwonensis 3B-1 isolated from the pit mud of strong-flavor Baijiu[J].J Biotechnol,2022,358(22):33-40.
[18] LIU Y B, SUN M X, HOU P, et al.Analysis of microbial community structure and volatile compounds in pit mud used for manufacturing Taorong-type Baijiu based on high-throughput sequencing[J].Sci Rep,2022,12:7347.
[19]姜新宇.金徽“生态酿酒”引领陇酒风尚[N].华夏酒报,2010-06-11.
[20]党延强.金徽酒营销策略研究[D].兰州:兰州大学,2019.
[21]康晓云.金徽酒业集团有限责任公司发展战略研究[D].兰州:兰州理工大学,2013.
[22]WEI H W,WANG L H,HASSAN M,et al.Succession of the functional microbial communities and the metabolic functions in maize straw composting process[J].Bioresource Technol,2018,256:333-341.
[23] LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int, 2017,102:68-76.
[24] WAGNER B D, GRUNWALD G K, ZERBE G O, et al.On the use of diversity measures in longitudinal sequencing studies of microbial communities[J].Front Microbiol,2018,9:01037.
[25]THUKRAL A K.A review on measurement of Alpha diversity in biology[J].Agr Res J,2017,54(1):1-10.
[26]SINCLAIR L,OSMAN O A,BERTILSSON S,et al.Microbial community composition and diversity via 16S rRNA gene amplicons:evaluating the illumina platform[J].PloS One,2015,10(2):e0116955.
[27]AMARESAN N,KUMAR M S,ANNAPURNA K,et al.Beneficial Microbes in Agro-Ecology: bacteria and fungi[M].New York: Academic Press,2020:363-396.
[28]MCGENITY T,VAN DER MEER J R,DE LORENZO V.Handbook of hydrocarbon and lipid microbiology[M].Berlin:Springer,2010:105-110.
[29]TAO Y,LI J B,RUI J P,et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Appl Environ Microbiol,2014,80(7):2254-2260.
[30]LIANG H P,LI W F,LUO Q C,et al.Analysis of the bacterial community in aged and aging pit mud of Chinese Luzhou-flavour liquor by combined PCR-DGGE and quantitative PCR assay[J].J Sci Food Agr,2015,95(13):2729-2735.
[31]CHAI L J,XU P X,QIAN W,et al.Profiling the Clostridia with butyrateproducing potential in the mud of Chinese liquor fermentation cellar[J].Int J Food Microbiol,2019,297:41-50.
[32] LIU Y, QIAO J T, YUAN X Z, et al. Hydrogenispora ethanolica gen.nov., sp.nov., an anaerobic carbohydrate-fermenting bacterium from anaerobic sludge[J].Int J Syst Evol Microbiol,2014,64:1756-1762.
[33]SUN Z K,CHEN C,HOU X G,et al.Prokaryotic diversity and biochemical properties in aging artificial pit mud used for the production of Chinese strong flavor liquor[J].3 Biotech,2017,7:335.
[34]胡晓龙,付丹阳,王永亮,等.浓香型白酒窖池空间位置及窖龄对窖泥原核微生物群落的影响[J].中国酿造,2023,42(3):65-71.
[35]赵东,郑佳,彭志云,等.高通量测序技术解析五粮液窖泥原核微生物群落结构[J].食品与发酵工业,2017,43(9):1-8.