中国白酒酿造已有悠久的历史,其品种繁多、香型各异、工艺更是各有不同[1]。发酵过程中,窖池中各种微生物生化代谢及其相互作用、互相影响、协调发展共同构成了窖池特定的微生态系统,微生物多样性一定程度上决定了白酒品质[2]。针对特定酿酒企业解析窖池微生物多样性,分离发酵过程中优势菌株具有重要意义。长期以来,人们利用传统可培养技术对窖池中的微生物组分进行分析,揭示了不同窖池中的优势菌群的种属与分布特点,如刘雯雯[3]应用传统可培养技术分离到328株霉菌,其中优势真菌属为交链孢属(Alternaria)、地丝菌属(Geotrichum)、孢霉属(Cladosprium)、曲霉属(Aspergillus)、散囊菌属(Eurotium)和红曲霉属(Monascus)等;CHEN B等[4]研究发现,酱香型白酒发酵窖池优势真菌为宛氏拟青霉(Paecilomyces variotii)、米曲霉(Aspergillus oryzae)和土曲霉(Aspergillus terreus)。可培养技术虽然促进酒企生产技术的发展,但不能对非培养微生物进行分析,无法全面解析窖池微生物群落结构及生长规律。随着分子生物学技术的快速发展,高通量测序技术以其灵敏度高、重复性好、可分析不可培养微生物等优点,被广泛应用到微生物群落多样性的分析[5]。如胡小霞等[6-7]采用高通量技术研究发现,窖池微生物优势细菌属包括乳酸杆菌属(Lactobacillus)、埃希氏菌属(Escherichia-Shigella)和芽孢杆菌属(Bacillus);优势真菌属为交链孢属(Alternaria)、曲霉属(Aspergillus)、伊萨酵母属(Issatchenkia)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、接合酵母属(Zygosaccharomyces)等。同时白酒风味独特,种类繁多,采用常规化学方法测定如白酒中总酸、总酯、总醛、甲醇和杂醇油等成分已经满足不了白酒工作者的工作需求。气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)技术可对白酒微量成分准确剖析,但仅依据化学含量难以评估风味物质的特征贡献,还需结合感官阈值指标,评价白酒风味物质贡献和白酒品质[8]。
本研究以山东扳倒井股份有限公司国井白酒窖池发酵中酒醅为研究对象,通过可培养技术,将优势功能微生物进行分离、筛选、鉴定及应用;应用现代分子生物学技术,深入了解国香型白酒酒醅的微生物群落结构及演变过程,明确酒醅发酵过程中的优势真菌和细菌种类;结合GC-MS技术,分析原酒中的挥发性风味物质对样品总体香气的贡献;通过对发酵过程酒醅中水分、酸度、还原糖、淀粉含量以及原酒酒精度、总酸、总酯等理化性质测定,进一步认识微生物群落代谢对酒质的影响,为提升国井白酒的品质提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
本研究酒醅样品取自山东扳倒井股份有限公司,收集窖池不同时间点7个酒醅样品(入窖堆积、发酵0 d、6 d、12 d、18 d、24 d、30 d),采样时间为2021年11月15日~2021年12月14日,每次采集样品覆盖不同位置(窖池对角线两个点,同一位点上层和下层糟醅)通过四分法采集两份等同样品(每份500 g)分别用于可培养法和非培养法的测定。
1.1.2 化学试剂
氯化钠、葡萄糖、氢氧化钠、邻苯二甲酸氢钾、乙二胺四乙酸、十六烷基三甲基溴化铵、氯仿、异戊醇、异丙醇、醋酸钠、盐酸、无水乙醇、4-甲基-2-戊醇(均为分析纯):国药集团化学试剂有限公司;3,5-二硝基水杨酸(分析纯)、Tris-饱和酚:上海源叶生物科技有限公司;0.85%生理盐水:北京陆桥技术股份有限公司;琼脂糖(分析纯):北京全式金生物技术有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物:生工生物工程(北京)股份有限公司;DL2000脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker、核糖核酸酶(ribonuclease,RNase)、蛋白酶K:宝生物工程(大连)有限公司;DNA纯化试剂盒、真菌DNA提取试剂盒:美国Omega Bio-Tek公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯浸粉5.0 g/L,葡萄糖20.0 g/L,琼脂20.0 g/L。121 ℃高压灭菌20 min。
大豆酪蛋白琼脂(trypticase soy agar,TSA)培养基:胰蛋白胨15.0 g/L,大豆胨5.0 g/L,氯化钠5.0 g/L,琼脂15.0 g/L,pH值7.3±0.2。121 ℃高压灭菌15 min。
强化梭菌培养基(reinforcedClostridiummedium,RCM):蛋白胨10.0 g/L,牛肉粉10.0 g/L,酵母粉3.0 g/L,葡萄糖5.0 g/L,可溶性淀粉1.0 g/L,氯化钠5.0 g/L,醋酸钠3.0 g/L,L-半胱氨酸盐酸盐0.5 g/L,琼脂0.5 g/L,pH值6.8±0.1。121 ℃高压灭菌15 min。
1.2 仪器与设备
AC2-6S1生物安全柜、GHP-9160隔水式培养箱:上海一恒科学仪器有限公司;5424 R高速冷冻离心机:德国Eppendorf 公司;TRIO48聚合酶链式反应(PCR)仪:德国Biometra公司;BioDrop-μLite微量核酸蛋白分析仪:英国Biochrom有限公司;DT-401A电子天平:常熟市佳衡天平仪器有限公司;HG-50高压灭菌锅:日本HIRAYAMA公司;Votex 2000旋涡振荡仪:美国Coleparmer公司;Microflex LRF基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization-time of flight-mass spectrometry,MALDI-TOF-MS)仪:意大利BRUKER公司;EC250-90电泳仪、Gel DoCqM EZ凝胶成像仪:美国BIO-RAD公司。
1.3 方法
1.3.1 可培养微生物分离
取样品25 g至225 mL生理盐水中,稀释至10-1~10-4浓度,不同浓度稀释液吸取100 μL分别涂布到PDA、TSA和RCM平板上,PDA平板置于培养箱中28 ℃好氧培养5 d,TSA平板置于培养箱中37 ℃好氧培养3 d,RCM平板置于培养箱中37 ℃厌氧培养3 d。
1.3.2 酒醅样品中可培养微生物的菌种鉴定
真菌鉴定:利用真菌基因组提取试剂盒提取分离菌株的脱氧核糖核酸(DNA),再利用核糖体内部转录间隔区(internal transcribed spacer,ITS)、核糖体rDNA大亚基(26SD1/D2)[9-10]等分子标记引物对丝状真菌和酵母菌的核酸序列进行聚合酶链式反应(PCR)扩增。PCR扩增体系:2×PCR MasterMix21μL,10μmol/L上、下游引物各1μL,DNA 30 ng,双蒸水(ddH2O)补足至50 μL。PCR扩增条件:94 ℃10 min;94 ℃30 s,55 ℃30 s,72 ℃40 s,共35个循环;72 ℃7 min。扩增后获得约600 bp的DNA片段,并进行测序。根据测序结果,用菌株的26S rDNA和ITS rDNA基因作为靶序列,在美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中用基本局部比对搜索工具(basic local alignment search tool,BLAST)程序搜索同源序列,挑选与靶序列最相近的参考菌株系列,以99%序列相似性为判定标准完成菌种鉴定。
细菌鉴定:利用细菌基因组提取试剂盒提取分离菌株的DNA,再利用16S rRNA基因通用引物27F/1492R进行PCR扩增。PCR扩增体系:2×PCRMasterMix25μL,10μmol/L上、下游引物各1 μL,DNA 2 μL,双蒸水(ddH2O)补足至50 μL。PCR扩增条件:94 ℃5 min;94 ℃1 min,55 ℃1 min,72 ℃1 min 30 s,共30个循环;72 ℃10 min。扩增后获得约1 500 bp的DNA片段,并进行测序。根据测序结果,在EzBio Cloud数据库中进行比对,获得目标菌株及其近缘种的序列相似性,以98.65%序列相似性为判定标准完成菌种鉴定。
1.3.3 样品宏基因组提取与高通量测序分析
利用溴化十六烷基三甲铵(cetyltrimethyl ammonium bromide,CTAB)法提取样品的宏基因组DNA。以质检合格的宏基因组DNA为模板,使用16S rRNA基因V4区通用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')进行PCR扩增。PCR扩增体系:5×FastPfu缓冲液8 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)4 μL,10 μmol/L上、下游引物各2 μL,FastPfu酶1 μL,DNA 30 ng,双蒸水(ddH2O)补足至40 μL。PCR扩增条件:95 ℃5 min;95 ℃30 s,55 ℃45 s,72 ℃45 s,共27个循环;72 ℃10 min[11]。使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化并溶于洗脱缓冲液中,完成文库的构建。使用Agilent 2100 Bioanalyzer对构建文库的片段范围及浓度进行检测,检测合格的文库利用HiSeq2500平台进行扩增子测序。
将高通量测序数据与已知数据库进行比对分析,对获得的操作分类单元(operational taxonomic unit,OTU)进行物种分类,使用软件R(v3.4.1),在种水平绘制样品的物种丰度图,直观的展示样品中物种的组成及丰度,反映样品间微生物物种的变化情况。
1.3.4 酒醅样品及原酒理化指标测定
水分的测定[12]:采用电热烘箱干燥法;酸度的测定[12]:采用中和滴定法;淀粉含量的测定:采用滴定法;还原糖的测定[12]:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)-分光光度计法[12];原酒总酸、总酯的测定:采用中和滴定(指示剂)法;原酒酒精度的测定:参考国标GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》;原酒综合品评:参考国标GB/T10345—2007《白酒分析方法》。
1.3.5 原酒中挥发性风味物质的检测及气味活度值分析
原酒中挥发性风味物质的检测采用GC-MS法。
样品预处理:取待分析的酒样0.5 mL,置于10 mL 固相微萃取仪采样瓶中,加入5 mL去离子水、1.5 g氯化钠及20 μL 2.005 g/L的4-甲基-2-戊醇,35 ℃顶空萃取40 min,热解吸3 min进样。
气相色谱条件:CP-WAX57CB毛细管柱(50m×0.25mm×0.2 μm),柱温采用程序升温,初温35 ℃,保持3 min后以3 ℃/min 升至80 ℃,再以9 ℃/min升至200 ℃,保持20 min。载气为高纯氦气(He)(纯度99.999%),流速1.0 mL/min,进口温度230 ℃,不分流进样1 μL。质谱条件:电子电离(elctronic ionization,EI)源,电子能量70 eV,离子源温度230 ℃,质谱扫描范围50~500 amu。
采用气味活度值(odor activity value,OAV)评价各化合物对样品总体风味的贡献,OAV=物质浓度/阈值,OAV<1,说明该物质对总体风味无实际作用;OAV>1,说明该物质可能对总体风味有较大影响;且在一定范围内,OAV越大,说明该物质对总体风味的贡献越大[13-14]。
1.3.6 数据处理
数据分析主要包括测序数据过滤、序列标签(Tag)拼接、OTU聚类、物种注释和物种复杂度分析等流程。利用QIIME 2[15]的DADA2方法[16]对下机数据进行质控,去除低质量序列、嵌合体并得到Clean Data。使用FLASH软件(v1.2.11),利用重叠关系将双末端测序得到的成对Reads组装成一条序列,得到高变区的Tags。利用USEARCH软件(v7.0.1090)将拼接好的Trags聚类为OTU,并采用RDP classifier 贝叶斯算法对OTU代表序列进行分类学分析,并在界、门、纲、目、科、属和种水平统计分析各样本的群落组成。利用QIIME2中q2-diversity方法进行Alpha多样性指数分析,Chao1、Ace、Shannon和Simpson指数共同表征样品的微生物群落结构的丰富度和多样性。实验数据用“平均值±标准差”表示,样品差异分析采用单因素方差法,差异显著(P<0.05)时通过Duncan氏法进行多重比较,分析由SPSS 27.0软件完成。
2 结果与分析
2.1 不同发酵时间酒醅样品中可培养微生物分离结果
不同发酵时间酒醅样品中可培养微生物分离结果见表1。由表1可知,通过可培养技术在不同发酵时期酒醅样品中共分离出155株,获得14种微生物,涵盖11个属,其中真菌5种[谢瓦曲霉(Aspergillus chevalieri)、酿酒酵母(Saccharomyces cerevisiae)、发酵毕赤酵母(Pichia fermentans)、横梗霉(Lichtheimia sp.)和Trichomonascus ciferrii];细菌9种[解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)、布氏慢生乳杆菌(Lentilactobacillus buchneri)、啄木鸟肠球菌(Enterococcus phoeniculicola)、成团泛菌(Pantoea agglomerans)、植物乳杆菌(Lactobacillus plantarum)、短发酵乳杆菌(Levilactobacillus brevis)、希尔加德慢生乳杆菌(Lentilactobacillus hilgardii)和高原芽孢杆菌(Bacillus altitudinis)]。所有样品都分离到解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和酿酒酵母(Saccharomyces cerevisiae)。随着发酵时间增长,可培养微生物种类变化较大。入窖堆积样品中分离到酿酒酵母(Saccharomyces cerevisiae)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、Trichomonascus ciferrii、谢瓦曲霉(Aspergillus chevalieri)、横梗霉(Lichtheimia sp.)、枯草芽孢杆菌(Bacillus subtilis)、啄木鸟肠球菌(Enterococcus phoeniculicola)和成团泛菌(Pantoea agglomerans),入窖池样品分离到发酵毕赤酵母(Pichia fermentans),发酵12 d、发酵18 d和发酵24 d均分离到布氏慢生乳杆菌(Lentilactobacillus buchneri),发酵12 d样品还分离到短发酵乳杆菌(Levilactobacillus brevis),发酵18 d分离到希尔加德慢生乳杆菌(Lentilactobacillus hilgardii)和高原芽孢杆菌(Bacillus altitudinis),发酵30 d样品分离到枯草芽孢杆菌(Bacillus subtilis)。
表1 不同发酵时间酒醅样品中可培养微生物分离结果
Table 1 Isolation results of culturable microorganism of fermented grains samples at different fermentation time

样品名称 分离菌种名称Trichomonascus ciferrii谢瓦曲霉(Aspergillus chevalieri)酿酒酵母(Saccharomyces cerevisiae)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)横梗霉属(Lichtheimia sp.)枯草芽孢杆菌(Bacillus subtilis)啄木鸟肠球菌(Enterococcus phoeniculicola)成团泛菌(Pantoea agglomerans)酿酒酵母(Saccharomyces cerevisiae)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)发酵毕赤酵母(Pichia fermentans)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)植物乳杆菌(Lactobacillus plantarum)酿酒酵母(Saccharomyces cerevisiae)酿酒酵母(Saccharomyces cerevisiae)短发酵乳杆菌(Levilactobacillus brevis)希尔加德慢生乳杆菌(Lentilactobacillus buchneri)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)酿酒酵母(Saccharomyces cerevisiae)布氏慢生乳杆菌(Lentilactobacillus buchneri)希尔加德慢生乳杆菌(Lentilactobacillus hilgardii)高原芽孢杆菌(Bacillus altitudinis)酿酒酵母(Saccharomyces cerevisiae)布氏慢生乳杆菌(Lentilactobacillus buchneri)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)酿酒酵母(Saccharomyces cerevisiae)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)枯草芽孢杆菌(Bacillus subtilis)入窖堆积样品发酵0 d发酵6 d发酵12 d发酵18 d发酵24 d发酵30 d
2.2 不同发酵时间酒醅样品微生物菌群结构分析
2.2.1 真菌群落组成分析
在属水平上,基于高通量测序技术对7个不同发酵时间样品真菌的种类和相对丰度进行分析,结果见图1。由图1可知,7个不同发酵时间样品共测序获得真菌435 114个OTUs,种水平上共有224种OTUs,优势菌种(相对丰度>1%)主要有发酵毕赤酵母(Pichia fermentans)、橙色嗜热子囊菌(Thermoascus aurantiacus)、谢瓦曲霉(Aspergillus chevalieri)、棉毛状嗜热霉(Thermomyces lanuginosus)、东方伊萨酵母(Issatchenkia orientalis)同物异名为库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)、少孢毕赤酵母(Pichia exigua)与臭曲霉(Aspergillus foetidus)。入窖堆积样品中主要有橙色嗜热子囊菌(Thermoascusaurantiacus)、谢瓦曲霉(Aspergillus chevalieri)和棉毛状嗜热(Thermomyces lanuginosus)3种菌,入窖池发酵样品中主要包含发酵毕赤酵母(Pichia fermentans)、橙色嗜热子囊菌(Thermoascus aurantiacus)、谢瓦曲霉(Aspergillus chevalieri)、棉毛状嗜热霉(Thermomyces lanuginosus)4种菌,随着发酵时间的延长,发酵毕赤酵母(Pichia fermentans)、谢瓦曲霉(Aspergillus chevalieri)、棉毛状嗜热霉(Thermomyces lanuginosus)和少孢毕赤酵母(Pichia exigua)比例逐渐减小,东方伊萨酵母(Issatchenkia orientalis)逐渐增多。发酵时间在18~30 d时,微生物多样性增多,相对丰度增大。
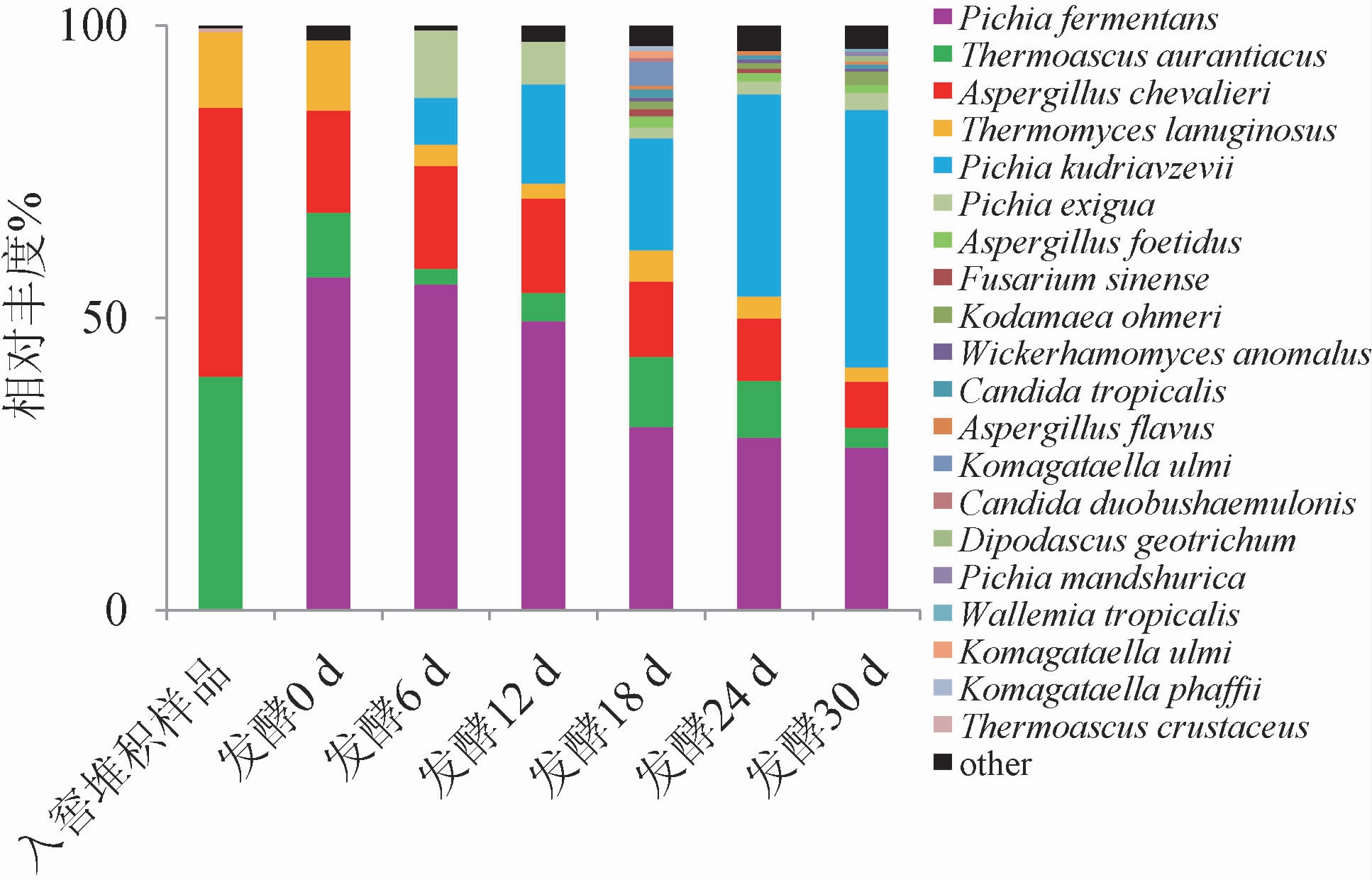
图1 基于属水平不同发酵时间酒醅样品的真菌群落结构
Fig.1 Fungal community structure of fermented grains samples at different fermentation time based on genus level
2.2.2 细菌群落组成分析
在属水平上,基于高通量测序技术对7个不同发酵时间样品细菌的种类和相对丰度进行分析,结果见图2。由图2可知,7个不同发酵时间样品共测序获得细菌422 720个OTUs,种水平上共有304种OTUs,发酵起始细菌种类较多,优势菌种(相对丰度>1%)主要有金山醋酸乳杆菌(Acetilactobacillus jinshanensis)、耐酸乳杆菌(Lactobacillus acetotolerans)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、考氏科萨克氏菌(Kosakonia cowanii)、魏斯氏菌(Weissella confuse)、乳杆菌属(Lactobacillus sp.)、鸡葡萄球菌(Staphylococcus gallinarum)、巴氏醋杆菌(Acetobacter pasteurianus)、小片球菌(Pediococcus parvulus)、桥乳杆菌(Lactobacillus pontis)和发酵乳杆菌(Lactobacillus fermentum)。入窖堆积样品中优势菌种有10种,分别为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、考氏科萨克氏菌(Kosakonia cowanii)、魏斯氏菌(Weissella confuse)、鸡葡萄球菌(Staphylococcus gallinarum)、斯氏泛菌(Pantoea stewartii)、戊糖片球菌(Pediococcus pen tosaceus)、桥乳杆菌(Lactobacillus pontis)、发酵乳杆菌(Lactobacillus fermentum)、直杆糖多孢菌(Saccharopolyspora rectivirgula)和类食品乳杆菌(Lactobacillus paralimentarius)。入窖池发酵样品中主要包含金山醋酸乳杆菌(Acetilactobacillus jinshanensis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、考氏科萨克氏菌(Kosakonia cowanii)、魏斯氏菌(Weissellaconfuse)、鸡葡萄球菌(Staphylococcusgallinarum)、戊糖片球菌(Pediococcus pentosaceus)、巴氏醋杆菌(Acetobacter pasteurianus)、桥乳杆菌(Lactobacillus pontis)、发酵乳杆菌(Lactobacillus fermentum)、直杆糖多孢菌(Saccharopolyspora rectivirgula)、乳酸乳球菌(Lactococcus lactis)、玫瑰色葡糖杆菌(Gluconobacter roseus)、旧金山乳酸菌(Lactobacillus sanfranciscensis)和解糖肠球菌(Enterococcus saccharolyticus)。随着发酵时间延长,金山醋酸乳杆菌(Acetilactobacillus jinshanensis)快速增加,发酵18~30 d时,样品中金山醋酸乳杆菌(Acetilactobacillus jinshanensis)和耐酸乳杆菌(Lactobacillus acetotolerans)相对丰度>97%。
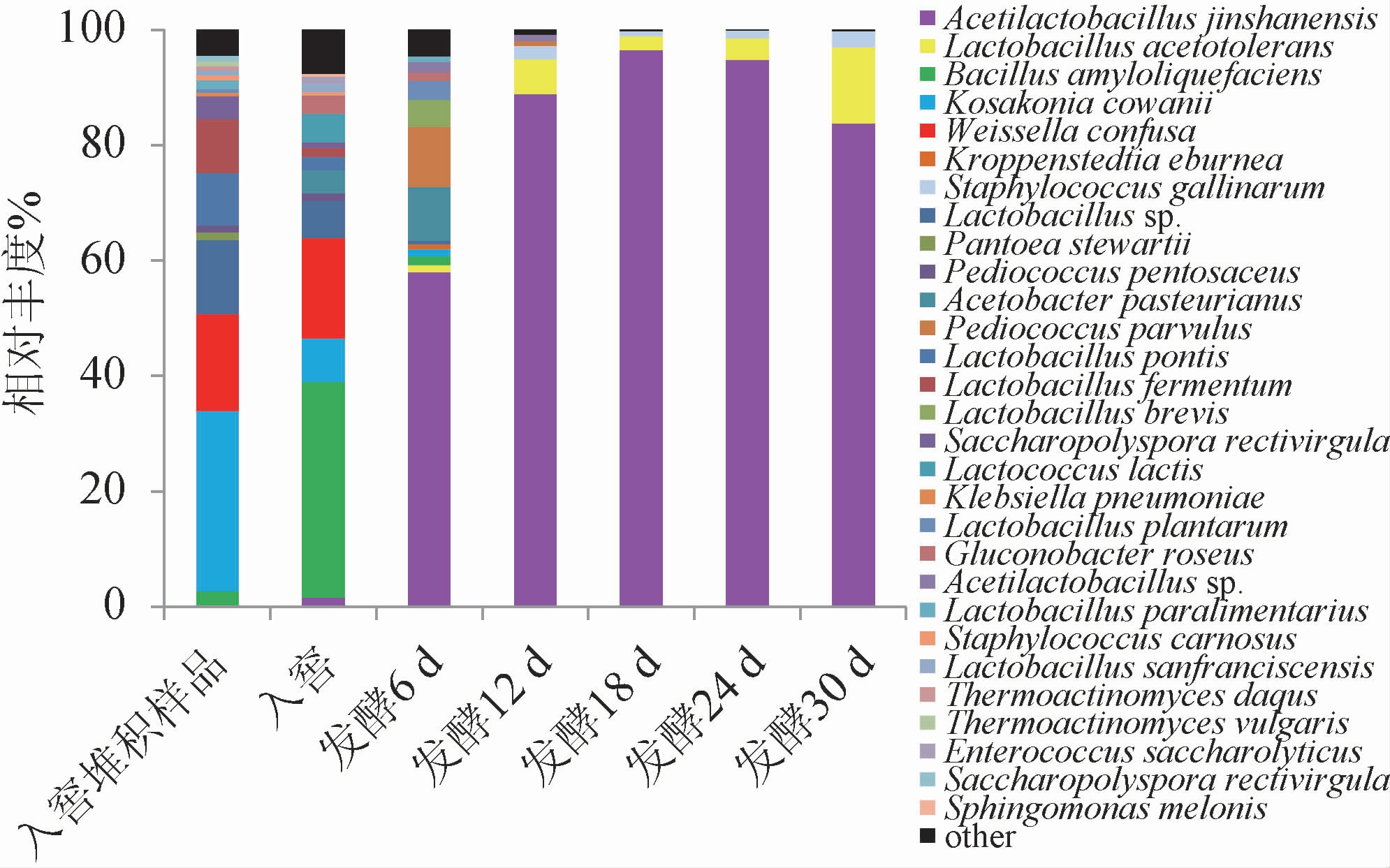
图2 基于属水平不同发酵时间酒醅样品的细菌群落结构
Fig.2 Bacterial community structure of fermented grains samples at different fermentation time based on genus level
2.3 窖池酒醅发酵过程中优势菌特性分析
窖池酒醅发酵过程中细菌、酵母菌、霉菌之间有相互促进也有相互拮抗作用,随着温度、酒精浓度、酸度和氧气含量等因素的变化,微生物群落结构不断的演化,不同微生物对原料中淀粉和蛋白质分解,生成各类代谢产物[17]。这些代谢产物最终进入生化反应中进行大量复杂的物质转化及能量代谢,形成重要风味物质。谢瓦曲霉(Aspergillus chevalieri)和臭曲霉(Aspergillus foetidus)有产酶和糖化的作用[18-19],枯草芽孢菌(Bacillus subtilis)、高原芽孢杆菌(Bacillus altitudinis)和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)主要具有耐高温、产酶、产香的功能,与一些风味物质(如吡嗪类化合物)的形成有关[20],发酵毕赤酵母(Pichia fermentans)在不同底物和不同环境调节下,代谢产物主要有醇、酯、酸[21-23],酿酒酵母(Saccharomyces cerevisiae)和东方伊萨酵母(Issatchenkia orientalis)可将葡萄糖在无氧条件下发酵成为酒精和二氧化碳,是主要的产酒酵母;Trichomonascus ciferrii具有重要产香功能[24],横梗霉属(Lichtheimia sp.)与芳香类物质呈显著正相关[25],植物乳杆菌(Lactobacillus plantarum)与酿酒酵母共同作用对酯类、醇类和醛酮类等大部分挥发性物质的形成有明显促进作用[26],金山醋酸乳杆菌(Acetilactobacillus jinshanensis)有利于有机酸的产生[27],耐酸乳杆菌(Lactobacillus acetotolerans)具有优良的耐酸和产酸特性,有利于其在白酒酿造过程中生长繁殖并丰富白酒风味[28]。考氏科萨克氏菌(Kosakonia cowanii)具有产阿魏酸酯酶功能,能够增加麸皮、大曲和糟醅中阿魏酸的释放量,使得样品中阿魏酸含量增加[29]。魏斯氏菌(Weissella confuse)可以产生酸、醛、酮和酯等风味物质[30]。
2.4 Alpha多样性指数分析
Alpha多样性指数是用来分析样本内的微生物群落多样性,通过对样本该指数的分析可以反映样本内微生物群落的丰富度和多样性。其中,Chao1和Ace指数是估计样品中的物种总数,指数值越大,表示样品中群落丰富度越高。Shannon 指数反映群落的多样性,Simpson 指数反映群落中优势种的集中程度,Shannon指数越大,Simpson指数越小,说明样品中的物种多样性越高。深度测序指数Coverage是指各样品文库的覆盖率,其数值越高,则样品中序列被测出的概率越高。不同发酵时期样品中微生物群落结构多样性指数分析结果见表2。
表2不同发酵时间酒醅样品微生物Alpha多样性分析结果
Table 2 Alpha diversity analysis results of microorganism in fermented grains samples at different fermentation time
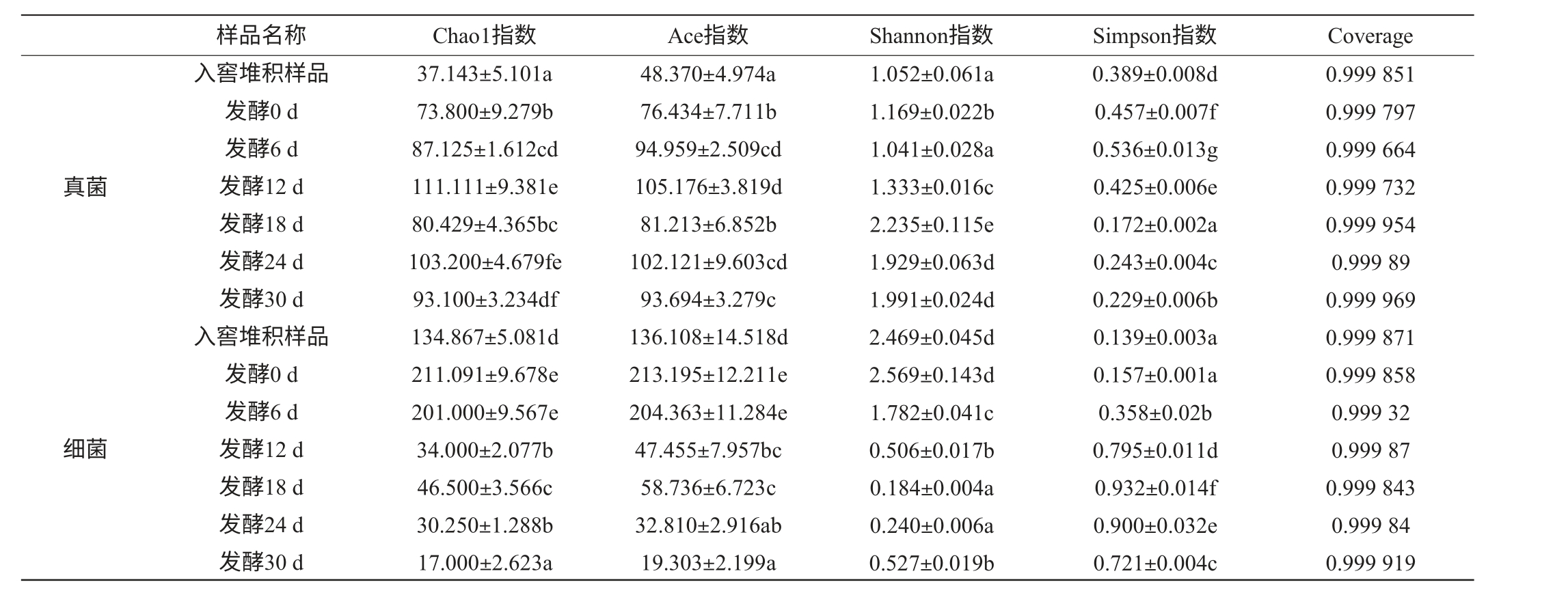
注:同列不同字母表示差异显著(P<0.05)。
真菌细菌样品名称 Chao1指数 Ace指数 Shannon指数 Simpson指数 Coverage入窖堆积样品发酵0 d发酵6 d发酵12 d发酵18 d发酵24 d发酵30 d入窖堆积样品发酵0 d发酵6 d发酵12 d发酵18 d发酵24 d发酵30 d 37.143±5.101a 73.800±9.279b 87.125±1.612cd 111.111±9.381e 80.429±4.365bc 103.200±4.679fe 93.100±3.234df 134.867±5.081d 211.091±9.678e 201.000±9.567e 34.000±2.077b 46.500±3.566c 30.250±1.288b 17.000±2.623a 48.370±4.974a 76.434±7.711b 94.959±2.509cd 105.176±3.819d 81.213±6.852b 102.121±9.603cd 93.694±3.279c 136.108±14.518d 213.195±12.211e 204.363±11.284e 47.455±7.957bc 58.736±6.723c 32.810±2.916ab 19.303±2.199a 1.052±0.061a 1.169±0.022b 1.041±0.028a 1.333±0.016c 2.235±0.115e 1.929±0.063d 1.991±0.024d 2.469±0.045d 2.569±0.143d 1.782±0.041c 0.506±0.017b 0.184±0.004a 0.240±0.006a 0.527±0.019b 0.389±0.008d 0.457±0.007f 0.536±0.013g 0.425±0.006e 0.172±0.002a 0.243±0.004c 0.229±0.006b 0.139±0.003a 0.157±0.001a 0.358±0.02b 0.795±0.011d 0.932±0.014f 0.900±0.032e 0.721±0.004c 0.999 851 0.999 797 0.999 664 0.999 732 0.999 954 0.999 89 0.999 969 0.999 871 0.999 858 0.999 32 0.999 87 0.999 843 0.999 84 0.999 919
由表2可知,7个样品真菌的Chao1指数在37.143~111.111,呈现先增大后降低趋势;Ace指数在48.370~105.176,丰富度最高的是发酵12 d样品,但与发酵6 d和发酵24 d不具有显著差异(P>0.05),入窖堆积样品显著低于其他样品(P<0.05)。样品的Shannon指数在1.052~2.235;Simpson 指数在0.172~0.536,多样性最高的是发酵18 d样品,最低的是发酵6 d样品。
由表2可知,7个样品细菌的Chao1 指数在17.0 ~211.091之间,呈逐渐降低趋势;Ace指数在19.303~213.195,丰富度最高的是发酵0 d样品,但与发酵6 d样品不具有显著差异(P>0.05),发酵24 d与发酵30 d样品显著低于其他样品(P<0.05),但二者之间不具有显著差异(P>0.05)。样品的Shannon指数在0.184~2.569;Simpson指数在0.139~0.932,发酵0 d与入窖堆积样品多样性最高, 但二者不具有显著差异(P>0.05),发酵18 d显著低于其他样品(P<0.05)。所有样品的Coverage均>0.999, 表明测序深度已经基本覆盖到样本中所有的物种。
2.5 不同发酵时期酒醅样品及原酒理化指标测定
不同发酵时期酒醅样品理化指标测定结果见图3。 由图3a可知,随着发酵时间的增加,酒醅中的水分含量逐渐增加,增幅10.54%,微生物的生长繁殖和物质代谢都伴随着水分的生成和消耗,水分在整个测量过程呈上升趋势,由此可见发酵过程中产生的水分要大于消耗的水分。发酵前6 d水分含量由56.2%增加至58.8%,主要由于菌群快速繁殖,产生较多的代谢水,水的含量增加较快。 发酵6~24 d,水分含量增加减缓,主要由于氧气的消耗,酒精度的增加,导致部分微生物死亡,代谢产生的水有所减少。发酵后6 d酒醅中水分含量上升最快,可以推测微生物在这段时间活动比较旺盛。
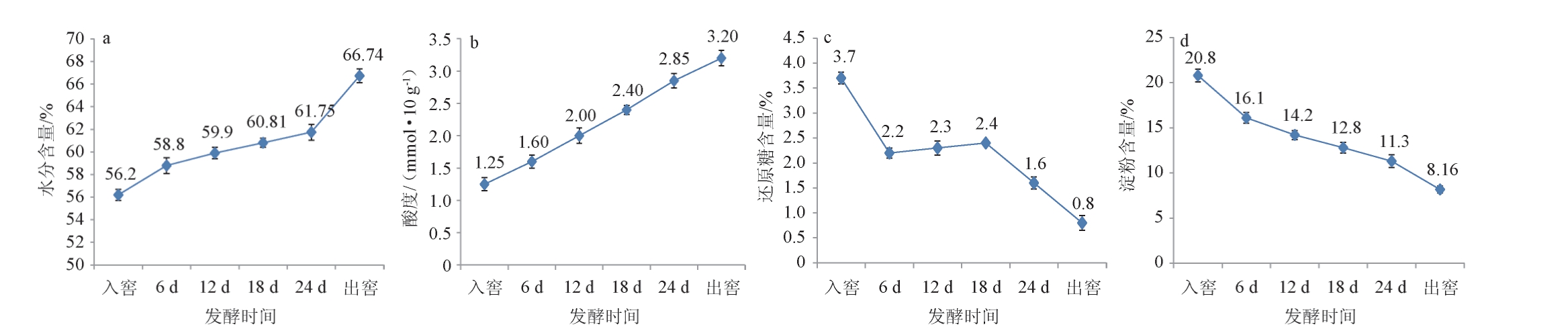
图3 不同发酵时间酒醅样品的理化指标测定结果
Fig.3 Determination results of physicochemical indexes of fermented grains samples at different fermentation time
酒醅中酸度主要来源于部分微生物产酸代谢和脂肪、淀粉、蛋白质的降解。酸度是决定白酒质量的关键因素之一。窖池中适当的酸度可以抑制部分有害杂菌的生长繁殖,促进呈香呈味物质的形成,参与酯化过程。然而,窖池酸度过高,会使发酵缓慢,产酒率降低[31]。 由图3b可知,发酵过程中酸度呈现持续上升的趋势,酸度由入窖时的1.25 mmol/10 g增加到出窖的3.2 mmol/10 g,酸度增幅1.95 mmol/10 g。发酵前期霉菌、酵母菌大量增殖在酒醅中占据主导地位,产酸菌利用前期生成的还原糖和乙醇产生较多的酸,中后期随着营养物质及氧的消耗,酵母菌逐渐衰亡,此时部分厌氧及兼性厌氧细菌大量增殖产生多种有机酸,使得酒醅酸度持续升高。
白酒酿造过程中,糟醅中淀粉和还原糖含量的动态变化既间接反映了乙醇生成和发酵状态,也显示了糟醅中微生物代谢活性。由图3c可知,随着发酵的时间增加,酒醅中的还原糖含量逐渐减少,还原糖降幅2.9%。发酵前6 d,还原糖减少很快,可见在发酵的前期还原糖被酵母菌和一些产酸菌大量利用导致产糖的减少,使还原糖快速下降;发酵6~18 d还原糖有少量增加,说明酒醅中的菌群糖化作用非常明显,产生的还原糖略高于消耗的。 发酵18~30 d,还原糖快速降低,推测酒精的积累对糖化酶的抑制作用,消耗量明显大于产生量。由图3d可知,随着发酵的时间增加,酒醅中的淀粉含量逐渐减少,淀粉消耗12.64%。淀粉在发酵前6 d由20.8%降至16.1%,消耗量比较大,这是因为菌群的糖化作用消耗了大量的淀粉;发酵6~24 d下降趋势减缓,由16.1%下降至11.3%,一方面因为酸度以及酒精度的增大,抑制了淀粉酶的作用,另一方面可能是由于窖池氧气的减少导致霉菌大量死亡,糖化作用减弱。发酵24~30 d,淀粉含量继续快速下降,推测可能由于厌氧菌或兼性厌氧菌的繁殖,加速了淀粉的消耗。
原酒理化指标测定结果为总酸1.42 g/L,总酯3.81 g/L,酒精度66.7%vol。山东扳倒井股份有限公司评酒团队对酒样进行品评:闻香带糟香,稍带青味,较醇和,后味较长,带甜香,较细腻。
2.6 原酒中挥发性风味物质GC-MS分析结果
通过GC-MS对原酒中挥发性风味物质进行检测,结果见表3。由表3可知,原酒酒样中共检测出56种挥发性风味物质,其中酯类27种,酸类9种,醇类11种,烷类3种,其他6种。参考相关文献,其中具有挥发性风味的物质41种,OAV>1的有两种,正己酸乙酯OAV为6.326 2,辛酸乙酯OAV为1.725 7。正己酸乙酯具有甜香,水果香,窖香,青瓜香;辛酸乙酯具有梨子香,荔枝香,水果香,甜香,百合花香等气味。此两种物质为原酒中关键风味化合物,对样品总体香气贡献较大。
表3 原酒样品中挥发性风味成分GC-MS检测结果
Table 3 GC-MS determination results of volatile flavor components in original liquor samples
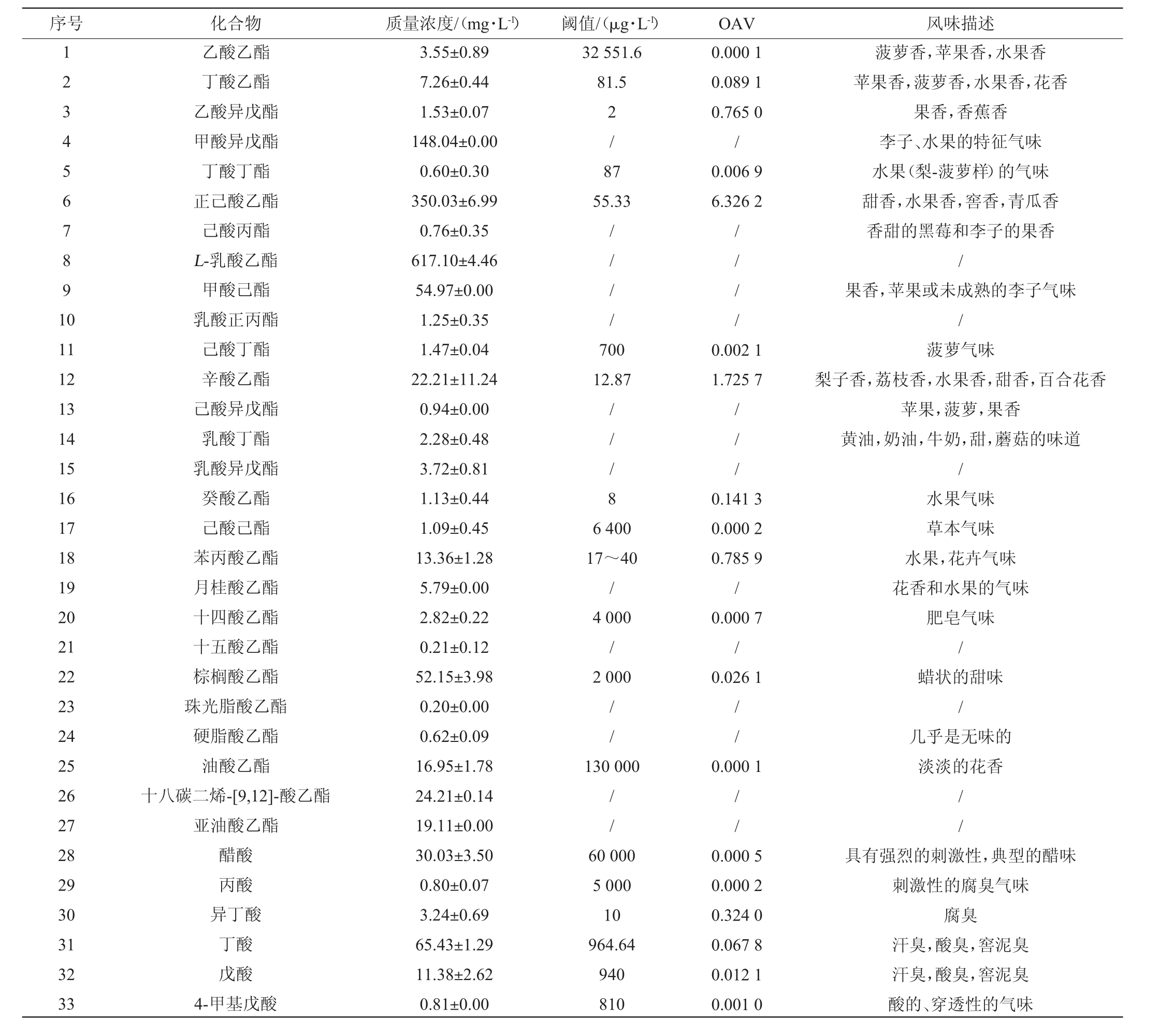
序号 化合物 质量浓度/(mg·L-1) 阈值/(μg·L-1) OAV 风味描述12 34 56 7891 0 32 551.6 81.5 2/ 8 7 55.33 0.000 1 0.089 1 0.765 0/0.006 9 6.326 2乙酸乙酯丁酸乙酯乙酸异戊酯甲酸异戊酯丁酸丁酯正己酸乙酯己酸丙酯L-乳酸乙酯甲酸己酯乳酸正丙酯己酸丁酯辛酸乙酯己酸异戊酯乳酸丁酯乳酸异戊酯癸酸乙酯己酸己酯苯丙酸乙酯月桂酸乙酯十四酸乙酯十五酸乙酯棕榈酸乙酯珠光脂酸乙酯硬脂酸乙酯油酸乙酯十八碳二烯-[9,12]-酸乙酯亚油酸乙酯醋酸丙酸异丁酸丁酸戊酸4-甲基戊酸3.55±0.89 7.26±0.44 1.53±0.07 148.04±0.00 0.60±0.30 350.03±6.99 0.76±0.35 617.10±4.46 54.97±0.00 1.25±0.35 1.47±0.04 22.21±11.24 0.94±0.00 2.28±0.48 3.72±0.81 1.13±0.44 1.09±0.45 13.36±1.28 5.79±0.00 2.82±0.22 0.21±0.12 52.15±3.98 0.20±0.00 0.62±0.09 16.95±1.78 24.21±0.14 19.11±0.00 30.03±3.50 0.80±0.07 3.24±0.69 65.43±1.29 11.38±2.62 0.81±0.00// / /// / /11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 700 12.87 0.002 1 1.725 7// / 8// /6 400 17~40/4 000/2 000 0.141 3 0.000 2 0.785 9/0.000 7/0.026 1菠萝香,苹果香,水果香苹果香,菠萝香,水果香,花香果香,香蕉香李子、水果的特征气味水果(梨-菠萝样)的气味甜香,水果香,窖香,青瓜香香甜的黑莓和李子的果香/果香,苹果或未成熟的李子气味/菠萝气味梨子香,荔枝香,水果香,甜香,百合花香苹果,菠萝,果香黄油,奶油,牛奶,甜,蘑菇的味道/水果气味草本气味水果,花卉气味花香和水果的气味////130 000 0.000 1肥皂气味/蜡状的甜味/几乎是无味的淡淡的花香//////60 000 5 000 10 964.64 940 810 0.000 5 0.000 2 0.324 0 0.067 8 0.012 1 0.001 0具有强烈的刺激性,典型的醋味刺激性的腐臭气味腐臭汗臭,酸臭,窖泥臭汗臭,酸臭,窖泥臭酸的、穿透性的气味
续表

序号 化合物 质量浓度/(mg·L-1) 阈值/(μg·L-1) OAV 风味描述34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56己酸辛酸棕榈酸异丁醇仲戊醇R(-)-2-戊醇丁醇戊醇异戊醇己醇3-甲基-2-丁醇2,6-二甲基-4-庚醇糠醇苯乙醇2-甲基-2-丁烯1,1-二乙氧基-3-甲基丁烷2-正戊基呋喃1,1,3-三乙氧基丙烷糠醛对甲酚植酮正二十一烷油酸酰胺150.18±10.48 3.16±0.23 12.12±7.22 35.67±19.51 0.98±0.00 0.28±0.06 164.07±60.90 273.63±0.00 138.14±0.00 48.54±21.68 1.54±0.00 16.07±0.00 8.30±1.75 3.87±0.00 1.88±0.25 25.34±0.69 0.09±0.01 0.71±0.07 9.77±4.79 0.98±0.64 0.50±0.00 0.10±0.00 2.42±0.00 2 517.16 2 701.23 10 000 360 0.059 7 0.001 2 0.001 2 0.099 1////2 733.35 160 0 179 190.83 200 410 1 300 1 000~2 000 1 200 0.060 0 0.171 0 0.000 8 0.242 7 0.003 8 0.012 4 0.008 3 0.003 2乳酪酸香奶酪苦涩味轻微的特色气味穿透型,不愉快的气味酒味,空灵的气味/水果香醇香状甜而怡人的气味和烧焦的味道水果香、花香、臭水果的气味和芳香的味道果香清新的气味/煮熟的糖味道玫瑰气味// 6 /////280 55 0.015 0/0.034 9 0.017 8水果气味、绿豆、金属和蔬菜的气味/环醛典型的穿透性气味具有酚类气味的特征// /// /// /
3 结论
本研究对国井白酒窖池发酵中微生物群落结构及风味物质的进行了研究,通过可培养技术共分离获得14种微生物,涵盖11个属,其中真菌5种,分别为谢瓦曲霉(Aspergillus chevalieri)、酿酒酵母(Saccharomyces cerevisiae)、发酵毕赤酵母(Pichia fermentans)、横梗霉属(Lichtheimia sp.)和Trichomonascus ciferrii;细菌9种,分别为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)、布氏慢生乳杆菌(Lentilactobacillus buchneri)、啄木鸟肠球菌(Enterococcus phoeniculicola)、成团泛菌(Pantoea agglomerans)、植物乳杆菌(Lactobacillus plantarum)、短发酵乳杆菌(Levilactobacillus brevis)、希尔加德慢生乳杆菌(Lentilactobacillus hilgardii)和高原芽孢杆菌(Bacillus altitudinis)。通过高通量测序发现真菌优势菌主要有发酵毕赤酵母(Pichia fermentans)、橙色嗜热子囊菌(Thermoascus aurantiacus)、谢瓦曲霉(Aspergillus chevalieri)、棉毛状嗜热霉(Thermomyces lanuginosus)、东方伊萨酵母(Issatchenkia orientalis)同物异名为库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)、少孢毕赤酵母(Pichia exigua)与臭曲霉(Aspergillus foetidus);细菌优势菌主要有金山醋酸乳杆菌(Acetilactobacillus jinshanensis)、耐酸乳杆菌(Lactobacillus acetotolerans)、解淀粉芽孢杆菌(Bacillus amyloliquefa ciens)、考氏科萨克氏菌(Kosakonia cowanii)、魏斯氏菌(Weissella confuse)、乳杆菌属(Lactobacillus sp.)、鸡葡萄球菌(Staphylococcus gallinarum)、巴氏醋杆菌(Acetobacter pasteurianus)、小片球菌(Pediococcus parvulus)、桥乳杆菌(Lactobacillus pontis)和发酵乳杆菌(Lactobacillus fermentum)。通过对不同发酵时间样品理化指标测定,水分含量增幅10.54%,酸度增幅1.95,还原糖降幅2.9%,淀粉消耗12.64%。通过GC-MS分析,共检测出56种挥发性风味物质,其中酯类27种,酸类9种,醇类11种,烷类3种,其他类6种。采用气味活度值评价了各化合物对样品总体风味的贡献,发现正己酸乙酯和辛酸乙酯OVA较大,是原酒中关键风味化合物,对总体风味起到主要贡献。
[1]王琳.茅台产区酱香白酒窖池发酵酒醅微生物菌群结构特征分析[D].贵阳:贵州大学,2021.
[2]周新虎,陈翔,杨勇,等.浓香型白酒窖内参数变化规律及相关性研究(I):理化参数[J].酿酒科技,2012(4):39-43.
[3]刘雯雯.酱香型白酒酒醅中真菌资源与多样性的研究[D].齐齐哈尔:齐齐哈尔大学,2012.
[4] CHEN B, WU Q, XU Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotaiflavor liquor[J].Int J Food Microbiol,2014,179:80-84.
[5]任海伟,孙一帆,王希,等.不同窖龄及位置浓香型白酒窖泥中细菌群落结构的差异性分析[J].食品与发酵工业,2023,49(9):103-111.
[6]胡小霞,黄永光,涂华彬,等.酱香型白酒一轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[7]DAI Y J,TIAN Z Q,MENG W N,et al.Microbial diversity and physicochemical characteristics of the Maotai-flavored liquor fermentation process[J].J Nanosci Nanotechno,2020,20:4097-4109.
[8]刘明,徐姿静,钟其顶,等.白酒中风味物质阈值测定方法的比较[J].中国食品学报,2018,18(4):253-260.
[9]O'DONNELL K.Fusarium and its near relatives fungal holomorph mitotic meiotic & pleomorphic speciation in fun-gal systematic[M].California:International,1993:225-233.
[10]WHITE T J,BRUNS T D,LEE S B,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M].Cambridge:Academic Press inc.,1990:315-322.
[11]ZHANG X L,TIAN X Q,MA L Y,et al.Biodiversity of the symbiotic bacteria associated with toxic marine dinoflagellate Alexandrium tamarense[J].J Biosci Med,2015,3(6):23-28.
[12]乔宗伟,张霞,施思,等.不同感官质量曲药在培曲过程中理化指标变化规律研究[J].中国酿造,2016,35(10):116-119.
[13]周健,郭志,明红梅,等.优质中高温浓香型大曲主要香味成分的初步研究[J].酿酒科技,2014(4):11-14.
[14]GARCÍA-GONZÁLEZ D L,TENA N,APARICIO-RUIZ R,et al.Relationship between sensory attributes and volatile compounds qualifying dry-cured hams[J].Meat Sci,2008,80(2):315-325.
[15]BOLYEN E,RIDEOUT J R,DILLON M R,et al.Reproducible,interactive,scalable and extensible microbiome data science using QIIME 2[J].Nat Biotechnol,2019,37:852-857.
[16]CALLAHAN B J,MCMURDIE P J,ROSEN M J,et al.DADA2:Highresolution sample inference from Illumina amplicon data[J].Nat Method,2016,13:581-583.
[17]尚柯,韩兴林,王德良,等.酱香白酒高温堆积酒醅挥发性风味物质的检测分析[J].中国酿造,2016,35(2):139-143.
[18]黄晓宁,黄晶晶,李兆杰,等.浓香型和酱香型大曲微生物多样性分析[J].中国酿造,2016,35(9):33-37.
[19]胡佳音,周森,赵卫鹏,等.清、浓、酱三种大曲真菌多样性初步分析[J].酿酒科技,2016(8):87-90.
[20]张荣,徐岩,范文来,等.酱香大曲中地衣芽孢杆菌及其特征风味代谢产物的分析研究[J].工业微生物,2010,40(3):7-12.
[21]庄名扬,孙达孟.酱香型白酒高温堆积糟醅中酵母菌分离、选育及其分类学鉴定[J].酿酒,2003,30(2):12-13.
[22]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[23]余婷婷,赖世强,曹文涛,等.酱香型白酒高温堆积糟醅中耐高温酵母的筛选及鉴定[J].酿酒科技,2014(6):24-26.
[24]文鹤,刘江崟,胡祥飞,等.一株产香酵母Trichomonascus ciferrii的分离鉴定及其纯种发酵豆豉的挥发性成分分析[J].食品与发酵工业,2021,47(16):152-158.
[25]王玉荣,葛东颖,蔡文超,等.低温大曲真菌菌群结构解析及其风味品质评价[J].食品与发酵工业,2023,49(14):229-234.
[26]李斌斌,李宇辉,刘战霞,等.植物乳杆菌与酿酒酵母混合发酵对红枣酒挥发性风味物质的影响[J].食品工业科技,2023,44(8):170-179.
[27]孙佳.金山醋酸乳杆菌比较基因组分析与酿醋功能评价[D].无锡:江南大学,2021.
[28]赵皓静,冯婧煕,王晓丹,等.一株耐酸乳杆菌Lactobacillus acetotolerans FBKL1.0204的筛选鉴定及耐酸、产酸特性[J].食品与发酵工业,2022,48(19):50-57.
[29]章宇丹,温雪瓶,李丽,等.考氏科萨克氏菌产阿魏酸酯酶条件优化、酶学性质及其初步应用[J].中国酿造,2021,40(2):47-52.
[30]刘境,李福君.魏斯氏菌在发酵食品中的应用研究[J].食品安全导刊,2020(33):181.
[31]高玲,许冠生,张磊,等.浓香型白酒糟醅发酵过程中主要参数的跟踪研究[J].酿酒科技,2018(1):47-53.