随着世界人口的迅速增长,人们对畜牧产品的需求也不断增加,这就需要通过饲喂高精饲料来提高动物产量[1],然而这容易导致动物代谢紊乱,进而产生疾病[2]。因此,有必要使用饲料添加剂来改善动物健康[3]。
在全球“禁抗”背景下,益生菌成为反刍动物营养学家和微生物学家关注的焦点。益生菌能够改变瘤胃或后肠中的微生物种群,改变其发酵模式,并提高饲料消化率[4]。酵母作为常用的益生菌,含有多种蛋白质、氨基酸、维生素和微量元素等,营养成分十分丰富[5]。研究表明,补充酵母可以增加反刍动物的饲料摄入量和生长速度[6-7]以及改善肉奶品质等[8-9]。丁洪涛等[10]研究发现,饲粮中添加产朊假丝酵母可以提高奶牛瘤胃氨态氮和总挥发性脂肪酸含量,改善瘤胃发酵。MAAMOURI O等[11]在反刍动物饲料中添加酿酒酵母(Saccharomyces cerevisiae)使育肥犊牛平均日质量增加400 g,极大地改善了育肥犊牛的生长性能和饲料转化率。酵母还能通过与乳酸产生菌(如牛链球菌)相互竞争发酵底物,减少乳酸的产生,同时刺激乳酸利用菌(如埃氏巨型球菌和反刍兽月形单胞菌)的生长[12-13],降低乳酸的积累,从而稳定瘤胃pH。此外,酵母还有提高免疫力[14]、改善繁殖性能[15]和清除瘤胃氧气[16]等作用。薛帅帅等[17]研究发现,饲粮中添加布拉氏酵母可以降低犊牛血清白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)含量,增强机体免疫功能。VILLOT C等[18]研究发现,补充1×1010 CFU/d的布拉氏酵母菌可将腹泻率从69.1%降至50.0%。因此,合理利用酵母作为饲料添加剂,对反刍动物的提质增效和健康养殖具有重要的现实意义[19]。
本研究通过对3株反刍酵母(编号分别为YL-1,YQ-1,FG-1)的耐乳酸、耐胆盐和产气性能进行比较,筛选出综合性能最佳的菌株,并对筛选菌株进行鉴定。然后通过单因素试验和响应面试验,得到其最佳培养基配方和最适培养条件,以期为该菌株的微生态制品生产和工业化应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种反刍酵母YL-1、AQ-1、FG-1(均已证实对反刍动物具有益生功能):法国乐斯福公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20.0 g/L,酵母粉10.0 g/L,蛋白胨20.0 g/L。121 ℃高压蒸汽灭菌20 min。
YPD固体培养基:YPD液体培养基中添加琼脂粉20.0 g/L。121 ℃高压蒸汽灭菌20 min。
基础发酵培养基:蔗糖74.0 g/L,玉米浆干粉52.0 g/L,MgSO4 1.1 g/L。121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
乳酸、葡萄糖、蔗糖、麦芽糖、乳糖、NaCl、CaCl2、MgSO4、MnSO4、NH4Cl、NaNO3、(NH4)2SO4(均为分析纯)、鱼粉蛋白胨(生化试剂):国药集团化学试剂有限公司;胰蛋白胨、酵母粉(均为生化试剂):英国Oxoid公司;琼脂、牛胆盐(均为生化试剂):北京索莱宝科技有限公司;玉米浆干粉(生化试剂):南京全隆生物技术有限公司。
1.2 仪器与设备
GR110DR高压蒸汽灭菌锅:美国致微仪器有限公司;7GI-16M高速冷冻离心机:美国赛默飞世尔科技公司;Synergy H4酶标仪:美国BioTek公司;SPX-250-Z恒温培养箱:上海跃进医疗器械厂;PHS-3C pH计:梅特勒-托利多国际股份有限公司;ZHJH-C1115B型超净工作台:上海智诚分析仪器制造有限公司。
1.3 实验方法
1.3.1 菌种活化与种子液制备
使用接种环从甘油管中蘸取少量菌液,在YPD固体培养基上划线,然后将平板置于30 ℃的恒温培养箱中培养48 h。挑取平板上的单菌落接种到斜面培养基培养48 h,再从斜面取一环接种至YPD液体培养基,培养12 h后得到活化的种子液。
1.3.2 菌体生物量测定
菌体密度测定:取发酵后的菌液稀释至合适倍数,并以原始发酵培养基为空白对照,使用酶标仪测定OD560nm值。
菌落数测定:取发酵后的菌液用无菌生理盐水进行梯度稀释,取0.2 mL稀释液涂布于固体YPD平板,培养48 h后统计菌落数。
1.3.3 耐乳酸试验
在灭菌后的YPD液体培养基中加入乳酸,分别调节pH值为3.0、4.0、5.0、6.0,然后以4%接种量接入种子液,30 ℃、180 r/min摇床培养24 h,每隔2 h取样并测定其OD560nm值。
1.3.4 耐胆盐试验
将酵母种子液接种于胆盐质量分数分别为0、0.3%、0.6%、0.9%的YPD液体培养基中,于30 ℃培养6 h,每隔2 h取样,将样品稀释至合适倍数并涂布平板,30 ℃培养48 h后统计菌落数。
1.3.5 产气试验
取种子液50 μL接入装有10 mL YPD液体培养基的试管中,倒置放入杜氏小管,以避免杜氏小管中产生气泡,置于30 ℃恒温培养箱中培养,定期观察并记录菌株的产气情况。
1.3.6 菌株分子生物学鉴定
通过上述性能比较选出综合性能最佳的菌株进行分子生物学鉴定,并作为后续试验菌株。使用基因组提取试剂盒提取菌株全基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),并以其作为模板,利用通用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')对其26S rDNA进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR产物经琼脂糖凝胶电泳检测合格后,送至上海生工生物工程有限公司进行测序。将测序结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)Gen bank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,比对结果用MEGA-X构建系统发育树。
1.3.7 培养基配方优化单因素试验
(1)碳源种类及最佳碳源添加量对菌株生长的影响
分别用20 g/L的葡萄糖、蔗糖、麦芽糖、糖蜜和乳糖替换YPD液体培养基中的碳源,保持培养基其他组分和含量不变,按4%的接种量接种种子液,在30 ℃、180 r/min的条件下培养24 h后测定菌液OD560 nm值。筛选出最适碳源后,保持其他组分不变,将其添加量设为20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L、80 g/L,进行摇瓶培养,测定菌液的OD560 nm值,以确定最佳碳源添加量。
(2)氮源种类及最佳氮源添加量对菌株生长的影响
分别用20 g/L的胰蛋白胨、鱼粉蛋白胨、酵母粉、玉米浆干粉、NaNO3、(NH4)2SO4和NH4Cl替换YPD液体培养基中的氮源,保持培养基其他组分和含量不变,培养条件和测定方法与碳源种类筛选试验相同。筛选出最适氮源后,保持其他组分不变,将其添加量设为20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L、80 g/L,摇瓶培养后测定菌液的OD560nm值,确定最佳氮源添加量。
(3)无机盐种类及最佳无机盐添加量对菌株生长的影响
分别向YPD液体培养基添加NaCl、CaCl2、K2HPO4、MgSO4和MnSO4,作为培养所需的无机盐,添加量为1 g/L,培养基其他组分和含量保持不变,培养条件和测定方法与碳源种类筛选试验相同。筛选出最适无机盐后,将其添加量设为0、0.5 g/L、1.0 g/L、3.0 g/L、5.0 g/L、7.0 g/L,保持其他组分不变,摇瓶培养后测定菌液的OD560 nm值,确定最佳无机盐添加量。
1.3.8 培养基配方优化响应面试验[20]
根据单因素试验结果,选取蔗糖添加量(A)、玉米浆干粉添加量(B)和MgSO4添加量(C)为考察因素,并以OD560nm值(Y)作为响应值,采用Design Expert 12.0软件设计3因素3水平Box-Behnken试验,Box-Behnken试验因素和水平见表1。
表1 培养基配方优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments for medium formula optimization
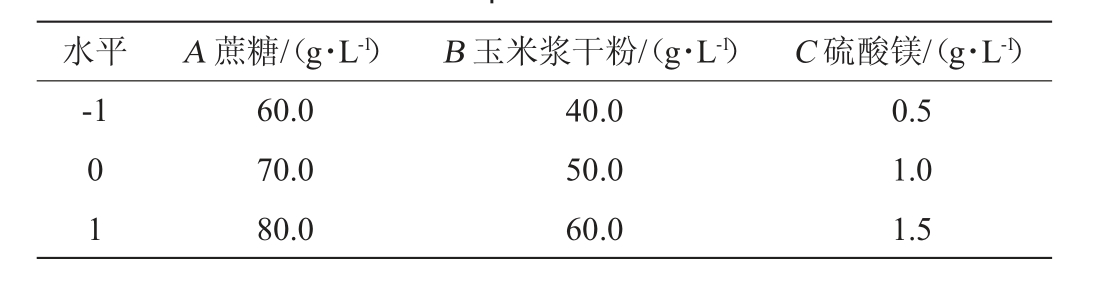
水平 A 蔗糖/(g·L-1) B 玉米浆干粉/(g·L-1) C 硫酸镁/(g·L-1)-1 0 1 60.0 70.0 80.0 40.0 50.0 60.0 0.5 1.0 1.5
1.3.9 培养条件优化
以优化培养基为基础,分别考察pH值(4.0、4.5、5.0、5.5、6.0、6.5)、培养温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃、36 ℃)、接种量(4%、6%、8%、10%、12%、14%)对菌液OD560 nm值的影响。
1.3.10 数据分析
利用Design Expert 12.0设计Box-Behnken试验,试验数据采用Origin 2022绘图。所有试验进行3次重复。
2 结果与分析
2.1 耐乳酸试验
优良的反刍酵母应能够在反刍动物胃肠道极端环境下存活,并与乳酸产生菌竞争发酵底物,从而稳定胃肠道pH及降低乳酸含量,因此需要对乳酸有较强耐受性。考察菌株的耐乳酸性,结果见图1。由图1可知,3株酵母在pH为3.0的条件下仍然能够生长,说明3株酵母都有较强的耐乳酸能力,但菌株FG-1在pH为3.0时生长迟滞期明显短于其余两株酵母,说明菌株FG-1耐乳酸性能最优。
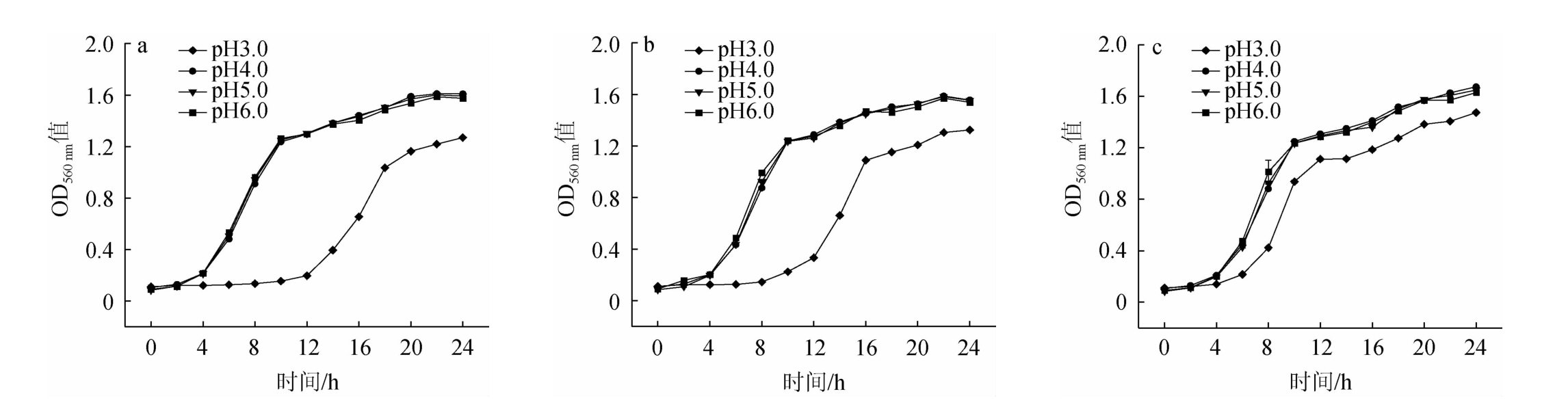
图1 菌株AQ-1(a)、YL-1(b)、FG-1(c)的耐乳酸试验结果
Fig.1 Results of lactic acid resistance tests for strains AQ-1(a), YL-1(b) and FG-1(c)
2.2 耐胆盐试验
反刍酵母需要在反刍动物胃肠道内发挥其益生作用,因此必须对胆盐等形成的高渗透压环境有较强耐受能力。分别在胆盐为0、0.3%、0.6%、0.9%的培养基中培养2 h、4 h、6 h,3株反刍酵母耐胆盐试验结果见图2。由图2可知,当胆盐含量分别为0.3%和0.6%时,菌株AQ-1和YL-1的存活数与不含胆盐相比,存活数无明显下降,而菌株FG-1的存活数有明显的下降;当胆盐含量为0.9%时,3株酵母的存活数均呈下降趋势;说明菌株AQ-1和YL-1能耐受0.6%的胆盐含量,耐胆盐效果较好,而菌株FG-1的胆盐耐受力较差。
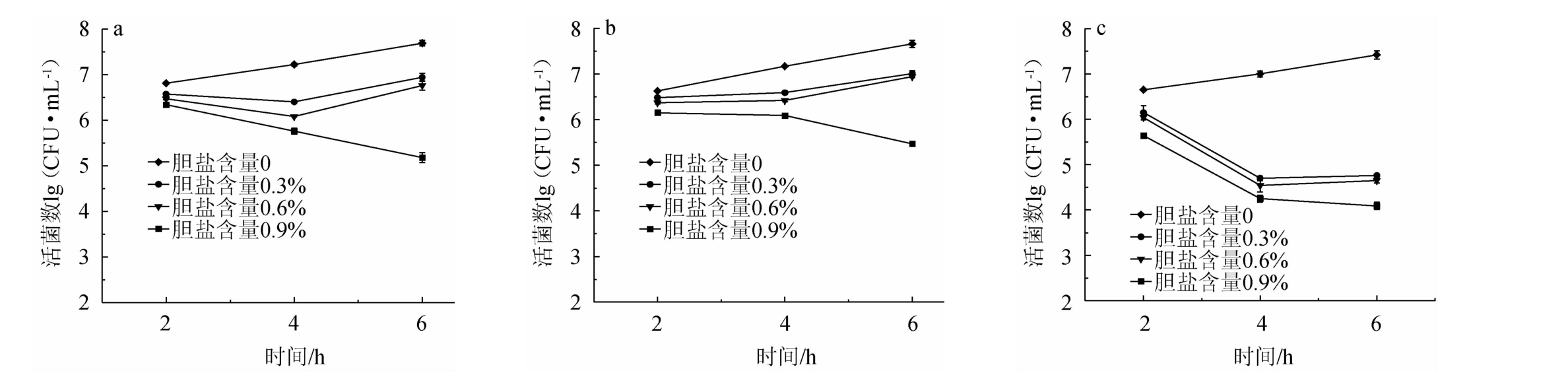
图2 菌株AQ-1(a)、YL-1(b)、FG-1(c)耐胆盐试验结果
Fig.2 Results of bile salt tolerance tests for strains AQ-1(a), YL-1(b) and FG-1(c)
2.3 产气试验
作为反刍酵母,应具备产气量小的特点,因其产气量大则会在反刍动物进食后引起腹胀,如瘤胃膨气等[21]。3株酵母的产气结果见表2。由表2可知,3株菌株均在发酵8 h后开始产气,其中以菌株AQ-1产气能力最强,发酵14 h产气量便充满整个杜氏小管,菌株YL-1产气能力次之,于发酵16 h后产气量充满杜氏小管,菌株FG-1产气能力最弱,于发酵18 h后产气量充满杜氏小管。说明菌株FG-1适宜作为反刍酵母饲喂反刍动物,而菌株AQ-1产气能力过强,不适宜饲喂反刍动物。
表2 菌株产气试验结果
Table 2 Results of gas production tests of strains
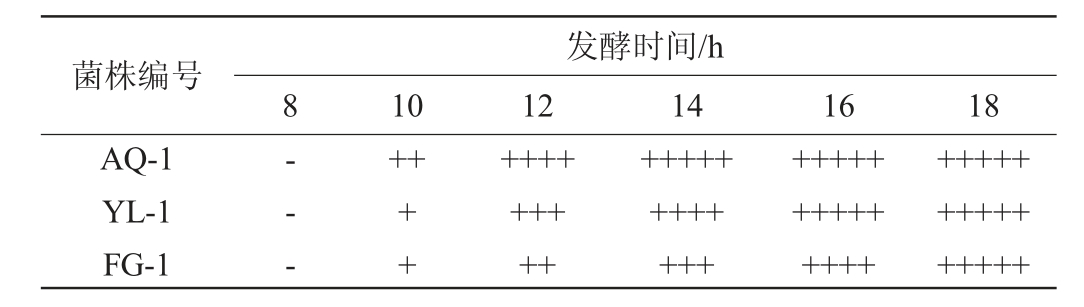
注:“-”表示杜氏小管中未出现气体;“+”表示产气量约为杜氏小管体积的l/5;“++”表示产气量约为杜氏小管体积的2/5;“+++”表示产气量约为杜氏小管体积的3/5;“++++”表示产气量约为杜氏小管体积的4/5;”+++++”表示产气量充满整个杜氏小管。
菌株编号AQ-1 YL-1 FG-1发酵时间/h 8 10 12 14 16 18-- -++++++++++++++++++++++++++++++++++++++++++++++++++++++
2.4 菌株分子生物学鉴定
经上述性能比较,3株菌株耐乳酸性能都比较优秀,但菌株FG-1胆盐耐受力较差,菌株AQ-1产气能力过强,综合性能最佳的为菌株YL-1。对菌株YL-1进行分子生物学鉴定,利用PCR技术扩增26S rDNA,经上海生工测序,测序结果在Genbank数据库中进行BLAST比对,将比对结果用MEGA-X软件绘制系统发育树,结果见图3。由图3可知,菌株YL-1与酿酒酵母(Saccharomyces cerevisiae)MT420738聚于一个分支,亲缘关系最近,在Genbank中比对的相似度也最高,相似度为100%,因此鉴定菌株YL-1为酿酒酵母(Saccharomyces cerevisiae)。
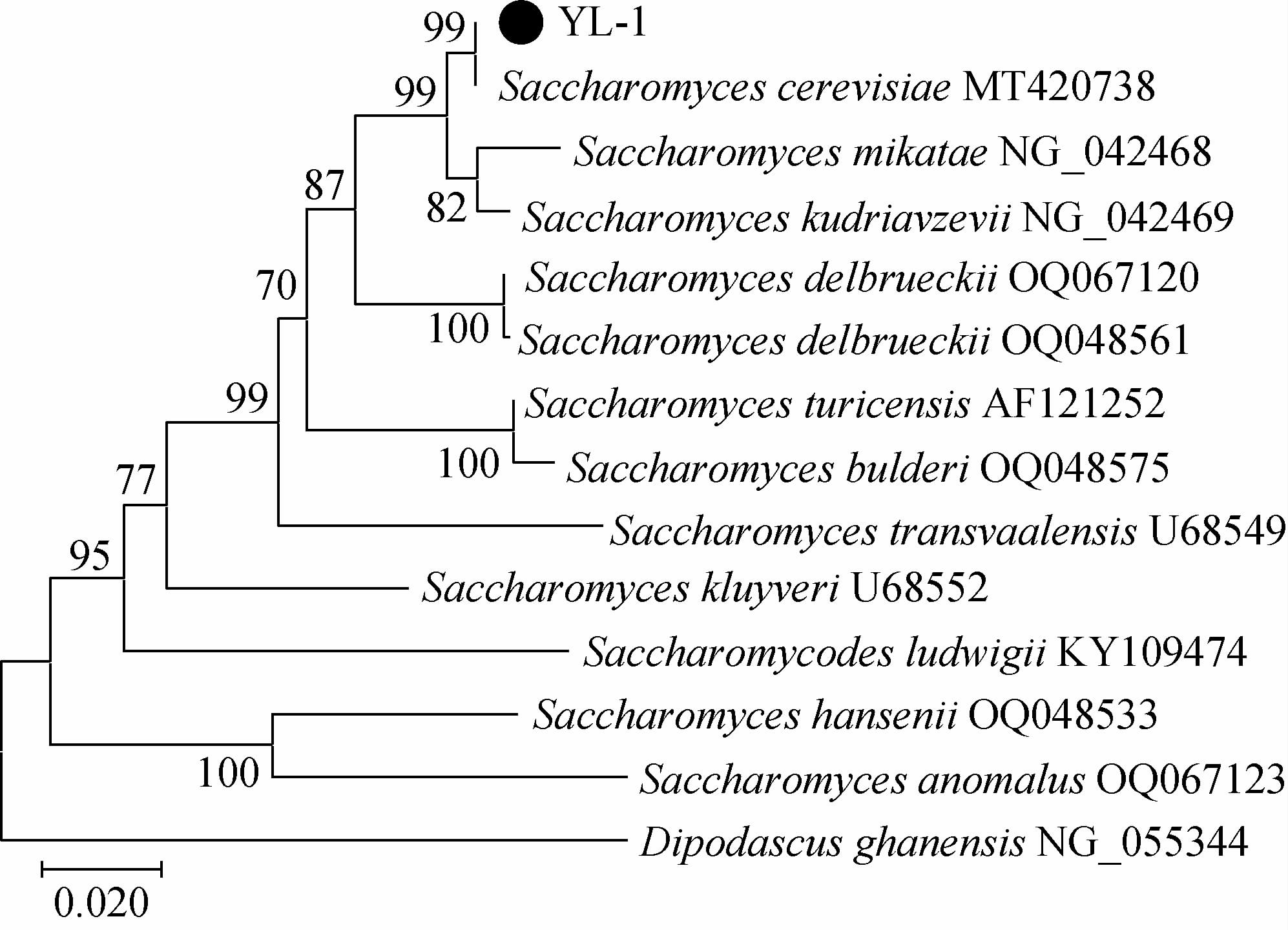
图3 基于26S rDNA基因序列菌株YL-1的系统发育进化树
Fig.3 Phylogenetic tree of strain YL-1 based on 26S rDNA gene sequence
2.5 培养基配方优化单因素试验结果
2.5.1 碳源种类及最佳碳源添加量对菌株YL-1生长的影响有机碳源是构成培养基的主要成分,对于一切异源微生物,碳源又兼做能源,是菌体生长存活必不可少的营养物质之一[22]。碳源种类及最佳碳源添加量对菌株YL-1生长的影响见图4。由图4a可知,当以麦芽糖作为碳源时,菌株YL-1的OD560 nm值最高,蔗糖次之,这表明菌株YL-1对麦芽糖的利用效率最好,但由于麦芽糖价格昂贵,考虑到经济因素,最终选择蔗糖作为最适碳源。由图4b可知,当蔗糖添加量低于70 g/L时,菌体密度随蔗糖添加量增加而增加;当蔗糖添加量高于70 g/L时,菌体生长受到抑制;当蔗糖添加量为70 g/L时,OD560nm值最高。因此,确定最适的蔗糖添加量为70 g/L。
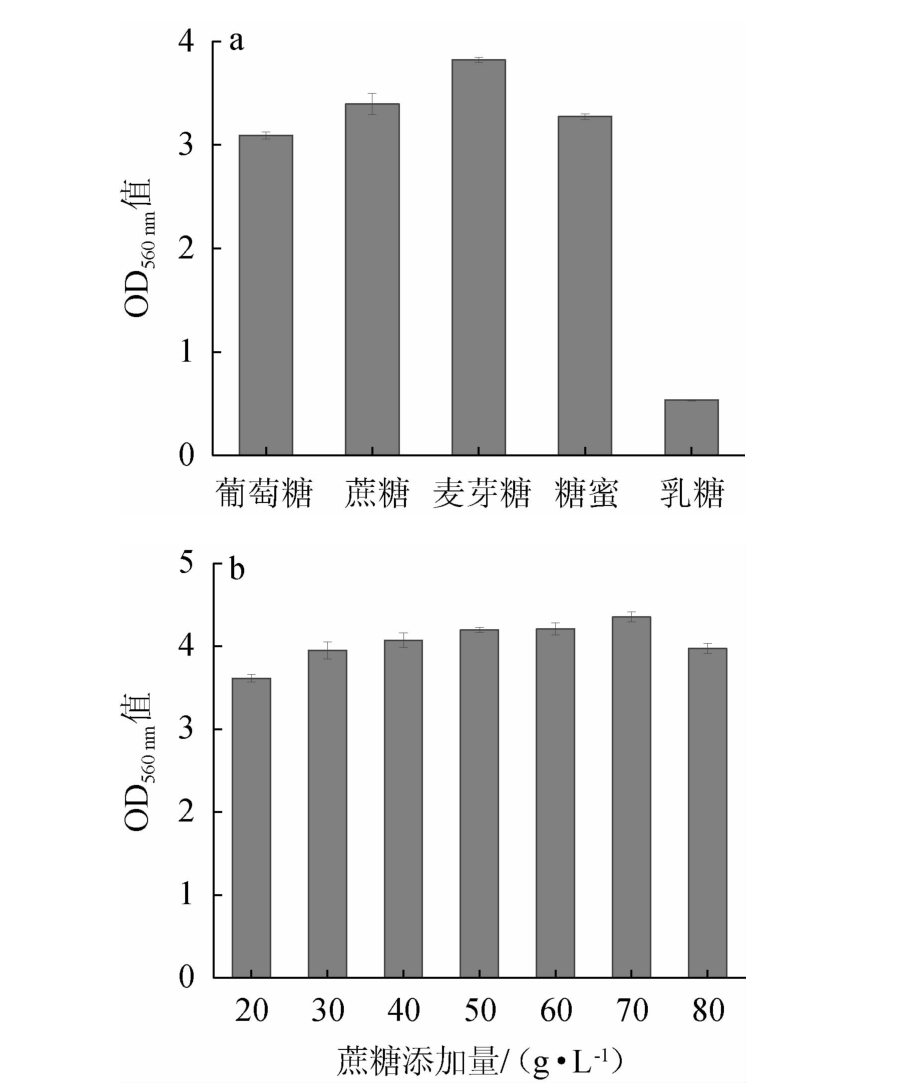
图4 碳源种类(a)及蔗糖添加量(b)对菌株YL-1生长的影响
Fig.4 Effects of carbon source types (a) and sucrose addition (b)on the growth of strain YL-1
2.5.2 氮源种类及最佳氮源添加量对菌株YL-1生长的影响
微生物生长和产物合成都需要利用氮源,主要用于氨基酸、蛋白质、核酸等和含氮代谢产物的合成[23]。不同氮源及最佳氮源添加量对菌株YL-1生长的影响见图5。由图5a可知,有机氮源的效果明显好于无机氮源,其中以玉米浆干粉的作用效果最佳。玉米浆干粉成本低廉,且富含蛋白质、氨基酸、维生素等[24],可以作为酵母繁殖所需的氮源。因此,选择其作为培养基的最适氮源。由图5b可知,随着玉米浆干粉添加量的增加,菌株YL-1的OD560nm值呈先升高后降低的趋势,当玉米浆干粉添加量为50 g/L时,菌株YL-1的OD560 nm值最高,为4.10。因此,确定玉米浆干粉的最适添加量为50 g/L。
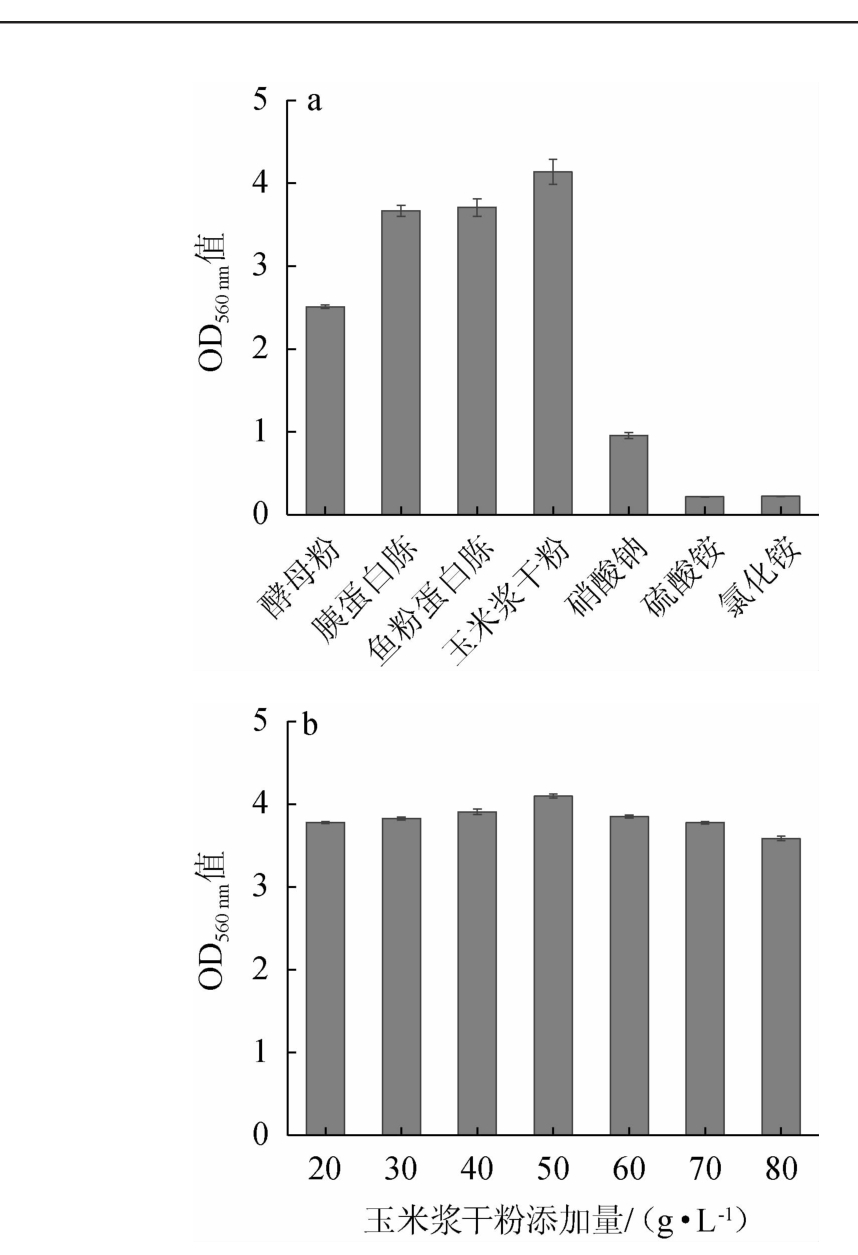
图5 氮源种类(a)及玉米浆干粉添加量(b)对菌株YL-1生长的影响
Fig.5 Effects of nitrogen source types (a) and corn steep power addition (b) on the growth of strain YL-1
2.5.3 无机盐种类及最佳无机盐添加量对菌株YL-1生长的影响
微生物的生长除了需要碳源、氮源外,还需要部分无机盐。无机盐的用量虽然很少,但因为其具有多种生理功能,对微生物的生长有重要影响[25]。无机盐种类及最佳无机盐添加量对菌株YL-1生长的影响见图6。由图6a可知,MgSO4作为无机盐对菌株YL-1的菌体生长影响显著,明显优于其他无机盐,而其他种类无机盐处理与空白对照相比,对菌株YL-1的生长均有不同程度的抑制作用。因此,选择MgSO4作为最适无机盐。由图6b可知,当MgSO4添加量为1 g/L时,菌株YL-1的菌体密度最高。当继续增加MgSO4添加量,菌体密度开始缓慢下降。因此,确定MgSO4的最适添加量为1 g/L。
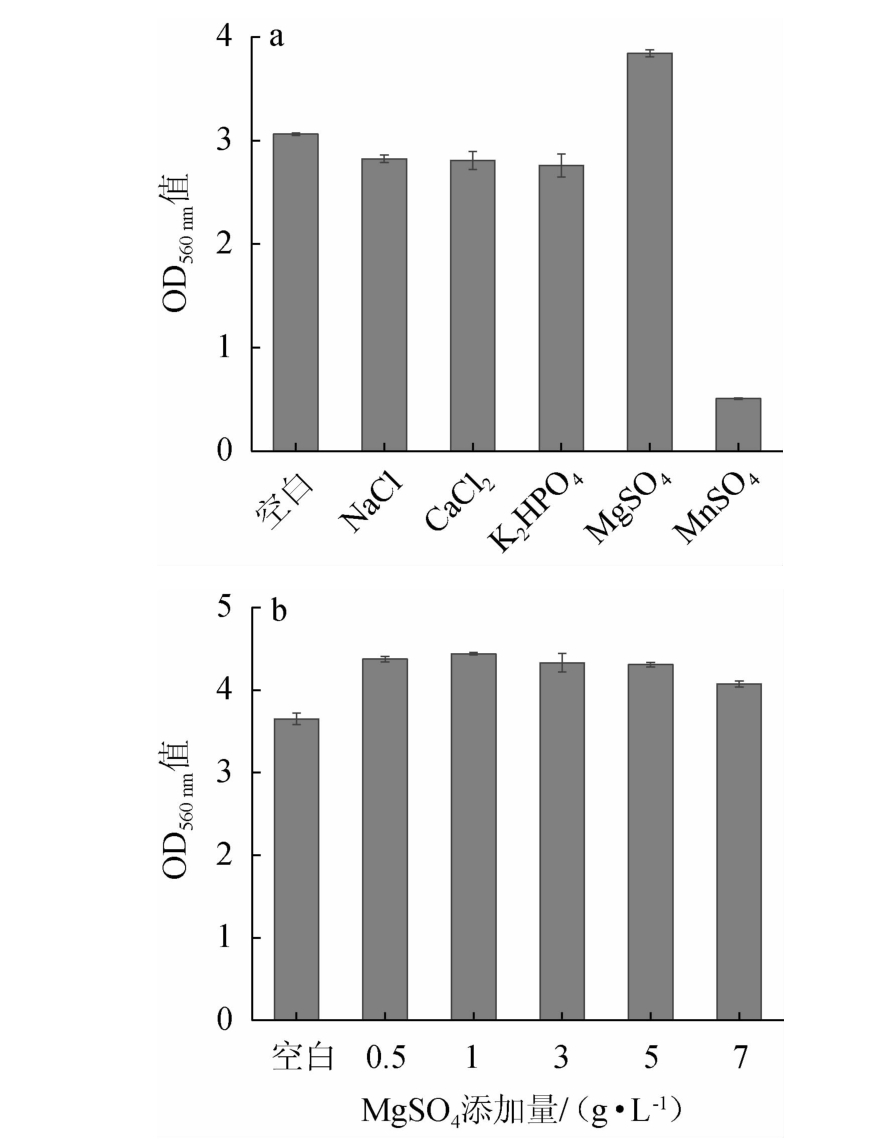
图6 无机盐种类(a)及MgSO4添加量(b)对菌株YL-1生长的影响
Fig.6 Effects of inorganic salt types (a) and MgSO4 addition (b)on the growth of strain YL-1
2.6 培养基配方优化响应面试验
2.6.1 响应面优化试验设计及结果分析
以蔗糖添加量(A)、玉米浆干粉添加量(B)和MgSO4添加量(C)为考察因素,以OD560 nm值(Y)为响应值,利用Design Expert 12.0软件进行响应面优化设计,试验设计及结果见表3,回归模型方差分析结果见表4。
表3 培养基配方优化Box-Behnken试验设计与结果
Table 3 Design and results of Box-Behnken tests for medium formula optimization
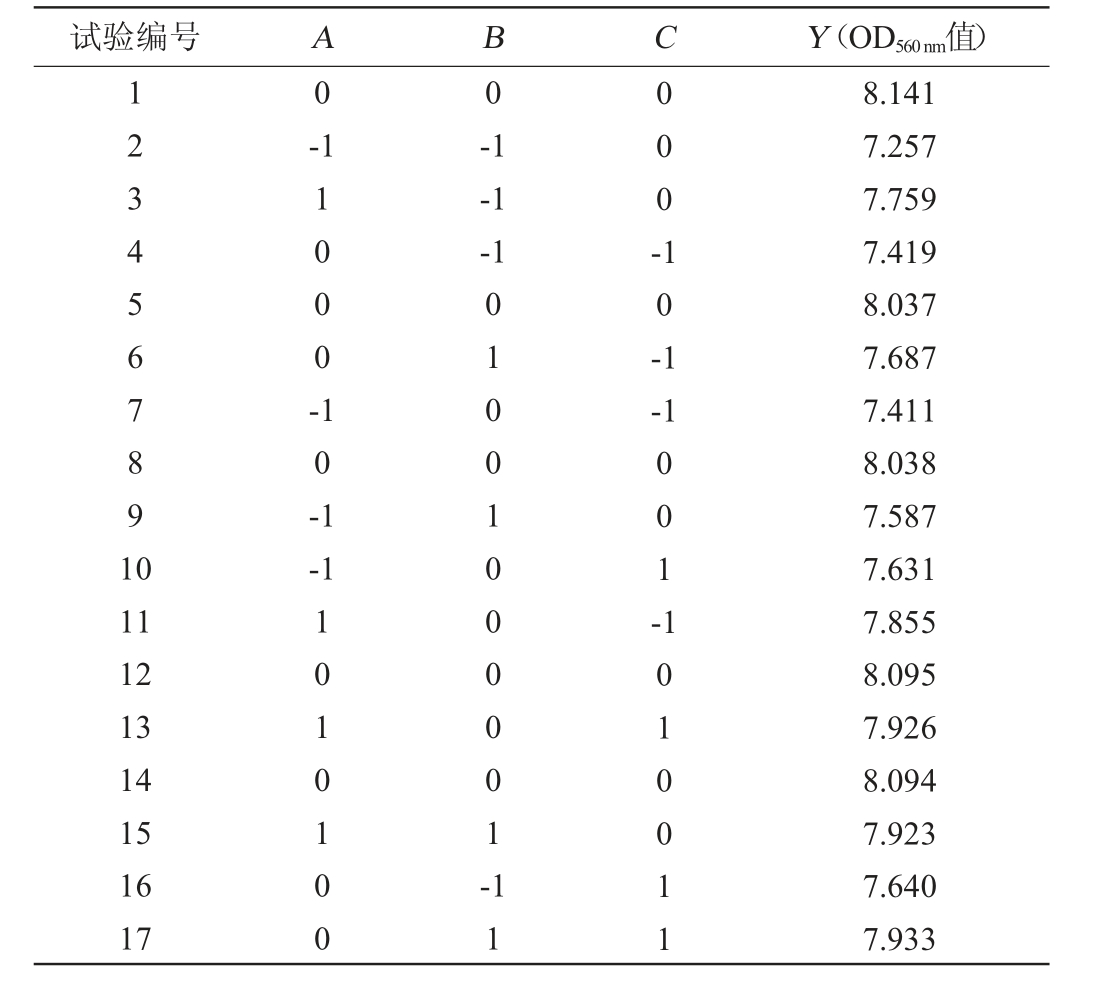
试验编号 A B C Y(OD560 nm值)1234567891 0 0 0-1 1000--1-1-1 000-10-1 10-1-1-1 11 12 13 14 15 16 17 1010100 01001000001-001-11 1010011 8.141 7.257 7.759 7.419 8.037 7.687 7.411 8.038 7.587 7.631 7.855 8.095 7.926 8.094 7.923 7.640 7.933
表4 回归模型方差分析
Table 4 Variance analysis of the regression model
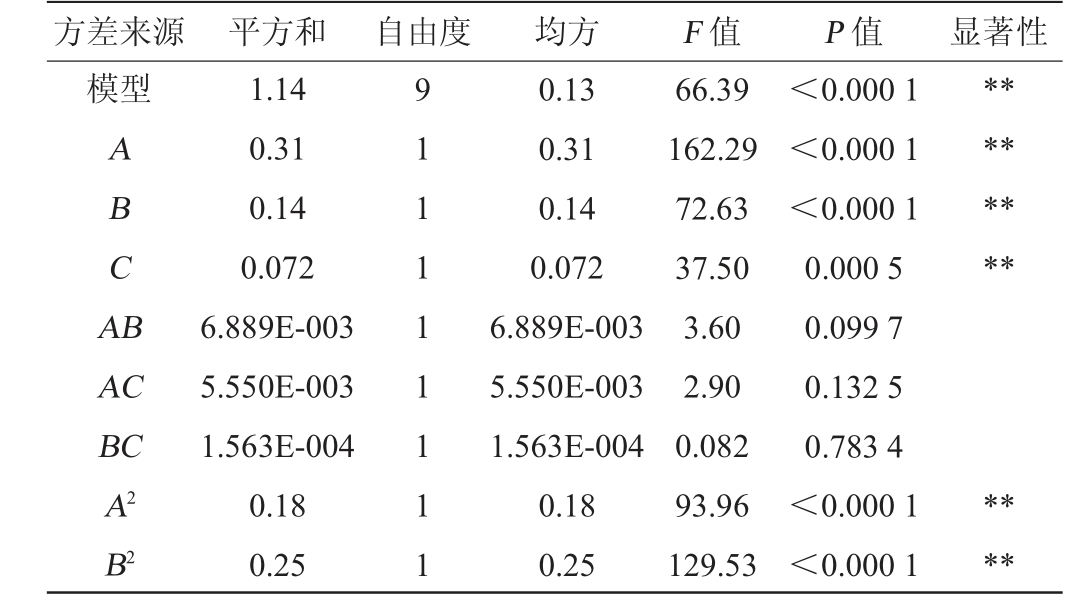
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B********AC BC A2 B2 1.14 0.31 0.14 0.072 6.889E-003 5.550E-003 1.563E-004 0.18 0.25 9 1 1 1 1 1 1 1 1 0.13 0.31 0.14 0.072 6.889E-003 5.550E-003 1.563E-004 0.18 0.25 66.39 162.29 72.63 37.50 3.60 2.90 0.082 93.96 129.53<0.000 1<0.000 1<0.000 1 0.000 5 0.099 7 0.132 5 0.783 4<0.000 1<0.000 1****
续表
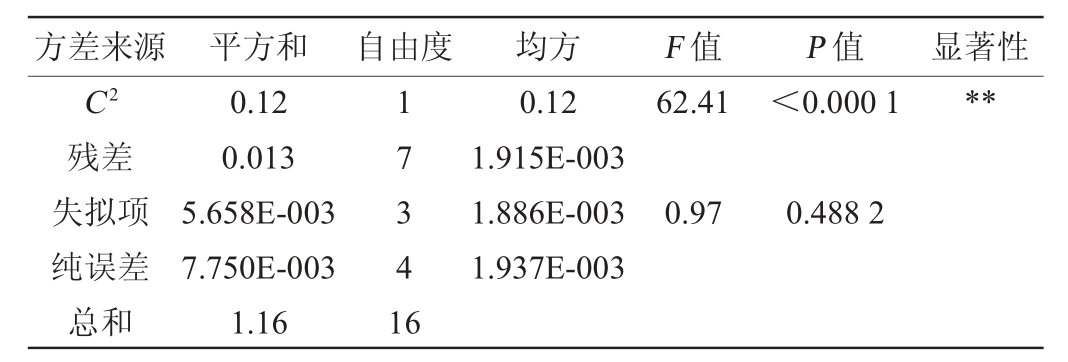
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著
(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性C2残差失拟项纯误差总和0.12 0.013 5.658E-003 7.750E-003 1.16 17341 6 0.12 1.915E-003 1.886E-003 1.937E-003 62.41<0.000 1**0.97 0.488 2
根据表3中的试验结果,通过Design Expert 12.0软件进行回归拟合分析,得到培养基配方的二次多项回归方程为
由表4结果可知,模型的P值<0.000 1,极显著;失拟项的P值>0.05,不显著;模型的决定系数R2=0.981 5,调整决定系数R2Adj=0.957 6,均>0.9,说明该模型拟合程度较好,可用于分析试验结果。由回归模型和方差分析可知,一次项A、B、C和二次项A2、B2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。
2.6.2 响应面试验结果验证
蔗糖、玉米浆干粉和MgSO4添加量3个因素之间交互作用对菌株YL-1生长影响的响应面及等高线见图7。
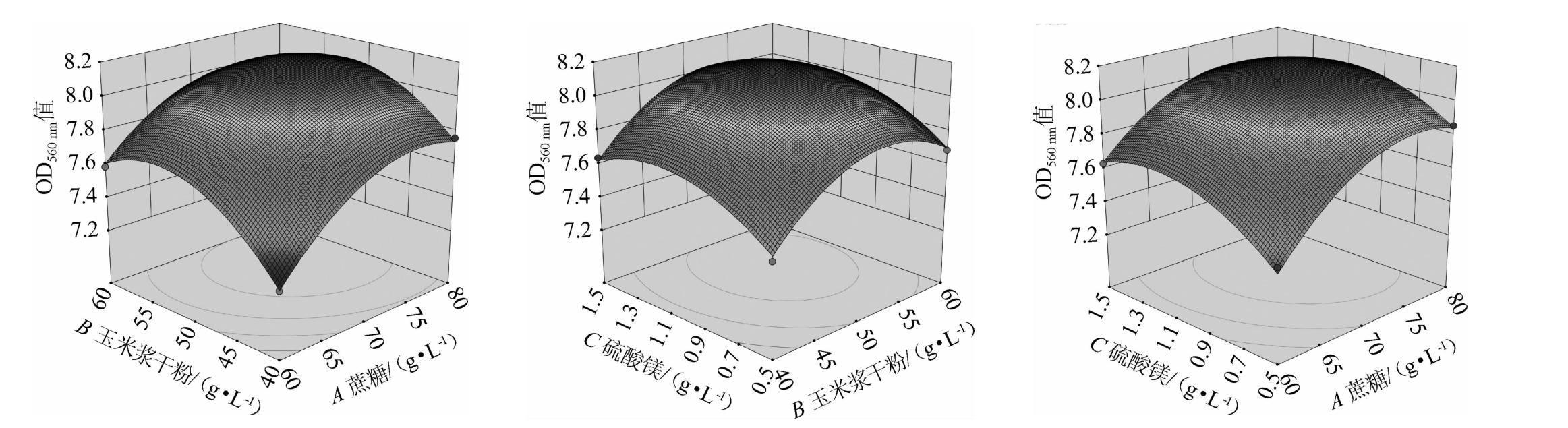
图7 各因素间交互作用对菌株YL-1生长影响的响应面及等高线
Fig.7 Response surface plots and contour lines of effects of interaction between various factors on the growth of strain YL-1
由图7可知,该方程的抛物线图形开口均向下,说明方程存在最大值。由Design Expert12.0软件对回归方程求解,得到菌体密度最大时培养基最佳组合为:蔗糖添加量74.31 g/L,玉米浆干粉添加量52.38 g/L,MgSO4添加量1.12 g/L,此时菌体密度OD560nm值预测值为8.150。考虑到实际操作的可行性,将培养基组分调整为蔗糖添加量74.0 g/L,玉米浆干粉添加量52.0 g/L,MgSO4添加量1.1 g/L。在此条件下,进行3组平行验证试验,得到菌株YL-1的OD560 nm值实际值为8.117±0.054,与预测值相差不大,说明该模型可用于预测YL-1菌体密度的变化。
2.7 菌株YL-1培养条件优化
初始pH值、培养温度和接种量对菌株YL-1生长的影响见图8。
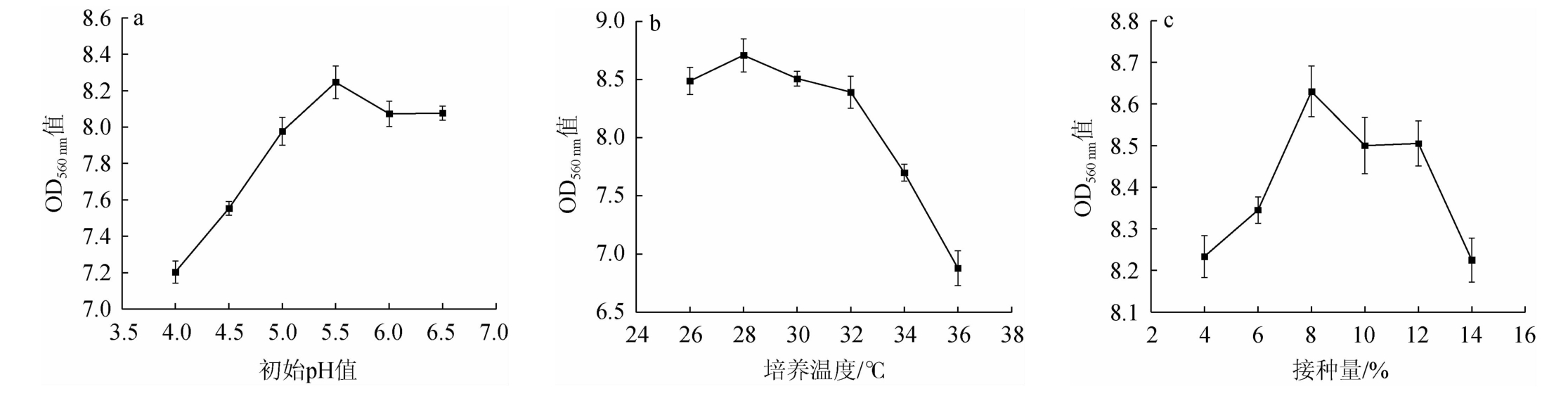
图8 初始pH值(a)、培养温度(b)和接种量(c)对菌株YL-1生长的影响
Fig.8 Effects of initial pH value (a), culture temperature (b) and inoculum (c) on the growth of strain YL-1
微生物在生长过程中都有最适pH范围,而对于许多酵母菌而言,其最适生长pH为4.5~6.5。若pH值过高或过低,均会对酵母菌的增殖产生不利影响[26]。
由图8a可知,当初始pH值在4.0~5.5范围内时,菌体密度随pH升高而增大;当初始pH值为5.5时,菌株YL-1的OD560 nm值最大为8.25;当初始pH值>5.5时,菌体密度随pH升高而降低。因此确定最适初始pH值为5.5。温度的变化会导致微生物生长和繁殖速度产生巨大变化。由图8b可知,随发酵温度升高,菌株YL-1的OD560nm值呈先升高后下降的趋势,在28 ℃时达到最大值,说明菌株YL-1的最适生长温度为28 ℃。合适的接种量能够提高发酵速度,从而缩短发酵周期,同时也有助于节约成本。由图8c可知,当接种量为8%时,菌株YL-1的OD560 nm值可达8.63,之后随接种量增大菌体密度开始降低,说明菌株YL-1最佳接种量为8%。综上所述,菌株YL-1的最适培养条件为初始pH值5.5,培养温度28 ℃,接种量8%,在此最适条件下进行培养,菌株YL-1的OD560nm值可达8.835,活菌数为3.58×108 CFU/mL,分别是初始培养条件下的2.38倍和2.20倍。
3 结论
本研究对3株反刍酵母的耐乳酸、耐胆盐、产气性能进行了比较,选出了综合性能最佳的菌株YL-1,经分子生物学鉴定为一株酿酒酵母(Saccharomyces cerevisiae)。通过单因素试验和响应面试验得到菌株YL-1的最佳培养基配方为蔗糖74.0 g/L,玉米浆干粉52.0 g/L,MgSO4 1.1 g/L。最适培养条件为初始pH值5.5,培养温度28 ℃,接种量8%。在此优化条件下,菌株YL-1活菌数可达3.58×108 CFU/mL,提高至未优化前活菌数的2.20倍。优化后的培养基采用蔗糖为主要碳源,并且采用廉价的玉米浆干粉作为氮源,培养基配方简单,易得且成本较低,为后续反刍酵母YL-1的工业化大规模生产奠定了基础。
[1]LARA E C,BRAGIATO U C,RABELO C H S,et al.Inoculation of corn silage with Lactobacillus plantarum and Bacillus subtilis associated with amylolytic enzyme supply at feeding.1.Feed intake,apparent digestibility,and microbial protein synthesis in wethers[J].Anim Feed Sci Technol,2018,243:22-34.
[2]杨坤,胡红莲,李大彪,等.奶牛亚急性瘤胃酸中毒(SARA)的易感因素及其对瘤胃功能的影响[J].畜牧与饲料科学,2022,43(5):55-60.
[3]NOZIERE P,STEINBERG W,SILBERBERG M,et al.Amylase addition increases starch ruminal digestion in first-lactation cows fed high and low starch diets[J].J Dairy Sci,2014,97(4):2319-2328.
[4]KREHBIEL C,RUST S,ZHANG G,et al.Bacterial direct-fed microbials in ruminant diets:Performance response and mode of action[J].J Anim Sci,2003,81(14_suppl_2):E120-E132.
[5]王颖,何宁,李清彪,等.酿酒酵母S.cerevisiae高密度培养条件优化研究[J].工业微生物,2007,37(1):34-38.
[6]GENG C Y,REN L P,ZHOU Z M,et al.Comparison of active dry yeast(Saccharomyces cerevisiae) and yeast culture for growth performance,carcass traits,meat quality and blood indexes in finishing bulls[J].Anim Sci J,2016,87(8):982-988.
[7] TRIPATHI M K, KARIM S A.Effect of yeast cultures supplementation on live weight change, rumen fermentation, ciliate protozoa population,microbial hydrolytic enzymes status and slaughtering performance of growing lamb[J].Livest Sci,2011,135(1):17-25.
[8]BAYAT A,KAIRENIUS P,STEFAN′ SKI T,et al.Effect of camelina oil or live yeasts(Saccharomyces cerevisiae)on ruminal methane production,rumen fermentation, and milk fatty acid composition in lactating cows fed grass silage diets[J].J Dairy Sci,2015,98(5):3166-3181.
[9] SWYERS K, WAGNER J, DORTON K, et al.Evaluation of Saccharomyces cerevisiae fermentation product as an alternative to monensin on growth performance, cost of gain, and carcass characteristics of heavyweight yearling beef steers[J].J Anim Sci,2014,92(6):2538-2545.
[10]丁洪涛,刘星,夏冬华,等.产朊假丝酵母对奶牛体外瘤胃发酵参数及日粮营养物质消化率的影响[J].中国畜牧杂志,2012,48(9):56-59.
[11]MAAMOURI O,BEN SALEM M.The effect of live yeast Saccharomyces cerevisiae as probiotic supply on growth performance,feed intake,ruminal pH and fermentation in fattening calves[J].Vet Med Sci,2022,8(1):398-404.
[12]PINLOCHE E,MCEWAN N,MARDEN J P,et al.The effects of a probiotic yeast on the bacterial diversity and population structure in the rumen of cattle[J].PLoS One,2013,8(7):e67824.
[13]MALEKKHAHI M,TAHMASBI A M,NASERIAN A A,et al.Effects of supplementation of active dried yeast and malate during sub-acute ruminal acidosis on rumen fermentation, microbial population, selected blood metabolites,and milk production in dairy cows[J].Anim Feed Sci Technol,2016,213:29-43.
[14]HE Z,FERLISI B,ECKERT E,et al.Supplementing a yeast probiotic to pre-weaning Holstein calves: Feed intake, growth and fecal biomarkers of gut health[J].Anim Feed Sci Technol,2017,226:81-87.
[15]刘强,黄应祥,DAWSON K,等.赛乐硒对发情奶牛外周血生殖激素含量和繁殖性能的影响[J].家畜生态学报,2007(5):52-56.
[16]OGUNADE I M,LAY J,ANDRIES K,et al.Effects of live yeast on differential genetic and functional attributes of rumen microbiota in beef cattle[J].J Anim Sci Biotechol,2019,10(1):1-7.
[17]薛帅帅,李亚飞,李可瑶,等.饲粮中添加布拉迪酵母对安格斯犊牛生长性能、血清免疫指标及粪便微生物区系的影响[J].动物营养学报,2022,34(6):3743-3757.
[18]VILLOT C,MA T,RENAUD D,et al.Saccharomyces cerevisiae boulardii CNCM I-1079 affects health, growth, and fecal microbiota in milk-fed veal calves[J].J Dairy Sci,2019,102(8):7011-7025.
[19]张书阅,熊本海,刘明,等.酿酒酵母培养物对瘤胃内环境和免疫功能的影响及其在反刍动物上的应用[J].中国乳业,2021(7):18-24.
[20]李莉,张赛,何强,等.响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-45.
[21]王学东,周建军,付国静,等.不同用途酵母菌株环境适应性差异研究[J].中国饲料,2018(21):89-93.
[22]封成玲,刘洋,贾紫伟,等.产酶溶杆菌L-43合成抗菌肽的发酵工艺优化[J].食品与发酵工业,2022,48(19):196-203.
[23]肖美娟,朱治任,刘月旺,等.响应面法优化羰基还原酶产生菌Cyberlindnera saturnus发酵培养基[J].生物加工过程,2021,19(1):47-53.
[24]王亮,胡曼,王江月,等.马克斯克鲁维酵母高密度发酵条件的优化研究[J].食品工业科技,2017,38(17):111-118,124.
[25]李婷婷,陈雪,程涛,等.基于响应面法优化酿酒酵母培养体系[J].中国酿造,2020,39(11):126-131.
[26]REDDY L,REDDY O.Effect of fermentation conditions on yeast growth and volatile composition of wine produced from mango(Mangifera indica L.)fruit juice[J].Food Bioprod Process,2011,89(4):487-491.