高温大曲是以小麦、大麦和豌豆为主要原料,经过研磨、混合、定型、培养、成熟和干燥而成,富含大量的微生物、酶及风味化合物[1]。大曲的质量决定了白酒的质量,曲中的微生物及其代谢产物可显著影响白酒的风味和口感[2],因而越来越多的学者围绕高温大曲微生物类群与风味品质之间的关联性进行系统研究。LI H等[3]研究发现,茅台大曲中细菌属主要为高温放线菌属(Thermoactinomyces)、糖多孢菌属(Saccharopolyspora)、芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)、乳杆菌属(Lactobacillus)、微球菌属(Micrococcus)、拟杆菌属(Bacteroides)、黄杆菌属(Flavobacterium)和糖单孢菌属(Saccharomonospora),且这些菌属之间通过分泌代谢产物等相互作用促进了乙酸甲酯、棕榈酸异丙酯、亚油酸乙酯和苯乙醇等风味化合物的产生。沈世明等[4]对高温大曲微生物群落结构及其风味物质进行分析,发现高温大曲中优势菌属主要为克罗彭斯特菌属(Kroppenstedtia)、枝芽孢菌属(Virgibacillus)、海洋杆菌属(Oceanobacillus)、Bacillus、丝衣霉菌属(Byssochlamys)和毕赤酵母属(Pichia),其中Bacillus和Oceanobacillus等细菌属可促进亚油酸、草莓酸和癸酸等酸类物质和吡嗪类物质的产生,Pichia等酵母属可促进酯类物质的产生。由此可见,高温大曲中不同微生物的代谢作用可赋予酱香型白酒不同的风味品质。作为中国酱香白酒核心产区的茅台镇,其拥有上千家酒厂企业,任爱容等[5]的研究结果表明,茅台镇不同酒厂生产的高温大曲细菌菌群多样性存在明显差异,因而增加大曲样品研究的数量和厂家来源,对后续更好地解析茅台镇大曲微生物与风味品质之间的关系具有重要的意义。
近年来,第二代高通量测序技术已被广泛应用于解析窖泥[6]、酒曲[7]、酒醅[8]及大曲[9]微生物群落组成以及动态演替规律。作为一种快速、全面和易于操作的仿生学设备[10],基于气体传感器或化学传感器的组合,电子鼻或电子舌模仿了人的鼻子或舌头[11],已广泛应用于食品风味的评价研究中。
本研究采用MiSeq高通量测序技术对茅台镇某酒厂高温大曲的微生物类群进行解析,结合常规检测方法、电子鼻和电子舌对大曲的理化指标、气味及滋味进行测定,并进一步建立了微生物类群与酒曲感官指标之间的相关性,以期为高温大曲微生物资源的进一步挖掘提供理论依据和数据支撑。
1 材料与方法
1.1 材料与试剂
高温大曲样品:于2022年9月中旬采集自贵州省遵义市仁怀市茅台镇某知名酒业制曲车间,所采集的6份样品均为同一批次黄色大曲。样品随机选取,编号为M1~M6,取样后及时粉碎,并置于-20 ℃下低温保存。
QIAGEN DNeasy mericon Food Kit 脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;5×TransStartTMFastPfu Buffer、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)Mix和FastPfu Fly DNA聚合酶:北京全式金生物技术有限公司;引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')/806R(5'-GGACTACHVGGGTWTCTAAT-3')和ITS1F(5'-CTT GGTCATTTAGAGGAAGTAA-3')/ITS2R(5'-GCTGCGTTCTTCATCGATGC-3'):均由上海桑尼生物科技有限公司合成;MiSeq高通量测序配套试剂:美国Illumina公司;参比溶液、阴阳离子溶液、内部溶液:日本Insent公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HR83卤素水分测定仪:梅特勒-托利多国际贸易(上海)有限公司;AW-1水分活度仪:无锡碧波电子设备厂;PEN3电子鼻、SA402B电子舌:德国Airsense公司;Veriti FAST聚合酶链式应(polymerase chain reaction,PCR)仪:美国ABI公司;DYY-12电泳仪:北京六一仪器厂;UVPCDS8000凝胶成像分析系统:美国ProteinSimple公司;PE300 MiSeq高通量测序平台:美国Illumina公司;R930机架式服务器:美国DELL公司。
1.3 实验方法
1.3.1 理化指标的测定
根据轻工业行业标准QB/T 4257—2011《酿酒大曲通用分析方法》对高温大曲的酸度、氨基酸态氮、灰分和淀粉含量进行测定;使用卤素水分测定仪测定大曲中水分含量;使用水分活度仪测定大曲中水分活度。
1.3.2 感官品质的评价
气味指标的测定:准确称取高温大曲样品12 g于电子鼻专用瓶中,将其置于室温下平衡1 h后,参照席啦等[12]的测定方法使用PEN3电子鼻对其风味指标进行测定。
滋味指标的测定:准确称取高温大曲样品30 g于250 mL烧杯中,按照1∶4的比例加入120 mL去离子水并于室温下放置30 min后,在4 ℃、10 000 r/min条件下离心10 min,取上清,使用SA402B电子舌对大曲的5个基本味(酸味、苦味、涩味、咸味和鲜味)和3个回味(苦的回味、鲜的回味和涩的回味)进行测定[13],设置大曲M4为对照组。
1.3.3 宏基因组DNA提取、PCR扩增及高通量测序
按照提取试剂盒的说明对高温大曲样品中微生物的基因组DNA进行提取,参照GUO Z等[14-15]的方法,使用加入核苷酸标签(Barcord)的338F/806R引物和ITS1F/ITS2R引物分别对细菌16S rRNA的V3-V4区和真菌ITS区进行PCR扩增,之后将检测合格的PCR产物低温寄送至上海美吉生物医药科技有限公司进行双末端测序。
1.3.4 生物信息学分析
参照DENG L等[16]的方法对测序返回的双端序列进行拼接和高质量序列筛选,利用QIIME(V1.9.1)平台对保留序列进行微生物群落注释和多样性评价[17]。首先按照97%相似度使用UCLUST进行聚类生成操作分类单元(operational taxonomic units,OTU),继而去除嵌合体,然后基于各数据库对具有代表性的序列进行同源性比对完成物种注释,最终计算样品中微生物类群的α多样性指数。
1.3.5 数据处理
雷达图和柱形图均使用Origin 2017绘制,曲线图使用R(v4.1.3)绘制,瀑布图使用Excel 2016绘制,相关性网络图使用Cytoscape(v3.7.2)绘制。
2 结果与分析
2.1 高温大曲样品理化性质分析
理化性质不仅是判断大曲是否适合发酵的主要标准,亦是鉴别大曲品质的重要参考依据[18]。对茅台镇某酒厂高 温大曲样品的理化指标进行测定,结果见表1。
表1 高温大曲样品理化指标的测定结果
Table 1 Determination results of physicochemical indexes of high-temperature Daqu samples
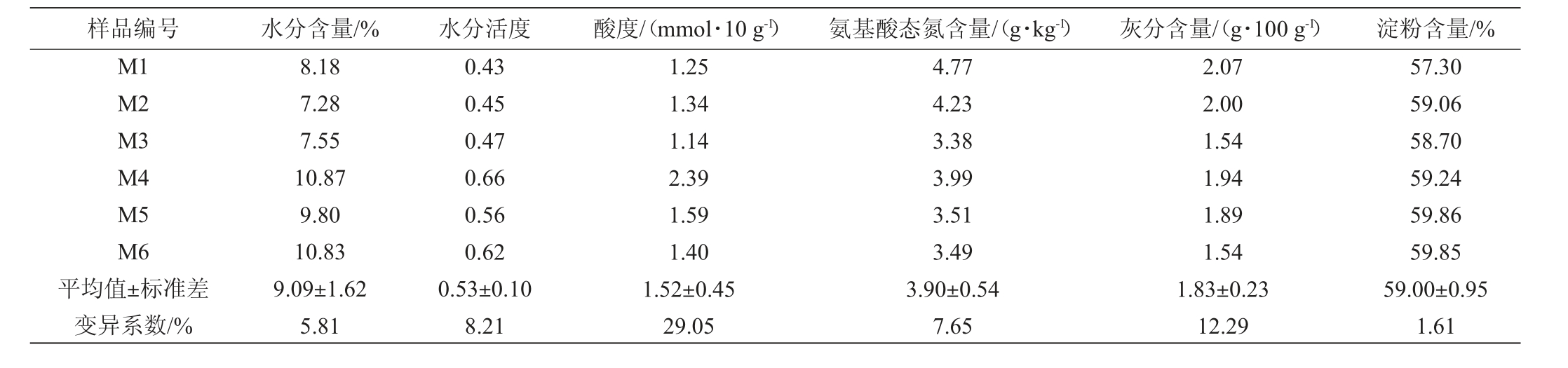
样品编号 水分含量/% 水分活度 酸度/(mmol·10 g-1) 氨基酸态氮含量/(g·kg-1) 灰分含量/(g·100 g-1) 淀粉含量/%M1 M2 M3 M4 M5 M6平均值±标准差变异系数/%8.18 7.28 7.55 10.87 9.80 10.83 9.09±1.62 5.81 0.43 0.45 0.47 0.66 0.56 0.62 0.53±0.10 8.21 1.25 1.34 1.14 2.39 1.59 1.40 1.52±0.45 29.05 4.77 4.23 3.38 3.99 3.51 3.49 3.90±0.54 7.65 2.07 2.00 1.54 1.94 1.89 1.54 1.83±0.23 12.29 57.30 59.06 58.70 59.24 59.86 59.85 59.00±0.95 1.61
由表1可知,茅台镇某酒厂高温大曲的平均水分含量为9.09%,水分活度为0.53,酸度为1.52 mmol/10 g,氨基酸态氮含量为3.90 g/kg,灰分含量为1.83 g/100 g,淀粉含量为59.00%,6份高温大曲样品的理化指标均符合贵州省地方标准DB52/T 871—2014《酱香型白酒酿酒用大曲》要求。其中,酸度和灰分指标的变异系数均>10%,在6份高温大曲样品间存在较大差异。由此可见,同一批次生产的高温大曲曲块之间其部分理化性质存在明显差异。
2.2 高温大曲样品感官品质分析
采用电子鼻和电子舌进一步对6份高温大曲样品的感官品质特性进行评价,结果见图1。
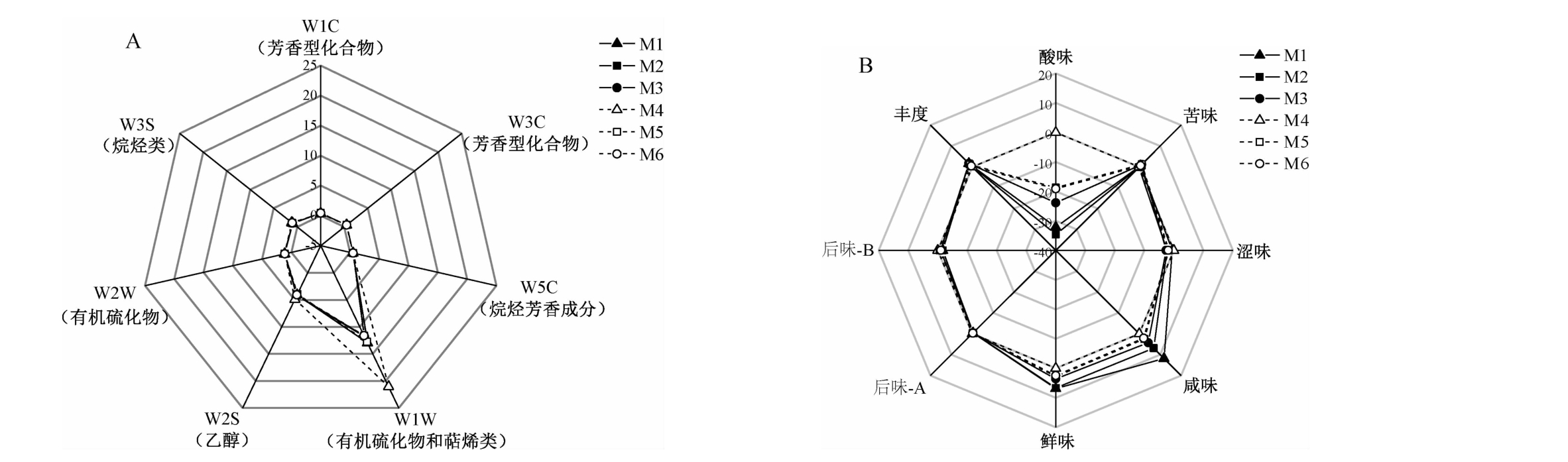
图1 高温大曲样品风味品质(A)和滋味品质(B)雷达图
Fig.1 Radar map of flavor quality (A) and taste quality (B) of high-temperature Daqu samples
由图1A可知,仅有W1W和W2S这2个电子鼻传感器对高温大曲样品具有响应强度,表明高温大曲样品的挥发性风味物质中乙醇、有机硫化物和萜类物质的相对丰度较高。W1W传感器对M4大曲样品的响应值高达21,而对其他5份大曲样品的响应值均<13,由此可见,6份高温大曲样品挥发性风味物质差异主要体现在有机硫化物和萜类物质上。由图1B可知,高温大曲样品在酸味、咸味和鲜味指标上的差异较大,在苦味、后味A(涩味的回味)、后味B(苦味的回味)和丰度(鲜味的回味)指标上的差异较小。由此可见,6份高温大曲样品滋味指标差异主要体现在酸味、咸味和鲜味这3个基本味上。王利萍等[19]对贵州怀仁地区酱香型白酒大曲中的风味和滋味物质进行分析,发现大曲挥发性风味物质差异主要体现在氮氧化物、有机硫化物和萜类物质上,其滋味物质差异主要体现在酸味、咸味和鲜味上,该结论与本研究结果具有一定相似性。亦有研究指出,大曲中含有大量醇类、醛酮类、吡嗪类和醚酚类等风味物质[20]。
2.3 高温大曲样品微生物类群α多样性分析
基于Illumina MiSeq高通量测序技术,从6份高温大曲样品共获得318 131条高质量16S rRNA基因序列和448 244条高质量ITS序列,使用UCLUST聚类分析后,共得到13 596个细菌OTU和4 832个真菌OTU。本研究首先通过Chao 1指数和香农指数对茅台镇某酒厂高温大曲样品中的微生物物种丰富度和多样性进行分析,结果见图2。
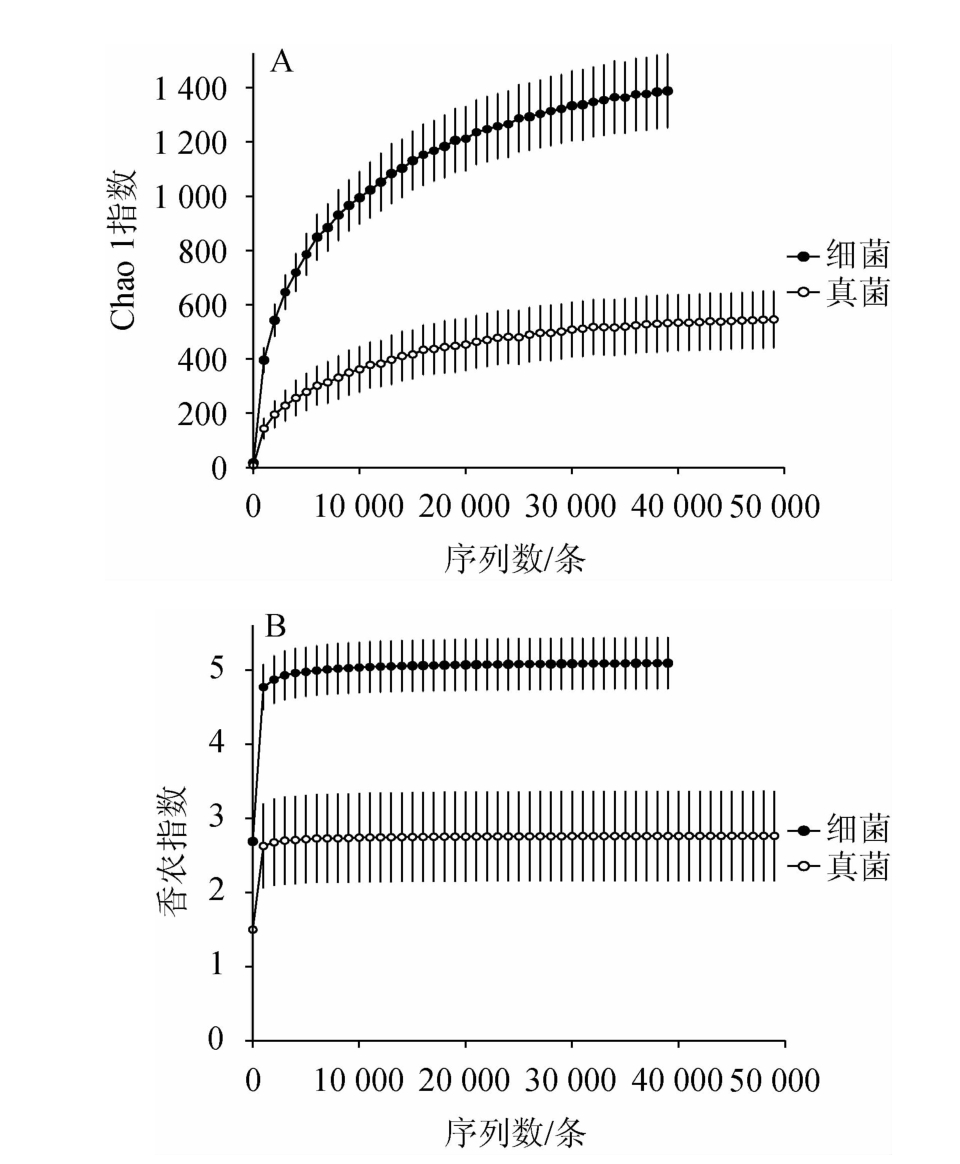
图2 高温大曲样品微生物菌群Chao 1指数(A)和香农指数(B)分析结果
Fig.2 Analysis results of Chao 1 index (A) and Shannon index (B) of microorganism flora in high-temperature Daqu samples
细菌α多样性指数均在测序深度为39 010条序列时计算;真菌在测序深度为49 010条序列时计算。
由图2可知,随着测序深度的增加,虽然6份高温大曲样品中细菌与真菌类群的Chao 1指数一直处于上升趋势,但其香农指数早已进入稳定状态,因而本研究的测序深度足以捕捉大曲样品中大多数微生物类群的多样性并满足后续分析的要求。经α多样性分析可知,纳入本研究的高温大曲样品细菌和真菌菌群的平均Chao 1指数分别为1 388和546,细菌和真菌菌群的平均香农指数分别为5.10和2.76。由此可见,在同一测序深度下时,细菌类群丰富度和多样性均高于真菌类群。
2.4 高温大曲样品微生物群落结构分析
高温大曲样品中细菌类群共鉴定到18个门、35个纲、58个目、114个科和197个属;其真菌类群共鉴定到4个门、9个纲、14个目、32个科和48个属。为明确茅台镇某酒厂高温大曲的微生物类群特征,对其微生物群落结构进行解析,结果见图3。将在6份高温大曲中相对含量>1.0%的细菌属和真菌属定义为优势菌属,相对含量<1.0%的菌属归为其他。
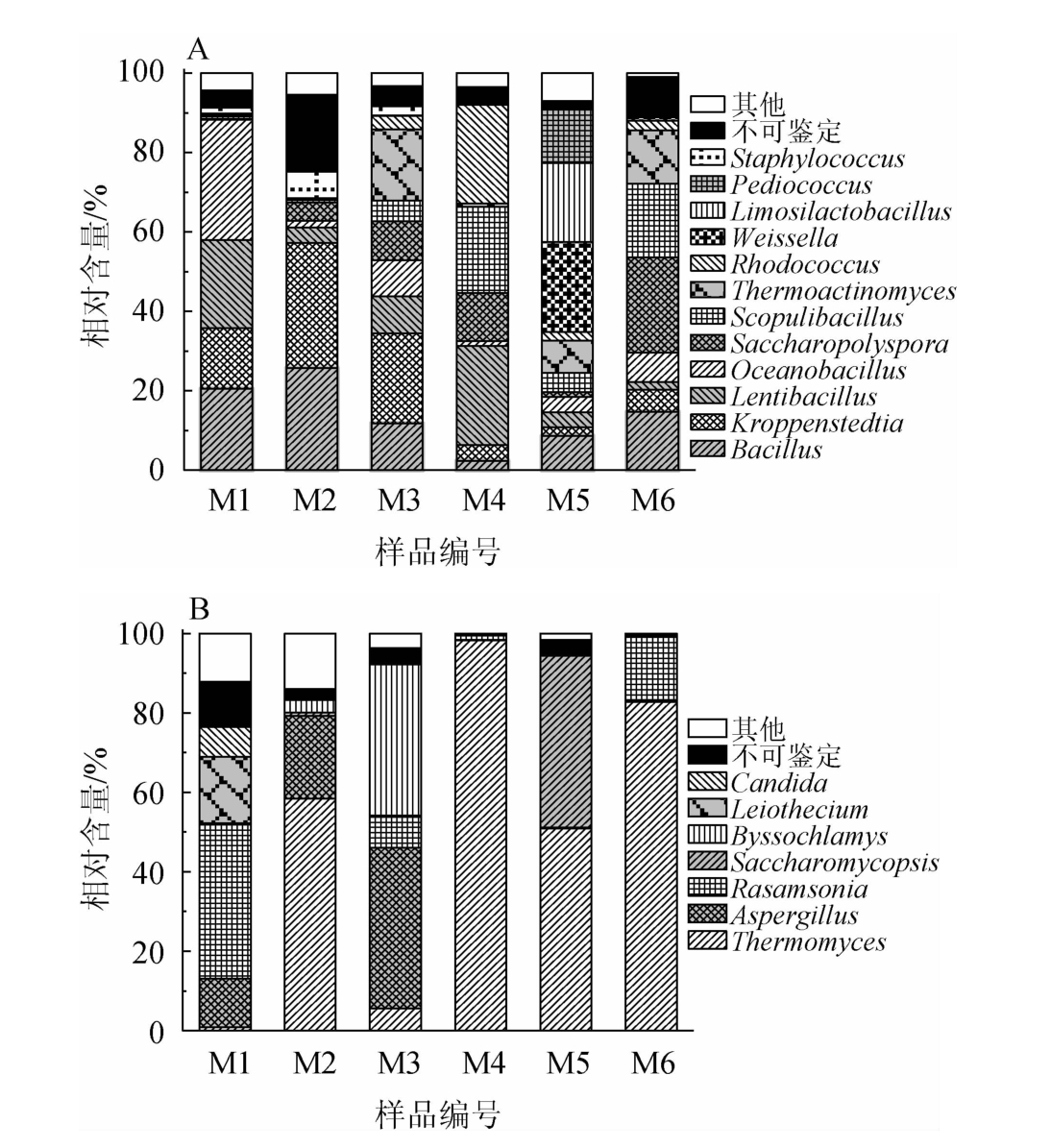
图3 基于属水平高温大曲样品中细菌(A)及真菌(B)菌群结构
Fig.3 Bacterial (A) and fungal (B) flora structure of high-temperature Daqu samples based on genus level
由图3A可知,高温大曲样品中有12个优势细菌属,分别为芽孢杆菌属(Bacillus)、克罗彭斯特德菌属(Kroppenstedtia)、慢生芽孢杆菌属(Lentibacillus)、海洋芽孢杆菌属(Oceanobacillus)、糖多孢菌属(Saccharopoly-spora)、岩石芽孢杆菌属(Scopulibacillus)、高温放线菌属(Thermoactinomyces)、红球菌属(Rhodococcus)、魏斯氏菌属(Weissella)、黏液乳杆菌属(Limosilactobacillus)、片球菌属(Pediococcus)和葡萄球菌属(Staphylococcus),其平均相对含量分别为13.96%、13.52%、11.01%、8.93%、8.63%、8.62%、6.72%、5.52%、4.00%、3.38%、2.40%和1.81%。由图3A亦可知,高温大曲样品中出现了Oceanobacillus、Scopulibacillus、Rhodococcus、Weissella、Limosilactobacillus 和Pediococcus相对含量分布明显不均一的现象。Oceanobacillus在M1大曲样品中相对含量为30.28%,而在其他大曲样品中相对含量均<10.0%;Scopulibacillus和Rhodococcus在M4大曲样品中相对含量分别为21.70%和24.77%,而在其他大曲样品中相对含量均<6.0%;Weissella、Limosilactobacillus和Pediococcus在M6大曲样品中相对含量分别为22.60%、19.91%和13.43%,而在其他大曲中相对含量均<0.5%。由此可见,虽然高温大曲样品为同一批次生产,但其细菌类群存在一定的差异。
由图3B可知,高温大曲中有7个优势真菌属,分别为嗜热真菌属(Thermomyces)、曲霉菌属(Aspergillus)、踝节菌属(Rasamsonia)、复膜孢酵母属(Saccharomycopsis)、丝衣霉属(Byssochlamys)、Leiothecium和假丝酵母属(Candida),其平均相对含量分别为49.49%、12.25%、10.68%、7.51%、6.88%、2.83和1.28%。由图3B亦可知,高温大曲样品中7个优势真菌属亦均出现了相对含量分布明显不均一的现象,例如Aspergillus在M1~M3大曲样品中的相对含量分别为12.28%、20.72%和40.34%,而在其他大曲中相对含量均<0.1%,类似现象在Thermomyces、Rasamsonia、Saccharomycopsis、Byssochlamys、Leiothecium和Candida中均存在。由此可见,虽然高温大曲为同一批次生产,但其真菌类群亦存在一定差异。
本研究将存在于所有高温大曲样品中的OTU,定义为核心OTU,并将平均相对含量>1.0%的核心OTU定义为核心优势OTU。进一步在OTU水平上对高温大曲样品核心微生物类群进行解析,结果见图4。
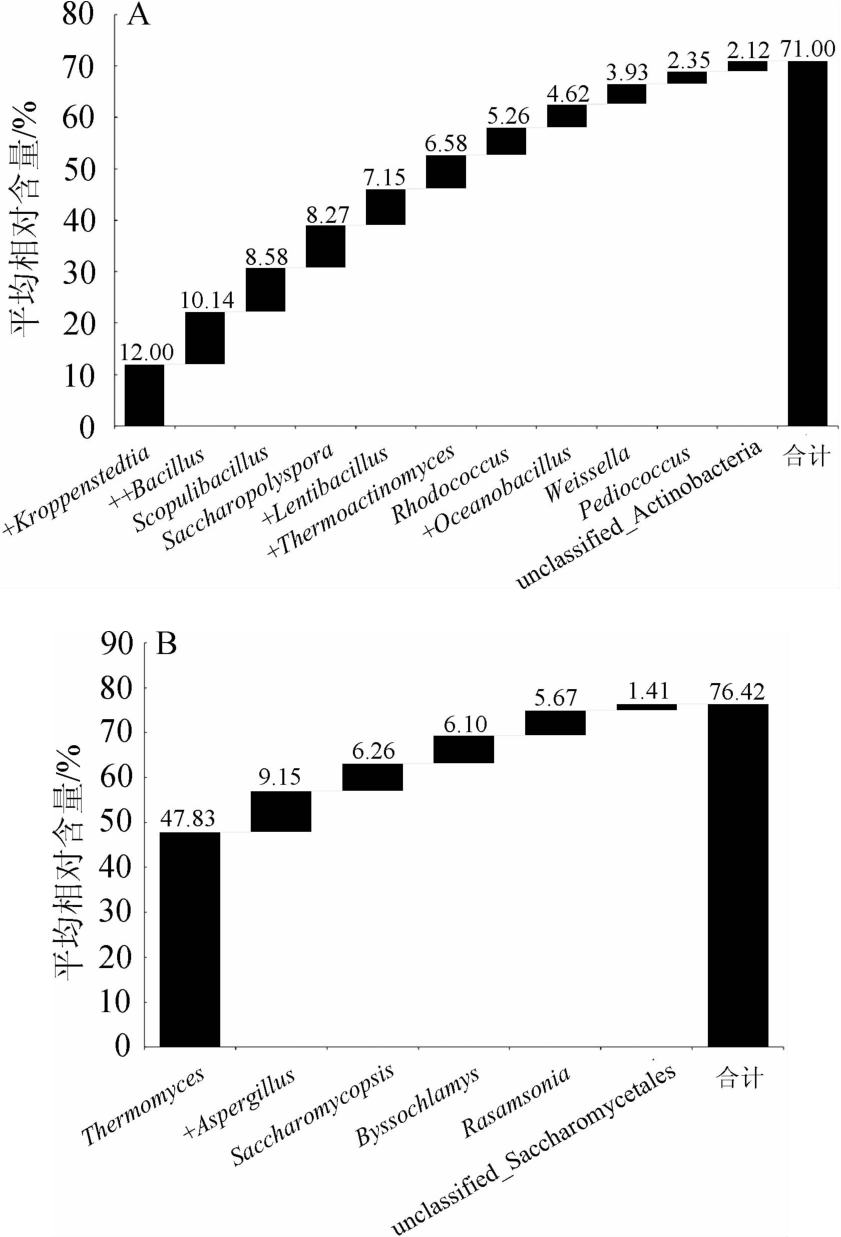
图4 高温大曲样品中细菌(A)和真菌(B)核心优势OTU瀑布图
Fig.4 Core dominant OTU waterfall diagram of bacteria (A) and fungi (B) in high-temperature Daqu samples
“+”表示有2个核心OTU隶属于该属,“++”表示有4个,
没有标注“+”的表示仅有1个核心OTU。
由图4A可知,高温大曲样品细菌菌群中有129个核心OTU,其中核心优势OTU有18个,分别隶属于Kroppenstedtia(12.00%)、Bacillus(10.14%)、Scopulibacillus(8.58%)、Saccharopolyspora(8.27%)、Lentibacillus(7.15%)、Thermoactinomyces(6.58%)、Rhodococcus(5.26%)、Oceanobacillus(4.62%)、Weissella(3.93%)、Pediococcus(2.35%)和不可鉴定的放线菌门(unclassfield_Actinobacteria)(2.12%),累积平均相对含量高达71.00%。由图4B可知,高温大曲样品真菌菌群中有23个核心OTU,其中核心优势OTU有7个,分别隶属于Thermomyces(47.83%)、Aspergillus(9.15%)、Saccharomycopsis(6.26%)、Byssochlamys(6.10%)、Rasamsonia(5.67%)和不可鉴定的酵母目(unclassfield_Saccharomycetales)(1.41%),累积相对含量高达76.42%。由此可见,虽然高温大曲样品间微生物类群的相对含量存在一定差异,但其共有大量的核心菌群。
HE G等[21]研究表明,大曲优势菌群的代谢活动对茅台镇酱香型白酒的独特风味至关重要,其中,Kroppenstedtia、Bacillus和Lentibacillus为酱香型白酒发酵过程中的优势菌群和功能菌群,在酿造过程中,会分泌多种水解酶,包括淀粉酶、蛋白酶、脂肪酶和纤维素酶等以促进大分子的水解以及吡嗪类、酯类和醇类等风味化合物的产生[22]。高温大曲在制曲过程中其培养温度在60 ℃以上,甚至高达70 ℃,Thermoactinomyces、Scopulibacillus 和Oceanobacillus 均 属于耐热微生物,亦均可分泌蛋白酶、淀粉酶和纤维素酶等,对酱香型白酒风味的生成具有一定的贡献[23]。有研究亦表明,Thermoactinomyces还可生产出独具酱香风味的愈创木酚[24]。Weissella和Pediococcus均属于乳酸菌,在大曲发酵过程中经代谢活动可生成乙酸乙酯和乳酸乙酯等风味物质[25]。张翰之等[26]研究表明,Aspergillus为丝状真菌,能够产生淀粉酶和蛋白酶等多种酶类,对大曲的糖化力、液化力和酯化力发挥着重要的作用。Thermomyces为高温大曲中的优势菌属,在酱香型白酒酿造过程中可产生多种重要酶类,以促进微生物的生长代谢及酒体生香[16]。Saccharomycopsis不仅具有分泌淀粉酶和蛋白酶等多种水解酶的能力,还具有分泌β-葡萄糖苷酶的能力,且该菌属的生长代谢可对乙酸乙酯的产生具有促进作用,从而使得酒体的风味更加协调和饱满[27]。
2.5 高温大曲样品中优势菌属与其感官品质的相关性分析
在对高温大曲微生物类群进行解析的基础上,进一步对高温大曲中优势菌属与气味和滋味指标之间的相关性进行分析,结果见图5。
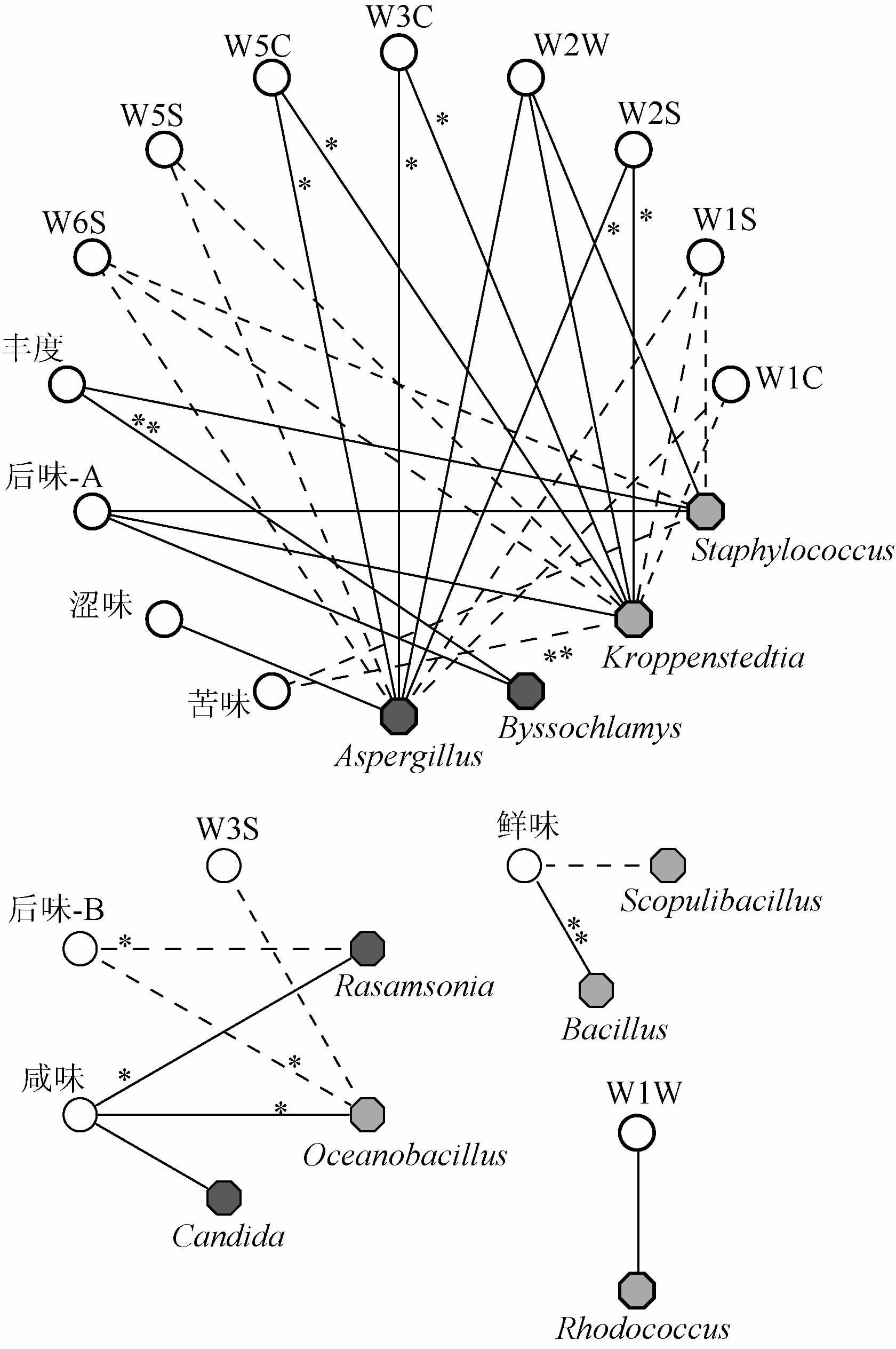
图5 高温大曲样品优势菌属与感官品质间相关性分析网络图
Fig.5 Correlation analysis network diagram between dominant bacteria genera and sensory quality of high-temperature Daqu samples
图中实线表示正相关,虚线表示负相关,线越粗代表相关性越大;
“*”表示相关性显著(P<0.05),“**”表示相关性极显著(P<0.01)。
由图5可知,Kroppenstedtia和Aspergillus均与芳香型化合物和乙醇等风味物质的生成呈显著正相关(P<0.05),Kroppenstedtia与苦味呈极显著负相关(P<0.01);Oceanobacillus与苦味的回味呈显著负相关(P<0.05);Bacillus与鲜味呈极显著正相关(P<0.01);Byssochlamys与丰度呈现极显著正相关(P<0.01);Rasamsonia与苦味的回味呈显著负相关(P<0.05)。有研究表明,Aspergillus可促进正丁醇和2-甲基丁酸乙酯的形成,Bacillus可促进四甲基吡嗪和2,3-丁二醇的形成[28]。由此可见,Kroppenstedtia和Aspergillus对高温大曲芳香类风味物质的形成具有一定的积极作用,Bacillus对鲜味的形成和Byssochlamys对鲜味回味的形成亦具有一定的积极作用。
3 结论
理化性质研究发现,本研究中6份高温大曲样品的理化指标均符合贵州省地方标准要求,但酸度和灰分指标差异较大,变异系数>10%。风味物质分析发现,6份高温大曲样品的风味在乙醇、有机硫化物、萜类物质、酸味、咸味和鲜味上差异较为突出。高通量测序结果发现,细菌类群丰富度和多样性均高于真菌,其中细菌主要隶属于Bacillus、Kroppenstedtia、Lentibacillus、Oceanobacillus、Saccharopolyspora、Scopulibacillus、Thermoactinomyces、Rhodococcus、Weissella、Limosilactobacillus、Pediococcus和Staphylococcus,而真菌主要隶属于Thermomyces、Aspergillus、Rasamsonia、Saccharomycopsis、Byssochlamys、Leiothecium 和Candida。相关性分析发现,Kroppenstedtia和Aspergillus均与芳香类风味物质呈显著正相关,Bacillus与鲜味呈显著正相关。总体上,积极挖掘和培育具有提升酒曲风味和滋味特性的Kroppenstedtia、Aspergillus和Bacillus菌株,对于后续提高贵州地区酒曲的品质具有积极意义。
[1]GOU M,WANG H Z,YUAN H W,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].J I Brewing,2015,121(4):620-627.
[2]LIU J,CHEN J,FAN Y,et al.Biochemical characterisation and dominance of different hydrolases in different types of Daqu a Chinese industrial fermentation starter[J].J Sci Food Agr,2018,98(1):113-121.
[3] LI H, LIAN B, DING Y, et al.Bacterial diversity in the central black component of Maotai Daqu and its flavor analysis[J].Ann Microbiol,2014,64(4):1659-1669.
[4]沈世明,何猛超,刘桂珍,等.酱香型大曲贮存初期微生物及风味物质变化的分析研究[J].酿酒科技,2023(2):128-135.
[5]任爱容,黄永光.茅台镇不同主酿区域酱香型白酒酿造大曲中细菌菌群结构分析[J].食品科学,2021,42(4):167-174.
[6]ZHANG Z,DONG Y,XIANG F,et al.Analysis of bacterial diversity and genetic evolution of Lacticaseibacillus paracasei isolates in fermentation pit mud[J].J Appl Microbiol,2022,133(3):1821-1831.
[7] CHEN L,LIU B, FENG S, et al.Correlation between microbe, physicochemical properties of Jiuqu in different plateau areas and volatile flavor compounds of highland barley alcoholic drink[J].Food Biosci,2023,51(2):102276.
[8]LI K,CHEN Y,LIU T,et al.Analysis of spatial distribution of bacterial community associated with accumulation of volatile compounds in Jiupei during the brewing of special-flavor liquor[J].LWT-Food Sci Technol,2020,130(8):109620.
[9]WANG Y,CAI W,WANG W,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2021,9(2):1003-1016.
[10]ZHU D,REN X,WEI L,et al.Collaborative analysis on difference of apple fruits flavour using electronic nose and electronic tongue[J].Sci Horticamsterdam,2020,260(1):108879.
[11]ORLANDI G,CALVINI R,FOCA G,et al.Data fusion of electronic eye and electronic tongue signals to monitor grape ripening[J].Talanta,2019,195(4):181-189.
[12]席啦,熊英梅,王玉荣,等.3类辣椒对鲊广椒细菌类群和品质的影响[J].食品工业科技,2022,43(19):154-159.
[13]张苗苗,解云,王玉荣,等.五峰土家族自治县泡菜水品质评价及其乳酸菌多样性解析[J].食品与发酵工业,2022,48(22):187-193.
[14]GUO Z,WANG Y,XIANG F,et al.Bacterial diversity in pickled cowpea(Vigna unguiculata[Linn.]Walp)as determined by Illumina MiSeq sequencing and culture-dependent methods[J].Curr Microbiol, 2021,78(4):1286-1297.
[15]WHITE T J,BRUNS T,LEE S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J].PCR Protocols: A Guide to Methods and Applications,1990,18(1):315-322.
[16]DENG L,MAO X,LIU D,et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Front Microbiol,2020,11(11):588117.
[17] WANG Y, XIANG F, ZHANG Z, et al.Characterization of bacterial community and flavor differences of different types of Douchi[J].Food Sci Nutr,2021,9(7):3460-3469.
[18]FAN G,SUN B,FU Z,et al.Analysis of physicochemical indices,volatile flavor components,and microbial community of a Light-flavor Daqu[J].J Am Soc Brew Chem,2018,76(3):209-218.
[19]王利萍,郎莹,邱树毅,等.电子鼻结合电子舌技术对五种酱香型白酒大曲的风味物质分析[J].酿酒科技,2022(9):116-122.
[20]沈世明,张娇娇,张高瑜,等.酱香型大曲贮存过程曲香风味物质变化的分析[J].中国酿造,2022,41(7):58-63.
[21]HE G,HUANG J,WU C,et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong-flavor liquor brewing microecosystem[J].Food Res Int,2020,129(3):108851.
[22]HE G,HUANG J,ZHOU R,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10(1):56.
[23]SHI W,CHAI L J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Res Int,2022,156(6):111298.
[24]李豆南,黄魏,王晓丹,等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学,2018,39(6):171-176.
[25]LI Q, HUDARI M S B, WU J C.Production of optically pure D-lactic acid by the combined use of Weissella sp.S26 and Bacillus sp.ADS3[J].Appl Biochem Biotech,2016,178(2):285-293.
[26]张瀚之,席德州,王欢,等.酱香型白酒机械化酿造不同轮次堆积发酵酒醅真菌群落结构多样性研究[J].中国酿造,2021,40(12):64-69.
[27]李静心,王艳丽,何宏魁,等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业,2018,44(12):52-59.
[28] HE G, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT-Food Sci Technol,2019,111(8):1-8.