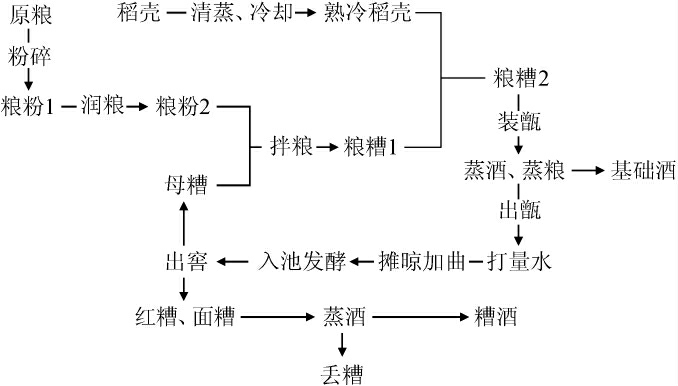
白酒是中国特有的蒸馏酒,国内根据酿造工艺的差异将白酒细分为如今主流的12种香型[1],浓香型作为四大基础香型之一,其是以粮谷为原料,采用浓香大曲为糖化发酵剂,经泥窖固态发酵,固态蒸馏、陈酿、勾调而成的,不直接或间接添加食用酒精及非自身发酵产生的呈色呈香呈味物质的白酒[2],浓香型白酒的生产工艺流程如下:
浓香型白酒含有1 300多种风味物质,具有窖香浓郁,绵甜甘冽,香味协调,尾净余长的特点[3],风味物质的组成及含量由白酒酿造生境中微生物决定[4],因此微生物在浓香型白酒酿造过程中处于核心地位。浓香型白酒酿造生境中的微生物群落并不是微生物个体的简单聚集,而是微生物菌种与其他生物及其环境通过多种方式的相互作用形成的网络生态系统,并且由于生产过程中开放的环境导致了酿酒生态环境中微生物组成十分复杂,这使得白酒生产工艺的相关参数存在不确定性,制约着浓香型白酒生产。
现阶段国内外对发酵微生物的探索日益深入,如研究发现在腐乳发酵中微生物的种群结构是个动态变化的过程,发酵后期微生物优势种群由芽孢杆菌属(Bacillus)演替为不动杆菌属(Acinetobacter)[5],在白酒酿造中也存在这种微生物种群优势交替变化现象。酒醅在发酵前期优势细菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria),随着酒醅发酵时间延长,乳杆菌属(Lactobacillus)成长为绝对的优势菌属进而为发酵提供所需的酸性环境以及形成有机酸等风味物质[6-8]。酿造工具及人为因素携带的环境微生物是酒醅在入池发酵初期细菌和真菌群落的主要贡献者,窖泥则是入池发酵末期细菌群落的主要来源,因此不同地区环境微生物的差异也是白酒酿造过程微生物群落结构特征不同的重要原因[9]。此外,白酒中高级醇等风味物质的含量与共有优势细菌属乳杆菌属(Lactobacillus)、共有优势真菌属曲霉属(Aspergillus)、伊酵母属(Issatchenkia)息息相关[10]。发酵过程中微生物的代谢及一系列基于代谢产物的种间相互作用是形成白酒风味物质的关键,通常包括细菌-细菌作用、酵母-酵母作用以及酵母-细菌作用,如篮状菌属(Talaromyces)在部分酵母菌的协助下在酒醅发酵初期完成淀粉质的糖化,同时伊萨酵母属(Issatchenkia)酵母菌大量增殖,在其他酵母菌的协助下完成酒精发酵;此外,芽孢梭菌属(Clostridium)和某些未分类的梭菌目(Clostridiales)微生物为主的细菌类微生物在发酵前期大量增殖,积累乙酸、丁酸等有机酸,为发酵后期的酯化增香提供前体物质[11]。目前国内外对浓香型白酒酿造微生物的研究主要集中在酒醅,然而对于浓香型白酒整个酿造生境中的微生物具体群落组成及群落间相互作用尚不完全明确,这导致了生境中某些主要菌株的功能动力学无法明晰,对浓香型白酒的酿造生产造成了一定阻碍。目前亟需探明浓香型白酒酿造生态系统中微生物的群落组成及群落间相互作用机制,以进一步解析白酒风味形成机理,为浓香型白酒的产质量稳定提供理论基础。本文综述了浓香型白酒酿造生态系统(大曲、酒醅、窖泥、黄水)微生物群落组成及功能的最新进展,同时阐述了酿酒微生物群落间的相互作用,为浓香型白酒酿造生态系统中特征菌种的定向筛选和培养研究奠定理论基础,基于其代谢特性研究针对性的优化白酒生产工艺,提高浓香型白酒产质量。
1 浓香型白酒酿酒微生物研究进展
目前行业内对于白酒酿造微生物的研究呈增长趋势,以“浓香型白酒”作为关键词,检索2018-2022年在核心合集数据库(web of science,WOS)和中国知网(China National Knowledge Internet,CNKI)数据库发表的文献,利用CitesPace 5.7软件进行文献计量分析,结果见图1,关键词共现网络见图2。
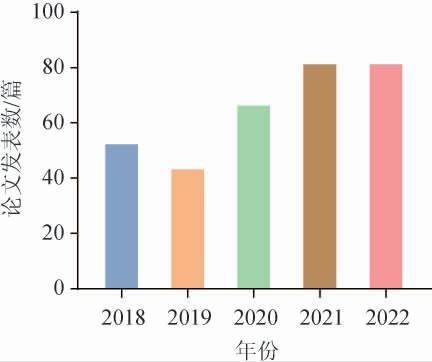
图1 2018-2022年国内外浓香型白酒相关论文统计
Fig.1 Statistics of domestic and foreign strong-flavor Baijiu related-papers from 2018 to 2022
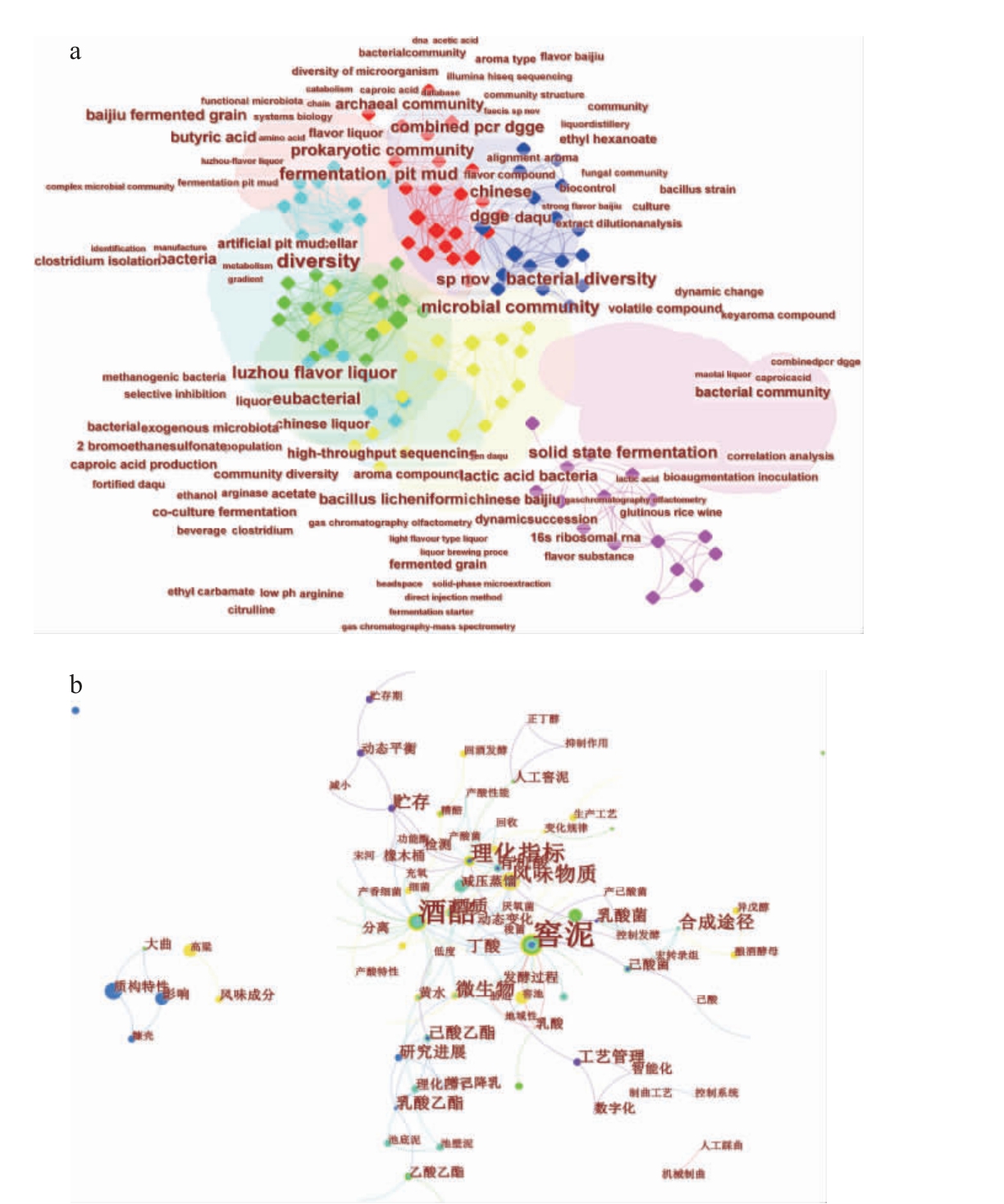
图2 WOS( a)及CNKI( b)关键词共现网络
Fig.2 Keywords co-appearance network of WOS (a) and CNKI (b)
由图1可知,国内外学者对于关于浓香型白酒的研究日益增加,2022年发表相关论文83篇。由图2可知,2018-2022年浓香型白酒生境微生物多样性越来越受到关注,酒醅、窖泥、黄水、微生物、细菌、酿酒酵母、乳酸菌、梭菌、古菌、风味成分等关键词高频出现。
起初研究人员主要采用分离培养的方法筛选鉴定白酒酿造过程中的微生物[11],施安辉[12]对浓香型白酒发酵过程中窖池中微生物区系进行分析,发现酒醅中的细菌主要为己酸菌、丁酸菌和乳酸菌,酵母菌主要为酒精酵母和产酯酵母;霉菌主要为曲霉、根霉、毛霉。姜明军等[13]对某浓香型白酒厂窖泥微生物富集培养同时进行窖泥功能菌(己酸菌、酵母菌)强化培养,培养出的优质窖泥提高了白酒的产质量。乔宗伟等[14]对浓香型白酒酒醅中微生物进行分离纯化得到113类细菌类菌株、92株酵母类菌株以及32类霉菌类菌株,其中芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、梭菌属(Clostridium)为主要细菌微生物类群,酵母菌属(Saccharomyces)、复膜孢子酵母属(Saccharomycopsis)和伊萨酵母属(Issatchenkia)为优势酵母类菌群,犁头霉属(Absidia)和曲霉属(Aspergillus)在霉菌类菌株中占绝对优势。
基于传统微生物培养方法的研究有助于初步了解浓香型白酒生态系统的微生物多样性,但这些方法不足以研究数量庞大的微生物种群,随着分子生物学技术的发展和普及,变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)、克隆文库(clone library)、高通量测序等方法大量应用于白酒酿造微生物,某些无法培养的微生物类群也逐渐被人们所认识,浓香型白酒酿造生境中优势微生物见表1。这些方法旨在全面了解浓香型白酒生态系统的微生物多样性,进一步解析白酒风味形成机理,为浓香型白酒酿造生产提供指导。
表1 浓香型白酒酿造生境中优势微生物
Table 1 Dominant microorganisms in brewing habitat of strong-flavor Baijiu

主要微生物微生物来源 文献门细菌属优势菌门真菌属优势菌大曲酒醅窖泥黄水厚壁菌门变形菌门拟杆菌门蓝藻门放线菌门厚壁菌门变形菌门放线菌门拟杆菌门蓝细菌门厚壁菌门广古菌门拟杆菌门厚壁菌门广古菌门芽孢杆菌属葡萄球菌属高温放线菌属乳杆菌属微小杆菌属假单胞菌属梭菌属链球菌属魏斯氏菌属乳杆菌属片球菌属瘤胃球菌属酒球菌属乳酸杆菌属产己酸菌属甲烷杆菌属甲烷八叠球菌属乳杆菌属梭菌属沉积菌属甲烷短杆菌属甲烷细菌属乳酸菌葡萄球菌梭状芽孢杆菌乳酸菌醋酸菌酒球菌乳酸菌产己酸菌甲烷菌乳酸菌沉积菌甲烷菌担子菌门子囊菌门担子菌门子囊菌门子囊菌门子囊菌门曲霉属毛霉属根霉属嗜热真菌属链格孢属伊萨酵母属威克汉姆酵母属毕赤酵母属酵母属伊撒酵母属假丝酵母属汉逊酵母属曲霉属青霉属毡盘菌属被孢霉属嗜热真菌属酿酒酵母属曲霉属毛霉属扣囊复膜酵母异常毕赤酵母红曲霉米曲霉毕赤酵母伊萨酵母红曲霉米曲霉青霉菌曲霉菌毛霉菌酿酒酵母红曲霉[15-20][6-7,21-25][26-31][32-35]
2 浓香型白酒酿造生境中微生物多样性
2.1 大曲微生物多样性
中高温大曲作为浓香型白酒生产中的糖化发酵剂,由大麦、小麦、豌豆等原料在开放环境中制作而成。大曲的生产制作对环境要求极高,经过长期的自然驯化可为后续酒醅发酵提供复杂多样的微生物群,进而产生多种功能酶和风味物质。大曲中一般有丝状真菌(主要是霉菌)、酵母、细菌和放线菌四类微生物[36]。大曲内各种微生物通过代谢积累液化酶、糖化酶、蛋白酶和酯化酶等功能酶,将大曲中的淀粉和蛋白质降解成小分子物质,为微生物生长和代谢提供能源以及作为风味物质形成的前体[37]。DENG Y K等[17]研究发现,白酒酒醅中来自大曲中细菌和真菌的比例分别为81.5%和79.2%,它们不仅影响发酵过程中多种功能酶的积累,还决定了大曲最终的微生物群落组成。
细菌是白酒生产中关键酶类和某些风味物质的重要来源,大曲中细菌的优势菌属为芽孢杆菌属(Bacillus)[38]、乳杆菌属(Lactobacillus)、热放线菌属(Thermoactinomyces)[39]等。刘青阳等[38]从中高温大曲中分离出芽孢杆菌(Bacillus),对其进行16S rRNA基因序列分析发现,占比最高的是贝莱斯芽孢杆菌(Bacillus velezensis)(21.74%),其次是苏云金芽孢杆菌(Bacillus thuringiensis)(19.57%)、蜡状芽孢杆菌(15.22%)。此外,大曲中存在的大量地衣芽孢杆菌(Bacillus licheniformis)和枯草芽孢杆菌(Bacillus subtilis)可在高温、酸性环境下通过美拉德反应产生大量吡嗪类化合物,如四甲基吡嗪、三甲基吡嗪、2,6-二甲基吡嗪等[40],四甲基吡嗪是中国白酒特有的功能性成分,可对酒体贡献坚果香及烘焙香,进一步丰满白酒的香气。大曲中的乳酸菌也是一类优势菌种,主要包括融合魏斯氏菌(Weissella confuse)、戊糖片球菌(Pediococcus pentosaceus)、柠檬明串珠菌(Leuconostoc citreum)、耐酸乳杆菌(Lactobacillus acetotolerans)等[41]。乳酸菌通过糖酵解途径将糖类转化为乳酸,除增加酒体绵厚感外,乳酸还可通过醇酰基转移酶途径合成乳酸乙酯,改善酒体风味,然而过量的乳酸乙酯会导致酒质酸涩感较重。大曲中的放线菌也是一类关键微生物,研究人员从浓香型白酒发酵大曲中分离出36种放线菌,其中优势菌属为热放线菌属(Thermoactinomyces)以及链霉菌属(Streptomyces)。热放线菌在发酵过程中产生的脂肪酶和磷酸酶可以减少乳酸乙酯的产生,减轻白酒的酸涩感,同时热放线菌可以自身合成重要的风味成分,如己酸乙酯、糠醇、苯乙醇、吡嗪、丁酸和乙酸。更有意义的是,主要的放线菌株能够产生抗生素,抑制功能性细菌及有害微生物的生长[42]。
酿酒酵母和非酿酒酵母是浓香型白酒大曲中主要存在的两类酵母,包括酿酒酵母属(Saccharomyces)、假丝酵母属(Candida)、毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)、汉逊酵母属(Hansenula)、结合酵母属(Zygosac charomyces)等[43]。WANG H Y等[18]研究显示,大曲中优势酵母菌为扣囊复膜酵母(Saccharomycopsis fibuligera)和异常毕赤酵母(Pichia anomala)。扣囊复膜酵母(Saccharomycopsis fibuligera)能够分泌高活性的淀粉酶、酸性蛋白酶及β-葡萄糖苷酶等酶类促进酒醅发酵[44]。毕赤酵母属(Pichia)、汉逊酵母属(Hansenula)、假丝酵母属(Candida)等能够产生有机酸、酯类、醛类及高级醇等风味物质[45]。除酵母外,浓香型白酒大曲中还含有丰富的霉菌,最常见的霉菌种类有嗜热子囊菌属(Thermoascus)、根毛霉属(Rhizomucor)、曲霉菌属(Aspergillus)等[46]。HUANG Y H等[47]利用宏转录组学技术对大曲生产过程中活性微生物群落功能进行探索,发现毛霉菌、酵母菌和米根霉菌等真菌在50 ℃和62 ℃条件下参与糖酵解、乙醇代谢、丙酮酸代谢和柠檬酸盐循环等途径,同时能够上调8种己糖激酶、10种6-磷酸果糖激酶和16种丙酮酸激酶基因,意味着大曲能够进行稳定的糖化发酵及产生风味物质。雷学俊等[48]分别对浓香型白酒酿造生境中的产α-淀粉酶、中性蛋白酶、果胶酶及纤维素酶的霉菌产酶特性进行解析,发现烟曲霉(Aspergillus tabacinus)产α-淀粉酶活力最高,Penicillium limosum产中性蛋白酶活力最高,Scopulariopsis sclerotiorum产果胶酶及纤维素酶活力最高。
2.2 酒醅微生物多样性
酒醅是指蒸煮过后发酵好的谷物,浓香型白酒酒醅分为上中下三层,是微生物进行发酵的主要载体,酒醅中的微生物主要来自大曲粉及酿造生产环境(包括水、空气、窖泥和生产工具等)。由于发酵前期酒醅中营养物质丰富以及适宜的环境,微生物生长繁殖快,因此该阶段酒醅中微生物多样性及相对丰度均较高,发酵前期浓香型白酒酒醅中的优势细菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)[6],发酵中后期不同层次的酒醅菌群多样性及相对丰度降低,这是由于酒醅的厌氧发酵抑制了好氧微生物生长繁殖,同时产生的酸类物质影响了不耐酸菌群的生长。郭小蛟等[21]对浓香型白酒酒醅微生物蛋白质提取检测发现细菌蛋白质占总蛋白的50%,这说明细菌在酒醅中占据主导地位,其中随着酒醅发酵时间延长,乳杆菌属(Lactobacillus)成长为绝对的优势菌属,主要包括乳酸菌科和醋酸杆菌科[7]。此外其他平均相对丰度>1.00%的乳酸菌为片球菌属(Pediococcus)、瘤胃球菌属(Ruminococcus)及酒球菌属(Oenococcus)[22],这些微生物提供了发酵所需的酸性环境以及形成有机酸等风味物质。
酵母是酒醅发酵过程中的核心真菌微生物,在发酵过程中除产生乙醇及风味物质外,还可与其他微生物相互作用,如酿酒酵母在发酵过程中可以抑制地衣芽孢杆菌的生长,以不同的比例接种酿酒酵母和地衣芽孢杆菌,代谢产物随两种微生物的比例而变化[49]。酿酒酵母属(Saccharomyces)、伊撒酵母属(Issatchenkia)、假丝酵母属(Candida)、汉逊酵母属(Hansenula)等是浓香型白酒酒醅中的主要优势菌属,同时不同层酒醅中的微生物丰富度存在差异[23],如上层酒醅细菌数量最多,下层酵母菌数量最多,这导致了不同层次的酒醅风味差异,这可能与酒醅自身的物料配比、与窖泥及黄水接触程度有关。此外,酒醅中曲霉菌属(Aspergillus)、拟孔菌属(Fomitopsis)、嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)也被检出[24-25],米曲霉可作为发酵过程中的糖化剂为酵母提供可发酵糖,同时其代谢也可产生大量的醇和酯[50]。
2.3 窖泥的微生物多样性
窖池是酒醅进行发酵的场所,窖池的内壁及底部被窖泥所覆盖,窖泥中有大量的酿酒微生物存在,可分为窖底泥与窖壁泥。窖底泥由于长期被黄水所浸泡表现为厌氧环境,而窖壁泥通常封窖后才处于厌氧状态,这导致了不同层次的窖泥微生物多样性具有差异,此外窖龄的不同也导致了窖泥内的菌群差异。通常年份短的窖泥中的微生物多样性总体上高于年份长的窖泥,尤其是原核微生物,同一窖龄的上层和中层窖泥的真菌的多样性与丰富度高于底层窖泥[51]。窖泥内的微生物主要由细菌及古菌组成,其中细菌以革兰氏阳性菌和厌氧菌占主导地位,古菌以甲烷菌为主要菌群[26],优势菌门为厚壁菌门(Fimicutes)、广古菌门(Euryarchaeota)和拟杆菌门(Bacteroidetes)[27],其中Firmicutes菌群是窖泥产香生酸的关键微生物菌群,窖泥质量的与其丰度息息相关。就细菌菌属而言,研究发现乳酸杆菌属(Lactobacillus)及产己酸菌属(Caproiciproducens)在窖泥细菌微生物群落中占绝对优势[28],这使得酒醅中有机酸的含量甚至高于乙醇的含量,产己酸菌主要为厌氧己酸菌,包括梭菌属(Clostridium)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)等。辜杨[29]研究发现,甲烷杆菌属(Methanobacterium)和甲烷八叠球菌属(Methanosarcina)为窖泥内的优势古菌属。梭状芽孢杆菌、产己酸菌和甲烷杆菌科(Methanobacteriaceae)之间存在协同作用,氢元素能够进行种间转移有利于代谢二者互利共生,氨基酸杆菌属(Acidaminobacter)和巴氏甲烷八叠球菌(Methanosarcina barkeri)能够促进挥发性脂肪酸的产生,进一步丰富酒体风味[49]。此外,甲烷菌能够促进某些厌氧真菌进行降解一些小分子物质[52]。酵母菌在窖泥内的真菌占据主导地位,尤其是毕赤酵母属(Pichia)、威克汉姆酵母属(Wickerhamomyces)、酿酒酵母属(Saccharomyces)和Galactomyces[30]。王春艳等[31]对浓香型白酒窖泥的真菌菌群结构分析,发现门水平上绝对优势菌门为子囊菌门(Ascomycota),其相对丰度为68.7%~86.2%,属水平上,优势真菌群(相对丰度>1%)主要有青霉属(Penicillium)、毡盘菌属(Byssonectria)、被孢霉属(Mortierella)、嗜热真菌属(Thermomyces)、曲霉菌属(Aspergillus)、根毛霉属(Rhizomucor),尤其是红曲霉对突出浓香型白酒己酸乙酯的主体香具有重要作用。
2.4 黄水微生物多样性
黄水是酒醅发酵过程中由微生物的代谢产物以及淋浆水沉降到窖池底部形成的棕褐色液体,其作为浓香型白酒发酵过程中的主要副产物,含有多种微生物菌群,对于浓香型白酒风味物质的形成起关键作用[32]。浓香型白酒酿造生境中主要微生物群落的功能特性见图3。
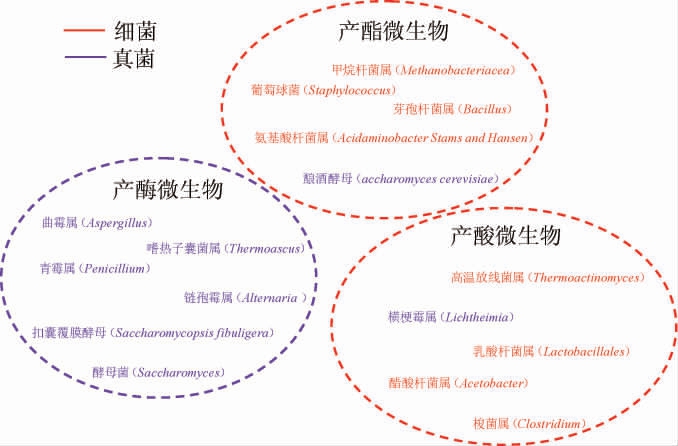
图3 浓香型白酒酿造生境中主要微生物群落的功能特性
Fig.3 Functional characteristics of main microbial communities in strong-flavor Baijiu brewing habitat
由图3可知,浓香型白酒酿造过程中所需的酶主要由真菌所提供,包括曲霉属(Aspergillus)、青霉属(Penicillium)、链孢霉属(Streptomyces)等,细菌中的乳酸杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)、高温放线菌属(Thermoactinomyces)等微生物主要进行产酸,酯化增香的过程则依赖芽孢杆菌属(Bacillus)、甲烷杆菌属(Methanobacterium)、葡萄球菌属(Staphylococcus)等细菌进行。张会敏等[33]在黄水中检测到32个细菌门、3个古菌门,其中厚壁菌门(Firmicutes)为黄水中的绝对优势菌门,其含量占样本的95%以上,其产生的酯类物质占黄水挥发性成分的90%,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)为其余四个优势菌门。黄水中存在的主要细菌属包括乳杆菌属(Lactobacillus)、梭菌属(Clostridium)和沉积菌属(Sedimentibacter),这也是发酵后期酒醅中有机酸、乙醛、乙缩醛等物质含量明显增高的原因之一。此外甲烷短杆菌属(Methanobrevibacter)、甲烷细菌属(Methanobacterium)、甲烷粒菌属(Methanocorpusculum)、甲烷袋状菌属(Methanoculleus)、甲烷杆菌属(Methanobacterium)、甲烷八叠球菌属(Methanosarcina)被确定为黄水内存在的古菌[34]。李可[35]对浓香型白酒发酵黄水中的真菌种属进行鉴定,结果显示,酿酒酵母(Saccharomyces cerevisiae)是黄水中真菌主要类群,约占总数的41.0%,其他优势菌属还有曲霉属(Aspergillus)、毛霉属(Mucor)等。
3 浓香型白酒酿造生境中微生物群落主要菌群种间相互作用
传统白酒发酵具有复杂的微生物体系和生物转化机制,不同的菌株之间的物理缔合和分子相互作用可以导致多种不同结果,如共生、竞争、抑制等。发酵过程中微生物的代谢及一系列基于代谢产物的种间相互作用是形成白酒风味物质的关键,通常包括细菌-细菌作用、酵母-酵母作用以及酵母-细菌作用,利用微生物的相互作用对白酒品质进行定向调控是浓香型白酒生产工艺升级的一个重要方向。
3.1 细菌-细菌相互作用
大部分细菌的代谢产物都具有一定的生物调控功能,尤其是放线菌,其可通过产生纤维素酶、淀粉酶、果胶酶和蛋白酶等生物分子对其他功能细菌进行生物调节,如链霉菌促进己酸生成主要原因就是产生黑色素清除丁酸梭菌细胞表面的自由基[42]。放线菌还是天然抗生素的重要来源,如链霉菌属(Streptomyces)、小单孢菌属(Micromonospora)及诺卡氏菌属(Nocardia)均能产生氯霉素类、大环内酯类和四环素类等抗生素,从而有效抑制发酵过程中有害菌及功能性菌生长[53]。此外,产生土臭素的链霉菌被认为是导致白酒中泥土异味的最频繁和最严重的异味污染源,枯草芽孢杆菌(Bacillus subtilis)及解淀粉芽孢杆菌(Bacillus amyloliquefaciens)在生长过程中可以产生脂肽来抑制链霉菌的生长,从而降低白酒中土臭素的浓度[54]。
3.2 酵母-酵母相互作用
尽管各种各样的微生物可能参与酒精发酵并有助于最终产品的感官特性,但酿酒酵母由于其发酵性能强以及高乙醇耐受性等原因总是在发酵的最后阶段占主导地位。研究发现酿酒酵母与非酿酒酵母混合培养时其存活以及发酵糖的时间比单一培养时长得多,这有助于发酵前期优势菌群的建立以及糖的充分消耗,此外具有高β-葡萄糖苷酶活性的非酿酒酵母可以提高白酒的香气复杂性[55]。然而,由于非酿酒酵母自身无法控制发酵过程,发酵前期的快速生长可能限制酿酒酵母的营养摄取,这就导致了发酵缓慢或停滞,同时也可能对酒体香气组成造成影响[56]。
3.3 酵母-细菌相互作用
许多微生物生活在群落中,依靠群落成员分泌的代谢物生存。如酵母菌利用原料中的还原糖进行生长繁殖和发酵产生乙醇的同时,其代谢产物还为乳酸菌提供生长所需的营养物质如氨基酸、维生素等。在富含氮的环境中,酿酒酵母通过分泌大量代谢物(尤其是氨基酸)来调节其新陈代谢,从而使乳杆菌和乳酸菌存活,有效氮源的数量和氮分解代谢抑制途径共同对这种生态位进行调节[57]。乳酸菌的存在也可使得酿酒酵母受益,尽管酿酒酵母不能利用乳糖,但乳酸菌能够将乳糖分解成葡萄糖和半乳糖,这些葡萄糖和半乳糖可以很容易地被酵母代谢。
酵母分泌的代谢物和肽能够对其他微生物的生长产生重大影响,其他微生物的可培养性可能在与酵母共同发酵下被降低。除产生高浓度乙醇外,酿酒酵母还产生某些挥发性化合物及抗菌肽抑制其他微生物生长[58]。
4 展望
浓香型白酒酿造生境中存在的各种微生物赋予了浓香型白酒的独特风味,然而由于其内微生物种类繁多、种属间互作形式多样、代谢反应复杂、时空差异显著等原因,导致了浓香型白酒发酵过程难以调控,尽管酒体平均质量稳定,但单一窖池产出酒体品质稳定性有波动,同时目前浓香型白酒酿造生境中微生物的研究大多集中于某些功能微生物的分离培养以及菌群鉴定上,对菌群种间相互作用的了解仅限于少数具有少量交换代谢物的群落。因此亟需对浓香型白酒生态系统中微生物群落的动态变化及种属间相互作用进行全面研究,这些研究有助于阐述浓香型白酒酿造生境中的关键生物成分,将这些关键成分与微生物群落的功能与相互作用相关联,进而构建出具备预测能力的微生物代谢模型,提升浓香型白酒发酵质量及酒体的稳定性。
[1]张治刚,张彪,赵书民,等.中国白酒香型演变及发展趋势[J].中国酿造,2018,37(2):15-18.
[2]李曙光,宋全厚,宋书玉,等.GBT10781.1—2021 白酒质量要求第一部分:浓香型白酒[S].北京:中国标准出版社,2021.
[3]YAO F,YI B,SHEN C H,et al.Chemical analysis of the Chinese liquor Luzhoulaojiao by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Sci Rep,2015,5(1):9553.
[4] CHEN G, CHEN C C, LEI Z H.Meta-omics insights in the microbial community profiling and functional characterization of fermented foods[J].Trends Food Sci Tech,2017,65(7):23-31.
[5]阙云飞,杨昌彪,朱平,等.腐乳发酵过程中微生物种群结构研究进展[J].食品安全质量检测学报,2022,13(5):1582-1587.
[6]胡晓龙,王康丽,余苗,等.浓香型酒醅微生物菌群演替规律及其空间异质性[J].食品与发酵工业,2020,46(10):66-73.
[7] SUN W N,XIAO H Z,PENG Q,et al.Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J].Ann Microbiol,2016,66(3):1293-1301.
[8]XU Y Q,WU M Q,NIU J L,et al.Characteristics and correlation of the microbial communities and flavor compounds during the first three rounds of fermentation in Chinese sauce-flavor Baijiu[J].Foods,2023,12(1):207.
[9]LU Y H,ZHANG C N,ZHAO H,et al.Effect of environmental microorganisms on fermentation microbial community of sauce-flavor Baijiu[J].Foods,2023,12(1):10.
[10]范培文,刘蒲临,张明春,等.浓酱兼香型白酒发酵酒醅微生物群落及理化指标对正丙醇产出的影响[J].中国酿造,2022,41(7):32-37.
[11]乔宗伟.中国浓香型白酒窖池微生物区系解析[D].成都:四川大学,2005.
[12]施安辉.浓香型白酒发酵过程窖中微生物区系的分析[J].酿酒,1986,13(4):24-29.
[13]姜明军,宋和付,陈安国.浓香型白酒窖泥中重要微生物的分析与研究[J].湘潭矿业学院学报,2003(4):91-94.
[14]乔宗伟,张文学,张丽莺,等.浓香型白酒发酵过程中酒醅的微生物区系分析[J].酿酒,2005,37(1):18-22.
[15] LIU Y B, LI X, LI H D, et al.Taorong-type Baijiu starter: Analysis of fungal community and metabolic characteristics of middle-temperature Daqu and high-temperature Daqu[J].Plos One,2022,17(10):e0274881.
[16]HOU X G,HUI M,SUN Z K,et al.Comparative analysis of the microbiotas and physicochemical properties inside and outside medium-temperature Daqu during the fermentation and storage[J].Front Microbiol,2022,13(7):934696.
[17] DENG Y K, HUANG D, HAN B L, et al.Correlation: Between autochthonous microbial diversity and volatile metabolites during the fermentation of Nongxiang Daqu[J].Front Microbiol,2021,12(9):688981.
[18]WANG H Y,GAO Y B,FAN Q W,et al.Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCRDGGE: Microbiota in Chinese liquor Daqu[J].Lett Appl Microbiol,2011,53(2):134-140.
[19]王清龙,李海登,刘延波,等.河南不同地区浓香型白酒大曲理化性质和微生物多样性分析[J].中国酿造,2022,41(11):31-38.
[20]周森,王成,朱绍宾,等.基于高通量测序技术分析浓香型白酒大曲真菌菌群多样性[J].中国酿造,2021,40(11):55-59.
[21]郭小蛟,唐玉明,田新惠,等.基于两种预处理方法的白酒酒醅微生物宏蛋白质组学比较[J].食品科学,2022,43(20):216-221.
[22]陈慧颖,李慧星,许彬,等.高通量测序研究浓香型酒酷的细菌菌群多样性及共变性[J].工业微生物,2021,51(4):35-43.
[23]刘念,刘绪,张磊,等.浓香型白酒糟醅中真菌菌群的研究[J].食品与发酵科技,2011,47(2):28-31.
[24] ZHANG W X, QIAO Z W, TANG Y Q, et al.Analysis of the fungal community in zaopei during the production of Chinese Luzhou-flavour liquor[J].J I Brewing,2007,113(1):21-27.
[25] SHI S, ZHANG L, WU Z Y, et al.Analysis of the fungi community in multiple-and single-grains Zaopei from a Luzhou-flavor liquor distillery in western China[J].World J Microbiol Biotechnol,2011,27(8):1869-1874.
[26]ZHAO J S,ZHENG J,ZHOU R Q,et al.Microbial community structure of pit mud in a Chinese strong aromatic liquor fermentation pit:Microbial community of pit mud[J].J I Brewing,2012,118(4):356-360.
[27]雷学俊,张霞,赵东,等.乳酸对浓香型白酒窖泥微生物群落的影响研究[J].中国酿造,2023,42(1):37-40.
[28]胡晓龙,余苗,王康丽,等.浓香型白酒窖泥微生物群落多样性及理化因素对其影响[J].食品研究与开发,2021,42(2):178-185204.
[29]辜杨.中国浓香型白酒酿造窖泥微生物多样性研究[D].无锡:江南大学,2021.
[30]ZHANG L,ZHOU R,NIU M,et al.Difference of microbial community stressed in artificial pit muds for Luzhou-flavour liquor brewing revealed by multiphase culture-independent technology[J].J Appl Microbiol,2015,119(5):1345-1356.
[31]王春艳,付博辰,郭书贤,等.宋河浓香型白酒不同窖龄窖壁泥与窖底泥真菌菌群结构分析[J].中国酿造,2021,40(2):88-91.
[32]黄治国,江科,乔宗伟,等.五粮浓香型白酒发酵过程中黄水变化规律探究[J].现代食品科技,2023,39(5):210-216.
[33]张会敏,孟雅静,王艳丽,等.新老窖池黄水的差异性及静置培养对其影响[J].食品科学,2020,41(2):215-222.
[34] LI H, HUANG J, LIU X P, et al.Characterization of interphase microbial community in Luzhou-flavored liquor manufacturing pits of various ages by polyphasic detection methods[J].J Microbiol Biot,2017,27(1):130-140.
[35]李可.中国浓香型白酒发酵黄水中微生物群落结构及多样性解析[D].成都:西华大学,2014.
[36] ZHENG X W,TABRIZI M R, NOUT M J R, et al.Daqu-A traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[37] HE G Q, HUANG J, ZHOU R Q, et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10(1):56.
[38]刘青阳,黄晓宁,陆玮,等.中高温大曲中芽孢杆菌多样性及代谢特征研究[J].中国酿造,2022,41(7):26-31.
[39] MAO J J,LIU X L,GAO T,et al.Unraveling the correlations between bacterial diversity,physicochemical properties and bacterial community succession during the fermentation of traditional Chinese strong-flavor Daqu[J].LWT-Food Sci Technol,2022,154(1):112764.
[40]王鹏.地衣芽孢杆菌强化对浓香型白酒酿造微生物群落结构和代谢的影响[D].无锡:江南大学,2017.
[41]周森,胡佳音,崔洋,等.应用高通量测序技术解析清香型大曲微生物多样性[J].中国食品学报,2019,19(6):244-250.
[42]CHEN C,YANG H Q,LIU J,et al.Systematic review of actinomycetes in the Baijiu fermentation microbiome[J].Foods,2022,11(22):3551.
[43]董琪,蒲顺昌,刘飞翔,等.浓香型大曲中功能性酵母菌的筛选、鉴定及发酵特性研究[J].中国酿造,2020,39(6):106-110.
[44]苏畅,马莹莹,杨建刚.扣囊复膜酵母在酿酒中的应用研究进展[J].食品研究与开发,2018,39(1):205-209,220.
[45]张敏倩,刘功良,费永涛,等.白酒酿造中杂醇油调控技术的研究进展[J].中国酿造,2020,39(5):8-12.
[46]夏玙,罗惠波,周平,等.不同处理方式的大曲真菌群落差异分析[J].食品科学,2018,39(22):166-172.
[47] HUANG Y H, YI Z L, JIN Y L, et al.Metatranscriptomics reveals the functions and enzyme profiles of the microbial community in Chinese Nong-flavor liquor starter[J].Front Microbiol,2017,8(9):1747.
[48]雷学俊,赵东,郑佳,等.五粮液酿造环境空气中霉菌的分离鉴定及产酶初探[J].食品与发酵工业,2022,48(23):71-77.
[49]MENG X,WU Q,WANG L,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J].J Ind Microbiol Biot, 2015,42(12):1601-1608.
[50]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J].J Food Sci,2018,84(1):6-18.
[51]肖琴,何平,周瑞平,等.不同窖龄及位置浓香型白酒窖泥的微生物群落多样性与理化因子的比较分析[J].食品科学,2023,44(20):165-174.
[52]李袁飞.共培养技术研究甲烷菌对厌氧真菌代谢的影响[D].南京:南京农业大学,2017.
[53] IVEY M, MASSEL M, PHISTER T G.Microbial Interactions in Food Fermentations[J].Annu Rev Food Sci Technol,2013,4(2):141-162.
[54]ZHI Y,WU Q,DU H,et al.Biocontrol of geosmin-producing Streptomyces spp.by two Bacillus strains from Chinese liquor[J].Int J Food Microbiol,2016,231(8):1-9.
[55] ALBERGARIA H, ARNEBORG N.Dominance of Saccharomyces cerevisiae in alcoholic fermentation processes:role of physiological fitness and microbial interactions[J].Appl Microbiol Biot,2016,100(1):2035-2046.
[56] MEDINA K, BOIDO E, DELLACASSA E, et al.Growth of non-Saccharomyces yeasts affects nutrient availability for Saccharomyces cerevisiae during wine fermentation[J].Int J Food Microbiol, 2012, 157(2):245-250.
[57]PONOMAROVA O,GABRIELLI N,SÉVIN D C,et al.Yeast creates a niche for symbiotic lactic acid bacteria through nitrogen overflow[J].Cell Syst,2017,5(4):345-357.
[58]JOUHTEN P,PONOMAROVA O,GONZALEZ R,et al.Saccharomyces cerevisiae metabolism in ecological context[J].Fems Yeast Res,2016,16(7):fow080.