沙棘是甘肃省的特色经济林资源之一,既是水土保持和防风固沙的先驱植物,又为卫生部颁布的第一批药食同源资源[1]。沙棘的根、茎、叶、花、果,特别是沙棘果实含有丰富的维生素、有机酸、氨基酸、脂肪酸、微量元素等营养物质和超氧化歧化酶(superoxide dismutase,SOD)、多酚、黄酮、三萜类及生物碱等生物活性物质[2-3],具有较高的营养保健作用和药用价值[4-5]。目前,对沙棘资源的研究与开发逐渐深入,已从最初的水土保持的先锋树种转变为具有营养价值和医药保健作用的经济林[6],沙棘被广泛应用于高级饮料和保健产品的加工领域,发展潜力巨大[7-9]。基于沙棘较高的保健作用和营养药用价值,以及沙棘浆果能有效促进益生菌生长和繁殖的特性[10],利用微生物发酵沙棘制备沙棘酵素具有较好的应用开发前景。
在“后疫情”、“大健康”时代背景下,“药食同源”思想与“医养结合”的理念相契合,追求健康成为消费者的首要诉求,使得功能性原料尤其是药食同源原料备受追捧[11-12]。食用沙棘酵素作为一种由药食同源食品沙棘经微生物发酵制成的新型食品,富集了沙棘果实中的多酚、黄酮、有机酸等功能因子,具有营养、食疗等功能[13]。沙棘酵素不仅含有原料自身的多种维生素、矿物质和酶等营养物质,还可通过复杂的物质代谢,产生一些新的次生代谢物及生物活性成分,可有效预防与缓解人体的亚健康状态,具有十分重要的科学意义与社会意义[14]。目前,沙棘酵素的研究多集中在发酵过程难以精准控制的自然发酵方面,张浩然等[15]从微生物的角度阐述了沙棘酵素的代谢过程;金哲宁等[16]研究发现,自然发酵沙棘酵素具有较好的体外抗氧化能力可能与其有机酸、游离氨基酸等功能性成分的协同作用有关;汤灿辉等[17]揭示了沙棘酵素发酵过程中细菌菌群结构演变规律及自然发酵本质,但自然发酵工艺因其发酵菌种庞杂,造成产品的品质难以控制,因而利用特定微生物发酵加工食用沙棘酵素以提高其品质和发酵过程可控性势在必行。
有研究表明,植物乳杆菌(Lactiplantibacillus plantarum)和酿酒酵母(Saccharomyces cerevisiae)混合发酵可显著改善红枣酒的挥发性风味特征和感官品质[18],异常汉逊酵母(Hansenula anomala)可提高发酵产品的酶含量,同时产生的乙酸乙酯在改善食品风味中起了一定作用[19]。因此,本研究以沙棘为原料,选择酿酒酵母(Saccharomyces cerevisiae)、异常汉逊酵母(Hansenula anomala)、植物乳杆菌(Lactiplantibacillus plantarum)为发酵菌剂混菌发酵制备沙棘酵素,并通过单因素试验和响应面法优化沙棘酵素多菌种发酵工艺条件,为沙棘酵素的产业化、规模化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
沙棘果实:采自庆阳市华池县,果实完好无损,约在10月中下旬采收;酿酒酵母(Saccharomyces cerevisiae)(Sc)、异常汉逊酵母(Hansenula anomala)(Ha)、植物乳杆菌(Lactiplantibacillus plantarum)(Lp):中国食品发酵工业研究院有限公司。
1.1.2 培养基与试剂
MRS培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:北京奥博星生物技术有限责任公司;蛋白胨、琼脂粉、酵母浸出粉、葡萄糖(均为生化试剂):上海源叶生物科技有限公司;NaOH、福林酚、没食子酸、苯酚、硫酸、无水乙醇、三羟甲基氨基甲烷、盐酸、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid disodium salt,EDTA·2Na)、邻苯三酚(均为分析纯):陕西中瑞合成化学有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
RIGOL L3000高效液相色谱(high performance liquid chromatography,HPLC)仪:北京普源精电科技有限公司;LRH-70型恒温培养箱:上海一恒科学仪器有限公司;YXQLS-75G型立式压力蒸汽灭菌锅:上海博迅实业有限公司医疗设备厂;BL-2200H电子天平(精度0.01 g):日本岛津公司;CARY 100紫外-可见分光光度计:美国瓦里安有限公司;TGL-16LM高速冷冻离心机:湖南星科科学仪器有限公司;MDF-U3386S超低温冰箱:青岛海尔集团;DL-CJ-1N超净工作台:北京东联哈尔仪器制造有限公司;PB-10型精密pH计:赛多利斯科学仪器(北京)有限公司。
1.3 方法
1.3.1 菌种活化
酵母菌和植物乳植物杆菌分别以0.5%的接种量接种于50 mL的YPD、MRS培养基中,酵母菌于28 ℃条件下活化48~72 h,植物乳杆菌于37 ℃条件下活化24 h后,将它们传代到相应的固体培养基中获得单菌落,单菌落再次传代液体培养,酵母菌细胞数达到6 lgCFU/mL,植物乳杆菌细胞数达到8 lgCFU/mL,再将菌液于4 ℃、5 000 r/min离心10 min,取菌泥用等体积蒸馏水重悬清洗3次,备用。
1.3.2 沙棘酵素的制备工艺
沙棘→清洗→沥干水分→辐照→破碎→装罐→加水→调节糖度、pH→接种发酵→过滤→成品
操作要点[20,29]:挑选新鲜沙棘果用纯净水冲洗干净后沥干水分,沙棘果、冰糖粉以及破碎、称量等相关器具均在紫外灯下辐照处理30 min。利用小型水果破碎机将沙棘果果皮破碎后,将其与纯净水按料液比500∶1(g∶L)加入3 L无菌酵素发酵罐中,加入15%的冰糖粉并搅拌均匀,采用碳酸钠调节pH至5.0,将活化好的Sc、Ha和Lp以1.0∶1.5∶2.5的菌种比例按10%的接种量接种到沙棘果与糖的混合发酵液中,充分混匀,先于28 ℃条件下发酵3 d后,调整发酵温度于37 ℃条件下发酵5 d,再于26 ℃下密封发酵后熟至180 d,每个样品3个重复,-80 ℃保存待检测。
1.3.3 沙棘酵素多菌种发酵工艺优化单因素试验
分别考察初始pH(4.0、4.5、5.0、5.5、6.0)、菌种比例(Sc∶Ha∶Lp)(1.0∶0.5∶1.5、1.0∶1.0∶2.0、1.0∶1.5∶2.5、1.0∶2.0∶3.0、1.0∶2.5∶3.5)、接种量(4%、6%、8%、10%、12%)对沙棘酵素pH、可溶性固形物、总酸、感官品质、还原力和SOD活性等品质指标的影响。
1.3.4 沙棘酵素多菌种发酵工艺优化响应面试验
在单因素试验的基础上,进一步采用Box-Behnken模型试验设计原理[21],以初始pH值(A)、菌种比例(B)、接种量(C)为自变量,以沙棘酵素产品的SOD活性(Y)为响应值,进行3因素3水平的响应面分析,试验重复3次,响应面试验因素与水平见表1。
表1 沙棘酵素多菌种发酵工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for multi-strain fermentation process optimization of Hippophae rhamnoides Jiaosu
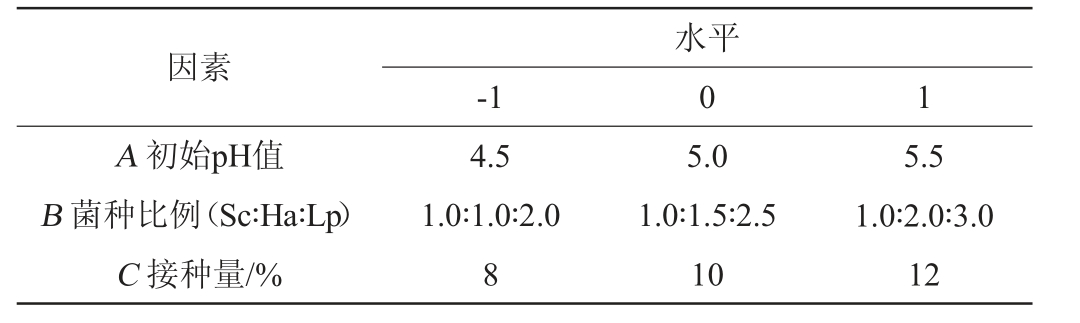
因素A 初始pH值B 菌种比例(Sc∶Ha∶Lp)C 接种量/%-1水平0 1 4.5 1.0∶1.0∶2.0 8 5.0 1.0∶1.5∶2.5 10 5.5 1.0∶2.0∶3.0 12
1.3.5 测定方法
pH、总酸和可溶性固形物含量的测定:参照AMANDA E等[22]的方法;感官评价(满分10分)和乙醇含量的测定:参照张海燕等[23]的方法;还原力(OD700nm值)的测定参照ZOMPRA A A等[24]的方法;超氧化物歧化酶活性的测定:参照GB/T 5009.171—2003《保健食品中超氧化物歧化酶(SOD)活性的测定》[25];总酚含量的测定:参照LI T等[26]的方法;总黄酮含量的测定:参照MULTARI S等[27]的方法;多糖和维生素C(vitamin C,VC)含量的测定:参照蔡丽琴[28]的方法。
1.3.6 数据处理
所有试验均重复3次。采用Design-Expert 8.0、Microsoft Excel 2010和IBM SPSS 26等数据分析软件对所获的数据进行分析处理、作图及显著性分析。
2 结果与分析
2.1 沙棘酵素多菌种发酵工艺优化单因素试验
2.1.1 初始pH值对沙棘酵素品质的影响
初始pH值对沙棘酵素pH值、可溶性固形物含量、总酸含量、感官评分、还原力、SOD活性的影响见图1。
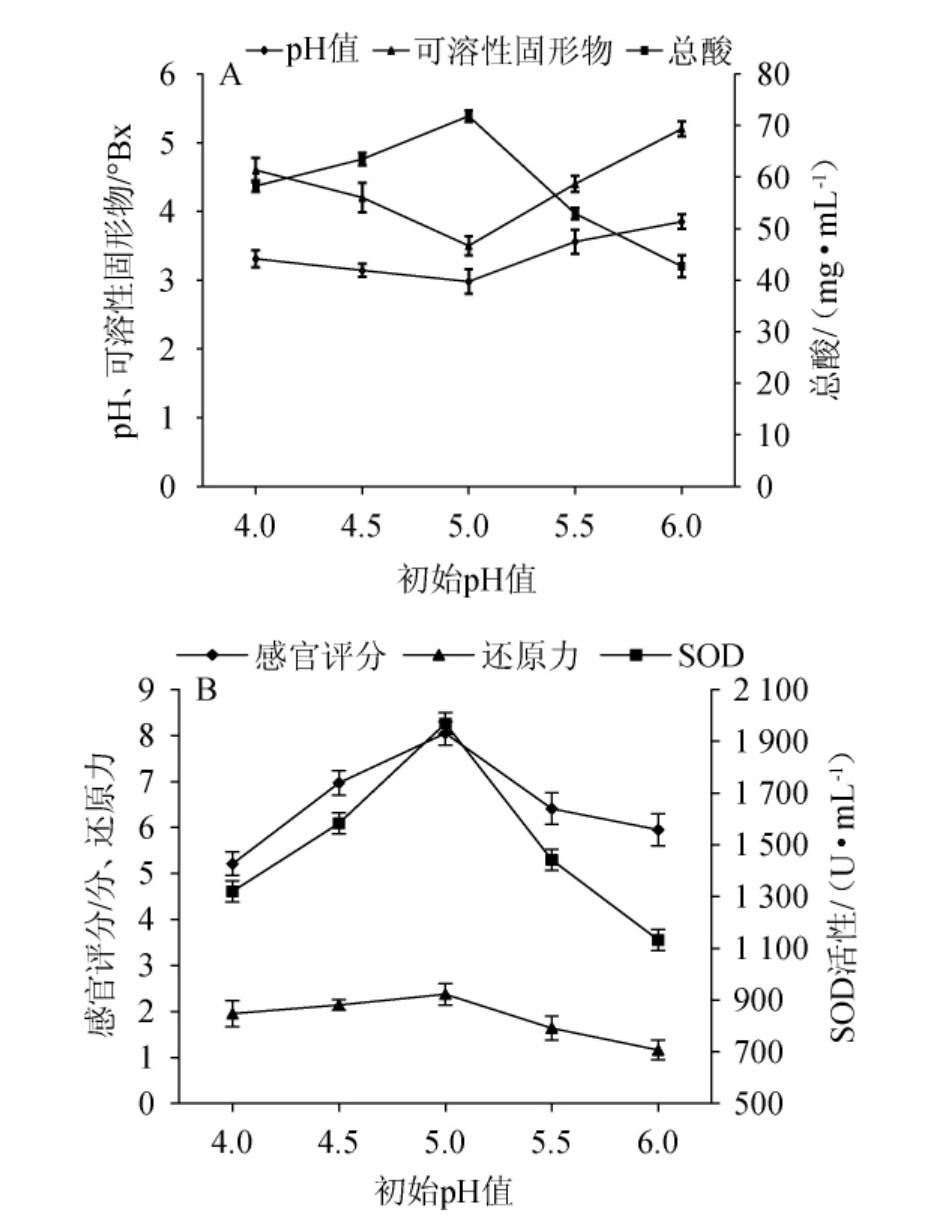
图1 初始pH值对沙棘酵素品质的影响
Fig.1 Effect of initial pH value on Hippophae rhamnoides Jiaosu quality
不同的微生物适宜生长和耐受的pH是不同的,食用酵素发酵过程中,初始pH在很大程度上影响着微生物的生长和代谢产物的生成[29]。由图1A可知,沙棘酵素的pH值和可溶性固形物含量均随着初始pH的升高呈先降低后升高的趋势,当初始pH值为5.0时均最低,分别为2.98和3.50°Bx;然而总酸含量呈先升高后降低的趋势,当初始pH值为5.0时达到最大值为71.80 mg/mL。由图1B可知,随着初始pH值的升高,沙棘酵素的感官评分、还原力和SOD活性均呈先升高后降低的趋势,当初始pH值为5.0时达到峰值,分别为8.05分、2.38和1 968.91 U/mL。说明初始pH值5.0保证了沙棘酵素发酵过程中微生物快速繁殖和生长代谢,有利于提高沙棘酵素的发酵效率,促进发酵进程的顺利进行,提高产品品质。因此,选择初始pH 4.5~5.5为最佳范围进行后续试验。
2.1.2 菌种比例对沙棘酵素品质的影响
酿酒酵母、异常汉逊酵母与植物乳植物杆菌的菌种比例对沙棘酵素pH值、可溶性固形物含量、总酸含量、感官评分、还原力、SOD活性的影响见图2。
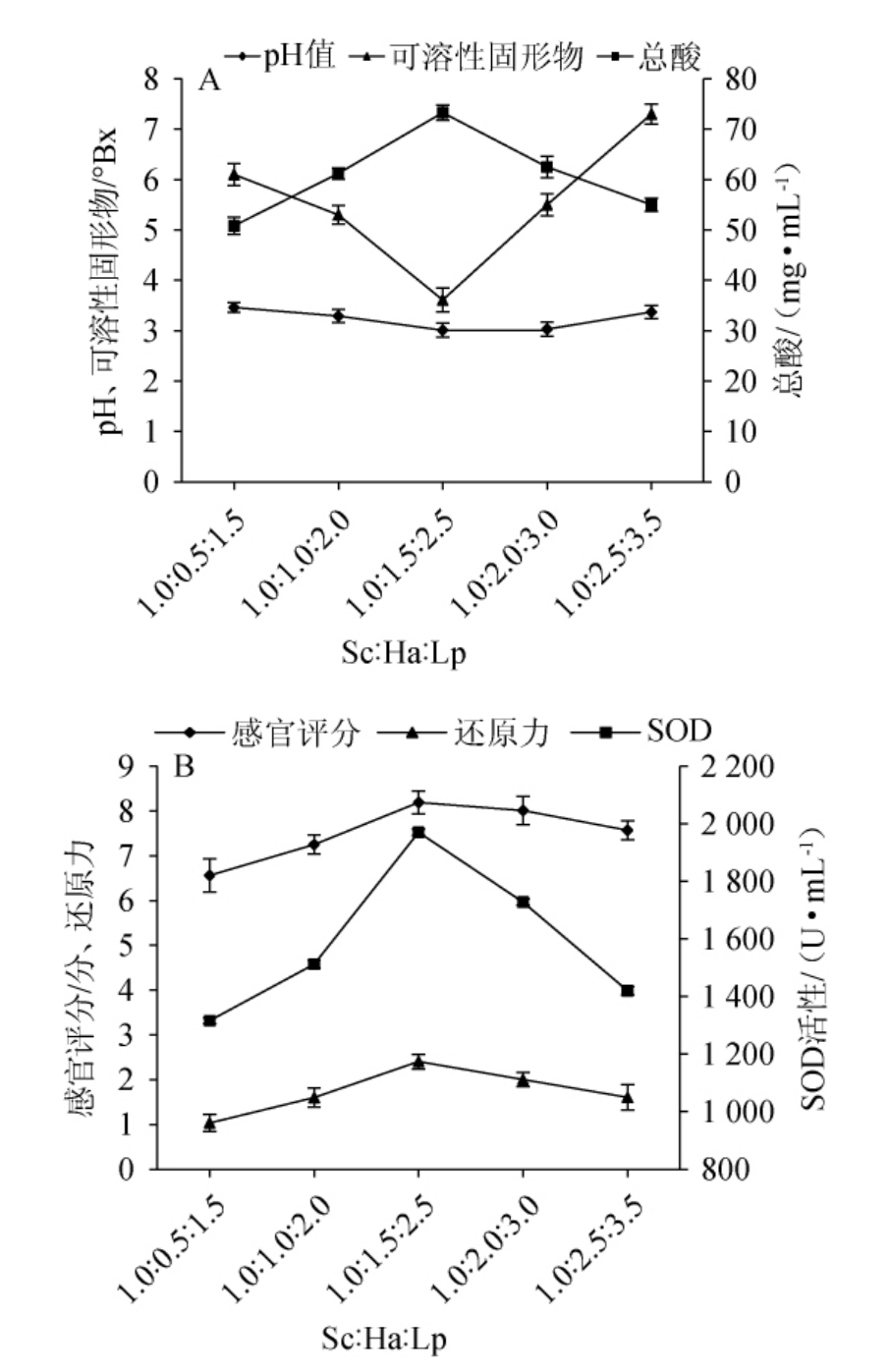
图2 菌种比例对沙棘酵素品质的影响
Fig.2 Effect of strains ratio on Hippophae rhamnoides Jiaosu quality
乳酸菌与酵母菌之间存在着代谢产物互补机制,在促进微生物共生、提高小分子活性物质含量和改进风味品质等方面起着重要的作用,多菌种发酵可以形成互利共生关系,有利于酵素的发酵过程[30]。由图2可知,不同的菌种比例对沙棘酵素的pH、可溶性固形物含量、总酸含量、感官评分、还原力和SOD活性的影响较大,随着菌种比例的变化,沙棘酵素的pH及可溶性固形物的含量均呈先降低后升高的趋势,而总酸含量、感官评分、还原力和SOD活性均呈先升高后下降的趋势。当Sc∶Ha∶Lp为1.0∶1.5∶2.5时,沙棘酵素的发酵进程顺利,发酵液pH和可溶性固形物含量最低,分别为3.01和3.61°Bx,总酸含量、感官评分、还原力和SOD活性最高,分别达到73.28 mg/mL、8.19分、2.40和1 970.33 U/mL,说明适宜比例的多菌种发酵,可提高沙棘酵素的品质,这可能是因为酵母菌通过利用糖代谢作用降低了pH值和可溶性固形物含量,同时通过促进乳酸菌的生长代谢增加了有机酸含量,而且乳酸菌与酵母菌协同发酵可能提高了对感官评价起到较好作用的风味物质含量和产品的抗氧化活性等[31]。因此,选择Sc∶Ha∶Lp 1∶1.0∶2.0~1∶2.0∶3.0为适宜的菌种比例范围进行后续试验。
2.1.3 接种量对沙棘酵素品质的影响
接种量对沙棘酵素pH值、可溶性固形物含量、总酸含量、感官评分、还原力、SOD活性的影响见图3。
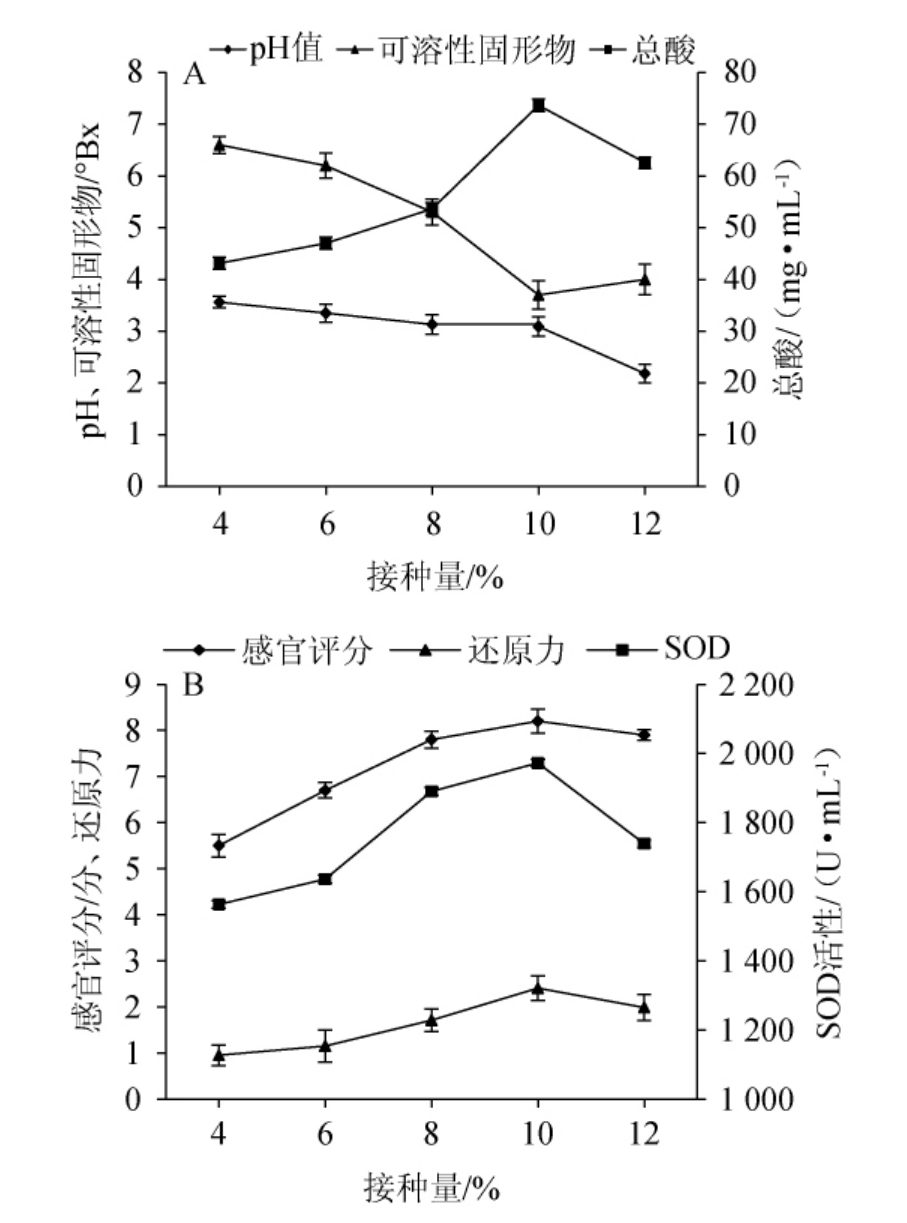
图3 接种量对沙棘酵素品质的影响
Fig.3 Effect of inoculum on Hippophae rhamnoides Jiaosu quality
接种量的大小直接影响着微生物生长繁殖的速度,较大的接种量可以缩短微生物生长代谢达到高峰的时间,提前形成目标产物,并抑制杂菌的生长繁殖;但接种量过大或过小,均会影响发酵进程,接种量过大,发酵初期代谢迅速,引起发酵液中溶氧不足,菌丝体提前衰老,乙醇含量超标,影响微生物代谢产物合成;接种量过小,微生物生长代谢缓慢,培养时间延长,代谢产物合成缓慢或降低,从而降低了产品的质量[32]。由图3可知,随着接种量的增加,发酵液pH和可溶性固形物含量均呈先降低后升高的趋势,总酸含量、感官评分、还原力和SOD活性均呈先升高后降低的趋势,当接种量为10%时,沙棘酵素发酵状态最好,pH和可溶性固形物含量最低,分别为3.09和3.70°Bx,总酸含量、感官评分、还原力和SOD活性最高,分别为73.65 mg/mL、8.20分、2.41和1 972.33 U/mL。因此,选择8%~12%为适宜的多菌种接种量范围进行后续试验。
2.2 沙棘酵素多菌种发酵工艺优化响应面试验结果
2.2.1 响应面试验设计及结果
食用植物酵素因其富含SOD活性而具有较好的保健功效,SOD活性的高低是其品质的重要评价因子[14]。因此,根据单因素试验结果,选择初始pH值(A)、菌种比例(Sc∶Ha∶Lp)(B)、接种量(C)为影响因素,以SOD活性(Y)为响应值,采用Box-Behnken试验设计3因素3水平的响应面试验,试验设计及结果见表2。
表2 沙棘酵素多菌种发酵工艺优化响应面试验设计与结果
Table 2 Design and results of response surface tests for multi-strain fermentation process optimization of Hippophae rhamnoides Jiaosu
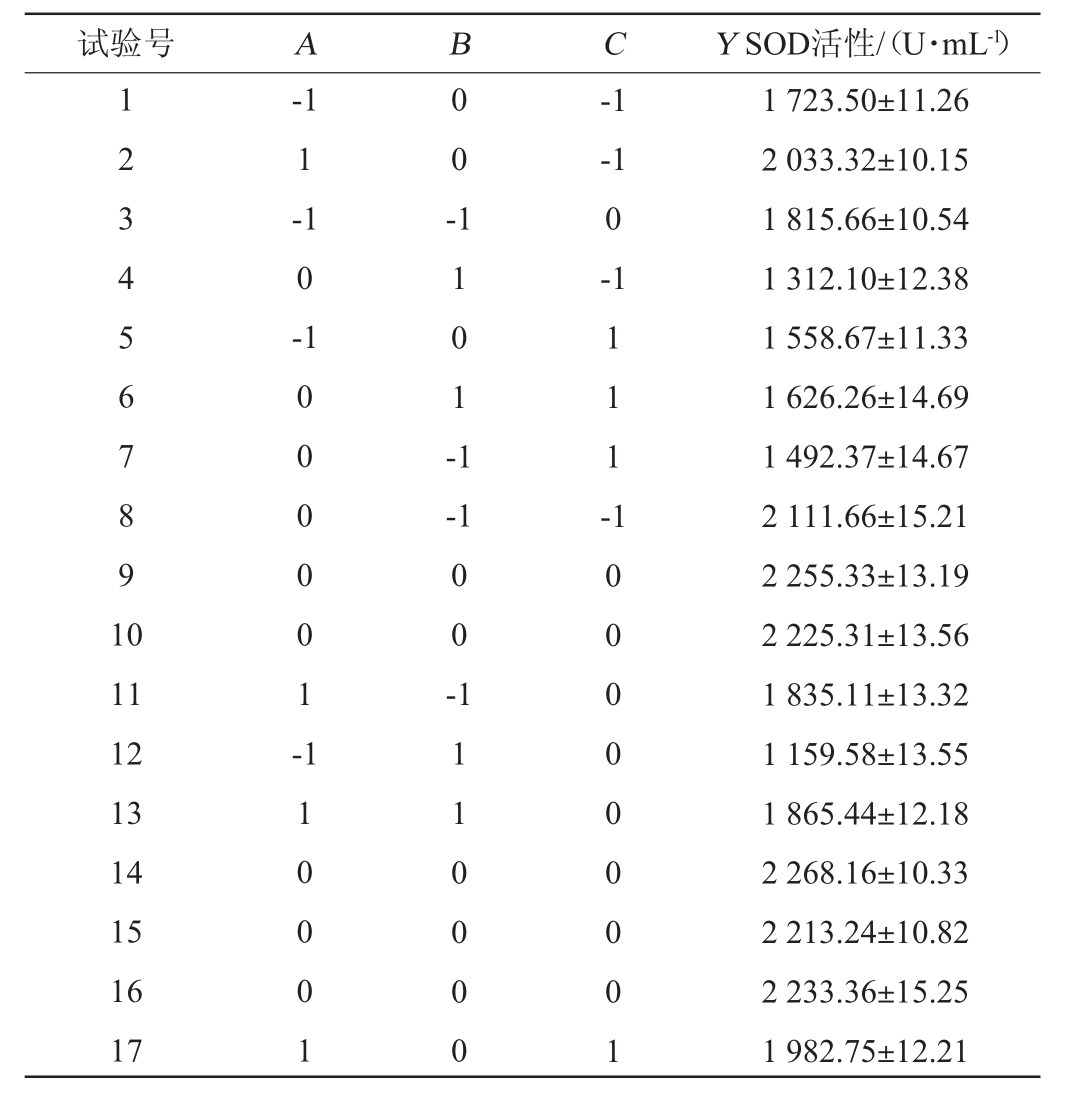
试验号 A B C Y SOD活性/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0-1 1-1 0 -0 0 -1 1 0 1 -1-1-1 0-1 1 0 0 0 0 0 1 --1 1 1 1 -11 12 13 14 15 16 17 0 0 -1 1 0 0 0 1 1 1 1 0 0 0 0 1 0 0 0 0 0 0 0 0 1 1 723.50±11.26 2 033.32±10.15 1 815.66±10.54 1 312.10±12.38 1 558.67±11.33 1 626.26±14.69 1 492.37±14.67 2 111.66±15.21 2 255.33±13.19 2 225.31±13.56 1 835.11±13.32 1 159.58±13.55 1 865.44±12.18 2 268.16±10.33 2 213.24±10.82 2 233.36±15.25 1 982.75±12.21
2.2.2 回归模型的建立与方差分析
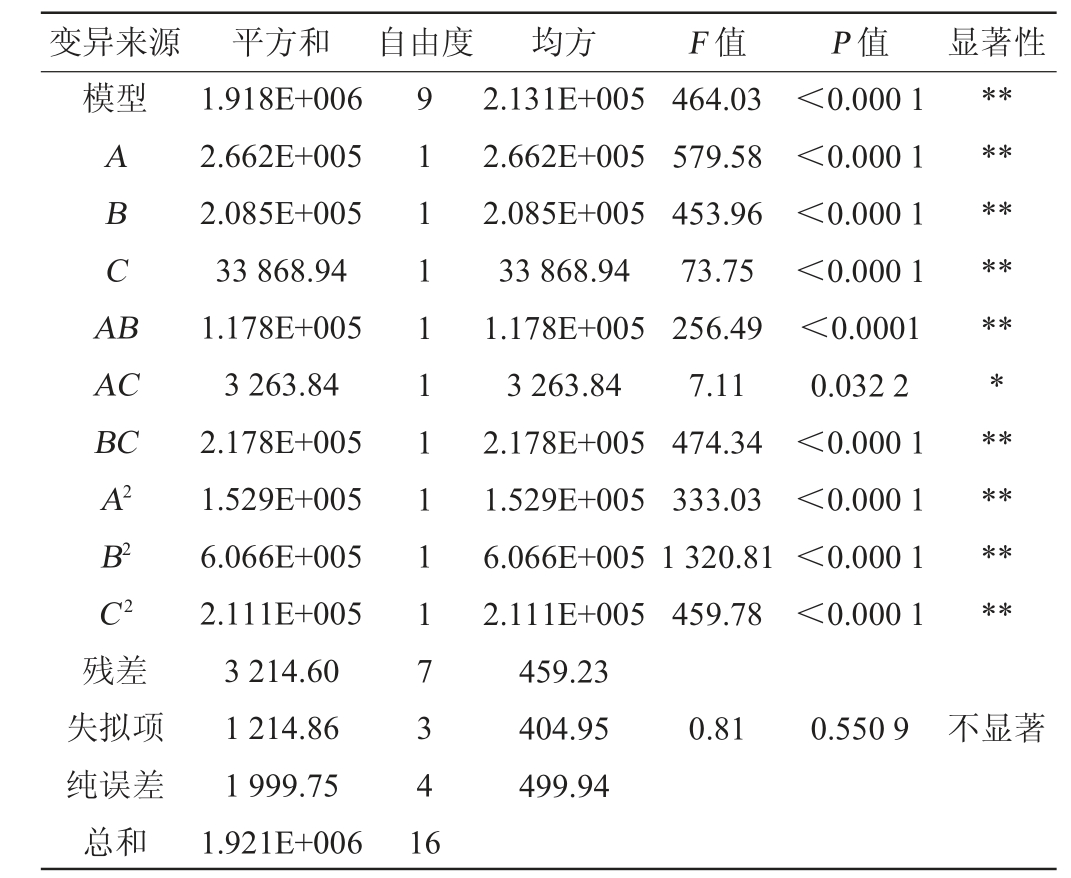
利用Design-Expert 8.0.6数据分析软件对表2数据进行多元回归拟合分析,得到SOD活性(Y)对自变量初始pH值(A)、菌种比例(Sc∶Ha∶Lp)(B)、接种量(C)的二次多项回归模型方程为:Y=2239.08+182.40A-161.43B-65.07C+171.60AB+28.57AC+233.36BC-190.58A2-379.55B2-223.94C2。进一步对回归模型进行方差分析,结果见表3。
表3 回归模型的方差分析
Table 3 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
变异来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总和1.918E+006 2.662E+005 2.085E+005 33 868.94 1.178E+005 3 263.84 2.178E+005 1.529E+005 6.066E+005 2.111E+005 3 214.60 1 214.86 1 999.75 1.921E+006 911 11111117341 6 2.131E+005 2.662E+005 2.085E+005 33 868.94 1.178E+005 3 263.84 2.178E+005 1.529E+005 6.066E+005 2.111E+005 459.23 404.95 499.94 464.03 579.58 453.96 73.75 256.49 7.11 474.34 333.03 1 320.81 459.78<0.000 1<0.000 1<0.000 1<0.000 1<0.0001 0.032 2<0.000 1<0.000 1<0.000 1<0.000 1*******************0.81 0.550 9不显著
由表3可知,模型P<0.000 1,极显著,失拟项P值为0.550 9>0.05,不显著,说明该方程合理可行;决定系数R2=0.998 3,调整决定系数R2Adj=0.996 2,说明该模型能够解释99.62%响应值的变化,拟合程度较好,可用该回归方程预测沙棘酵素多菌种发酵工艺条件。变异系数(variable co efficient,CV)=1.15%<10%,表明试验模型的可信度和精确度高。由表3亦可知,一次项A、B、C均对结果影响极显著(P<0.01),交互项AB、BC和二次项A2、B2、C2对沙棘酵素SOD活性的影响极显著(P<0.01),交互项AC对沙棘酵素SOD活性的影响显著(P<0.05),且各因素对沙棘酵素SOD活性影响的大小顺序为:初始pH值(A)>菌种比例(B)>接种量(C)。
2.2.3 响应面和等高线图分析
响应面和等高线图可以直观地反映各因素间交互作用对响应值的影响程度,响应曲面坡度越陡峭,等高线越密集,表明该因素对响应值的影响越显著,等高线越接近椭圆,两个因素间的交互作用越强;反之则各因素间交互作用对响应值的影响较小[33]。各因素间交互作用对沙棘酵素SOD活性影响的响应面和等高线图见图4。
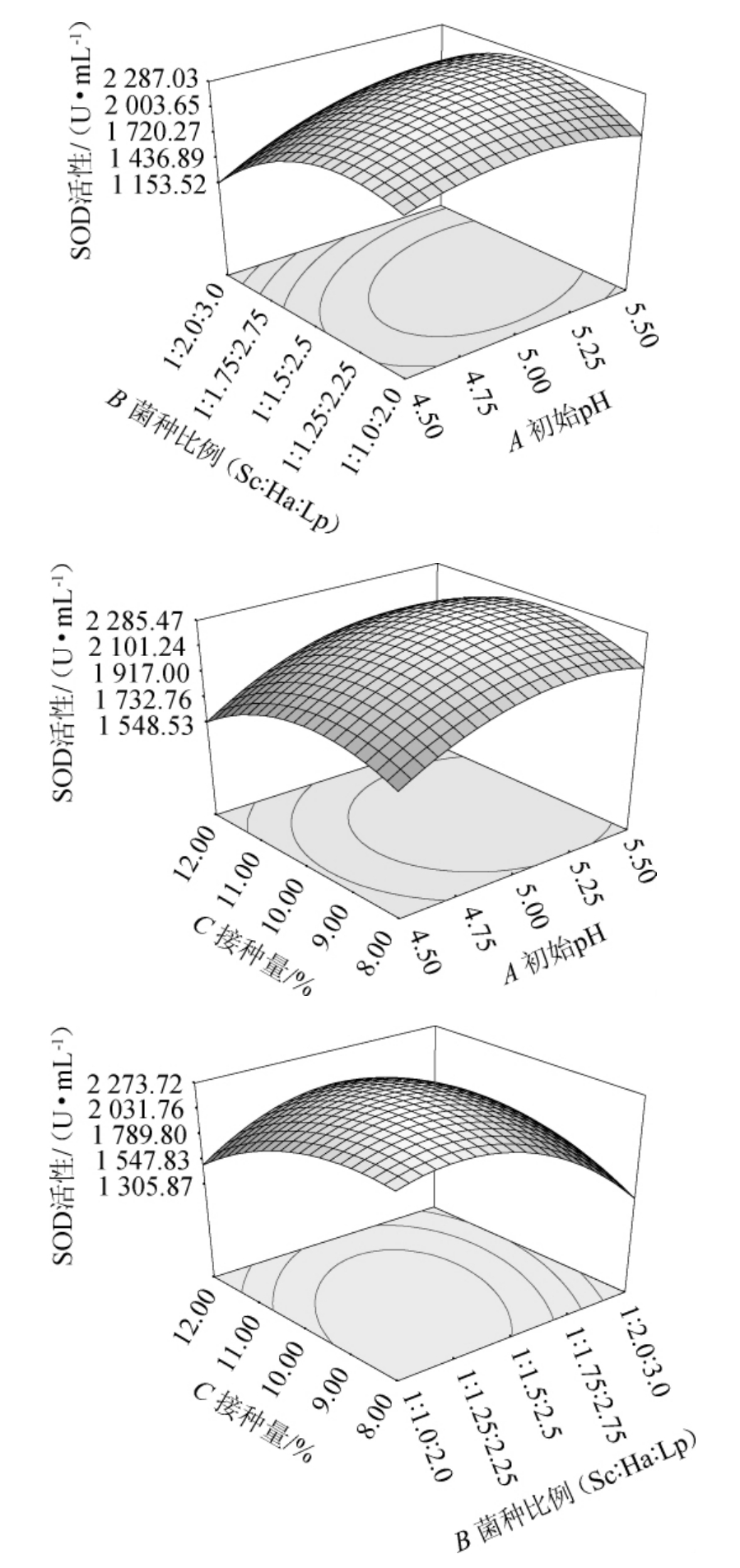
图4 各因素间交互作用对沙棘酵素SOD活性影响的响应面和等高线图
Fig.4 Response surface plots and contour lines of effect of interaction between different factors on SOD activity
由图4可知,AB和BC的响应曲面陡峭,等高线密集且呈椭圆,说明初始pH值和菌种比例、菌种比例和接种量间交互作用对沙棘酵素SOD活性的影响较大,AC的响应曲面较为陡峭,等高线较密集且接近椭圆,但相比AB和BC,交互作用影响较小,这与方差分析的结果一致。
2.2.4 最佳条件预测及验证试验
通过Design-Expert 8.0.6软件进行最大值分析,得到沙棘酵素多菌种发酵的最佳工艺条件为:初始pH值5.18,菌种(酿酒酵母∶异常汉逊酵母∶植物乳植物杆菌)比例1.0∶1.6∶2.6,接种量10.25%,在此条件下,沙棘酵素SOD活性的理论值为2 158.46 U/mL,在此条件下进行3次重复验证试验,得到沙棘酵素的SOD活性实际值为(2 206.67±13.67)U/mL,与预测值的相对误差为2.18%,与理论值误差较小,说明该模型准确可靠。
2.3 沙棘酵素产品品质分析
沙棘酵素发酵过程中酵母菌和乳酸菌等微生物利用糖原和原料中的蛋白质、糖类、矿物质等营养成分进行新陈代谢,产生新的生物活性物质,使其具有比原料更高、更好吸收的营养价值,而微生物的代谢过程不仅受微生物种类及自身代谢条件的影响,还因受到发酵液中pH、酸度、糖度及酒精度等物理、化学环境的影响,所得到的活性物质的质量及数量不同[34]。在最优工艺条件下,沙棘酵素产品的pH为2.23,总酸含量为78.60 mg/mL,可溶性固形物含量为2.68°Bx,乙醇含量为0.05g/100mL,总酚含量为18.85mg/mL,总黄酮含量为12.49 mg/mL,VC含量为6.48 mg/mL,多糖含量为22.49 mg/mL,SOD活性为2 206.67 U/mL,还原力(OD700nm值)为2.65,产品色泽透亮金黄,香气浓郁,感官评分为9.1分,产品理化指标及感官指标均符合轻工行业标准QB/T 5323—2018《植物酵素》的要求[35]。
3 结论
本研究以沙棘为原料,经酿酒酵母、异常汉逊酵母、植物乳植物杆菌等多菌种发酵制备沙棘酵素,考察初始pH、菌种比例、接种量对沙棘酵素品质的影响,进一步通过响应面法优化出沙棘酵素多菌种发酵最佳工艺条件为:初始pH 5.18、酿酒酵母、异常汉逊酵母与植物乳植物杆菌的菌种比例1∶1.6∶2.6、接种量10.25%。在此条件下,沙棘酵素产品色泽透亮金黄,香气浓郁,感官评分为9.1分,其pH为2.23,总酸含量为78.60mg/mL,可溶性固形物含量为2.68°Bx,乙醇含量为0.05 g/100 mL,总酚含量为18.85 mg/mL,总黄酮含量为12.49 mg/mL,VC含量为6.48 mg/mL,多糖含量为22.49 mg/mL,SOD活性为2 206.67 U/mL,还原力(OD700nm值)为2.65,产品指标符合轻工行业标准QB/T 5323—2018《植物酵素》的要求,为沙棘产业的综合利用和酵素产品的产业化生产提供了理论依据。
[1]赵东晓,卢顺光,胡建忠,等.全国沙棘开发35周年纪事[M].北京:中国水利水电出版社,2021:107,195-225.
[2]CIESAROVÁ Z,MURKOVIC M,CEJPEK K,et al.Why is seabuckthorn(Hippophae rhamnoides L.) so exceptional? A review[J].Food Res Int,2020,133:109170.
[3] SYTARˇOVÁ I, ORSAVOVÁ J, SNOPEK L, et al.Impact of phenolic compounds and vitamins C and E on antioxidant activity of seabuckthorn(Hippophae rhamnoides L.) berries and leaves of diverse ripening times[J].Food Chem,2020,310:125784.
[4]CRISTE A,URCAN A C,BUNEA A,et al.Phytochemical composition and biological activity of berries and leaves from four Romanian sea buckthorn (Hippophae rhamnoides L.) varieties[J].Molecules, 2020, 25(5):1-21.
[5]TKACZ K,WOJDYLO A,TURKIEWICZ I P,et al.UPLC-PDA-Q/TOFMS profiling of phenolic and carotenoid compounds and their influence on anticholinergic potential for AChE and BuChE inhibition and on-line antioxidant activity of selected Hippophae rhamnoides L.cultivars[J].Food Chem,2019,309:125766.
[6]JASNIEWSKA A,DIOWKSZ A.Wide spectrum of active compounds in sea buckthorn (Hippophae rhamnoides) for disease prevention and food production[J].Antioxidants,2021,10(8):1279.
[7] TKACZ K, WOJDYLO A, TURKIEWICZ I P, et al.Anti-diabetic, anticholinesterase,and antioxidant potential,chemical composition and sensory evaluation of novel sea buckthorn-based smoothies[J].Food Chem,2021,338:128105.
[8]LIU S,XIAO P,KUANG Y,et al.Flavonoids from sea buckthorn:A review on phytochemistry,pharmacokinetics and role in metabolic diseases[J].J Food Biochem,2021,45(5):el3724.
[9]SANWAL N,MISHRA S,SAHU J K,et al.Effect of ultrasound-as-sisted extraction on efficiency,antioxidant activity,and physico-chemical properties of sea buckthorn(Hippophae salicipholia)seed oil[J].LWT-Food Sci Technol,2022,153:112386.
[10] TERPOU A, PAPADAKI A, BOSNEA L, et al.Novel frozen yogurt production fortified with sea buckthorn berries and probiotics[J].LWTFood Sci Technol,2019,105(8):242-249.
[11]杨光,苏芳芳,陈敏.药食同源起源与展望[J].中国现代中药,2021,23(11):1851-1856.
[12] MARCINIAK B, KONTEK R, ZUCHOWSKI J, et al.Novel bioactive properties of low-polarity fractions from sea-buckthorn extracts(Elaeagnus rhamnoides (L.) A.Nelson)-(in vitro)[J].Biomed Pharmacother,2021,135:111-141.
[13] GE X J, TANG N Y, HUANG Y X, et al.Fermentative and physi-cochemical properties of fermented milk supplemented with sea buckthorn(Hippophae eleagnaceae L.)[J].LWT-Food Sci Technol, 2022, 153:112484.
[14]DAI J,SHA R Y,WANG Z Z,et al.Edible plant jiaosu:manufacturing,bioactive compounds,potential health benefits,and safety aspects[J].J Sci Food Agr,2020,100(15):5313-5323.
[15]张浩然,范昊安,顾逸菲,等.沙棘酵素发酵过程中代谢产物及抗氧化活性研究[J].食品工业科技,2020,41(11):125-133.
[16]金哲宁,方晟,沙如意,等.沙棘酵素功能成分及其体外抗氧化性能研究[J].食品研究与开发,2020,41(17):20-28.
[17]汤灿辉,王梦禅,刘少雄,等.沙棘酵素自然发酵过程中品质特征和细菌群落动态变化[J].食品工业科技,2021,42(23):150-157.
[18]李斌斌,李宇辉,刘战霞,等.植物乳杆菌与酿酒酵母混合发酵对红枣酒挥发性风味物质的影响[J].食品工业科技,2023,44(8):170-179.
[19]郑超群.基于酿酒酵母和异常汉逊酵母混合发酵技术的黄酒生产工艺及风味成分研究[D].杭州:浙江工商大学,2022.
[20]TKACZ K,CHMIELEWSKA J,TURKIEWICZ I P,et al.Dynamics of changes in organic acids, sugars and phenolic compounds and antioxidant activity of sea buckthorn and sea buckthorn-apple juices during malolactic fermentation[J].Food Chem,2020,332:127382.
[21]赵春妮,汤鑫鑫,刘可,等.响应面法优化金刺梨酵素发酵工艺[J].中国酿造,2023,42(3):151-156.
[22]AMANDA E,CHOO W S.Effect of refrigerated storage on the physicochemical characteristics and viability of Lactobacillus plantarum in fermented watermelon juice with or without supplementation with inulin or fructooligosaccharide[J].J Food Process Pres,2018,42(12):e13831.
[23]张海燕,康三江,袁晶,等.苹果酵素自然发酵过程中生物活性物质的变化[J].中国酿造,2021,40(3):111-114.
[24]ZOMPRA A A,CHASAPI S A,KARAGKOUNI E C,et al.Metabolite and bioactive compounds profiling of meteora sea buckthorn berries through high-resolution NMR analysis[J].Metabolites, 2021, 11(12):1-19.
[25]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.171—2003 保健食品中超氧化物歧化酶(SOD)活性的测定[S].北京:中国标准出版社,2003.
[26]LI T,JIANG T,LIU N,et al.Biotransformation of phenolic profiles and improvement of antioxidant capacities in jujube juice by select lactic acid bacteria[J].Food Chem,2021,339:127859.
[27]MULTARI S,CARAFA I,BARP L,et al.Effects of Lactobacillus spp.on the phytochemical composition of juices from two varieties of Citrus sinensis L.Osbeck:'Tarocco'and'Washington navel'[J].LWT-Food Sci Technol,2020,125:109-205.
[28]蔡丽琴.猕猴桃酵素发酵过程中代谢产物变化规律研究[D].杭州:浙江工商大学,2022.
[29]洪厚胜,朱曼利,李伟,等.葡萄果渣酵素的发酵工艺优化及其理化特性[J].食品科学,2019,40(8):63-72.
[30]OLANBIWONINU A A,ODUNFA S A.Microbial interaction in selected fermented vegetable condiments in Nigeria[J].Int Food Res J,2018,25(1):439-445.
[31] MARRERO S C, MARTÍNEZ-RODRÍGUEZ A, PÉREZ S E M, et al.New trends and applications in fermented beverages[J].Fermented Beverages,2019,5:31-66.
[32]ADESULU-DAHUNS A T,DAHUNSI S O,OLAYANJUl A.Synergistic microbial interactions between lactic acid bacteria and yeasts during production of Nigerian indigenous fermented foods and beverages[J].Food Control,2020,110(4):106963.
[33]YUAN J,ZHANG H Y,ZENG C Z,et al.Impact of fermentation conditions on physicochemical properties, antioxidant activity, and sensory properties of apple-tomato pulp[J].Molecules,2023,28(11):4363.
[34]XU X,BAO Y,WU B,et al.Chemical analysis and flavor properties of blended orange,carrot,apple and Chinese jujube juice fermented by selenium-enriched probiotics[J].Food Chem,2019,289:250-258.
[35]中华人民共和国工业和信息化部.QB/T 5323—2018 植物酵素[S].北京:中国标准出版社,2018.