纤维素作为世界上产量最高的可再生有机质资源,在植物、海藻、微生物等生物体内广泛存在,纤维素的有效开发和资源化利用对于整个社会的可持续发展具有重要意义[1]。现如今,纤维素世界年产量已达1 500亿t,其中仅秸秆产量就超过60亿t,中国秸秆年产量约占世界总量的20%~30%[2-3]。2017年,我国国家发展和改革委员会、国家能源局等十五部门联合印发的《关于扩大生物燃料乙醇生产和推广使用车用乙醇汽油的实施方案》中指出:到2025年,力争纤维素乙醇实现规模化生产,形成更加完善的市场化运行机制[4],为我国未来纤维素的开发利用指明了方向。纤维素因结构稳定,难以被有效利用,造成了极大的浪费,因此,如何对纤维素类进行降解处理成为国内外研究热点[5]。
现有纤维素降解的主要方法包括物理法、化学法、物理化学法、生物法和联合处理法[6],其中生物法主要为从自然界筛选可分解纤维素的真菌和细菌,它们可产生种类多、数量大的纤维素降解酶,这些纤维素酶虽结构各异,降解作用不同,但是都可以破坏纤维素的化学键使其结构裂解[7-8]。生物法反应条件温和、无污染、成本低、生物转化率高,在生物质资源转化方面具有广阔的应用前景[9],但是现有微生物所产生的纤维素酶大部分都不同程度地存在酶系不完全、活性不高、酶作用条件苛刻等问题,因此,选育优良的高产纤维素酶的菌株,提高降解纤维素的效率仍然是当前和今后纤维素酶研究的主要任务[10-11]。现已发现的能够产生纤维素酶的微生物主要集中在真菌中的木霉属(Trichoderma)、青霉属(Penicillium)和曲霉属(Aspergillus)[12-13],细菌中的芽孢杆菌属(Bacillus)和节杆菌属(Arthrobacter)以及放线菌中的链霉菌属(Streptomyces)等[14-15]。其中,木霉是目前工业级水解酶活性较高的菌种之一[6,16]。在此背景下,不断选育优良的纤维素酶高产木霉菌株,提高菌株的生产稳定性,使其得到生产应用,是纤维素产业发展的重要研究方向[17]。
本研究以前期从河北某生物企业秸秆收储池筛选的具备一定开发潜力的拟康氏木霉(Trichodermapseudokoningii)TP-89作为出发菌株,利用紫外(ultraviolet,UV)诱变结合常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术[18]对其进行诱变处理,筛选纤维素酶高产正突变株,并对其遗传稳定性进行研究,以期为纤维素酶生产研究乃至工业化生产提供有价值的菌种。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
拟康氏木霉(Trichoderma pseudokoningii)TP-89:本实验室保藏。
1.1.2 试剂
葡萄糖、乳酸、KH2PO4、KH2PO4、MgSO4·7H2O、(NH4)2SO4、CaCl2·2H2O、FeSO4、CoCl2、MnSO4、ZnSO4、吐温80:国药集团化学试剂有限公司;CMC-Na、微晶纤维素:上海沃凯化学试剂有限公司;酵母粉、玉米浆粉、琼脂粉:北京索莱宝生物科技有限公司;刚果红染色液、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂:北京雷根生物技术有限公司。以上所用试剂均为分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[19]:去皮马铃薯200 g(切块后100 ℃加热30 min,过滤后弃掉滤渣),葡萄糖20 g,琼脂20 g,用蒸馏水定容至1 000 mL,121 ℃灭菌20 min,pH自然。
菌丝生长培养基[20]:去皮马铃薯200 g(切块后100 ℃加热30 min,过滤后弃掉滤渣),葡萄糖20 g,K2HPO4 3 g,MgSO4·7H2O 1.5 g,琼脂20 g,用蒸馏水定容至1 000 mL,pH 6.0,121 ℃灭菌20 min。
羧甲基纤维素钠(sodiumcarboxymethyl cellulose,CMCNa)培养基[21]:CMC-Na 15 g,乳糖3 g,KH2PO4 1 g,(NH4)2SO4 1 g,MgSO4·7H2O 0.5 g,酵母粉1 g,琼脂20 g,用蒸馏水定容至1 000 mL,pH 7.2,121 ℃灭菌20 min。
产酶培养基[22]:微晶纤维素10 g,玉米浆粉12 g,乳糖5 g,(NH2)2SO2 2 g,MgSO2·7H2O 1.2 g,CaCl2·2H2O 1.4 g,吐温80 2 mL,Mandels微量元素营养盐(配方:FeSO4 5 g/L、CoCl2 3.7 g/L、MnSO4 1.6 g/L、ZnSO4 1.4 g/L)1 mL,用蒸馏水定容至1 000 mL,pH 4.8,121 ℃灭菌20 min。
1.2 仪器与设备
ARTP-II型常压室温等离子体(ARTP)诱变仪:北京思清源生物科技有限公司;LDZX-50L型高压蒸汽灭菌锅:上海申安医疗器械厂;ME204型电子分析天平、FE22型pH计:梅特勒-托利多国际贸易(上海)有限公司;YJ-VS-1型垂直超净工作台:无锡一净净化设备有限公司;TG16.5型台式高速离心机:上海卢湘仪离心机仪器有限公司;BS-2E型恒温振荡培养箱:常州恒隆仪器有限公司;DHP-9602型恒温培养箱:上海一恒科学仪器有限公司;LD-96A型全波长多功能酶标仪:山东莱恩德科技有限公司。
1.3 方法
1.3.1 菌种活化和孢子悬液的制备
取适量实验室保藏的拟康氏木霉TP-89,于1 mL无菌水中振荡摇匀,通过涂布平板法接种到PDA培养基上,于30 ℃恒温培养7 d后,用接种铲取0.5 cm×0.5 cm的正方形菌块,平放到菌丝生长培养基平板上进一步活化,于30 ℃恒温培养15 d后,收集孢子并用生理盐水调节孢子浓度为1×106个/mL备用。1.3.2 UV诱变[23]
移取15 mL孢子悬液于无菌培养皿中,在搅拌子作用下将培养皿置于距离紫外灯20 cm处分别照射0 s、20 s、40 s、60 s、80 s、100 s、120 s、140 s、160 s,移取诱变后的孢子悬液用生理盐水稀释至104个/mL后,吸取0.1 mL均匀涂布于菌丝生长培养基,避光条件下30 ℃恒温培养2~3 d,观察并记录各平板形成的菌落数,以照射时长为0 s的培养皿为对照组,计算出发菌株在不同诱变时间的致死率,并绘制致死曲线进而确定最佳诱变时长,致死率计算公式如下:
式中:Z表示诱变致死率,%;X1为诱变组平板的菌落数,个;X为对照组平板的菌落数,个。
1.3.3 ARTP诱变[24-25]
保持ARTP诱变仪的工作条件不变,以诱变时间作为变量对孢子悬液进行诱变处理。具体处理流程为:在超净工作台中,移取10 μL孢子悬液于直径5 mm的无菌不锈钢载片上,注入纯度为99.999%的氦气(He),气体流速选择10.0 L/min,设置功率120 W,处理距离2 mm,处理温度低于40 ℃。出发菌株孢子悬液分别在ARTP诱变仪下照射处理0 s、20 s、40 s、60 s、80 s、100 s、120 s、140 s、160 s,每次诱变后分别将不锈钢载片置于含990 μL无菌生理盐水的EP管中,在漩涡器上振荡5 min。分别对上述孢子悬液进行梯度稀释至孢子浓度为104个/mL,吸取0.1 mL稀释液涂布接种到菌丝生长培养基,30 ℃倒置培养48 h后,观察并记录菌落数量,计算致死率,并绘制致死曲线,确定最佳诱变处理时间。
1.3.4 UV-ARTP复合诱变
按照1.3.2获得的最佳诱变条件对出发菌株孢子悬液进行紫外诱变后,初筛出发生正突变的菌株培养并制成孢子悬液,再按照方法1.3.3获得的最佳诱变条件进行ARTP诱变。
1.3.5 突变菌株的初筛
将诱变后的菌株孢子悬液适当稀释后涂布于CMC-Na培养基上,30 ℃恒温培养3 d后,加入5 mL刚果红染色液到平板表面染色60 min,采用1 mol/L的NaCl溶液洗脱30 min,记录水解圈直径与菌落直径的比值(H/C),H/C大于对照组(未经诱变菌株)的则视为正突变[22],选取正突变株进行复筛。
1.3.6 突变菌株的复筛
将初筛获得的菌株接种到200 mL菌丝生长培养基中,30 ℃、180 r/min条件下培养18 h后,制备浓度为1×108 个/mL的孢子悬液,然后以1%(V/V)接种量接种到200 mL产酶培养基中,30 ℃、180 r/min条件下培养7 d,每12 h取样,在离心机中以6000r/min离心10min,取上清液即为粗酶液,测定酶活,选取高产纤维素酶菌株。
1.3.7 纤维素酶活测定[26-28]
滤纸酶活测定:裁剪定性滤纸条(1 cm×6 cm)置于试管中,加入50 mmol/L、柠檬酸缓冲液(pH 4.8)1.50 mL和粗酶液0.50 mL,用同体积50 mmol/L、柠檬酸缓冲液(pH 4.8)代替粗酶液作为空白对照。在50 ℃水浴中振荡反应30 min后,加入DNS溶液2 mL,用酶标仪在波长540 nm处测定OD540nm值,根据标准曲线y(OD540nm值)=0.446 8x(葡萄糖含量)+0.043 4(R2=0.999 6)计算葡萄糖含量,并计算滤纸酶活。
外切酶活测定:定量称取50 mg脱脂棉替代滤纸条作为反应底物,其他步骤同滤纸酶活测定。
内切酶活测定:以CMC-Na作为反应底物,称取CMC-Na 0.50 g,用50 mmol/L柠檬酸缓冲液(pH 4.8)定容至100 mL获得CMC-Na溶液,用CMC-Na溶液替代柠檬酸水溶液,其他步骤同滤纸酶活测定。
酶活定义:在上述条件下,1 mL粗酶液每分钟水解产生1 μmol葡萄糖所需要的酶量为1个酶活力单位(U/mL)。
1.3.8 遗传稳定性试验
将筛选出的高产纤维素酶菌株连续传代培养7次,每代分别制成孢子悬液,按照1%(V/V)的接种量接种到液体产酶培养基中,于30 ℃、180 r/min条件下恒温振荡培养4 d,测定每代菌株的纤维素酶活,从而验证菌株产酶能力的遗传稳定性[20]。
1.3.9 数据处理及分析
采用Excel 2021对数据进行整理和作图,用SPSS 26.0软件对数据进行方差分析。每组实验平行测定3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 最佳紫外诱变时间的确定
在对出发菌株TP-89诱变育种时,菌株的突变率很大程度上受到诱变剂量的影响,诱变剂量越大则突变率越高,但是当达到一定诱变剂量时,继续加大诱变剂量会导致菌体死亡率过高,诱变效率反而下降[19]。为了获取理想的诱变效果,以紫外照射时间为变量,对拟康氏木霉菌株TP-89诱变处理后的致死率绘制致死曲线,结果见图1。
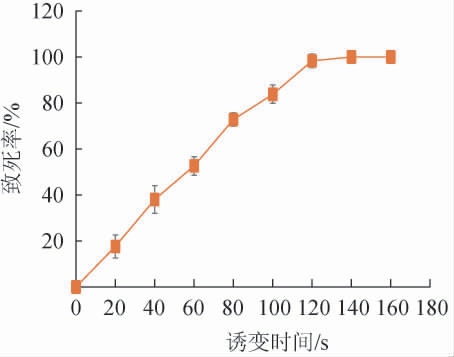
图1 紫外诱变时间对拟康氏木霉菌株TP-89致死率的影响
Fig.1 Effect of UV mutation time on the lethal rate of Trichoderma pseudokoningii TP-89
由图1可知,随着诱变时间在0~100 s范围内的延长,菌株致死率迅速增加,有研究表明,一般选择菌株致死率在80%~90%范围内对菌株进行诱变效果较好[19]。当诱变时间为100 s时,菌株致死率为83.8%,诱变时间为120 s时致死率已达98.3%,因此,本实验选择100 s为紫外诱变处理的最佳时间。
2.2 最佳ARTP诱变时间的确定
以ARTP诱变时间为变量,对诱变处理后拟康氏木霉菌株TP-89的致死率绘制致死曲线,结果见图2。
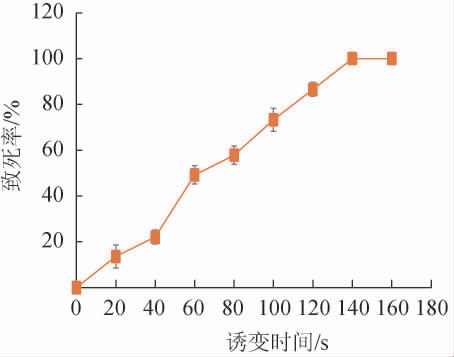
图2 ARTP诱变时间对拟康氏木霉菌株TP-89致死率的影响
Fig.2 Effect of ARTP mutation time on the lethal rate of Trichoderma pseudokoningii TP-89
由图2可知,随着诱变时间在0~120 s范围内的延长,菌株致死率同样迅速增加,当诱变时间为120 s时,菌株致死率为86.6%,诱变时间>140 s时,致死率达到100%,按照菌株致死率在80%~90%范围内进行选择,选择120 s为ARTP诱变处理的最佳时间。
2.3 突变菌株的筛选
2.3.1 初筛结果
出发菌株TP-89经UV-ARTP复合诱变后,获得96株正突变菌株,分别编号为UA-1~UA-96,其中水解圈直径与菌落直径比值(H/C)>2的正突变菌株有6株,结果见表1。
表1 突变菌株产纤维素酶性能初筛结果
Table 1 Preliminary screening results of cellulase production performance of mutant strains
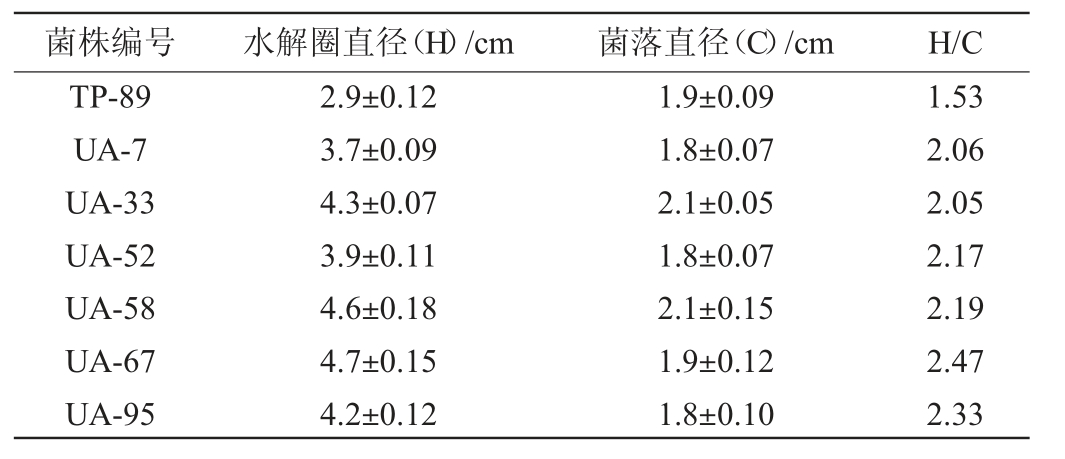
菌株编号 水解圈直径(H)/cm 菌落直径(C)/cm H/C TP-89 UA-7 UA-33 UA-52 UA-58 UA-67 UA-95 2.9±0.12 3.7±0.09 4.3±0.07 3.9±0.11 4.6±0.18 4.7±0.15 4.2±0.12 1.9±0.09 1.8±0.07 2.1±0.05 1.8±0.07 2.1±0.15 1.9±0.12 1.8±0.10 1.53 2.06 2.05 2.17 2.19 2.47 2.33
由表1可知,菌株UA-7、UA-33、UA-52、UA-58、UA-67、UA-95的H/C均>2,分别为2.06、2.05、2.17、2.19、2.47、2.33,因此,选择这6株突变株进行产酶性能复筛。
2.3.2 复筛结果
对出发菌株TP-89和6株初筛突变菌株的纤维素酶酶活进行测定,结果见图3。
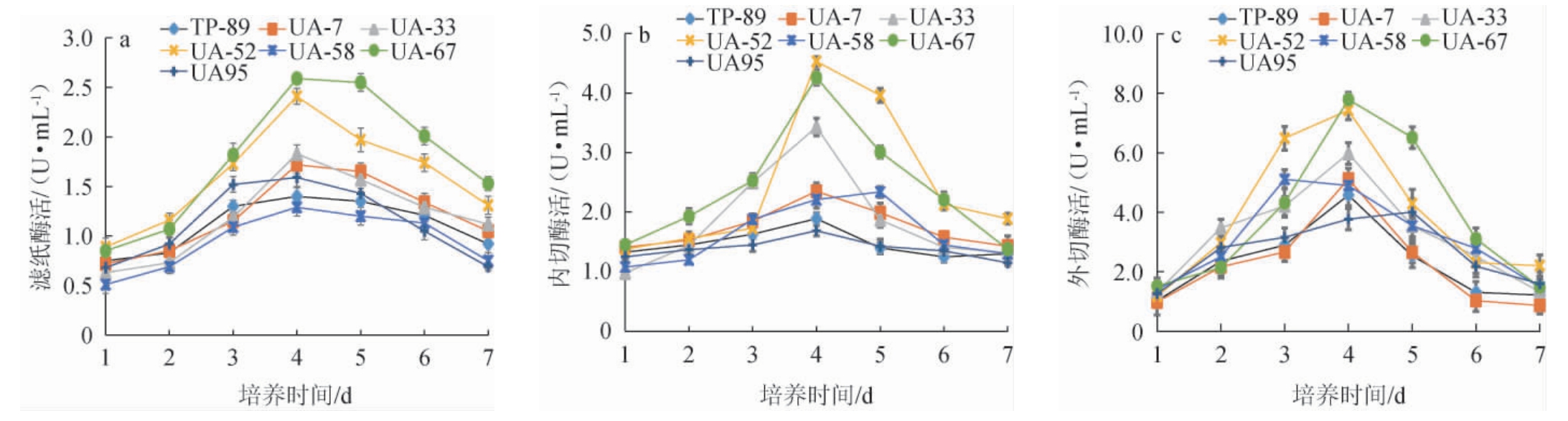
图3 出发菌株TP-89及6株突变菌株的滤纸酶活(a)、内切酶活(b)及外切酶活(c)测定结果
Fig.3 Determination results of filter paper enzyme activity (a), endonuclide enzyme activity (b), and exonuclide enzyme activity (c) of starting strain TP-89 and 6 mutant strains
由图3a可知,发酵过程中,出发菌株TP-89和6株突变菌株的滤纸酶活均呈现先增加后下降的趋势,且均在培养第4天达到酶活的峰值。与出发菌株TP-89相比,5株突变菌株的酶活峰值提高,1株突变菌株的酶活峰值下降,其中突变菌株UA-52和UA-67的最大酶活提高的幅度较大,分别达到了2.41 U/mL和2.59 U/mL,相较于出发菌株TP-89(1.40 U/mL)分别提高了72.1%和85.0%
由图3b可知,发酵过程中,出发菌株TP-89和6株突变菌株的内切酶活均呈现先升高后下降的趋势。出发菌株TP-89及突变菌株UA-7、UA-33、UA-52、UA-67、UA-95均在发酵4 d时酶活达到最高,分别为1.89 U/mL、2.35 U/mL、3.43 U/mL、4.53 U/mL、4.26 U/mL和1.69 U/mL;突变菌株UA-58在发酵5 d时,酶活达到最高,为2.34 U/mL。相较于出发菌株,突变菌株UA-33、UA-52、UA-67的最高酶活提高的幅度较大,分别提高了81.5%、139.7%和125.4%。
由图3c可知,发酵过程中,各菌株的外切酶活均呈现先上升后下降的趋势,突变菌株UA-58在发酵3 d时,酶活达到最高,为5.11 U/mL;出发菌株TP-89及突变菌株UA-7、UA-33、UA-52、UA-67在发酵4 d时,酶活达到最高,分别为4.58 U/mL、5.12 U/mL、5.98 U/mL、7.43 U/mL、7.79 U/mL;突变菌株UA-95在发酵5 d时,酶活达到最高,为4.01 U/mL。相较于出发菌株TP-89,突变菌株UA-52和UA-67的最高酶活提高的比较明显,分别提高了62.2%和70.1%。
综上,突变菌株UA-52和UA-67的滤纸酶活、内切酶活和外切酶活均比出发菌株TP-89得到了明显的提升,确定为高产纤维素酶的菌株。
2.4 突变菌株遗传稳定性测定结果
将筛选出的突变菌株UA-52和UA-67连续7次传代培养,分别培养4 d后测定酶活,结果见表2。
表2 突变菌株UA-52和UA-67遗传稳定性的测定结果
Table 2 Determination results of genetic stability of mutant strains UA-52 and UA-67
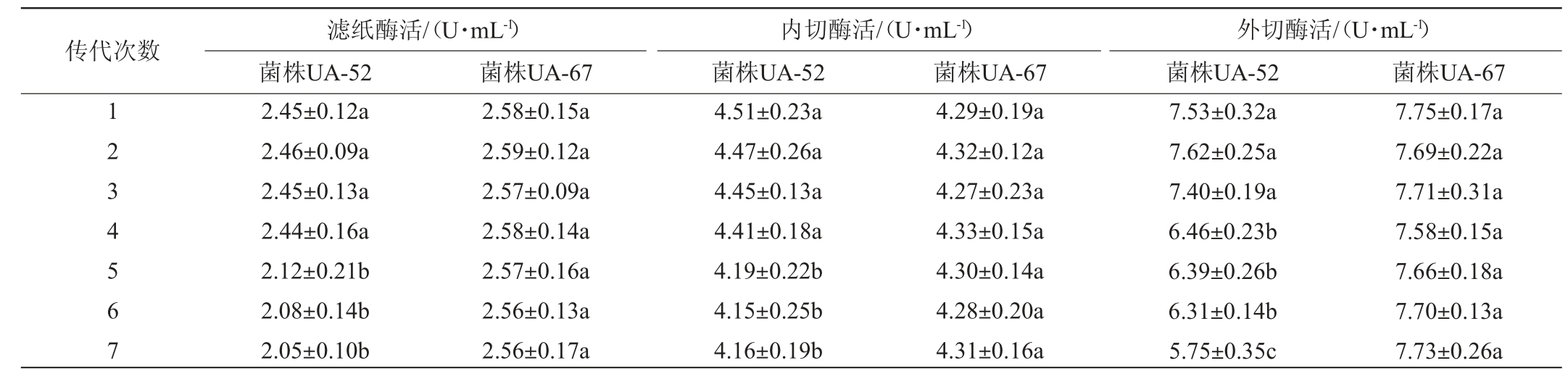
注:同列数据不同小写字母表示差异显著(P<0.05)。
传代次数1234567滤纸酶活/(U·mL-1)菌株UA-52内切酶活/(U·mL-1)菌株UA-52菌株UA-67 菌株UA-67 2.45±0.12a 2.46±0.09a 2.45±0.13a 2.44±0.16a 2.12±0.21b 2.08±0.14b 2.05±0.10b 2.58±0.15a 2.59±0.12a 2.57±0.09a 2.58±0.14a 2.57±0.16a 2.56±0.13a 2.56±0.17a 4.51±0.23a 4.47±0.26a 4.45±0.13a 4.41±0.18a 4.19±0.22b 4.15±0.25b 4.16±0.19b 4.29±0.19a 4.32±0.12a 4.27±0.23a 4.33±0.15a 4.30±0.14a 4.28±0.20a 4.31±0.16a外切酶活/(U·mL-1)菌株UA-52 菌株UA-67 7.53±0.32a 7.62±0.25a 7.40±0.19a 6.46±0.23b 6.39±0.26b 6.31±0.14b 5.75±0.35c 7.75±0.17a 7.69±0.22a 7.71±0.31a 7.58±0.15a 7.66±0.18a 7.70±0.13a 7.73±0.26a
由表2可知,突变菌株UA-52在第5代时滤纸酶活和内切酶活显著下降(P<0.05),外切酶活在第4代时显著下降(P<0.05),说明此突变菌株的遗传稳定性不够稳定。而突变菌株UA-67经过7次传代培养后,滤纸酶活、内切酶活和外切酶活相对初代菌株均无显著变化(P>0.05),说明菌株UA-67具有较高的遗传稳定性。因此,最终筛选突变菌株UA-67为优良的高产纤维素酶菌株,其遗传稳定性与王丰园等[20]筛选的拟康氏木霉相近,且产酶性能更优。
3 结论
本研究以实验室保藏的拟康氏木霉(Trichoderma pseudokoningii)菌株TP-89为出发菌株,对其进行UV诱变100 s,ARTP诱变120 s后,获得96个正突变菌株,经产纤维素酶性能初筛后,发现6株突变菌株的水解圈直径与菌落直径比值(H/C)>2;通过复筛发现,突变菌株UA-52和UA-67的滤纸酶活、内切酶活和外切酶活较出发菌株均得到了明显的提升。对2株菌株进行连续传代7次培养后,发现突变菌株UA-67具有较高的遗传稳定性,其在产酶培养基上培养4d时的滤纸酶活为2.59U/mL、内切酶活为4.26U/mL、外切酶活为7.79 U/mL,较出发菌株TP-89分别提了85.0%、125.4%和70.1%,具有一定工业应用潜力。
[1]李静,李明源,王继莲,等.纤维素的微生物降解研究进展[J].食品工业科技,2022,43(9):396-403.
[2]许从峰,艾士奇,申贵男,等.木质纤维素的微生物降解[J].生物工程学报,2019,35(11):2081-2091.
[3]石祖梁,贾涛,王亚静,等.我国农作物秸秆综合利用现状及焚烧碳排放估算[J].中国农业资源与区划,2017,38(9):32-37.
[4]中国能源编辑部.《关于扩大生物燃料乙醇生产和推广使用车用乙醇汽油的实施方案》印发[J].中国能源,2017,39(9):1.
[5]毛婷,朱瑞清,牛永艳,等.纤维素降解芽孢菌的筛选及产酶条件优化[J].中国酿造,2020,39(1):71-76.
[6]章沙沙,徐健峰,柳增善.纤维素降解菌的研究与应用进展[J].工业微生物,2021,51(2):46-52.
[7]WANG Q,AWASTHI M K,ZHAO J,et al.Improvement of pig manure compost lignocellulose degradation,organic matter humification and compost quality with medical stone[J].Bioresource Technol,2017,243:771-777.
[8] CRAGG S M, BECKHAM G T, BRUCE N C, et al.Lignocellulose degradation mechanisms across the tree of life[J].Curr Opin Chem Biol,2015,29:108-119.
[9]李冠杰,刘莹莹,甄静,等.一株降解纤维素细菌的分离、鉴定及酶学性质分析[J].河南科学,2015,33(4):530-534.
[10]PHADAGI R,SINGH S,HASHEMI H,et al.Understanding the role of dimethyl form amide as co-solvents in the dissolution of cellulose in ionic liquids:Experimental and theoretical approach[J].J Mol Liq,2021,328:115392.
[11]TYAGI U,ANAND N.Facile depolymerization of micro crystalline cellulose in ionic liquid medium catalyzed by carbon ma terials as catalysts[J].Curr Res Green Sust Chem,2021,4:100068.
[12]李子婧,刘帆,汤胜,等.纤维素降解菌长枝木霉菌(Trichoderma longibrachiatum)ZJ-10的筛选及产酶条件优化[J].浙江大学学报(农业与生命科学版),2022,48(5):614-624.
[13]YOON L W,ANG T N,NGOH G C,et al.Fungal solid-state fermentation and various methods of enhancement in cellulase production[J].Biomass Bioenerg,2014,67(1):319-338.
[14]张东升,徐一馨,宋双民,等.细菌产纤维素酶和脂肪酶固体培养基及接种和培养时间的研究[J].微生物学杂志,2022,42(3):44-53.
[15]HASUNUMA T,OKAZAKI F,OKAI N,et al.A review of enzymes and microbes for lignocellulosic biorefinery and the possibility of their application to consolidated bioprocessing technology[J].Bioresource Technol,2013,135:513-522.
[16]宫秀杰,钱春荣,于洋,等.近年纤维素降解菌株筛选研究进展[J].纤维素科学与技术,2021,29(2):68-77.
[17] SINGH B,GARG N, MATHUR P, et al.Microbial production of multienzyme preparation from mosambi peel using Trichoderma asperellum[J].Arch Microbiol,2022,204(6):313.
[18]ZHANG X,ZHANG X F,Li H P,et al.Atmospheric and room temperature plasma(ARTP)as a new powerful mutagenesis tool[J].Appl Microbiol Biot,2014,98(12):5387-5396.
[19]左勇,何颂捷,秦世蓉,等.紫外-亚硝酸钠复合诱变高产纤维素酶菌株[J].中国酿造,2020,39(8):97-101.
[20]王丰园,金海炎,张征田,等.ARTP-DES复合诱变选育高产纤维素酶突变菌株[J].饲料研究,2021,44(21):92-97.
[21]单建荣,全鑫,朱用哲,等.一株低温纤维素降解菌的筛选与产酶条件优化[J].生态学杂志,2021,40(4):1128-1136.
[22]邹宗胜,王婧雅,赵运英,等.高产纤维素酶突变株的筛选及其产酶条件优化[J].食品科学,2019,40(6):48-54.
[23]蒋汶,张庆庆,汤文晶,等.紫外-等离子体复合诱变红曲霉产胞外多糖[J].食品与发酵工业,2016,42(1):64-69.
[24]刘冬,邱婧云,王霞,等.ARTP诱变选育高产油脂酵母菌[J].食品研究与开发,2016,37(10):164-169.
[25]金丽华,方明月,张翀,等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报,2011,27(3):461-467.
[26]中华人民共和国国家发展和改革委员会.QB/T 2583—2003 纤维素酶制剂[S].北京:中国标准出版社,2003.
[27]罗奉奉,付跃,黄秀艳,等.一株纤维素酶真菌的筛选鉴定及产酶条件优化[J].中国酿造,2021,40(2):133-139.
[28]于慧娟,郭夏丽.秸秆降解菌的筛选及其纤维素降解性能的研究[J].生物技术通报,2019,35(2):58-63.