中国白酒的传统工艺主要包括大曲制备、淀粉糖化、酒精发酵、固态蒸馏和陈化[1]。白酒发酵过程中的品质与酿酒大曲微生物类群、酿酒原材料和酿造工艺息息相关[2]。大曲是中国传统白酒发酵曲的一种,在白酒发酵过程中作为微生物载体之一,主要以高粱、大麦或豌豆等谷物为原料,经过润粮粉碎、原料堆积、曲块成型、固态培养和成熟干燥等步骤制成,可为白酒发酵提供丰富的微生物群和酶系,进而影响发酵过程中乙醇和风味的产生,对白酒的质量有着决定性作用[3-4]。细菌是大曲微生物群落中的重要类群之一,其中芽孢杆菌属(Bacillus)可以分泌多种酶,如淀粉酶、蛋白酶、脂肪酶等,对大曲中微生物群落的调节和风味化合物的生产具有重要作用[5]。因此,解析大曲中细菌类群,探究Bacillus分布情况对白酒品质的改善具有重要意义。
高通量测序(high-throughput sequencing,HTS)技术具有通量高、测序快且无需培养的优点,可以有效对样品中属水平及其以上分类学地位的微生物进行解析与注释,许多学者利用HTS技术解析酿酒大曲中微生物群落结构,对大曲中微生物资源的开发与利用提供了参考与指导[6-7]。风味是评价白酒质量的关键指标,电子鼻则是模拟动物嗅觉器官开发的一种快速识别食品气味的仪器,利用电子传感器阵列的响应值提供样品的风味信息[8],具有操作简单、分析快速、成本低及结果直观的优点,对食品风味的解析及品质的改善具有重要作用,现已广泛应用于发酵食品和饮料研究中[9]。因此,通过HTS和电子鼻技术联合,解析大曲中微生物多样性和风味物质对改善大曲品质具有明显的优势。
内蒙古自治区以温带大陆性气候为主,地理环境和水资源独特[10]。基于此,本研究使用Illumina MiSeq高通量测序技术对采集自内蒙古河套地区中温大曲的细菌菌群多样性进行分析,采用电子鼻技术对大曲风味品质进行分析,并对优势菌属和风味品质之间的相关性进行解析与探讨,然后采用PICRUSt软件对菌群基因功能进行预测,同时结合可培养技术对大曲中芽孢杆菌进行分离鉴定,以期为进一步解析内蒙古地区中温大曲微生物结构和品质提供参考,从而为改善大曲品质提供数据支撑。
1 材料与方法
1.1 材料与试剂
中温大曲样品:内蒙古自治区河套地区H酒厂;DNeasy mericon Food Kit脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;聚合酶链式反应(polymerase chain reaction,PCR)清洁试剂盒:Axygen生物技术(杭州)有限公司;引物338F/806R、27F/1495R、M13F(-47)/M13R(-48):武汉天一辉远生物科技有限公司;5×TransStartTM FastPfu Buffer、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)、FastPfu Fly DNA Polymerase、牛血清白蛋白(bovine serum albumin,BSA)、2×PCR Buffer、rTaq酶和克隆载体pMDR18-T Vector:宝生物工程大连有限公司;大肠杆菌(Escherichia coli)top10感受态细胞:湖北省食品配料工程技术研究中心制备;营养琼脂(nutrient agar,NA)培养基:青岛海博生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BF-10小型高速粉碎机:河北本辰科技有限公司;5810R型离心机(冷冻型):德国Eppendorf公司;DYY-12型电泳仪:北京六一仪器厂;veritiFAST梯度PCR扩增仪:美国AB公司;Fluor Chem FC3型化学发光凝胶成像系统:美国Protein Simple公司;ND-2000C微量紫外分光光度计:美国Nano Drop公司;Illumina MiSeq高通量测序平台:美国Illumina公司;R920型机架式服务器:美国DELL公司;PEN3电子鼻:德国Airsense公司;HR40-IIB2生物安全柜:海尔集团电子商务有限公司。
1.3 方法
1.3.1 中温大曲样品采集和预处理
中温大曲样品于2022年10月采集自河套地区(111°45′20″E、39°54′39″N)H酒厂的制曲车间,以优质冬小麦为制曲原料,经过润粮、粉碎、拌料压曲、入房卧曲、培曲翻曲和入库贮存等工艺制成[11],选择同一批次、相同条件下制备的无断裂[12]、表面无霉斑、厚度适中、有特殊香气[13]的中温大曲曲块共5份,编号为BMZW1~BMZW5。在实验室条件下切割粉碎曲块,并通过20目筛子处理大曲粉末,以获取品质均一的大曲粉样品,将样品转移到无菌自封袋于4 ℃贮存。
1.3.2 中温大曲样品宏基因组DNA提取、PCR扩增和Illumina MiSeq高通量测序
按照试剂盒说明书中的步骤,使用DNeasy mericon Food Kit DNA基因组提取试剂盒对大曲样品中宏基因组DNA进行提取,以其为模板,使用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对检测合格的宏基因组DNA的16S rRNA V3-V4区基因序列进行PCR扩增[14],将合格的PCR扩增产物委托上海美吉生物医药科技有限公司完成Illumina MiSeq高通量测序。
1.3.3 序列质控和生物信息学分析
使用QIIME v1.9.1平台对Illumina MiSeq测序返回的原始序列进行质量控制和生物信息学分析,具体分析流程包括:对齐并合并双端序列,删减低质量序列、引物序列和嵌合体序列[15];划分操作分类单元(operational taxonomic unit,OTU)[16],通过RDPv11.5、Greengenev13.5和SILVA v132数据库[17]进行细菌物种注释;统计各样品中细菌在门和属水平的相对含量;计算相同测序深度下样品的超1(Chao1)指数和香农(Shannon)指数[18];使用PICRUSt软件对中温大曲中细菌菌群的基因功能进行预测[19],参考蛋白质直系同源簇数据库(clusters of orthologous groups of proteins,COGs)进行基因功能注释[20]。
1.3.4 大曲风味品质分析
参考文献[21]对中温大曲样品进行预处理,测量样品前,以空气为载体清洁注射针95 s,调零时间5 s,预备时间5 s,具体测量参数参考赵慧君等[22]的研究并略做调整。样品测试时间为60 s,选取49 s、50 s和51 s时的测试响应值作为有效数据进行后续分析,每个样品测试3个平行。
1.3.5 大曲中芽孢杆菌的分离及鉴定
分离与纯化:取10 g大曲粉末加入到装有90 mL无菌生理盐水的锥形瓶中,置于37 ℃摇床中220 r/min振荡30 min。采用梯度稀释法和平板涂布法对样品中可培养芽孢杆菌进行分离[23],并通过平板划线法对分离株进行多代纯化[24],根据菌落和细胞形态将纯化菌株保藏于-80 ℃超低温冰箱。
鉴定:参考文献[25]提取分离株的DNA,使用1%琼脂糖凝胶电泳对提取的DNA进行检测,将检测合格的DNA进行PCR扩增、清洁、连接和转化[26],选取鉴定结果为阳性的单克隆委托上海桑尼生物科技有限公司进行测序,将返回的测序序列进行拼接与去引物后,提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的Genbank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,明确分离株的分类学地位。
1.3.6 数据处理与可视化
使用Excel 2016进行数据处理,使用SAS软件(v9.4)中的Spearman相关系数法计算优势细菌属和大曲风味物质之间的相关系数;使用R软件绘制棒棒图、瀑布图和热图;使用jvenn(http://jvenn.toulouse.inra.fr/app/example.html)绘制韦恩图;使用在线网站(https://www.genescloud.cn/chart/chartOverview)绘制箱型图;使用MEGA7软件中的邻接法(neighbor joining,NJ)绘制系统发育树,并采用R软件包ggtree美化系统发育树。
2 结果与分析
2.1 中温大曲样品中细菌菌群多样性及组成分析
对采集自河套地区的5份中温大曲细菌菌群的16S rRNA V3-V4区域基因序列进行高通量测序,在测序量44 010 bp条件下获得超1(Chao1)指数和香农(Shannon)指数,对样品中细菌菌群的丰富度和多样性进行解析,结果见图1。
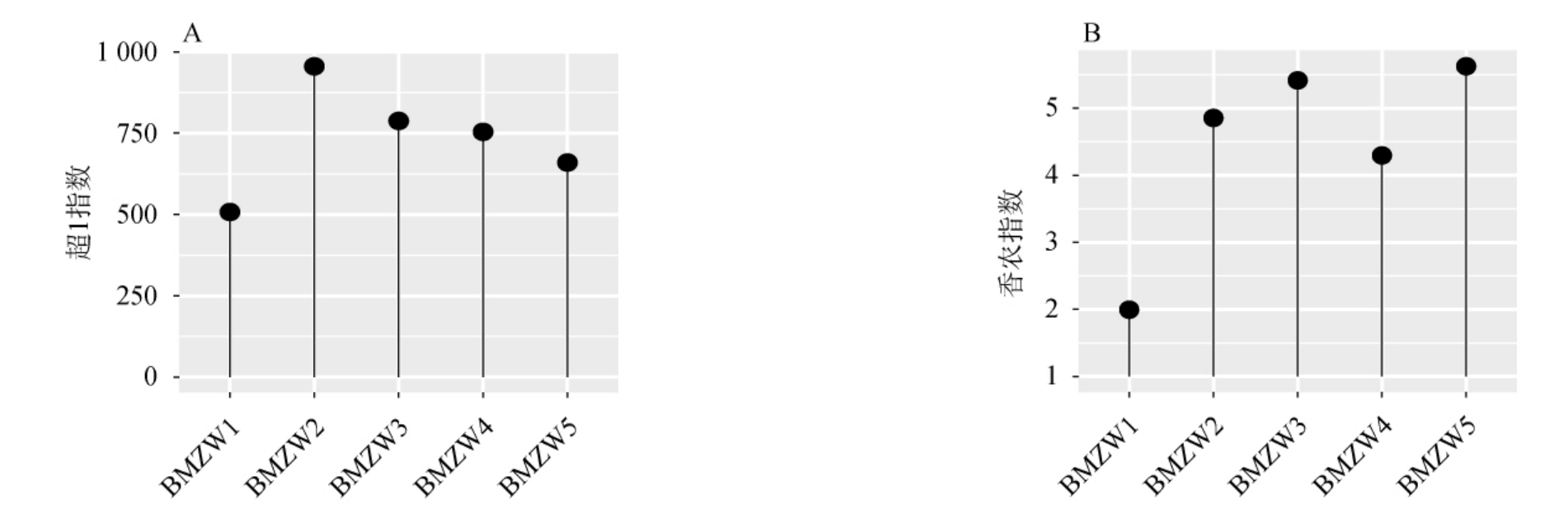
图1 中温大曲样品中细菌菌群的超1指数(A)和香农指数(B)
Fig.1 Chao 1 index (A) and shannon index (B) of bacterial groups in medium-temperature Daqu samples
由图1可知,样品BMZW1的超1指数和香农指数均最小,表明样品BMZW1的细菌物种数最少且物种多样性最低;样品BMZW2的超1指数最大,样品BMZW5的香农指数最大,表明样品BMZW2细菌物种数最多,BMZW5细菌物种多样性最高。由此表明,不同中温大曲样品之间细菌物种数和多样性存在差异。
从不同中温大曲样品中选择具有代表性的细菌OTU序列与数据库进行同源性比对,完成OTU序列物种注释。本研究将仅存在于其中一个样品中的OTU称为特有OTU,将存在于所有样品中的OTU称为核心OTU,将平均相对含量>1%的核心OTU称为核心优势OTU。中温大曲样品中OTU分布及核心优势OTU分析结果见图2。
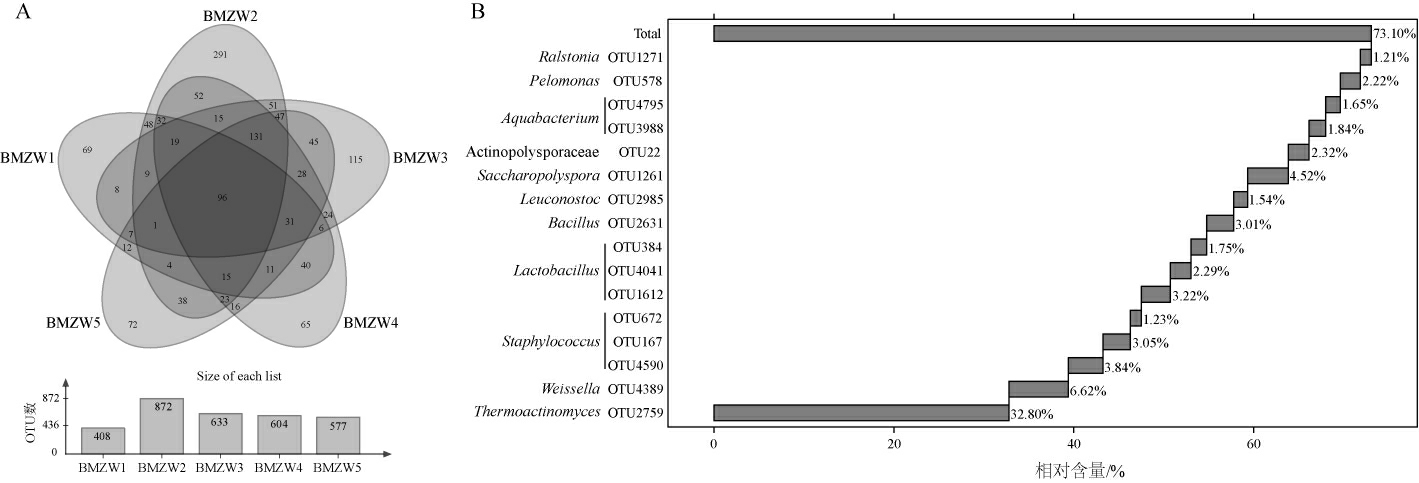
图2 中温大曲样品的OTU韦恩图(A)和核心优势OTU瀑布图(B)
Fig.2 OTU Venn diagram (A) and waterfall diagram of core advantage OTU (B) of medium-temperature Daqu samples
由图2A可知,中温大曲样品中共注释到3 094个OTU,包含197 041条有效序列。样品中共含有612个特有OTU,包含2 999条序列,占总测序量的1.52%;核心OTU有96个,包含173 246条序列,占总测序量的87.92%。由此表明,河套中温大曲样品中核心细菌总量占较大比重。
为进一步解析样品中核心细菌类群,对核心优势OTU进行数据可视化分析。由图2B可知,核心优势OTU相对含量为73.10%,包括隶属于高温放线菌属(Thermoactinomyces)(32.80%)的OTU2759,隶属于魏斯氏菌属(Weissella)(6.62%)的OTU4389,隶属于葡萄球菌属(Staphylococcus)(8.12%)的OTU4590、OTU167和OTU672,隶属于乳杆菌属(Lactobacillus)(7.27%)的OTU1612、OTU4041和OTU384,隶属于芽孢杆菌属(Bacillus)(3.01%)的OTU2631,隶属于明串珠球菌属(Leuconostoc)(1.54%)的OTU2985,隶属于糖多孢菌属(Saccharopolyspora)(4.52%)的OTU1261,隶属于放线多孢菌科(Actinopolysporaceae)(2.32%)的OTU22,隶属于水杆菌属(Aquabacterium)(3.48%)的OTU3988和OTU4795,隶属于嗜糖假单胞菌属(Pelomonas)(2.22%)的OTU578和隶属于青枯菌属(Ralstonia)(1.21%)的OTU1271。综上表明,河套中温大曲样品中优势菌群类群丰富且相对含量较高。
为进一步解析不同样品中核心细菌类群,基于细菌门和属水平对样品中细菌群落进行分析。其中,本研究将样品中平均相对含量>1%的细菌门和属称为优势细菌门和属,各样品中细菌门、属分布见图3。
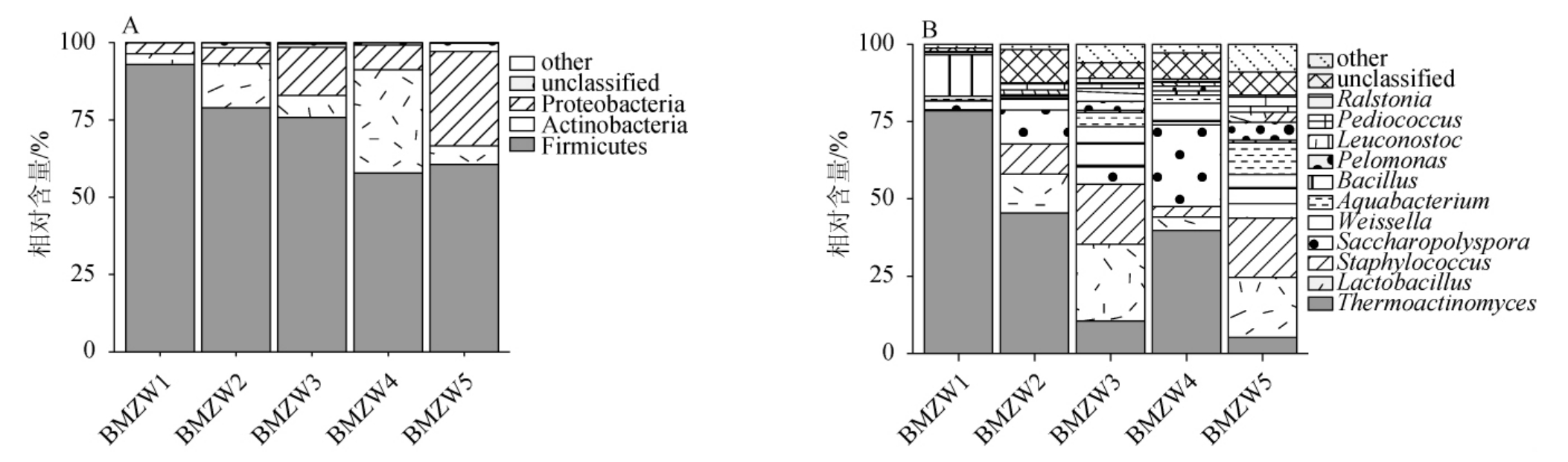
图3 基于门(A)和属(B)水平中温大曲样品中细菌菌群结构
Fig.3 Bacterial community structure of medium-temperature Daqu samples based on phylum (A) and genus (B) levels
other:平均相对含量≤1%的门或属。
由图3A可知,中温大曲样品中优势细菌门主要隶属于厚壁菌门(Firmicutes)(73.23%)、放线菌门(Actinobacteria)(12.85%)和变形菌门(Proteobacteria)(12.56%),累计平均相对含量达98.64%。Firmicutes是大曲中具有绝对优势的细菌类群,由此可推测,本研究河套中温大曲的生产工艺、制曲原料等条件更适合Firmicutes类细菌的富集。
由图3B可知,中温大曲样品中优势细菌属有11个,分别为Thermoactinomyces、Lactobacillus、Staphylococcus、Saccharopolyspora、Weissella、Aquabacterium、Bacillus、Pelomonas、Leuconostoc、片球菌属(Pediococcus)和Ralstonia,平均相对含量分别为35.88%、12.29%、10.36%、10.07%、6.82%、3.78%、3.33%、2.22%、2 07%、1.28%和1.21%。冯佳婷等[27]通过对泸州老窖大曲微生物群落结构进行分析显示,Bacillus(63.53%)、Thermoactinomyces(7.0%)和Saccharopolyspora(9.7%)是高温曲中高丰度菌群,Lactobacillus(35.8%)、Weissella(35.9%)和Thermoactinomyces(13.77%)是中温曲中高丰度菌群。与本研究结论相比,酿酒大曲中菌群构成具有一定的相似性,但菌群丰度受到制曲温度、地域条件等因素的影响存在差异。
2.2 中温大曲样品风味品质电子鼻分析
为进一步解析中温大曲品质,本研究基于电子鼻技术对大曲样品中的风味物质进行分析,结果见图4。
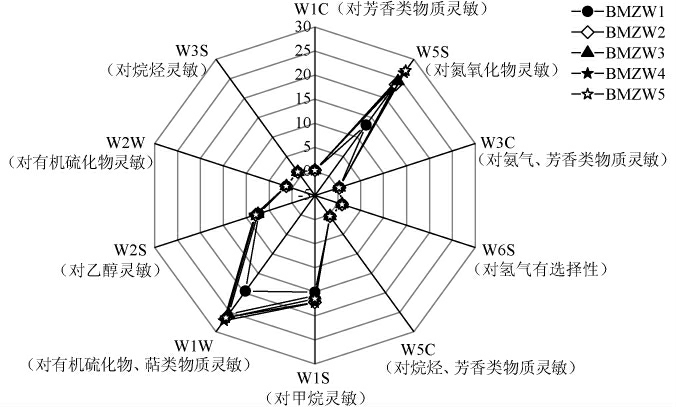
图4 中温大曲样品风味电子鼻分析结果
Fig.4 Electronic nose analysis results of flavor of mediumtemperature Daqu samples
由图4可知,W1W、W5S和W1S传感器响应值较大,表明大曲样品中含量较高的风味物质包括有机硫化物、萜类物质、氮氧化物和甲烷,其次为乙醇和烷烃等风味物质。此外,对芳香类物质灵敏的传感器W1C、W3C和W5C的响应值偏低,表明大曲样品中芳香类物质强度较低。
2.3 中温大曲样品风味品质与优势细菌属间相关性分析
为进一步探究大曲风味品质与优势细菌属之间的关联性,本研究对其进行Spearman相关性分析,结果见图5。
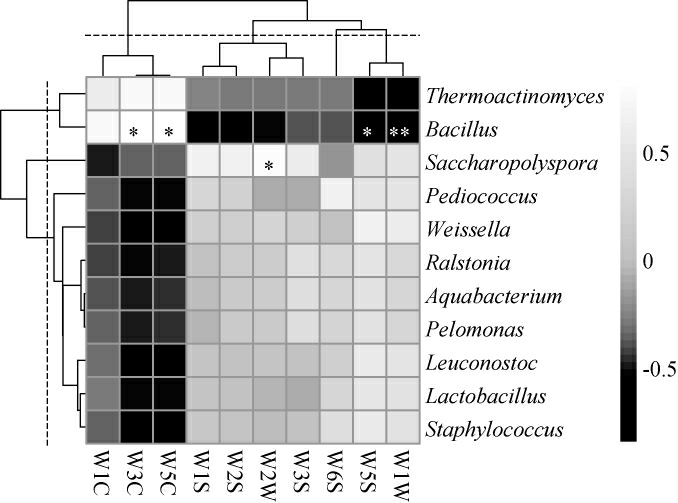
图5 中温大曲样品风味品质与优势细菌属相关性分析热图
Fig.5 Heatmap of correlation analysis between flavor quality and dominant bacterial genera in medium-temperature Daqu samples
“*”表示相关性显著(P<0.05);“**”表示相关性极显著(P<0.01)。
由图5可知,Bacillus与W3C和W5C呈显著正相关(P<0.05),与W5S呈显著负相关(P<0.05),与W1W呈极显著负相关(P<0.01),Saccharopolyspora与W2W呈显著正相关(P<0.05)。由此表明,Bacillus与大曲中有机硫化物、萜类物质、氮氧化物和芳香类物质等风味物质之间存在显著相关性(P<0.05),这可能与芽孢杆菌可以分泌多种酶有关[28],如淀粉酶、蛋白酶和脂肪酶等,对大曲中风味化合物的产生发挥重要作用。Saccharopolyspora与有机硫化物之间存在显著相关性(P<0.05),Saccharopolyspora中存在能产生抗生素、酶类、免疫抑制剂等生物活性物质的物种,是寻找新的生物活性物质的重要菌源[29]。
2.4 细菌菌群的基因功能预测分析
本研究使用PICRUSt软件对大曲样品中细菌菌群的基因功能进行预测,从而探索大曲微生物的潜在功能,所有细菌序列注释到4 092个COG,分别隶属于23个功能大类,结果见图6。
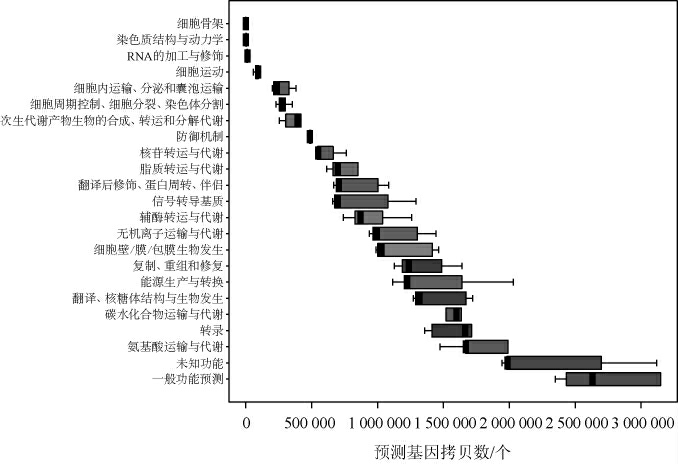
图6 中温大曲中细菌菌群的基因功能预测结果
Fig.6 Gene function prediction results of bacteria in mediumtemperature Daqu
由图6可知,中温大曲样品中细菌菌群基因除了在转录、翻译、核糖体结构与生物发生、复制、重组和修复等与自身生长繁殖功能相关方面具有较高丰度(25.15%),在氨基酸运输与代谢、碳水化合物运输与代谢和能源生产与转换等营养物质生产与代谢功能上也呈现高丰度分布状态,占总丰度的22.03%。由此表明,大曲中细菌群落在原料降解和风味物质代谢方面具有较大潜力,且样品中细菌基因的生长繁殖功能具有较高丰度,伴随着其能量产生与转换功能具有较高的丰度。CAI W C等[30]研究显示,大曲的发酵依赖氨基酸和碳水化合物的运输与代谢,氨基酸作为微生物生长所需的氮源,影响微生物的生长和代谢,是大曲挥发性芳香物质产生的基础,同时氨基酸与碳水化合物反应会赋予大曲独特的香气。大曲中的细菌还存在高丰度的一般功能预测和未知功能的基因,分别占总丰度的12.96%和10.16%。结合图3B可知,大曲中存在一定丰度的未鉴定细菌属,平均相对含量达6.58%。由此推测,样品中未知功能的基因可能与这些未研究的细菌相关[31]。
2.5 中温大曲样品中芽孢杆菌的分离及鉴定
上述分析已表明,Bacillus是中温大曲中的优势菌群,与大曲中多种风味物质具有显著相关性,为进一步解析中温大曲中芽孢杆菌的分布情况,本研究对样品中可培养芽孢杆菌进行分离纯化。根据菌落形态、颜色、大小和边缘情况,从大曲样品中共分离纯化出30株疑似芽孢杆菌菌株,并对分离菌株进行分子生物学鉴定,经同源性比对分析发现,分离菌株隶属于7个种,其菌落形态和细胞形态见图7。
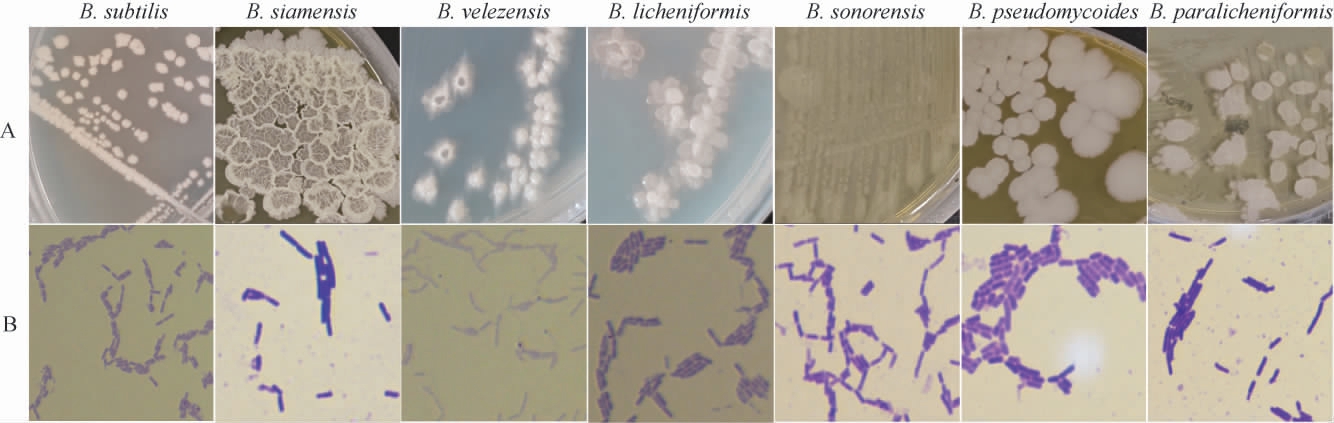
图7 7种分离菌株的菌落形态(A)和细胞形态(B)
Fig.7 Colony morphology (A) and cell morphology (B) of 7 isolated strains
由图7可知,隶属于不同种的芽孢杆菌其菌落形态呈现明显差异,细胞形态均呈现杆状,但菌体粗细和长短不尽相同。为进一步呈现30株分离菌株中芽孢杆菌的分布情况,构建系统发育树分析,结果见图8。
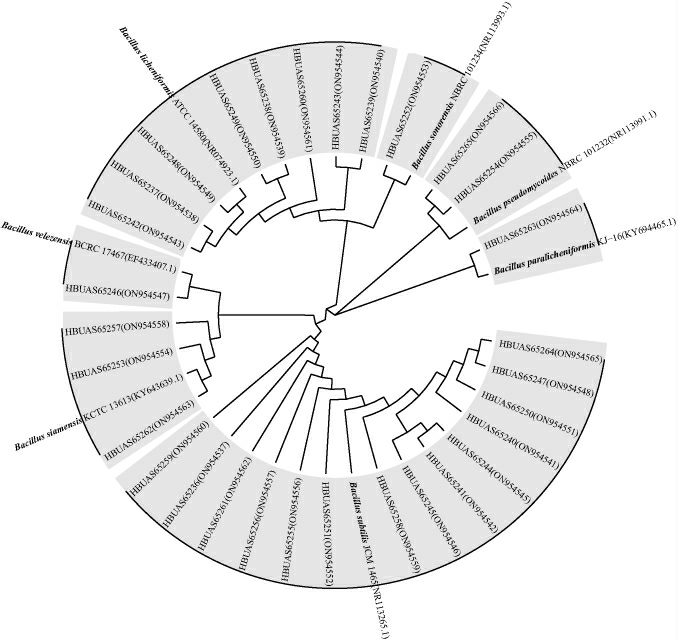
图8 基于16S rRNA基因序列30株分离菌株的系统发育树
Fig.8 Phylogenetic tree of 30 isolated strains based on 16S rRNA gene sequence
由图8可知,分离菌株与其对应标准菌株之间形成明显的聚类树形,且位于同一聚类的分离株与标准菌株之间的相似度均≥99%。由此表明,30株分离菌株被鉴定为7个细菌种。其中,14株被鉴定为枯草芽孢杆菌(Bacillus subtilis),占总分离株数的36.67%,为大曲中可培养芽孢杆菌的第一大优势菌种。8株被鉴定为地衣芽孢杆菌(Bacillus licheniformis),占总分离株数的26.67%,为第二大优势菌种。3株被鉴定为暹罗芽孢杆菌(Bacillus siamensis),2株被鉴定为假蕈状芽孢杆菌(Bacillus pseudomycoides),其余3株分别被鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)、索诺氏芽孢杆菌(Bacillus sonorensis)和副地衣芽孢杆菌(Bacillus paralicheniformis)。不同芽孢杆菌可在大曲发酵中影响其特征风味物质的合成,HE G Q等[32]研究显示,接种Bacillus subtilis和Bacillus velezensis可以增加大曲中己酸、己酸乙酯和己酸己基酯等风味代谢物的含量,改善大曲品质。XU B Y等[33]研究表明,接种Bacillus licheniformis和Bacillus velezensis可以改变大曲中微生物丰度,控制微生物代谢,使大曲中醇类、酸类和酮类等风味物质的含量有所提高。
3 结论
纳入研究的河套中温大曲样品细菌菌群丰富,优势细菌门包括Firmicutes、Actinobacteria和Proteobacteria,优势细菌属主要隶属于Thermoactinomyces、Lactobacillus、Staphylococcus、Saccharopolyspora、Weissella、Aquabacteri um、Bacillus、Pelomonas、Leuconostoc、Pediococcus和Ralstonia。其中,Bacillus与有机硫化物、萜类物质、氮氧化物和芳香类物质之间存在显著相关性(P<0.05),Saccharopolyspora与有机硫化物呈显著正相关(P<0.05),且细菌菌群基因在氨基酸运输与代谢、碳水化合物运输与代谢和能源生产与转换功能上有较高丰度。大曲中可培养芽孢杆菌种类丰富,分离的30株芽孢杆菌分别隶属于7个种,其中Bacillus subtilis(36.67%)和Bacillus licheniformis(26.67%)相对含量较高,对大曲中风味物质的形成及中温大曲品质的改善具有不可忽视的作用。
[1]ZHOU Q F,MA K,SONG Y,et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu daqu starters made at low-,mediumand high-temperatures[J].LWT-Food Sci Technol,2022,162:113408.
[2] SHANG C H, LI Y J, ZHANG J, et al.Analysis of bacterial diversity in different types of Daqu and fermented grains from Danquan distillery[J].Front Microbiol,2022,13(7):883122.
[3] CHEN Y R, LI K M, LIU T, et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese Special-flavor Baijiu Daqu[J].Front Microbiol,2021,11(1):3340.
[4]HUANG Y H,YI Z L,JIN Y L,et al.New microbial resource:microbial diversity, function and dynamics in Chinese liquor starter[J].Sci Rep,2017,7(1):14577.
[5] WU X Y, JIANG Q E, WANG Z S, et al.Diversity, enzyme production and antibacterial activity of Bacillus strains isolated from sesame-flavored liquor Daqu[J].Arch Microbiol,2021,203(9):5831-5839.
[6]张会敏.古井贡酒微生物群落结构及其与主要风味物质的关联研究[D].哈尔滨:哈尔滨工业大学,2017.
[7]MEEK MH,LARSON W A.The future is now:Amplicon sequencing and sequence capture usher in the conservation genomics era[J].Mol Ecol Resour,2019,19(4):795-803.
[8]LI Y,YUAN L,LIU H J,et al.Analysis of the changes of volatile flavor compounds in a traditional Chinese shrimp paste during fermentation based on electronic nose, SPME-GC-MS and HS-GC-IMS[J].Food Sci Hum Well,2023,12(1):173-182.
[9]SEESAARD T,WONGCHOOSUK C.Recent progress in electronic noses for fermented foods and beverages applications[J].Fermentation,2022,8(7):302.
[10]张自学.内蒙古生态环境状况及生态环境受破坏原因[J].内蒙古环境保护,2000(2):30-33,36.
[11]YANG Y,WANG S T,LU Z M,et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature daqu starter[J].Food Res Int,2021,140(2):110037.
[12]FAN G S,FU Z L,TENG C,et al.Comprehensive analysis of different grades of roasted-sesame-like flavored Daqu[J].Int J Food Prop,2019,22(1):1205-1222.
[13]ZHANG Y D,DING F,SHNE Y,et al.Characteristics of the microbiota and metabolic profile of high-temperature Daqu with different grades[J].World J Microb Biot,2022,38(8):137.
[14]张雅琳,刘廷锐,朱文优,等.基于Illumina MiSeq高通量测序技术解析四川麸醋发酵过程中微生物菌群结构[J].中国食品学报,2022,22(6):299-306.
[15]DONG W W,YANG Q,LIAO Y X,et al.Characterisation and comparison of the microflora of traditional and pure culture xiaoqu during the Baijiu liquor brewing process[J].J I Brewing,2020,126(2):213-220.
[16]WANG Q,WANG C Y,XIANG X Q,et al.Analysis of microbial diversity and succession during Xiaoqu Baijiu fermentation using high-throughput sequencing technology[J].Eng Life Sci,2022,22(7):495-504.
[17]BALVOCIUTE M,HUSON D H.SILVA,RDP,Greengenes,NCBI and OTT-how do these taxonomies compare?[J].BMC Genomics,2017,18(2):114-121.
[18]侯强川,王玉荣,王文平,等.茅台和尧治河高温大曲细菌群落结构差异及功能预测[J].食品与发酵工业,2022,48(1):36-44.
[19]TALLEI T E,FATIMAWALI,YELNETTY A,et al.Predictive microbial community and functional gene expression profiles in pineapple peel fermentation using 16S rRNA gene sequences[J].Fermentation,2022,8(5):194.
[20] BARQ M G, HASSAN M M, YASMIN H, et al.Variation in archaeal and bacterial community profiles and their functional metabolic predictions under the influence of pure and mixed fertilizers in paddy soil[J].Saudi J Biol Sci,2021,28(11):6077-6085.
[21]张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[22]赵慧君,王玉荣,李昕沂,等.基于电子鼻和GC-MS技术分析大头菜的挥发性风味物质[J].中国调味品,2018,43(11):17-22.
[23]DABIRÉ Y,SOMDA N S,SOMDA M K,et al.Molecular identification and safety assessment of Bacillus strains isolated from Burkinabe traditional condiment"soumbala"[J].Ann Microbiol,2022,72(1):10.
[24] HA G, YANG H, RYU M, et al.Bacterial community and anti-cerebrovascular disease-Related Bacillus species isolated from traditionally made kochujang from different provinces of Korea[J].Microorganisms,2021,9(11):2238.
[25]POVEDANO-PRIEGO C,JROUNDI F,LOPEZ-FERNANDEZ M,et al.Deciphering indigenous bacteria in compacted bentonite through a novel and efficient DNA extraction method:insights into biogeochemical processes within the Deep Geological Disposal of nuclear waste concept[J].J Hazard Mater,2021,408(4):124600.
[26]黄治国,刘娜,卫春会,等.高温大曲曲房空气中可培养细菌的分离鉴定及产酶特性[J].食品与机械,2021,37(5):15-21.
[27]冯佳婷,陆震鸣,时伟,等.不同培养温度对大曲微生物群落结构、酶活及挥发性化合物的影响[J].应用与环境生物学报,2021,27(3):760-767.
[28]WU X Y,JIANG Q E,WANG Z S,et al.Diversity,enzyme production and antibacterial activity of Bacillus strains isolated from sesame-flavored liquor Daqu[J].Arch Microbiol,2021,203(9):5831-5839.
[29]吴冬冬,张建丽.糖多孢菌属的多相分类[J].微生物学杂志,2007,27(1):55-58.
[30] CAI W C,WANG Y R, NI H, et al.Diversity of microbiota, microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150(12):110734.
[31]ZHANG J,LIU S P,SUN H L,et al.Metagenomics-based insights into the microbial community profiling and flavor development potentiality of Baijiu Daqu and huangjiu wheat Qu[J].Food Res Int,2022,152(2):110707.
[32] HE G Q, HUANG J, ZHOU R Q, et al.Effect of fortified Daqu on the microbial community and flavor in Chinese Strong-flavor liquor brewing process[J].Front Microbiol,2019,10(1):56-66.
[33]XU B Y,XU S S,CAI J,et al.Analysis of the microbial community and the metabolic profile in medium-temperature Daqu after inoculation with Bacillus licheniformis and Bacillus velezensis[J].LWT-Food Sci Technol,2022,160(4):113214.