益生菌作为有益微生物(酵母或细菌),在与宿主共生时能给人体带来有益的保健作用[1]。目前,在发酵食品加工中利用率最广的益生菌为乳酸菌。乳酸菌是一类革兰氏染色阳性、无芽孢的菌株,其可以通过发酵糖类而产生大量的乳酸,在自然界中广泛地存在[2],是一类应用较早的微生物,主要用于生产发酵食品,赋予产品丰富的滋味和香气特征,提高其益生性能及抗氧化性能[3-4]。
目前,通过诱变育种来提高乳酸菌菌株的产乳酸能力,常见的诱变技术有紫外诱变、化学试剂诱变、常压室温等离子体技术等[5-7],然而,国内关于利用脉冲强光技术诱变选育高产酸乳酸菌的研究鲜有报道。与其他诱变技术相比,脉冲强光技术作为一种新型诱变技术,具有耗能低、效率高、处理时间短、操作简单等优点[8-9]。在对枯草芽孢杆菌(Bacillussubtilis)、保加利亚乳杆菌(Lactobacillusbulgaricus)、黑曲霉(Aspergillus niger)和酿酒酵母(Saccharomyces cerevisiae)等菌株中成功运用,可筛选出耐热、耐酸、耐胆盐等性能良好的突变株[10-13]。
为进一步提高植物乳杆菌(Lactobacillus plantarum)CICC 6240的产乳酸能力,本研究以其为研究对象,采用脉冲强光进行诱变处理,并以乳酸含量为响应值,通过响应面法优化最佳处理条件。采用最佳脉冲强光对植物乳杆菌CICC 6240进行诱变后,通过溶钙圈法和乳酸产量测定选育产乳酸能力高的突变株,并对其耐酸、耐胆盐、人工胃肠液耐受性、疏水性、自聚集能力进行研究,初步探究突变菌株的益生性能,考察脉冲强光作为一种新型的诱变技术应用于植物乳杆菌诱变的可行性,为诱变技术的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
植物乳杆菌(Lactobacillus plantarum)CICC 6240:沈阳农业大学食品学院保藏。
1.1.2 试剂
胃蛋白酶(800 U/mg)、胰蛋白酶(250 U/mg)、碳酸钙、琼脂粉、氢氧化钠:北京鼎国昌盛生物技术有限责任公司;无水乳酸锂、对羟基联苯、钨酸钠、硫酸铜、氢氧化钙、浓硫酸、盐酸、猪胆盐、二甲苯、氯仿、乙酸乙酯:沈阳伽玛商贸有限公司;葡萄糖、乙酸钠、磷酸氢二钾、柠檬酸二铵、七水硫酸镁、一水硫酸锰、吐温80:沈阳莱博科贸有限公司。本研究所用试剂均为分析纯或生化试剂。
人工胃液:磷酸盐缓冲液(phosphatebuffersaline,PBS)、胃蛋白酶3.0 g/L,盐酸调节pH至2.5,过0.45 μm滤膜除菌。人工肠液:磷酸盐缓冲液、胰蛋白酶1.0 g/L,氢氧化钠调pH至8.0,过0.45 μm滤膜除菌。
1.1.3 培养基
MRS液(固)体培养基:北京索莱宝科技有限公司。
1.2 仪器与设备
QL-10152氙灯管:沈阳农业大学食品学院研制;YX-280A高压蒸汽灭菌锅、DK-S22恒温水浴锅:常州国华科技有限公司;250Lwi17192恒温培养箱:上海一恒科学仪器有限公司;2-16KL离心机:美国Sigma公司;Libra S50紫外分光光度计:上海美谱达仪器有限公司。
1.3 方法
1.3.1 乳酸菌的活化和菌悬液的制备
将保藏于-80 ℃冰箱的植物乳杆菌CICC6240接种于MRS液体培养基中,37 ℃静置培养24 h,将菌株活化3次后培养至对数期,8 000 r/min离心10 min,去上清,用0.85%无菌生理盐水清洗菌体表面3次,采用等体积的0.85%无菌生理盐水重悬菌体并稀释106倍制成菌悬液。
1.3.2 脉冲强光诱变条件的确定
取10 mL菌悬液进行脉冲强光照射,在单因素试验结果(脉冲电压1 600 V、脉冲次数16次、脉冲距离9 cm)的基础上,以脉冲电压(A)、脉冲次数(B)、脉冲距离(C)为考察因素,乳酸产量(Y)为响应值,采用Design-Expert V12.0.3.0设计3因素3水平的Box-Behnken响应面试验,试验因素与水平见表1[14-15]。
表1 脉冲强光诱变条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for pulsed light mutagenesis conditions optimization

水平 A 脉冲电压/V B 脉冲次数/次 C 脉冲距离/cm 10-1 1 800 1 600 1 400 19 16 13 11 97
1.3.3 致死率的计算
取200 μL脉冲强光照射处理后的菌悬液均匀涂布于MRS固体培养基上,37 ℃倒置培养48 h,记录诱变后菌落数;取200 μL未经脉冲处理菌悬液,相同条件涂布培养,记录诱变前菌落数,并计算致死率,其计算公式如下:
式中:X为菌株致死率,%;N1为诱变前菌落数,CFU/mL;N2为诱变后菌落数,CFU/mL。
1.3.4 高产乳酸突变菌株的筛选
(1)初筛
取200 μL脉冲强光处理后的细胞悬浮液均匀涂布于含有1.5%碳酸钙的MRS固体培养基上,37 ℃倒置培养48 h,记录菌落数,每组做3次平行。测量诱变菌株的溶钙圈直径(H)及菌落直径(C),计算HC值,挑选其中HC值相比于原始菌株HC值大30%的菌株进行复筛[16]。
(2)复筛
将初筛菌株活化后以2%(V/V)的接种量接种到MRS液体培养基中,37 ℃培养14 h,采用对羟基联苯法测定发酵液乳酸产量[17],挑选高产乳酸菌株。
1.3.5 益生特性的测定
(1)耐酸能力的测定
将活化3次的菌液以2%(V/V)的接种量接种至pH值分别为2.0、3.0、6.0的MRS液体培养基中,37 ℃培养3 h,试验重复3次,活菌计数,计算存活率,其计算公式如下:
式中:X为菌株存活率,%;Nt为不同条件下培养后的活菌数,CFU/mL;N为初始活菌数,CFU/mL。
(2)耐人工模拟胃肠液能力的测定
将活化3次的菌液于4 ℃、8 000 r/min条件下离心10 min,弃上清,采用等体积0.85%无菌生理盐水重悬菌体制备菌悬液。移取1 mL菌悬液于9 mL人工模拟胃液,37 ℃恒温培养3 h,活菌计数。再取胃液处理后的菌液1 mL接种至9 mL人工模拟肠液,37 ℃培养4 h,活菌计数,并按照公式(2)计算其存活率。
(3)耐胆盐能力的测定
将活化3次的菌液以2%(V/V)的接种量接种胆盐含量分别为0.3%、0.5%、1.0%的MRS培养基中,37 ℃恒温培养3 h,活菌计数,并按照公式(2)计算其存活率。
(4)自凝集性的测定
将1.3.1所制备的菌悬液调整OD600 nm值至0.6±0.05,为A0。于37 ℃恒温培养,在培养0 h、3 h、6 h和24 h时,移取上层培养液,测定OD600 nm值,为At,试验重复3次,计算自凝集率,其计算公式如下:
式中:X为自凝集率,%;A0为培养0 h时的OD600 nm值;At为不同培养时间的OD600 nm值。
(5)表面疏水性的测定
取2 mL菌悬液分别与2 mL二甲苯、氯仿、乙酸乙酯混合,漩涡振荡10 min,室温静置30 min。取水相测定OD600nm值,重复试验3次,计算疏水率,其计算公式如下:
式中:X为疏水率,%;A0为试剂萃取前水相的OD600 nm值;At为试剂萃取后水相的OD600 nm值。
1.3.6 数据处理
每个试验均平行重复3次,测定结果以“平均值±标准差”表示,使用IBM SPSS Statistics 25.0进行数据分析。
2 结果与分析
2.1 脉冲强光诱变条件优化响应面试验结果
利用Design-Expert V12.0.3.0软件进行3因素3水平的Box-Behnken响应面试验,试验设计及结果见表2,方差分析见表3。
表2 脉冲强光诱变条件优化响应面试验设计及结果
Table 2 Design and results of response surface tests for pulsed light mutagenesis conditions optimization
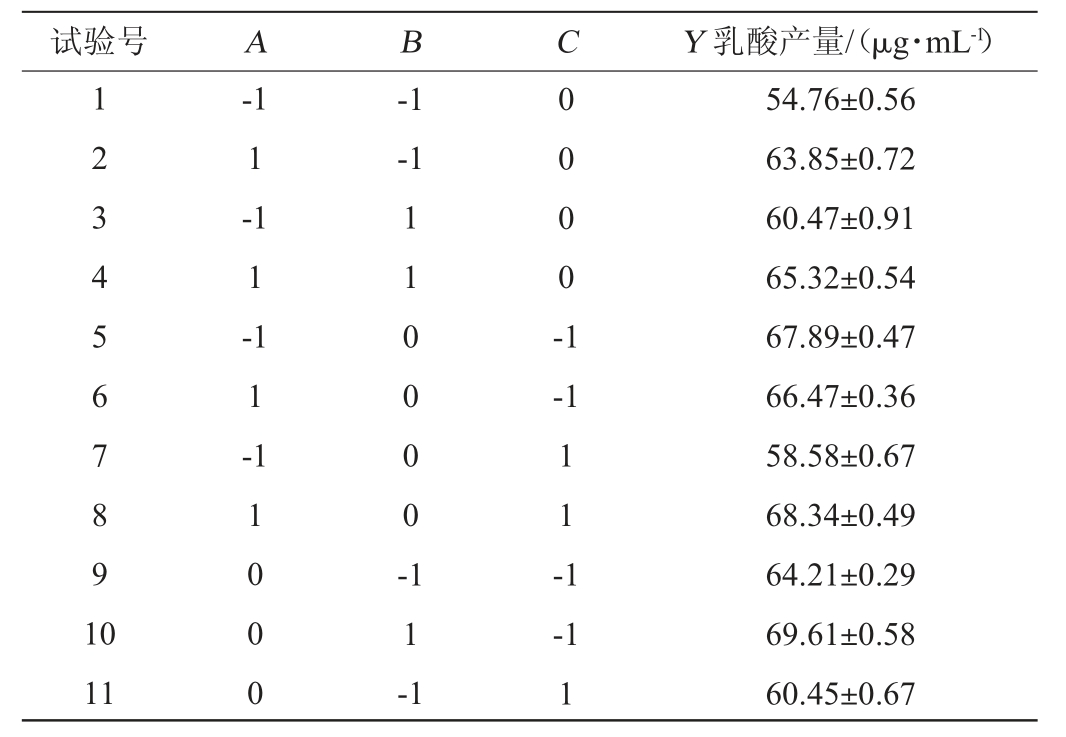
试验号 A B C Y 乳酸产量/(μg·mL-1)1 2 3 4 5 6 7 8 9 1 0-1 1-1 1-1 1-1-1-1 1 1 0 0 0 0 -0 0 0 0 -1-1 1 1 -1 11 1 0 0 0 1 1 -1-1 1 54.76±0.56 63.85±0.72 60.47±0.91 65.32±0.54 67.89±0.47 66.47±0.36 58.58±0.67 68.34±0.49 64.21±0.29 69.61±0.58 60.45±0.67
续表
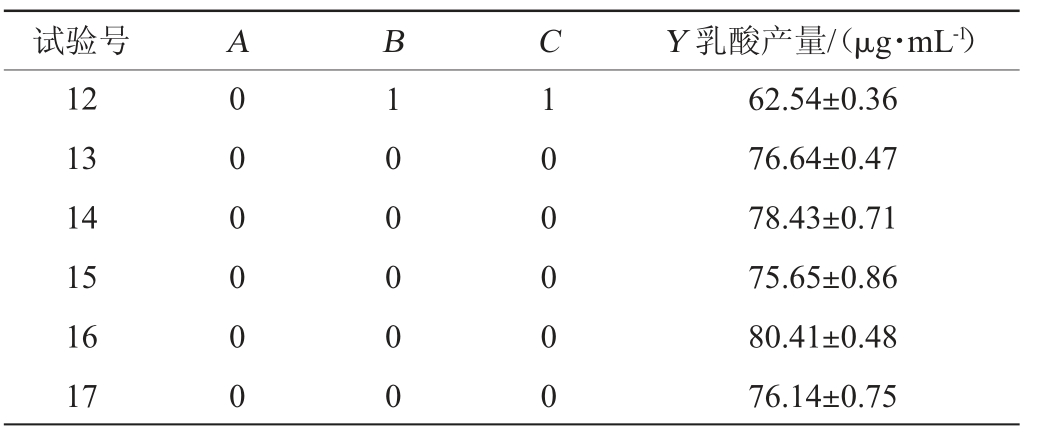
试验号 A B C Y 乳酸产量/(μg·mL-1)12 13 14 15 16 17 0 0 0 0 0 0 1 0 0 0 0 0 1 0 0 0 0 0 62.54±0.36 76.64±0.47 78.43±0.71 75.65±0.86 80.41±0.48 76.14±0.75
表3 回归模型的方差分析
Table 3 Variance analysis of regression model
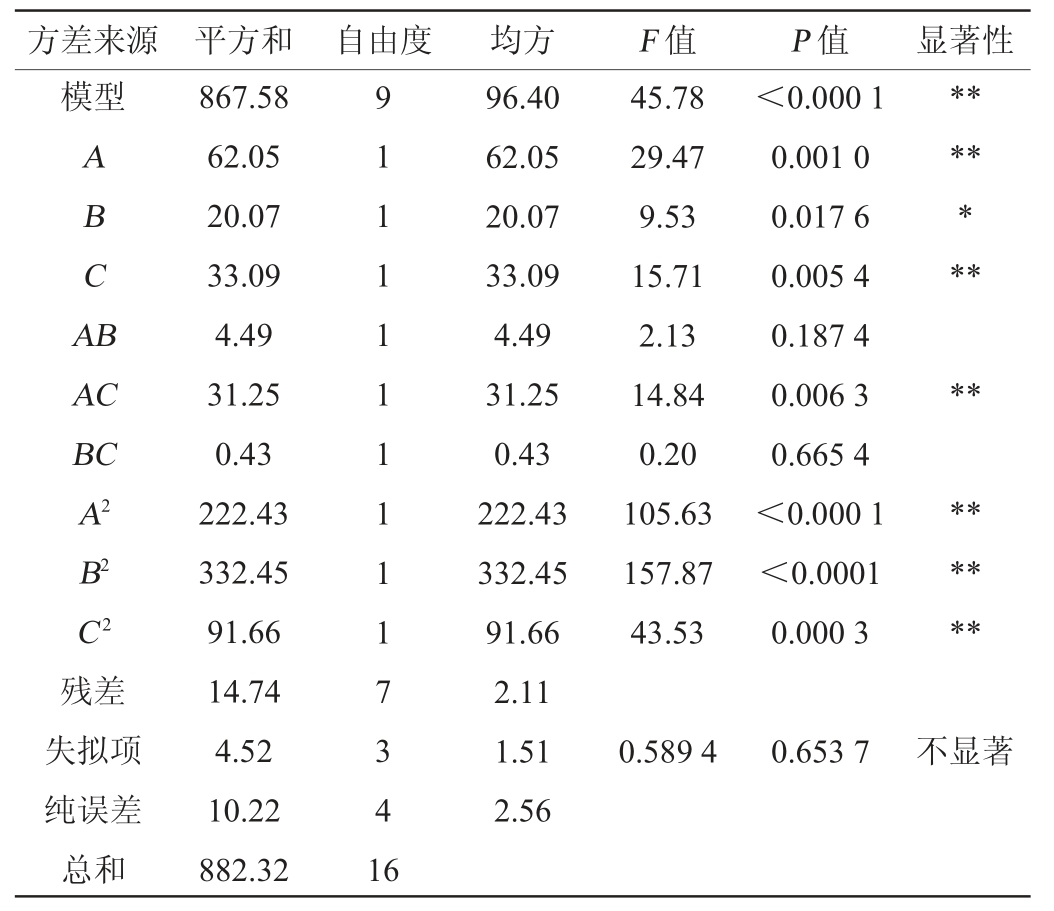
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B*******AC BC A2 B2 C2残差失拟项纯误差总和867.58 62.05 20.07 33.09 4.49 31.25 0.43 222.43 332.45 91.66 14.74 4.52 10.22 882.32 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 96.40 62.05 20.07 33.09 4.49 31.25 0.43 222.43 332.45 91.66 2.11 1.51 2.56 45.78 29.47 9.53 15.71 2.13 14.84 0.20 105.63 157.87 43.53<0.000 1 0.001 0 0.017 6 0.005 4 0.187 4 0.006 3 0.665 4<0.000 1<0.0001 0.000 3********0.589 4 0.653 7不显著
采用Design-Expert V12.0.3.0软件对表2结果进行二次多元回归拟合,得到多元二次回归方程:
由表3可知,模型极显著(P<0.01),失拟项不显著(P>0.05),模型的决定系数R2为0.983 3,校正决定系数R2Adj为0.961 8,表明该模型合理,方程与实际拟合较好,能有效反映出菌株产乳酸与脉冲电压、脉冲次数和照射距离之间的关系。由表3亦可知,一次项A、C,交互项AC,二次项A2、B2、C2对结果影响极显著(P<0.01),一次项B对结果影响显著(P<0.05),其余项则不显著(P>0.05)。由F值可知,各因素对乳酸产量影响大小顺序为A(脉冲电压)>C(脉冲距离)>B(脉冲次数)。
对回归方程进行最优求解,确定最佳诱变条件为:脉冲电压1 702.15 V、脉冲次数18.205 4次、脉冲距离9.068 12 cm,在此条件下,乳酸产量预测值为72.7104μg/mL。为便于实际操作,将最优脉冲强光处理条件修订为:脉冲电压1 700 V,脉冲次数18次,脉冲距离9 cm。在此条件下重复进行3次试验,乳酸产量为69.48 μg/mL,与预测值相近,且在此条件下,致死率达到82.56%,说明所建模型拟合条件可行,具有实际参考意义。
2.2 脉冲强光诱变选育
2.2.1 初筛
采用最佳脉冲强光诱变处理植物乳杆菌CICC6240,对高产乳酸菌株进行初筛,结果见图1。
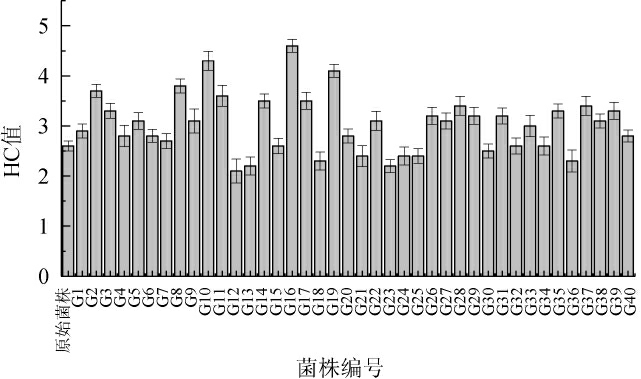
图1 高产乳酸突变株的初筛结果
Fig.1 Preliminary screening results of mutant strains with high-yield lactic acid
由图1可知,27株突变菌株的HC值高于原始菌株HC值(2.6),其中,突变菌株G2、G8、G10、G11、G14、G16、G17、G19的HC值较高,为3.5~4.2。因此,对初筛出的8株突变菌株进行复筛。
2.2.2 复筛
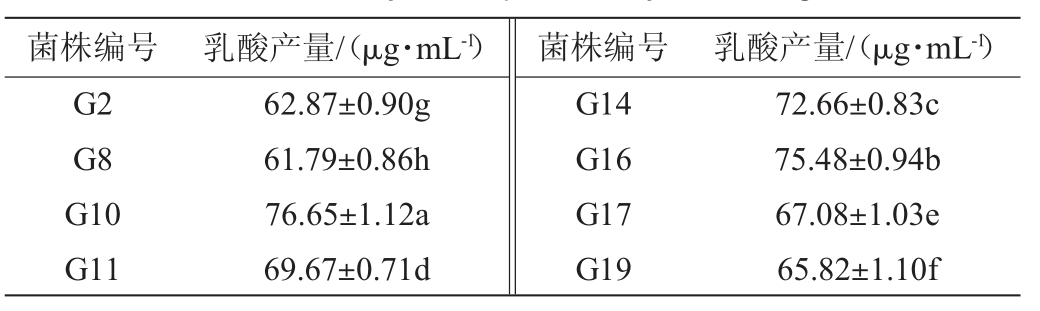
初筛突变菌株的乳酸产量见表4。由表4可知,相较于原始菌株的乳酸产量[(48.22±0.61)μg/mL],突变菌株的产乳酸能力均有显著提升(P<0.05)。其中,突变菌株G10和G16的产乳酸能力较强,分别为76.65 μg/mL、75.48 μg/mL,比原始菌株分别提高58.96%和56.53%。因此,选取突变菌株G10和G16为高产乳酸突变株。
表4 初筛菌株的乳酸产量
Table 4 Lactic acid yield of preliminary screening strains
注:不同小写字母表示差异显著(P<0.05)。下同。
菌株编号G2 G8 G10 G11乳酸产量/(μg·mL-1) 菌株编号 乳酸产量/(μg·mL-1)62.87±0.90g 61.79±0.86h 76.65±1.12a 69.67±0.71d G14 G16 G17 G19 72.66±0.83c 75.48±0.94b 67.08±1.03e 65.82±1.10f
2.3 体外益生特性研究
2.3.1 耐酸性试验
耐酸能力的强弱是评价乳酸菌益生性能的重要指标之一,具有良好的耐酸能力才可以通过胃肠环境且发挥其益生作用,因此,乳酸菌在低pH值下生存是保持胃液环境下存活的条件之一[18-19],原始菌株和突变株G10、G16的耐酸性见图2。
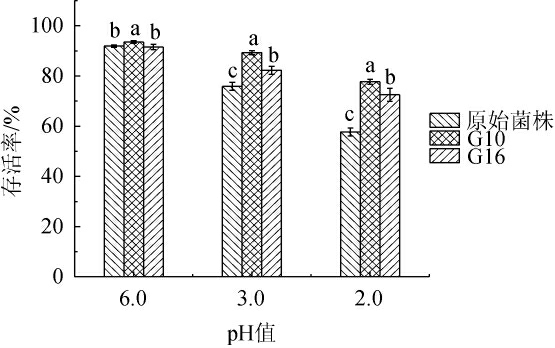
图2 原始菌株与突变株G10和G16的酸耐受性
Fig.2 Acid tolerance of original and mutant strains G10 and G16
由图2可知,在pH值6.0的条件下,3株菌株的存活率均>90%;在pH值2.0和3.0的条件下,突变株G10、G16的存活率均显著高于原始菌株(P<0.05),且突变株G10的存活率显著高于突变株G16(P<0.05)。在pH值3.0时培养3 h后,突变株G10、G16的存活率分别为89.30%、82.32%;在pH值2.0时培养3 h后,突变株G10、G16的存活率分别为77.72%、72.55%。
2.3.2 人工模拟胃肠液的耐受性
耐受胃肠液能力是益生菌筛选的另一个重要指标[20],原始菌株和突变菌株G10、G16的人工模拟胃肠液耐受性见图3。
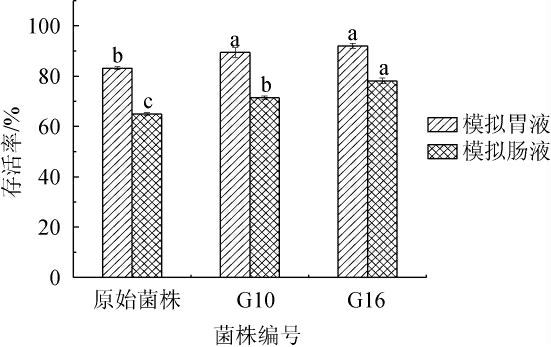
图3 原始菌株与突变株G10和G16的人工模拟胃肠液耐受性
Fig.3 Artificial simulated gastrointestinal fluid tolerance of original and mutant strains G10 and G16
由图3可知,人工模拟胃液处理3 h后,3株菌株的存活率均>80%,且突变株G10、G16的存活率(89.44%和92.02%)均显著高于原始菌株(83.14%)(P<0.05),这与SON S H等[21]研究泡菜中鼠李糖乳杆菌(Lactobacillus rhamonsus)KCTC 12202BP和布氏乳杆菌(Lactobacillus brevis)G1在同等胃液条件下的存活率(81.28%和87.09%)相似。3株菌株再经人工模拟肠液处理4 h后,活菌数呈下降的趋势,原因可能是菌株所形成的初始被膜可能会被胃肠液所含有的胃、胰蛋白酶抑制,同时破坏成熟的被膜,导致抑制菌株生长甚至死亡的情况[22]。原始菌株在经人工模拟肠液处理后存活率仅为64.98%,而突变株G10、G16的存活率均维持在70%以上,分别为71.40%、78.16%,显著高于原始菌株(P<0.05),表明突变株能够以较高的活性在肠液环境下存活,这与何宇星等[23]的研究结果相似。总体而言,经过脉冲强光诱变的突变株G10和G16具有较强的胃肠液耐受性,在发酵食品中具备一定的应用潜力。
2.3.3 耐胆盐性试验
益生菌菌株需要在十二指肠胆盐中存活,以在肠道发挥其有益作用,促进肠道菌群微生态平衡,被认为是益生菌微生物最重要的特性之一[24-25]。原始菌株和突变菌株G10、G16的胆盐耐受性见图4。
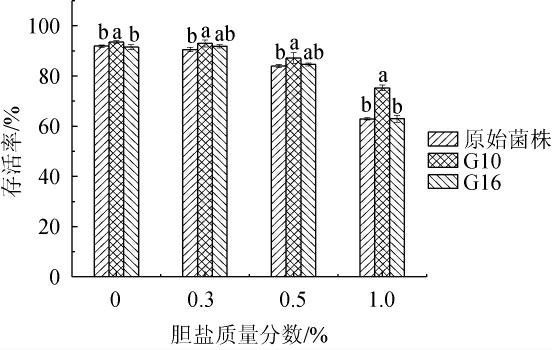
图4 原始菌株与突变株G10和G16的胆盐耐受性
Fig.4 Bile salt tolerance of original and mutant strains G10 and G16
由图4可知,在0.3%、0.5%的胆盐条件下,3株菌株的存活率均>80%,其中突变株G10的存活率最高,分别为92.98%和87.17%,其次为突变株G16,分别为91.85%和84.61%,均高于原始菌株(90.54%和84.00%)。在1.0%的胆盐条件下,突变株G10的存活率(75.32%)显著高于原始菌株(62.94%)(P<0.05),说明其具有良好的胆盐耐受性。
2.3.4 自凝集能力
细菌的自凝集能力是决定细菌对宿主组织粘附程度的一个重要指标[26],原始菌株和突变株G10、G16的自凝集能力见图5。
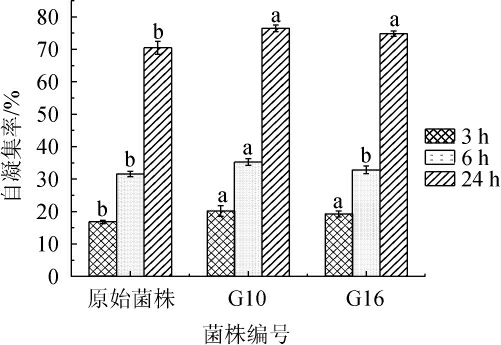
图5 原始菌株与突变株G10和G16的自凝集性
Fig.5 Autoagglutination of original and mutant strains G10 and G16
由图5可知,3株菌株于37℃培养3h后,自凝集率在16%~20%;培养6 h后,自凝集率在30%~35%;培养24 h后,自凝集率在70%~80%。其中,突变株G10在培养24 h时具有最高的自凝集率(76.49%),其次为突变株G16(74.80%),均显著高于原始菌株(70.24%)(P<0.05)。有研究表明,分离出的乳酸菌孵育4 h时的自凝集率在18%~25%,且随着孵育时间愈长,自凝集率越高[27],这与本研究结果一致。
2.3.5 表面疏水性
细胞表面的高疏水性有助于细菌在肠黏膜表面定植,促进细菌与肠上皮细胞的粘附[28]。采用二甲苯(非极性溶剂)、氯仿(单极性,酸性有机溶剂,电子受体)和乙酸乙酯(单极性,碱性有机溶剂,电子供体)检测原始菌株和突变株G10和G16的表面疏水性,结果见图6。
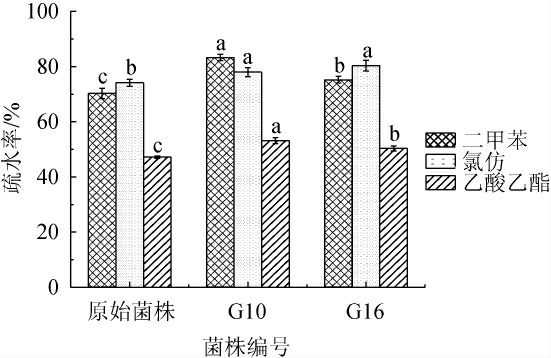
图6 菌株的表面疏水性
Fig.6 Surface hydrophobicity of strains
由图6可知,不同菌株的表面疏水性有显著差异(P<0.05),且突变株G10和G16的疏水性显著高于原始菌株(P<0.05)。原始菌株和突变株G10、G16对二甲苯(70.30%、83.33%、75.26%)和氯仿(74.16%、78.00%、80.36%)的疏水性均高于对乙酸乙酯的疏水性(47.2%、53.16%、50.36%),表明突变株均具备疏水细胞表面,具有强电子供体。综上,突变株G10具有良好的表面疏水性。
3 结论
本研究通过单因素试验及响应面试验确定植物乳杆菌(Lactobacillus plantarum)CICC 6240的最优脉冲强光诱变条件为脉冲电压1 700 V,脉冲次数18次,脉冲距离9 cm。在此条件下对植物乳杆菌CICC 6240进行诱变处理,通过钙透明圈法和乳酸含量测定,筛选得到两株高产乳酸的突变菌株,分别为G10、G16,其乳酸产量分别为76.65 μg/mL和75.48 μg/mL,比原始菌株分别提高58.96%和56.53%。突变株G10及G16在pH2.0的条件下培养3 h后存活率分别为77.72%和72.55%;在人工模拟胃肠液中培养后,突变株G10、G16的存活率分别为71.40%、78.16%;在1.0%胆盐条件下培养3 h后,突变株G10及G16的存活率分别为75.32%、62.96%;突变株G10、G16在培养24 h时自凝集率分别为76.49%、74.80%;突变株具有良好的表面疏水性,尤其是突变株G10,其对二甲苯的疏水率为83.33%,对氯仿的疏水率为78.00%,对乙酸乙酯的疏水率为53.16%,说明脉冲强光诱变处理的突变株具有较强的益生特性。综上,突变株G10为高产乳酸的优良菌株。
[1]MOJAVERI S J,HOSSEINI S F,GHARSALLAOUI A.Viability improvement of Bifidobacterium animalis Bb12 by encapsulation in chitosan/poly(vinyl alcohol)hybrid electrospun fiber mats[J].Carbohyd Polym,2020,241:116278.
[2] GHOSH T, BENIWAL A, SEMWAL A, et al.Mechanistic insights into probiotic properties of lactic acid bacteria associated with ethnic fermented dairy products[J].Front Microbiol,2019,10:502.
[3] DE VRIES M C, VAUGHAN E E, KLEEREBEZEM M, et al. Lactobacillus plantarum-survival,functional and potential probiotic properties in the human intestinal tract[J].Int Dairy J,2006,16(9):1018-1028.
[4]DUARY R K,BATISH V K,GROVER S.Expression of the atpD gene in probiotic Lactobacillus plantarum strains under in vitro acidic conditions using RT-qPCR[J].Res Microbiol,2010,161(5):399-405.
[5]高若珊,王冰,范洪臣,等.酸浆豆腐中产酸菌的耐高温紫外诱变[J].食品科学技术学报,2021,39(1):137-143.
[6]何慧玲.高产酸及耐酸性干酪乳杆菌的诱变筛选及其发酵条件的优化[D].武汉:武汉轻工大学,2017.
[7]殷娜,严小玉,马珊,等.常压室温等离子体诱变选育高产酸植物乳杆菌[J].中国酿造,2020,39(1):77-81.
[8]WANG T,MACGREGOR S J,ANDERSON J G,et al.Pulsed ultra-violet inactivation spectrum of Escherichia coli[J].Water Res, 2005, 39(13):2921-2925.
[9]SLIEMAN T A,NICHOLSON W L.Artificial and solar UV radiation induces strand breaks and cyclobutane pyrimidine dimers in Bacillus subtilis spore DNA[J].Appl Environ Microbiol,2000,66(1):199-205.
[10]陶雨施,张佰清.脉冲强光诱变保加利亚乳杆菌高产胞外多糖[J].食品工业科技,2018,39(10):143-148.
[11]赵天惠,张佰清.耐受性枯草芽孢杆菌的脉冲强光诱变筛选及产酶活力分析[J].食品科学,2018,39(2):192-197.
[12]葛新宇.脉冲强光对果胶酶生产菌黑曲霉的诱变研究[D].沈阳:沈阳农业大学,2020.
[13]彭光华,王璐瑶,涂贻轩,等.复合增强脉冲强光保鲜鲜切荸荠技术研究[J].长江蔬菜,2019,474,(4):72-76.
[14]刘延波,宋艳洁,李海登,等.复合诱变选育耐高温产乙醇酵母菌的研究[J].中国酿造,2022,41(10):55-61.
[15]孙肇敏.脉冲强光诱变谷胱甘肽生产菌酿酒酵母的研究[D].沈阳:沈阳农业大学,2022
[16]殷娜,严小玉,马珊,等.常压室温等离子体诱变选育高产酸植物乳杆菌[J].中国酿造,2020,39(1):77-81.
[17]卢艳丽.酵母发酵麦麸生产乳酸的研究[D].天津:天津科技大学,2018.
[18]刘震坤,陈鲜鑫,任思宇,等.一株鸡源植物乳杆菌益生性能的评价[J].中国饲料,2022(8):21-24.
[19]肖秋颖,王翔宇,陈炼红.川西高原传统发酵牦牛酸乳中高产γ-氨基丁酸乳酸菌筛选及鉴定[J].食品工业科技,2021,42(6):111-117.
[20] JANG H J, NA-KYOUNG L, PAIK H D.Probiotic characterization of Lactobacillus brevis KU15153 showing antimicrobial and antioxidant effect isolated from kimchi[J].Food Sci Biotechnol,2019,28(5):1521-1528.
[21]SON S H,JEON H L,JEON E B,et al.Potential probiotic Lactobacillus plantarum Ln4 from kimchi:Evaluation of β-galactosidase and antioxidant activities[J].LWT-Food Sci Technol,2017,85:181-186.
[22] PATEL A K, AHIRE J J, PAWAR S P, et al.Evaluation of probiotic characteristics of siderophoregenic Bacillus spp.isolated from dairy waste[J].Appl Biochem Biotech,2010,160:140-155.
[23]何宇星,其其日力格,刘玮,等.潜在益生作用乳酸菌的筛选鉴定及其生物学特性[J].现代食品科技,2021,37(11):50-57.
[24]ABDULLAH-AL-MAMUN M,HASAN M J,AZAD S A,et al.Evaluation of potential probiotic characteristics of isolated lactic acid bacteria from goat milk[J].Biotechnol J Int,2016,14(2):1-7.
[25] WANG Y, SUN Y, ZHANG X, et al.Bacteriocin-producing probiotics enhance the safety and functionality of sturgeon sausage[J].Food Control,2015,50:729-735.
[26]杨珍珠,潘秭琪,迟海,等.羊奶源产细菌素乳酸菌筛选、鉴定及益生特性研究[J].中国食品学报,2021,21(11):71-77.
[27]FATIMA A,TARIQUE M,OSAILI T,et al.Lactic acid bacteria isolated from fresh vegetable products: potential probiotic and postbiotic characteristics including immunomodulatory effects[J].Microorganisms,2022,10(2):389.
[28]AHIRE J J,PATIL K P,CHAUDHARI B L,et al.A potential probiotic culture ST2 produces siderophore 2,3-dihydroxybenzoylserine under intestinal conditions[J].Food Chem,2011,127(2):387-393.