白酒作为世界三大蒸馏酒之一,在我国有着广泛的消费,2019年在我国食品工业主营收入中白酒产业占6.92%的份额[1]。作为我国的传统酒类,同时又是传统文化的典型代表,多年来有关白酒的风味研究从未停止[2]。然而随着人民生活水平的不断提高,健康饮食的观念不断深入人心,饮酒的健康效应也逐渐受到研究人员的关注。
糖尿病作为一个世界性的公共卫生问题,目前已被认为是仅次于恶性肿瘤和心脑血管疾病的第三大威胁人类健康的疾病[3]。有研究显示,一定量的啤酒、葡萄酒、烈性酒摄入对于2型糖尿病(type 2 diabetes mellitus,T2DM)病症有一定的缓解作用[4]。国内外均有流行病学研究表明,饮酒量和T2DM患病风险之间呈U型关系[5-7]。已有研究显示,在较低的酒精摄入剂量下(10 g/d),饮酒会降低T2DM患病风险,而当酒精摄入量超过10 g/d后,T2DM患病风险会随着摄入量的增大而升高,提示10 g/d的酒精摄入剂量可能是饮酒与T2DM之间U型关系的剂量拐点[8]。而本团队的前期研究发现,按人群10 g/d的酒精摄入剂量与小鼠给药剂量进行等效换算,对小鼠进行低剂量的酒精摄入会加重T2DM雄性小鼠的病症[9]。
本文的前期研究结果已经说明单纯的酒精摄入可对T2DM产生影响,而单纯的酒精摄入并不能完全等同于饮酒。酒类中除了水和酒精以外还有很多其他成分,白酒中的微量成分超过2 000种,其中有200多种成分已被证明对健康有益[10-11]。由于原料及生产工艺条件的不同,使得不同香型白酒的风味成分也存在着显著差异。又鉴于饮酒与T2DM发生在流行病学研究中体现出的U型相关性,因此进一步探究不同香型白酒摄入尤其是低剂量不同香型白酒摄入对于T2DM的影响,对于未来阐明饮酒于T2DM发生之间的关系则显得尤为重要。
为更好的了解低剂量摄入不同香型白酒对T2DM的影响,本研究对T2DM小鼠进行不同香型白酒(52度浓香型、52度清香型、53度酱香型)连续30 d灌胃,随后对小鼠T2DM相关指标进行检测,并对小鼠肝脏、胰腺组织病理学损伤和胰腺氧化应激、炎症水平进行分析,以期为未来阐明低剂量摄入不同香型白酒对T2DM的影响提供一定的参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验小鼠
无特定病原体(specific pathogen free,SPF)级雄性昆明小鼠(6~8周龄,体质量(20±2)g):湖北省疾病预防控制中心实验动物研究中心。小鼠饲养于标准实验动物房内,鼠笼内通入无菌空气,室温20~25 ℃,相对湿度50%~70%,12 h/12 h明暗交替,自由进食饮水。
1.1.2 试剂
高脂高糖饲料:上海集奇生物科技有限公司;链脲佐菌素(streptozotocin,STZ)、2',7'-二氯荧光黄双乙酸盐(2',7'-dichlordihydrofluorescein diacetate,DCFH-DA)、硫代巴比妥酸(2-thiobarbituric acid,TBA)(均为分析纯):美国Sigma-Aldrich公司。其他试剂均为国产分析纯。
小鼠总胆固醇(total cholesterol,TC)检测试剂盒、甘油三酯(triglyceride,TG)检测试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)检测试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)检测试剂盒、还原型谷胱甘肽(glutathione,GSH)检测试剂盒、胰岛素检测试剂盒:南京建成生物工程研究所。
小鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测试剂盒、白介素1β(Interleukin-1β,IL-1β)检测试剂盒:美国eBioscience公司;核因子NF-κB(nuclear factor-κB,NF-κB)检测试剂盒:上海蓝基生物公司。
1.1.3 原料
52度某品牌浓香型白酒、52度某品牌清香型白酒、53度某品牌酱香型白酒均为市售成品白酒。
1.2 仪器与设备
590血糖仪及试纸:江苏鱼跃医疗设备有限公司;FLx800荧光酶标仪:美国Bio-Tek公司;DNM-9602全波长酶标仪:北京普朗新技术有限公司;5424R低温冷冻离心机:德国Eppendorf公司;DP73显微镜:日本Olympus公司。
1.3 方法
1.3.1 T2DM模型的构建
在动物房内对小鼠进行一周的基础饲料适应性喂养后,随机选取10只小鼠继续进行基础饲料喂养,剩余小鼠更换高脂高糖饲料喂养。参照文献[9,12]的方法利用高脂高糖饲料喂养结合STZ腹腔注射方式进行小鼠T2DM模型构建,以小鼠的空腹血糖(fasting blood glucose,FBG)>11.1 mol/L视为建模成功。随机选择建模成功的小鼠40只进行实验。
1.3.2 实验动物分组及饮酒暴露
将实验动物按表1分为5组,参照文献[9,13]的方法,以10 g/d的纯酒精摄入量作为人群低剂量饮酒标准,进行人与小鼠等效给药剂量换算后得出52度浓香型白酒、52度清香型白酒、53度酱香型白酒的小鼠日灌胃剂量分别为3.17 mL/kg、3.17 mL/kg、3.11 mL/kg,连续灌胃30 d。
表1 实验动物分组与处理
Table 1 Grouping and treatment of animals
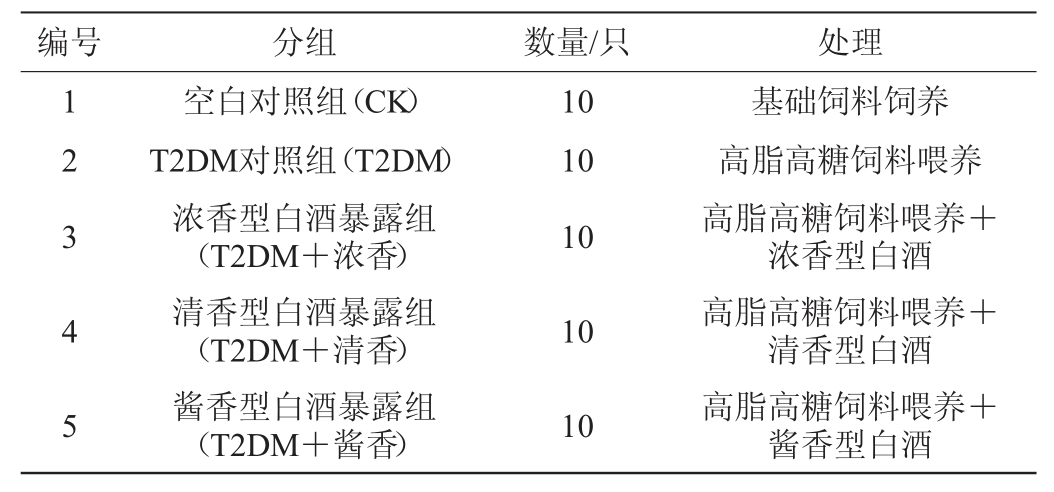
编号 分组 数量/只 处理1 2 3 4 5空白对照组(CK)T2DM对照组(T2DM)浓香型白酒暴露组(T2DM+浓香)清香型白酒暴露组(T2DM+清香)酱香型白酒暴露组(T2DM+酱香)10 10 10 10 10基础饲料饲养高脂高糖饲料喂养高脂高糖饲料喂养+浓香型白酒高脂高糖饲料喂养+清香型白酒高脂高糖饲料喂养+酱香型白酒
1.3.3 小鼠体质量增长量及饮食饮水量的测定
参照文献[9,14],在实验期间每天记录小鼠的体质量及饮食饮水量,计算小鼠30 d的体质量增长量和饮食饮水量。
1.3.4 小鼠空腹血糖及糖耐量的测定
参照文献[15]的方法,在最后一次灌胃暴露后,对小鼠进行禁食不禁水12 h,随后对小鼠的空腹血糖、口服糖耐量和血糖曲线下面积(area under the curve of blood glucose,AUC)进行测定。
1.3.5 小鼠血脂指标及胰岛素含量的测定
最后一次灌胃暴露24 h后,参照试剂盒说明书对小鼠血清中TC、TG、LDL-C、HDL-C及胰岛素含量进行测定。
1.3.6 小鼠肝脏和胰腺组织病理学观察
最后一次酒精暴露结束24 h后,用颈椎脱臼法处死小鼠,取小鼠胰腺组织和肝组织。参照文献[9]的方法对小鼠肝脏和胰腺组织进行石蜡包埋和切片后,进行苏木素-伊红(hematoxylin and eosin,H&E)染色,随后在显微镜下进行切片观察。
1.3.7 小鼠胰腺组织样品制备及氧化应激、炎症指标测定
参照文献[16]的方法对小鼠胰腺组织样品进行组织匀浆制备,采用DCFH-DA法检测活性氧(reactive oxygen species,ROS)相对表达量,使用相对荧光强度进行衡量[17]。使用TBA法测定小鼠胰腺组织匀浆上清液中的丙二醛(malondialdehyde,MDA)含量[17]。按试剂盒说明书测定小鼠胰腺组织匀浆上清液中的GSH、NF-κB、TNF-α、IL-1β含量。
1.3.8 数据处理
采用SPSS 13.0对数据进行单因素方差分析(analysis of variance,ANOVA)结合Duncan检验分析差异性,差异显著水平是P<0.05,使用GraphPad Prism 8.0生成数据统计图。
2 结果与分析
2.1 不同香型白酒对T2DM小鼠体质量、饮食量、饮水量的影响
各组小鼠灌胃30 d后的体质量、饮食量、饮水量变化结果见表2。
表2 各组小鼠体质量、饮食量、饮水量
Table 2 Bodyweight, food and water intake of mice in each group
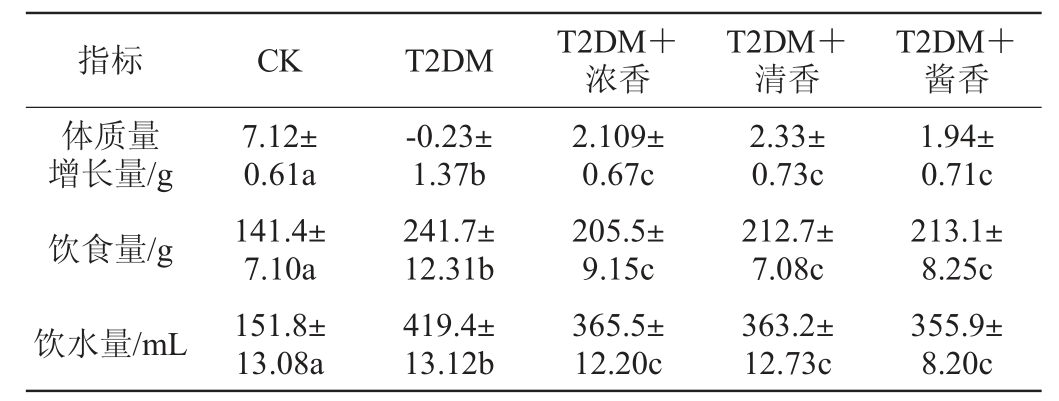
注:小写字母不同表示差异显著(P<0.05)。下同。
指标 CK T2DM T2DM+浓香T2DM+清香T2DM+酱香体质量增长量/g饮食量/g饮水量/mL 7.12±0.61a 141.4±7.10a 151.8±13.08a-0.23±1.37b 241.7±12.31b 419.4±13.12b 2.109±0.67c 205.5±9.15c 365.5±12.20c 2.33±0.73c 212.7±7.08c 363.2±12.73c 1.94±0.71c 213.1±8.25c 355.9±8.20c
由表2可知,灌胃30 d后只有T2DM组小鼠体质量出现了下降,而低剂量摄入不同香型白酒的T2DM小鼠体质量均出现了少量的增加,但增长量依然显著低于CK组小鼠(P<0.05)。饮食量和饮水量的结果显示,T2DM组小鼠的饮食量和饮水量均显著高于CK组小鼠(P<0.05),而低剂量摄入不同香型白酒的T2DM小鼠的饮食量和饮水量与T2DM组小鼠比出现了一定的下降,但依然显著高于CK组小鼠(P<0.05)。不同香型白酒对T2DM小鼠在体质量增长量、饮食量、饮水量的影响并未出现显著性的差异(P>0.05)。
“三多一少”为糖尿病的典型症状,以上结果显示,建模后T2DM组小鼠出现了饮食多、饮水多,但体质量减少的糖尿病典型症状,而低剂量摄入不同香型白酒后可以缓解T2DM小鼠体质量下降、进食和饮水量增加的症状,该结果与周振宇等[3]的研究结果一致,但与CK组小鼠相比饮酒组小鼠的高摄食量、高饮水量、低体质量的糖尿病症状依然明显,而不同香型白酒对于T2DM小鼠在以上指标上并未体现出差异性的影响(P>0.05)。说明低剂量摄入白酒对于T2DM小鼠“三多一少”症状有所改善,但改善程度有限。
2.2 不同香型白酒对T2DM小鼠空腹血糖的影响
空腹血糖(FBG)是判断糖尿病的主要依据,按糖尿病诊断标准,FBG高于11.1 mmol/L则可被视为血糖超标[18]。不同香型白酒对T2DM小鼠FBG的影响结果见图1。由图1可知,30 d后CK组小鼠FBG处于正常值范围,而T2DM组小鼠FBG已远超建模标准,小鼠FBG的异常升高符合T2DM典型症状。与T2DM组小鼠相比,各低剂量白酒摄入组小鼠FBG虽然出现了小幅度的下降,但是依然显著高于CK组(P<0.05),同时也高于建模标准。结果显示,低剂量摄入不同香型白酒可以降低T2DM小鼠的FBG,该结果与周振宇等[3,19]的研究结果类似,可能与低剂量摄入白酒提高了小鼠胰岛素分泌量或降低了小鼠胰岛素抵抗有关。但是降低程度有限,各组小鼠FBG异常升高的症状依然明显。而不同香型白酒对T2DM小鼠FBG降低的程度并无显著性差异(P>0.05)。说明低剂量摄入白酒可缓解T2DM小鼠FBG异常升高,但缓解程度有限。
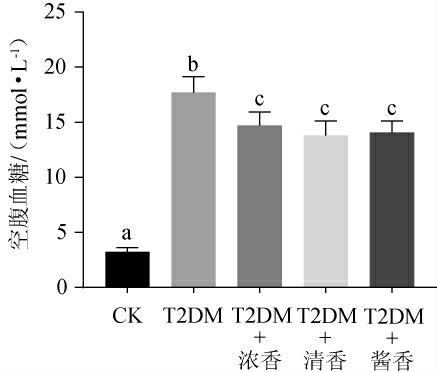
图1 各组小鼠空腹血糖测定结果
Fig.1 Determination results of fasting blood glucose of mice in each group
2.3 不同香型白酒对T2DM小鼠口服糖耐量的影响
糖耐量是机体对血糖的调节能力,当机体大量摄入葡萄糖后会快速分泌胰岛素、合成肝糖原促使体内血糖下降,如胰腺组织无法快速做出反应,那么葡萄糖摄入2 h后都无法回正常值[20]。不同香型白酒对T2DM小鼠血糖浓度变化的影响见图2。由图2可知,CK组小鼠的血糖浓度在灌胃葡萄糖0.5 h后内出现了升高,随后开始出现下降,2 h后已经恢复到原水平。而T2DM组小鼠的血糖浓度则在1 h内持续升高,2 h后虽出现下降,但与原水平相比依然有显著升高(P<0.05)。而低剂量摄入不同香型白酒的T2DM小鼠血糖浓度变化趋势与CK组小鼠类似,2 h后血糖浓度与原水平相比虽然有升高,但升高的程度小于T2DM组小鼠。说明T2DM小鼠对于血糖的调节能力出现了改变,胰腺组织无法快速执行降低血糖的功能糖耐量出现了异常。而低剂量摄入不同香型白酒后可能通过改善胰腺功能,提高胰岛素表达加快降低血糖浓度的速率,对T2DM小鼠糖耐量异常的改善有一定的作用,但是改善作用有限,小鼠依然存在糖耐量异常。
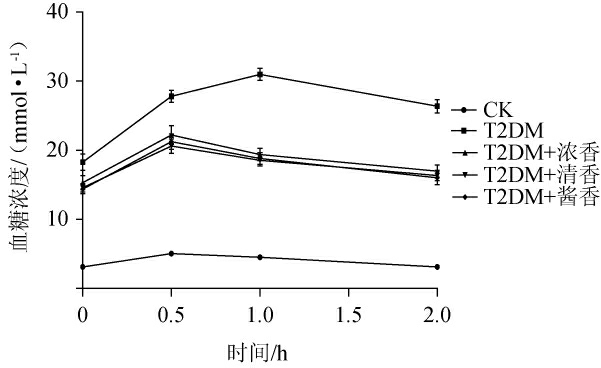
图2 各组小鼠血糖浓度测定结果
Fig.2 Determination results of blood glucose concentration of mice in each group
糖耐量曲线下面积可以用来衡量物质改善机体糖耐量异常的能力[21],不同香型白酒对T2DM小鼠口服糖耐量曲线下面积的影响见图3。
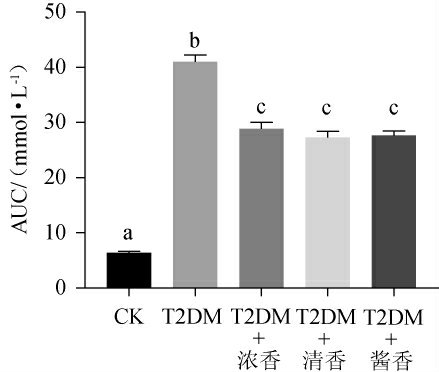
图3 各组小鼠血糖曲线下面积测定结果
Fig.3 Determination results of blood glucose curve area of mice in each group
由图3可知,与CK组小鼠相比,T2DM组小鼠AUC显著性的升高(P<0.05)。低剂量摄入不同香型白酒后使T2DM小鼠的AUC出现了一定程度的下降,但依然显著性高于CK组小鼠(P<0.05),且不同香型白酒对T2DM小鼠AUC的影响并未呈现出差异性。说明低剂量摄入不同香型白酒对T2DM小鼠AUC的异常有一定的改善作用,但程度有限,而不同香型白酒组AUC之间差异不显著(P>0.05),说明不同香型白酒T2DM小鼠糖耐量的改善能力无差异。
2.4 不同香型白酒对T2DM小鼠脂代谢相关指标的影响
T2DM通常伴有不同程度的脂代谢紊乱,主要体现在TC、TG、LDL-C含量的升高以及HDL-C含量的下降,血脂含量的异常已经被证明是引起胰岛素分泌异常、胰岛素受体抵抗的原因之一[22]。各组小鼠灌胃30 d后TC、TG、LDL-C、HDL-C的检测结果见表3。由表3可知,T2DM组小鼠血清TC含量较CK组小鼠出现了显著升高(P<0.05),而低剂量摄入不同香型白酒使得T2DM小鼠血清TC含量出现了一定下降,但是依然显著高于CK组小鼠(P<0.05),且饮用不同香型白酒之间并未出现显著差异(P>0.05)。各组小鼠血清TG和LDL-C含量的变化情况与TC类似。HDL-C含量检测结果显示,T2DM组小鼠血清HDL-C含量出现了显著下降(P<0.05),而低剂量摄入不同香型白酒使得T2DM小鼠血清HDL-C出现了一定升高,但依然显著低于CK组小鼠(P<0.05)。该研究结果与陈欣怡等[23]的研究结果类似,可能是由于低剂量饮用白酒会改善了高脂高糖饮食导致的肠道菌群失衡,促进了机体脂代谢稳定。而不同香型白酒之间无显著性差异(P>0.05)。说明低剂量摄入不同香型白酒对T2DM脂代谢紊乱有一定的调节作用,但作用程度有限且无香型差异。
表3 各组小鼠总胆固醇、甘油三酯、低密度脂蛋白胆固醇及高密度脂蛋白胆固醇含量
Table 3 Contents of total cholesterol, triglyceride, low density lipoprotein cholesterol, high density lipoprotein cholesterol of mice in each group mmol/L
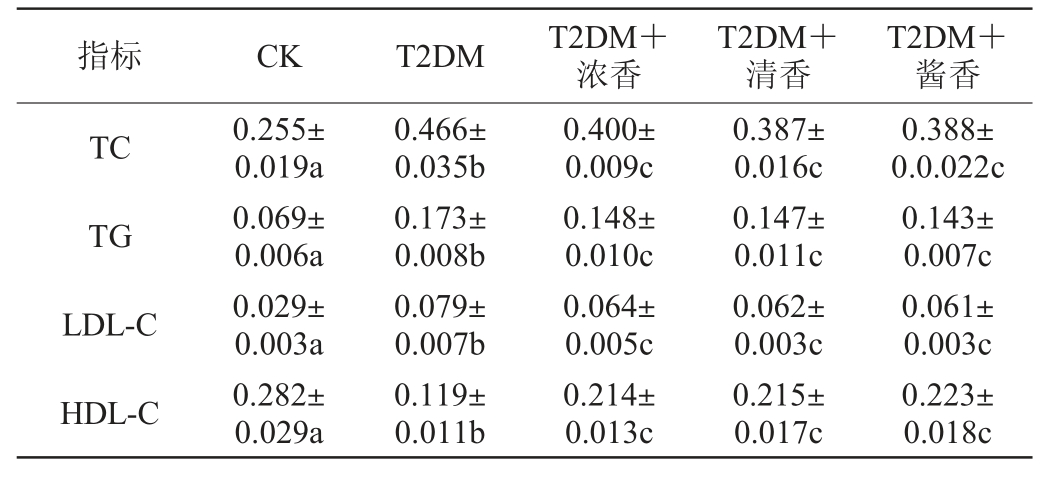
指标 CK T2DM T2DM+浓香T2DM+酱香TC TG T2DM+清香0.388±0.0.022c 0.143±0.007c LDL-C HDL-C 0.255±0.019a 0.069±0.006a 0.466±0.035b 0.173±0.008b 0.400±0.009c 0.148±0.010c 0.387±0.016c 0.147±0.011c 0.029±0.003a 0.282±0.029a 0.079±0.007b 0.119±0.011b 0.064±0.005c 0.214±0.013c 0.062±0.003c 0.215±0.017c 0.061±0.003c 0.223±0.018c
2.5 不同香型白酒对T2DM小鼠肝组织和胰腺组织的影响
胰岛组织结构功能异常是糖尿病发生的主要原因之一,而肝脏也在糖尿病的发生过程中起着重要的作用,如葡萄糖激酶的标达、肝糖原的合成、脂代谢的调节等[24]。不同香型白酒对T2DM小鼠肝组织和胰腺组织的影响结果见图4。
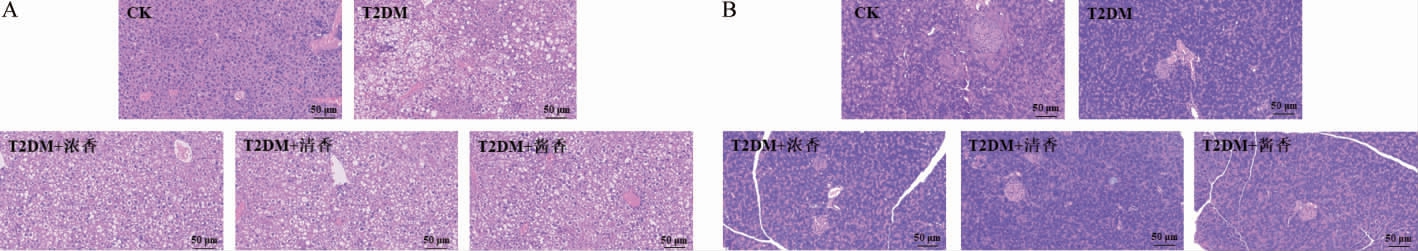
图4 各组小鼠肝组织(A)和胰腺组织(B)细胞形态
Fig.4 Cell morphology of mice lives tissue (A) and pancreas (B) in each group
由图4A可知,CK组小鼠肝脏细胞形态正常,未见脂肪性病变和明显的肿胀或萎缩。T2DM组小鼠肝脏胞体变大,细胞出现明显的脂肪性病变,细胞大面积集中出现胞质稀疏,胞质内出现大量空泡,结构明显异常。低剂量摄入不同香型白酒后各组小鼠肝脏细胞胞质稀疏和空泡样变化虽仍然显著,但是和T2DM组相比,未见大面积集中性的细胞损伤。说明低剂量摄入不同香型白酒可以缓解T2DM小鼠肝脏损伤,但是缓解程度有限,肝脏损伤依然显著存在。
由图4B可知,CK组小鼠胰腺组织中胰岛和胰岛外周细胞规则、完整,胰岛呈清晰的圆形或椭圆形,胰岛边缘明显,胰岛大小正常,胰岛内细胞分布均匀。T2DM组小鼠胰岛呈不规则形态,内部细胞稀疏、不均匀,胰岛边缘不整。低剂量摄入不同香型白酒后各组小鼠胰岛不规则和边缘不整的情况有所缓解,可见圆形或椭圆形胰岛,但胰岛内部细胞稀少,胰岛形态明显小于CK组,存在一定的萎缩。说明低剂量摄入不同香型白酒后T2DM小鼠胰岛病变有一定的缓解,但胰岛内细胞稀少和胰岛萎缩依然明显。
综上,低剂量饮用白酒可以对于T2DM小鼠肝脏和胰腺的结构异常有一定的改善作用,但是作用程度有限。
2.5 不同香型白酒对T2DM小鼠胰岛素水平的影响
不同香型白酒对T2DM小鼠胰岛素水平的影响结果见图5。
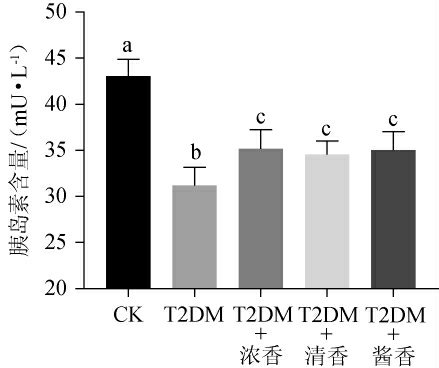
图5 各组小鼠胰岛素水平测定结果
Fig.5 Determination results of insulin levels of mice in each group
由图5可知,与CK组小鼠相比,T2DM小鼠胰岛素水平出现了显著下降(P<0.05),而摄入不同香型白酒使T2DM小鼠胰岛素水平显著上升(P<0.05),但依然显著低于CK组小鼠(P<0.05),且摄入不同香型白酒之间并未出现显著差异。说明低剂量摄入不同香型白酒有促进胰岛素分泌的作用,进而可以缓解T2DM小鼠胰岛素水平下降,结果与前期相关研究报道结果相符,可能与低剂量白酒摄入增加了胰岛组织血流量有关[25]。但调节程度有限,T2DM小鼠胰岛素水平依然显著低于CK组(P<0.05)。
2.6 不同香型白酒对T2DM小鼠胰腺组织氧化应激水平的影响
胰腺组织氧化应激已被证明和T2DM的发生发展有着密切的联系[26],本团队前期研究也证明T2DM小鼠胰腺组织氧化应激水平升高,且摄入纯酒精后氧化应激水平会进一步提高[9]。但白酒与酒精不同,白酒中酚类物质、部分醛类和多肽类等物质都具有一定的抗氧化作用[27-28],由于不同香型白酒的组成存在差异,所以对自由基的清除能力也可能不同。各组小鼠胰腺组织氧化应激水平的变化见表4。
表4 各组小鼠胰腺组织活性氧、丙二醛及还原型谷胱甘肽水平
Table 4 Reactive oxygen species, malondialdehyde and glutathione levels of mice in each group
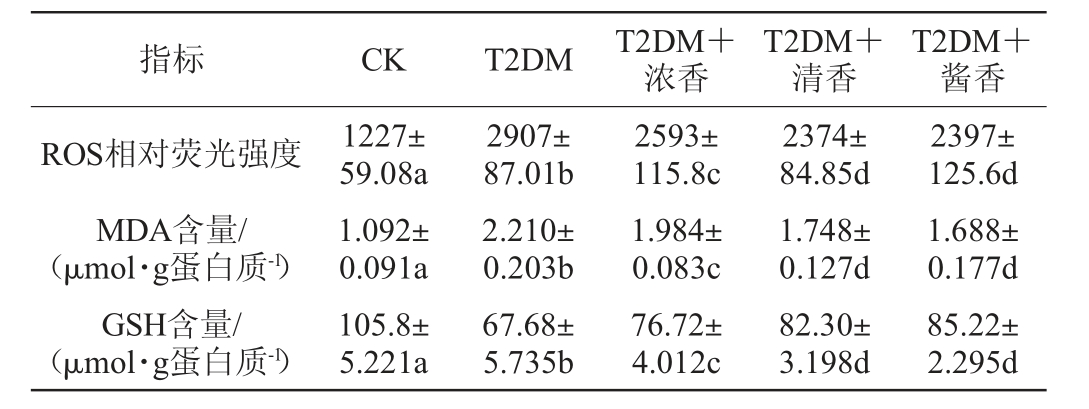
指标 CK T2DM T2DM+浓香T2DM+清香T2DM+酱香2397±125.6d 1.688±0.177d GSH含量/(μmol·g蛋白质-1)ROS相对荧光强度MDA含量/(μmol·g蛋白质-1)1227±59.08a 1.092±0.091a 2907±87.01b 2.210±0.203b 2593±115.8c 1.984±0.083c 2374±84.85d 1.748±0.127d 105.8±5.221a 67.68±5.735b 76.72±4.012c 82.30±3.198d 85.22±2.295d
由表4可知,与CK组小鼠相比,T2DM小鼠胰腺组织ROS表达量和脂质过氧化物MDA的含量均出现了显著升高(P<0.05)。低剂量摄入不同香型白酒使ROS表达量和MDA含量均出现了不同程度的下降,但下降程度有限,依然显著高于CK组小鼠(P<0.05)。而摄入不同香型白酒之间出现了差异性,摄入清香型和酱香型白酒后T2DM小鼠ROS表达量和MDA含量的下降程度要大于浓香型白酒。小鼠胰腺组织GSH含量检测结果显示,与CK组小鼠相比,T2DM小鼠胰腺组织GSH含量出现了显著下降(P<0.05),低剂量摄入不同香型白酒使GSH含量出现了一定的回升,但回升程度有限,依然显著低于CK组小鼠(P<0.05)。同时摄入不同香型白酒之间也出现了差异性,摄入清香型和酱香型白酒后T2DM小鼠GSH含量的上升程度要大于浓香型白酒。白酒中富含的抗氧化物质以及不同香型白酒风味物质类型的不同,可能是导致上述结果的原因。
以上结果说明低剂量摄入不同香型白酒对T2DM小鼠胰腺组织氧化应激有一定的调节作用,但调节程度有限,T2DM小鼠胰腺氧化应激依然显著。而在本研究中清香型和酱香型白酒抗T2DM小鼠胰腺氧化的作用要略大于浓香型白酒。已有研究表明,不同香型白酒均具有一定的自由基清除能力,且清除能力强弱依次为清香、酱香、芝麻香、老白干香、浓香[29]。而本研究的结果也提示清香型和酱香型白酒抗T2DM小鼠胰腺组织氧化应激的能力略大于浓香型白酒。但不同香型白酒抗氧化性的差异并未体现在对T2DM糖脂代谢紊乱的调节作用中,可能是因为虽然不同香型白酒均可下调T2DM小鼠胰腺组织氧化应激水平,但是调节程度有限,调整后饮酒组小鼠胰腺氧化应激仍处于很高的水平,依然导致了小鼠肝脏和胰腺功能的异常,所以不同香型白酒抗氧化性的差异并未体现在对T2DM糖脂代谢功能紊乱的调节上。
2.7 不同香型白酒对T2DM小鼠胰腺组织炎症水平的影响
根据氧化应激分级模型,细胞中持续高水平的氧化应激会活化炎症信号通路,相关转录因子被激活,炎症因子表达上调诱导炎症反应[30]。白酒的抗炎作用研究发现,白酒有机萃取物具有抗炎作用[31]。各组小鼠胰腺组织炎症水平的变化结果见表5。
表5 各组小鼠胰腺组织的NF-κB、TNF-α和IL-1β水平
Table 5 NF-κB, TNF-α and IL-1β levels of pancreatic tissue of mice in each group
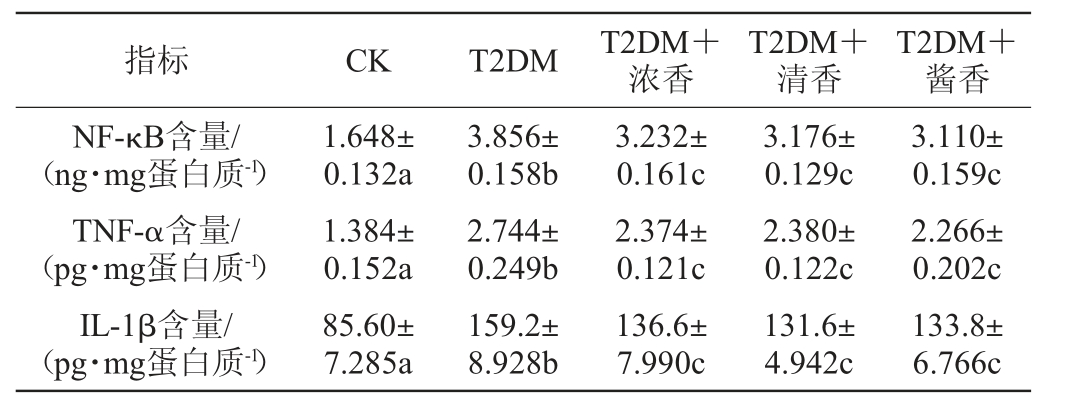
指标 CK T2DM T2DM+浓香T2DM+清香T2DM+酱香3.110±0.159c 2.266±0.202c IL-1β含量/(pg·mg蛋白质-1)NF-κB含量/(ng·mg蛋白质-1)TNF-α含量/(pg·mg蛋白质-1)1.648±0.132a 1.384±0.152a 3.856±0.158b 2.744±0.249b 3.232±0.161c 2.374±0.121c 3.176±0.129c 2.380±0.122c 85.60±7.285a 159.2±8.928b 136.6±7.990c 131.6±4.942c 133.8±6.766c
由表5可知,与CK组小鼠相比T2DM小鼠胰腺组织转录因子NF-κB及其调控转录的主要炎症因子TNF-α和IL-1β[32-33]的含量均显著升高(P<0.05),而低剂量摄入不同香型白酒对NF-κB、TNF-α和IL-1β的升高有调节作用,但是调节程度有限,T2DM小鼠胰腺组织中NF-κB、TNF-α和IL-1β的表达量仍然显著高于CK组小鼠(P<0.05),且摄入不同香型白酒差异不显著(P>0.05)。说明低剂量摄入白酒对缓解T2DM小鼠胰腺组织炎症水平有一定的作用,但缓解程度有限,且不同香型白酒的作用无差异。
结合2.6的结果,不同香型的白酒可能是通过降低T2DM小鼠胰腺组织氧化应激水平进而达到缓解胰腺组织炎症水平的作用。但在调节胰腺组织氧化应激水平的作用上不同香型白酒体现出了一定的差异性,而在调节炎症水平上并未显示出差异,可能是由于低剂量摄入不同香型白酒后T2DM小鼠胰腺组织氧化应激水平虽有不同水平下降,但是均仍然处于高水平的氧化应激状态,均可以促进高水平炎症反应的发生。因此在本研究中,低剂量摄入不同香型白酒对T2DM小鼠胰腺组织炎症水平的调节并未显示出差异性。
3 结论
建模后T2DM小鼠糖脂代谢紊乱,胰岛素水平下降,肝脏及胰腺组织出现明显损伤,胰腺组织氧化应激和炎症水平上调。而低剂量摄入不同香型白酒,对T2DM小鼠出现的异常均体现出了一定的调节作用,但是调节程度有限,各组小鼠T2DM相关症状和损伤依然显著存在。降低T2DM小鼠胰腺组织氧化应激和炎症水平可能是低剂量摄入不同香型白酒对T2DM小鼠产生调节作用的主要机制之一。低剂量摄入不同香型白酒对T2DM小鼠的调节作用只在调节小鼠胰腺组织氧化应激水平上体现出了一定的差异,而这种差异对于T2DM小鼠胰腺组织炎症水平及T2DM相关病症并未产生影响。后续研究中,可考虑分析不同香型白酒主要差异成分对T2DM的作用,进一步为阐明不同香型白酒对于T2DM的影响提供参考。
[1]工业和信息化部消费品工业司.食品工业发展报告(2019年度报告)[M].北京:中国轻工业出版社,2020:3-4,81-83.
[2]孙宝国,黄明泉,王娟.白酒风味化学与健康功效研究进展[J].中国食品学报,2021,21(5):1-3.
[3]周振宇,沈才洪,卢中明,等.低氘白酒对糖尿病大鼠糖代谢和胰岛细胞及其功能的影响[J].上海交通大学学报(医学版),2010,30(10):1204-1207.
[4]NEUENSCHWANDER M,BALLON A,WEBER K S,et al.Role of diet in type 2 diabetes incidence:Umbrella review of meta-analyses of prospective observational studies[J].BMJ,2019,365:l2368.
[5]KOPPES L L J,DEKKER J M,HENDRIKS H F J,et al.Moderate alcohol consumption lowers the risk of type 2 diabetes[J].Diabetes Care,2005,28(3):719-725.
[6]BI Y,WANG T,XU M,et al.Advanced research on risk factors of type 2 diabetes[J].Diabetes Metab Res Rev,2012,28(2):32-39.
[7]马笑堑,王庆祝,宁光,等.血清肝酶水平联合乙醇摄入量预测2型糖尿病发病的价值[J].中华肝脏病杂志,2015,23(1):55-58.
[8]GBD 2016 ALCOHOL COLLABORATORS.Alcohol use and burden for 195 countries and territories, 1990-2016: a systematic analysis for the global burden of disease study 2016[J].Lancet,2018,5(12):978-1012.
[9]张玉超,张智淮,刘良禹,等.低剂量酒精摄入对不同性别2型糖尿病小鼠的影响[J].中国酿造,2022,41(9):43-48.
[10]霍嘉颖,黄明泉,孙宝国,等.中国白酒中功能因子研究进展[J].酿酒科技,2017(9):17-23.
[11]徐岩,范文来,葛向阳,等.科学认识中国白酒中的生物活性成分[J].酿酒科技,2013(9):1-6.
[12]陈小敏,谭书明,黄颖,等.刺梨、桑叶、苦瓜饮料对糖尿病小鼠的降糖作用[J].中国酿造,2019,38(6):123-127.
[13]李才.人类疾病动物模型的复制[M].北京:人民卫生出版社,2018:60-62.
[14]陈超,谭书明,王画,等.刺梨及其活性成分对2型糖尿病小鼠糖脂代谢的影响[J].食品科学,2022,43(13):146-154.
[15]陆敏涛,任廷远,杨建,等.花椒精油对链脲佐菌素诱导的糖尿病小鼠糖代谢的影响[J].食品科学,2021,42(9):115-122.
[16] LIU X D, ZHANG Y C, YANG X.Vitamin E reduces the extent of mouse brain damage induced by combined exposure to formaldehyde and PM2.5[J].Ecotox Environ Safe,2019,172:33-39.
[17] GE S Z, YAN B, HUANG J W, et al.Diisodecyl phthalate aggravates the formaldehyde-exposure-induced learning and memory impairment in mice[J].Food Chem Toxicol,2019,126:152-161.
[18]向红丁.糖尿病的流行病学、诊断分型及防治原则[J].继续医学教育,2005(1):28-29.
[19]李容瑢,梁文妹,夏白娟,等.Glu在适量饮用贵州某食用白酒1型糖尿病小鼠表达的变化[J].酿酒科技,2018(3):31-37.
[20]王香丹,杨丽,高怀林.糖耐量异常的中西医药物治疗研究进展[J].疑难病杂志,2021,20(2):207-211.
[21]张建华,李章平,陈芳,等.口服葡萄糖耐量试验曲线下面积在妊娠期糖尿病中的应用[J].内科急危重症杂志,2017,23(5):375-378.
[22]李晓冰,裴兰英,陈玉龙,等.山药多糖对链脲菌素糖尿病大鼠脂代谢及氧化应激的影响[J].中国老年学杂志,2014,34(2):420-422.
[23]陈欣怡,丁子元,刘永泉,等.馥郁香型白酒对高脂饮食小鼠脂代谢及肠道菌群的影响[J].中国酿造,2021,40(8):59-64.
[24]曹宏伟,姬秋和.葡萄糖激酶调控血糖稳态的主要方式—调控激素分泌和肝糖原合成[J].中华糖尿病杂志,2020,12(7):539-542.
[25] HUANG Z, SJÖHOLM A.Ethanol acutely stimulates islet blood flow,amplifies insulin secretion, and induces hypoglycemia via nitric oxide and vagally mediated mechanisms[J].Endocrinology,2008,149(1):232-236.
[26] YARIBEYGI H, SATHYAPALAN T, ATKIN S L, et al.Molecular mechanisms linking oxidative stress and diabetes mellitus[J].Oxid Med Cell Longev,2020,2020:8609213.
[27]WU J H, HUO J Y, HUANG M Q, et al.Structural characterization of a tetrapeptide from Sesame flavor-type Baijiu and its preventive effects against AAPH-induced oxidative stress in HepG2 cells[J].J Agr Food Chem,2017,65(48):10495-10504.
[28]张明珠,吴学凤,穆冬冬,等.不同香型白酒的风味物质及抗氧化作用分析[J].食品工业科技,2021,42(11):218-225.
[29]石亚林,范文来,徐岩.白酒抗氧化性的初步研究[J].食品工业科技,2015,36(2):95-97.
[30]XIAO G G,WANG M Y,LI N,et al.Use of proteomics to demonstrate a hierarchical oxidative stress response to diesel exhaust particle chemicals in a macrophage cell line[J].J Biol Chem,2003,278(50):50781-50790.
[31]LIU J,WANG H L,LIU X Y,et al.Chinese liquor extract enhances inflammation resistance in RAW 264.7 and reduces aging in Caenorhabditis elegans[J].RSC Adv,2018,8:38529-38537.
[32]BROWN D M,DONALDSON K,BORM P J,et al.Calcium and ROSmediated activation of transcription factors and TNF-alpha cytokine gene expression in macrophages exposed to ultrafine particles[J].AM J Physiol-lung C,2004,286(2):L344-353.
[33] SHANKAR E, VYKHOVANETS E V, VYKHOVANETS O V, et al.High-fat diet activates pro-inflammatory response in the prostate through association of Stat-3 and NF-κB[J].Prostate,2012,72(3):233-243.