L-丙氨酸(L-alanine,L-Ala),又称L-α-氨基丙酸,是人体血液中含量最高的中性氨基酸,被广泛应用于医药、食品和日化领域[1-2]。L-丙氨酸是美国食品和药品管理局批准的食品添加剂和营养补充剂[3],用于食品中可以起到增甜提鲜的作用[4];作为一种药物成分,L-丙氨酸是维生素B6、索非布韦、醋酸格拉替雷等众多药品的生产原料,也可用于氨基酸输液[5-6];此外,L-丙氨酸还被广泛用作头发和皮肤的调理剂,也被用作化妆品和一些个人护理产品的成分[6]。以L-丙氨酸为原料生产新型螯合剂甲基甘氨酸二乙酸(methylglycine-N,N-diacetic acid,MGDA),可替代洗涤剂中的含磷螯合剂,其在水中可以自然降解,避免了对环境产生的负面影响[7-8]。
微生物发酵法生产成本低、反应条件温和,已成为L-丙氨酸生产的主流方式[9-10]。目前用于L-丙氨酸发酵生产的主要菌株是大肠杆菌(Escherichia coli)[11-12],其次是谷氨酸棒状杆菌(Corynebacterium glutamicum)[13-14]。相比于其他的微生物,大肠杆菌具有遗传背景清晰、基因改造技术成熟、繁殖速度快和发酵周期短等优点[15-16]。目前,高产L-丙氨酸大肠杆菌细胞工厂的构建主要是通过在大肠杆菌中引入异源的丙氨酸脱氢酶(alanine dehydrogenase,ADH),丙氨酸脱氢酶可高效催化丙酮酸、氨(NH4+)和烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)生成L-丙氨酸[17-18]。有研究发现[19],发酵液中L-丙氨酸的积累会降低大肠杆菌细胞的比生长速率,且异源丙氨酸脱氢酶的高效表达会对菌体造成代谢负担。ZHOU L等[20]设计了一种温度调节的遗传开关来动态控制丙氨酸脱氢酶的表达,将发酵分为细胞生长和L-丙氨酸生产两个阶段,实现了发酵过程的动态调控,发酵40 h,L-丙氨酸产量达120.8 g/L。目前,已有研究报道了响应L-缬氨酸[21]和L-异亮氨酸[22]等氨基酸的生物传感器,但尚未发现响应L-丙氨酸的生物传感器。
利用转录组测序技术筛选响应天然产物的启动子已经是一种比较成熟的启动子建库策略[23-24]。LIANG G J等[25]在光滑假丝酵母中利用转录组分析筛选得到了响应L-苹果酸的Pcgr-10启动子元件,并以此构建了响应L-苹果酸的动态调控系统,提高了L-苹果酸产量;汪舒颖等[26]在单增李斯特氏菌(Listeria monocytogenes)中利用转录组分析筛选到了在厌氧条件下高效表达的Pan4启动子,用于调控天青蛋白和θ毒素表达。本研究对90 g/L L-丙氨酸压力下培养的大肠杆菌(Escherichia coli)进行比较转录组测序分析,筛选在L-丙氨酸压力下显著上调基因的启动子,利用mKate荧光蛋白进行表征,添加10 g/L的L-丙氨酸进行诱导,从中筛选出响应L-丙氨酸的启动子,并通过测定不同浓度L-丙氨酸和不同种类氨基酸诱导下启动子的相对荧光强度,评估启动子的灵敏性与特异性。本研究旨在从大肠杆菌中筛选出特异性响应L-丙氨酸的启动子元件,为后续L-丙氨酸动态响应系统的构建奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒和引物
大肠杆菌(E.coli)W3110、E.coli JM109、质粒pTET:由本实验室保藏。本研究所用引物如表1所示。
表1 本研究所用引物
Table 1 Primers in the study

引物名称 引物序列(5�3)pTET-mKate-2 pTET-mKate-1 P-BetA-F P-BetA-R P-ArgK-F P-ArgK-R P-CpxP-F P-CpxP-R P-FlgG-F P-FlgG-R P-GlgP-F P-GlgP-R P-GlpA-F P-GlpA-R P-KdpB-F P-KdbB-R P-LivH-F P-LivH-R P-PulG-F P-PulG-R P-YhfX-F P-YhfX-R CX-P-1 CX-P-2 mKate-1 mKate-2 pTET-1 pTET-2 TTTTCTCTATCACTGATAGGGAGTGGT GGATCCAAAGAGGAGAAAGGTACCAT CCTATCAGTGATAGAGAAAACAGCTTCCCGCATCGCGATAA CCTTTCTCCTCTTTGGATCCATAAACCTCCTGGTTAGAATATGGACTGG CCTATCAGTGATAGAGAAAAACGATAGAGCATCGGCTGATGC CCTTTCTCCTCTTTGGATCCCCAGTATCCCCACTGTTATTGTTACCAT CCTATCAGTGATAGAGAAAAACGGCGCAGGATCGCGCGAATA CCTTTCTCCTCTTTGGATCCCATTTGCTCCCAAAATCTTTCTGTCGC CCTATCAGTGATAGAGAAAATCTCGGCGCTCAATCCGGGC CCTTTCTCCTCTTTGGATCCAAAATGTCCTGTAGTGGATTAGTGAC CCTATCAGTGATAGAGAAAATGGAGCAGGGCGGGCAGCTG CCTTTCTCCTCTTTGGATCCATAGGCGTTTCCTGAAAACTATTTCAAGCG CCTATCAGTGATAGAGAAAAATAAGCAATCGAGATCCCCGAAAGG CCTTTCTCCTCTTTGGATCCTGTTATCCCTCTGAAGTTCGTTTTTTACCATT CCTATCAGTGATAGAGAAAACCAGAAAAGCATGAAAGGCAGCG CCTTTCTCCTCTTTGGATCCCAGAACGCCTCCGCATTGATCA CCTATCAGTGATAGAGAAAATACTCCGGCCAGATCTTTTGCAG CCTTTCTCCTCTTTGGATCCAGTCAAAAATCCCCATTCGTGATGTTG CCTATCAGTGATAGAGAAAAGCTGGTTAGCCCGACTACGCT CCTTTCTCCTCTTTGGATCCCTCAATGCCTGCTCATCAAAAAATTGTTCC CCTATCAGTGATAGAGAAAAGCACCACGGCTTACCGGATGATC CCTTTCTCCTCTTTGGATCCGCTCGCTGTTTTGTCTCTCTTGC CAATGTAGGCTGCTCTACACCTAGCTTCTG AGCGGAATATATCCCTAGGTATAAACGCAG ATGCTCTCAGAATTAATTAAAGAAAATATGCACAT TGTCGACGGAGCTCGAATTCTCAACGATGTCCTAATTTCGACGGAAG CGTCGAAATTAGGACATCGTGAATTCGAGCTCCGTCGACAAG GGGATCCAAAGAGGAGAAAGGTACCATGCTCTCAGAATTAATTAA
1.1.2 化学试剂
限制性内切酶、脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker、Prime Star高保真酶、T4 DNA连接酶和Taq DNA聚合酶:大连宝生物工程公司;ClonExpress II One step cloning kit:南京诺唯赞生物科技有限公司;细菌基因组提取试剂盒、质粒提取试剂盒、胶回收试剂盒、产物纯化试剂盒、氯霉素(分析纯):上海生工生物工程技术有限公司;L-丙氨酸(分析纯):上海阿拉丁生化科技股份有限公司;酵母粉、蛋白胨(均为生化试剂):英国Oxoid公司;其他试剂来自国药集团化学试剂有限公司。
1.1.3 培养基
LB培养基:酵母粉5.0g/L,蛋白胨10.0g/L,NaCl10.0g/L,pH自然,121 ℃条件下高压灭菌20 min。
LB固体培养基:酵母粉5.0 g/L,蛋白胨10.0 g/L,NaCl 10.0 g/L,琼脂粉20 g/L,pH自然,121 ℃条件下高压灭菌20 min。
氯霉素抗性平板:酵母粉5.0 g/L,蛋白胨10.0 g/L,NaCl 10.0 g/L,琼脂粉20 g/L,pH自然,121 ℃条件高压灭菌20 min后,添加终质量浓度为30 μg/mL的氯霉素。
1.2 仪器与设备
CFX96聚合酶链式反应(polymerasechainreaction,PCR)仪、Gel Doc凝胶成像仪:美国Bio-Rad公司;BEP-600核酸电泳仪:北京伯兰特生物科技有限公司;ZQZY-AF8恒温调速摇床:上海知楚仪器有限公司;5804R冷冻离心机:德国Eppendorf公司;SpectraMaxRM3多功能酶标仪酶标仪:美国Molecular Devices公司。
1.3 方法
1.3.1 质粒和基因组的提取
细菌质粒DNA提取方法参照上海生工生物工程技术有限公司细菌质粒提取试剂盒相关操作说明,基因组提取参照上海生工生物工程技术有限公司细菌基因组提取试剂盒相关操作说明。
1.3.2 转录组测序
将培养至对数期的大肠杆菌分别在非胁迫(未添加L-丙氨酸的LB培养基)和胁迫(添加90 g/L L-丙氨酸的LB培养基)条件下接种,初始OD600nm值为0.1[27]。培养6 h后,4 ℃、12 000 r/min离心10 min收集细胞,然后用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤两次,在液氮中快速冷冻,并送到苏州金唯智生物科技有限公司进行转录组分析。
1.3.3 重组质粒构建
以pTET质粒为模板,pTET-mKate-1/pTET-mKate-2为引物,PCR扩增线性载体,PCR扩增体系:模板DNA 2 μL,Prime Star高保真酶50 μL,引物1、引物2各2 μL,双蒸水(ddH2O)44 μL。PCR扩增程序:94 ℃预变性10 min,循环程序(94 ℃变性10 s,55 ℃退火30 s,72 ℃延伸1 000 bp/min),循环程序运行29次,后延伸72 ℃,5 min。将PCR扩增后的产物胶回收后得到线性化载体片段。以E.coli W3110基因组为模板,扩增目的基因前500 bp片段,胶回收后得到目的片段产物。
使用同源重组酶连接线性化载体片段和目的片段,制作JM109化转感受态细胞,将连接好的质粒利用化学转化法转入JM109感受态细胞中,37 ℃、200 r/min摇床孵育1 h后,5 000 r/min离心5 min后去掉上清,用剩余少许培养基将菌体重悬,涂至含有氯霉素抗性的LB固体平板上。挑选氯霉素抗性平板上长出的单菌落,以引物CX-P-1/CX-P-2进行菌落PCR验证,验证成功的单菌落送于天霖生物科技(无锡)有限公司测序,测序成功的质粒化转入E.coli W3110中进行下一步试验。
1.3.4 24孔板培养
24孔板装液量为2 mL,将培养至对数期的菌种以2%的接种量接入24孔板的LB培养基中(含不同质量浓度的L-丙氨酸),37 ℃、600 r/min振荡培养8 h。
1.3.5 相对荧光强度测定
取1 mL待测样品,8 000 r/min离心1 min,用相同体积的PBS清洗两次,然后用PBS稀释OD600nm值在0.4~0.6左右,取200 μL稀释后样品加入黑色避光的酶标板中,使用酶标仪测量荧光强度,设定激发波长为588 nm,发射波长为645 nm,并测定OD600 nm值,根据荧光强度和OD600 nm值的比值计算相对荧光强度[27]。
1.3.6 数据处理
试验数据用Microsoft Excel 2016进行整理和分析,使用Origin 2021作图。
2 结果与分析
2.1 L-丙氨酸压力下高转录启动子的筛选
转录水平在L-丙氨酸压力下比正常条件下升高基因的启动子可能是由L-丙氨酸驱动的启动子[28]。从测序结果给出的差异表达基因分析列表中,选择转录水平较对照组提高水平靠前的10个基因(ArgK,FlgG,GlgP,CpxP,BetA,GlpA,KdpB,PulG,LivH和YhfX)作为候选基因,结果见图1。
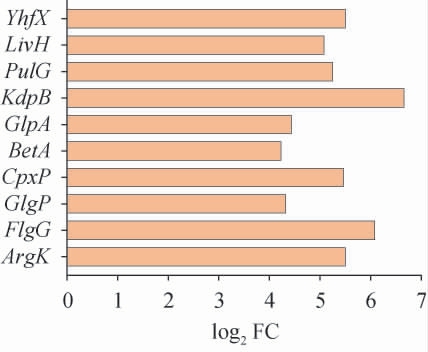
图1 十个候选启动子的差异表达
Fig.1 Differential expression of ten candidate promoters
log2 FC:差异变化的对数值,代表转录水平差异。
由图1可知,转录水平提高最多的基因为KdpB,转录水平差异为6.66,其次是FlgG,转录水平差异为6.08。
使用蛋白质直系同源簇数据库(cluster of orthologous groups of proteins,COG)查询分析10个候选基因的基因功能,结果见表2。由表2可知,该10个基因的功能分别属于细胞运动和分泌、氨基酸运输与代谢、碳水化合物运输和代谢、无机离子转运和代谢和能量产生和转化,将这10个基因的启动子分别编号为PAla-7~PAla-10。
表2 10个转录水平提高的基因
Table 2 10 genes with increased transcriptional level
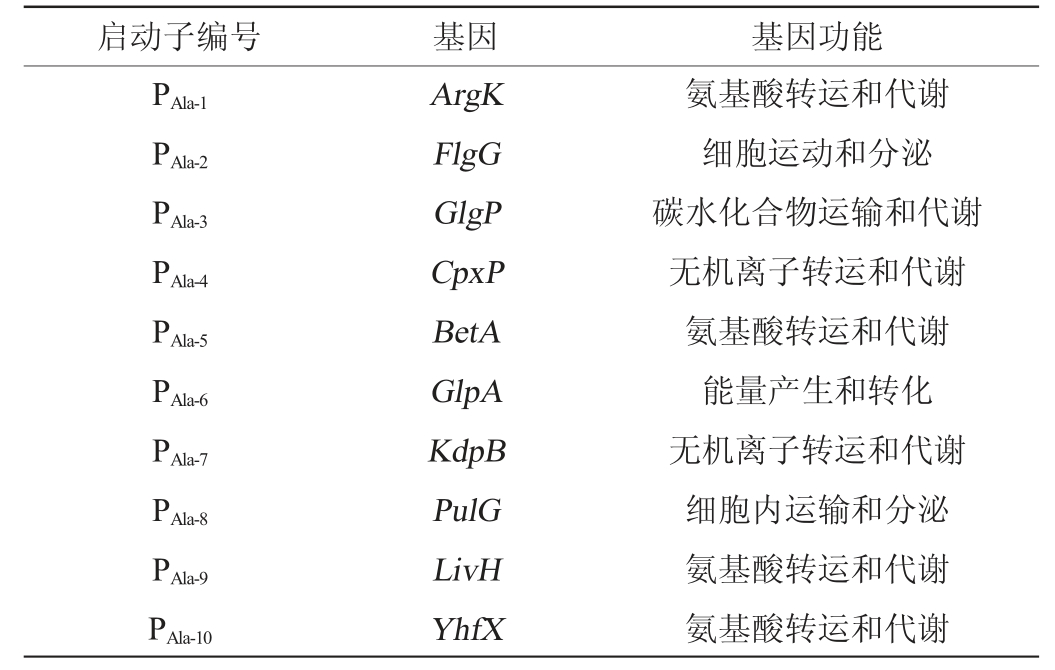
启动子编号 基因 基因功能PAla-1 PAla-2 PAla-3 PAla-4 PAla-5 PAla-6 PAla-7 PAla-8 PAla-9 PAla-10 ArgK FlgG GlgP CpxP BetA GlpA KdpB PulG LivH YhfX氨基酸转运和代谢细胞运动和分泌碳水化合物运输和代谢无机离子转运和代谢氨基酸转运和代谢能量产生和转化无机离子转运和代谢细胞内运输和分泌氨基酸转运和代谢氨基酸转运和代谢
2.2 荧光报告菌株的构建
为了构建含有红色荧光蛋白基因的质粒,以pTET质粒作为骨架质粒,以实验室已有的mKate基因片段为模板[29],设计含同源臂的引物mKate-1和mKate-2扩增mKate基因片段,得到目的基因片段;以含有同源臂的引物pTET-1和pTET-2扩增pTET质粒,得到线性化载体片段,按方法1.3.3进行质粒构建。挑选五个氯霉素抗性平板上长出的pTETmKate质粒重组菌单菌落进行菌落PCR验证,结果见图2。由图2可知,1号、2号、4号和5号泳道PCR扩增产物碱基长度约为1 000 bp,与mKate基因大小相符,说明mKate基因成功连接到了pTET质粒上。将菌落PCR验证正确的菌株送至天霖生物科技(无锡)有限公司测序,测序成功后得到pTET-mKate质粒。
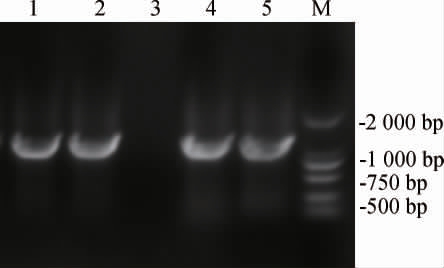
图2 pTET-mKate质粒重组菌菌落PCR验证
Fig.2 PCR verification of pTET-mKate plasmid recombinant colony
泳道1~5为挑选的五个单菌落;M为DL 2000 DNA Marker。
基因的前500 bp可能包含潜在的启动子序列,为了更直观的表征启动子的转录水平,筛选响应L-丙氨酸浓度的启动子,通过京都基因与基因组百科全书数据库(Kyoto encyclopedia of genes and genomes,KEGG)和美国国家生物技术信息中心数据库(national center of biotechnology information,NCBI)查询并预测10个候选基因前500 bp含有潜在启动子的序列。以E.coli W3110的基因组为模板,设计同源臂引物,将转录组分析筛选出的10个候选基因的前500 bp进行扩增,利用同源重组连接pTET-mKate质粒的红色荧光蛋白基因mKate,质粒图谱见图3。由图3可知,将10个候选基因的启动子序列插入到mKate基因前面,即可得到不同启动子控制的mKate基因表达质粒。
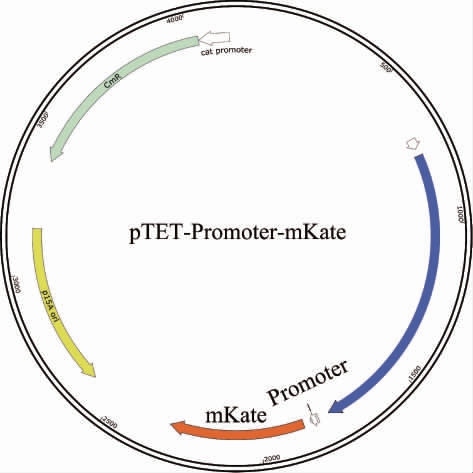
图3 荧光蛋白表达质粒构建
Fig.3 Construction of fluorescent protein expression plasmid
挑取氯霉素抗性平板长出的单菌落进行菌落PCR鉴定,结果见图4。由图4可知,PCR扩增产物碱基长度约为1500bp,说明500 bp的启动子片段成功连接到了pTET-mKate质粒上。将验证成功的菌株送至天霖生物科技(无锡)有限公司测序,测序成功后提取重组质粒化学转化入E.coli W3110感受态细胞中,所获得的菌株分别命名为P1~P10。
图4 重组菌株启动子菌落PCR验证
Fig.4 PCR verification of recombinant strains promoter colony
泳道1~10为菌株P1~P10;M为DL 2000 DNA Marker。
2.3 重组菌株相对荧光强度测定
为了比较不同菌株在L-丙氨酸压力下的相对荧光强度,将培养至对数期的菌株接种到未添加L-丙氨酸和添加10 g/L L-丙氨酸的LB培养基中,培养8 h后取样测定荧光强度和OD600nm值,通过荧光强度和OD600 nm值的比值计算相对荧光强度,结果见图5。由图5可知,PAla-4、PAla-8和PAla-10启动子显示出了较高的相对荧光强度,在不添加L-丙氨酸的LB培养基中培养8 h后,相对荧光强度分别达到1 421、1 121和1 226,但是在添加10 g/L L-丙氨酸的LB培养基中培养后,相对荧光强度分别下降了21.2%、18.4%和51.5%,说明PAla-4、PAla-8和PAla-10启动子并不会响应L-丙氨酸浓度来提高基因的转录水平。PAla-7和PAla-9启动子的荧光报告菌株在添加10g/L L-丙氨酸压力下的相对荧光强度均高于未添加L-丙氨酸,分别是未添加L-丙氨酸相对荧光强度的1.5倍和3.8倍。其他启动子菌株在添加10 g/L L-丙氨酸压力下的相对荧光强度均低于未添加L-丙氨酸,可能是L-丙氨酸会抑制荧光蛋白基因的表达。因此,选择PAla-7和PAla-9启动子进行下一步的评估验证。
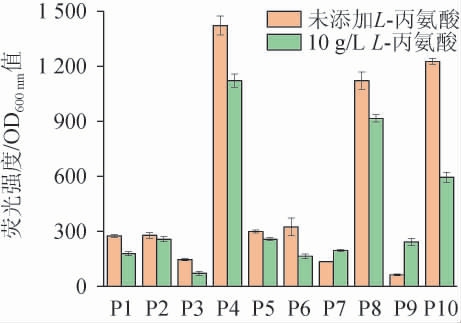
图5 10个启动子菌株在10 g/L L-丙氨酸质量浓度下相对荧光强度比较
Fig.5 Comparison of relative fluorescence intensity of 10 promoters strains at mass concentration of 10 g/L L-alanine
2.4 启动子响应L-丙氨酸浓度的灵敏性分析
将含有PAla-7和PAla-9启动子的菌株P7和P9分别接种到添加0~60 g/L L-丙氨酸的LB培养基中进行诱导,观察PAla-7和PAla-9启动子对不同L-丙氨酸浓度响应的灵敏性,结果见图6。
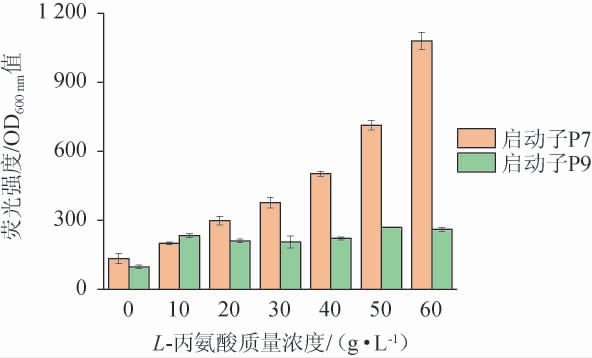
图6 PAla-7和PAla-9启动子在不同L-丙氨酸质量浓度下相对荧光强度比较
Fig.6 Comparison of relative fluorescence intensity of PAla-7 and PAla-9 promoters at different L-alanine mass concentrations
由图6可知,在不同浓度L-丙氨酸的诱导下,PAla-9启动子并未随着L-丙氨酸浓度的增加而增加。在不同浓度L-丙氨酸的诱导下,PAla-7启动子的相对荧光强度随着L-丙氨酸浓度的而增加,相对于未添加L-丙氨酸,添加10 g/L、20 g/L、30 g/L、40 g/L、50 g/L和60 g/L L-丙氨酸诱导后的相对荧光强度分别增加了49%、122%、181%、275%、432%和705%,PAla-7启动子在0~60 g/L L-丙氨酸诱导下显示出了良好的灵敏性。
2.5 启动子响应L-丙氨酸浓度的特异性分析
为了分析PAla-7启动子是否对L-丙氨酸具有特异性响应,选择11种常见的氨基酸(甲硫氨酸、丙氨酸、苏氨酸、缬氨酸、脯氨酸、赖氨酸、半胱氨酸、亮氨酸、苯丙氨酸、甘氨酸、精氨酸)分别进行诱导。将培养至对数期的菌株P7接种至含10 g/L和20 g/L的不同氨基酸的LB培养基中,测定诱导后的相对荧光强度,结果见图7。由图7可知,L-丙氨酸诱导质量浓度从10 g/L增加到20 g/L时,相对荧光强度增加了52.4%,而其他氨基酸随着浓度的增加,相对荧光强度并没有随着有明显的增加。因此,PAla-7启动子对L-丙氨酸具有特异性响应。
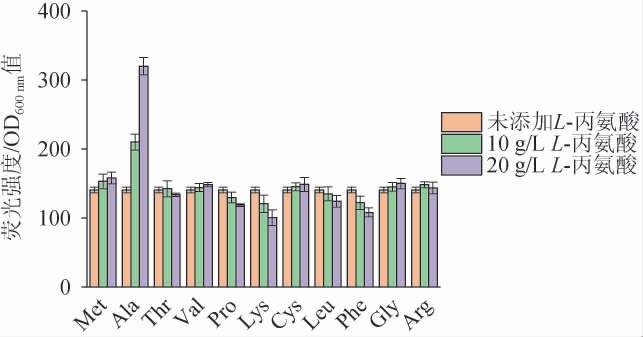
图7 PAla-7启动子在不同种类氨基酸下相对荧光强度比较
Fig.7 Comparison of relative fluorescence intensity of PAla-7 promoter under different kinds of amino acids
3 结论
通过对不同质量浓度L-丙氨酸压力下的大肠杆菌进行转录组学分析,从中筛选了可能是L-丙氨酸诱导的10个候选基因的启动子。随后,利用红色荧光蛋白进行表征,筛选得到了特异性响应L-丙氨酸浓度的PAla-7启动子,该启动子在0~60 g/L L-丙氨酸范围内具有良好的灵敏性。值得注意的是,其余启动子虽不能响应L-丙氨酸浓度表达,但可作为组成型启动子,用于后续启动子优化、调控基因表达水平和平衡代谢流等研究。该研究筛选得到的PAla-7启动子可作为生物传感器的调控元件,也为后续L-丙氨酸动态调控系统的构建提供了理论基础。
[1]徐慧,崔颖,王珊珊,等.L-丙氨酸转化菌发酵条件的优化[J].食品研究与开发,2021,42(7):177-182.
[2]聂玉朋,徐慧,姚明静,等.L-丙氨酸的应用及生产现状概述[J].中国酿造,2021,40(11):26-30.
[3]SHARMA A,NODA M,SUGIYAMA M,et al.Metabolic engineering of Pediococcus acidilactici BD16 for heterologous expression of synthetic alaD gene cassette and L-alanine production in the recombinant strain using fed-batch fermentation[J].Foods,2021,10(8):1-16.
[4]田宋魁,郭恒华,张冬竹,等.L-丙氨酸生产工艺的研究进展[J].精细与专用化学品,2017,25(8):12-14.
[5]徐友强,马玉岳,姚粟,等.重组大肠杆菌转化富马酸生产L-丙氨酸[J].生物加工过程,2016,14(2):7-11.
[6]DAVE U C,KADEPPAGARI R K.Alanine dehydrogenase and its applications-A review[J].Crit Rev Biotechnol,2019,39(5):648-664.
[7] GONZALEZ I, CPRTES A, NEAMAN A, et al.Biodegradable chelate enhances the phytoextraction of copper by Oenothera picensis grown in copper-contaminated acid soils[J].Chemosphere,2011,84(4):490-496.
[8]刘晓庆,刘金龙.新型绿色螯合剂MGDA合成研究进展[J].化工管理,2020,553(10):105-107.
[9]孙金凯.代谢工程改造产酸克雷伯氏菌生产D/L-乳酸与丙氨酸[D].济南:山东大学,2019.
[10]赵桂红.谷氨酸棒杆菌发酵法生产L-丙氨酸和D-丙氨酸的研究[D].天津:天津科技大学,2021.
[11] LEE M, SMITH G M, EITEMAN M A, et al.Aerobic production of alanine by Escherichia coli aceF ldhA mutants expressing the Bacillus sphaericus alaD gene[J].Appl Microbiol Biot,2004,65(1):56-60.
[12] SMITH G M, LEE S A, REILLY K C, et al.Fed-batch two-phase production of alanine by a metabolically engineered Escherichia coli[J].Biotechnol Lett,2006,28(20):1695-1700.
[13]YAMAMOTO S,GUNJI W,SUZUKI H,et al.Overexpression of genes encoding glycolytic enzymes in Corynebacterium glutamicum enhances glucose metabolism and alanine production under oxygen deprivation conditions[J].Appl Environ Microbiol,2012,78(12):4447-4457.
[14] JOJIMA T, FUJII M, MORI E, et al.Engineering of sugar metabolism of Corynebacterium glutamicum for production of amino acid L-alanine under oxygen deprivation[J].Appl Microbiol Biot, 2010, 87(1): 159-165.
[15]潘海亮,王灿,赵筱,等.大肠杆菌ptsG基因缺陷菌株的构建及其发酵混合糖产L-丙氨酸[J].中国酿造,2019,38(11):160-164.
[16]孟帅帅.大肠杆菌生产L-色氨酸重组菌株的改造及发酵条件优化[D].福州:福建师范大学,2020.
[17] ZHANG X L, JANTAMA K, MOORE J C, et al.Production of L-alanine by metabolically engineered Escherichia coli[J].Appl Microbiol Biot,2007,77(2):355-366.
[18] JOJIMA T, FUJII M, MORI E, et al.Engineering of sugar metabolism of Corynebacterium glutamicum for production of amino acid L-alanine under oxygen deprivation[J].Appl Microbiol Biot, 2010, 87(1): 159-165.
[19]周丽,邓璨,崔文璟,等.温度调节基因开关调控大肠杆菌发酵合成L-丙氨酸[J].微生物学通报,2015,42(11):2272-2281.
[20]ZHOU L,DENG C,CUI W J,et al.Efficient L-alanine production by a thermo-regulated switch in Escherichia coli[J].Appl Biochem Biotech,2016,178(2):324-337.
[21]MUSTAFI N,GRÜNBERGER A,KOHLHEYER D,et al.The development and application of a single-cell biosensor for the detection of L-methionine and branched-chain amino acids[J].Metab Eng,2012,14(4):449-457.
[22]LAI W M,SHI F,TAN S Y,et al.Dynamic control of 4-hydroxyisoleucine biosynthesis by multi-biosensor in Corynebacterium glutamicum[J].Appl Microbiol Biot,2022,106(13):5105-5121.
[23]YUAN F Y,LI K,ZHOU C X,et al.Identification of two novel highly inducible promoters from Bacillus licheniformis by screening transcriptomic data[J].Genomics,2020,112(2):1866-1871.
[24]KONG L H,XIONG Z Q,SONG X,et al.Characterization of a panel of strong constitutive promoters from Streptococcus thermophilus for finetuning gene expression[J].ACS Synth Biol,2019,8(6):1469-1472.
[25]LIANG G J,ZHOU P,LU J X,et al.Dynamic regulation of membrane integrity to enhance l-malate stress tolerance in Candida glabrata[J].Biotechnol Bioeng,2021,118(11):4347-4359.
[26]汪舒颖,马俊飞,季倩玉,等.基于厌氧条件下转录组分析的单增李斯特氏菌强启动子的鉴定[J].工业微生物,2022,52(2):1-8.
[27]LI Z D,GAO C,YE C,et al.Systems engineering of Escherichia coli for high-level shikimate production[J].Metab Eng,2023,75(75):1-11.
[28] YE J W,HU D K,YIN J,et al.Stimulus response-based fine-tuning of polyhydroxyalkanoate pathway in Halomonas[J].Metab Eng,2020,57(4):85-95.
[29]GUO L,DIAO W W,GAO C,et al.Engineering Escherichia coli lifespan for enhancing chemical production[J].Nature Catalysis, 2020, 3(3):307-318.