豉香型白酒有着十分悠久的历史,是我国珠江三角洲地区传统地域性产品,其入口顺喉绵甜,回味悠远,俗称“玉冰烧”或“肉冰烧”[1],该产品已录入广东省非物质文化遗产,以及国家地理标志产品[2]。有研究表明,适度饮酒有助于抗类风湿性关节炎[3]、预防肥胖[4]、非酒精性肝病[5]、心脑血管疾病[6]、痴呆[7]等;也有研究指出,过量饮酒将会增加头疼眩晕[8]、肠道损伤、患高血压、糖尿病[9]、高乳酸血症[10]、癌症的风险[11]。豉香型白酒中2%的微量成分[12]的配比和平衡关系是保证其香气、味道、醉酒效果的关键因素[13]。关于这些微量成分对风味的影响已有部分研究[14-15],而关于其对醉酒效果影响的研究还有待深入。
为了量化酒类产品中物质的致醉作用,WU Z Q等[16]结合小鼠酒后血液乙醇浓度变化和运动能力的测试,推算小鼠的综合醉酒情况,形成了一个科学、精确且相对快速的醉酒程度评价动物模型。彭斌[14]通过药物代谢动力学软件处理数据,再结合水迷宫实验增加记忆能力检测,对醉酒程度的检测方式进行了优化。该研究完善了醉酒程度评价体系,为探究微量成分对酒类产品的致醉效果提供了更可靠和完善的技术。XIE J等[17]通过对不同白酒关键微量醇、酸、酯配比的致醉程度进行研究,揭示了其主要通过影响乙醇代谢导致致醉程度差异。其中乙酸和乙酸乙酯可以显著降低醉酒程度,异丁醇和异戊醇则相反。彭斌等[18]进一步研究了白酒中醇、酸、酯等微量成分的浓度和比例对酒后小鼠的作用,结果发现,适量高浓度的乙酸有利于促进乙醇代谢,同时减缓其他组分对乙醇脱氢酶(alcohol dehydrogenase,ADH)和乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)活性的抑制作用,能够刺激小鼠记忆能力,显著降低逃逸潜伏时间,过高的杂醇,尤其是异戊醇,作用效果则相反。
本研究将通过研究豉香型白酒的主要香气成分对小鼠血液乙醇代谢、行为能力和急性酒精性肝损伤的作用程度及作用机理,挖掘豉香型白酒降低醉酒程度的因子,进一步为低醉酒程度白酒的研制和生产提供依据。
1 材料与方法
1.1 材料与试剂
实验小鼠:无特定病原体(specefic pathogen free,SPF)级雄性昆明小鼠,体质量18~22 g,购自湖南斯莱克景达实验动物有限公司,小鼠在温度25~28 ℃、相对湿度60%、自然光照环境中适应性饲养一周,期间自由进食进水,实验前一晚禁食不禁水。按照《广东省动物实验管理条例》(2010年10月1日)要求进行。
肝素钠(≥180 U/mg)、无水乙醇、乙腈、乙缩醛、反-2,4-癸二烯醛、丁二酸二乙酯、庚二酸二乙酯、辛二酸二乙酯、苯甲醇、β-苯乙醇(均为色谱纯)、壬醛、反-2-辛烯醛、反-2-癸烯醛、庚二酸、辛二酸、壬二酸、3-甲硫基-1-丙醇(均为分析纯):Aladdin-阿拉丁试剂(上海)有限公司;乙醛(色谱纯)、叔丁醇、辛醛、反-2-壬烯醛、壬二酸二乙酯(均为分析纯):上海麦克林生化科技有限公司。
总蛋白定量测试盒、乙醇脱氢酶测试盒、乙醛脱氢酶测试盒、谷丙转氨酶(alanine transaminase,ALT)测试盒、谷草转氨酶(aminotransferase aspartate,AST)测试盒、总超氧化物歧化酶(superoxide dismutase,SOD)测试盒、丙二醛(malondialdehyde,MDA)测试盒:南京建成生物工程研究所。
豉香型白酒五年陈酒(酒精度为38%vol):由广东省九江酒厂有限公司提供,其主要的风味物质种类及含量见表1[19-22]。
表1 五年陈酒中主要风味物质种类及含量
Table 1 Types and contents of major flavor substances in five-year aged Baijiu
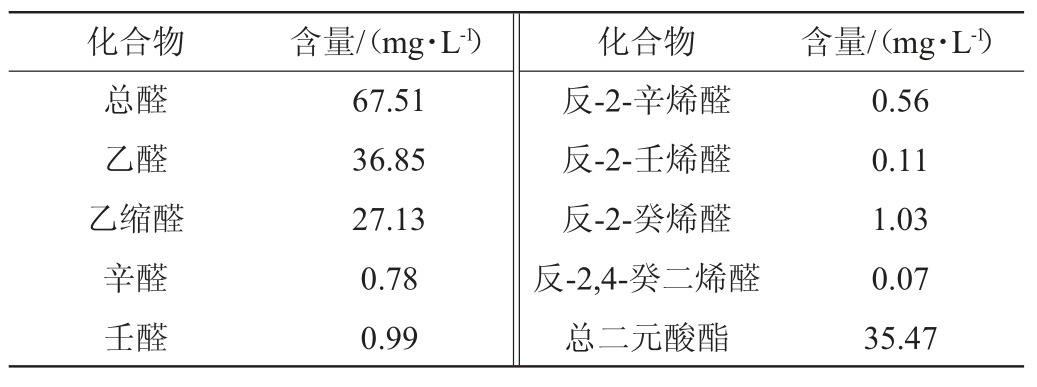
化合物 含量/(mg·L-1) 化合物 含量/(mg·L-1)总醛乙醛乙缩醛辛醛壬醛67.51 36.85 27.13 0.78 0.99反-2-辛烯醛反-2-壬烯醛反-2-癸烯醛反-2,4-癸二烯醛总二元酸酯0.56 0.11 1.03 0.07 35.47
续表
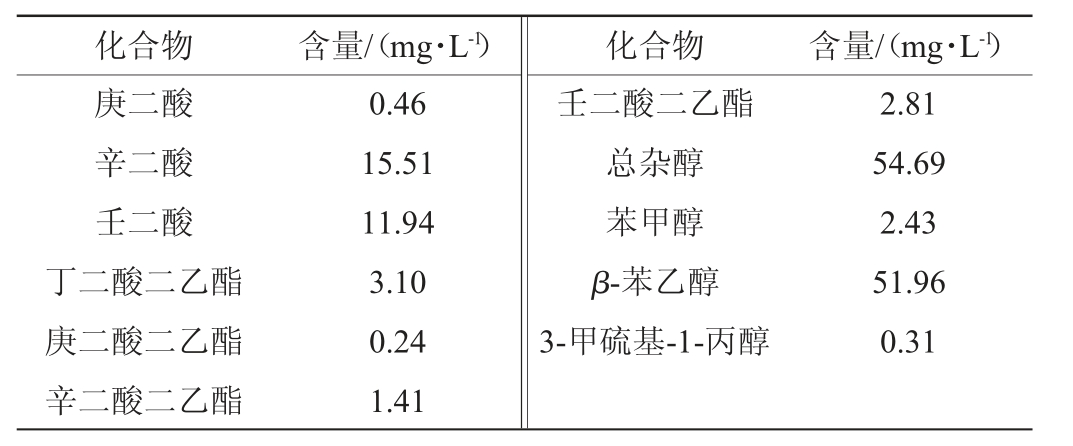
化合物 含量/(mg·L-1) 化合物 含量/(mg·L-1)庚二酸辛二酸壬二酸丁二酸二乙酯庚二酸二乙酯辛二酸二乙酯0.46 15.51 11.94 3.10 0.24 1.41壬二酸二乙酯总杂醇苯甲醇β-苯乙醇3-甲硫基-1-丙醇2.81 54.69 2.43 51.96 0.31
1.2 仪器与设备
Morris水迷宫:上海欣软信息科技有限公司;KK24E78TI西门子冰箱:博西华家用电器有限公司;5804R冷冻离心机:德国Eppendorf公司;GC-2014C气相色谱(gas chromatography,GC)仪、GsBP-Inowax色谱柱(30 m×0.32 mm×0.40 μm):日本岛津公司;BS224S分析天平:赛多利斯科学仪器有限公司;HH-S水浴锅:上海程造仪器设备有限公司;KQ-400KDE型超声清洗仪:昆山市超声仪器有限公司;MX-S可调式混匀仪:大龙兴创实验仪器(北京)有限公司;FJ200-SH数显恒速高速分散均质机:上海沪析实业有限公司;TGL-16G型高速台式离心机:上海安亭科学仪器厂;SpectraMax M5多功能酶标仪:美国Molecular Devices公司;UV-2802S型紫外可见分光光度计:上海尤尼柯仪器有限公司。
1.3 方法
1.3.1 主要风味成分缺失配制酒的制备
以体积分数为30%的乙醇为基酒,添加表1中所有物质制备对照组;依据表1中五年陈酒的主要风味物质成分含量,删除某些成分或某类物质,配制出酒精度为30%vol的相应风味成分缺失的配制酒酒样(formula liquors,FLs),具体见表2,用以探讨主要风味成分缺失对醉酒程度、小鼠酒精代谢和急性酒精性肝脏损伤的作用。
表2 配制酒酒样及相应缺失组分
Table 2 Blending liquors samples and corresponding missing components
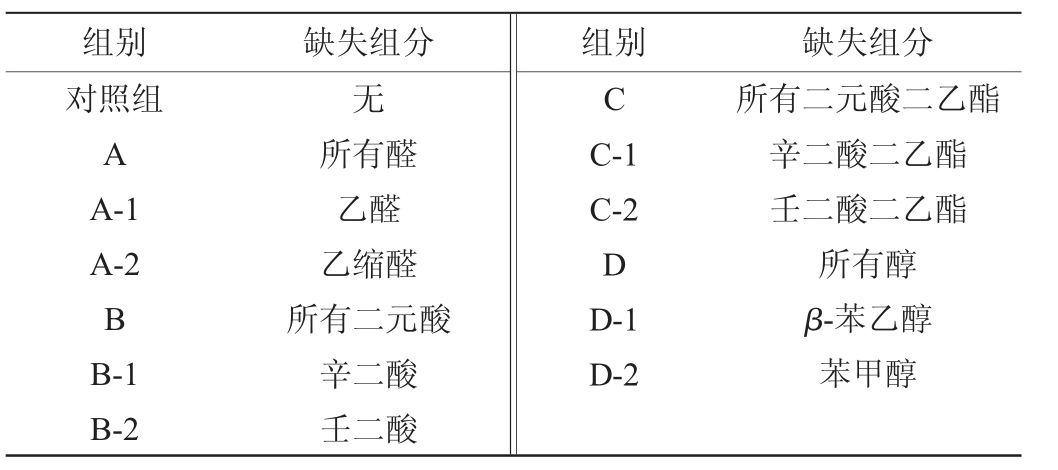
组别 缺失组分 组别 缺失组分对照组A A-1 A-2 B B-1 B-2无C所有醛乙醛乙缩醛所有二元酸辛二酸壬二酸C-1 C-2 D D-1 D-2所有二元酸二乙酯辛二酸二乙酯壬二酸二乙酯所有醇β-苯乙醇苯甲醇
1.3.2 血液乙醇浓度测定
小鼠随机分组,每组24只,再随机分为3小组,作为3组平行实验。对照组小鼠灌胃对照溶液(4 g/kg体质量),实验组小鼠灌胃相同剂量的FLs,均只灌胃一次。每小组小鼠分别在灌胃后30 min、60 min、75 min、90 min、120 min、180 min、240 min用尾静脉穿刺法采集血液50 μL,收集于含烘干肝素钠(配制1 800 U/mL的肝素钠溶液润湿离心管内壁,烘干)的1.5 mL离心管中,再加入425 μL乙腈、25 μL叔丁醇内标溶液(500 mg/L)混匀,12 000 r/min离心10 min,取上层液体经0.22 μm尼龙膜过滤至气相瓶,采用GC法测定血液乙醇浓度(blood alcohol concentration,BAC)[14]。
为了更清晰直观的分析各种酒样对酒精代谢的作用,通过药物代谢动力学程序DAS 2.0分析血液乙醇浓度随时间变化的数据,由此得出了乙醇代谢的动力学参数,主要包括药峰浓度(peak concentration,Cmax)和时间曲线下面积(area under curve,AUC)(0-∞)。血液乙醇浓度实验从生理学角度反映醉酒程度变化,即Cmax值低,AUC(0-∞)值小,则血液乙醇代谢快,醉酒程度小;反之,Cmax值高,AUC(0-∞)值大,则血液乙醇代谢慢,醉酒程度大[14]。
1.3.3 记忆和行为能力测定
采用Morris水迷宫实验研究小鼠空间学习记忆能力[14]。Morris水迷宫由直径120 cm水池和直径9 cm平台组成,辅以录像装置、分析软件和加热装置。实验时将水灌至高于平台1.5 cm处,用加热器保持水温在25.5~27.0 ℃。水池四周贴上不同的视觉标志,帮助小鼠记忆、寻找逃生平台。小鼠先进行连续3 d的认知学习,开始训练时将小鼠从一个随机的位置放入迷宫中,若60 s内没有找到水下平台,则将其放在平台上15 s加强记忆;若60 s内找到平台,则将其取出擦干,放入垫有干燥垫料的塑料笼中。第4天正式进行实验,小鼠随机分组,每组4只,对照组小鼠灌胃对照溶液(4 g/kg体质量),实验组小鼠灌胃相同剂量FLs,均只灌胃一次。每只小鼠分别在灌胃后1 h、2 h、3 h、4 h从一个随机的位置放入迷宫中,计时90 s,直至小鼠找到平台或时间至90 s(90 s内小鼠未找到平台则记为90 s),将小鼠取出擦干,放入垫有干燥垫料的塑料笼中。录像装置将全程记录小鼠实验过程,得到小鼠找到平台时间,即逃逸潜伏期(escape latency,ELT)和游泳速度(velocity,V)。水迷宫实验从行为学角度反映醉酒程度变化,即ELT短,V快,则认知记忆能力强,行动能力强,醉酒程度小;反之,ELT长,V慢,则认知记忆能力弱,行动能力弱,醉酒程度大[14]。
1.3.4 小鼠乙醇代谢酶分析
小鼠随机分组,每组4只,作为4组平行实验。对照组小鼠灌胃对照溶液(4 g/kg体质量),实验组小鼠灌胃相同剂量FLs,均只灌胃一次。每小组小鼠在灌胃后2 h摘眼球取血,再颈椎脱臼处死,取肝脏。肝脏先用4 ℃的预冷生理盐水洗去血水,用滤纸片吸干后称取0.1 g左右的肝组织放入10 mL离心管内,然后再加入9倍体积的预冷生理盐水(或ALDH测试盒中的提取液),并在冰水浴条件下机械匀浆至10%的肝组织匀浆,4 ℃条件下3 000 r/min离心15 min后,收集上清,采用预冷生理盐水(或ALDH测试盒中的提取液)稀释成1.0%、0.5%肝组织匀浆,待测。根据试剂盒说明,测定样品总蛋白含量、ADH活性、ALDH活性。
1.3.5 小鼠急性酒精性肝损伤分析
小鼠随机分组,每组4只,作为4组平行实验。对照组小鼠灌胃对照溶液(6 g/kg体质量),实验组小鼠灌胃相同剂量FLs,均只灌胃一次。每组小鼠在灌胃后6 h摘眼球取血,再颈椎脱臼处死,取肝脏。血样于常温静置1 h后,4 ℃条件下6 000 r/min离心10 min,收集上清,待测。根据试剂盒说明,测定样品ALT、AST活性。肝脏匀浆制备方法同1.3.4,稀释成1.0%、0.5%、0.04%肝组织匀浆,待测。根据试剂盒说明,测定样品总蛋白含量、SOD活性、MDA活性。
1.3.6 数据处理及统计分析
血液乙醇浓度实验数据为3组平行,记忆和行为能力实验数据为4组平行,结果用“平均值±标准差”表示。采用IBM SPSS 26.0软件进行组间差异显著性分析,用Origin 2018软件进行作图。
2 结果与分析
2.1 主要风味成分缺失对血液乙醇代谢的影响
BAC通常被用作酒精中毒的法定、医疗指标,有报道称BAC对人类行为和损伤有渐进性影响[23]。不同主要风味成分缺失配制酒酒样对小鼠血液乙醇代谢动力学参数的影响见表3。
表3 不同配制酒酒样对小鼠血液乙醇代谢动力学参数的影响
Table 3 Effect of different blending liquors samples on the kinetic parameters of alcohol metabolism in blood of mice
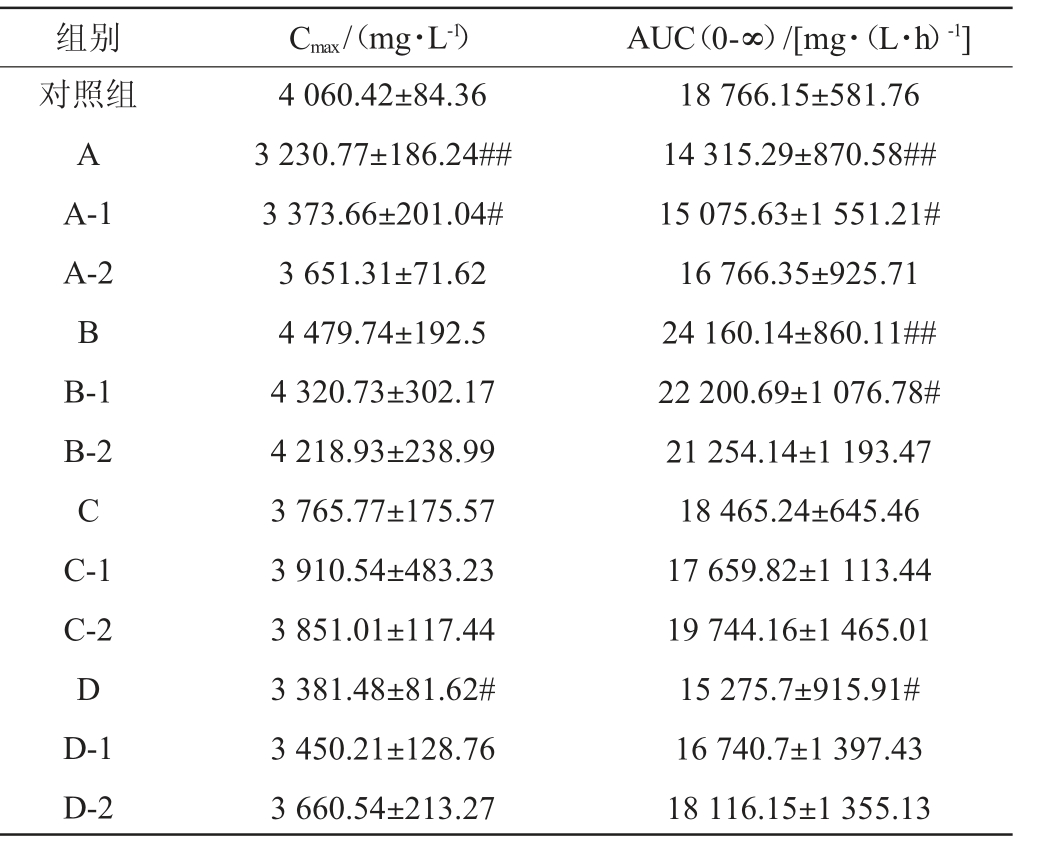
注:“#”表示与对照组比较差异显著(P<0.05),“##”表示与对照组比较差异极显著(P<0.01)。下同。
组别 Cmax/(mg·L-1) AUC(0-∞)/[mg·(L·h)-1]对照组A A-1 A-2 B B-1 B-2 C C-1 C-2 D D-1 D-2 4 060.42±84.36 3 230.77±186.24##3 373.66±201.04#3 651.31±71.62 4 479.74±192.5 4 320.73±302.17 4 218.93±238.99 3 765.77±175.57 3 910.54±483.23 3 851.01±117.44 3 381.48±81.62#3 450.21±128.76 3 660.54±213.27 18 766.15±581.76 14 315.29±870.58##15 075.63±1 551.21#16 766.35±925.71 24 160.14±860.11##22 200.69±1 076.78#21 254.14±1 193.47 18 465.24±645.46 17 659.82±1 113.44 19 744.16±1 465.01 15 275.7±915.91#16 740.7±1 397.43 18 116.15±1 355.13
由表3可知,与对照组相比,A组(所有醛缺失)的Cmax和AUC极显著降低(P<0.01),D组(所有醇缺失)的Cmax和AUC显著降低(P<0.05),小鼠血液乙醇代谢加强;B组(所有二元酸缺失)的AUC极显著升高(P<0.01),小鼠血液乙醇代谢减弱;C组(所有二元酸二乙酯缺失)的Cmax和AUC无显著变化(P>0.05),对小鼠血液乙醇代谢影响不明显。结果表明,缺失的醛类物质以及醇类物质是起关键致醉效果的成分,缺失的二元酸类物质是起关键降低醉酒效果的成分,缺失的酯类物质对醉酒效果影响不明显。
白酒中的部分醛类物质浓度过高时,会使白酒出现强烈的刺激性和辣味,对口腔和食道黏膜产生影响[24],且某些醛类化合物会损伤肝脏、心脑血管、增加癌症风险[25],所以应将其含量控制在适当范围内。白酒中的高级醇,在水溶液中呈油状液体,又称“杂醇油”[26]。杂醇油含量不协调时,白酒苦涩、辛辣增加,风味及风格破坏,同时引起嗓子发干,使人“上脸”,麻醉人体神经系统,损害脑神经细胞,使人“上头”,引发肝损伤、心跳加速、血压上升等[27]。白酒中的酸类物质含量合适时,有助于新酒老熟,使白酒的香气稳定、丰满、柔和而清爽[28]。并且能在降低喝酒后上头、口感不适等现象的同时,具有如抗肿瘤、抗炎、抗氧化、抗菌、抗血管硬化、助消化、降肺火等多种生物活性[29-31]。
A-1组(乙醛缺失)的Cmax和AUC显著降低(P<0.05),小鼠血液乙醇代谢加强。B-1组(辛二酸缺失)的AUC显著升高(P<0.05),小鼠血液乙醇代谢减弱。结果表明,醛类物质中乙醛起主要作用,二元酸类物质辛二酸起主要作用,其他物质虽然有一定作用趋势但是作用效果不明显。
乙醇在人体内的代谢是一个复杂、漫长的过程,进入人体后小部分先在胃和肠道吸收,大部分进入肝脏进行主要代谢,还有小部分随汗液和尿液排出[32]。乙醇在肝脏中的代谢分为三类:主要通过ADH催化转化成乙醛,乙醛再通过ALDH催化转化成乙酸,剩余部分通过氧化氢酶和微粒体乙醇氧化系统处理[33]。所以乙醛的堆积,也是导致乙醇代谢缓慢的关键因素。有研究表明,在豉香型白酒肥肉浸坛的过程中,肉中油脂通过水解和ω-氧化分解后产生的羧酸类物质,其中庚二酸、辛二酸和壬二酸等,合称“二元酸”,可与酒中的醇类物质酯化形成二元酸二乙酯及高级不饱和脂肪酸,这些物质能够提高酒中各组分的稳定性,在饮酒后也更利于产生竞争性吸收,减少酒精的消化吸收速率,从而降低机体在吸收酒精后带来的刺激性和伤害[15]。且有研究表明,辛二酸具有缓解皮肤老化的作用[34]。因此,辛二酸具有缓解醉酒程度的作用,同时辛二酸为二元酸,是可代谢脂肪酸,对人身体无毒害作用[35]。作用不明显的物质可能与其含量较低相关,自然发酵产生的这些物质本身很少,如果加其浓度能显著的探究出其降低醉酒程度作用,可以通过额外添加或者探索发酵途径或者跟别的物质相互影响达到降低醉酒程度的目的,但需要注意的是额外添加物质可能对白酒风味或者其他方面产生影响。
2.2 主要风味成分缺失对记忆和行为能力的影响
根据酒后小鼠在水迷宫实验中的ELT和V,可判断小鼠认知记忆和行为能力,不同主要风味成分缺失配制酒酒样对小鼠记忆和行为能力的影响见图1。
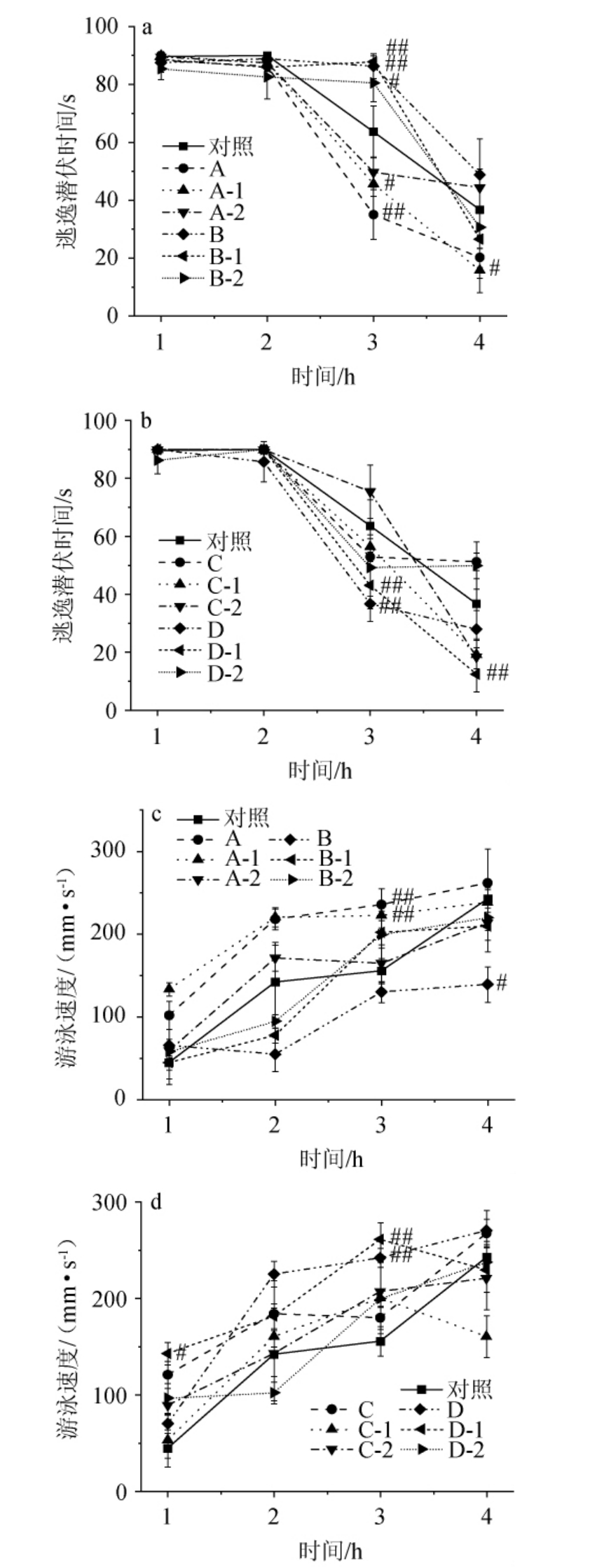
图1 不同配制酒酒样对小鼠行为学参数的影响
Fig.1 Effect of different blending liquors samples on behavioral parameters of mice
由图1可知,与对照组相比,3 h时,A组(所有醛缺失)、D组(所有醇缺失)小鼠逃逸潜伏时间极显著减短(P<0.01),小鼠认知记忆能力增强,B组(所有二元酸缺失)小鼠逃逸潜伏时间极显著加长(P<0.01),小鼠认知记忆能力减弱,C组(所有二元酸二乙酯缺失)小鼠逃逸潜伏时间无显著变化(P>0.05),对小鼠认知记忆能力影响不明显。3 h时,A组(所有醛缺失)和D组(所有醇缺失)小鼠游泳速度极显著加快(P<0.01),小鼠运动能力增强;4 h时,B组(所有二元酸缺失)小鼠游泳速度显著减慢(P<0.05),小鼠运动能力减弱。C组(所有二元酸二乙酯缺失)小鼠逃逸潜伏时间无显著变化(P>0.05),对小鼠运动能力影响不明显。这些物质对行为学的影响印证了2.1的结果,说明这些物质对醉酒程度的影响不仅只通过对血液乙醇代谢产生影响,还通过对运动记忆能力产生影响。
高级醇化学构造比乙醇更加复杂,在人体内的氧化分解代谢速度较乙醇慢,对机体的刺激作用持续时间较长,对中枢神经系统产生的毒害影响是直接而持久的[36],对人类神经所形成的抑制、毒害和麻醉效果比乙醇强,因此对小鼠的行为造成比较持续性的影响。白酒中过高浓度的杂醇可抑制三羧酸循环,并引起由醇代谢的有机酸在体内累积而带来的兴奋抑制[37]。某些白酒成分如有机酸等,则对人体酒精代谢可起到促进作用,有减轻乙醇毒害的作用[38]。
由图1亦可知,与对照组相比,3 h和4 h时,A-1组(乙醛缺失)小鼠逃逸潜伏时间显著减短(P<0.05),D-1组(β-苯乙醇缺失)小鼠逃逸潜伏时间极显著减短(P<0.01),小鼠认知记忆能力增强。3 h时,B-1组(辛二酸缺失)小鼠逃逸潜伏时间极显著加长(P<0.01),B-2组(壬二酸缺失)小鼠逃逸潜伏时间显著加长(P<0.05),小鼠认知记忆能力减弱。其他单物质缺失组逃逸潜伏时间无明显变化(P>0.05),对小鼠运动能力影响不明显。1 h时,D-1组(β-苯乙醇缺失)小鼠游泳速度显著加快(P<0.05),3 h时,A-1组(乙醛缺失)和D-1组(β-苯乙醇缺失)小鼠游泳速度极显著加快(P<0.01),小鼠运动能力增强。其他单物质缺失组游泳速度无明显变化(P>0.05),对小鼠运动能力影响不明显。说明醛类物质起主要作用的是乙醛,醇类物质起主要作用的是β-苯乙醇,二元酸类物质起主要作用的是辛二酸、壬二酸,其他物质虽然有一定作用趋势但是作用效果不明显。
乙醛是饮酒养成“酒瘾”的原因,可与人体内的脱氧核糖核酸(deoxyribonucleic acid,DNA)和蛋白质共价结合,形成的各种DNA加成产物和乙醛-蛋白质加成产物(acetaldehyde protein adduct,APA)干扰细胞功能,引起酶活性降低或丢失、DNA修复蛋白功能异常[39]、线粒体和肝组织的微管结构损伤、脂过氧化反应,损害肝细胞[40]。同时乙醛也会干扰谷胱甘肽过氧化物酶水平,提高机体的抗氧化压力;造成局部结肠黏膜的损害,引发大肠道黏膜的恶变[15];导致微管功能障碍,产生糖缺失转铁蛋白(酒精性肝病特异性标志物),干扰营养产物的运送[41],对小鼠的行为能力影响较大。β-苯乙醇的摄入或经由肌肤直接接触后,对眼部、肌肤、黏膜和呼吸道产生强烈刺激作用,接触后引起头痛、眩晕、恶心、腹泻、咳嗽、气短等[42],对小鼠的行为能力产生负作用。有研究证明,壬二酸具有抗炎功能[43],可以减少活性氧和炎性因子[44],具有抗增生和抗细胞毒素[45]以及抗动脉粥样硬化作用[46],利于增强小鼠行为能力。
综上所述,乙醛、β-苯乙醛是豉香型白酒主要的致醉物质,在实际生产中,应控制其含量。而辛二酸、壬二酸都对豉香型白酒有降低醉酒程度作用,在实际生产中,可以适当的增加其含量。
2.3 主要风味成分缺失对乙醇代谢酶及急性酒精性肝损伤的影响
根据酒后小鼠肝脏ADH、ALDH活性,血清ALT、AST浓度和肝脏SOD、MDA水平的变化,可判断小鼠乙醇代谢变化的机理以及急性酒精性肝损伤的归因,不同主要风味成分缺失配制酒酒样对小鼠乙醇代谢酶和急性酒精性肝损伤的影响见图2。
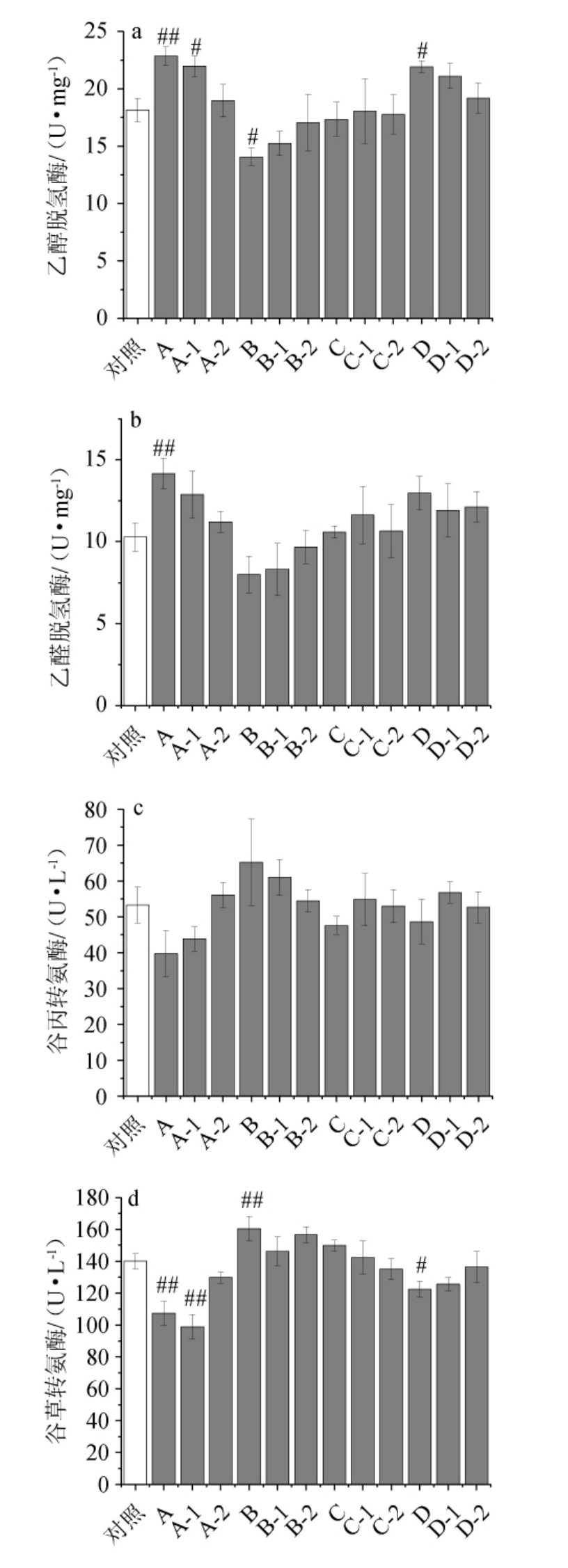
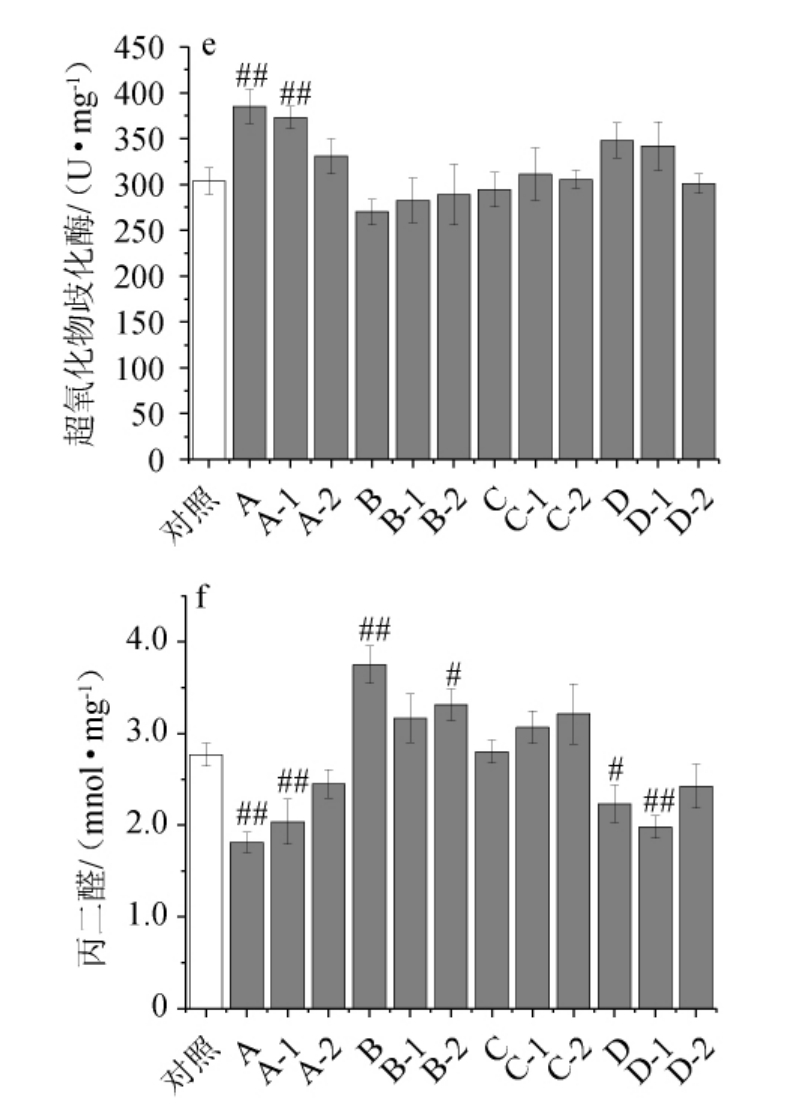
图2 不同配制酒酒样对乙醇代谢酶和急性酒精性肝损伤的影响
Fig.2 Effect of different blending liquors samples on ethanol metabolizing enzymes and acute alcoholic liver injury
由图2可知,与对照组相比,灌胃不同的豉香型主要风味成分缺失酒样后,关于ADH活性,A组(所有醛缺失)极显著升高25.94%(P<0.01),A-1组(乙醛缺失)显著升高21.06%(P<0.05),B组(所有二元酸缺失)显著降低22.43%(P<0.05),D组(所有醇缺失)显著升高20.83%(P<0.05);关于ALDH活性,A组(所有醛缺失)极显著升高37.58%(P<0.01),说明小鼠主要通过影响ADH活性影响乙醇代谢。对于血清ALT,各组无显著性差异(P>0.05);对于血清AST,A组(所有醛缺失)极显著降低23.36%(P<0.01),A-1组(乙醛缺失)极显著降低29.37%(P<0.01);B组(二元酸缺失)极显著升高14.63%(P<0.01),说明小鼠主要通过影响血清AST水平影响肝脏抗氧化能力。对于肝脏SOD,A组(所有醛缺失)极显著升高26.77%(P<0.01),A-1组(乙醛缺失)极显著升高22.98%(P<0.01);对于肝脏MDA,A组(所有醛缺失)极显著降低34.51%(P<0.01),A-1组(乙醛缺失)极显著降低26.36%(P<0.01),B组(二元酸缺失)显著升高35.47%(P<0.05),B-2组(壬二酸缺失)显著升高19.66%(P<0.05),D组(所有醇缺失)显著降低19.34%(P<0.05),D-1组(β-苯乙醇缺失)极显著降低28.45%(P<0.01),说明小鼠主要通过影响肝脏MDA水平影响肝脏抗氧化、抗脂质过氧化能力。
总的来说,豉香型白酒中主要风味成分对醉酒程度的调节作用主要是通过抑制ADH活性,影响肝脏乙醇代谢;通过调节血清AST水平,影响急性酒精性肝损伤;调节肝脏MDA水平,影响肝脏抗氧化、抗脂质过氧化。
3 结论
本研究着重探讨了豉香型白酒的主要风味成分对其醉酒程度的调节作用,同时还通过对小鼠体内乙醇代谢关键酶及急性肝损伤中关键生物参数的检测,研究了醉酒程度调控与乙醇代谢以及急性酒精性肝损伤之间的交叉关联。结果发现,豉香型白酒主要风味成分对酒的醉酒程度及乙醇代谢和急性酒精性肝损伤保护具有重要作用。其中,二元酸类物质是主要的降低醉酒程度的因子,醛类物质和醇类物质则相反,二元酸二乙酯类物质对醉酒程度的作用不大。二元酸类物质中辛二酸和壬二酸都有较好的降低醉酒程度的作用,能有利于促进血液乙醇代谢,同时提升小鼠记忆、运动能力。醛类、醇类物质中乙醛、β-苯乙醛则相反。这些成分对乙醇代谢以及急性酒精性损伤的调节作用主要是通过影响酒后肝脏乙醇脱氢酶活性以及血清谷草转氨酶活性和肝脏丙二醛含量。本研究探究豉香型白酒醉酒程度中醛类物质和豉香型白酒主要风味成分对醉酒程度的调节作用及作用机理,挖掘了新的低醉酒程度调控因子,对白酒的生产工艺提供了方向,为高质量白酒的生产提供了理论支持,为解酒保肝类药物的研制提供了数据支撑。后续可补充完善其他酒类成分或者外加解酒保肝类物质调节醉酒效果;与酒类产品实际生产相结合,进一步明确具体控制参数;继续利用豚鼠、兔、犬等试验加以证明,最后再与人体醉酒研究相结合,从而确立小鼠醉酒程度评价和人体醉酒程度研究之间的关联,进行进一步研究。
[1]WEI D,LI L,HE S,et al.Improving the lipid oxidation in pork fat processing for Chi-aroma Baijiu through pretreatments and segmented soaking with liquor[J].LWT-Food Sci Technol,2020,130:109624.
[2]杨帅,皇甫洁,董建辉,等.清雅型“玉冰烧”白酒酒体风格特征研究[J].中国酿造,2020,39(4):49-52.
[3] VRDOLJAK J, KUMRIC M, TICINOVIC KURIR T, et al.Effects of wine components in inflammatory bowel diseases[J].Molecules, 2021,26(19):5891.
[4] BARBHAIYA M, LU B, SPARKS J A, et al.Influence of alcohol consumption on the risk of systemic lupus erythematosus among women in the nurses'health study cohorts[J].Ar C Res,2017,69(3):384-392.
[5] MITCHELL T, JEFFREY G P, DE BORE B, et al.Type and pattern of alcohol consumption is associated with liver fibrosis in patients with nonalcoholic fatty liver disease[J].Am J Gastroenterol,2018,113(10):1484-1493.
[6] KRITTANAWONG C, ISATH A, ROSENSON R S, et al.Alcohol consumption and cardiovascular health[J].Am J Med,2022,135(10):1213-1230.
[7]YASAR S.Relation between alcohol consumption in midlife and dementia in late life[J].Brit Med J,2018,362:k3164.
[8]PEDRO-BOTET J,MILLÁN NU′ÑEZ-CORTÉS J,CHILLARÓN J J,et al.Severity of statin-induced adverse effects on muscle and associated conditions:data from the DAMA study[J].Expert Opin Drug Safety,2016,15(12):1583-1587.
[9]AMBERBIR A,LIN S H,BERMAN J,et al.Systematic review of hypertension and diabetes burden,risk factors,and interventions for prevention and control in Malawi: The NCD BRITE Consortium[J].Global Heart,2019,14(2):109-118.
[10]王洪京,郭峰.酒精性肝病中医研究进展近况[J].山东中医杂志,2000(6):377-380.
[11]CHOI Y J,LEE D H,HAN K D,et al.The relationship between drinking alcohol and esophageal, gastric or colorectal cancer: A nationwide population-based cohort study of South Korea[J].Public Lib Sci,2017,12(10):e0185778.
[12]LI H,QIN D,WU Z,et al.Characterization of key aroma compounds in Chinese Guojing sesame-flavor Baijiu by means of molecular sensory science[J].Food Chem,2019,284:100-107.
[13] HONG J, ZHAO D, SUN B.Research progress on the profile of trace components in Baijiu[J].Food Rev Int,2021,13:1-27.
[14]彭斌.白酒醉度检测模型参数改进及微量成分低醉机理研究[D].广州:华南理工大学,2020.
[15]谢佳.杂醇、酸、酯组成及氨基酸对白酒醉度的调节作用[D].广州:华南理工大学,2018.
[16]WU Z Q,TIAN X F,HE S G,et al.Evaluation of intoxicating effects of liquor products on drunken mice[J].Med Chem Comm,2017,8(1):122-129.
[17]XIE J,TIAN X,HE S,et al.Evaluating the intoxicating degree of liquor products with combinations of fusel alcohols,acids,and esters[J].Molecules,2018,23(6):1239.
[18]彭斌,张敬媛,何松贵,等.白酒醇酸酯比率对小鼠酒后乙醇代谢及行为能力的影响[J].中国酿造,2022,41(1):103-108.
[19] FAN H, FAN W, XU Y.Characterization of key odorants in Chinese Chixiang aroma-type liquor by gas chromatography-olfactometry,quantitative measurements,aroma recombination,and omission studies[J].J Agr Food Chem,2015,63(14):3660-3668.
[20]曾新安,张本山,于淑娟.豉香型米酒特征香气成分研究[J].华南理工大学学报(自然科学版),2001(12):93-95.
[21]黄清意,李湘銮,费永涛,等.陈肉酝浸对豉香型白酒风味影响的研究进展[J].食品与发酵工业,2020,46(19):284-288.
[22]张五九,何松贵,韩兴林,等.豉香型白酒风味成分分析研究[J].酿酒科技,2010(12):58-64.
[23] GIRALDO L F, PASSINO K M, CLAPP J D, et al.Dynamics of metabolism and decision making during alcohol consumption:Modeling and analysis[J].IEEE Trans Cybern,2017,47(11):3955-3966.
[24] TSOU H H, TSAI H C, CHU C T, et al.Cigarette smoke containing acrolein upregulates EGFR signaling contributing to oral tumorigenesis in vitro and in vivo[J].Cancers,2021,13(14):3544.
[25]LIAO S,ZHANG J,SHI S,et al.Association of aldehyde exposure with cardiovascular disease[J].Ecotox Environ Safety,2020,206:111385.
[26]SAFIEDDIN ARDEBILI S M,SOLMAZ H, I˙PCI D,et al.A review on higher alcohol of fusel oil as a renewable fuel for internal combustion engines:Applications,challenges,and global potential[J].Fuel,2020,279:118516.
[27]蒋洋,张翠英,李于,等.酒类风味物质对人体乙醇代谢影响的研究进展[J].食品科学,2021,42(15):242-250.
[28]张金修,张雪飞,郭芳文.新型白酒勾兑技术与市场分析[J].酿酒科技,2014(4):120-121.
[29]SMITH P G,ROQUE D,CHING M M,et al.The role of eicosanoids in gynecological malignancies[J].Front Pharmacol,2020,11:1233.
[30] BARRY A R, DIXON D L.Omega-3 fatty acids for the prevention of atherosclerotic cardiovascular disease[J].Cochrane Database Syst Rev,2021,41(12):1056-1065.
[31]XU T,ZHONG Y,CHEN Q,et al.Modulating the digestibility of cassava starch by esterification with phenolic acids[J].Food Hydrocolloid,2022,127:107432.
[32]CHI Y C,LEE S L,LEE Y P,et al.Modeling of human hepatic and gastrointestinal ethanol metabolism with kinetic-mechanism-based full-rate equations of the component alcohol dehydrogenase isozymes and allozymes[J].Chem Res Toxicol,2018,31(7):556-569.
[33] JIANG Y, ZHANG T, KUSUMANCHI P, et al.Alcohol metabolizing enzymes,microsomal ethanol oxidizing system,cytochrome P450 2E1,catalase,and aldehyde dehydrogenase in alcohol-associated liver disease[J].Biomedicines,2020,8(3):50.
[34]KANG W,CHOI D,PARK T.Dietary suberic acid protects against UVBinduced skin photoaging in hairless mice[J].Nutrients, 2019, 11(12):2948.
[35]TIAN J,LIU C,XIANG H,et al.Investigation on the antidepressant effect of sea buckthorn seed oil through the GC-MS-based metabolomics approach coupled with multivariate analysis[J].Food Funct,2015,6(11):3585-3592.
[36]RAVETTI S,GUALDESI M S,TRINCHERO-HERNÁNDEZ J S,et al.Synthesis and anti-HIV activity of novel 2',3'-dideoxy-3'-thiacytidine prodrugs[J].Bioorg Med Chem,2009,17(17):6407-6413.
[37]YOU M,ARTEEL G E.Effect of ethanol on lipid metabolism[J].J Hepatol,2019,70(2):237-248.
[38]GRECO R,DEMARTINI C,ZANABONI A M,et al.Chronic and intermittent administration of systemic nitroglycerin in the rat induces an increase in the gene expression of CGRP in central areas:potential contribution to pain processing[J].J Headache Pain,2018,19(1):51.
[39]ROCCO A,COMPARE D,ANGRISANI D,et al.Alcoholic disease:liver and beyond[J].World J Gastroenterol,2014,20(40):14652-14659.
[40] YAN T, ZHAO Y, JIANG Z, et al.Acetaldehyde induces cytotoxicity via triggering mitochondrial dysfunction and overactive mitophagy[J].Mol Neurobiol,2022,59(6):3933-3946.
[41]KONG L Z,CHANDIMALI N,HAN Y H,et al.Pathogenesis,early diagnosis,and therapeutic management of alcoholic liver disease[J].Int J Mol Sci,2019,20(11):2712.
[42] HAN P, SCHRIEVER V A, PETERS P, et al.Influence of airflow rate and stimulus concentration on olfactory event-related potentials(OERP)in humans[J].Chem Senses,2018,43(2):89-96.
[43]HUNG W H,CHEN P K,FANG C W,et al.Preparation and evaluation of azelaic acid topical microemulsion formulation: In vitro and in vivo study[J].Pharmaceutics,2021,13(3):410.
[44] GOLLNICK H, LAYTON A.Azelaic acid 15% gel in the treatment of rosacea[J].Expert Opin Pharmacother,2008,9(15):2699-2706.
[45]ZHANG D,JIN Y,YANG T,et al.Antiproliferative and immunoregulatory effects of azelaic acid against acute myeloid leukemia via the activation of notch signaling pathway[J].Front Pharmacol,2019,10:1396.
[46]LITVINOV D,SELVARAJAN K,GARELNABI M,et al.Anti-atherosclerotic actions of azelaic acid,an end product of linoleic acid peroxidation,in mice[J].Atherosclerosis,2010,209(2):449-454.