酿酒酵母(Saccharomyces cerevisiae)是应用于乙醇生产行业的一类主要微生物,酒精发酵过程中酿酒酵母受到各种环境因子的胁迫,如乙醇[1-2]、高渗透压[3]、呋喃醛[4]、酚类化合物[5]、硫化物[6]和高酸[7]等。其中,在酒精发酵过程中因弱有机酸而带来的弱酸(低pH)胁迫是的常见胁迫之一[8]。近年来,酿酒酵母的弱酸胁迫响应机制研究逐渐获得了科研工作者的关注,目前,关注的弱有机酸主要有甲酸[9-10]、乙酸[11]、柠檬酸[12]、绿原酸[13]、乳酸[14]、油酸[15]。实际上,酒精发酵过程中酿酒酵母应对的环境远比已报道的情况复杂,因此,如何优化发酵环境、提高酵母的生产力、厘清酿酒酵母对弱有机酸胁迫的响应机制是目前面临的重大科学问题。辛酸作为一种弱有机酸,高浓度的辛酸对酿酒酵母具有毒性,胁迫酵母细胞的生长[16-17]。酿酒酵母肯定有一套响应辛酸胁迫的应答机制,但目前学术界对该机制的解析欠深入,未获得统一认识。基于此,从酒精发酵的视角,系统梳理了近40年来有关辛酸对酿酒酵母生长影响的文献,就辛酸对酿酒酵母的影响、酒精发酵过程中辛酸的来源和酿酒酵母应对辛酸胁迫的部分应答机制进行了综述,以期为全面解析酿酒酵母对辛酸胁迫的应答机制以及开发辛酸高耐受菌株提供参考。
1 辛酸对酿酒酵母的影响
辛酸[CH3(CH2)6COOH]是一种脂溶性中链饱和脂肪酸,可以有效治疗与真菌滋生有关的疾病,如阴道酵母菌感染、念珠菌感染[18]和鹅口疮[19]等,说明辛酸对真菌具有明显的抑制效应。酒精发酵过程中,辛酸是公认的发酵抑制剂,在果汁发酵过程中随着乙醇浓度的升高和pH值的降低,对酿酒酵母的毒性也逐渐增强[16],这可能与辛酸在水中的微溶解性有关。随着发酵的进行,乙醇的产量逐渐增多,辛酸在发酵液中的溶解度逐渐升高,提高了辛酸对酵母的毒性。有研究表明,辛酸能提高乙醇对酵母的致死效果,并且致死率与辛酸的浓度呈指数关系[20],高浓度的辛酸对酿酒酵母的生长产生胁迫,导致发酵停滞[21]。
2 酒精发酵过程中辛酸的来源
为了探明酒精发酵过程中酿酒酵母响应辛酸胁迫的机制,首先需明确该过程中辛酸的来源,有研究表明,酒精发酵过程中的辛酸主要来源于原材料和酿酒酵母的代谢。
2.1 来源于原材料的辛酸
谷物类、水果类等糖质原料均可作为酒精发酵的原材料。过去已从肉豆蔻(Myristica fragrans)、柠檬草(Cymbopogoncitratus)、苹果(Malusdomestica)、椰子(Cocosnucifera)、棕榈(Trachycarpus fortunei)、啤酒花(Humulus lupulus)等多种原材料中检测出了辛酸,其中棕榈仁油和椰子油是天然辛酸的主要来源[22]。近年来,HUANG M Z等[23]利用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法测定了贵州省5个产地成熟刺梨的挥发性风味成分时,发现盘州地区的辛酸含量最高(约1.3 mg/L),贵定地区的辛酸含量最低(约0.04 mg/L),大方、龙里和水城地区的辛酸含量均约为0.1 mg/L。杜薇等[24]在测定5种野生苹果(花红、新疆野苹果、西府海棠、海棠花和楸子)的挥发性风味成分时,发现辛酸含量为95.99(新疆野苹果)~346.59 μg/kg(楸子)。付勋等[25]从玫瑰香橙(Citrus sinensis)果汁中检测出的辛酸含量约占总挥发性物质的4.04%。张琦婧[26]研究发现,诺丽(Morinda citrifolia)果汁中含有大量辛酸,并且是其“腐臭干酪”类气味的主要来源。
酒精发酵结束后,辛酸与醇类物质形成相应的酯类物质,辛酸乙酯和辛酸异戊酯是酒类产品中常见的辛酸酯类物质,已在浓香型白酒[27]、枳椇高粱混酿酒[28]、葛根蒸馏酒[29]、小曲清香型白酒[30]、凯里糯米酒[31]、黑糯米酒[32]等酒类产品中检测到辛酸乙酯。有趣的是,部分水果的果汁中未检出辛酸和辛酸乙酯,但在相应的水果酒中却检出了辛酸乙酯。李凯等[33]在火龙果汁中未检出辛酸和辛酸乙酯,但在火龙果发酵酒中却检出了辛酸乙酯。胡来丽等[34]在百香果汁中仅检测到295.34 μg/L的辛酸乙酯,在百香果发酵酒中也检测到了465.95 μg/L的辛酸乙酯。结果表明,无论在原材料中是否检测到辛酸,酒精发酵过程中原材料并不是辛酸的唯一来源。
2.2 来源于酿酒酵母代谢的辛酸
研究表明,酿酒酵母的自身代谢可以产生辛酸,进而形成辛酸乙酯[35]。酿酒酵母中脂肪酸(辛酸是其中之一)的合成主要是在细胞质中的脂肪酸合酶(fatty acid synthase,FAS)I系统中完成,该系统是具有多酶活性的多结构域复合体[36]。酿酒酵母中脂肪酸的具体合成途径如图1所示[37-39]。来源于糖酵解途径(glycolysis)的乙酰辅酶A(coenzyme A,CoA)是脂肪酸合成的初始单位,丙二酰CoA是二碳供应单位。乙酰CoA羧化酶(acetyl-CoA carboxylase)催化乙酰CoA合成丙二酰CoA,然后在酰基转移酶(acyltransferase)作用下,乙酰CoA和丙二酰CoA分别将酰基部分转移到酰基载体蛋白(acyl carrier protein,ACP),随后,二者在酮基合成酶(ketosynthase)的催化下脱羧缩合,形成酰基载体蛋白结合的β-酮酰基中间体。缩合后,β-酮酰基中间体通过烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)依赖型酮基还原酶(ketoreductase)、脱水酶(dehydratase)以及另一种NADPH依赖型烯酰基还原酶(enoylreductase)的依次处理,得到完全饱和的酰基中间体。最终特定链长的脂肪酸主要通过底物特异性硫酯酶(thioesterase)来水解相应链长的酯酰ACP得到,即短、中、长链脂肪酸。
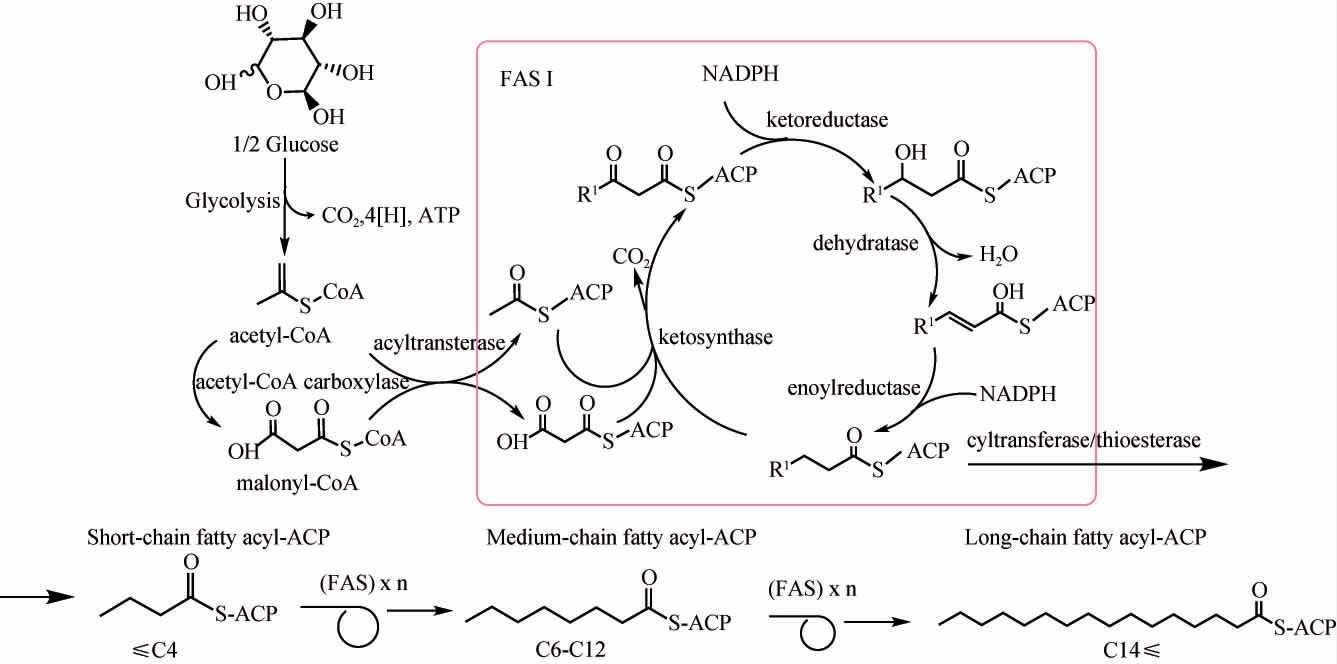
图1 酿酒酵母细胞内脂肪酸的合成途径
Fig.1 Synthesis pathway of fatty acids in Saccharomyces cerevisiae
辛酸及其相应的中链脂肪酸在生物燃料[40]、功能性食品[41]、医药行业和饲料[42]等行业具有广泛应用,促使通过改造酿酒酵母的辛酸/中链脂肪酸的合成途径[43]达到高产目的成为酿酒酵母的研究热点。乙酰CoA羧化酶催化乙酰CoA合成丙二酰CoA是脂肪酸合成途径的限速步骤。当前针对酿酒酵母高产辛酸/中链脂肪酸的基因改造主要集中在该限速步骤和FAS I系统[43]。研究显示,酵母中同时表达人类的hFAS△TE基因、枯草芽孢杆菌(Bacillus subtilis)的PPT基因和兔的TE II基因,可提高短链脂肪酸产量达64倍,其中辛酸产量达到82 mg/L,己酸和癸酸的总量达到111 mg/L[44]。酵母菌FAS的丙二酰棕榈酰转移酶(malonyl palmitoyl transferase,MPT)结构域上的精氨酸和赖氨酸交换位置('R1834K')即形成酵母突变体FAS。在该突变体中,当丙二酰CoA减少时,短酰基链(如八酰基CoA)先释放出来,然后通过硫酯酶水解八酰基CoA,即可释放游离的辛酸[45-46]。通过该基因工程途径,在面包酵母中辛酸产量可高达245 mg/L[46]。无论是野生菌株或是工程菌株,酿酒酵母均可发酵产辛酸/中链脂肪酸,不同菌株的产量有极大差异。有学者认为,通过改造脂肪酸的合成途径提高短中链脂肪酸及其衍生物的产量是将来研究的方向[43]。实际上,按照该逻辑,由于中链脂肪酸(辛酸)对酿酒酵母具有毒性,因此随着中链脂肪酸产量的增加,如何提高酿酒酵母对中链脂肪酸(辛酸)的耐受性是另一个非常重要的科学问题。
3 酿酒酵母对辛酸胁迫的应答机制
3.1 增加细胞膜的通透性
LIU P等[47]在研究己酸、辛酸和癸酸对酿酒酵母生长的影响时发现,当辛酸浓度>1 mmol/L时,酿酒酵母的生长完全受到抑制,而且毒性随着脂肪酸链的增加和培养基pH值的下降而提高,芯片数据显示,辛酸的攻击可能降低了酿酒酵母细胞膜的完整性,这种完整性的降低虽然对细胞膜的流动性没有影响,但是直接使得细胞膜的通透性增加。众所周知,细胞膜是具有高度选择性的,倘若细胞膜的通透性增加,意味着更多的物质能够进出细胞,可能给细胞带来更大的伤害,因此,辛酸使细胞的通透性增加更确切的说是一种损伤而非应答解决问题的机制。同时,也有学者研究发现,向培养基中添加油酸能提高酵母细胞对辛酸的耐受性,可以降低细胞膜的通透性[47]。BESADA-LOMBANA P B等[48]将酿酒酵母乙酰CoA羧化酶1157位的丝氨酸替换为丙氨酸后阻止了该位点的磷酸化,将该基因在菌株BY4741中表达后,菌株的油酸产量提高了3.1倍(无辛酸胁迫)或1.6倍(有辛酸胁迫),在0.9 mmol/L的辛酸下胁迫24 h,该菌株的密度比原始菌株要高10倍多,这为避免添加外源油酸来降低细胞膜的通透性提供了新思路。
实际上,在利用酿酒酵母生产生物燃料的过程中,添加油酸来缓解膜的通透性是不够的,因此,近年来多位学者尝试从基因工程的角度来改造酿酒酵母,使其具备高浓度的中链脂肪酸的耐受性。LIU H等[49]在酿酒酵母中共表达了Lem3和Sfk1基因(二者均是膜不对称调节因子),从而重塑了膜磷脂的分布,使得脑磷脂在质膜内叶中的积累量增加,进而使得膜电位和完整性分别提高了131.5%和29.2%,在应对己酸、辛酸和癸酸的胁迫下,OD600 nm值分别提高了79.6%、73.4%和57.7%。另外,酿酒酵母生成的中链脂肪酸能否全部排放至发酵液中与细胞壁的厚度与渗漏性有关。WANG J J等[50]在拉格酵母中利用自克隆技术破坏掉β-1,3-葡聚糖合成酶的催化亚基(fks1)后,增加了细胞壁的厚度,使得辛酸和癸酸渗出量分别减少了39.9%和63.41%,因此,通过改变酵母细胞壁的厚度可控制胞内中链脂肪酸的渗出量。
3.2 升高H+-ATP酶的活性
研究表明,在含4~50 mg/L辛酸的条件下培养的酿酒酵母IGC 3507III的质膜腺苷三磷酸(adenosine triphosphate,ATP)酶活性是无辛酸加入的1.5倍,当从培养基中去除辛酸后,这种情况迅速逆转[51]。H+-ATP酶活性的升高与其编码基因PMA1相关,低浓度辛酸对H+-ATP酶具有激活作用,同时可以观察到PMA1的表达量也得到了提高[52]。这种酶活性的提高往往在指数生长早期达到最大值,H+-ATP酶活性激活直接与pH下降有关,并且能观察到因pH值的下降而使细胞的活力受到损害[53]。在辛酸亚致死浓度下对酿酒酵母进行驯化或者是将酿酒酵母细胞短暂的(1 h)置于轻度辛酸胁迫条件下,可以使酿酒酵母获得对辛酸致死浓度的抗性,这种适应性可能来自于质膜转运蛋白受到诱导后介导锌酸盐主动流出细胞所致,另外将酿酒酵母细胞短暂置于轻度乙醇胁迫下也可提高酿酒酵母对辛酸的抗性,但是这种交叉响应获得的抗性要低于上述水平,进一步的研究发现,无论是短暂的使用辛酸胁迫还是乙醇胁迫均能激活质膜上的H+-ATP酶的活性[54]。
学者们对酿酒酵母在辛酸胁迫下H+-ATP酶活性升高的机理进行了总结归纳,认为辛酸的质子和阴离子在细胞质释放后,不能穿过细胞膜的疏水双分子层而滞留在细胞内,使得细胞内积累高浓度的质子而酸化,为了抵抗胞内酸化,酵母细胞会增加H+-ATP酶的活性,排出高浓度的质子,导致大量能量丧失,由于胞质的低pH值,排出的质子会和阴离子重新结合,再次穿过细胞膜进入细胞内,从而形成循环,导致细胞内的能量不断被消耗,随着时间的增加,细胞内pH值(intracellular pH,pHi)不能维持在正常的生理pH水平[20,55]。因此H+-ATP酶活性的提高可能是酿酒酵母应对辛酸胁迫的一种应对机制,但是目前针对单一的辛酸对酿酒酵母的胁迫研究暂未见报道,需要进一步研究。
4 结论与展望
酿酒酵母最适pH范围为4.5~5.0,而酒类酿造过程中所控制的pH值为3.0~3.6,因此,必然产生低pH值(高酸)胁迫[11]。酒精发酵过程中,高浓度的辛酸抑制了酿酒酵母的生长。酿酒酵母肯定具有一套完善的辛酸胁迫响应机制,但是目前知之甚少,已有报道的增加细胞膜通透性以及升高H+-ATP酶活性的机制需要进一步验证。辛酸作为生产生活中广泛应用的产品,仅从棕榈油和椰子油中获取既不环保也不利于可持续发展,基于代谢途径改造从微生物中获取的策略是获取辛酸的可行路径,然而由于辛酸的毒性,获得辛酸高耐受性菌株对于高产辛酸的获得就显得尤为重要。以上均建立在酿酒酵母响应辛酸胁迫机制完全解析的基础之上,因此对该问题的阐释对于解决酒精发酵中的迟滞、开发辛酸高耐受性工程菌株以及获得具有特殊需求的高密度发酵菌株,推动乙醇生产行业和清洁能源产业的发展具有重要意义,同时对于其他脂肪酸的研究也具有重要的参考价值。
[1]DE-MOURA-FERREIRA M A,DA-SILVEIRA F A,DA-SILVEIRA W B.Ethanol stress responses in Kluyveromyces marxianus:current knowledge and perspectives[J].Appl Microbiol Biot,2022,106(4):1341-1353.
[2]SHEN D X,HE X L,WENG P F,et al.A review of yeast:high cell-density culture,molecular mechanisms of stress response and tolerance during fermentation[J].FEMS Yeast Res,2022,22(1):1-16.
[3] SIPICZKI M.Yeast two- and three-species hybrids and high-sugar fermentation[J].Microb Biotechnol,2019,12(6):1101-1108.
[4]LIU Z L.Reasons for 2-furaldehyde and 5-hydroxymethyl-2-furaldehyde resistance in Saccharomyces cerevisiae: current state of knowledge and perspectives for further improvements[J].Appl Microbiol Biot, 2021,105(8):2991-3007.
[5]CUNHA J T,ROMANI A,COSTA C E,et al.Molecular and physiological basis of Saccharomyces cerevisiae tolerance to adverse lignocellulosebased process conditions[J].Appl Microbiol Biot,2019,103(1):159-175.
[6]AILER Š,JAKABOVÁ S,BENEŠOVÁ L,et al.Wine faults:state of knowledge in reductive aromas,oxidation and a typical aging, prevention, and correction methods[J].Molecules,2022,27(11):3535.
[7]LI B,LIU N,ZHAO X B.Response mechanisms of Saccharomyces cerevisiae to the stress factors present in lignocellulose hydrolysate and strategies for constructing robust strains[J].Biot Biofuels Bioprod, 2022, 15(1):28.
[8]刘兴艳,贾博,赵芳,等.酿酒酵母对弱有机酸胁迫的应激机制研究进展[J].食品与发酵工业,2013,39(6):125-129.
[9] ZENG L J, SI Z Y, ZHAO X M, et al.Metabolome analysis of the response and tolerance mechanisms of Saccharomyces cerevisiae to formic acid stress[J].Int J Biochem Cell Biol,2022,148:106236.
[10] ZENG L J, HUANG J X, FENG P X, et al.Transcriptomic analysis of formic acid stress response in Saccharomyces cerevisiae[J].World J Microb Biot,2022,38(2):34.
[11]HU J J,DONG Y C,WANG W,et al.Deletion of Atg22 gene contributes to reduce programmed cell death induced by acetic acid stress in Saccharomyces cerevisiae[J].Biotechnol Biofuels,2019,12(1):298.
[12]褚瑞超.酿酒酵母柠檬酸胁迫机制研究[D].新乡:河南科技学院,2023.
[13]杨超,肖媚,张菡,等.苹果酒发酵过程中绿原酸胁迫对酿酒酵母生理特性的影响[J].中国食品学报,2022,22(1):116-124.
[14] DENG N, DU H, XU Y.Cooperative response of Pichia kudriavzevii and Saccharomyces cerevisiae to lactic acid stress in Baijiu fermentation[J].J Agr Food Chem,2020,68(17):4903-4911.
[15]程迅,杜秀秀,王寒冬,等.脂肪酸延长酶缺陷对酵母细胞脂质代谢及油酸胁迫响应的影响[J].中国细胞生物学学报,2018,40(9):1494-1503.
[16]LEGRAS JL,ERNY C,LE JEUNE C,et al.Activation of two different resistance mechanisms in Saccharomyces cerevisiae upon exposure to octanoic and decanoic acids[J].Appl Environ Microbiol,2010,76(22):7526-7535.
[17] YU Z H, HUANG G D, HUANG X Y, et al.A comparative study of yeasts for Rosa roxburghii wine fermentation[J].Fermentation,2022,8(7):311.
[18]TAKAHASHI M,INOUE S,HAYAMA K,et al.Inhibition of Candida mycelia growth by a medium chain fatty acids,capric acid in vitro and its therapeutic efficacy in murine oral candidiasis[J].Med Mycol J,2012,53(4):255-261.
[19] HUANG C B, ALIMOVA Y, MYERS T M, et al.Short- and mediumchain fatty acids exhibit antimicrobial activity for oral microorganisms[J].Arch Oral Biol,2011,56(7):650-654.
[20]VIEGAS C A,SA-CORREIA I.Effects of low temperatures(9-33 degrees C)and pH(3.3-5.7)in the loss of Saccharomyces cerevisiae viability by combining lethal concentrations of ethanol with octanoic and decanoic acids[J].Int J Food Microbiol,1997,34(3):267-277.
[21]VIEGAS C A,FERNANDA ROSA M,SA-CORREIA I,et al.Inhibition of yeast growth by octanoic and decanoic acids produced during ethanolic fermentation[J].Appl Environ Microbiol,1989,55(1):21-28.
[22]章霞.逆向脂肪酸β-氧化途径高效合成中链脂肪酸的研究[D].南京:南京农业大学,2018.
[23] HUANG M Z, LI T T, HARDIE W J, et al.Comparative characterization and sensory significance of volatile compounds in Rosa roxburghii Tratt fruit from five geographic locations in Guizhou,China[J].Flavour Frag J,2022,37(3):163-180.
[24]杜薇,陈丽娟,李瑞,等.5种苹果野生资源果实香气物质的分析[J].西北农业报,2021,30(10):1547-1555.
[25]付勋,聂青玉,李翔,等.HS-SPME/GC-MS测定玫瑰香橙果汁挥发性成分[J].贵州师范大学学报(自然科学版),2021,39(4):70-75,111.
[26]张琦婧.热处理对诺丽果汁理化性质及风味影响研究[D].沈阳:沈阳农业大学,2020.
[27]田静,莫晓慧,赵耀等.紫糯麦-糯高粱复合原粮浓香型白酒的风味物质及危害成分分析[J].食品工业科技,2023,44(4):96-107.
[28]赵敏惠,易媛,张强,等.枳椇高粱共酿蒸馏酒酿造工艺优化及其特征风味物质和体外抗氧化活性[J].食品工业科技,2023,44(1):224-232.
[29]黄小雨.葛根蒸馏酒酿造工艺及其品质研究[D].重庆:西南大学,2022.
[30]王喆.特色小曲清香型白酒关键挥发性化合物及其相关微生物分析研究[D].武汉:华中农业大学,2021.
[31]乔世玉,王洪琳,杨宏,等.贵州不同地区发酵糯米酒风味对比分析[J].酿酒科技,2021(10):17-23,35.
[32]王洪琳.黑糯米酒特征风味物质分析及风味轮构建[D].贵阳:贵州大学,2020.
[33]李凯,王金晶,李永仙,等.红心火龙果果酒特征香气分析[J].食品与发酵工业,2019,45(13):217-223.
[34]胡来丽,秦礼康,王玉珠.百香果全果与果汁发酵酒滋味成分及香气成分对比[J].食品与机械,2021,37(12):10-19.
[35] LIAN J Z, ZHAO H M.Reversal of the β-oxidation cycle in Saccharomyces cerevisiae for production of fuels and chemicals[J].ACS Synth Biol,2015,4(3):332-341.
[36] MAIER T, LEIBUNDGUT M, BOEHRINGER D, et al.Structure and function of eukaryotic fatty acid synthases[J].Q Rev Biophys,2010,43(3):373-422.
[37]DELLOMONACO C,CLOMBURG J M,MILLER E N,et al.Engineered reversal of the β-oxidation cycle for the synthesis of fuels and chemicals[J].Nature,2011,476(7360):355-359.
[38]HEIL C S,WEHRHEIM S S,PAITHANKAR K S,et al.Fatty acid biosynthesis:chain-length regulation and control[J].Chembiochem,2019,20(18):2298-2321.
[39]VALENCIA L E,INCHA M R,SCHMIDT M,et al.Engineering Pseudomonas putida KT2440 for chain length tailored free fatty acid and oleochemical production[J].Commun Biol,2022,5(1):1363.
[40] BOHL M,BJØRNSHAVE A,LARSEN M K, et al.The effects of proteins and medium-chain fatty acids from milk on body composition,insulin sensitivity and blood pressure in abdominally obese adults[J].Eur J Clin Nutr,2017,71(1):76-82.
[41]YUAN T L,WANG L,JIN J,et al.Role medium-chain fatty acids in the lipid metabolism of infants[J].Front Nutr,2022,9:804880.
[42]陈倩倩,王金荣,王朋,等.中链脂肪酸的生物学功能及其在动物生产中的应用研究进展[J].中国畜牧杂志,2022,58(2):41-47.
[43]张云丰,何丹,卢欢,等.代谢工程改造酿酒酵母底盘细胞[J].科学通报,2021,66(3):310-318.
[44]LEBER C,CHOI J W,POLSON B,et al.Disrupted short chain specific β-oxidation and improved synthase expression increase synthesis of short chain fatty acids in Saccharomyces cerevisiae[J].Biotechnol Bioeng,2016,113(4):895-900.
[45] BAUMANN L, DOUGHTY T, SIEWERS V, et al.Transcriptomic response of Saccharomyces cerevisiae to octanoic acid production[J].Fems Yeast Res,2021,21(2):foab011.
[46] GAJEWSKI J, PAVLOVIC R, FISCHER M, et al.Engineering fungal de novo fatty acid synthesis for short chain fatty acid production[J].Nat Commun,2017,8:14650.
[47]LIU P,CHERNYSHOV A,NAJDI T,et al.Membrane stress caused by octanoic acid in Saccharomyces cerevisiae[J].Appl Microbiol Biot,2013,97(7):3239-3251.
[48] BESADA-LOMBANA P B, FERNANDEZ-MOYA R, FENSTER J, et al.Engineering Saccharomyces cerevisiae fatty acid composition for increased tolerance to octanoic acid[J].Biotechnol Bioeng,2017,114(7):1531-1538.
[49]LIU H,YUAN W J,ZHOU P,et al.Engineering membrane asymmetry to increase medium-chain fatty acid tolerance in Saccharomyces cerevisiae[J].Biotechnol Bioeng,2022,119(1):277-286.
[50]WANG J J,XU W N,LI X E,et al.Absence of fks1p in lager brewing yeast results in aberrant cell wall composition and improved beer flavor stability[J].World J Microb Biot,2014,30(6):1901-1908.
[51]VIEGAS C A,SA-CORREIA I.Activation of plasma membrane ATPase of Saccharomyces cerevisiae by octanoic acid[J].J Gen Microbiol,1991,137(3):645-651.
[52] VIEGAS C A, SUPPLY P, CAPIEAUX E, et al.Regulation of the expression of the H+-ATPase genes PMA1 and PMA2 during growth and effects of octanoic acid in Saccharomyces cerevisiae[J].Biochim Biophys Acta,1994,1217(1):65-73.
[53] VIEGAS C A, ALMEIDA P F, CAVACO M, et al.The H+-ATPase in the plasma membrane of Saccharomyces cerevisiae is activated during growth latency in octanoic acid-supplemented medium accompanying the decrease in intracellular pH and cell viability[J].Appl Environ Microb,1998,64(2):779-783.
[54]CABRAL M G,VIEGAS C A,SA-CORREIA I.Mechanisms underlying the acquisition of resistance to octanoic-acid-induced-death following exposure of Saccharomyces cerevisiae to mild stress imposed by octanoic acid or ethanol[J].Arch Microbiol,2001,175(4):301-307.
[55] ORIJ R, BRUL S, SMITS G J.Intracellular pH is a tightly controlled signal in yeast[J].Biochim Biophys Acta,2011,1810(10):933-944.