白酒作为中国销量最高的酒精饮品,其独特的酿造工艺使中国白酒含有丰富的活性物质,如有机酸及其酯类、酚类、吡嗪类、呋喃类、萜烯类等。其中白酒中的游离脂肪酸(free fatty acids,FFAs)在白酒风味和健康两个领域中都起到举足轻重的作用[1-2]。游离脂肪酸一方面是酒中主要香气成分脂肪酸乙酯形成的前体物质,对白酒香气及白酒后味形成有着重要作用[3-4];另一方面如亚油酸、亚麻酸这样的多不饱和脂肪酸,被公认为人体必需的健康物质[5-6]。白酒中游离脂肪酸(FFAs)主要由以下两种途径产生:粮食中含有丰富的脂肪,由脂肪酶水解为甘油及脂肪酸,一部分长链脂肪酸受微生物的β-氧化作用,进一步生成低级脂肪酸[7]。由酵母代谢产生,在其细胞质中乙酰辅酶A(coenzyme A,CoA)通过脂肪酸合成途径转化为脂肪酸,有助于细胞生长和细胞结构的维持[8-9]。因此白酒中FFAs无论是对白酒香气的形成,还是在白酒酿造过程中质量控制都起到重要作用。
现阶段白酒中FFAs的研究更关注中、短链等挥发性或半挥发性的游离脂肪酸以及其对白酒香气的影响[7],而长链的FFAs(通常碳链大于12个碳原子)由于其分子基团大、导致其沸点高、性质不稳定,在白酒中提取、检测困难,进而研究较少。长链脂肪酸自身具有重要的生理活性,且适量的长链FFAs能够使酒体香气舒缓,回味悠长,不会出现爆香及后味寡淡的现象[11]。因此,检测和控制白酒中的长链FFAs具有重要意义。然而,目前我国没有专门针对白酒中长链FFAs的检测标准,国家颁布的食品中的脂肪酸检测标准,即GB 5009.168—2016《食品中脂肪酸的测定》适用于脂肪酸含量较高的食品,如乳制品、动植物油脂等,方法定量限为13~26 mg/L[24],而酒类中FFAs含量一般低于10 mg/L,因此不适用于酒类中FFAs的检测。相关酒类产品大都采用高效液相色谱质谱联用法进行分析检测[11-12],高效液相色谱质谱仪价格高昂,普及率低,而气相色谱质谱(gas chro matography-mass spectrometer,GC-MS)具有谱库成熟、综合成本低的优点,更适合于实际生产质量控制。
气相色谱-质谱法具有谱库成熟、综合成本低,实际生产应用普遍的优点,其应用的前提是需要探究一套针对白酒产品中长链FFAs的高效提取方法。目前酒类物质中FFAs的提取方法主要有液液萃取法(liquid-liquid extraction,LLE)[10,13-14,17]、固相萃取法(solid-phase extraction,SPE)[15-16]、固相微萃取法(solid phase micro extraction,SPME)[18]、磁力搅拌吸附法(stir bar sorptive extraction,SBSE)[19]。其中固相微萃取法(SPME)及磁力搅拌吸附法(SBSE)虽不需要对样品进行预处理,但仅能检测到白酒中易挥发或半挥发的中短链FFAs,如辛酸、癸酸,对长链FFAs的萃取效率较低[16]。液液萃取法和固相萃取法是目前酒类产品中提取长链FFAs常用的方法。本研究比较了液液萃取和固相萃取两种脂肪酸提取方法,并探究长链FFAs的衍生试剂、优化色谱条件,建立了气相色谱-质谱联用同时测定月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、油酸、亚油酸共6种长链FFAs的检测方法,并根据该方法定量检测不同香型白酒中长链FFAs,全面地了解白酒中长链FFAs的构成与量比,为白酒健康及白酒口感的研究奠定基础。
1 材料与方法
1.1 材料与试剂
月桂酸、肉豆蔻酸、棕榈酸、油酸、亚油酸、硬脂酸、十七烷酸、棕榈酸乙酯、脂肪酸甲酯混合标准品(色谱纯):西格玛奥德里奇(上海)贸易有限公司;正己烷(色谱纯)、CH2Cl2(色谱纯)、戊烷(分析纯)、甲醇(色谱纯):天津市北联精细化学品开发有限公司;无水硫酸钠(优级纯):天津市北联精细化学品开发有限公司;三氟化硼(BF3)-甲醇(每100 mL甲醇中有14 g BF3):上海麦克林生化科技有限公司;浓硫酸、浓盐酸(分析纯):莱阳市康德化工有限公司。
52%vol浓香型白酒、54%vol芝麻香型白酒、53%vol清香型白酒、53%vol酱香型白酒、52%vol米香型白酒、42%vol凤香型白酒、45%vol豉香型白酒:市售。
1.2 仪器与设备
Agilent 7890A-5975C气相色谱质谱联用仪:美国安捷伦科技有限公司;RE-5220A型真空旋转蒸发仪:上海亚荣生化仪器厂;LC-DCY-12G型氮吹仪、LC-SPE-12固相萃取仪:上海力辰仪器科技有限公司;C18固相萃取小柱:天津博纳艾杰尔科技有限公司。
1.3 实验方法
1.3.1 样品衍生试剂优化
分别用BF3-甲醇法和甲醇-H2SO4法对脂肪酸标准溶液进行衍生化处理,具体方法为:1 mL脂肪酸标准品加入0.1 mLBF3-甲醇或2 mL甲醇和2滴浓H2SO4,在95 ℃条件下水浴20 min,酯化结束后加2 mL去离子和2 mL正己烷,收集有机相,氮气吹干后,加入2 mL正己烷复溶,测定酯化率。
1.3.2 样品前处理方法优化
(1)液液萃取法
二氯甲烷:戊烷提取法是根据文献[13]改进后的方法,具体样品处理方法如下:取1 mL酒样,加9 mL水,2 g NaCl,1 mL十七烷酸内标,0.2 mL浓盐酸,连续采用5 mL、3 mL、3 mL二氯甲烷:戊烷(体积比为4∶5)溶液萃取3次,合并有机相后,连续用5 mL、3 mL、2 mL 50 g/L的Na2CO3溶液萃取3次;合并水相弃有机相,水相用6 mol/L HCl调节pH至2~3后,再次用5 mL、3 mL、3 mL二氯甲烷:戊烷溶液萃取3次,收集有机相,有机相经无水Na2SO4除水后,滤入25mL梨形瓶,真空旋转蒸发至1mL后,转入酯化管,待酯化。
(2)固相萃取法
按照文献[10]改进预处理方法,C18固相萃取小柱依次用2.5 mL甲醇和5 mL水进行活化。取1 mL酒样,加9 mL水和1 mL十七烷酸内标溶液,混匀后加样到C18固相萃取小柱中,抽真空使试样慢慢渗入固相萃取柱中,静置10 min。先用酸化水(2.5 mL水中加1 mL 0.1 mol/L HCl)洗涤滤筒,随后用2 mL二氯甲烷和2.5 mL戊烷以1 mL/min流速洗脱小柱,收集有机相,有机相经无水Na2SO4除水后,在室温下用氮气缓缓吹至1 mL,待酯化。
酯化方法:处理好的样品加入0.1 mL的14%三氟化硼-甲醇溶液,在95 ℃水浴20 min,酯化结束后加2 mL去离子水和2 mL正己烷,最终收集有机相,氮气吹干后,加入2 mL正己烷复溶,待测定。
1.3.3 GC-MS条件(1)色谱柱的优化
试验设置两种不同的色谱柱(CP-WAX和HP-5),确定分离长链FFAs的最佳色谱柱,其中WAX色谱柱为强极性柱,该色谱柱对低沸点分析物具有较高的分离度,如醇、脂肪酸甲酯等;HP-5柱为非极性高性能通用色谱柱,填料是(5%-苯基)-甲基聚硅氧烷,其适用范围广,温度上限高。二者均可用于长链FFAs甲酯的分离,在不同色谱柱对应的条件下进行测定,确定最佳色谱柱及分离长链脂肪酸酯的最佳条件。两种色谱柱及对应的色谱条件如下:
CP-WAX色谱柱(50 m×0.25 mm×0.25 μm);进样口温度250 ℃;程序升温:初始温度60 ℃,0 min;15 ℃/min升至125 ℃保持2 min;5 ℃/min升至210 ℃保持10 min;载气:氦气(He)(纯度≥99.9995%),恒定流量0.8 mL/min,进样模式:不分流进样。
HP-5色谱柱(30 m×0.25 mm×0.25 μm);进样口温度280℃;程序升温:初始温度50 ℃,2 min;10 ℃/min升至200℃,0 min;5 ℃/min升至290 ℃保持5 min;载气:He(纯度≥99.9995%),恒定流量1 mL/min,进样模式:不分流进样。
(2)质谱条件
电子电离(electron ionization,EI)源;离子源温度230 ℃;四级杆温度150 ℃;电子能量70 eV;接口温度250 ℃;质量扫描范围50~550 m/z;扫描方式为选择离子模式;溶剂延迟5 min。
(3)定性定量方法
采用棕榈酸、油酸、亚油酸、月桂酸、肉豆蔻酸和硬脂酸的各单标进行衍生确定每种组分的保留时间,然后根据6种脂肪酸的质谱图选择响应高、特征性高的离子作为选择特征离子。
由于酒样酒精度为52%vol,稀释后约为5%vol,为了模拟酒体,采用5%vol的酒精水溶液配制标准溶液,将6种长链FFAs的标准品用5%的酒精水溶液稀释至不同梯度,对长链FFAs标准溶液进行同酒样一致的固相萃取法提取,BF3-甲醇衍生化,GC-MS分析,以质量浓度-峰面积进行线性回归,建立标准曲线。检出限为3倍信噪比时物质的质量浓度;定量限为10倍信噪比时物质的质量浓度。
1.3.4 酯化率计算公式
根据配制的脂肪酸标准品质量浓度和酯化后脂肪酸甲酯的含量进行计算。
1.3.5 方法学考察
取适量长链FFAs标准品,配制成2.5 mg/L、5.0 mg/L和50.0 mg/L的混合标准溶液,并对方法的加标回收率、精密度进行测定。
1.3.6 数据处理数据统计分析及表格制作采用Microsoft Excel 2019,图片绘制采用Origin 9.5。
2 结果与分析
2.1 衍生试剂的优化
选取体积分数14%的BF3-甲醇溶液和甲醇-H2SO4两种衍生化试剂,对200 mg/L的脂肪酸标准品进行脂肪酸甲酯化效果比较,结果见表1。
表1 不同衍生化试剂的酯化效果比较
Table 1 Comparison of esterification effects of different derivatization reagents

FFAs月桂酸肉豆蔻酸棕榈酸硬脂酸油酸亚油酸平均酯化率/%BF3-甲醇 甲醇-H2SO4 90 91 88 85 90 85 92 91 87 84 86 85
由表1可知,两种衍生化方法酯化效果接近。BF3-甲醇法的酯化率在85%~91%之间,甲醇-H2SO4法的酯化率在84%~92%之间。甲醇-H2SO4反应体系中,脂肪酸在酸性条件下与甲醇发生酯化反应,而BF3-甲醇法是脂肪酸的羧基在BF3的诱导下发生亲核取代反应,进而与甲醇进行酯化[20],其更适用于游离脂肪酸的衍生,而甲醇-H2SO4法可以衍生游离态脂肪酸及结合态脂肪酸。目前在啤酒、果酒等发酵酒的游离脂肪酸检测中,由于酒体中含有大量微生物,若采用甲醇-H2SO4法衍生化,细胞膜中的磷脂等脂肪酸衍生物对结果产生干扰,因此大多采用BF3-甲醇法对酒中脂肪酸进行衍生化及后续测定[16,19]。白酒属于蒸馏酒,其本身杂质较少,酒液清澈透明,综合考虑BF3-甲醇法对游离脂肪酸衍生化相对专一性,而且操作更为方便,成本更加低廉,因此后续脂肪酸测量均采用BF3-甲醇法进行衍生化。
2.2 样品前处理方法的比较
分别采用液液萃取法、固相萃取法对同一白酒样品进行处理。结果见图1。
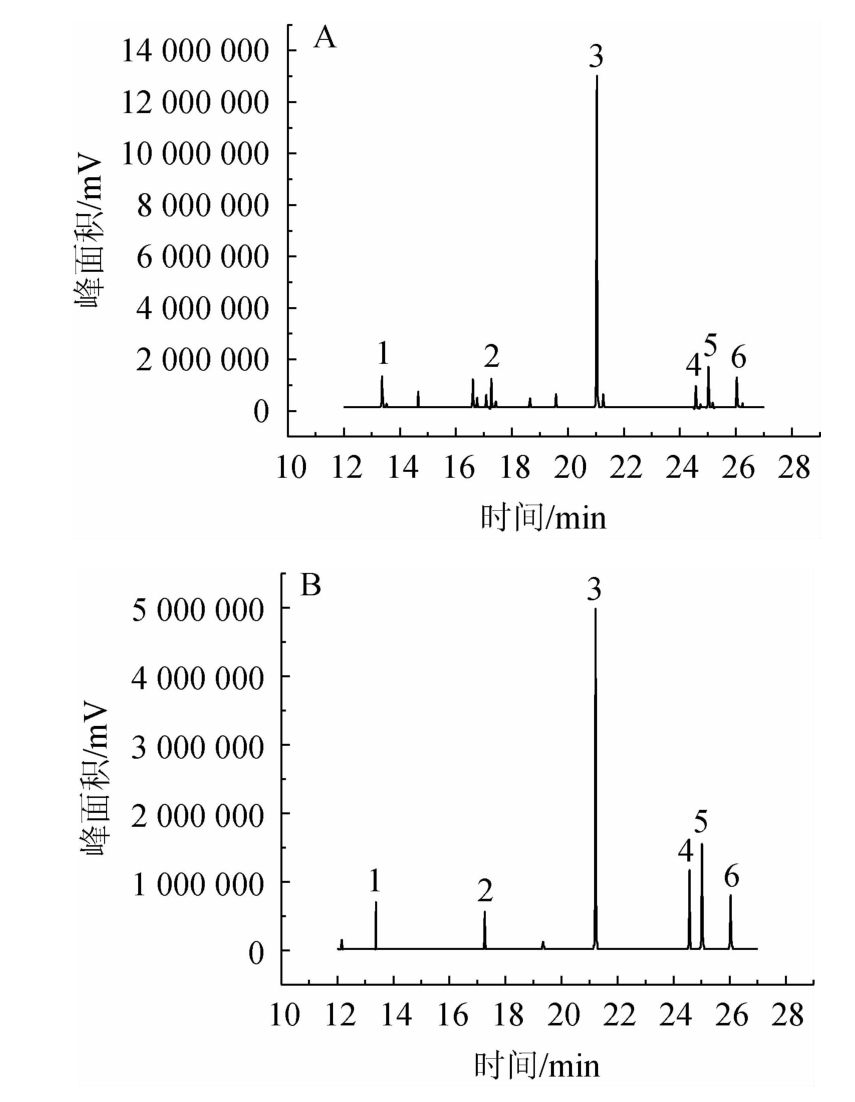
图1 液液萃取法(A)及固相萃取法(B)处理样品色谱图
Fig.1 Chromatogram of samples treated by liquid-liquid extraction(A)and solid phase extraction (B)
1~6分别代表月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、油酸、亚油酸。
由图1可知,样品经固相萃取处理后,分离效果明显优于液液萃取。固相萃取法处理样品的色谱图,杂峰少,峰形好,目标峰清晰,且不会水解白酒中的脂肪酸乙酯。除此之外,液液萃取法的质谱图中出现了乙酯峰,补充实验证明,在酸性条件下进行脂肪酸提取,使白酒中的酯类发生不完全水解,部分脂肪酸乙酯水解生成脂肪酸和乙醇,脂肪酸再进行衍生化,生成脂肪酸甲酯[21]。因此,固相萃取法适用于白酒中FFAs的提取。
2.3 色谱柱的优化
本实验分别采用长链脂肪酸酯标准溶液,分别优化HP-5(30m×0.25mm×0.25μm)及CP-WAX(50m×0.25mm×0.25μm)色谱柱载气流速、初始温度、升温程序等,使两种色谱柱在分离长链脂肪酸酯时处于最优状态。HP-5与CP-WAX两种色谱柱对6种FFAs标准品测定的离子色谱图见图2。
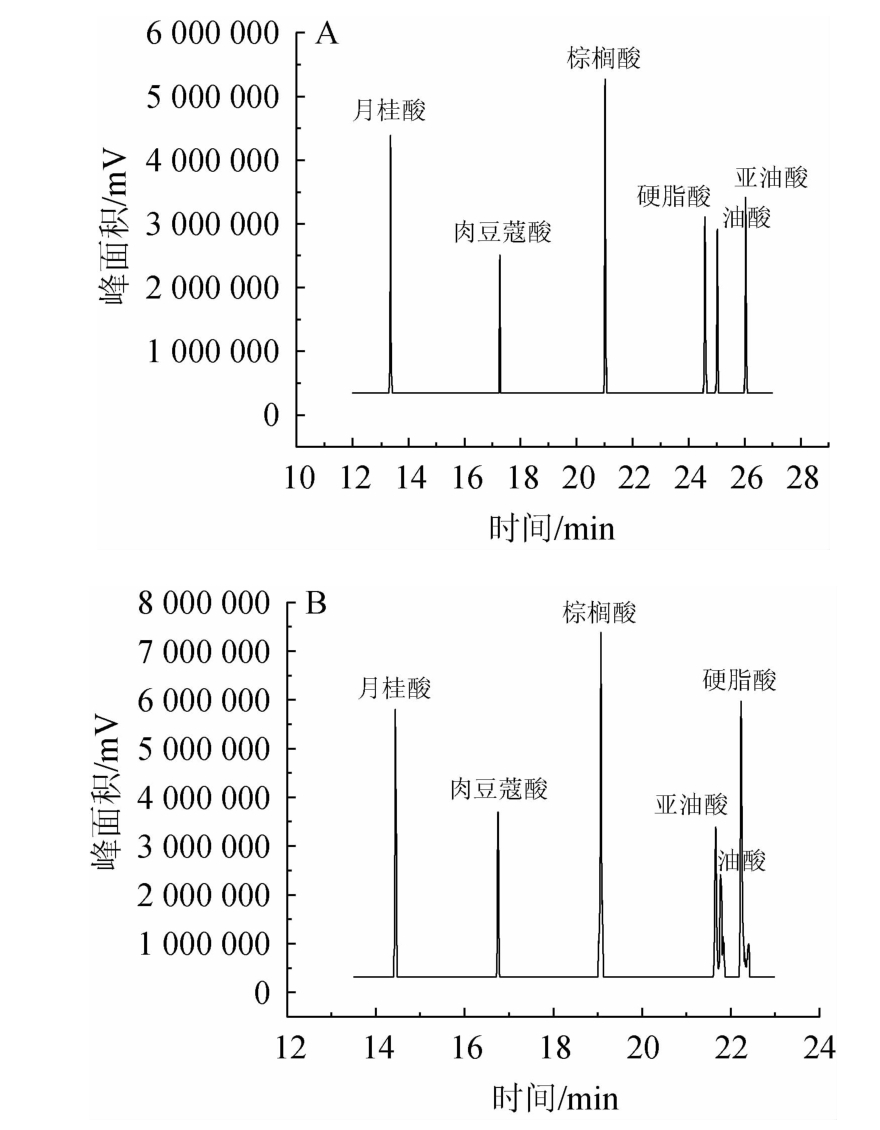
图2 CP-WAX色谱柱(A)及HP-5色谱柱(B)检测6种FFAs标准品的离子色谱图
Fig.2 Ion chromatogram of 6 free fatty acids standards detected with CP-WAX column (A) and HP-5 column (B)
由图2可知,在分析时间上来看,HP-5色谱柱的分析时间小于CP-WAX色谱柱,但是在分离效果上来看,CP-WAX测得6种脂肪酸可完全分离,峰形基本对称,而HP-5在分离亚油酸、油酸和硬脂酸时,这三种脂肪酸未完全分离且峰形不好。因此本实验最终选择CP-WAX(50 m×0.25 mm×0.25 μm)来分离6种FFAs。
2.4 白酒中长链FFAs的定性
将配制好的脂肪酸混标溶液进行衍生,通过GC-MS进行测定,确定6种长链FFAs的保留时间及定性定量离子,具体见表2。
表2 6种游离氨基酸的保留时间和特征离子
Table 2 Retention time and characteristic ions of 6 free fatty acids
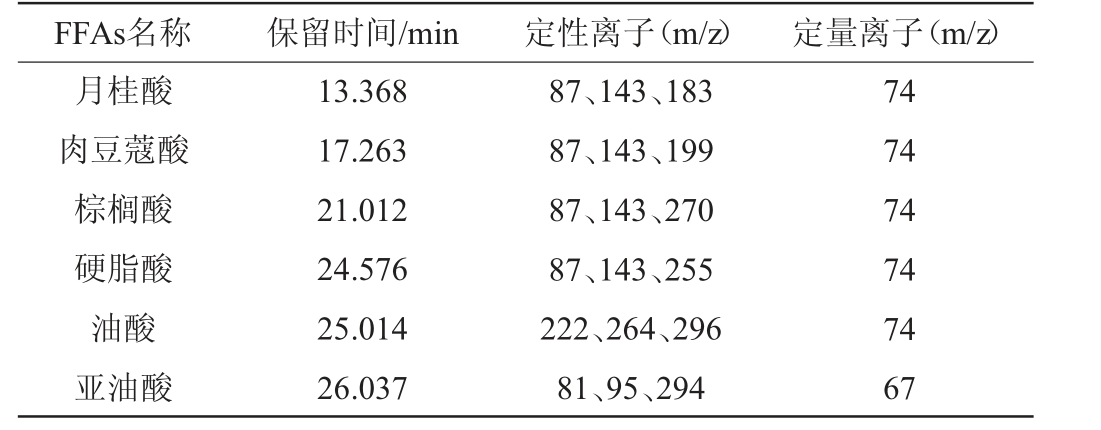
FFAs名称 保留时间/min 定性离子(m/z) 定量离子(m/z)月桂酸肉豆蔻酸棕榈酸硬脂酸油酸亚油酸13.368 17.263 21.012 24.576 25.014 26.037 87、143、183 87、143、199 87、143、270 87、143、255 222、264、296 81、95、294 74 74 74 74 74 67
2.5 6种长链脂肪酸的标准曲线回归方程及相关参数
长链FFAs的标准品的标准曲线回归方程、线性范围、检出限及定量限测定结果见表3。由表3可知,固相萃取法测定6种长链FFAs的标准曲线回归方程相关系数R2均>0.993,对于经过前处理与衍生化的标准品而言,其在检测浓度范围内线性均良好,满足检测要求。检出限为0.002~0.009 mg/L,定量限为0.010~0.034 mg/L。
表3 6种游离氨基酸标准品的线性范围、线性方程、相关系数、检出限和定量限
Table 3 Six kinds of free fatty acids standards linear range,correlation coefficient, precision, recovery rate,detection limit and quantitative limit
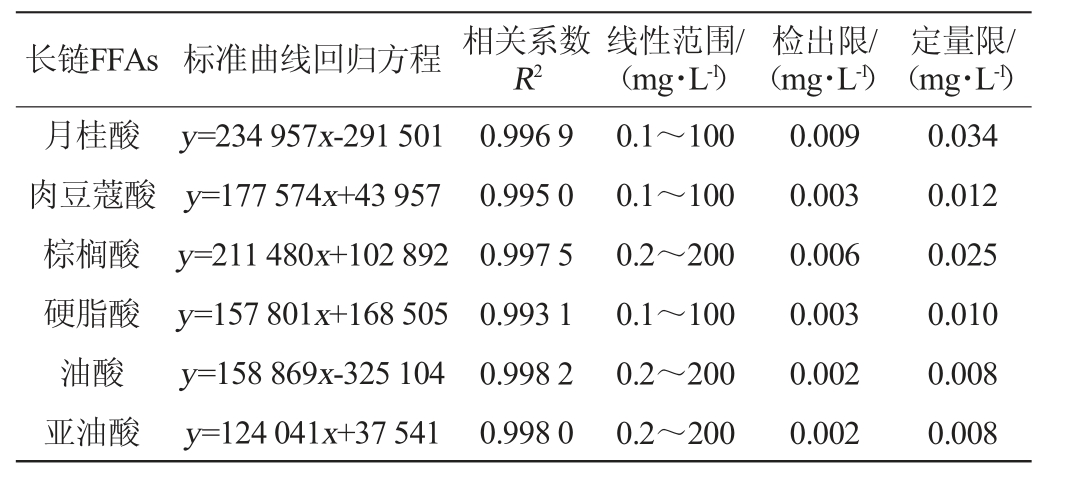
长链FFAs 标准曲线回归方程 相关系数R2线性范围/(mg·L-1)检出限/(mg·L-1)定量限/(mg·L-1)月桂酸肉豆蔻酸棕榈酸硬脂酸油酸亚油酸y=234 957x-291 501 y=177 574x+43 957 y=211 480x+102 892 y=157 801x+168 505 y=158 869x-325 104 y=124 041x+37 541 0.996 9 0.995 0 0.997 5 0.993 1 0.998 2 0.998 0 0.1~100 0.1~100 0.2~200 0.1~100 0.2~200 0.2~200 0.009 0.003 0.006 0.003 0.002 0.002 0.034 0.012 0.025 0.010 0.008 0.008
2.6 方法的回收率与精密度
方法的加标回收率和精密度试验结果见表4。由表4可知,6种长链FFAs3个水平的加标回收率为92%~112%,精密度试验结果相对标准偏差(relative standard deviation,RSD)值为3.9%~9.3%,表明该方法精密度较高、回收率较好,表明本实验所建的方法能够满足检测要求。
表4 长链游离氨基酸检测方法的回收率与精密度(n=6)
Table 4 Recovery and precision of detection methods for long-chain free fatty acids (n=6)
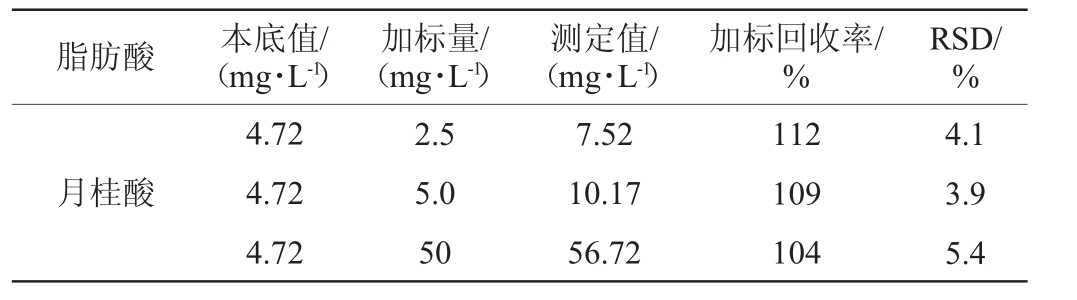
脂肪酸 本底值/(mg·L-1)加标量/(mg·L-1)测定值/(mg·L-1)加标回收率/%RSD/%月桂酸4.72 4.72 4.72 2.5 5.0 50 7.52 10.17 56.72 112 109 104 4.1 3.9 5.4
续表
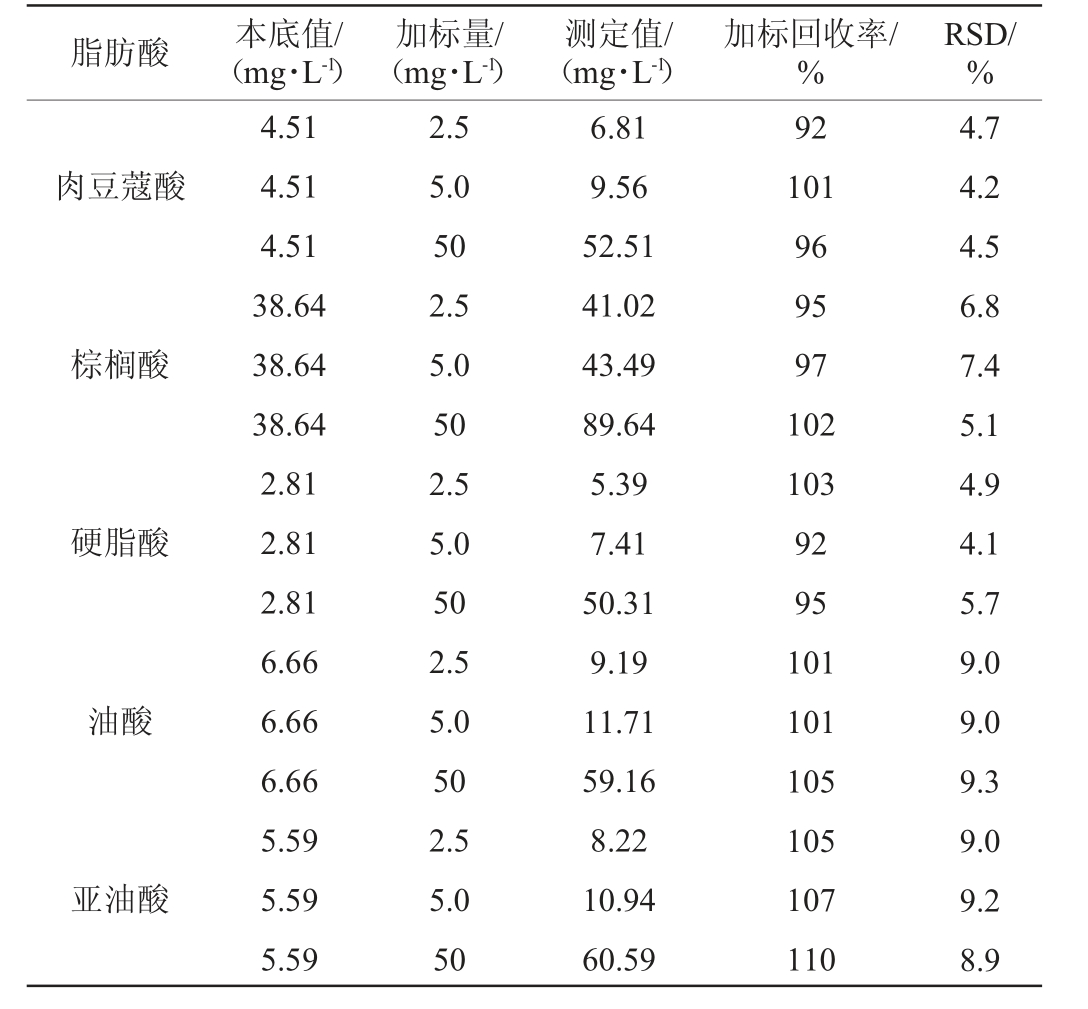
脂肪酸 本底值/(mg·L-1)加标量/(mg·L-1)测定值/(mg·L-1)加标回收率/%RSD/%肉豆蔻酸棕榈酸硬脂酸油酸亚油酸4.51 4.51 4.51 38.64 38.64 38.64 2.81 2.81 2.81 6.66 6.66 6.66 5.59 5.59 5.59 2.5 5.0 50 2.5 5.0 50 2.5 5.0 50 2.5 5.0 50 2.5 5.0 50 6.81 9.56 52.51 41.02 43.49 89.64 5.39 7.41 50.31 9.19 11.71 59.16 8.22 10.94 60.59 92 101 96 95 97 102 103 92 95 101 101 105 105 107 110 4.7 4.2 4.5 6.8 7.4 5.1 4.9 4.1 5.7 9.0 9.0 9.3 9.0 9.2 8.9
2.7 不同香型白酒中长链FFAs的检测
采用固相萃取法结合GC-MS检测市售不同香型白酒中FFAs,测定结果如表5所示。
表5 不同白酒样品中长链游离氨基酸含量的测定结果
Table 5 Determination results of long-chain free amino acid contents in different liquor samples mg/L
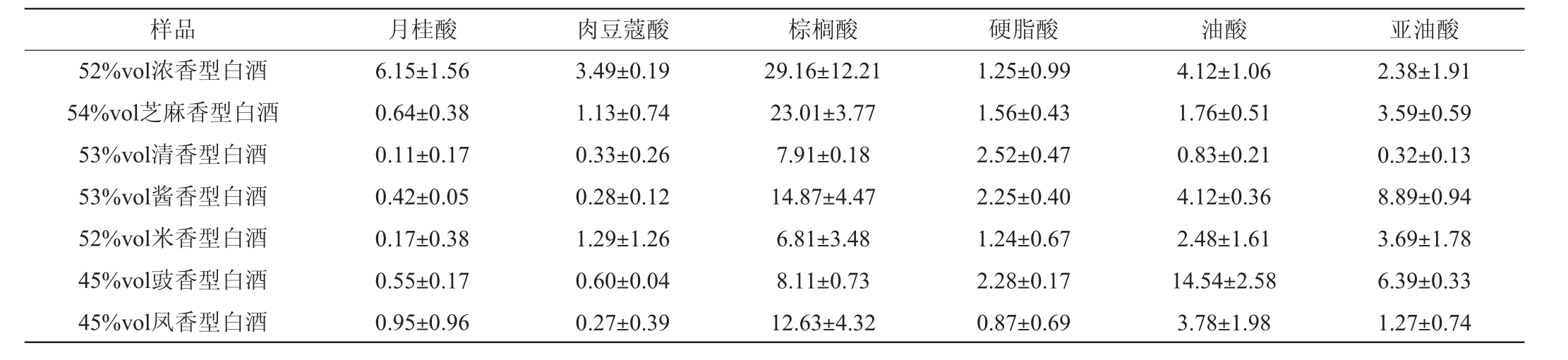
样品 月桂酸 肉豆蔻酸 棕榈酸 硬脂酸 油酸 亚油酸52%vol浓香型白酒54%vol芝麻香型白酒53%vol清香型白酒53%vol酱香型白酒52%vol米香型白酒45%vol豉香型白酒45%vol凤香型白酒6.15±1.56 0.64±0.38 0.11±0.17 0.42±0.05 0.17±0.38 0.55±0.17 0.95±0.96 3.49±0.19 1.13±0.74 0.33±0.26 0.28±0.12 1.29±1.26 0.60±0.04 0.27±0.39 29.16±12.21 23.01±3.77 7.91±0.18 14.87±4.47 6.81±3.48 8.11±0.73 12.63±4.32 1.25±0.99 1.56±0.43 2.52±0.47 2.25±0.40 1.24±0.67 2.28±0.17 0.87±0.69 4.12±1.06 1.76±0.51 0.83±0.21 4.12±0.36 2.48±1.61 14.54±2.58 3.78±1.98 2.38±1.91 3.59±0.59 0.32±0.13 8.89±0.94 3.69±1.78 6.39±0.33 1.27±0.74
由表5可知,从长链FFAs种类上看,棕榈酸是白酒中含量最高的长链FFAs,为7.91~29.16 mg/L,主要存在于浓香型白酒和芝麻香型白酒中,与文献报道过的8.48~29.43 mg/L检测结果相似[22],酱香型白酒、凤香型白酒中的含量分别为14.87 mg/L、12.63 mg/L,清香型白酒、米香型白酒和豉香型白酒中的棕榈酸含量较低,分别为7.91 mg/L、6.81 mg/L、8.11 mg/L。其次为油酸和亚油酸,其中油酸在豉香型白酒中含量最高,为14.54 mg/L,油酸在豉香型白酒中含量较高应与豉香型白酒浸肉工艺有关[23],亚油酸在酱香型白酒中含量最高8.89 mg/L,其次是豉香型白酒6.39 mg/L。月桂酸在浓香型白酒中含量较高,为6.15 mg/L,其他香型白酒中含量较少。肉豆蔻酸在浓香型和米香型白酒中含量较高,分别为3.49 mg/L、1.29 mg/L。硬脂酸的含量在凤香型白酒中较低,为0.87 mg/L。
从白酒中长链FFAs总量上看,浓香型白酒中长链FFAs含量最高,总量为46.55 mg/L,其次为豉香型白酒,总量为32.47 mg/L;再次为芝麻香型白酒,总量为31.69 mg/L,酱香型白酒30.83 mg/L,凤香型白酒为19.77 mg/L,最少的为清香型白酒12.02 mg/L和米香型白酒15.68 mg/L。
2.8 不同香型白酒中长链FFAs差异性与共性分析
6种长链FFAs在7种不同香型酒中的分布情况见图3。由图3可知,棕榈酸为白酒中含量最高的长链FFAs,月桂酸主要存在于浓香型白酒中,油酸主要存在于豉香型白酒中,亚油酸在酱香型白酒中含量较高。浓香型白酒与芝麻香型白酒的长链FFAs具有一定相似性,清香型白酒和米香型白酒中的长链FFAs具有一定相似性,而豉香型白酒、酱香型白酒和凤香型白酒各有特点。
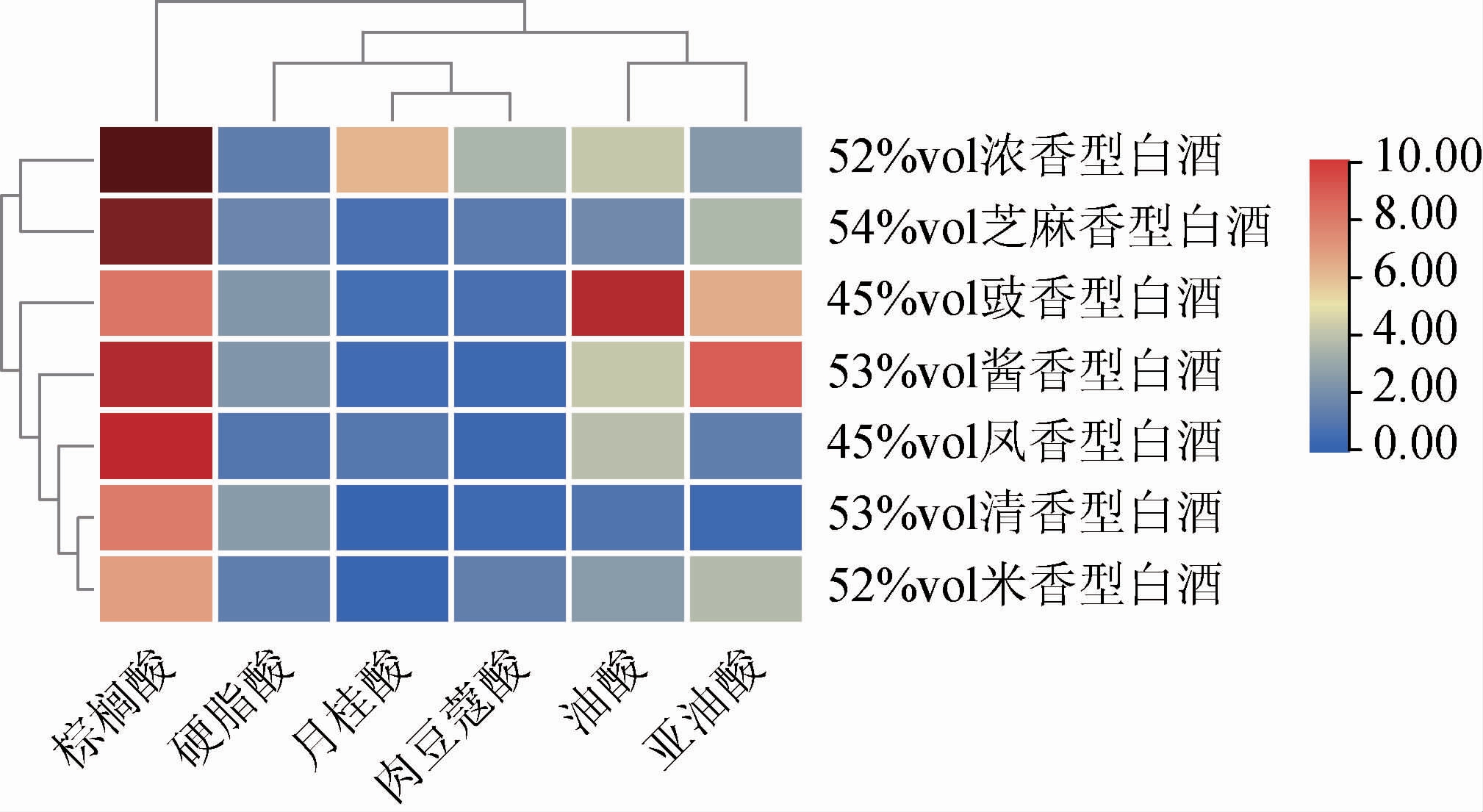
图3 不同香型白酒中长链游离氨基酸的差异性与共性分析
Fig.3 Differences and commonality analysis of long-chain free fatty acids in Baijiu of different aroma
不同香型白酒中长链FFAs含量的差异主要是与5种香型白酒的酿造工艺以及发酵容器的差异所导致的[7],白酒中长链FFAs的产生,主要来源于微生物对原料的代谢,而微生物主要集中在窖泥中。浓香型白酒的发酵容器为泥窖,酒醅与窖泥接触面积较大,因此浓香型白酒中微生物代谢产生的长链FFAs含量最高;芝麻香型白酒窖池为泥底砖窖,二者工艺具有相似之处,因此,芝麻香型白酒与浓香型白酒中长链FFAs具有共性,但芝麻香型长链FFAs整体含量低于浓香型白酒。凤香型白酒采用新泥窖池发酵,虽然也是泥窖,但是其需要每年去掉窖池内壁和底部的老窖泥,由于新窖泥中微生物含量较少,因此,由发酵产生的长链FFAs较少。但是凤香型白酒采用酒海贮存,酒海采用荆条编织而成,其内壁糊以麻纸,并以猪血和石灰做粘合剂,然后用蛋清、蜂蜡、热菜籽油按比例配制成涂料,涂擦晾干后作为凤香型白酒的贮酒容器[25],因此凤香型白酒中的长链FFAs大多是在贮酒期间产生。酱香型白酒由于其工艺特殊,产地独特,因此其长链FFAs的含量与其他香型相比具有差异性。
清香型白酒和米香型白酒中长链FFAs具有一定共性,清香型白酒发酵容器为地缸,米香型白酒发酵容器为醅缸,两者均没有窖泥,因此其二者中的长链FFAs含量最少。豉香型白酒虽采用酒瓮发酵,也没有窖泥,但其用肥肉陈酿,因此其长链FFAs含量也较高。
3 结论
本实验建立了一种利用SPE-GC-MS结合衍生化法测定白酒中长链FFAs的研究方法,并优化了试验条件。该方法中BF3-甲醇法衍生脂肪酸具有一定专一性,固相萃取法能够避免白酒中脂肪酸乙酯水解,且该方法用时少、有毒试剂用量少,安全性高;CP-WAX色谱柱具有分离效率高的优点。在该分析条件下建立定量校正曲线:6种长链FFAs在线性范围内相关系数R2均>0.993,方法检出限为0.002~0.009 mg/L,方法的精密度为3.9%~9.3%,平均加标回收率为92%~112%。该方法准确度和精密度试验结果RSD良好,适合于白酒中月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、油酸、亚油酸6种长链FFAs的定量检测。
应用该方法对不同香型白酒中的FFAs进行定量分析,并通过热图的形式对7种不同香型白酒进行差异性与共性分析,结果表明白酒中长链FFAs的含量与白酒发酵容器及发酵工艺息息相关,含量最高的为浓香型白酒,其次为豉香型白酒,再次为芝麻香型白酒,凤香型白酒,最少的为清香型白酒和米香型白酒。上述结论可为白酒中长链FFAs的研究提供一定的数据支持。
[1]韦露露,宗启,陆伦维,等.基于白酒风味的现代分析技术及其生物活性研究进展[J].中国酿造,2021,40(9):12-18.
[2]HONG J,ZHAO D R,SUN B G.Research progress on the profile of trace components in Baijiu[J].Food Rev Int,2021,7:1-27.
[3]肖冬光.白酒酿造过程中酯类物质形成机理探讨[J].酿酒科技,2022(9):17-24.
[4]邢爽.白酒发酵过程中酯类物质形成机理的研究[D].天津:天津科技大学,2018.
[5]NITBANI F O,TJITDA P J P,NITTI F,et al.Antimicrobial properties of lauric acid and monolaurin in virgin coconut oil: a review[J].Chem Bio Eng Rev,2022,9(5):442-461.
[6]XU Y Q,ZHU Y,LI X,et al.Dynamic balancing of intestinal short-chain fatty acids:The crucial role of bacterial metabolism[J].Trends Food Sci Tech,2020,100:118-130.
[7]范文来,龚舒蓓,徐岩.白酒有机酸谱[J].酿酒,2019,46(1):37-42.
[8]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:223.
[9]苏墨.改造酿酒酵母中心碳途径提高脂肪酸产量[D].北京:北京化工大学,2020.
[10]KAREN D.Determination of free fatty acids in wort and beer[J].J Am Soc Brew Chem,2018,48(1):13-17.
[11]廖勤俭,练顺才,李杨华,等.高效液相色谱四级杆飞行时间质谱联用技术检测白酒中高级脂肪酸[J].酿酒科技,2013(10):97-99.
[12]余剑霞.高效液相色谱测定豉香型白酒中微量的高级脂肪酸[J].酿酒科技,2006(6):45-46.
[13]刘春凤,郑飞云,李永仙,等.多溶剂萃取-气相色谱法测定啤酒中的游离脂肪酸[J].分析实验室,2008,27(2):26-29.
[14]王儒珍,陆燕,曹建平,等.基于GC和GC-MS技术检测果酒中的脂肪酸[J].现代食品科技,2018,34(7):266-272.
[15] BRAVI E, BENEDETTI P, MARCONI O, et al.Determination of free fatty acids in beer wort[J].Food Chem,2014,151(3):374-378.
[16]TOMAS H,JIRI C,PAVEL C,et al.Analysis of free fatty acids in beer:comparison of solid-phase extraction, solid-phase microextraction, and stir bar sorptive extraction[J].J Agr Food Chem,2009,57(23):11081-11085.
[17]周漪波,朱志鑫,梁永威,等.气相色谱-质谱法分析啤酒中游离脂肪酸[J].食品研究与开发,2017,38(18):154-157.
[18]PACHECO I,MARIA J.RODRIGUEZ T,et al.Anderson.Zwitterionic polymeric ionic liquid-based sorbent coatings in solid phase microextraction for the determination of short chain free fatty acids[J].Talanta,2019,200:415-423.
[19]BALTUSSEN E,SANDRA P,DAVID F,et al.Stir bar sorptive extraction(SBSE),a novel extraction technique for aqueous samples: Theory and principles[J].Microcolumn Sep,1999,11:737-747.
[20]黄峥,盛灵慧,马康,等.5种脂肪酸甲酯化方法的酯化效率研究[J].中国油脂,2013,38(9):86-88.
[21]宋卫得,李兆杰,杨立明,等.离子色谱法快速测定白酒中多种有机酸和阴离子[J].中国酿造,2017,36(11):153-157.
[22]杨会,范文来,徐岩.基于BSTFA衍生化法白酒不挥发有机酸研究[J].食品与发酵工业,2017,43(5):192-197.
[23]潘丽娟,赖嘉雯,赵文红,等.豉香型白酒研究现状[J].中国酿造,2020,39(10):21-25.
[24]国家食品药品监督管理总局.GB5 009.168—2016 食品中的脂肪酸检测[S].北京:中国质检出版社,2016.
[25]刘丽丽,杨辉,荆雄,等.不同贮酒容器对凤香型白酒风味物质的影响[J].食品科学,2022,43(16):285-293.