白酒酿造中的固态发酵过程涉及多种微生物的生长变化及新陈代谢,形成复杂的微生物系统并具有明显的非线性与时变特征[1-2]。有研究表明,白酒酿造过程中入罐糟酸度、淀粉度以及水分等理化参数的变化会直接影响参与发酵的微生物生长和代谢[3-7]。对固态发酵过程的优化控制和反馈调整直接关系到发酵产物的产率,进而影响蒸馏摘酒后原酒品质[8-10]。因此,如何在不影响发酵环境的前提下,对固态发酵过程进行实时监测成为了目前该领域研究的重点问题,且对实际生产应用具有重要的指导意义[11-13]。
在通常的情况下,发酵装置作为一个封闭的系统,较难在不影响发酵环境的情况下实现频繁的采样检测。同时,这种采样离线分析的方法普遍具有一定时间上的延迟,操作较为繁杂且无法实现对发酵过程的实时监测[14-15]。而在目前已有应用的在线监测方法中,多数集中在对于发酵温度等间接参量的观察方面,或通过发酵过程结束后得到的原酒质量来评价发酵过程,缺乏对于直接反映发酵状态的生物参量(如微生物浓度、产物浓度)进行实时在线监测的方法和技术手段[16-18]。这种检测方法上的不足也让全面、准确评估发酵罐内的发酵情况变得非常困难,也无法进一步研究发酵过程的实时变化[19-22]。研究表明,发酵过程中产生的代谢气体浓度变化揭示了整个发酵过程的基质代谢流向,可以反映发酵过程中微生物的生长情况,并影响最终产物的生成[23-24]。因此,从理论上来说,通过对发酵过程代谢气体数据的实时观测,可以实现对发酵过程的状态变化进行表征和监测,并为优化发酵工艺过程提供数据支撑[25]。
基于此,本研究酿造小曲清香型白酒,分别考察不同熟粮与糠壳体积比(粮糠比)(1∶4、1∶1、4∶1)及水分含量(48%、55%、59%和63%)入罐糟发酵过程中CO2含量与产酒情况,提出基于CO2浓度的固态发酵在线监测白酒品质的方法。以期为进一步为全面、准确判断固态发酵状态、合理调整配糟和提高原酒品质提供数据基础。
1 材料与方法
1.1 材料与试剂
酿酒曲:安琪酵母股份有限公司;高粱粉:产地为泸州;糠壳:由泸州老窖股份有限公司提供。
1.2 仪器与设备
FZ800-CO2便携式CO2气体检测仪:淮安孚淮环保科技有限公司。
1.3 方法
1.3.1 小曲清香型白酒的酿造工艺流程及操作要点
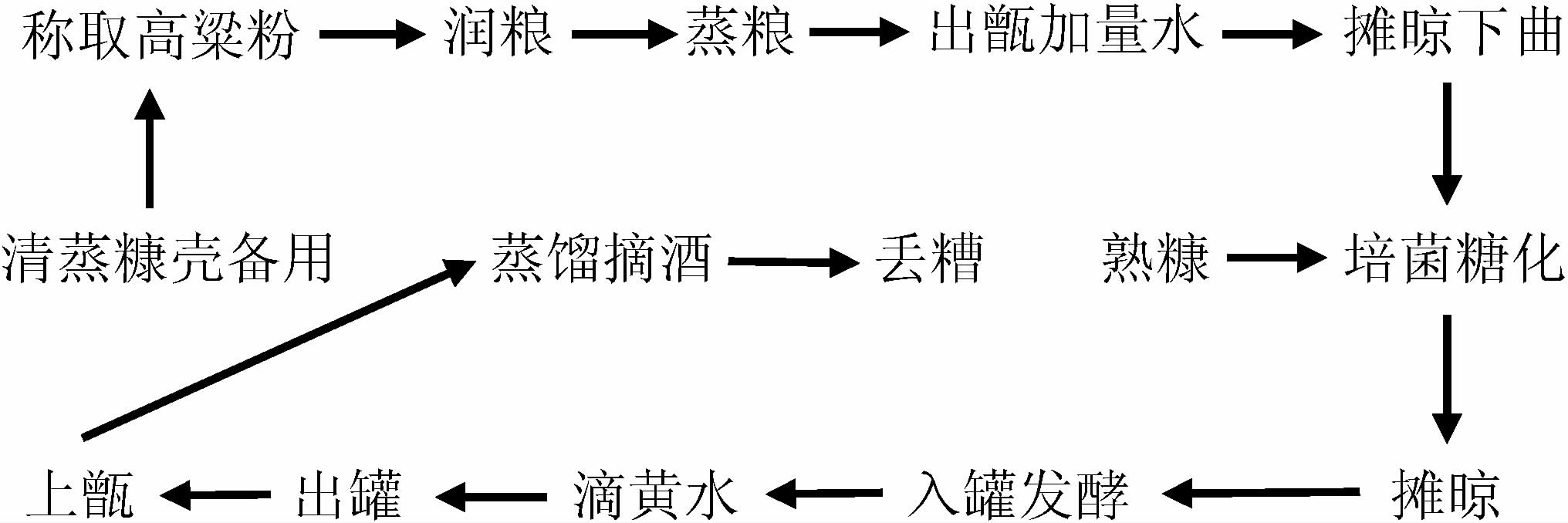
操作要点:
清蒸糠壳的制备:壳装入甑桶内进行蒸糠,穿汽后继续蒸30 min,清蒸结束后将糠壳挖出摊平,自然冷却后备用。
取适量(又称投粮量)的高粱粉加入40 ℃温水拌匀,堆积成圆锥形在室温环境下静待30 min润粮;润粮结束后进行上甑蒸粮过程,蒸粮温度为100 ℃,蒸粮时间为甑桶内高粱穿大汽后继续蒸25 min,使高粱熟透无生心,经此蒸粮操作后的高粱又称为熟粮;然后取出甑桶内蒸熟后的粮糟加90 ℃量水后将粮糟打散进行摊晾至粮糟温度为35~40 ℃;0.5%投粮量的小曲撒于粮糟表面后拌匀,将下曲后的粮糟拌匀后收堆呈锥形,表面覆盖糠壳进行保温糖化约3 h;糖化结束后将设置好体积比的粮糟和糠壳拌匀,其中糠壳作为酿酒辅料使糟醅具有一定的疏松度和含氧量,可以增加酒糟与空气间的接触面积,并可降低糟醅酸度[26-28],温度为22 ℃后将糟醅轻装入20 L不锈钢发酵罐内,满罐后将其盖密封进行为期7 d的固态发酵;发酵结束滴黄水,然后进行上甑环节,上甑时先在甑底撒一层糠壳,再撒入糟醅,上甑过程做到轻撒匀铺,探汽上甑,在出酒口用烧杯收集原酒。
1.3.2 入罐糟参数的实验设计
(1)不同熟粮与糠壳体积比入罐糟发酵过程中CO2含量的变化特征及产酒情况
分别配制熟粮与糠壳体积比(粮糠比)为1∶4(对应投粮量750 g,糠壳用量520 g)、1∶1(对应投粮量1 500 g,糠壳用量260 g)和4∶1(对应投粮量1 500 g,糠壳用量65 g)3组入罐糟。在相同的环境条件下,将3组入罐糟分别放入密封发酵罐内进行固态发酵,并在线实时监测其所产生的CO2浓度在一个发酵周期内(共7 d)的变化。发酵结束后,对各实验组的出罐糟进行蒸馏摘酒,测定产酒情况。
(2)不同水分含量入罐糟发酵过程中CO2含量的变化特征及产酒情况
清蒸除杂后的糠壳作为酿酒辅料使糟醅具有一定的疏松度和含氧量,可以增加酒糟与空气间的接触面积,并可降低糟醅酸度[27-29],固定粮糠比为1∶1的条件下,在熟粮摊晾时加不同量的量水来制成不同水分含量入罐糟(水分含量分别为48%、55%、59%和63%)。在相同的环境条件下,将4组入罐糟分别放入密封发酵罐内进行固态发酵,并在线实时监测一个发酵周期内CO2浓度的变化。发酵期结束后,对各实验组的出罐糟进行蒸馏摘酒,测定产酒情况。
1.3.3 CO2含量的检测
通过密封橡胶塞和橡胶管在发酵罐盖子中间的小孔中连接便携式CO2检测仪,具体操作为在橡胶塞上打3个小孔,其中两个接入橡胶管,橡胶管一边开口在罐内酒糟上层气体空间(不与酒糟接触),另一端开口分别接CO2检测仪的进气口和出气口,第3个孔内插入单向排气阀保证测量过程中发酵罐内气压恒定。整个发酵过程中CO2检测仪保持运行状态,并自动保存发酵罐内CO2含量数据。
1.3.4 酒精度的测定
摘酒过程中每得100 mL原酒,即用酒度计和温度计测量得到酒精度和对应原酒温度,根据《酒精温度计浓度换算表》可得到20 ℃酒精度,同时换算酒精度为60%vol的出酒率,其计算公式如下:

2 结果与分析
2.1 不同粮糠比入罐糟发酵过程中CO2含量变化特征
将3组不同粮糠比的入罐糟,在相同的环境条件下分别放入连接有CO2浓度检测仪的密封发酵罐内进行固态发酵。设置数据采样间隔为60 min,测量得到在一个发酵周期内CO2含量变化曲线(见图1)。由图1可知,在发酵前期(发酵第1天),3组入罐糟在发酵过程中所产生的CO2含量均呈现快速上升的趋势;在发酵中期(发酵第2~3天),CO2含量保持稳定;在发酵后期(发酵第4~7天),CO2含量稍有回落。其中,粮糠比为1∶1的入罐糟在发酵过程中所产生的CO2含量在整个发酵过程中最高,其主要原因是,在粮糠比设置较为合适时,酒糟间氧气含量较多,使得发酵过程中微生物有氧呼吸增加,酒糟中淀粉充分发酵,由蒸馏后原酒质量参数可以判断本组固态发酵状态较为正常[4]。
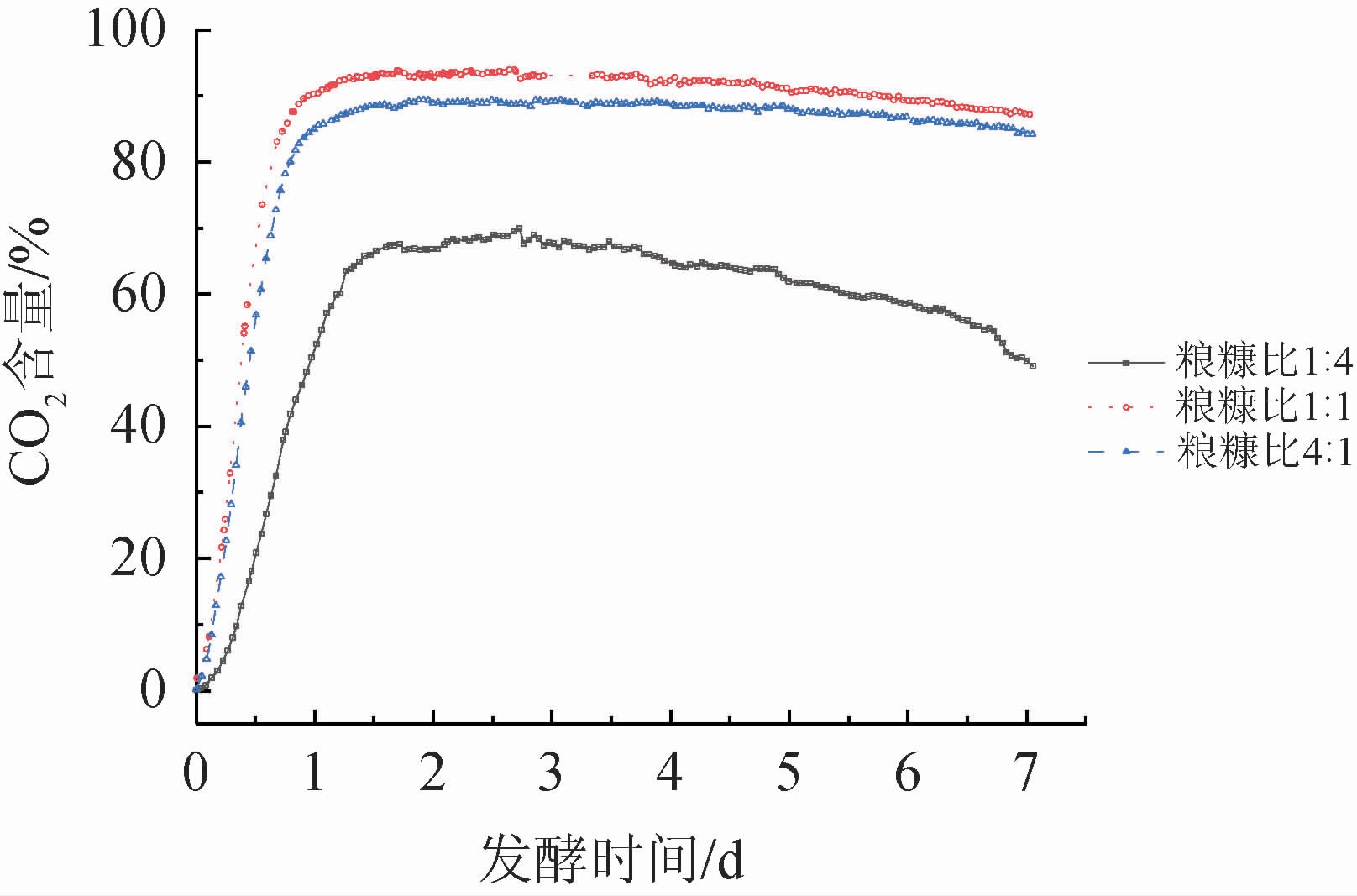
图1 不同粮糠比入罐糟在一个发酵周期内所产CO2含量变化
Fig.1 Changes of CO2 content produced by fermented grains in fermenter with different grain to bran ratios in a fermentation cycle
入罐糟的粮糠比为4∶1时,发酵前期产生的CO2含量上升速度略微变缓,表明发酵前期微生物生长繁殖稍有减弱。其主要原因是该组入罐糟粮多糠少,淀粉含量比例高,酒糟间氧气含量变少,酵母菌代谢不充分;在发酵中期,CO2含量保持稳定且比粮糠比为1∶1的实验组整体CO2含量稍低一些;在发酵后期,CO2含量稍有回落。当粮糠比为1∶4时,发酵前期微生物繁殖明显减弱,CO2含量上升十分缓慢,发酵中后期CO2含量明显下降,发酵过程变缓。主要原因是入罐糟中粮食含量较少,糠壳比例较大,酒糟整体较为干燥,不利于微生物生长繁殖,甚至在发酵中后期微生物过早衰亡[23]。
2.2 不同粮糠比条件下酿造原酒酒精度及出酒率检测结果
发酵结束后,对3组实验中得到的酒糟分别进行蒸馏摘酒,其对应原酒酒精度及出酒率检测结果见表1。由表1可知,粮糠比为4∶1的酒糟蒸馏后得到的原酒20 ℃酒精度和60%vol出酒率最低,其主要原因是在粮食比例过高时,微生物会利用多余营养物质生长繁殖,优势菌体反而抑制酵母菌代谢活动,抑制发酵过程。又因糠壳含量较少导致酒糟紧致,孔隙度较低,进一步地抑制了酵母菌的发酵[4]。当粮糠比为1∶1时,得到原酒20 ℃酒精度最高,为65%vol,此时,出酒率也相对较高,为19.5%,根据原酒的酒精度和较高的出酒率可以判断为正常的发酵状态。当粮糠体积比为1∶4时,与粮糠比为1∶1的条件下相比,原酒出酒率提高了2.7%,但酒精度下降了3.7%vol,主要原因是酒糟整体较为干燥,不利于正常发酵,且糠壳含量过高,酒糟疏松,蒸馏时更容易穿汽[23]。
表1 不同粮糠比条件下酿造原酒酒精度及出酒率检测结果
Table 1 Detection results of alcohol content and liquor yield of original liquor under different grain and bran ratios conditions
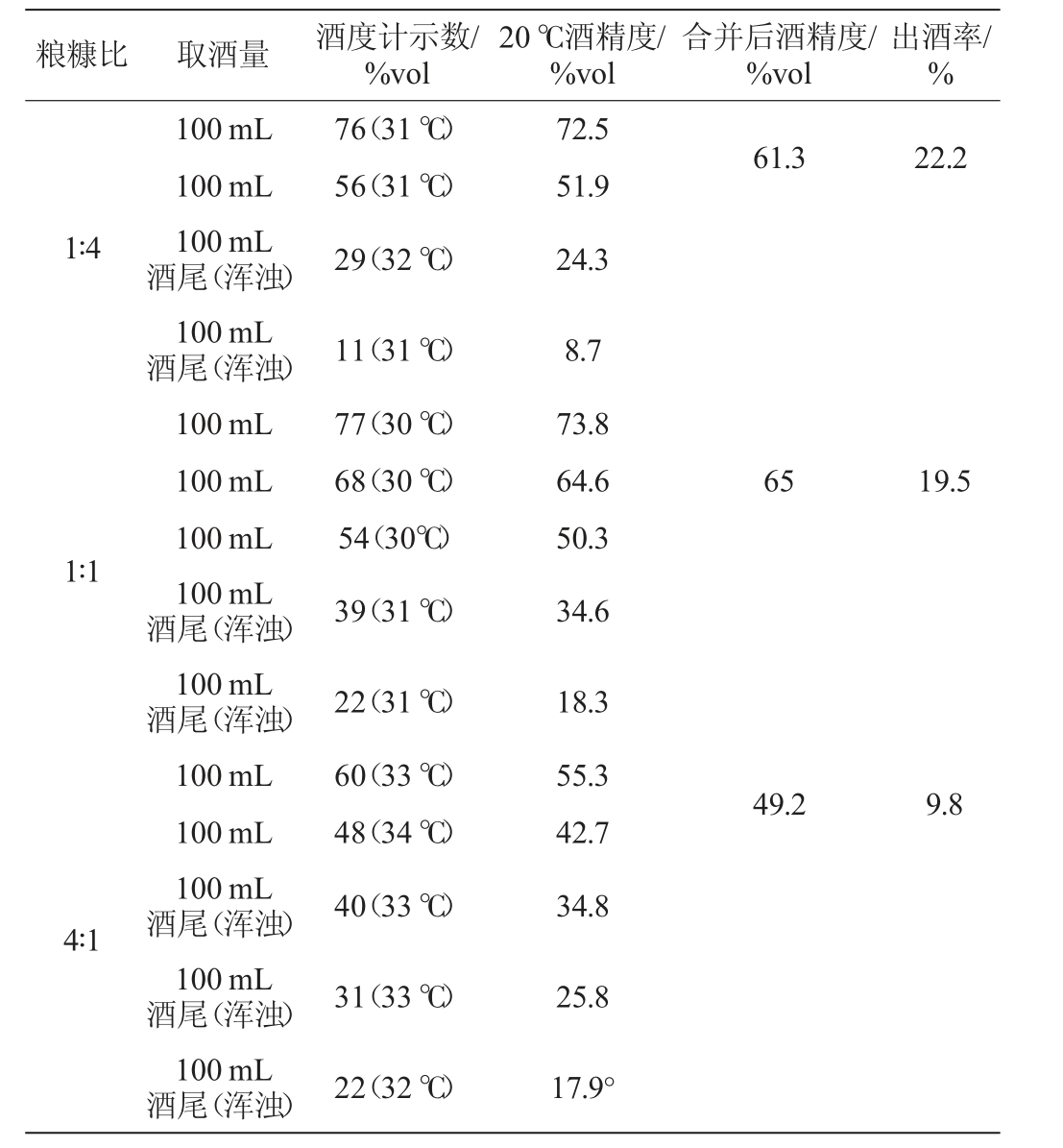
粮糠比 取酒量 酒度计示数/%vol 20 ℃酒精度/%vol合并后酒精度/%vol出酒率/%100 mL 100 mL 100 mL酒尾(浑浊)100 mL酒尾(浑浊)100 mL 100 mL 100 mL 100 mL酒尾(浑浊)100 mL酒尾(浑浊)100 mL 100 mL 100 mL酒尾(浑浊)100 mL酒尾(浑浊)100 mL酒尾(浑浊)76(31 ℃)56(31 ℃)29(32 ℃)72.5 51.9 24.3 61.3 22.2 1∶4 65 19.5 1∶1 11(31 ℃)77(30 ℃)68(30 ℃)54(30℃)39(31 ℃)8.7 73.8 64.6 50.3 34.6 22(31 ℃)60(33 ℃)48(34 ℃)40(33 ℃)18.3 55.3 42.7 34.8 49.2 9.8 4∶1 31(33 ℃)25.8 22(32 ℃)17.9°
结合上述蒸馏后得到的原酒质量参数可以看出,在正常发酵时,发酵产生的CO2含量均呈现前期快速上升、中间期缓慢上升且中后期稍有回落的变化规律,此时得到的原酒质量也较高。而当发酵过程中CO2含量前期上升速率较慢(降幅>50%)或中后期含量呈明显降低趋势时(降幅>10%),表明发酵异常,所得原酒质量也会受到影响。这样,通过对固态发酵过程中所产生的CO2含量进行在线监测,可以对发酵过程实现实时评测,有助于提高发酵质量和原酒品质。
2.3 不同水分含量入罐糟发酵过程中CO2含量变化特征
不同水分含量的入罐糟分别放入连接有CO2浓度检测仪的密封发酵罐内进行固态发酵,其数据采集的间隔时间同为60 min,测量得到一个发酵周期内CO2含量变化(见图2)。由图2可知,对于不同水分含量的入罐糟来说,在封罐后的固态发酵环节,其CO2含量依然呈现快速上升至稳定,然后在发酵后期呈缓慢下降的趋势,而对不同水分含量的入罐糟来说,其CO2含量上升速度有所区别。其中,水分含量为55%的入罐糟在发酵前期CO2含量上升速度最快,这也反应了在这些不同水分含量的入罐糟中,发酵过程的速度和代谢产物均有着明显的不同。
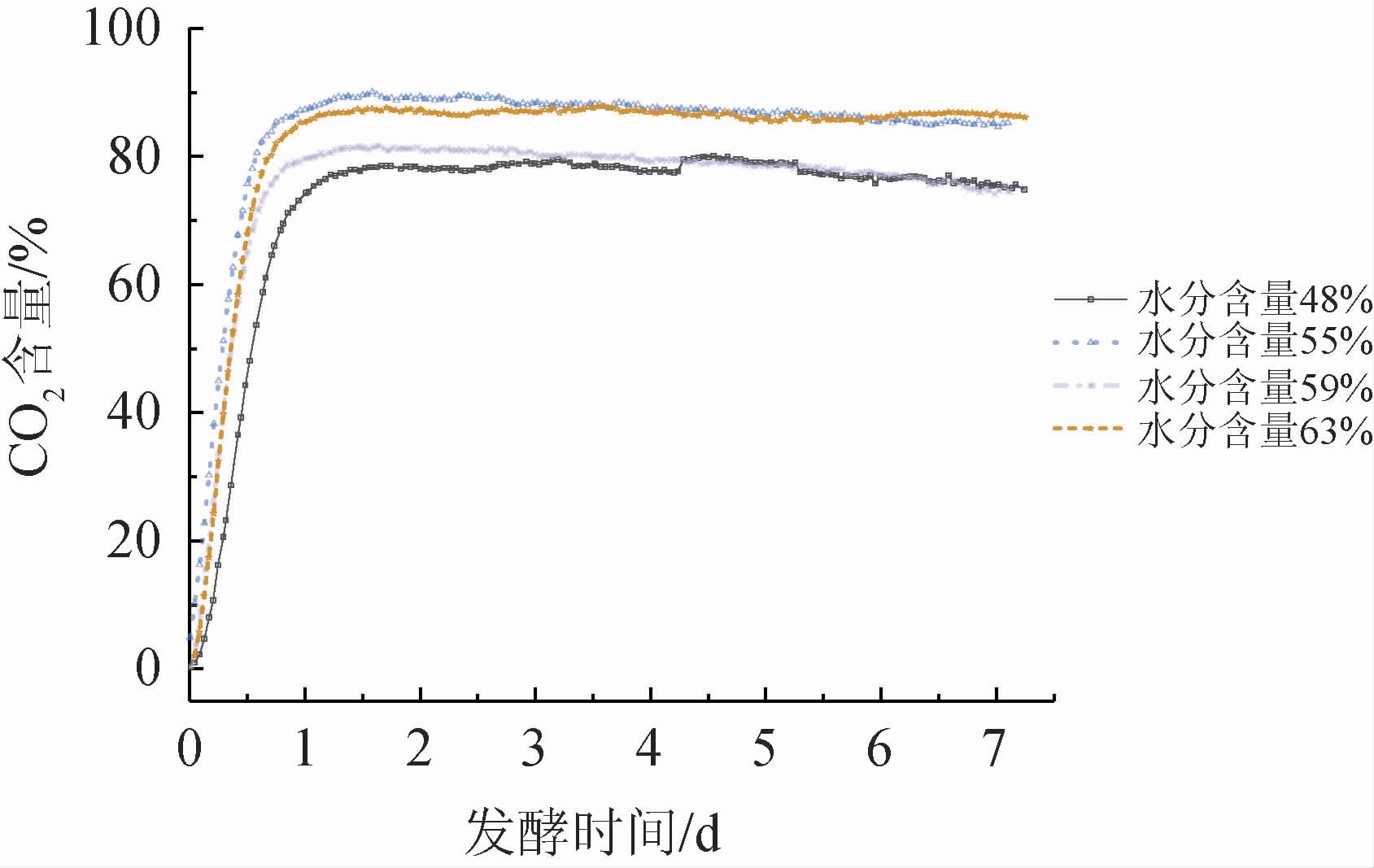
图2 不同水分含量入罐糟在一个发酵周期内所产CO2含量变化
Fig.2 Changes of CO2 content produced by fermented grains with different water content in fermenter in a fermentation cycle
当入罐糟水分含量为55%时,在发酵前期呈快速上升趋势,发酵中期时所产生的CO2含量稳定在最高值(约为89%),发酵后期CO2含量稍有回落;当入罐糟水分含量为48%时,发酵前期CO2含量上升减缓,发酵产生的CO2气体含量减少,且在发酵中后期出现二次峰值,这主要是过于干燥的环境使得有关耐干燥的微生物二次生长所导致[12];当入罐糟水分含量为59%时,发酵前期CO2含量上升速度也有所减缓,发酵中期时CO2含量稳定值相比于入罐糟水分含量为55%时也有所减少,这主要是由于酒糟水分含量增加时,微生物生长代谢减缓[23],发酵后期CO2含量稍有回落;当入罐糟水分含量为63%时,CO2含量在发酵前期快速上升,发酵中期稳定在较高值(约为87%),但在发酵后期出现二次峰值,主要是过于潮湿的环境使得喜水的微生物二次生长导致[12],这也抑制酵母菌的生长代谢。因此,入罐糟水分含量过高会影响酒糟正常发酵,最终影响原酒质量。
发酵结束后,取出这4组发酵实验的酒糟进行蒸馏摘酒,不同入罐糟水分含量条件下产出的原酒参数酒精度及出酒率的检测结果见表2。由表2可知,当水分含量为48%时,出酒率较低为14.2%,酒精度为69.1%vol,其原因可能是引起耐干燥微生物的二次生长,从而抑制酵母菌代谢活动[12],且水分含量的减少会降低微生物生长和代谢活性,使得淀粉利用不充分[4]。当入罐糟水分含量为55%时,原酒酒精度为61.6%vol,出酒率最高为18%。此条件下,CO2含量上升较快且含量较高,表明微生物代谢旺盛且维持至发酵结束。当入罐糟水分含量为59%时,原酒酒精度和出酒率都明显降低,主要原因是水分含量的增加会稀释微生物的代谢产物,部分溶于水的物质会随黄水渗入发酵罐底部,从而影响原酒质量[4]。当水分含量为63%时,甚至会引起另外一部分耐潮湿环境微生物的二次生长,从而抑制酵母菌代谢活动[12]。
表2 不同入罐糟水分含量条件下产出的原酒酒精度及出酒率的检测结果
Table 2 Determination results of alcohol content and liquor yield of original liquor produced by fermented grains in fermenter under different water content conditions
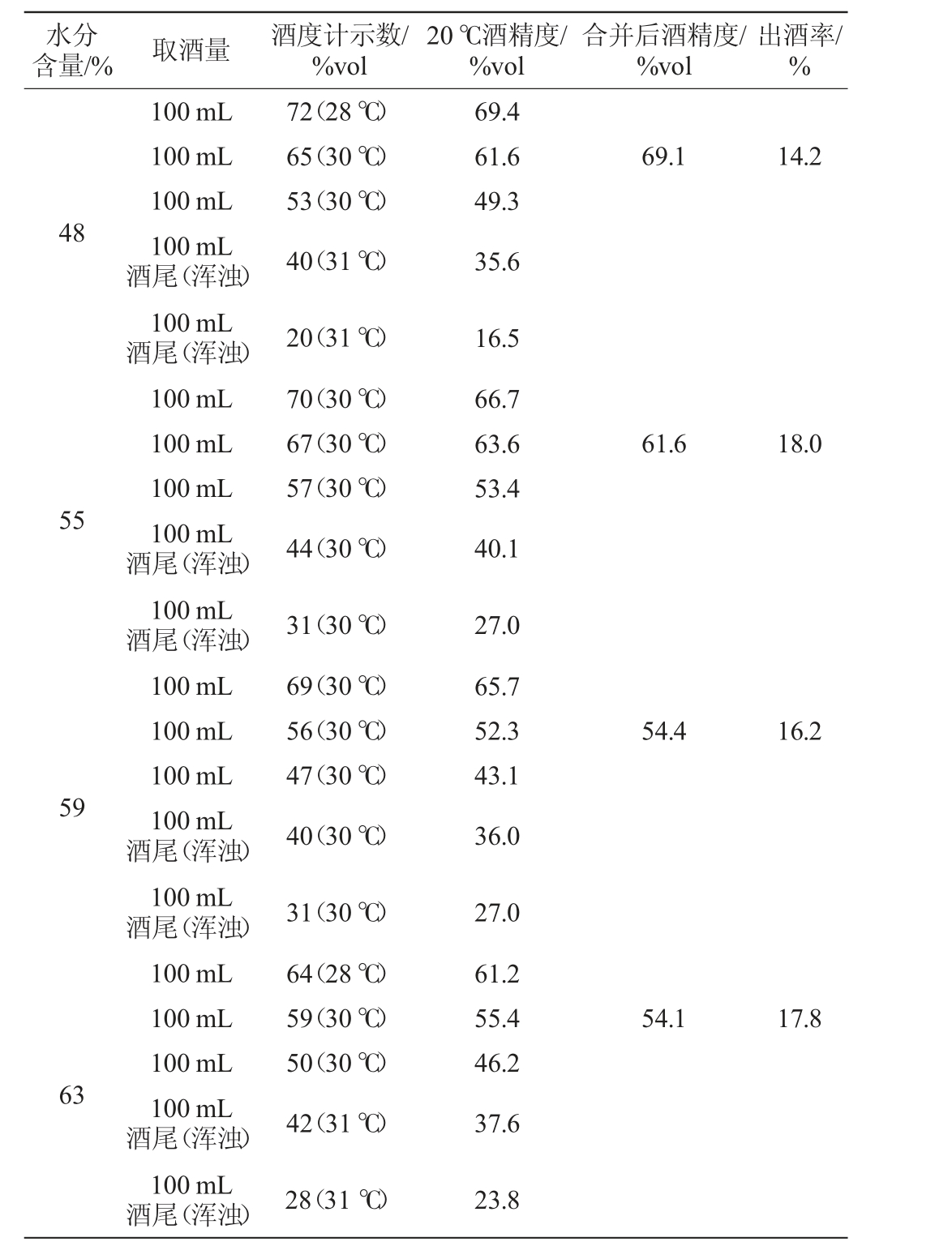
水分含量/% 取酒量 酒度计示数/%vol 20 ℃酒精度/%vol合并后酒精度/%vol出酒率/%100 mL 100 mL 100 mL 100 mL酒尾(浑浊)100 mL酒尾(浑浊)100 mL 100 mL 100 mL 100 mL酒尾(浑浊)100 mL酒尾(浑浊)100 mL 100 mL 100 mL 100 mL酒尾(浑浊)100 mL酒尾(浑浊)72(28 ℃)65(30 ℃)53(30 ℃)40(31 ℃)69.4 61.6 49.3 35.6 69.1 14.2 48 61.6 18.0 55 20(31 ℃)70(30 ℃)67(30 ℃)57(30 ℃)44(30 ℃)16.5 66.7 63.6 53.4 40.1 54.4 16.2 59 31(30 ℃)69(30 ℃)56(30 ℃)47(30 ℃)40(30 ℃)27.0 65.7 52.3 43.1 36.0 31(30 ℃)27.0 54.1 17.8 63 100 mL 100 mL 100 mL 100 mL酒尾(浑浊)100 mL酒尾(浑浊)64(28 ℃)59(30 ℃)50(30 ℃)42(31 ℃)61.2 55.4 46.2 37.6 28(31 ℃)23.8
对于不同水分含量的入罐糟,在发酵过程中CO2含量均呈现前期快速上升、中期缓慢上升和中后期稍有回落的变化规律。当CO2含量变化曲线前期上升速率大幅减缓(降幅>50%)或中后期CO2含量明显降低(降幅>10%),表明发酵异常,所得原酒质量也会受到影响。当CO2含量前期上升速率大幅减缓时,对应60%vol出酒率从18%下降到14.2%。而中后期CO2含量明显降低时,其20℃酒精度下降了3.8%vol。在该条件下,均可判定为发酵异常。
3 结论
本研究对不同粮糠比和水分含量酒糟固态发酵过程代谢CO2气体进行实时监测,并对其原酒产酒情况进行分析。结果表明,不同粮糠比入罐糟在固态发酵过程中,其CO2浓度呈前期快速上升、中期保持稳定和后期缓慢下降的特点,粮糠比为1∶1的入罐糟在发酵过程中所产生的CO2含量在整个发酵过程中最高,酒精度及出酒率均最高,分别为65%vol、19.5%。不同水分含量的入罐糟在固态发酵过程中,CO2含量在发酵前期呈快速上升趋势至发酵中器趋于稳定,在发酵中后期呈缓慢下降的趋势,且水分含量为55%的入罐糟在发酵前期CO2含量上升速度最快,此时,原酒酒精度及出酒率均最高,分别为61.6%vol、18.0%。该检测方法可以直接反映密闭发酵环境中微生物的生长代谢状况及发酵状态,且避免了频繁采样进行离线检测对发酵环境造成的破坏和时间延迟。通过对代谢气体CO2浓度变化观察,可以实现对固态发酵过程的实时监测。这种对于发酵代谢气体的实时监测可为合理调整配糟提供数据依据,从而达到精准配料和提高原酒品质的目的。
[1]赵爽,杨春霞,窦灿,等.白酒生产中酿酒微生物研究进展[J].中国酿造,2012,31(4):5-10.
[2]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2005:37-39.
[3]阎文飞,程凡升,郭瑞,等.北方黄酒陈酿过程中主要成分含量及其变化趋势[J].中国酿造,2017,36(5):72-75.
[4]赵金松.小曲清香白酒生产技术[M].北京:中国轻工业出版社,2018:80-104.
[5]晋湘宜,蔡开云,陈萍,等.中国白酒酿酒微生物研究概述[J].酿酒,2020,47(5):16-21.
[6]隋明,岳文喜,朱克永,等.酿酒微生物对酒体质量及风格的影响[J].酿酒,2018,45(6):24-25.
[7]王昆,庹先国,张贵宇,等.清香型酒醅水分,酸度和淀粉含量的在线预测[J].食品与发酵工业,2022,48(7):85-90.
[8] LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[9]杨建刚,苏畅,窦晓,等.泸型酒发酵过程中酵母菌演替规律及其对部分风味分子形成的影响[J].食品科学,2018,39(18):166-172.
[10] LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int,2017,102:68-76.
[11]王晓燕,谢建军.生物发酵过程的在线检测及控制技术进展研究[J].科技创新与应用,2016,21(7):64-67.
[12]李曦.不同温度变化过程对糟醅发酵影响的研究[J].酿酒,2022,49(3):63-66.
[13]余建国.初探固态法小曲酒质量的提高[J].酿酒科技,2006(11):65-67.
[14]张霞,王中凯,郑佳,等.浓香型白酒发酵过程中酒醅理化指标变化规律研究[J].酿酒科技,2021(10):53-56.
[15]施思,张文学,邓宇,等.用DGGE技术构建白酒酿造微生物指纹图谱的初步研究[J].中国酿造,2010,29(1):118-120.
[16]邱增钰,王亚平,李博艺,等.温度对高温大曲液态培菌过程菌群结构的影响[J].中国酿造,2017,36(5):30-35.
[17]钱志伟,卢中明,杨平,等.测定发酵期间糟醅温度的方法:CN201110104731.7[P].2012-11-07.
[18]王勇,周森,魏金旺.基于高通量测序技术分析牛栏山大曲微生物多样性[J].中国酿造,2019,38(2):58-61.
[19]张亚举.基于气体浓度在线检测的发酵过程反馈控制补料系统设计与实现[D].北京:北京化工大学,2020.
[20]冯爱军,赵文红,白卫东,等.不同黄酒中有机酸的测定[J].中国酿造,2010,29(8):144-146.
[21] TAN Y W, ZHONG H P, ZHAO D, et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].Int J Food Microbiol,2019,311:108350.
[22]LIU C C,FENG S B,WU Q,et al.Raw material regulates flavor formation via driving microbiota in Chinese liquor fermentation[J].Front Microbiol,2019,10:1520-1533.
[23]李慧娟,金元浩,李群庆,等.白酒发酵过程代谢气体与原酒品质的相关性分析[J].食品科技,2022,47(4):105-110.
[24]蒲岚,张超,李璐,等.温度对浓香型白酒发酵生酸的影响[J].宜宾学院学报,2010,10(12):97-100.
[25] YUAN L, LI G F, YAN N, et al.Optimization of fermentation conditions for fermented green jujube wine and its quality analysis during winemaking[J].J Food Sci Technol,2022,59(1):288-299.
[26]卢斌,王用普,王晓宇,等.白酒生产过程在线监测管理系统的开发[J].酿酒科技,2018(7):124-131.
[27]唐贤华,张崇军,彭志云,等.不同糠壳比例对浓香型白酒发酵糟醅质构特性的影响[J].酿酒,2019,46(5):28-31.
[28]蔡小波,林杨,杨平,等.不同品种稻壳对酿酒生产的影响研究[J].酿酒科技,2020(11):75-80.
[29]叶建秋,黄丹平,田建平,等.高光谱图像技术检测大曲发酵过程中的水分含量[J].食品与发酵工业,2020,46(9):250-254.