羊肚菌(Morchella esculenta L.),又称羊肚菜、羊肚蘑,属羊肚菌科(Morchellaceae)羊肚菌属(Morchella),是珍贵的食药兼用菌,因形似蜂巢状,又似羊肚状,故而得此名[1]。羊肚菌营养丰富,含有多糖、蛋白质(氨基酸)、甾醇、有机酸和微量元素等活性物质[2],并具有抗氧化、抗衰老、抗肿瘤、增强免疫力、降血糖、降血脂、抗疲劳等功效[2-7]。羊肚菌种类较多,不同产地的羊肚菌,其蛋白质含量有所差异。据报道,羊肚菌子实体中蛋白含量约为7.87%~38.11%[8],蛋白含量因品种而异。此外,羊肚菌还含有7种人体必需氨基酸,是一种优质的蛋白质源。
生物活性肽是由2个以上氨基酸通过肽键连接而成的介于氨基酸和蛋白质之间的多肽(相对分子质量<6 000 Da)[9-11],这类肽通常具有抗氧化、抗病毒、降血压、降低胆固醇、抑制细菌、提高免疫力、抗癌等活性[12]。常见生物活性肽的制备方法有微生物发酵法、分离提取法和酶解法等[12],其中,酶法制备的优点在于酶解条件易控制,制备的生物活性肽性能比较稳定,在酸性条件和较高温度条件下结构保持完整。酶解法利用特定的蛋白酶类,可以有目的地对特定肽段进行剪切,以期获得所需功能活性的肽[13]。食用菌水解酶是一种针对食用菌水解的专用复合酶制剂,具有纯天然、安全无毒、水解能力强等特点,目前已应用于蘑菇[14]、香菇[15]、草菇[16]、百灵菇[17]、金针菇和杏鲍菇[18]等食用菌酶解提取多糖及风味物质的研究。当前,对羊肚菌的研究主要集中在羊肚菌多糖提取及抗氧化活性方面[19-21],利用酶解法酶解羊肚菌制备多肽也有学者进行了研究[22-23],但利用食用菌水解酶来水解羊肚菌制备抗氧化肽和进行抗运动疲劳研究较少报道。
为进一步提高羊肚菌蛋白的附加经济价值,拓宽羊肚菌产品的深加工产业链,本研究以羊肚菌蛋白为原料,采用酶解法制备羊肚菌蛋白抗氧化肽,筛选最佳蛋白酶,以水解度及1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力为评价指标,通过单因素试验及响应面法优化羊肚菌蛋白抗氧化肽的制备工艺条件,并进行抗氧化和抗运动疲劳研究,以期为羊肚菌蛋白进行保健食品深加工开发提供理论依据。
1 材料与方法
1.1 材料与试剂
羊肚菌子实体:河南金海食用菌研究院有限公司;无特定病原体(specificpathogenfree,SPF)级雄性KM小鼠:40只,体质量(18±2)g,批号为[SCXK(豫)2020-0002]:洛阳普万泰生物技术有限公司。
碱性蛋白酶(酶活2万U/g):北京索莱宝科技有限公司;胰蛋白酶(酶活4万U/g)、食用菌水解酶A1(酶活2万U/g)、食用菌水解酶A2(酶活10万U/g):广西南宁庞博生物工程有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):成都麦卡希化工有限公司;血清尿素氮、血乳酸、肝糖原、肌糖原和超氧阴离子试剂盒:南京建成生物工程研究所;其他试剂均为分析纯。
1.2 仪器与设备
HH-2数显恒温水浴锅:常州澳华仪器有限公司;DL-5高速离心机:上海安亭科学仪器厂;LGJ-1F冷冻干燥机:北京四环仪器有限公司;PHS-3C数显pH计:上海精科仪器厂;紫外可见光分光光度计:上海菁华科技仪器有限公司;RE-5203旋转蒸发仪:上海蚁霖科学仪器有限公司。
1.3 方法
1.3.1 羊肚菌蛋白提取
参考文献[24]方法提取羊肚菌蛋白:利用碱提酸沉法提取羊肚菌蛋白,将羊肚菌干制品用粉碎机粉碎,过60目筛,按照料液比1∶50(g∶mL)加入蒸馏水,调节pH值至12,在超声温度60 ℃下浸提60 min。然后以8 000 r/min的转速离心10 min,取上清液,用双缩脲法[25]测定羊肚菌的蛋白质含量。提取的羊肚菌蛋白经冷冻干燥后,得羊肚菌蛋白粉末,备用。
1.3.2 羊肚菌蛋白抗氧化肽的制备
羊肚菌蛋白粉按试验设计加水复溶配制成5%的蛋白溶液,取50 mL溶液在超声功率300 W条件下超声30 min,调节溶液至酶最适pH和温度,恒温酶解(50 ℃、1.5 h),再灭酶处理(100 ℃、10 min),自然冷却至常温后,在转速为4 000 r/min条件下离心10 min,取上清液,调节pH至中性后旋转蒸发,冷冻干燥即得羊肚菌蛋白抗氧化肽粉。
1.3.3 蛋白酶筛选试验
以水解度和DPPH自由基清除率为评价指标,进行蛋白酶筛选试验,分别采用碱性蛋白酶、胰蛋白酶、食用菌水解酶A1、食用菌水解酶A2水解羊肚菌蛋白粉制备抗氧化肽,加酶量均为0.1%,酶解时间均为1.5 h,其酶解温度及pH值见表1。
表1 各种蛋白酶酶解条件
Table 1 Enzymatic hydrolysis conditions of various proteases
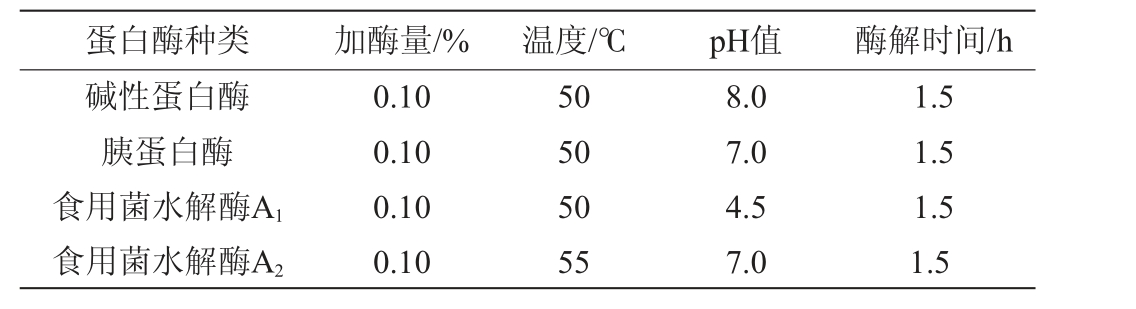
蛋白酶种类 加酶量/% 温度/℃ pH值 酶解时间/h碱性蛋白酶胰蛋白酶食用菌水解酶A1食用菌水解酶A2 0.10 0.10 0.10 0.10 50 50 50 55 8.0 7.0 4.5 7.0 1.5 1.5 1.5 1.5
水解度的测定:羊肚菌酶解液中氨基酸态氮含量的测定参考GB 5009.235—2016《食品安全国家标准食品中氨基酸态氮的测定》,总氮含量的测定参考GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》,水解度计算公式如下:
1.3.4 酶解条件优化单因素试验
以DPPH自由基清除率和水解度为评价指标,考察食用菌水解酶A1添加量(0.05%、0.10%、0.15%、0.20%、0.25%)、酶解时间(30 min、60 min、90 min、120 min、150 min、180 min)、底物质量分数(3%、4%、5%、6%、7%)、酶解温度(40 ℃、45 ℃、50 ℃、55 ℃、60 ℃)、酶解pH值(4.0、4.5、5.0、5.5、6.0)对酶解羊肚菌蛋白制备抗氧化肽DPPH自由基清除率和水解度的影响。
1.3.5 酶解条件优化响应面试验
固定水解酶添加量为0.15%,选取底物质量分数(A)、酶解温度(B)、酶解时间(C)、酶解pH值(D)为自变量,以DPPH·清除率(Y)为响应值,运用响应面法进行4因素3水平响应面试验优化其酶解条件,响应面试验设计因素与水平见表2。
表2 酶解条件优化响应面试验设计因素及水平
Table 2 Factors and levels of response surface test for enzymatic hydrolysis conditions optimization
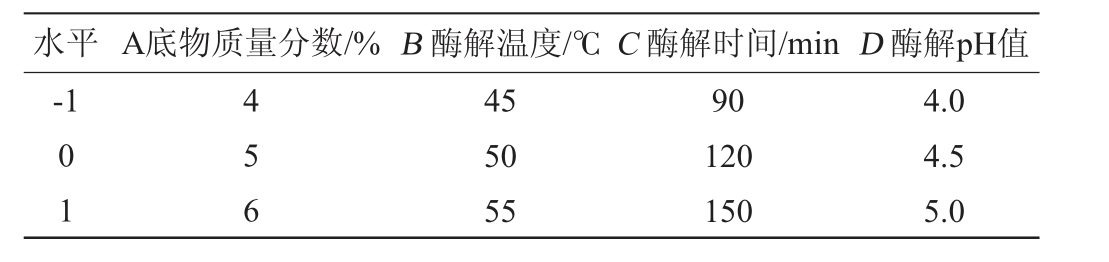
水平 A底物质量分数/% B 酶解温度/℃C 酶解时间/min D 酶解pH值-1 01 456 45 50 55 90 120 150 4.0 4.5 5.0
1.3.6 体外抗氧化活性分析
DPPH·和·OH清除率的测定参考文献[26-27]方法;超氧阴离子自由基清除活性的测定参考超氧阴离子测定试剂盒说明书。
1.3.7 羊肚菌蛋白抗氧化肽的抗运动疲劳活性
(1)试验动物分组与给药
试验前,分4个组别进行试验,每组小鼠10只。各小组需要保持在正常饲养的情况下,对照组小鼠给予纯净水(20 mg/kg)灌胃,低剂量、中剂量、高剂量组分别灌胃羊肚菌蛋白抗氧化肽50 mg/kg、100 mg/kg、200 mg/kg,连续灌胃30 d。所有试验均在小鼠灌胃羊肚菌蛋白抗氧化肽30 min后进行相关操作[28-29]。
(2)负重游泳时间测定试验
小鼠负重游泳测试放置在水温28 ℃的水中,并让各个小组分别进行负重游泳试验,游泳箱内的水深控制在35 cm左右。在试验过程当中,对小鼠进行铅丝捆绑负重,详细记录小鼠负重游泳的时间。
(3)爬杆时间测定试验
将小鼠放置在长30 cm的玻璃棒上,玻璃棒的直径控制在10 mm左右,从而使小鼠身体各部位肌肉保持紧张感觉。在整个试验过程中,注意记录小鼠攀爬玻璃棒的疲劳时间,详细记录爬杆时间。
(4)常压耐缺氧时间测定试验
将小鼠放置在放有15 g石灰的大瓶中,在小鼠进入大瓶后及时进行瓶口的密封,根据实际情况详细记录小鼠耐缺氧时间。
(5)疲劳相关生化指标的测定
参考文献[30]方法对小鼠进行采血制备血清,并用颈椎脱臼法使小鼠死亡,解剖后,取出小鼠的肝组织制备成10%的组织匀浆,并取小鼠股四头肌,对羊肚菌蛋白抗氧化多肽液进行血清尿素氮、血乳酸测定;再取一定量的肝组织匀浆,试用于测定肝糖原含量、肌糖原含量和超氧化物歧化酶(superoxide dismutase,SOD)活力。血清指标和组织指标均按剂盒说明书进行测定,血清指标包括血乳酸和血清尿素氮;组织指标包括肝糖原(肝脏组织)、肌糖原(股四头肌)、超氧化物歧化酶(SOD)活力。
1.3.8 数据分析
利用Excel2019、Origin 9.5软件进行作图和数据分析,采用Design-Expert 13.0软件进行响应面试验设计及方差分析,利用SPSS26.0软件进行统计学显著性分析。
2 结果与分析
2.1 羊肚菌蛋白抗氧化肽蛋白酶的筛选
由图1可知,以水解度为考察指标对蛋白酶排序从高到低为食用菌水解酶A1>碱性蛋白酶>食用菌水解酶A2>胰蛋白酶。以DPPH自由基清除率为考察指标对蛋白酶排序从高到低为食用菌水解酶A1>食用菌水解酶A2>碱性蛋白酶>胰蛋白酶。综合考虑,食用菌水解酶A1酶解效果最好,其水解度及对DPPH自由基清除率均最高,分别为24.66%、52.53%。食用菌水解酶是以纤维素酶和蛋白酶为主的复合酶[14],而食用菌水解酶A1以纤维素酶为主,纤维素酶有破坏菇体细胞壁的作用,并将纤维素部分降解为葡萄糖,可促进细胞内物质(蛋白质、多糖类、脂肪等)的溶出[16]。综合考虑,选择食用菌水解酶A1作为酶解羊肚菌制备抗氧化肽水解用酶。

图1 不同蛋白酶酶解对水解度及DPPH自由基清除率的影响
Fig.1 Effects of different proteases on hydrolysis degree and DPPH free radical scavenging rates
不同字母表示差异显著(P<0.05)。
2.2 酶解条件优化单因素试验结果
2.2.1 食用菌水解酶A1添加量的确定
由图2可知,随着食用菌水解酶A1添加量在0.05%~0.15%范围内的增加,水解度和DPPH自由基清除率均呈先升高的趋势;当食用菌水解酶A1添加量为0.15%时,水解度和DPPH自由基清除能力均最高,分别为30.22%、76.68%;当食用菌水解酶A1添加量在0.15%~0.25%范围内的增加,水解度和DPPH自由基清除能力均下降。综合考虑,最适食用菌水解酶A1添加量为0.15%。
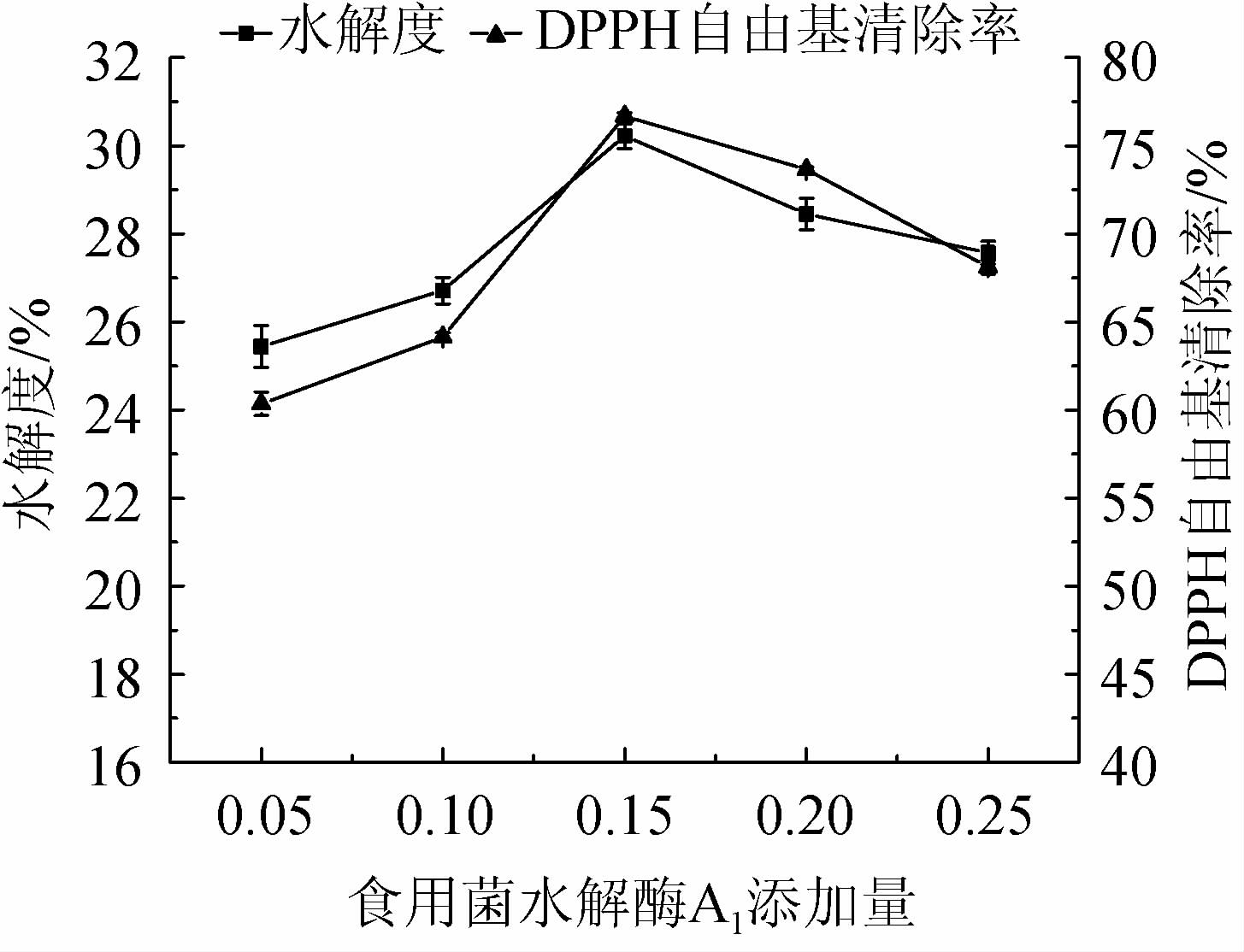
图2 食用菌水解酶A1添加量对水解度及DPPH自由基清除率的影响
Fig.2 Effects of edible fungi hydrolase A1 addition on hydrolysis degree and DPPH free radical scavenging rate
2.2.2 底物质量分数的确定
由图3可知,随着底物质量分数在3%~5%范围内的增加,水解度及DPPH自由基清除率呈上升趋势;当底物质量分数为5%时,水解度及DPPH自由基清除率均达到最大值,分别为26.17%、80.56%;当底物质量分数>5%时,水解度逐渐下降,DPPH自由基清除率有所下降。其原因可能是,适宜的底物质量分数使蛋白质与酶分子更好地接触,提高酶解效率;但当底物质量分数过大时,水解液黏度增大,酶不能与底物充分反应,底物与蛋白酶扩散速率降低,反应受到抑制,酶解效率下降,具有抗氧化活性的肽生成量相应降低[31-32]。综合考虑,最适底物质量分数为5%。
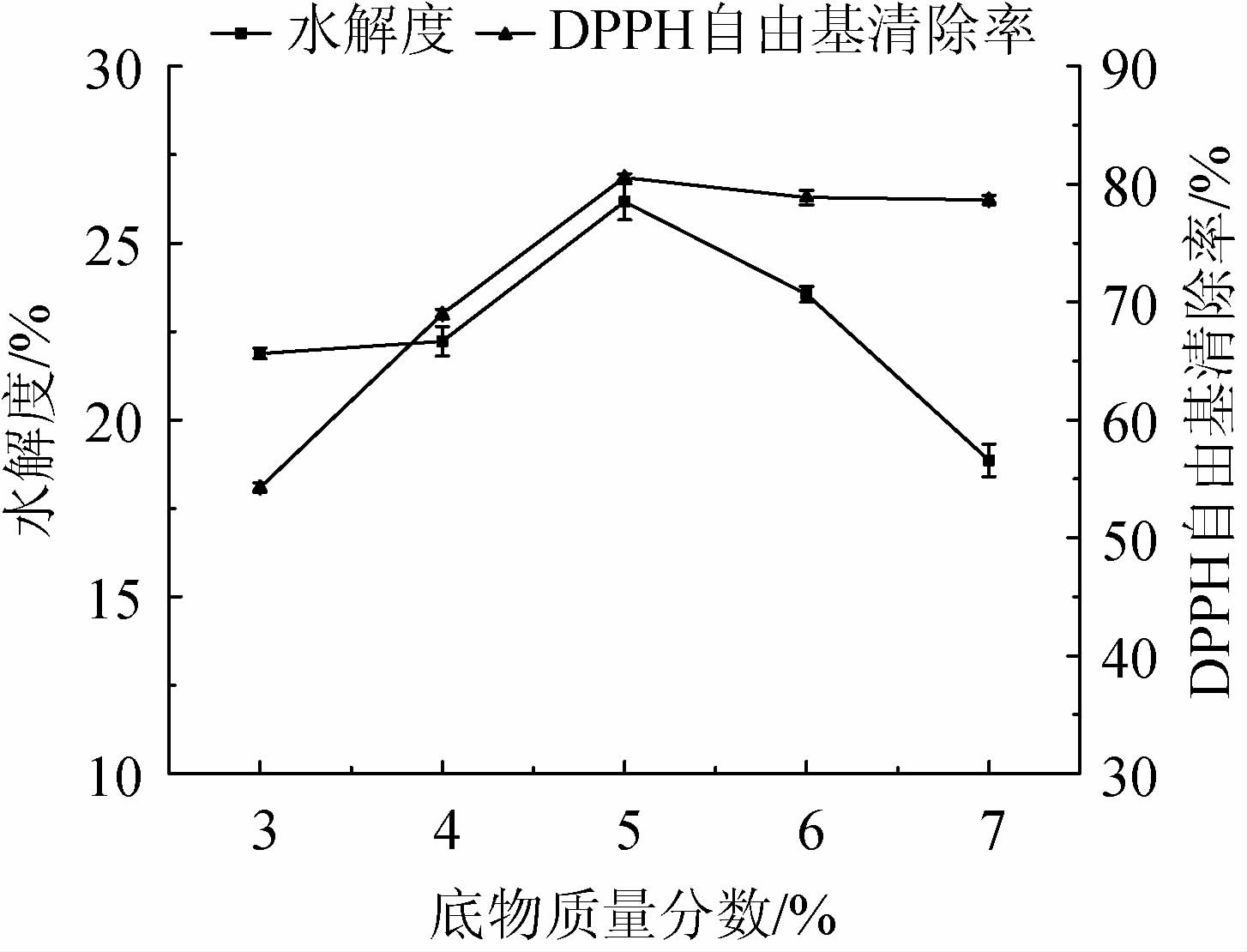
图3 底物质量分数对水解度及DPPH自由基清除率的影响
Fig.3 Effects of substrate mass fraction on hydrolysis degree and DPPH free radical scavenging rate
2.2.3 酶解时间的确定
由图4可知,随着酶解时间在30~120 min的延长,水解度及DPPH自由基清除率均逐渐上升;酶解时间为120 min时,水解度和DPPH自由基清除率达到最大值,分别为28.88%、71.98%;当酶解时间>120 min,水解度有所下降,DPPH自由基清除率明显下降。其原因可能是,酶解初期,酶与底物充分反应,水解和生成具有抗氧化活性的多肽较多;随着酶解时间的延长,底物不断被消耗,酶与底物特异性位点被完全反应,继续酶解导致底物的过度水解,具有抗氧化活性的肽进一步被降解为低活性的氨基酸[33]。综合考虑,最适酶解时间为120 min。
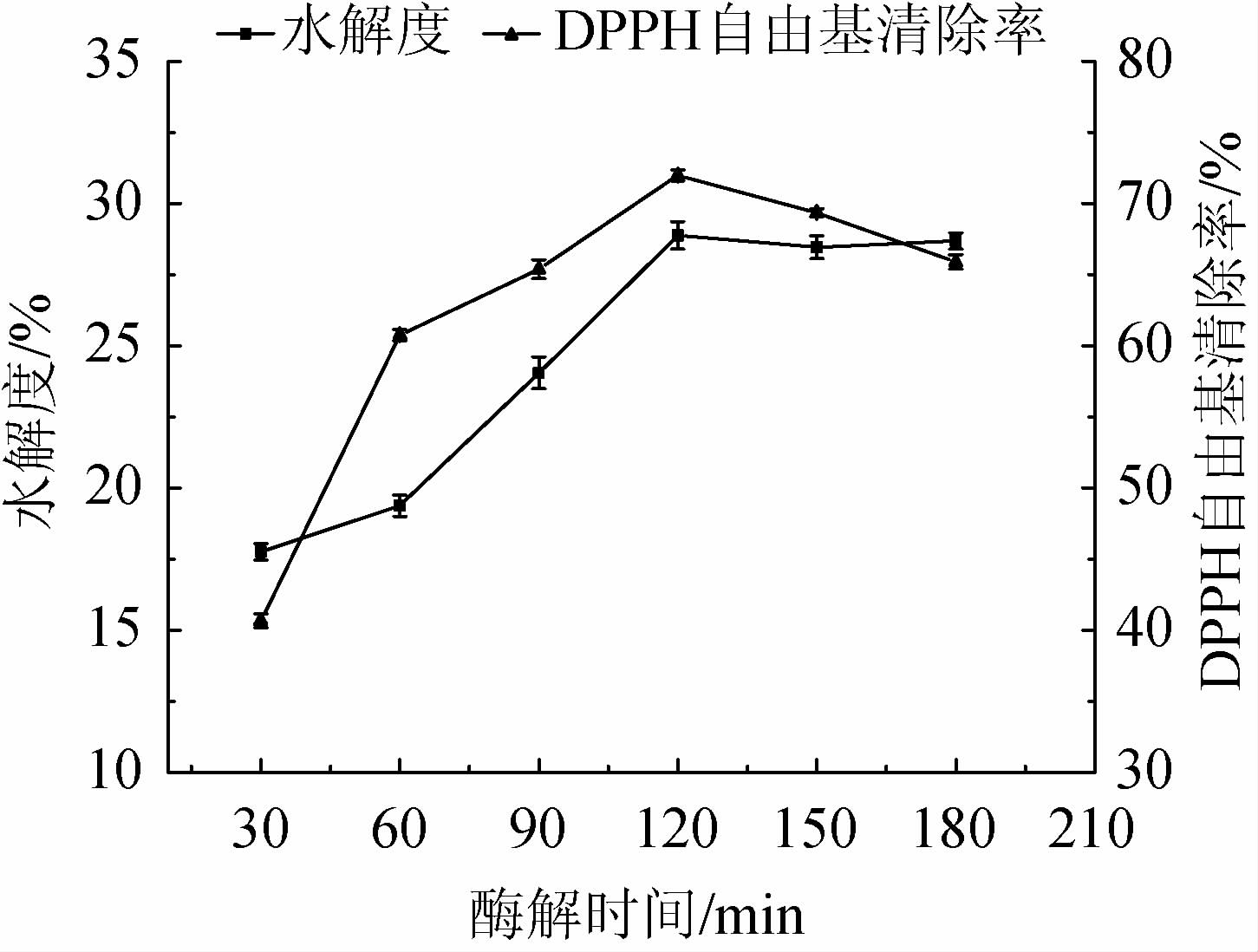
图4 酶解时间对水解度及DPPH自由基清除率的影响
Fig.4 Effects of enzymolysis time on hydrolysis degree and DPPH free radical scavenging rate
2.2.4 酶解温度的确定
由图5可知,随着酶解温度在40~50 ℃的升高,水解度及DPPH自由基清除率均逐渐上升;当酶解温度为50 ℃时,水解度及DPPH自由基清除率均达到最大值,分别为29.09%、78.67%;当酶解温度>50 ℃时,水解度和DPPH自由基清除率下降。综合考虑,最适酶解温度为50 ℃。
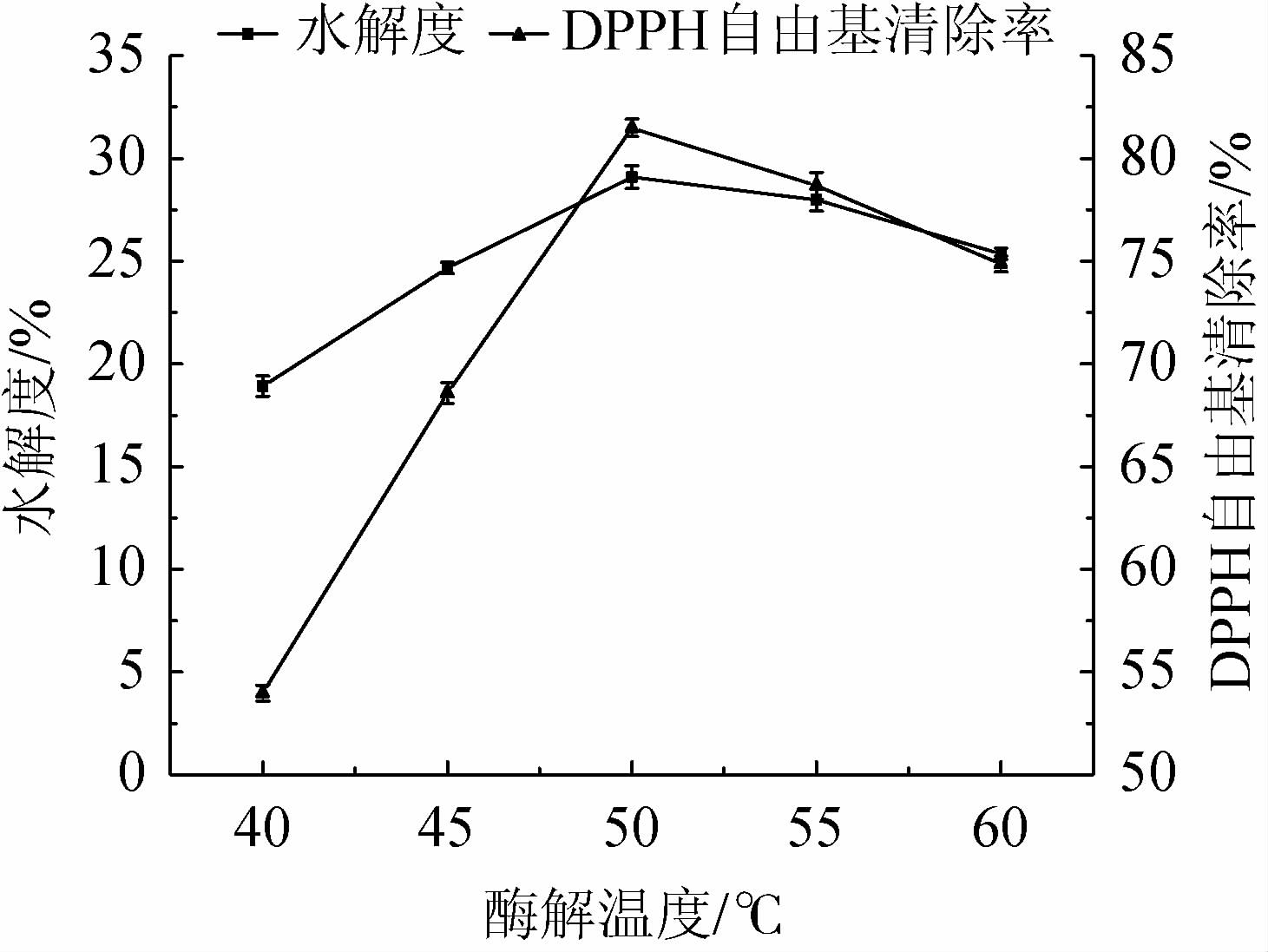
图5 酶解温度对水解度及DPPH自由基清除率的影响
Fig.5 Effects of enzymolysis temperature on hydrolysis degree and DPPH free radical scavenging rate
2.2.5 酶解pH值的确定
由图6可知,当酶解pH值为4.0~4.5时,水解度逐渐上升;当酶解pH值为4.5时,水解度达最大值,为30.26%;当酶解pH值>4.5时,水解度下降。当酶解pH值为4.0~5.0时,DPPH自由基清除率逐渐上升;当酶解pH值为5.0时,DPPH自由基清除率达最大值,为82.22%;当酶解pH值>5.0时,DPPH自由基清除率下降。综合考虑,最适酶解pH值为4.5。
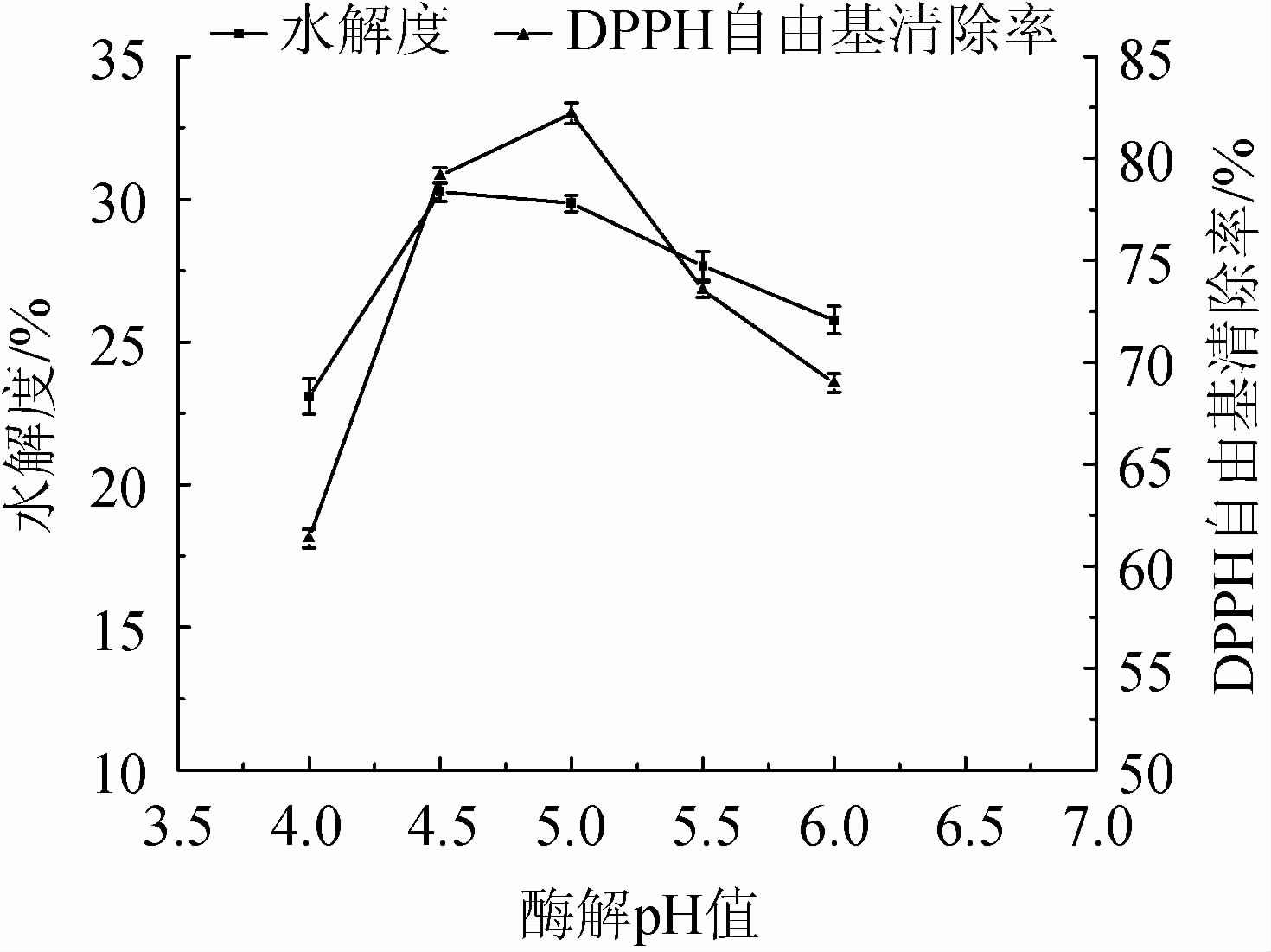
图6 酶解pH值对水解度及DPPH自由基清除率的影响
Fig.6 Effects of enzymolysis pH on hydrolysis degree and DPPH free radical scavenging rate
2.3 酶解条件优化响应面试验
2.3.1 响应面试验设计结果与方差分析
在单因素试验结果的基础上,固定食用菌水解酶A1添加量为0.15%,以底物质量分数(A)、酶解温度(B)、酶解时间(C)、酶解pH值(D)为自变量,以DPPH自由基清除率(Y)为响应值,进行4因素3水平的响应面试验设计,酶解条件优化响应面试验设计及结果见表5,回归模型的方差分析见表6。
表5 酶解条件优化响应面试验设计及结果
Table 5 Design and results of response surface tests for enzymatic hydrolysis conditions optimization
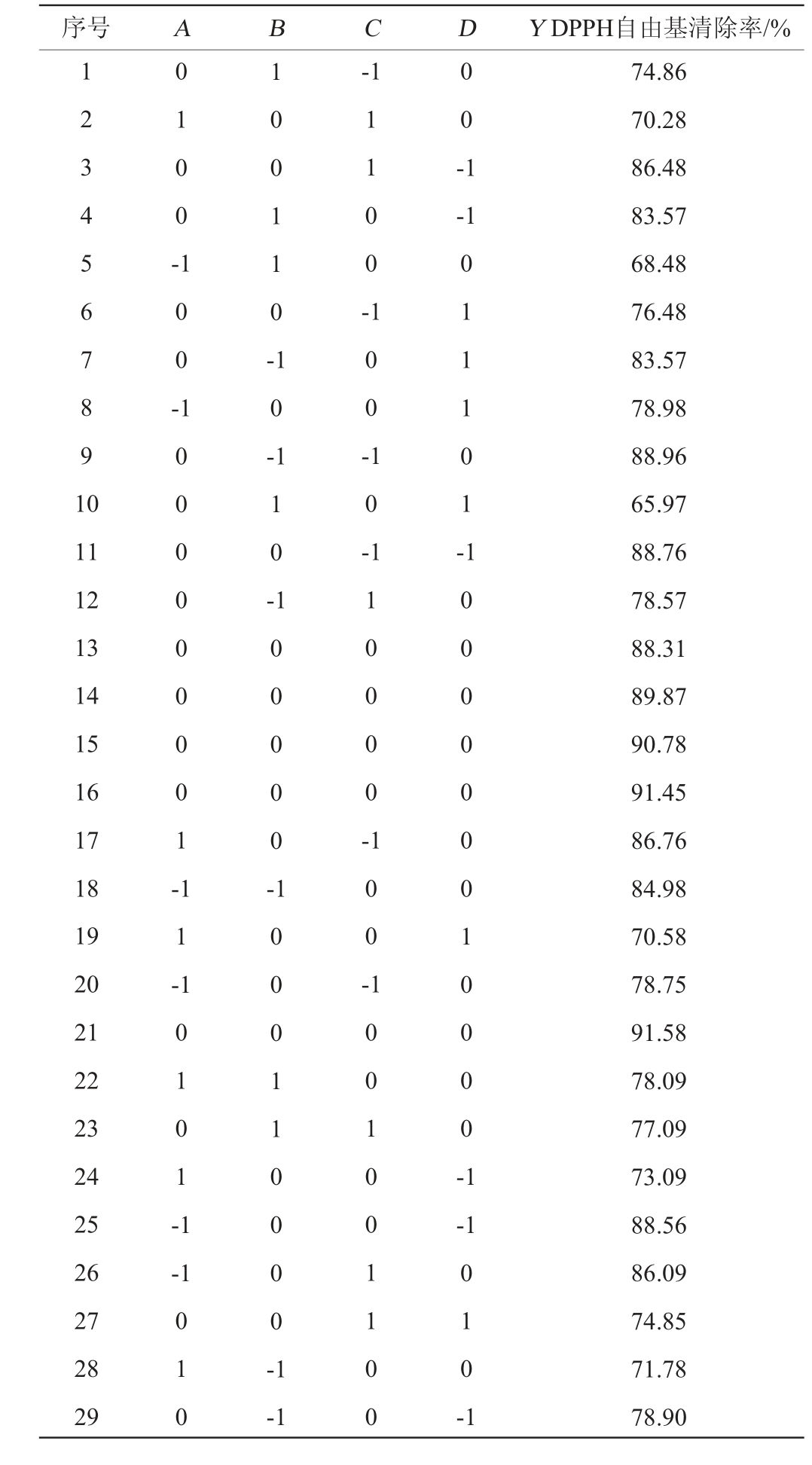
序号 A B Y DPPH自由基清除率/%1 2 3 4 5 6 7 8 9 1 0 0 1 0 0 -C D-1 0 0 -1-1 1 0 0 -1 0 0 1 1 0 -1 1 0 0 -1 0 0 0 0 0 0 0 0 1 -1 0 -1 0 0 -11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1 1 0 -1 0 -1 1 0 0 0 0 -0 1 1 1 0 1 -1 1 -1 0 0 0 0 0 -1 0 1 0 1 -1 1 0 0 -1 0 0 0 0 0 0 0 1 0 0 0 0 -1-1-1 0 1 0 1 0 0 0 1 1 0 0 0 0 -1-1 1 0 0 1 0 0 1 1 0 0 0 1 0 -1 74.86 70.28 86.48 83.57 68.48 76.48 83.57 78.98 88.96 65.97 88.76 78.57 88.31 89.87 90.78 91.45 86.76 84.98 70.58 78.75 91.58 78.09 77.09 73.09 88.56 86.09 74.85 71.78 78.90
表6 回归模型方差分析
Table 6 Analysis of variance of regression model
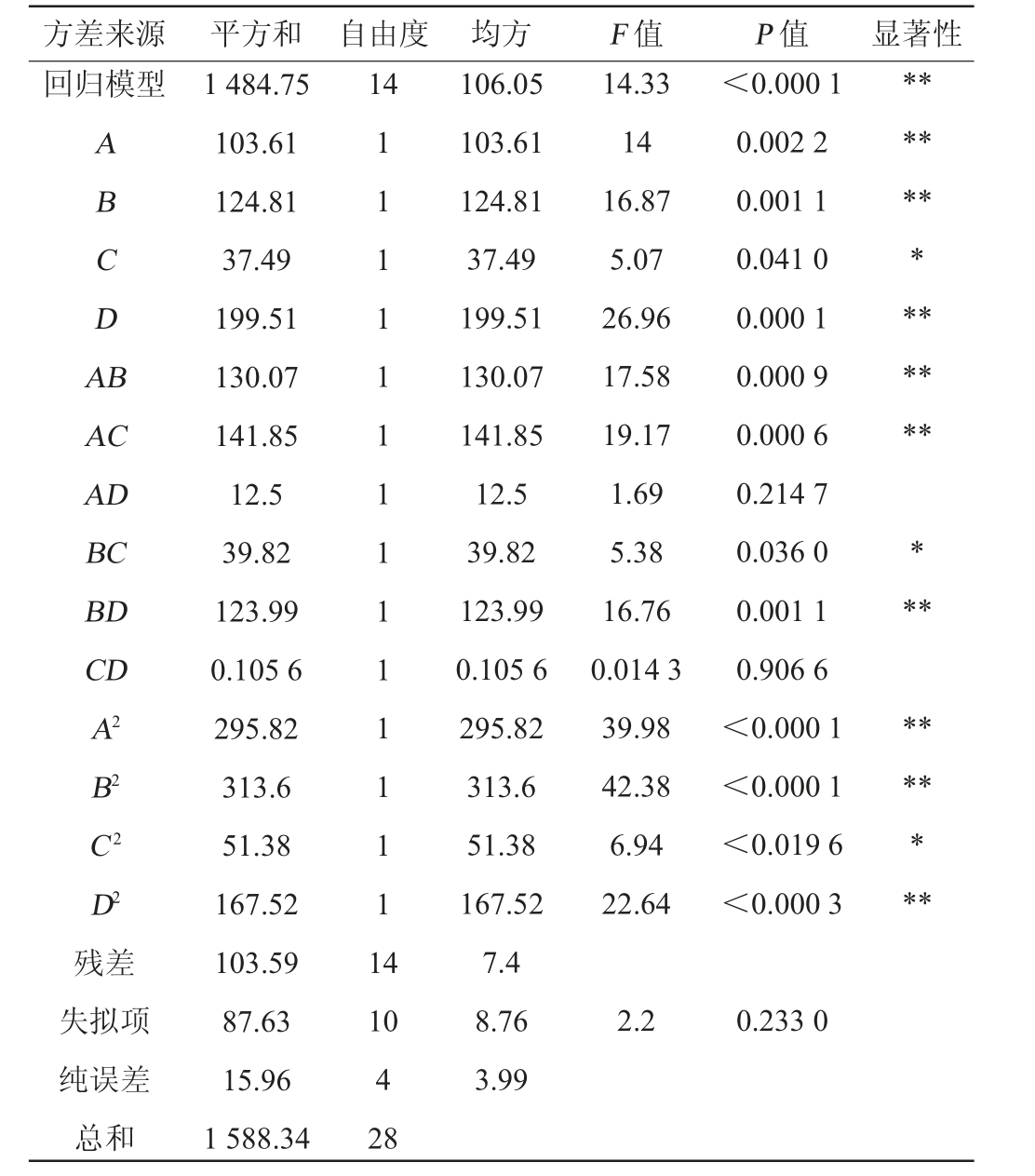
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性回归模型14 ABCDA B AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总和1 484.75 103.61 124.81 37.49 199.51 130.07 141.85 12.5 39.82 123.99 0.105 6 295.82 313.6 51.38 167.52 103.59 87.63 15.96 1 588.34 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 14.33 14 16.87 5.07 26.96 17.58 19.17 1.69 5.38 16.76 0.014 3 39.98 42.38 6.94 22.64<0.000 1 0.002 2 0.001 1 0.041 0 0.000 1 0.000 9 0.000 6 0.214 7 0.036 0 0.001 1 0.906 6<0.000 1<0.000 1<0.019 6<0.000 3***********************10 4 28 106.05 103.61 124.81 37.49 199.51 130.07 141.85 12.5 39.82 123.99 0.105 6 295.82 313.6 51.38 167.52 7.4 8.76 3.99 2.2 0.233 0
利用Design-Expert 13.0响应面软件对表5数据进行模型的方差和显著性分析,得到以DPPH·清除率为响应值,食用菌水解酶酶解羊肚菌蛋白制备抗氧化肽的二次多项式回归方程为:
由表6可知,响应面模型P值<0.000 1,说明该回归方程模型达极显著水平,失拟项不显著(P值=0.233>0.05),说明回归模型的实测值与拟合值拟合程度较好。模型的决定系数R2=0.942 1,调整决定系数R2Adj=0.884 3,表明该模型可以解释88.43%食用菌水解酶A1酶解羊肚菌蛋白制备抗氧化肽DPPH自由基清除率的变化。由P值可知,一次项A、B、D,交互项AB、AC、BD,二次项A2、B2、D2对结果影响极显著(P<0.01);一次项C、交互项BC、二次项C2对结果影响显著(P<0.05);其他项对结果影响不显著(P>0.05)。由F值可知,对水解羊肚菌蛋白制备抗氧化肽的影响强弱顺序为酶解pH值>酶解温度>底物质量分数>酶解时间。
2.3.2 响应面分析
食用菌水解酶A1水解羊肚菌蛋白制备抗氧化肽的响应面见图7。
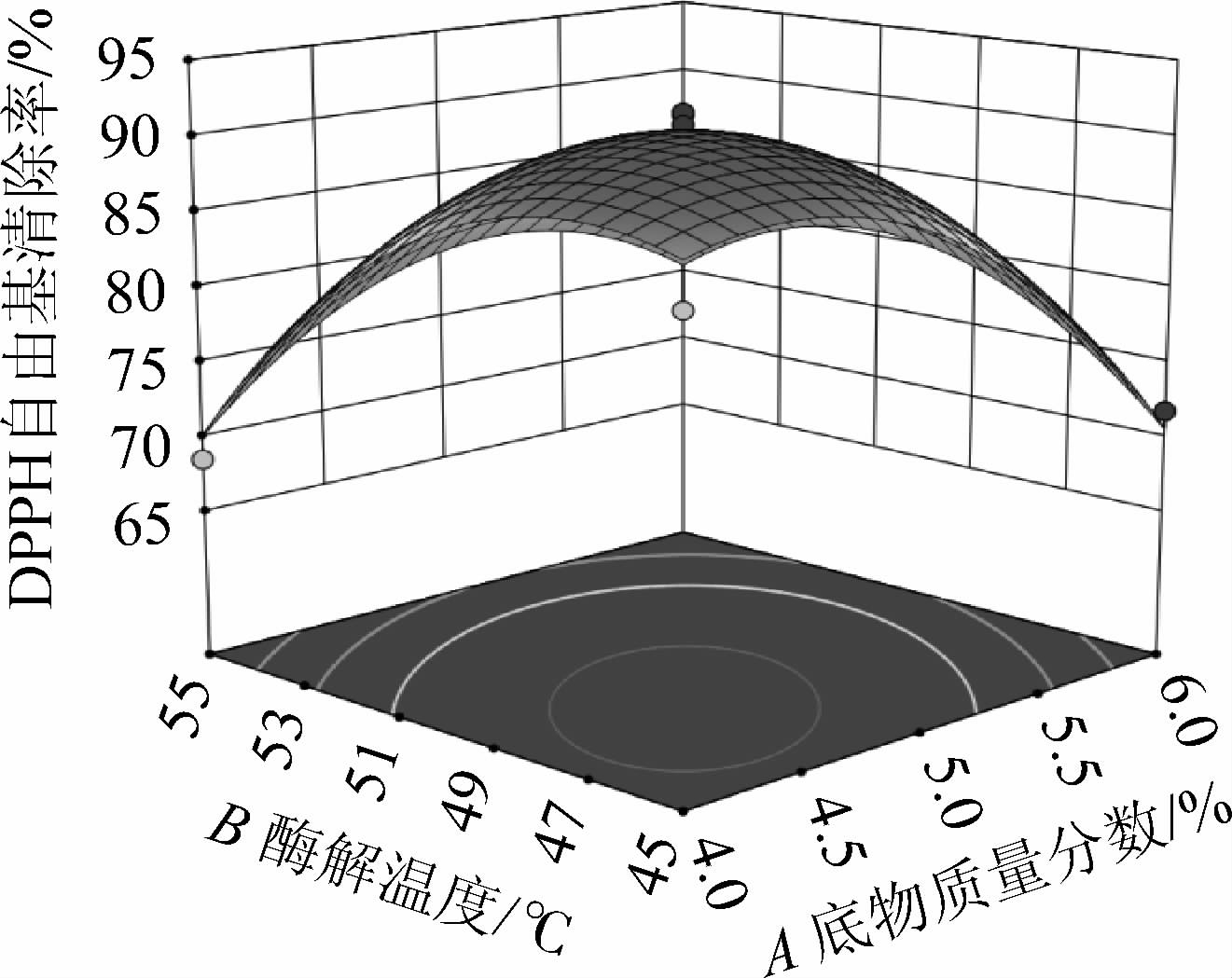
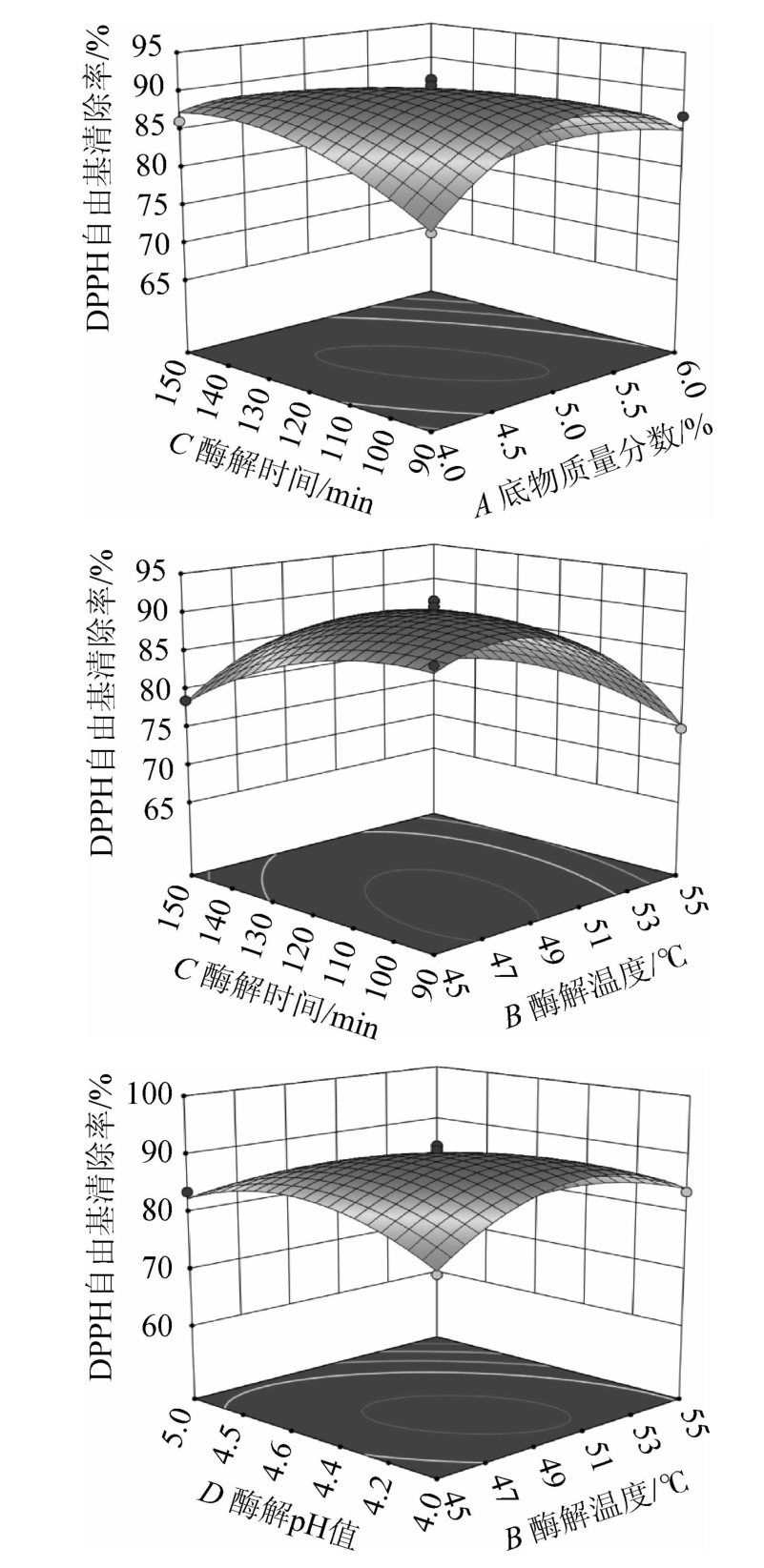
图7 各因素间交互作用对DPPH自由基清除率影响的响应曲面及等高线
Fig.7 Response surface plots and contour lines of effect of interaction between various factors on DPPH free radical scavenging rate
由图7可知,各因素的交互作用中,AB、AC、BC、BD的等高线为椭圆形,表明两两之间的交互作用显著(P<0.05),这与方差分析结果一致。
2.3.3 最佳酶解条件的确定与验证
固定食用菌水解酶A1添加量为0.15%,利用Design-Expert V13.0软件对食用菌水解酶A1酶解羊肚菌蛋白制备抗氧化肽的工艺进行优化预测,得到最佳酶解工艺条件为底物质量分数4.793%、酶解温度49.021 ℃、酶解时间115.703 min、酶解pH值4.36。在上述酶解工艺条件下,食用菌水解酶复合酶酶解羊肚菌蛋白抗氧化肽的DPPH·清除率预测值为91.91%。
为验证预测工艺条件,结合实际操作,将上述预测优化工艺条件修正为底物质量分数4.80%、酶解温度49.00 ℃、酶解时间116 min、酶解pH 4.4,并进行3次验证试验,得到酶解羊肚菌蛋白抗氧化肽的DPPH·平均清除率实际值为91.94%,接近预测值,表明该模型可用于食用菌水解酶酶解羊肚菌蛋白制备抗氧化肽工艺的预测。
2.4 体外抗氧化分析
抗氧化活性研究发现,羊肚菌蛋白抗氧化肽对DPPH·、·OH及·O2-清除率分别为(91.34±0.49)%、(85.04±0.59)%及(63.90±0.63)%,表明羊肚菌蛋白抗氧化肽具有一定的抗氧化作用。
2.5 抗运动疲劳活性分析
2.5.1 羊肚菌蛋白抗氧化肽对小鼠力竭游泳时间、爬杆时间、耐缺氧时间的影响
由表7可知,与空白对照组相比,经过对小鼠灌胃羊肚菌蛋白抗氧化肽后的低、中、高剂量组,各项运动指标均发生明显变化,力竭游泳时间、爬杆时间、耐缺氧时间均显著提升(P<0.05)。随着剂量浓度的增加,力竭游泳时间由对照组的(16.62±0.40)min提高到高剂量组的(32.29±0.39)min,游泳时间提高将近1倍。小鼠在高剂量组的灌胃下,其爬杆时间、耐缺氧时间较空白组也延长了1.56倍和0.87倍,并表现出剂量-量效关系。结果表明,羊肚菌蛋白抗氧化肽在增强小鼠运动能力方面,具有提高小鼠运动耐力和抗疲劳的效果。
表7 羊肚菌蛋白抗氧化肽对小鼠力竭游泳、爬杆、耐缺氧时间的影响
Table 7 Effect of Morchella esculenta protein antioxidant peptides on exhausted swimming, pole climbing and hypoxia tolerance time of mice
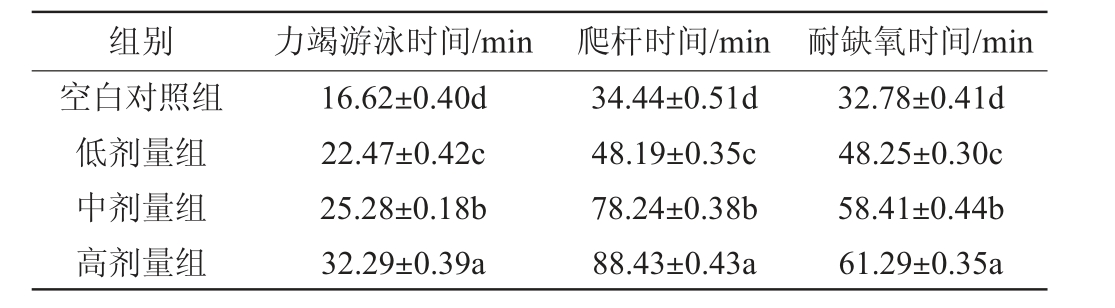
注:同一列中不同字母表示差异显著(P<0.05)。下同。
组别 力竭游泳时间/min 爬杆时间/min 耐缺氧时间/min空白对照组低剂量组中剂量组高剂量组32.78±0.41d 48.25±0.30c 58.41±0.44b 61.29±0.35a 16.62±0.40d 22.47±0.42c 25.28±0.18b 32.29±0.39a 34.44±0.51d 48.19±0.35c 78.24±0.38b 88.43±0.43a
2.5.2 羊肚菌蛋白抗氧化肽对小鼠生化指标的影响
由表8可知,与空白组相比,对灌胃羊肚菌蛋白抗氧化肽的小鼠,其各项生化指标得到显著提高(P<0.05)。随着灌胃剂量浓度的增加,小鼠体内的血清尿素氮、血乳酸、肌糖原、肝糖原等含量也有明显变化。其中,灌胃高剂量组羊肚菌蛋白抗氧化肽液的小鼠体内血清尿素氮含量由空白对照组(12.56±0.45)mmol/L降低到(10.26±0.08)mmol/L;血乳酸含量由对照组(8.32±0.12)mmol/L降低到(5.39±0.23)mmol/L,降低了35.21%。糖原是体内储存能量的主要形式之一,能够与糖在机体内进行转化作用,肌糖原通过无氧酵解的途径直接将能量供给肌肉组织,进而为机体提高能量,缓解机体的疲乏[34],肝糖原分解是血糖维持稳定的重要保障[35]。灌胃低、中、高剂量组的羊肚菌蛋白抗氧化肽液后,小鼠体内的肝糖原和肌糖原含量明显提高。说明灌胃羊肚菌蛋白抗氧化肽液后,能提高小鼠体内的肝糖原和肌糖原含量,并降低小鼠体内的血清中尿素氮、血乳酸含量,进而呈现较好的抗运动疲劳活性。
表8 羊肚菌蛋白抗氧化肽对小鼠生化指标的影响
Table 8 Effect of Morchella esculenta protein antioxidant peptides on biochemical indexes of mice
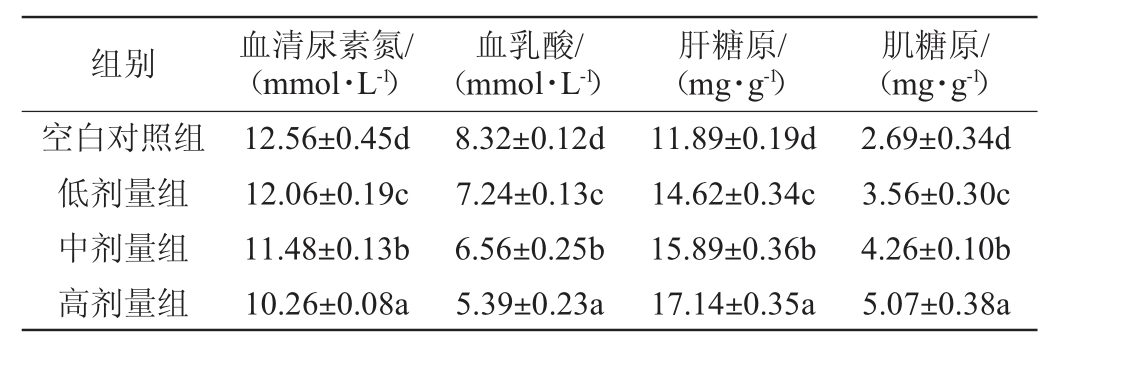
组别 血清尿素氮/(mmol·L-1)血乳酸/(mmol·L-1)肝糖原/(mg·g-1)肌糖原/(mg·g-1)空白对照组低剂量组中剂量组高剂量组12.56±0.45d 12.06±0.19c 11.48±0.13b 10.26±0.08a 8.32±0.12d 7.24±0.13c 6.56±0.25b 5.39±0.23a 11.89±0.19d 14.62±0.34c 15.89±0.36b 17.14±0.35a 2.69±0.34d 3.56±0.30c 4.26±0.10b 5.07±0.38a
2.6 羊肚菌抗氧化多肽的抗氧化与抗疲劳作用的关系
以小鼠力竭游泳时间(X)为横坐标,SOD活力(Y)为纵坐标,进行羊肚菌抗氧化与抗疲劳活性的线性相关分析,得到线性方程为Y=0.050 7X+12.674,相关系数R2=0.948 7。表明在一定范围内,羊肚菌蛋白抗氧化肽的小鼠力竭游泳时间与肝脏SOD活力有一定的相关性,说明羊肚菌蛋白抗氧化肽的抗氧化与抗疲劳作用具有相关性。
3 结论
本研究利用单酶对羊肚菌蛋白进行最优酶的筛选,得到较优水解酶为食用菌水解酶A1,制备羊肚菌蛋白抗氧化肽最佳工艺条件为食用菌水解酶A1添加量0.15%、底物质量分数4.80%、酶解温度49.00 ℃、酶解时间116 min、酶解pH 4.4,对DPPH·的清除率为91.94%。体外抗氧化实验结果表明,羊肚菌多肽具有一定的抗氧化作用对DPPH·、·OH和·O2-的清除率分别为91.34%、85.04%、63.90%。抗运动疲劳活性实验结果表明,羊肚菌蛋白抗氧化肽可降低血清尿素氮、血乳酸含量,提高肝糖原和肌糖原的储备,进而提高小鼠的运动耐力,表明羊肚菌蛋白抗氧化肽具有一定的抗运动疲劳的作用和功效,这为羊肚菌蛋白进行深加工开发提供了研究方向和理论依据。
[1]么越,荣丹,唐梦瑜,等.羊肚菌药用价值及产品开发现状[J].中国食用菌,2022,41(7):13-17,21.
[2]李文佳,田野,高昊,等.羊肚菌化学成分及药理活性研究进展[J].菌物研究,2017,15(2):144-150.
[3]李华,张运畅,姜伊,等.羊肚菌抗运动疲劳生理功能研究进展[J].赤峰学院学报:自然科学版,2021,37(12):36-39.
[4] LI F, JIN Y, WANG J, et al.Structure identification of two polysaccharides from Morchella sextelata with antioxidant activity[J].Foods,2022,11(7):1-13.
[5]ZHANG Q,WU C,FAN G,et al.Improvement of antioxidant activity of Morchella esculenta protein hydrolysate by optimized glycosylation reaction[J].CyTA-J Food,2018,16(1):238-246.
[6] MENG X, CHE C, ZHANG J, et al.Structural characterization and immunomodulating activities of polysaccharides from a newly collected wild Morchella sextelata[J].Int J Biol Macromol,2019,129:608-614.
[7]ZHANG J X,ZHAO J Y,LIU G Y,et al.Advance in Morchella sp.polysaccharides:Isolation, structural characterization and structure-activity relationship:A review[J].Int J Biol Macromol,2023,247:1-11.
[8]顾可飞,李亚莉,刘海燕,等.牛肝菌、羊肚菌营养功能特性及利用价值浅析[J].食品工业,2018,39(5):287-291.
[9]党仪安,王文亮,弓志青,等.食用菌生物活性肽制备及功能活性研究进展[J].食品工业,2019,40(8):228-231.
[10]薛荣,苏秀兰,李国华.生物活性肽的研究进展[J].中国疗养医学,2015,24(3):237-238.
[11]钱磊,张志军.食药用真菌生物活性肽制备的研究进展[J].北方园艺,2016,38(18):193-195.
[12]王耀冉,陈明杰,李治平,等.生物活性肽制备,鉴定及其生物活性研究进展[J].食品工业,2021,42(12):349-354.
[13]杨杰,赵淇,张乐,等.猴头菇多糖保健功效的研究进展[J].农产品加工,2021(12):79-81.
[14]李琴,朱科学,周惠明.酶解预处理对蘑菇汤营养成分及挥发性风味物质的影响[J].食品与生物技术学报,2012,31(8):836-843.
[15]华洵璐,张一平,匡群,等.酶法结合超声破壁提取香菇水溶性糖和多糖的研究[J].食用菌,2011,33(2):54-57.
[16]揭广川,陈红杰,李必金.微波辅助复合酶法提取草菇中的风味物质[J].食品与机械,2015,31(1):164-166,243.
[17]王肖莉,薛淑静,周明,等.基于主成分分析的白灵菇预煮液酶解研究[J].食品与机械,2015,31(4):35-37,71.
[18]林群英,龙良鲲,葛婷婷,等.金针菇和杏鲍菇菇脚酶解条件优化及抗氧化活性评价[J].北方园艺,2016(21):155-159.
[19]张强,吴彩娥.羊肚菌菌丝体蛋白的理化特性及抗氧化活性[J].浙江农业学报,2016,28(8):1408-1415.
[20]范三红,田雨,王娇娇,等.响应面法优化羊肚菌清蛋白的提取及其抗氧化性[J].食品工业,2019,40(11):113-118.
[21]李敬,周伟杰,赵士豪,等.羊肚菌多糖的分离纯化及其体外抗氧化、抗肿瘤活性研究[J].天然产物研究与开发,2016,28(9):1351-1356.
[22]范三红,田雨,张锦华.羊肚菌抗氧化肽的制备、纯化和鉴定[J].山西农业科学,2020,48(1):45-51,54.
[23]田雨.羊肚菌蛋白质提取及抗氧化肽制备研究[D].太原:山西大学,2020.
[24]李思,孟萌,马彦华,等.响应面法优化羊肚菌中蛋白质的提取工艺[J].食品安全质量检测学报,2020,11(7):2090-2095.
[25]何亚.羊肚菌的蛋白提取及其抗氧化性研究[D].太原:山西大学,2015.
[26]任嘉兴,张锦华,白宝清,等.羊肚菌多糖提取工艺优化及抗氧化性研究[J].山西农业科学,2018,46(7):1199-1203.
[27]DONG Y H,QI Y R,LIU M,et al.Antioxidant,anti-hyperlipidemia and hepatic protection of enzyme-assisted Morehella esculenta polysaccharide[J].Int J Biol Macromol,2018,120:1490-1499.
[28]曹亮.羊肚菌多糖对小鼠抗运动疲劳及耐缺氧的影响[J].中国食用菌,2020,39(6):40-42.
[29]郑红波.羊肚菌胞内多糖对小鼠运动心肌损伤的影响[J].中国食用菌,2019,38(8):52-54,58.
[30]刘雅娜,包晓玮,王娟,等.沙棘多糖抗运动性疲劳及抗氧化作用的研究[J].食品工业科技,2021,42(10):321-326.
[31]张志国,孙晓燕.碱性蛋白酶与外切蛋白酶酶解大豆分离蛋白及脱苦工艺的研究[J].粮食与油脂,2016,29(8):53-57.
[32]张靖,苏琳,陈晓雨,等.羊骨抗氧化肽酶解法制备和响应面工艺优化[J].食品与生物技术学报,2021,40(3):18-27.
[33]王群,郑海涛,葛尧,等.酶法制备鲽鱼鱼皮胶原蛋白肽及其清除超氧阴离子自由基的研究[J].中国农学通报,2011,27(14):87-93.
[34] LIU Y Y, LIU C J.Antifatigue and increasing exercise performance of Actinidia arguta crude alkaloids in mice[J].J Food Drug Anal,2016,24(4):738-745.
[35]乌兰,刘睿,杜倩,等.核桃肽对小鼠的抗疲劳作用[J].中国食物与营养,2018,24(12):50-54.