苯乳酸(phenyllactic acid,PLA)又称为2-羟基-3-苯丙酸,含有一个手性碳原子,可以形成两种对映体,即D-PLA和L-PLA,是一种具有广谱抗菌活性的化合物[1-4]。多种微生物如乳酸杆菌(Lactobacillus)、芽孢杆菌(Bacillus)、魏斯氏菌(Weissella)和白地霉(Geotrichum candidum)等都具有合成苯乳酸的能力[5-8]。其中,乳酸菌是公认的食品级安全(generally recognized as safe,GRAS)微生物,其可利用苯丙酮酸或苯丙氨酸为底物代谢产生苯乳酸,已成为微生物生产苯乳酸的优势菌种,其合成的苯乳酸也被视为食品级安全的天然防腐剂[9-10]。
LAVERMICOCCA P等[11]首次从酸面团中筛选获得一株产苯乳酸的植物乳杆菌(Lactobacillus plantarum)21B,苯乳酸产量为56 mg/L。随后研究者们从多种环境来源的乳酸菌中筛选产苯乳酸菌株,STRÖM K等[12]从草贮饲料中分离出一株高产苯乳酸的植物乳杆菌MiLAB393,苯乳酸产量为94 mg/L;刘长建等[13]从猪的消化系统中筛选得到24株能够产苯乳酸的乳酸菌,其中分离自猪粪便的乳酸菌r16苯乳酸产量较高,达233.0 mg/L;李兴峰等[14]从自然发酵泡菜中分离筛选出一株苯乳酸产量较高的乳酸菌,产量可达91 mg/L。但由于乳酸菌分离来源的不同,不同菌株间合成苯乳酸产量差异较大,且苯乳酸产量相对都较低[15]。因此,要实现乳酸菌工业化发酵生产苯乳酸,筛选高产苯乳酸的乳酸菌具有重要的研究价值和意义。
鱼类肠道内微生物种类丰富,乳酸菌是其肠道内天然栖息的一种益生菌,但由于其生存环境独特,其存在大量功能性菌株未被挖掘。因此,本研究通过高效液相色谱(high performance liquid chromatography,HPLC)法测定苯乳酸含量,从多种鱼肠道来源的乳酸菌中筛选高产苯乳酸的菌株,通过形态观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并通过单因素试验及响应面试验对其产苯乳酸发酵条件进行优化,以期为进一步实现乳酸菌工业化生产苯乳酸生物防腐剂提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株50株乳酸菌:分离自草鱼(CY)、刀鱼(DY)、镜鲤(LJ)、牙鲆(YP)和鲈鱼(LY)等肠道,均保藏在本实验室。
1.1.2 试剂
MRS液体培养基(pH5.0)、MRS固体培养基:上海吉至生化科技有限公司;苯丙酮酸、三氟乙酸(均为分析纯):上海麦克林生化科技有限公司;乳酸菌生化鉴定管:上海泽叶生物科技有限公司;甲醇(色谱级):上海易恩化学技术有限公司;苯乳酸标准品(纯度99%):上海源叶生物科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速抽提试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)扩增引物、Taq PCR Master、mixDNA marker-D:上海生工生物工程有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
SPX-150B高智能恒温恒湿培养箱:山东霍尔德电子科技有限公司;KS50R台式高速冷冻离心机:盐城市凯特实验仪器有限公司;DL-CJ-2N超净工作台:北京东联哈尔滨仪器制造;HT8300/8500全自动凝胶成像分析系统、HT-ECP3000高压电泳仪电源:北京鸿涛基业科技发展有限公司;PHB-4 pH计:广州瑞彬科技有限公司;Nikon尼康c1生物显微镜:北京长恒荣创科技有限公司;LC-2030高效液相色谱仪:日本岛津公司。
1.3 方法
1.3.1 高产苯乳酸乳酸菌的筛选
将乳酸菌以2%(V/V)的接种量接种于MRS液体培养基中,37 ℃静置培养24 h后,以2%(V/V)的接种量接种到含5 g/L苯丙酮酸的MRS肉汤培养基中,37 ℃培养24 h[16]。发酵液经8 000 r/min离心10 min,取上清液用0.22 μm的滤膜过滤,得到乳酸菌的无细胞上清液。参照侯楠楠等[17]高效液相色谱法检测苯乳酸的产量,筛选出苯乳酸产量高的乳酸菌菌株。
1.3.2 高产苯乳酸乳酸菌菌株的鉴定
形态学观察:采用四区划线法对高产苯乳酸的乳酸菌菌株进行培养,观察菌落形态,并进行革兰氏染色,采用显微镜进行细胞形态学观察[18]。
生理生化鉴定:将高产苯乳酸的乳酸菌用接种针接种到生理生化鉴定管中,30 ℃培养24~48 h后观察并记录结果[19-20]。
16S rDNA序列分析:采用DNA快速抽提试剂盒提取乳酸菌DNA,以其为模板,采用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGGYTACCTTTGTTACGACTT-3')对菌株的16S rDNA基因序列进行PCR扩增,PCR扩增体系及条件参照崔天琦等[21]的方法。将扩增后的产物利用1%琼脂糖凝胶电泳进行检测,将扩增成功的产物委托上海生工生物工程有限公司进行测序,将测序得到的16S rDNA基因序列提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,与已知模式菌株的16S rDNA基因序列进行基本局部序列比对搜索工具(basic local alignment search tool,BLAST)比对,寻找同源性较高的菌株,并利用MEGA5.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.3 高产苯乳酸乳酸菌菌株发酵条件优化
(1)单因素试验
通过控制单一变量法对乳酸菌菌株产苯乳酸发酵条件进行优化。
接种量的影响:将乳酸菌菌株分别以1%、2%、3%、4%、5%、6%和7%(V/V)的接种量接种到含5 g/L苯丙酮酸的MRS液体培养基中,37 ℃培养24 h,采用HPLC法检测菌株培养液中苯乳酸产量,以确定适宜接种量。
发酵时间的影响:将乳酸菌菌株以2%(V/V)的接种量接种到含5 g/L苯丙酮酸的MRS液体培养基中,分别在37 ℃条件下培养12 h、24 h、48 h、60 h、72 h后,采用HPLC法检测菌株培养液中苯乳酸产量,以确定适宜发酵时间。
初始pH值的影响:将乳酸菌菌株以2%(V/V)的接种量接种到含5 g/L苯丙酮酸、初始pH值分别为5.0、5.5、6.0、6.5、7.0、7.5的MRS液体培养基中,37 ℃培养24 h,采用HPLC法检测菌株培养液中苯乳酸产量,以确定适宜初始pH值。
发酵温度的影响:将乳酸菌菌株以2%(V/V)的接种量接种到含5 g/L苯丙酮酸的MRS液体培养基中,分别于25 ℃、28 ℃、31 ℃、34 ℃、37 ℃、40 ℃条件下培养24 h,采用HPLC法检测菌株培养液中苯乳酸产量,以确定适宜发酵温度[22-24]。
(2)响应面试验
根据单因素试验结果,以苯乳酸产量为响应值(Y),选择接种量(A)、发酵时间(B)、初始pH值(C)和发酵温度(D)为自变量,采用Design Expert 13设计Box-Behnken响应面试验优化乳酸菌产苯乳酸的发酵条件。响应面试验因素及水平见表1。
表1 发酵条件优化Box-Behnken试验因素及水平
Table 1 Factors and levels of Box-Behnken experiment for fermentation process conditions optimization

水平 A 接种量/% B 发酵时间/h C 初始pH值 D 发酵温度/℃-1 0 1 2 3 4 24 48 60 6.0 6.5 7.0 31 34 37
1.3.4 数据处理与统计分析
运用Design Expert 13软件对回归模型进行分析。试验均平行测定3次,结果用“平均值±标准差”表示,并采用IBM SPSS 23.0软件以及OriginPro 9.5软件对数据进行分析处理。
2 结果与分析
2.1 高产苯乳酸乳酸菌的筛选
50株乳酸菌在含5 g/L苯丙酮酸MRS液体培养基中培养,发现只有20株乳酸菌能正常生长,通过HPLC测定20株乳酸菌菌株合成苯乳酸的能力,结果见表2。
表2 20株乳酸菌菌株苯乳酸含量的测定结果
Table 2 Determination results of phenyllactic acid contents of 20 lactic acid bacteria strains
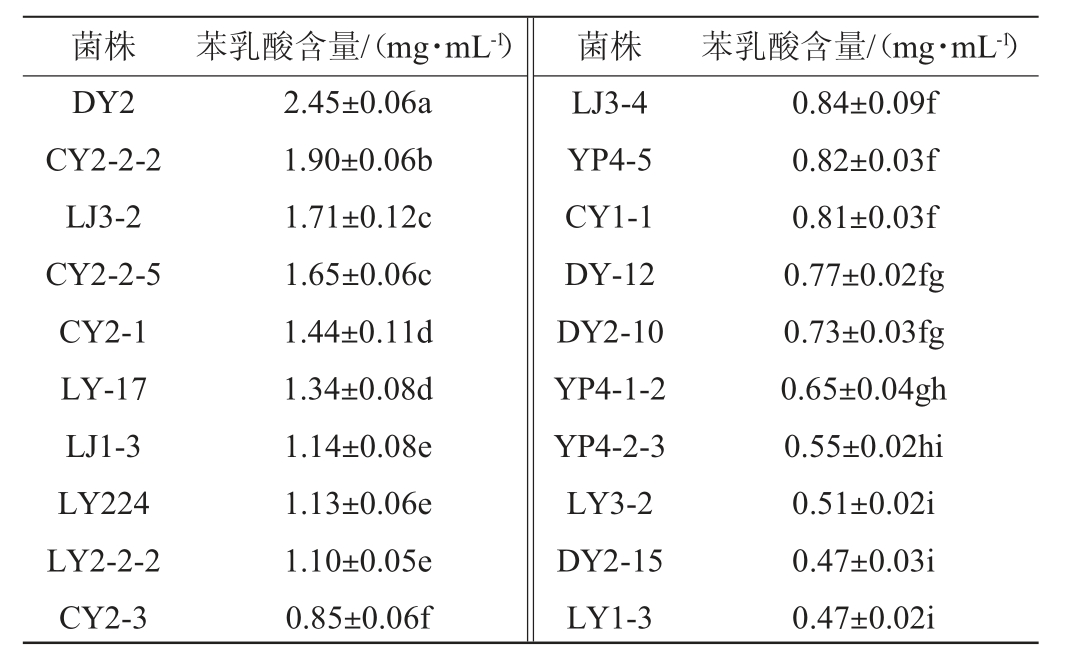
注:不同小写字母表示差异显著(P<0.05)。
菌株 苯乳酸含量/(mg·mL-1) 菌株 苯乳酸含量/(mg·mL-1)DY2 CY2-2-2 LJ3-2 CY2-2-5 CY2-1 LY-17 LJ1-3 LY224 LY2-2-2 CY2-3 2.45±0.06a 1.90±0.06b 1.71±0.12c 1.65±0.06c 1.44±0.11d 1.34±0.08d 1.14±0.08e 1.13±0.06e 1.10±0.05e 0.85±0.06f LJ3-4 YP4-5 CY1-1 DY-12 DY2-10 YP4-1-2 YP4-2-3 LY3-2 DY2-15 LY1-3 0.84±0.09f 0.82±0.03f 0.81±0.03f 0.77±0.02fg 0.73±0.03fg 0.65±0.04gh 0.55±0.02hi 0.51±0.02i 0.47±0.03i 0.47±0.02i
由表2可知,9株乳酸菌菌株的苯乳酸含量>1.00mg/mL,其中乳酸菌菌株DY2的苯乳酸产量显著高于其他乳酸菌菌株(P<0.05),为2.45 mg/mL。侯楠楠等[25]筛选得到1株产苯乳酸含量较高的乳酸菌BLCC2-0069,该菌株以5 g/L苯丙酮酸为底物发酵24 h时,苯乳酸的产量达到2.55 mg/mL,与本研究菌株DY2的苯乳酸产量相近。因此,确定菌株DY2为高产苯乳酸菌株。
2.2 高产苯乳酸乳酸菌DY2的鉴定
2.2.1 形态观察
菌株DY2的菌落及细胞形态见图1。由图1可知,菌株DY2的菌落呈圆形或椭圆形、光滑、乳白色、不透明、周围有溶钙圈,革兰氏染色结果呈阳性,菌体形态为杆状。
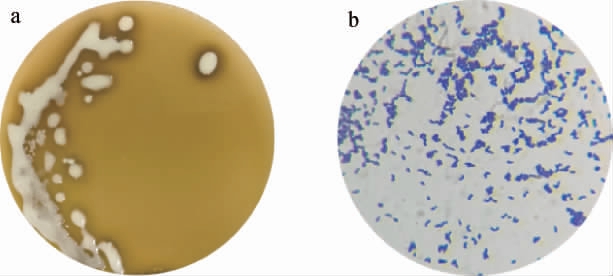
图1 乳酸菌菌株DY2的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of lactic acid bacteria strain DY2
2.2.2 生理生化试验
菌株DY2的生理生化试验结果见表3。由表3可知,菌株DY2可发酵纤维二糖、葡萄糖、蔗糖、麦芽糖、甘露糖、鼠李糖、甘露醇、蜜二糖肉汤、果糖、松三糖肉汤、半乳糖、七叶甘,不能发酵乳糖、阿拉伯糖、葡萄糖酸盐、棉籽糖、山梨醇、木糖,结合形态观察,根据《乳酸细菌分类鉴定及实验方法》[20],初步判定菌株DY2为魏斯氏菌属(Weissella sp.)。
表3 乳酸菌菌株DY2的生理生化试验结果
Table 3 Physiological and biochemical tests results of lactic acid bacteria strain DY2

注:“+”表示结果呈阳性,“-”表示结果呈阴性。
项目 结果 项目 结果 项目 结果纤维二糖阿拉伯糖葡萄糖酸盐果糖木糖葡萄糖+--+-+麦芽糖棉籽糖松三糖肉汤七叶甘蔗糖甘露糖+-++++甘露醇山梨醇乳糖鼠李糖蜜二糖肉汤半乳糖+--+++
2.2.3 分子生物学鉴定
基于16S rDNA基因序列,菌株DY2的系统发育树见图2。由图2可知,菌株DY2与融合魏斯氏菌(Weissella confuse)5952聚于一支,相似度达到99%,亲缘关系最近,因此,鉴定菌株DY2为融合魏斯氏菌(Weissella confuse)。

图2 基于16S rDNA基因序列乳酸菌菌株DY2的系统发育树
Fig.2 Phylogenetic tree of lactic acid bacteria strain DY2 based on 16S rDNA gene sequence
2.3 乳酸菌菌株DY2产苯乳酸发酵工艺优化
2.3.1 单因素试验
接种量、发酵时间、初始pH值和发酵温度对融合魏斯氏菌DY2产苯乳酸的影响见图3。
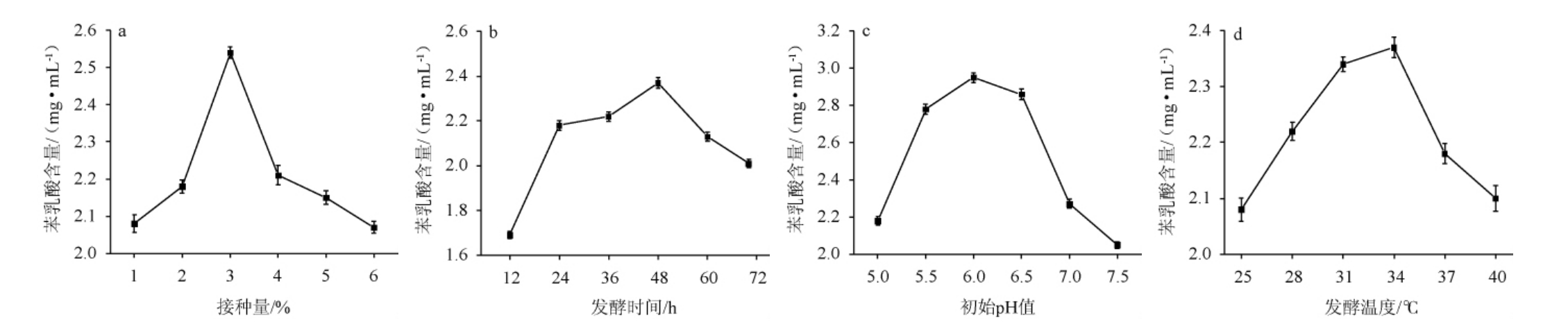
图3 接种量(a)、发酵时间(b)、初始pH值(c)及发酵温度(d)对融合魏斯氏菌DY2苯乳酸产量的影响
Fig.3 Effects of inoculum (a), fermentation time (b), initial pH (c) and fermentation temperature (d) on phenyllactic acid production by Weissella confuse DY2
由图3a可知,接种量对乳酸菌DY2合成苯乳酸的能力有较大的影响,当接种量在1%~3%的范围内,随着接种量的增加,苯乳酸产量逐渐增加,说明在一定接种量范围内,接种量越大,菌株代谢越快,从而使苯乳酸产量增加[26];当接种量为3%时,苯乳酸产量最高,为2.54 mg/mL;当接种量>3%之后,随着接种量的增加苯乳酸产量逐渐减少,分析原因可能是较高的接种量导致菌株繁殖速度过快,造成营养物质不足,从而导致乳酸菌合成苯乳酸的能力降低,这与黄国昌等[26]研究结果相似。因此,确定最优接种量为3%。
由图3b可知,发酵时间对乳酸菌DY2合成苯乳酸的能力也有很大的影响,当发酵时间在12~72 h的范围内,随着发酵时间的延长,苯乳酸产量呈先升高后下降的趋势。当发酵48 h时,苯乳酸产量最高,为2.37 mg/mL。发酵时间>48 h后,苯乳酸的产量下降,分析原因可能是随着发酵时间的延长,营养物质不断被消耗,营养物质减少到一定程度后导致苯乳酸的产量开始有所减少[27]。因此,确定最佳发酵时间为48 h。
由图3c可知,随着初始pH值的升高,苯乳酸产量呈先升高后下降的趋势,当初始pH值为6.0时,苯乳酸产量达到最高,为2.65 mg/mL。初始pH值偏高或偏低都会影响苯乳酸含量的下降,这可能是因为pH值偏高或偏低都会影响菌株细胞内酶的反应环境以及菌株的生长[28-29],从而影响乳酸菌合成苯乳酸的产量。因此,确定最佳初始pH值为6.0。
由图3d可知,随着发酵温度的升高,苯乳酸产量呈先升高后下降的趋势。当发酵温度为34 ℃时,苯乳酸产量最高,为2.37 mg/mL。发酵温度过高或过低都会影响苯乳酸含量,分析原因可能是因为乳酸菌对温度较为敏感,温度较高不适宜该菌株的生长,也可能是因为随着温度的增加合成苯乳酸所需要的酶的活性增强,有利于苯乳酸的合成,温度较高时又会导致酶的变性失活[30],使得苯乳酸的合成受阻,这与李士龙[31]的研究结果相似。因此,确定最佳发酵温度为34 ℃。
2.3.2 响应面试验结果
在单因素试验结果的基础上,选取接种量(A)、发酵时间(B)、初始pH值(C)、发酵温度(D)4个因素作为影响因子,以苯乳酸产量(Y)为响应值,采用Design Expert 13设计4因素3水平的Box-Behnken试验,试验设计及结果见表4,回归模型方差分析见表5。
表4 乳酸菌菌株DY2产苯乳酸发酵条件优化Box-Behnken试验设计及结果
Table 4 Design and results of Box-Behnken experiments for fermentation conditions optimization of phenyllactic acid production by lactic acid bacteria strain DY2
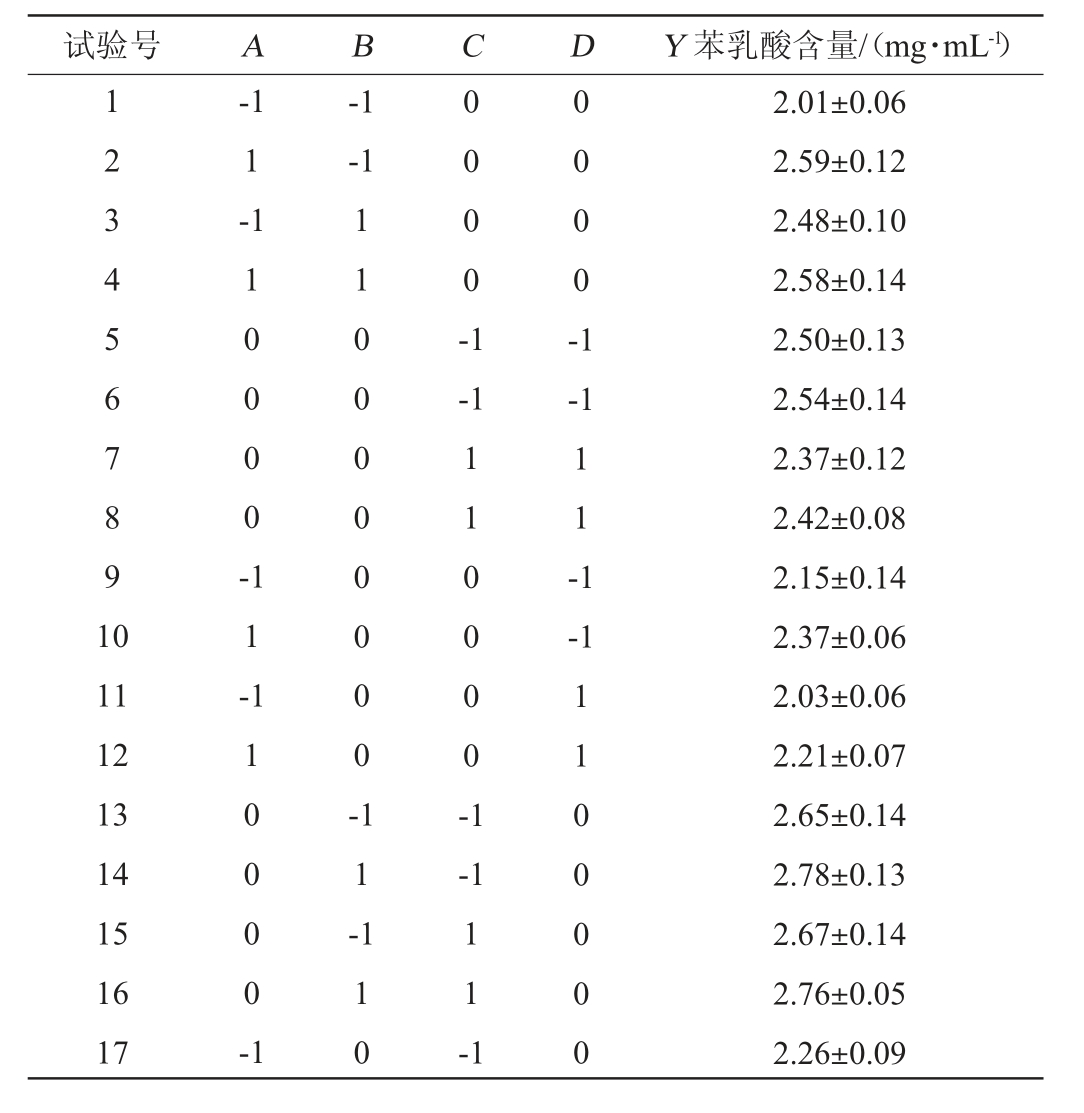
试验号 A B C D Y 苯乳酸含量/(mg·mL-1)1 2 3 4 5 6 7 8 9 1 0-1 1 --1-1 1 1 0 0 0 0 -0 0 0 0 -1 0 0 0 0 -1 1 1 0 0 0 0 0 0 0 0 --1-1 1 1 -1-1 11 12 13 14 15 16 17 1 1 -1 1 0 0 0 0 -1 1 1 -1 1 0 0 0 0 -1-1 1 1 0 1 1 -1 1 1 0 0 0 0 0 2.01±0.06 2.59±0.12 2.48±0.10 2.58±0.14 2.50±0.13 2.54±0.14 2.37±0.12 2.42±0.08 2.15±0.14 2.37±0.06 2.03±0.06 2.21±0.07 2.65±0.14 2.78±0.13 2.67±0.14 2.76±0.05 2.26±0.09
续表
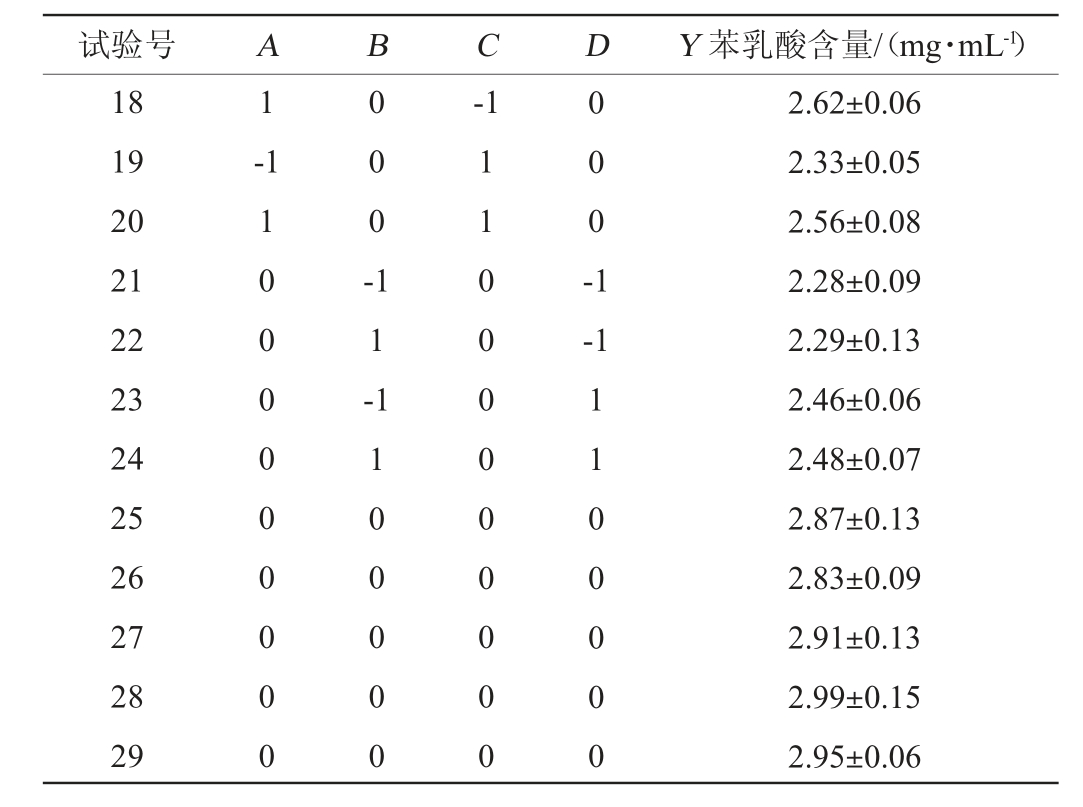
试验号 A B C D Y 苯乳酸含量/(mg·mL-1)18 19 20 21 22 23 24 25 26 27 28 29 1-1-1 1 0 0 0 0 0 0 0 0 0 0 0 0 -1 1 -0 0 0 -1-1 1 1 0 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 2.62±0.06 2.33±0.05 2.56±0.08 2.28±0.09 2.29±0.13 2.46±0.06 2.48±0.07 2.87±0.13 2.83±0.09 2.91±0.13 2.99±0.15 2.95±0.06
表5 回归模型的方差分析
Table 5 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著
(P<0.05)。
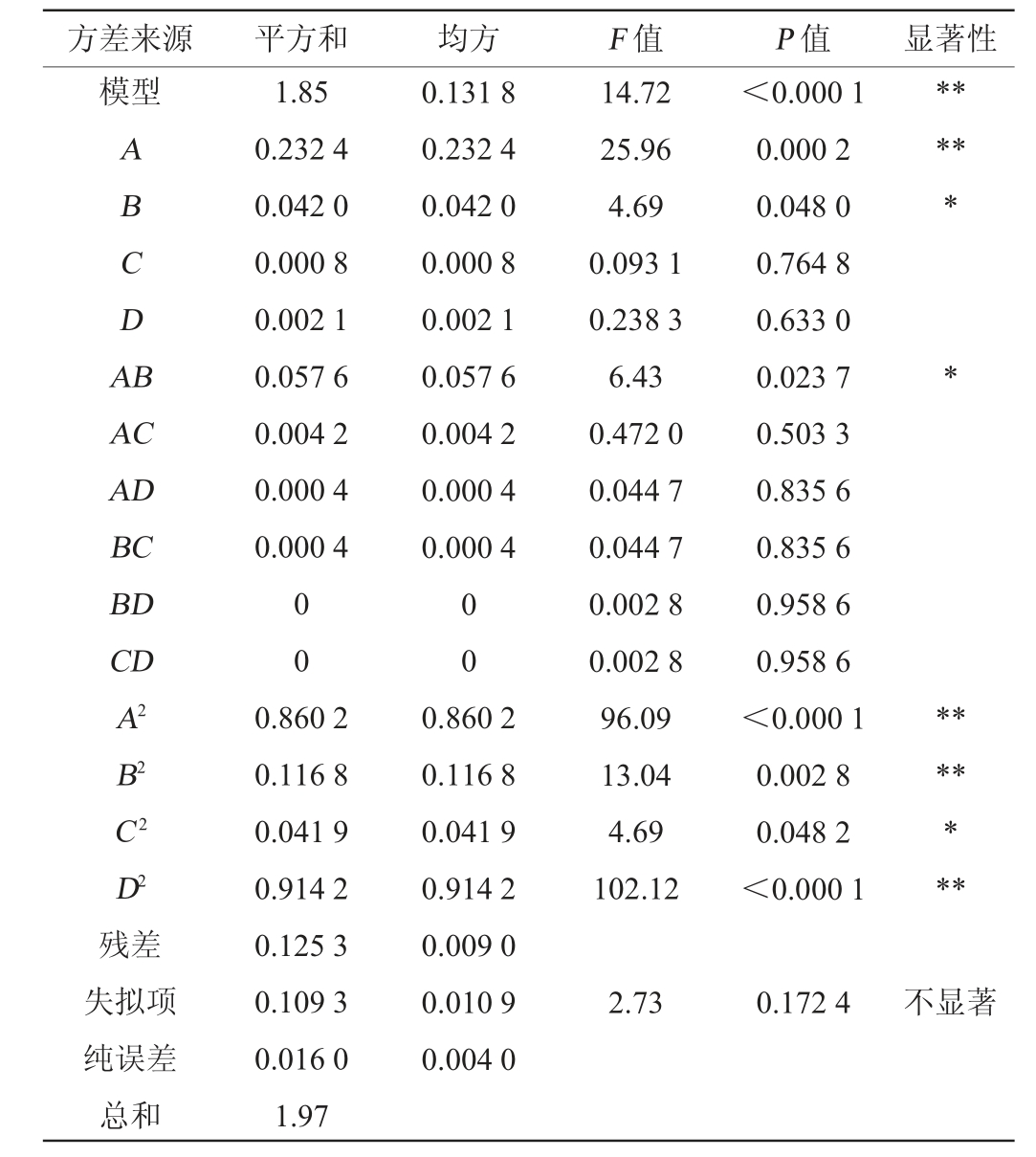
方差来源 平方和 均方 F 值 P 值 显著性模型ABCDA B******AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总和1.85 0.232 4 0.042 0 0.000 8 0.002 1 0.057 6 0.004 2 0.000 4 0.000 4 0.131 8 0.232 4 0.042 0 0.000 8 0.002 1 0.057 6 0.004 2 0.000 4 0.000 4 0 0 0 0 0.860 2 0.116 8 0.041 9 0.914 2 0.125 3 0.109 3 0.016 0 1.97 0.860 2 0.116 8 0.041 9 0.914 2 0.009 0 0.010 9 0.004 0 14.72 25.96 4.69 0.093 1 0.238 3 6.43 0.472 0 0.044 7 0.044 7 0.002 8 0.002 8 96.09 13.04 4.69 102.12<0.000 1 0.000 2 0.048 0 0.764 8 0.633 0 0.023 7 0.503 3 0.835 6 0.835 6 0.958 6 0.958 6<0.000 1 0.002 8 0.048 2<0.000 1*******2.73 0.172 4不显著
使用Design Expert 13软件对不同培养条件下苯乳酸产量进行多元回归拟合计算,得到接种量、发酵时间、初始pH值、发酵温度对苯乳酸含量的二次多项回归模型方程:Y=2.91+0.139 2A+0.059 2B+0.008 3C-0.013 3D-0.120 0AB-0.032 5AC-0.010 0AD-0.010 0BC+0.002 5BD+0.002 5CD-0.364 2A2-0.134 2B2-0.080 4C2-0.375 4D2。
由表4可知,回归模型P值为0.000 1<0.05,极显著,失拟项P值为0.172 4>0.05,不显著。决定系数R2=93.64%,说明该模型的相关性较好,校正决定系数R2Adj=87.28%,说明该模型的预测值与实测值拟合效果较好,能解释本试验87.28%响应值的变化情况。方差结果分析得出,一次项A及二次项A2、B2、D2对结果影响极显著(P<0.01),一次项B、交互项AB及二次项C2对结果影响显著(P<0.05),其他项则对结果影响不显著(P>0.05)。
响应面图和等高线图可以用来直观地表示各变量之间的交互作用及响应值在极点时各自变量的最佳水平,响应曲面坡度越陡,等高线越趋于椭圆形,说明对响应值影响越大[26]。接种量和发酵时间间交互作用对苯乳酸产量影响的响应面和等高线见图4。
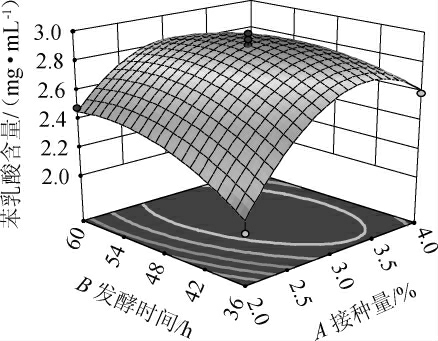
图4 接种量和发酵时间交互作用对苯乳酸产量影响的响应面和等高线
Fig.4 Response surface plots and contour lines of effect of interaction between inoculum and fermentation time on phenyllactic acid production
由图4可知,接种量(A)与发酵时间(B)间交互作用的响应面图曲面坡度明显,等高线为椭圆形,表明二者间交互作用对苯乳酸产量影响显著,这与方差分析结果一致。
通过回归方程得到回归模型预测的最佳发酵条件为接种量3.168%,发酵时间49.738 h,初始pH值6.005,发酵温度33.942 ℃,此时苯乳酸产量的最大预测值为2.926 mg/mL。为便于实际操作,将最佳条件修订为接种量3%,发酵时间50 h,初始pH值6.0,发酵温度34 ℃。为验证模型的可靠性和最大预测值的准确性,用上述最佳发酵条件进行三次平行验证试验,苯乳酸产量实际值为2.99 mg/mL,与预测值接近,说明该模型能准确反映各因素的变化与苯乳酸产量之间的关系。
3 结论
本研究从鱼肠道来源的50株乳酸菌中筛选获得1株高产苯乳酸菌株DY2,苯乳酸产量为2.45 mg/mL;通过形态观察、生理生化试验及分子生物学技术鉴定其为融合魏斯氏菌(Weissella confuse)。以苯乳酸产量为响应值,通过单因素试验和Box-Behnken试验设计优化确定菌株DY2产苯乳酸的最适发酵条件为接种量3%、发酵时间50 h、初始pH值6.0、发酵温度34 ℃。在此条件下,苯乳酸产量为2.99 mg/mL,是优化前的1.22倍。
[1]LUO X,ZHANG Y Y,YIN L F,et al.Efficient synthesis of d-phenyllactic acid by a whole-cell biocatalyst coexpressing glucose dehydrogenase and a novel d-lactate dehydrogenase from Lactobacillus rossiae[J].3 Biotech,2020,10:14.
[2]SORRENTINO E,TREMONTE P,SUCCI M,et al.Detection of antilisterial activity of 3-phenyllactic acid using Listeria innocua as a model[J].Front Microbiol,2018,9:1373.
[3]JIANG Y H,YING J P,XIN W G,et al.Antibacterial activity and action target of phenyllactic acid against Staphylococcus aureus and its application in skim milk and cheese[J].J Dairy Sci,2022,105(12):9463-9475.
[4] JIANG X B, JIANG C Y, YU T, et al.Phenyllactic acid application to control Listeria monocytogenes biofilms and its growth in milk and spiced bee[J].Int J Food Microbiol,2022,381:109910.
[5]MU W M,YU S H,ZHU L J,et al.Recent research on 3-phenyllactic acid,a broad-spectrum antimicrobial compound[J].Appl Microbiol Biot,2012,95:1155-1163.
[6] NDAGANO D, LAMOUREUX T, DORTU C, et al.Antifungal activity of 2 lactic acid bacteria of the Weissella genus isolated from food[J].J Food Sci,2011,76(6):M305-M311.
[7]ZHENG Z J,MA C Q,GAO C,et al.Efficient conversion of phenylpyruvic acid to phenyllactic acid by using whole cells of Bacillus coagulans SDM[J].PLoS One,2011,6(4):e19030.
[8]KAWTHARANI H,SNINI S P,HEANG S,et al.Geotrichum candidum phenyllactic acid produced by reduces and growth and T-2 toxin toncentration[J].Toxins,2020,12(4):209.
[9]MORADI M,KOUSHEH S A,ALMASI H,et al.Postbiotics produced by lactic acid bacteria:The next frontier in food safety[J].Compr Rev Food Sci Food Saf,2020,19(6):3390-3415.
[10]芦夏霏,刘毕琴,柳陈坚,等.乳酸菌苯乳酸的合成及其代谢调控机制研究进展[J].食品与发酵工业,2014,40(11):177-181.
[11] LAVERMICOCCA P, VALERIO F, EVIDENTE A, et al.Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum strain 21B[J].Appl Environ Microbiol,2000,66(9):4084-4090.
[12] STRÖM K, SJÖGREN J, BROBERG A, et al. Lactobacillus plantarum MiLAB 393 produces the antifungal cyclic dipeptides cyclo(L-Phe-L-Pro)and cyclo(L-Phe-trans-4-OH-L-Pro) and 3-phenyllactic acid[J].Appl Environ Microbiol,2002,68(9):4322-4327.
[13]刘长建,刘秋,姜波,等.产苯乳酸乳酸菌的筛选鉴定[J].食品工业科技,2012,33(21):192-195.
[14]李兴峰,江波,潘蓓蕾,等.产苯乳酸的乳酸菌分离筛选及菌种鉴定[J].食品与发酵工业,2007,33(2):1-4.
[15]邓林.四川冬菜中苯乳酸高产菌株的分离与鉴定[J].中国酿造,2014,33(4):97-100.
[16]谢全喜,侯楠楠,王梅,等.高产苯乳酸菌株的筛选及其在豆粕发酵中的应用[J].中国酿造,2021,40(7):65-70.
[17]侯楠楠,谢全喜,王梅,等.高效液相色谱法测定发酵制品中苯乳酸和苯丙酮酸[J].广东饲料,2021,30(9):40-43.
[18]于学健,刘锦浲,赵婷,等.一株分离自婴儿肠道的乳双歧杆菌BL-99的菌株鉴定[J].食品与发酵工业,2021,47(21):32-38.
[19]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-399.
[20]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:130-133.
[21]崔天琦,吕欣然,孙梦桐,等.降解嗜水气单胞菌群体感应AHLs信号分子的乳酸菌筛选及淬灭作用[J].中国食品学报,2020,20(9):19-29.
[22]李芬,刘晨,梁茜茜,等.植物乳杆菌UN-30菌株高产苯乳酸的发酵条件优化[J].中国食品添加剂,2016,150(8):135-141.
[23]李明华,孟秀梅.植物乳杆菌生物合成苯乳酸条件优化研究[J].中国酿造,2018,37(4):93-97.
[24]朱胜虎,赵天行,李爽爽,等.葡糖醋杆菌FBFS97产苯乳酸的液态发酵条件优化[J].中国酿造,2021,40(11):66-70.
[25]侯楠楠,谢全喜,王梅,等.一株高产苯乳酸菌株的安全性评价与发酵工艺优化[J].现代食品科技,2021,37(9):67-75.
[26]黄国昌,顾斌涛,于一尊,等.植物乳杆菌BLPC002产苯乳酸发酵工艺优化[J].中国酿造,2021,40(12):75-80.
[27]杨小院,李渐鹏,史国萃,等.植物乳杆菌发酵生产苯乳酸的条件优化研究[J].食品科技,2018,43(9):19-23.
[28]张雯.乳酸菌合成苯乳酸及其条件优化和苯乳酸检测方法的研究[D].上海:上海海洋大学,2020.
[29]王立梅,腾宇,陈文飞,等.pH值及底物对副干酪乳杆菌发酵生产苯乳酸的影响[J].食品科学,2014,35(1):163-166.
[30]邓林,刘延岭.一株植物乳杆菌产苯乳酸特性的研究[J].食品研究与开发,2015,36(20):161-164.
[31]李士龙.传统发酵食品中高产苯乳酸菌株的筛选及发酵工艺条件优化[D].大庆:黑龙江八一农垦大学,2012.