老鹰茶(Hawk tea),以樟科毛豹皮樟(Litsea coreana Levl.var.lanuginosa)的枝叶为原料,通过杀青、揉捻、渥堆和干燥等工艺制成的一种发酵茶[1],其富含茶多酚、多糖、氨基酸和Al、Zn、Fe等微量元素,具有较高的营养和保健功能,例如抗氧化、降胆固醇、酒精性肝损伤保护等[2-4]。目前,有关老鹰茶的研究多集中于靶向检测单一特定物质的含量、香气化合物检测和提取,缺乏对茶叶中所含代谢物系统的研究[5-7]。老鹰茶的品质与茶原料品种、加工方式等因素相关[8],成品老鹰茶陈化时长也是影响其品质的关键因素之一,在民间有老鹰茶越陈品质越好的说法。
非靶向代谢组学借助色谱、质谱等仪器对生物系统中小分子代谢物进行系统的定性定量分析,通过数据处理和分析准确找出样本间差异性代谢物[9],有助于解析生物样本中代谢物的重要信息[10]。代谢组学检测技术主要有高效液相色谱-质谱(high performance liquid chromatographymass spectrometry,LC-MS)联用[11]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用以及核磁共振(nuclear magnetic resonance,NMR)光谱等[12]。基于LC-MS联用的非靶向代谢组学主要应用于检测样本中分子质量<1 000 Da的氨基酸、糖、酮和有机酸等非挥发性相对小分子代谢物[13]。代谢组学技术已应用于探究茶叶加工[14]、发酵[15]、凋萎[16]、茶叶种质[17]及其冲泡茶汤[18]中代谢物的特征差异及种质鉴别[19-20],所分析的差异代谢物集中于红茶、白茶等茶叶中的黄酮、儿茶素、有机酸、氨基酸和核苷酸类化合物。目前,尚未见基于非靶向代谢组学探究老鹰茶中代谢产物影响的研究报道。
本研究以产自贵州省正安县未陈化、陈化1年、2年和3年的老鹰茶为研究对象,通过超高效液相色谱-四极杆-飞行时间质谱(ultraperformanceliquidchromatography-quadrupoletime-of-flight mass spectrometry,UPLC-QTOF-MS)技术分析老鹰茶中非挥发代谢物组成,利用主成分分析(principal component analysis,PCA)和正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)筛选差异性代谢物,旨在探究陈化对老鹰茶代谢物的影响,为老鹰茶代谢物资源挖掘与利用奠定理论基础,助力贵州老鹰茶产业发展。
1 材料与方法
1.1 材料与试剂
老鹰茶A(未陈化,HTa)、老鹰茶B(陈化1年,HTb)、老鹰茶C(陈化2年,HTc)、老鹰茶D(陈化3年,HTd):均购于贵州省正安县,在温度为20~25 ℃条件下进行陈化。
甲醇、乙腈(均为色谱纯):德国Merck公司;L-2-氯苯丙氨酸(色谱纯):上海阿拉丁生化科技股份有限公司;甲酸(色谱纯):印度HCL公司。
1.2 仪器与设备
UPLC Acquity I-Class PLUS超高效液相色谱、Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm)、Waters UPLCXevoG2-XSQTOF高分辨质谱(配有电喷雾离子(electric spray ion,ESI)源):美国Waters公司。
1.3 方法
1.3.1 老鹰茶代谢物的提取
将老鹰茶样研磨成粉,称取50 mg,加入1 000 μL甲醇∶乙腈∶水=2∶2∶1(V/V),涡旋30 s。研磨仪45 Hz研磨10 min后置于冰水浴中超声10 min。-20 ℃条件下静置1 h后,于4 ℃条件下12 000 r/min离心15 min,取500 μL上清液真空浓缩干燥。干燥后的代谢物加入160 μL乙腈水提取液乙腈∶水=1∶1(V/V)复溶,涡旋30 s后置于冰水浴中超声10 min。将样本在4 ℃条件下12 000 r/min离心15 min;取120 μL上清液于进样瓶中上机检测,每个样本各取10 μL混合成质量控制样本(quality control,QC)上机检测。
1.3.2 超高效液相色谱-质谱检测条件
超高效液相色谱条件:Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm);液相色谱的流动相A为0.1%甲酸水溶液,流动相B为乙腈(含0.1%甲酸)。进样体积1 μL,流速为400 μL/min。梯度洗脱程序为0~0.25 min,2%流动相B;10 ~13 min,98%流动相B;13.1 min 时,2%流动相B。
质谱条件:采用ESI源正、负离子模式检测,正离子模式毛细管电压2 500 V,负离子模式毛细管电压-2 000 V,锥孔电压30 V;离子源温度100 ℃,脱溶剂气温度500 ℃;反吹气流速50 L/h,脱溶剂气流速800 L/h;质核比50~1 200 m/z。
1.3.3 数据处理
使用MassLynx V4.2采集的原始数据,通过Progenesis QI软件做峰提取、峰对齐等数据处理操作,基于自建库开展化合物注释、识别。数据进行多维统计分析,采用Prcomp 3.6.1进行主成分分析,ropls1.6.2进行正交偏最小二乘-判别分析。根据老鹰茶样品变量投影重要度(variable importance in project,VIP)和T检验计算各化合物的差异显著性P值,以OPLS-DA模型P<0.05和VIP>1相结合的方法筛选差异代谢物。并使用Origin 2021软件绘制差异性代谢物热图。
2 结果与分析
2.1 QC样本检测
QC样本相关性越接近于1,说明整个检测过程稳定性越好[21]。QC样本相关性均>0.977,说明质谱检测的样品的均一度较好。
2.2 不同陈化时间老鹰茶代谢物的主成分分析
不同陈化时间的老鹰茶样本中共注释到4 530个代谢物,为反映不同陈化时间的老鹰茶样本间代谢物的差异大小,分别在正离子模式和负离子模式下对老鹰茶代谢物进行主成分分析,结果见图1。由图1可知,正离子模式下第一主成分(PC1)和第二主成分(PC2)方差贡献率分别为31.86%和19.96%,累计方差贡献率为51.82%,负离子模式下第一主成分(PC1)和第二主成分(PC2)方差贡献率分别为33.82%和17.12%,累计方差贡献率为50.94%,包含样本中大部分代谢物信息。主成分分析得分图中单个散点代表一个QC样本点,样本点间的距离越大代表样本间代谢物的组成和含量差异越大,样本点间的距离越小代表样本间代谢物组成和含量差异越小[22]。在正离子模式和负离子模式下,未经陈化的老鹰茶样本(HTa)点与陈化的老鹰茶样本(HTb、HTc、HTd)点间距离较远,说明经过陈化后老鹰茶中代谢物有明显变化。经过陈化的三个老鹰茶(HTb、HTc、HTd)样本点在PC1上较为靠近,说明陈化1年、2年和3年的老鹰茶样本代谢物的种类和含量差异较小。
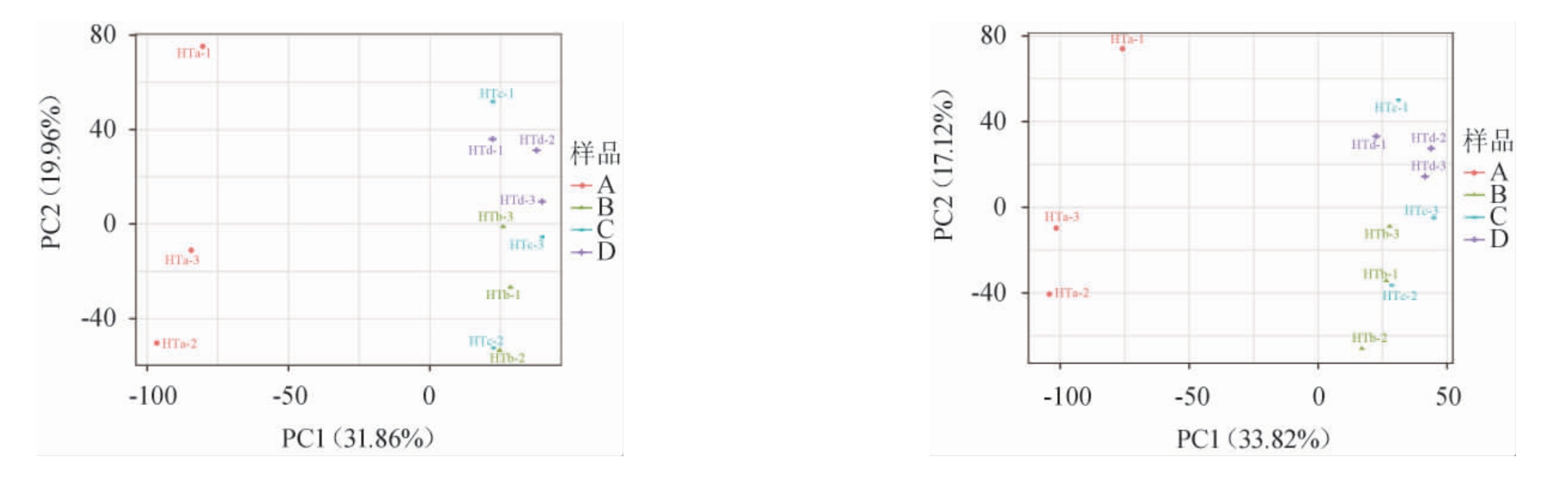
图1 正离子模式(A)和负离子模式(B)下老鹰茶代谢物主成分分析得分图
Fig.1 Score plots of principal component analysis of Hawk tea metabolites under positive ion (A) and negative ion (B) mode
2.3 不同陈化时间老鹰茶代谢物的正交偏最小二乘-判别分析
OPLS-DA模型得分图中横坐标(t1)代表组间差异分量,样本点横向距离大小与组间差异成正比。纵坐标(to1)代表组内差异分量,样本点纵向距离大小与组内差异成正比。括号中的百分比代表该分量在总方差中的占比[23]。指标Q2Y是评价模型的预测参数之一,表示模型的预测能力即所建模型能否通过代谢表达量区分正确的样本分组,Q2Y越接近于1时表示模型越稳定可靠,即可以用此模型筛选差异代谢物[24]。不同陈化时间的老鹰茶代谢物的OPLS-DA得分图见图2。由图2可知,Q2Y均>0.887,表明所建立的OPLS-DA模型有效。两两样本间横向距离较大且均处于95%置信区间,表明不同陈化时间老鹰茶样本的代谢物具有显著差异(P<0.05)。
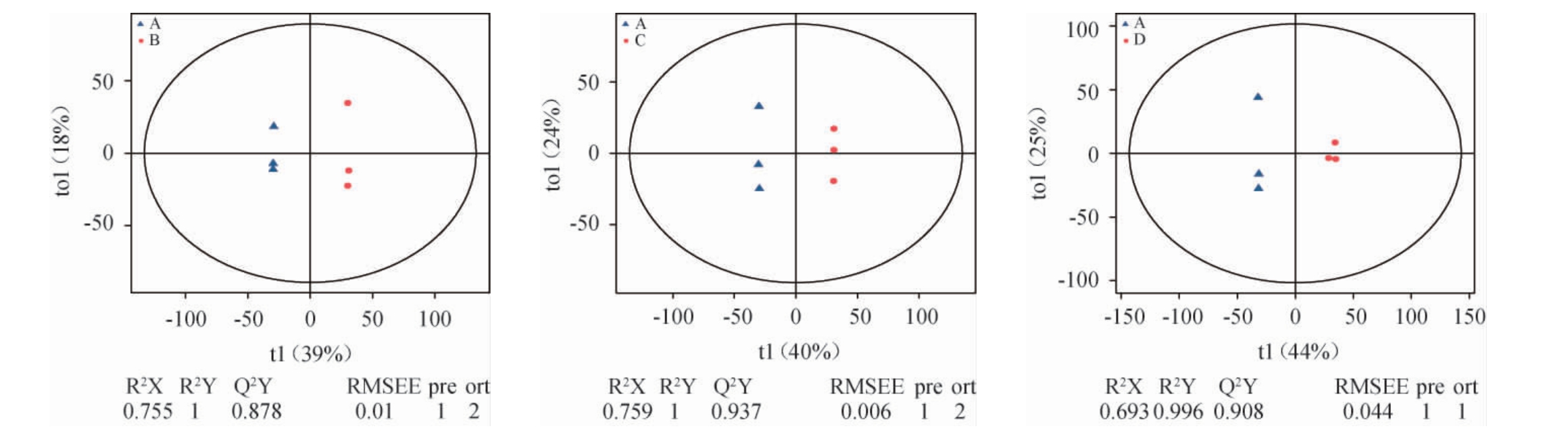
图2 不同陈化时间的老鹰茶代谢物的正交偏最小二乘-判别分析得分图
Fig.2 Score plots of orthogonal partial least squares-discriminant analysis of Hawk tea metabolites with different aging time
为检查OPLS-DA模型的可靠性,进行置换检验,按置换分组进行OPLS-DA建模计算其R2Y和Q2Y,将建模结果绘制成散点图,图中x轴表示置换分组与原模型分组的相关性,y轴表示R2Y或者Q2Y的取值(其中在x轴取1的R2Y和Q2Y为原模型的值),蓝点和红点分别代表置换后模型的R2Y和Q2Y,两条虚线为R2Y和Q2Y拟合的回归线。若Q2Y拟合回归线斜率为正则说明模型有意义,蓝点普遍位于红点上方代表其检测值都低于真实值,说明建模训练集和测试集的独立性较好[25]。为验证模型是否过拟合设置假设检验的次数为200,绘制不同陈化时间的老鹰茶代谢物的OPLS-DA置换检验图见图3。由图3可知,不同陈化时间的老鹰茶两两样本组的Q2Y拟合回归线斜率均>1,检测值都低于真实值,Q2Y的回归线截距小于0.5,证明所建立的OPLS-DA模型没有过拟合[26]。
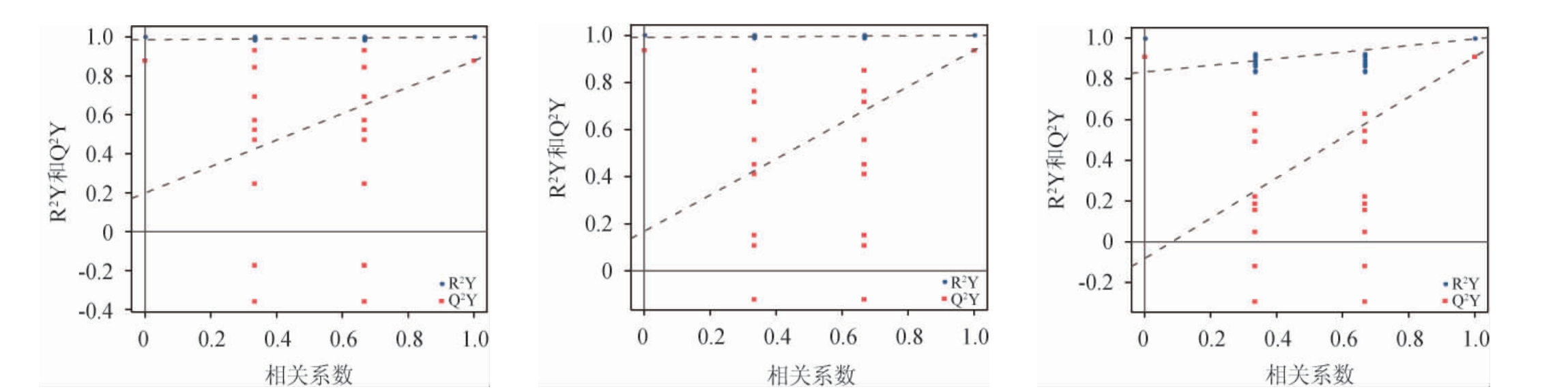
图3 不同陈化时间老鹰茶代谢物的正交偏最小二乘-判别分析置换检验图
Fig.3 Permutation test diagram of orthogonal partial least squares-discriminant analysis of Hawk tea metabolites with different aging time
2.4 不同陈化时间老鹰茶差异显著代谢物筛选及分析
基于OPLS-DA结果,根据OPLS-DA模型的VIP≥1且P<0.05的代谢物筛选老鹰茶组间差异显著代谢物。随着陈化时间的增加,老鹰茶样本中差异显著代谢物数量逐渐上升。未陈化老鹰茶样本与陈化1年老鹰茶样本差异显著代谢物数为832个,其中上调的差异显著代谢物为448个(占比53.85%),下调差异显著代谢物为384个(占比46.15%)。未陈化老鹰茶样本与陈化2年老鹰茶样本差异显著代谢物数为925个,其中上调的差异显著代谢物498个(占比53.84%),下调差异显著代谢物为427个(占比46.16%)。未陈化老鹰茶样本与陈化3年老鹰茶样本差异显著代谢物数为1 071个,其中上调的差异显著代谢物为644个(占比60.13%),下调差异显著代谢物为427个(占比39.87%)。结果表明,陈化3年老鹰茶样本差异显著代谢物数最多。
通过比对不同陈化时间的老鹰茶中氨基酸类、多酚类、嘌呤类化合物等影响发酵茶滋味的主要物质差异[27],分析陈化时间对老鹰茶滋味成分的影响,结果见图4。
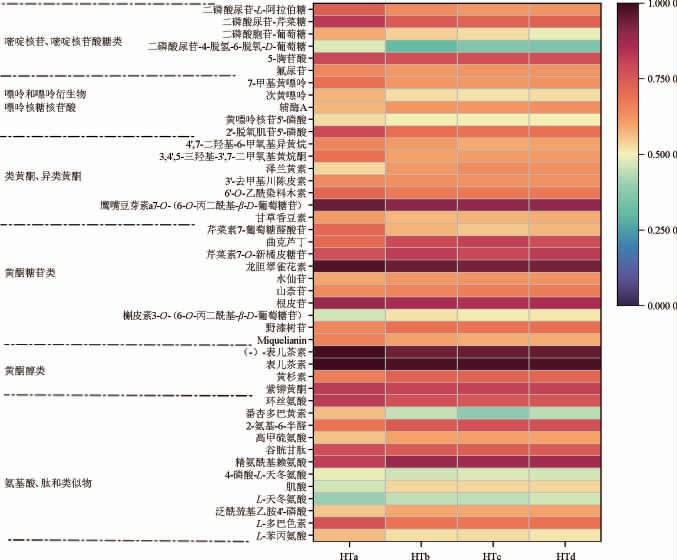
图4 不同陈化时间的老鹰茶显著差异代谢物热图
Fig.4 Heat map of significant difference metabolites of Hawk tea with different aging time
由图4可知,经过陈化的老鹰茶中氨基酸、肽和类似物显著差异代谢产物有12种,其中含量随陈化时间增加的物质有泛酰巯基乙胺4'-磷酸、L-天冬氨酸、肌酸、精氨酰基赖氨酸、高甲硫氨酸、2-氨基-6-半醛,在陈化过程中随着茶叶蛋白质分解,氨基酸类物质含量明显提高。含量随陈化时间降低的物质有L-苯丙氨酸、L-多巴色素、4-磷酸-L-天冬氨酸、谷胱甘肽、番杏多巴黄素和环丝氨酸。氨基酸是贡献茶汤香气和滋味的主要物质,对茶叶品质的形成有重要作用[28]。L-天冬氨酸属于鲜味氨基酸,是茶汤鲜爽味的主要来源之一[29]。肌酸存在于骨骼肌中,是合成磷酸肌酸的原料,磷酸肌酸可促进人体腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的合成,为机体运动提供能量[30]。L-苯丙氨酸是茶叶中苦味物质和重要的香气成分,其是合成茶叶香气物质挥发性苯丙酸/苯类化合物的前体物质[31],伴随着茶叶香气化合物的合成,其含量有所减少。在陈化中与氧气长期接触,茶叶中其含量有所减少。
在不同陈化时间老鹰茶的差异代谢物中黄酮醇类有表儿茶素和(-)-表儿茶素、黄杉素和紫铆黄酮4种物质。其中表儿茶素和(-)-表儿茶素相对含量较高,但随着陈化时间延长,其含量均呈现下降趋势。不同陈化时间老鹰茶样本中差异代谢物中黄酮糖苷类化合物有11种,其中,野漆树苷、槲皮素3-O-(6-O-丙二酰基-β-D-葡萄糖苷、山奈苷、水仙苷、芹菜素7-O-新橘皮糖苷、曲克芦丁的含量随陈化时间延长呈增加趋势。茶叶中的多酚类物质主要包括儿茶素、黄酮及其糖苷等,是茶叶中主要的水溶性成分,儿茶素类是茶叶中重要的多酚类物质,其化合性质活泼,在常温常压下能够缓慢氧化,氧化产生多酚类物质经一系列化学反应,生成一些对茶叶的滋味产生影响的物质[32]。
嘌呤类化合物与茶叶的苦涩味相关,且对茶叶适制性有重要影响。不同陈化时间老鹰茶样本中嘌呤和嘌呤衍生物为次黄嘌呤和7-甲基黄嘌呤,两者均为嘌呤生物碱,是茶叶苦味的主要来源[33]。随陈化时间延长,其含量均降低,陈化能够一定程度的降低茶叶中的苦味成分。
综上,老鹰茶陈化过程中,老鹰茶中鲜味成分含量增加、苦涩味相关成分物质含量降低,抗氧化成分及其他保健功能性成分增加。故认为老鹰茶的滋味和营养成分能够通过陈化改善,即陈化将增加老鹰茶及其茶汤的滋味和营养价值。
3 结论
基于UPLC-QTOF-MS非靶向代谢组学技术分析未陈化、陈化1年、2年和3年的老鹰茶代谢物,结合主成分分析(PCA)及正交偏最小二乘-判别分析(OPLS-DA)法对代谢物进行分析。结果表明,共注释到4 530个代谢物,以VIP≥1且P<0.05为筛选标准筛选差异显著代谢物,随着陈化老鹰茶样本中差异显著代谢物数量逐渐上升,且上调代谢物在数目占优势。陈化在一定程度上会提高老鹰茶滋味,经过陈化的老鹰茶中与鲜味相关的L-天冬氨酸含量显著提高,苦味物质次黄嘌呤和7-甲基黄嘌呤显著降低,具有抗氧化作用、降血糖潜力、抗肿瘤功效的黄酮类化合物显著增加。综合来看,老鹰茶陈化过程中鲜味成分含量增加、苦涩味相关成分物质降低,抗氧化及其他保健功能性成分增加。本研究为进一步为解析老鹰茶陈化过程中代谢机制奠定理论基础。
[1]彭娟,谢伦,熊彪.不同成熟度和渥堆时间对老鹰黑茶(狭叶润楠)品质的影响[J].特产研究,2022,44(4):53-58.
[2] XU Q, ZHOU Y J, WANG J H.The impact of fixation method on the biochemical characteristics of hawk tea(Litsea coreana)[J].Int J Food Eng,2020,16(8):1-8.
[3] FENG J, YANG J, CHANG Y J, et al.Caffeine-free hawk tea lowers cholesterol by reducing free cholesterol uptake and the production of verylow-density lipoprotein[J].Commun Biol,2019,2(1):1-6.
[4]LIU Y,LUO Y K,ZHANG L,et al.Chemical composition,sensory qualities,and pharmacological properties of primary leaf hawk tea as affected using different processing methods[J].Food Biosci,2020,36:100618.
[5]王雨鑫,邓燕莉,姚松林,等.贵州4个县域豹皮樟老鹰茶的理化品质比较[J].浙江农业学报,2021,33(1):142-149.
[6]QIN Z,FENG K,WANG W S,et al.Comparative study on the essential oils of six Hawk tea(Litsea coreana Levl.var.lanuginosa)from China:Yields,chemical compositions and biological activities[J].Ind Crop Prod,2018,124:126-135.
[7]张蕾,王杰,罗理勇,等.老鹰茶特征性香气成分分析[J].食品科学,2019,40(10):220-228.
[8]余文权,李鑫磊,钟秋生,等.基于非靶向代谢组学的春闺与铁观音乌龙茶品质研究[J].中国食品学报,2022,22(5):300-308.
[9] PENG Y, HONG J W, RAFTERY D, et al.Metabolomic-based clinical studies and murine models for acute pancreatitis disease: A review[J].Biochim Biophys Acta Mol Basis Dis,2021,1867(7):166123.
[10] CHUNG H J, SIM J H, MIN T S, et al.Metabolomics and lipidomics approaches in the science of probiotics:A review[J].J Med Food,2018,21(11):1086-1095.
[11]ZHONG P,WEI X Q,LI X M,et al.Untargeted metabolomics by liquid chromatography-mass spectrometry for food authentication: A review[J].Compr Rev Food Sci Food Saf,2022,21(3):2455-2488.
[12]燕飞,曲东,纪鹏彬,等.基于非靶向代谢组学分析杜仲金花茶发酵过程中代谢物的特征[J].食品科学,2023,44(10):300-309.
[13]吴雅琼,张春红,杨海燕,等.基于代谢组学分析黑莓、黑树莓果实代谢物的差异[J].江苏农业学报,2022,38(3):790-797.
[14]WANG H J,CAO X L,YUAN Z F,et al.Untargeted metabolomics coupled with chemometrics approach for Xinyang Maojian green tea with cultivar,elevation and processing variations[J].Food Chem,2021,352:129359.
[15]曾议霆,吴雪莉,杨春梅,等.基于非靶向代谢组学比较不同发酵方式红茶滋味物质差异[J].食品安全质量检测学报,2022,13(16):5288-5296.
[16]岳文杰,金心怡,陈明杰,等.基于非靶向代谢组学分析白茶室内自然萎凋过程代谢物的变化规律[J].茶叶科学,2021,41(3):379-392.
[17]李鑫磊,俞晓敏,林军,等.基于非靶向代谢组学的白茶与绿茶、乌龙茶和红茶代谢产物特征比较[J].食品科学,2020,41(12):197-203.
[18]罗春燕,姚新转,陈佳,等.基于非靶向代谢组学分析冠突散囊菌发酵红茶茶汤前后代谢物变化[J].食品科技,2021,46(5):246-253.
[19]徐春晖,王远兴.基于UPLC-QTOF-MS结合非靶向代谢组学鉴别3种江西名茶[J].食品科学,2022,43(2):316-323.
[20]ZHAO J,LIU W W,CHEN Y,et al.Identification of markers for tea authenticity assessment:Non-targeted metabolomics of highly similar oolong tea cultivars (Camellia sinensis var.sinensis)[J].Food Control,2022,142:109223.
[21]王磊,贾玉龙,罗彦玉,等.基于UHPLC-MS非靶向代谢组学分析乳杆菌发酵方竹笋超细全浆的代谢差异[J/OL].食品科学:1-16[2023-04-12].http://kns.cnki.net/kcms/detail/11.2206.TS.20221229.1953.019.html.
[22]徐晓敏,房城,卢芳.基于代谢组学技术的黄芩-白芍对二型糖尿病模型小鼠的作用机制[J].世界中医药,2023,18(5):600-605.
[23]任小彤,彭婧,韩晓,等.贺兰山东麓产区不同地块酿酒葡萄果实类黄酮物质分析[J].中外葡萄与葡萄酒,2022(6):32-41.
[24]LI M W,SHEN Y,LING T J,et al.Analysis of differentiated chemical components between Zijuan Purple Tea and Yunkang Green Tea by UHPLC-Orbitrap-MS/MS combined with chemometrics[J].Foods,2021,10(5):1070.
[25]毛明慧.基于宏基因组学和代谢组学分析2型糖尿病与肠道菌群的关系[D].北京:中央民族大学,2022.
[26]张耀海,陈细羽,王成秋,等.不同产地沃柑挥发性成分的差异分析[J/OL].食品与发酵工业:1-11[2023-09-21].https://doi.org/10.13995/j.cnki.11-1802/ts.034510.
[27]宫连瑾,薄佳慧,杜哲儒,等.基于代谢组学分析工夫红茶发酵过程中代谢物的变化[J].食品工业科技,2021,42(21):8-16.
[28]方仕茂,张拓,杨婷,等.基于HPLC-FLD靶向分析古茶树游离氨基酸积累特征[J].江苏农业学报,2022,38(4):1070-1077.
[29]刘亚军,范明慧,闫航宾,等.黄山毛峰茶呈味物质冲泡浸出与滋味形成的研究[J].茶叶通讯,2023,50(1):1-12.
[30]赵少平.运动营养素对运动员身体机能的影响[J].食品研究与开发,2021,42(14):233-234.
[31]闫振,王登良.茶叶香气物质响应胁迫机制与功能研究进展[J].食品科学,2021,42(15):337-345.
[32]毛阿静.焙火工艺对茶叶营养及风味特征成分的影响[D].合肥:安徽农业大学,2018.
[33]裴会敏,陈志,张龙芬,等.都匀毛尖本地种茶树代谢组研究[J].种子,2022,41(6):27-34.