红酸汤作为我国三大特色火锅底料之一,其制作是将红辣椒、番茄发酵半年以上后磨浆,加入辅料(生姜、食盐等)而成的一种发酵型辣椒制品,营养价值丰富,能够帮助消化、调剂人体生理机能等[1]。黔南州、黔东南州作为贵州传统的食酸地区,出现了以红酸汤、白酸汤、虾酸等为代表的一系列独具贵州民族特色的发酵食品。2018年以来,贵州红酸汤研究逐年递增,主要研究集中在工艺的优化[2-5]、微生物多样性的分析[6-11]、风味[12-14]及营养品质的解析利用[15-18]、优势菌种的筛选[10,19-20]等方面。
高通量测序(high-throughput sequencing,HTS)技术常用来深度挖掘发酵食品中的微生物群落组成,宫路路等[6-7]利用高通量测序技术筛选凯里红酸汤和丹江镇红酸汤样品中优势微生物,结果表明,主要优势菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria),主要优势菌属为乳酸杆菌属(Lactobacillus)等。李娟[8]研究发现,红酸汤中乳杆菌属为绝对优势细菌属,毕赤酵母属(Pichia)和酒香酵母属(Brettanomyces)为优势真菌属。目前,关于红酸汤理化指标和菌群多样性之间相关性的研究报道较少。
本研究从贵州黔南州、黔东南州采集红酸汤样品,对其pH值、总酸、可溶性固形物含量等理化指标进行检测,利用Illumina MiSeq高通量测序技术解析红酸汤样品的菌群多样性,通过Spearman相关系数法研究优势菌科与理化指标之间的相关性,以期对优质红酸汤微生物资源进行开发利用,为发酵工艺优化提供理论参考。
1 材料与方法
1.1 材料与试剂
红酸汤半成品:于2021年5月采集自贵州黔东南州酸汤企业样品3份,编号为LT、JJ、TY;来自黔南州酸汤企业样品3份,编号为ND、AD、YSQ。红酸汤主要原料为辣椒和西红柿,发酵8~9个月的未添加防腐剂发酵成熟的红酸汤半成品充分混匀后,用无菌采样袋密封保存至4 ℃冰柜备用。
TGuide S96磁珠法土壤/粪便基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;乙醇、酚酞、氢氧化钠、盐酸、硫酸铜、亚甲蓝、酒石酸钾、乙酸锌、冰乙酸、亚铁氰化钾、邻苯二甲酸氢钾、铬酸钾、硝酸银、甲醛(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
Synergy HTX酶标仪:基因科技(上海)股份有限公司;HH-S24数显恒温水浴锅:上海梅香仪器有限公司;BSA224SC W电子天平:赛多利斯科学仪器(北京)有限公司;PB-10 pH计:德国Sartorius公司;KQ-700DB型超声波清洗机:昆山市超声仪器有限公司;TD6离心机:长沙湘智离心机仪器有限公司;Veriti96well9902梯度基因扩增仪:美国应用生物系统公司。
1.3 方法
1.3.1 高通量测序分析
DNA的提取:采用TGuide S96磁珠法土壤/粪便基因组DNA提取试剂盒提取DNA,使用酶标仪对于提取的核酸浓度进行检测。
聚合酶链式反应(polymerase chain reaction,PCR)扩增:以提取的DNA为模板,细菌使用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rRNA基因V3-V4可变区进行PCR扩增,真菌使用ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')在ITS1区进行PCR扩增。PCR扩增体系(10.0 μL):0.3 μL上/下游引物引物(10 μmol/L)、5.0 μL KOD FX Neo Buffer、2.0脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(2 mmol/L)、0.2 μL KOD FX Neo、DNA模板20 ng。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s,25个循环;72 ℃再延伸7 min,4 ℃保存。
高通量测序分析:纯化扩增后的PCR产物,采用ImageJ v1.8.0软件系统对回收产物进行检测定量。使用e.Z.N.A.TM Cycle-Pure Kit建库,高通量测序由北京百迈客生物科技有限公司完成。原始数据上传至美国国家生物技术信息中心(national center for biotechnology information,NCBI)SRA数据库。用Qsep-400方法对原始测序序列进行质控,使用Usearch v10软件按照最小overlap长度为10 bp,overlap区允许的最小相似性90%、最大错配碱基数5 bp(Default)对每个样品的reads进行拼接。使用Usearch v10软件对97%相似度的可操作分类单元(operational taxonomic units,OTU)进行聚类分析并剔除嵌合体,得到优质序列。利用核糖体数据库项目(ribosomal database project,RDP)classifier对每条序列进行物种分类注释,并基于SILVA 138、UNITE 8.0、Greengenes 13.5、NCBI、fungene、MaarjAM数据库对OTU进行分类学注释。
1.3.2 理化指标的测定
总酸的测定:参照GB 12456—2021《食品安全国家标准食品中总酸的测定》;还原糖的测定:参照GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》;pH值的测定:使用pH计;食盐的测定:参照GB 5009.42—2016《食品安全国家标准食盐指标的测定》;氨基酸态氮的测定:参照GB 5009.235—2016《食品安全国家标准食品中氨基酸态氮的测定》;可溶性固形物的测定:采用PAL-1糖度计。
1.3.3 数据处理与分析
采用Excel2019进行数据处理,SPSS Statistics26.0统计分析数据,Origin2018软件用于绘制微生物群落组成图、主成分分析(principal component analysis,PCA)图、层级聚类分析(hierarchical cluster analysis,HCA)图。
2 结果与分析
2.1 红酸汤样品理化指标检测结果
pH值、总酸、可溶性固形物及氨基酸态氮含量是影响红酸汤品质的重要因素,是红酸汤自然发酵过程中重要的理化指标。红酸汤样品的理化指标检测结果见表1。
表1 红酸汤样品的理化指标
Table 1 Physicochemical indexes of red sour soup samples
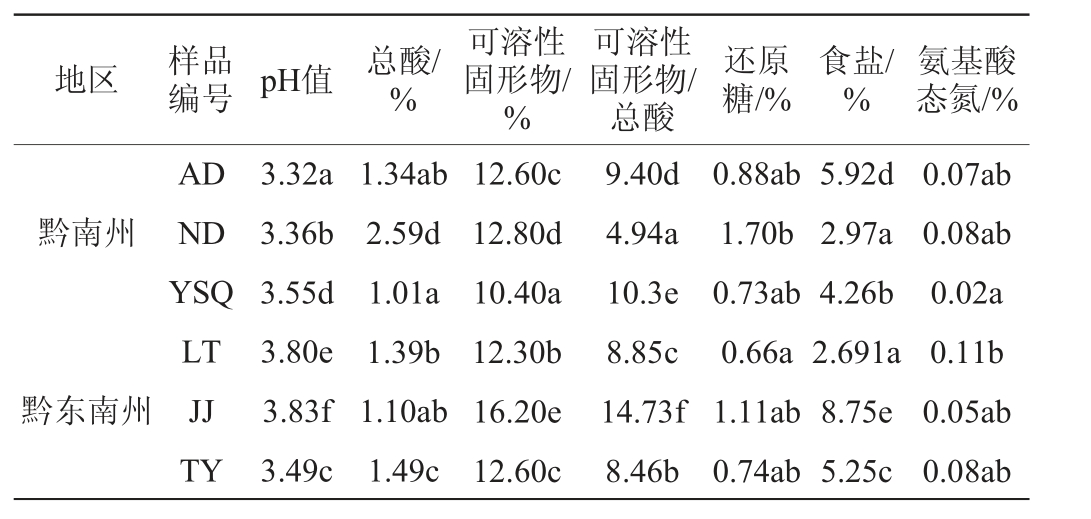
注:同列不同小写字母表示差异显著(P<0.05)。
地区 样品编号 pH值 总酸/%可溶性固形物/%可溶性固形物/总酸还原糖/%食盐/%氨基酸态氮/%黔南州黔东南州AD ND YSQ LT JJ TY 3.32a 3.36b 3.55d 3.80e 3.83f 3.49c 1.34ab 2.59d 1.01a 1.39b 1.10ab 1.49c 12.60c 12.80d 10.40a 12.30b 16.20e 12.60c 9.40d 4.94a 10.3e 8.85c 14.73f 8.46b 0.88ab 1.70b 0.73ab 0.66a 1.11ab 0.74ab 5.92d 2.97a 4.26b 2.691a 8.75e 5.25c 0.07ab 0.08ab 0.02a 0.11b 0.05ab 0.08ab
由表1可知,6个样品的pH值为3.32~3.83,总酸含量为1.01%~2.59%,与张璇[21]对红酸汤半成品检测结果一致,但明显低于舒亚非等[22]对二次加工的红酸汤商品的检测结果;可溶性固形物含量为10.40%~16.20%,可溶性固形物/总酸为4.94~14.73,其在样品JJ的数值最高,样品发酵时间相近(8~9个月),不同的可溶性固形物的含量可能是由于6个样品的辣椒和西红柿配比差异[21];食盐含量为2.691%~8.75%,样品JJ含量最高,为8.75%;还原糖含量为1.11%~1.70%,氨基酸态氮含量为0.02%~0.11%,其可能与红酸汤原料配比、食盐等辅料配比及发酵过程中的微生物组成有关[4]。综合DBS52/056—2021《食品安全地方标准酸汤》[23]和T/KLST 001—2021《凯里酸汤 红酸汤》[24],规定红酸汤总酸≥1.5 g/100 g,氯化物(以Cl-计)≤5.0 g/100 g,氨基酸态氮(以氮计)≥0.12 g/100 g。样品ND总酸、还原糖含量最高,分别为2.59%、1.70%,可溶性固形物含量、pH、氨基酸态氮含量较高,分别为12.80%、3.36、0.08%,食盐含量最低,为2.97%,可溶性固形物/总酸最小,为4.94,品质较优。
2.2 红酸汤样品中微生物Alpha多样性分析
稀释性曲线用于验证测序数据量是否足以反映样品中的物种多样性,并间接反映样品中物种的丰富程度。6个红酸汤样品中细菌(A)和真菌(B)的稀释性曲线见图1。
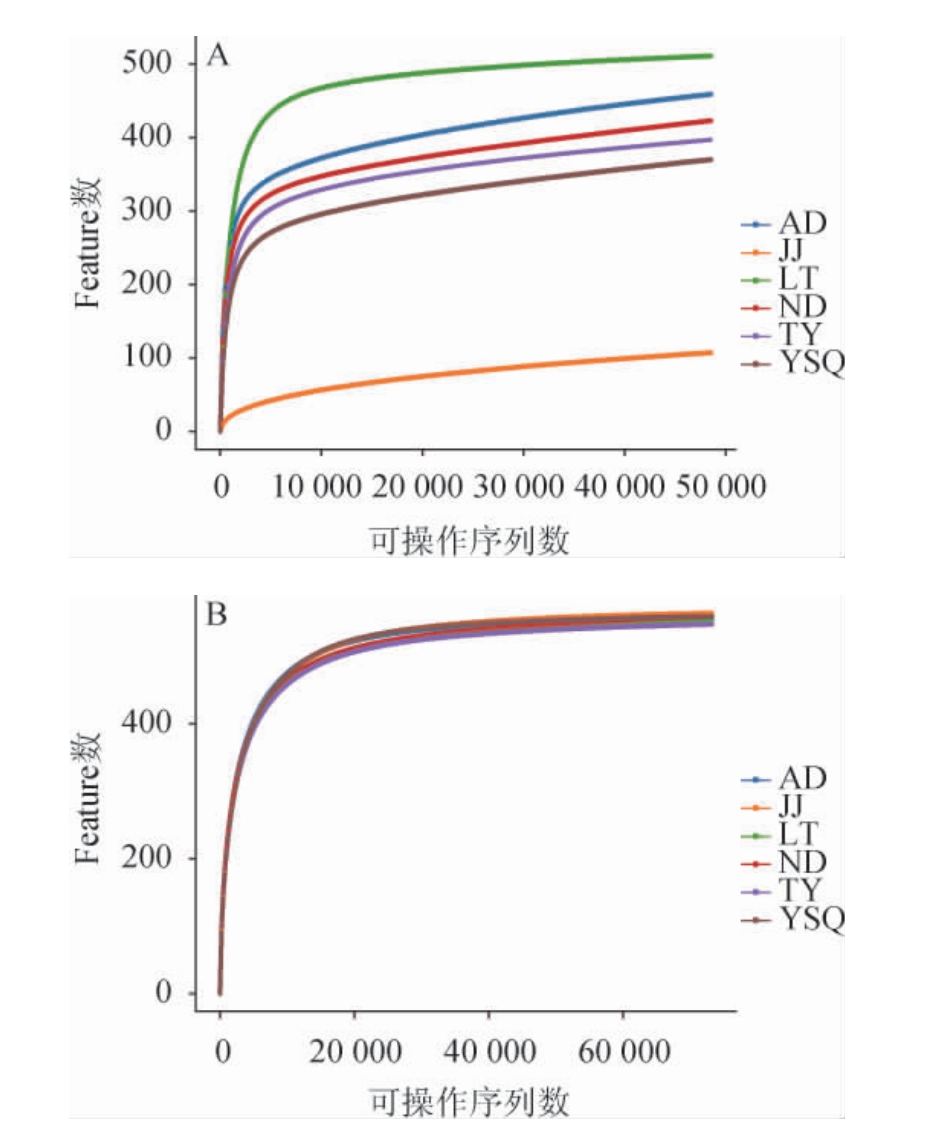
图1 6个红酸汤样品中细菌(A)和真菌(B)的稀释性曲线
Fig.1 Rarefaction curves of bacteria (A) and fungi (B) in six red sour soup samples
由图1A可知,样品LT中细菌的稀释曲线平缓,说明测序深度较好,测序数据量合理。其余5个红酸汤样品中细菌的稀释曲线趋于平缓,其中样品LT中细菌的丰富度最高,样品JJ中细菌的丰富度则远远小于其他5个样品,这可能是由于不同的红酸汤制作工艺、原辅料选择和发酵条件等因素的影响了发酵微生物菌群结构。由图1B可知,6个红酸汤样品中真菌的稀释曲线平缓,真菌的丰富度差异较小。
红酸汤样品细菌和真菌微生物群落Alpha多样性分析结果见表2。
表2 6个红酸汤样品细菌和真菌菌群Alpha多样性分析结果
Table 2 Alpha diversity analysis results of bacterial and fungal communities in six red sour soup samples
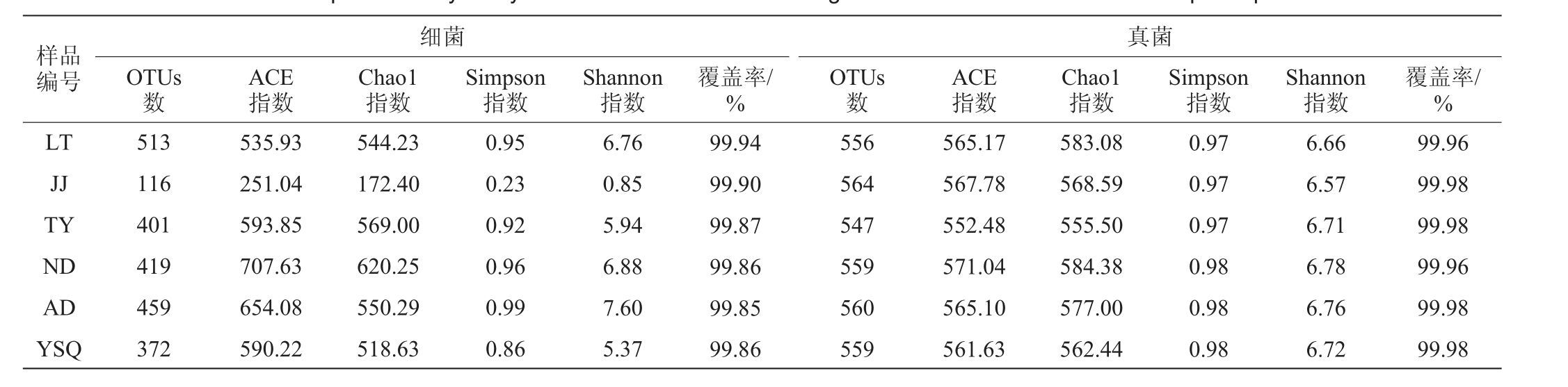
样品编号LT JJ TY ND AD YSQ细菌OTUs数ACE指数Chao1指数Simpson指数513 116 401 419 459 372 535.93 251.04 593.85 707.63 654.08 590.22 544.23 172.40 569.00 620.25 550.29 518.63 0.95 0.23 0.92 0.96 0.99 0.86 Shannon指数6.76 0.85 5.94 6.88 7.60 5.37覆盖率/%99.94 99.90 99.87 99.86 99.85 99.86真菌OTUs数ACE指数Chao1指数Simpson指数556 564 547 559 560 559 565.17 567.78 552.48 571.04 565.10 561.63 583.08 568.59 555.50 584.38 577.00 562.44 0.97 0.97 0.97 0.98 0.98 0.98 Shannon指数6.66 6.57 6.71 6.78 6.76 6.72覆盖率/%99.96 99.98 99.98 99.96 99.98 99.98
ACE指数和Chao1指数都是用来反映物种数目的丰富度,Simpson指数和Shannon指数都是用来估算样品中微生物的多样性[11]。由表2可知,覆盖率均≥99.85%,表明测序数据能够覆盖样品中细菌及真菌的种类,可真实反映样品中物种丰度及多样性。6个红酸汤样品细菌的OTUs个数为116~513,ACE指数为251.04~707.63,Chao1指数为172.40~620.25,Simpson指数为0.23~0.99,Shannon指数为0.85~7.60。其中样品JJ的OTUs个数、ACE指数、Chao1指数、Simpson和Shannon指数均远远小于其他5个样品,物种丰富度及多样性较差,样品ND的OTUs个数、ACE指数、Chao1指数、Simpson和Shannon指数较高,其物种丰富度及多样性较高。结合理化指标检测结果,说明原辅料大分子物质的营养相互作用和内生环境因子(温度、水分、酸度等)决定了传统发酵食品微生物群落的构建及演替[25],特别是高盐、高酸度发酵环境会较大程度地抑制腐败菌、病原菌及部分不耐盐不耐酸细菌的生长。6个红酸汤样品真菌的OTUs个数、ACE指数、Chao1指数、Simpson和Shannon指数差异性较小,真菌的丰富度及多样性差别不大。
2.3 基于门、科分类学地位的微生物群落结构分析
2.3.1 细菌菌群结构分析
基于门水平(A)和科水平(B)的红酸汤样品细菌菌群组成见图2。
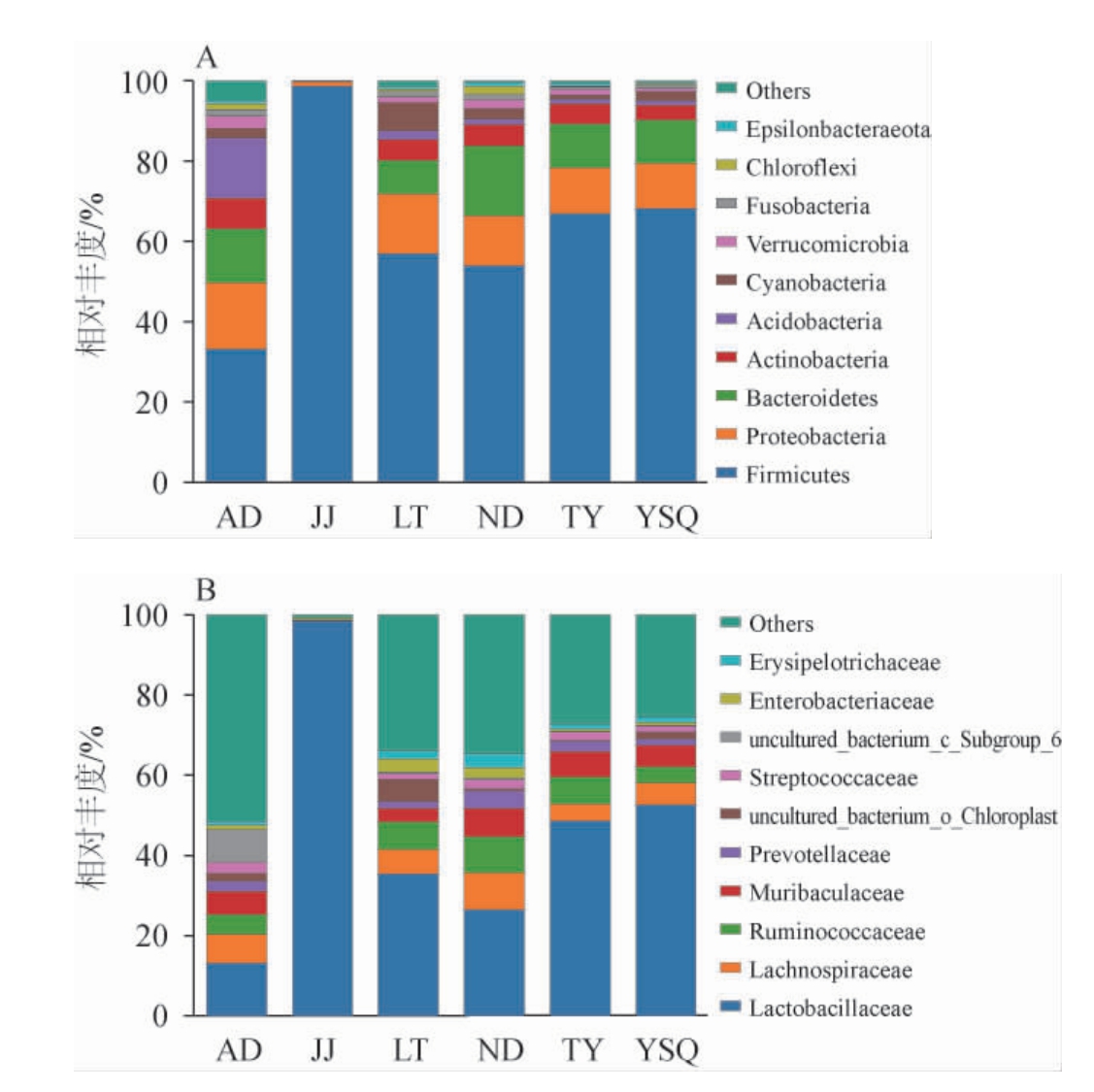
图2 基于门(A)和科(B)水平的红酸汤样品细菌菌群结构
Fig.2 Bacterial community structure of red sour soup samples at the phylum (A) and family (B) level
Others代表相对丰度后10的物种。下同。
在门水平上,共检测出22个细菌门,选取相对丰度前10的细菌门进行分析。由图2A可知,除样品JJ外,5个红酸汤样品中的细菌门平均相对丰度依次为厚壁菌门(Firmicutes)(55.82%)、变形菌门(Proteobacteria)(13.29%)、拟杆菌门(Bacteroidetes)(12.16%)、放线菌门(Actinobacteria)(5.44%)、酸杆菌门(Acidobacteria)(4.10%)、蓝细菌门(Cyanobacteria)(3.08%)、疣微菌门(Verrucomicrobia)(1.73%)、梭杆菌门(Fusobacteria)(1.18%)、绿弯菌门(Chloroflexi)(0.95%)、Epsilonbacteraeota(0.63%),这与宫路路等[6-7,11]研究的西红柿红酸汤、辣椒红酸汤中优势菌落组成结构相似,样品JJ和样品AD与其余4个样品在细菌门组成上差异性较大,这可能与其食盐、酸度等理化指标的差异性有关。6个样品中厚壁菌门的平均相对丰度均最高,其在样品JJ中占绝对优势,相对丰度达98.68%,其在样品AD中占比最少,相对丰度为33.12%。变形菌门相对丰度为0.99%~16.55%,拟杆菌门相对丰度为0.02%~17.33%,放线菌门相对丰度为0.13%~7.65%。疣微菌门在样品AD中相对丰度最高,为3.01%。酸杆菌门作为在土壤中最常见的嗜酸、寡营养、难培养的细菌门类之一[26],在红酸汤样品中鲜有报道,其在样品AD的相对丰度最高,为14.91%。厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门作为红酸汤发酵后期的主要细菌门,也是人类肠道主要菌群[27],两者菌门结构组成的相似,与红酸汤能够改善肠道健康,促进食物的消化吸收有关。
在科水平上,6个红酸汤样品共检测出193个细菌科,选取相对丰度前10的细菌科进行分析。由图2B可知,除样品JJ外,5个红酸汤样品中的细菌科平均相对丰度依次为乳杆菌科(Lactobacillaceae)(35.24%)、毛螺菌科(Lachnospiraceae)(6.43%)、瘤胃球菌科(Ruminococcaceae)(6.31%)、(Muribaculaceae)(5.59%)、普氏菌科(Prevotellaceae)(2.54%)、链球菌科(Streptococcaceae)(2.01%)、丹毒丝菌科(Erysipelotrichaceae)(1.75%)、肠杆菌科(Enterobacteriaceae)(1.66%)和两个未定名科uncultured_bacterium_o_Chloroplast(2.00%)、uncultured_bacterium_c_Subgroup_6(1.85%)。乳杆菌科的乳酸杆菌是发酵红酸汤中的主要优势细菌[8],除样品AD外,乳杆菌科相对丰度占比均最高,其在样品JJ占绝对优势,为98.52%。除样品JJ外,5个红酸汤样品的毛螺菌科相对丰度为4.30%~9.29%,瘤胃球菌科相对丰度为3.98%~8.96%,Muribaculaceae相对丰度为3.32%~7.08%,普氏菌科相对丰度为1.71%~4.32%,丹毒丝菌科相对丰度为1.01%~3.37%,这5个菌科的相对丰度在样品ND中均最高,这可能与食盐、酸度等发酵条件,温度气候等发酵环境的差异有关。
2.3.2 真菌菌群结构分析
基于门水平(A)和科水平(B)的红酸汤样品真菌菌群结构见图3。
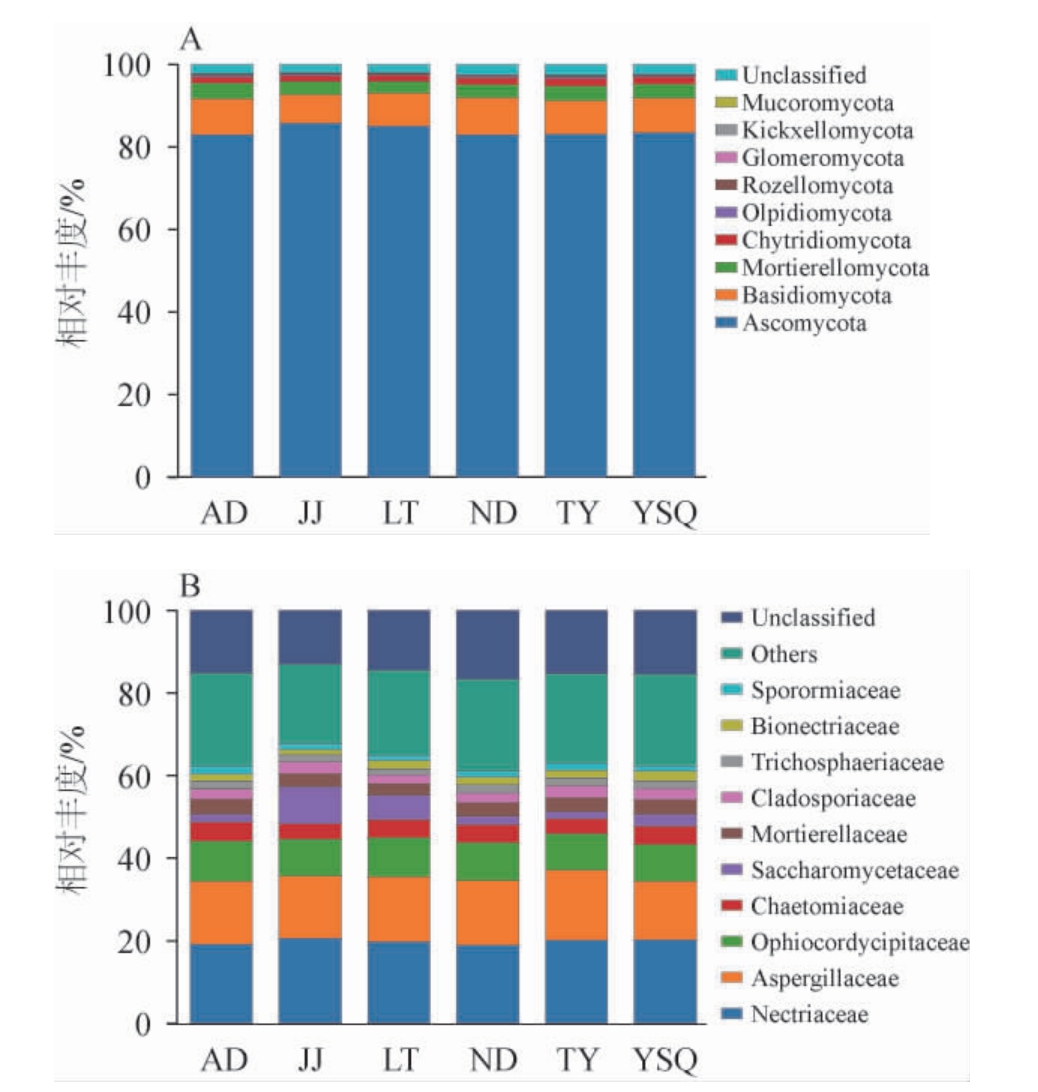
图3 基于门(A)和科(B)水平红酸汤样品真菌菌群结构
Fig.3 Fungal community structure of red sour soup samples at the phylum (A) and family (B) level
Unclassified代表未分类真菌门。
由图3A可知,在门水平上,6个红酸汤样品共检测出10个真菌门,其真菌门平均相对丰度分别为子囊菌门(Ascomycota)(83.83%)、担子菌门(Basidiomycota)(8.20%)、被孢霉门(Mortierellomycota)(3.30%)、壶菌门(Chytridiomycota)(1.64%)、油壶菌门(Olpidiomycota)(0.32%)、罗兹菌门(Rozellomycota)(0.27%)、球囊菌门(Glomeromycota(0.08%)、一个未分类真菌门Unclassified(2.34%)、梳霉门(Kickxellomycota)和毛霉菌门(Mucoromycota)平均相对丰度均<0.05%。6个红酸汤样品真菌门结构组成相似,其中子囊菌门相对丰度为82.87%~85.74%,为优势菌门。担子菌门相对丰度为6.92%~9.00%、被孢霉门相对丰度为2.78%~3.69%、未分类菌门相对丰度为2.06%~2.66%、壶菌门相对丰度为1.43%~1.88%、油壶菌门相对丰度为0.27%~0.37%、罗兹菌门相对丰度为0.18%~0.36%、球囊菌门相对丰度为0.06%~0.13%,这与王琪琪等[11]研究的红酸汤真菌门微生物区系组成相似。子囊菌门、担子菌门等作为多种发酵食品中的主要真菌种群[28],也在红酸汤的发酵中发挥着重要的作用。
在科水平上,6个红酸汤样品共检测出132个真菌科,选取相对丰度前10的真菌科进行分析。由图3B可知,丛赤壳科(Nectriaceae)(19.84%)、曲霉科(Aspergillaceae)(15.43%)、线虫草科(Ophiocordycipitaceae)(9.17%)、毛壳菌科(Chaetomiaceae)(4.18%)、酵母科(Saccharomycodaceae)(3.92%)、被孢霉科(Mortierellaceae)(3.28%)、枝孢霉科(Cladosporiaceae)(2.61%)、假毛壳菌科(Trichosphaeriaceae)(1.81%)、生赤壳科(Bionectriaceae)(1.76%)、荚胞腔菌科(Sporormiaceae)(1.55%)在6个红酸汤样品中的平均相对丰度较高。丛赤壳科是红酸汤发酵后期的优势真菌科,在自然界以寄生或腐生的营养方式生存,其相对丰度为18.96%~20.65%。曲霉科在发酵类食品中较为常见,其相对丰度为14.10%~16.93%。线虫草科相对丰度为8.86%~9.69%,毛壳菌科相对丰度为3.56%~4.56%,酵母科相对丰度为1.71%~8.98%。传统红酸汤的发酵过程是乳酸杆菌和酵母菌(Saccharomyces)的共同发酵[8],酵母科的酵母菌其在产香、产酒等方面具有较强作用,能够产生多种风味酯并贡献乙醇和其他有机酸[29]。
2.4 红酸汤样品理化指标与菌群的相关性分析
选取理化指标(pH、食盐、可溶性固形物/总酸、还原糖和氨基酸态氮)与相对丰度前10的细菌科及真菌科进行Pearson相关性分析,结果见图4。
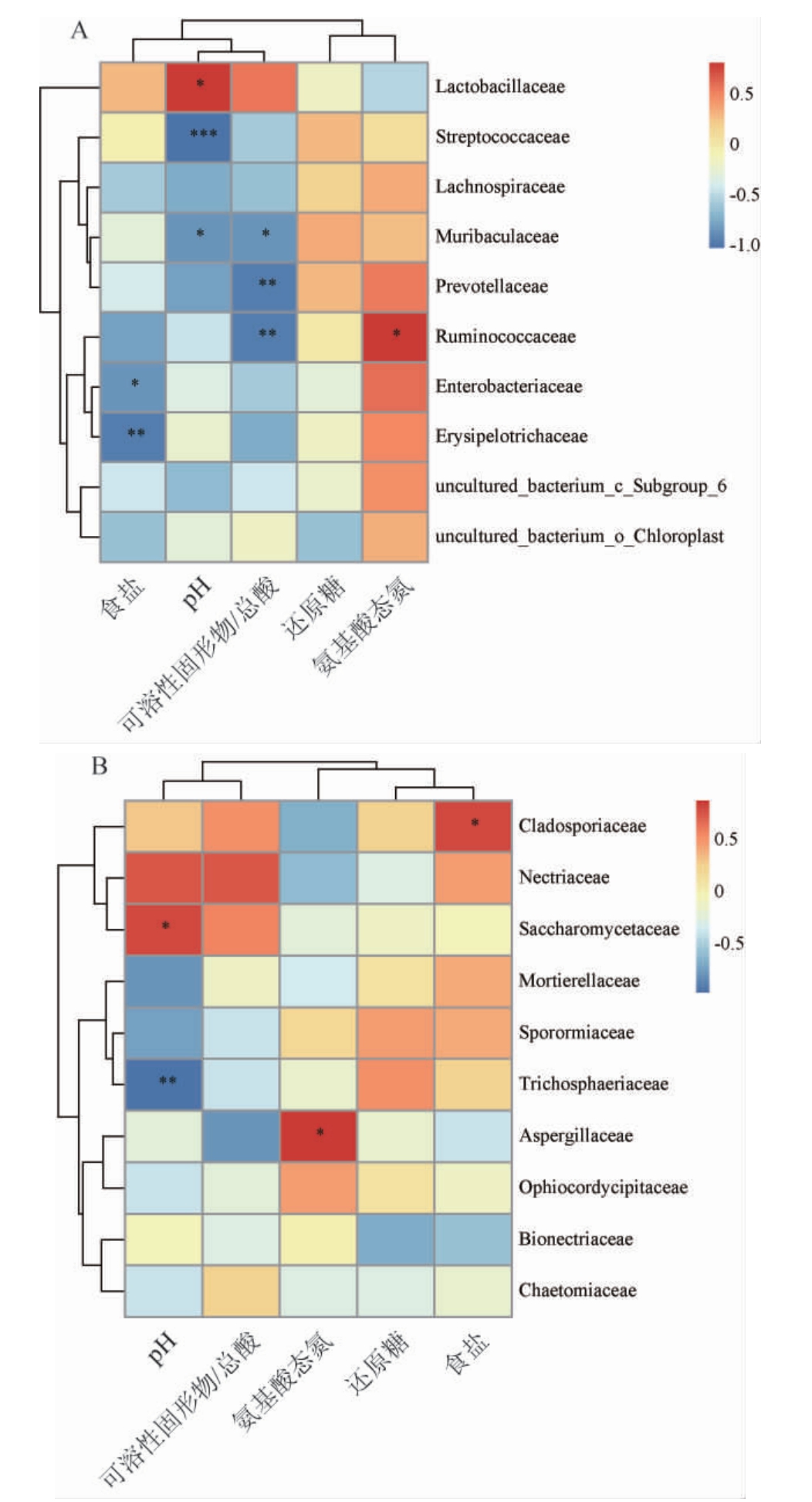
图4 6个红酸汤样品中细菌科(A)、真菌科(B)与理化指标的相关性分析热图
Fig.4 Heatmap of correlation between bacterial families (A),fungal families (B) and physicochemical indexes in six red sour soup samples
“*”表示显著相关(P<0.05);“**”表示极显著相关(P<0.01);“***”表示高度显著相关(P<0.001)。
由图4A可知,乳杆菌科与pH呈显著正相关(P<0.05),链球菌科与pH呈高度显著负相关(P<0.001),Muribaculaceae与pH、可溶性固形物/总酸呈显著负相关(P<0.05),普氏菌科与可溶性固形物/总酸呈极显著负相关(P<0.01),瘤胃球菌科与可溶性固形物/总酸呈极显著负相关(P<0.01),与氨基酸态氮呈显著正相关(P<0.05),肠杆菌科和丹毒丝菌科与食盐含量分别呈极显著、显著负相关(P<0.01)、(P<0.05)。综上,在红酸汤发酵过程中,对其细菌群落结构组成有显著影响的理化指标是食盐、pH、可溶性固形物/总酸和氨基酸态氮。食盐含量对肠杆菌科和丹毒丝菌科影响显著,食盐含量越高,肠杆菌科和丹毒丝菌科生长受到抑制。pH值对乳杆菌科呈正向影响,pH值与链球菌科、Muribaculaceae呈负向影响,可溶性固形物/总酸对Muribaculaceae、普氏菌科、瘤胃球菌科呈负向影响。氨基酸态氮含量越高,瘤胃球菌科占比越高,食盐含量对肠杆菌科和丹毒丝菌科呈负向影响。
由图4B可知,枝孢霉科与食盐含量呈显著正相关(P<0.05),酵母科与pH值呈显著正相关(P<0.05),假毛壳菌科与pH值呈极显著负相关(P<0.01),曲霉科与氨基酸态氮呈显著正相关(P<0.05)。在红酸汤发酵过程中,食盐、pH值和氨基酸态氮也是推动真菌菌落结构组成的重要因素。
3 结论
样品ND品质较优,其总酸、还原糖、可溶性固形物含量、pH值、氨基酸态氮含量较高,分别为2.59%、1.70%、12.80%、3.36、0.08%,食盐含量、可溶性固形物/总酸最低,分别为2.97%、4.94;6个红酸汤样品共计检测出22个细菌门,193个细菌科,10个真菌门,132个真菌科。真菌的丰富度和多样性差异不大,细菌有较大差异,这可能与食盐、酸度等发酵条件和温度、气候等发酵环境的差异有关;通过Spearman算法得出pH值、食盐、氨基酸态氮含量及可溶性固形物/总酸与其中7个细菌科、4个真菌科呈显著相关(P<0.05)。在红酸汤发酵过程中,以pH值、可溶性固形物/总酸、食盐、氨基酸态氮为主的理化指标是推动红酸汤微生物群落构建的重要因子,也是影响红酸汤品质的重要因素。
[1]常云鹤,陈曦,郑舒文,等.天然抗氧化剂对红酸汤发酵过程中亚硝酸盐含量及品质的影响[J].食品安全质量检测学报,2022,13(6):1935-1941.
[2]杨裕民,王雪郦,徐智虎,等.凯里红酸汤微胶囊制备及其工艺优化[J].中国酿造,2022,41(2):149-155.
[3]王若曦.贵州省传统发酵酸汤中的微生物群落结构特征及功能微生物的发掘[D].昆明:昆明理工大学,2021.
[4]潘季红.红酸汤干制工艺及烹饪肉类食品品质研究[D].贵阳:贵州大学,2020.
[5]张东亚.红酸汤发酵工艺优化及品质控制研究[D].贵阳:贵州大学,2018.
[6]宫路路,李晓然,陈芳勇,等.凯里红酸汤细菌群落多样性分析及其优势乳酸菌筛选[J].中国调味品,2022,47(10):67-72.
[7]宫路路,赵志敏,杨颜,等.丹江镇辣椒红酸汤细菌菌群多样性分析及抗食源性致病菌乳酸菌筛选[J].中国酿造,2022,41(9):93-98.
[8]李娟.贵州红酸汤优势菌群及特征风味相关性研究[D].贵阳:贵州大学,2022.
[9]何扬波,李国林,李咏富,等.红酸汤发酵过程中微生物区系及挥发性物质组成变化分析[J].食品工业科技,2022,43(19):177-190.
[10]王婵.凯里红酸汤菌群、风味分析及其品质提升和应用研究[D].贵阳:贵州大学,2021.
[11]王琪琪,田界先,潘宗东,等.基于Illumina MiSeq分析贵州凯里酸汤独特风味的优势菌群[J].食品与发酵工业,2020,46(14):40-47.
[12]范芳玉,杨璇,刘宇,等.刺梨果渣天然防腐剂的制备及其在红酸汤中的应用[J].食品安全质量检测学报,2022,13(22):7399-7406.
[13]鲁杨.凯里红酸汤成分及其对大鼠血脂调节作用研究[D].贵阳:贵州医科大学,2019.
[14]吴文燕,胡萍,李娟,等.酸汤对酸汤牛肉特征风味及品质的影响[J].食品科学,2022,43(12):10-17.
[15]杨进军,胡金祥,王林,等.气质联用技术结合电子鼻分析红酸汤挥发性风味差异[J].食品与发酵工业,2020,46(14):234-242.
[16]郑莎莎.干酪乳杆菌H1发酵红酸汤的品质影响及特征代谢物研究[D].贵阳:贵州大学,2020.
[17]杨红梅.凯里红酸汤对肥胖大鼠脂质代谢的影响及其机制研究[D].贵阳:贵州医科大学,2021.
[18]何扬波,李咏富,钟定江,等.电子鼻和气相离子迁移谱技术比较瓮臭味及正常红酸汤的风味差异[J].食品工业科技,2020,41(14):216-221,227.
[19]贺晓洁,赵良忠,李明,等.耐盐乳酸菌的筛选及其诱变育种与耐受性研究[J].食品与发酵工业,2022,48(1):84-90.
[20]张东亚,徐俐,鲁青松,等.菌群强化凯里红酸汤“番茄浆”及发酵工艺的优化[J].食品科技,2018,43(5):313-318.
[21]张璇.贵州“红酸汤”半成品中微生物区系的研究[D].重庆:西南大学,2011.
[22]舒亚非,廖伟先,杨丽娟,等.贵州11种酸汤品质特性分析[J].中国酿造,2021,40(10):129-133.
[23]贵州省卫生健康委员会.DBS52/056—2021 食品安全地方标准酸汤[S].贵阳:贵州省人民出版社,2021.
[24]黔东南州凯里酸汤产业发展协会.T/KLST 001—2021 凯里酸汤红酸汤[S].贵阳:贵州省人民出版社,2021.
[25]魏军林,聂尧,杜海,等.营养相互作用对传统发酵食品微生物群落构建的推动作用研究进展[J].微生物学通报,2021,48(11):4412-4424.
[26]王光华,刘俊杰,于镇华,等.土壤酸杆菌门细菌生态学研究进展[J].生物技术通报,2016,32(2):14-20.
[27]潘杰,刘来浩,牟建伟.肠道菌群与人类健康研究进展[J].山东师范大学学报(自然科学版版),2021,36(4):337-365.
[28]母应春,姜丽,苏伟.应用Illumina高通量测序技术分析3种酒曲中微生物多样性[J].食品科学,2019,40(14):115-122.
[29]贾曼,杨絮,周国燕,等.高通量测序分析黄酒糟制香糟自然发酵过程中微生物群落多样性[J].食品科学,2023,44(14):190-196.