我国黄酒酿造历史悠久,按照产区被划分为浙江绍兴黄酒[1]、湖北房县黄酒[2]和广东客家黄酒[3]等众多具有地域特色的黄酒品类[4]。制曲酿酒是我国酒之特色,自古有“曲乃酒之骨”之说[5],曲中蕴含的复杂微生物群系是推动黄酒酿造的主要动力,对黄酒的风味形成起到了关键作用[6],因而不同的曲塑造出了不同的黄酒风格特征。除了地域环境的差别,不同产区在酿造黄酒时所采用的曲亦有所差别。目前许多研究人员都开始关注黄酒酿造用曲中的微生物群系。在酿造绍兴黄酒的麦曲中,席啦等[7]研究发现,曲霉属(Aspergillus)和酵母属(Saccharomyces)为主要的真菌;LIU S P等[8]研究发现,芽孢杆菌属(Bacillus)和明串珠菌属(Leuconostoc)为主要的细菌;而HUANG Z R等[9]研究发现,紫色红曲霉(Monascus purpureus)和人参土魏茨曼氏菌(Weizmannia ginsengihumi)分别为红曲中丰度最高的真菌和细菌,少根根霉(Rhizopus arrhizus)和乳酸乳球菌(Lactococcus lactis)分别为小曲中丰度最高的真菌和细菌。不同曲中的微生物类群之间存在较大差异,而这些差异可能正是形成黄酒不同风格特征的主要原因之一。
湖北枣阳市鹿头镇酿制地封黄酒的主要原料是当地的优质糯米、小麦、富含矿物质的井水及其他辅料,采用传统的技艺方法,经过自制麦曲和高温大曲以及黄酒酿制三大技艺和十多道主要酿制流程,通过长时间的糖化、发酵酿制,纯天然无污染。与采用小曲发酵的湖北房县黄酒不同,枣阳鹿头镇生产的黄酒采用高温大曲和小曲共同发酵,二者的风味特征极为不同。房县黄酒色泽清亮,米香浓郁和酒味甘醇,而鹿头黄酒色泽澄黄、芳香馥郁和绵柔甜美,回味中略带苦涩。与房县黄酒相比,鹿头黄酒较为独特的风味特征或许与其使用的高温大曲有关。在开始发酵前大曲块要按照横三竖三交错侧立的方式在曲房排列至行六层五,这种堆积方式使得发酵时曲堆中心温度要略高于外围温度,且经过发酵后位于中心的大曲块通常呈黑色,而外围的大曲块通常呈黄色。目前已有不少研究证明了不同颜色高温大曲的理化性质与微生物类群存在显著差异[10-11],解析鹿头黄酒高温大曲的真菌类群对理解鹿头黄酒风味形成机理具有积极意义。
本研究以鹿头黄酒酿造用黑色和黄色高温大曲为研究对象,对其常规理化指标进行检测,进一步采用MiSeq高通量测序技术对其真菌类群进行解析,并揭示高温大曲真菌类群与其理化指标之间的相关性,以期为鹿头黄酒酿造用高温大曲制曲工艺的改良提供一定的理论参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高温大曲样品:湖北省襄阳市枣阳市某家黄酒生产企业。其中黑色高温大曲(简称黑曲,编号为B1~B10)和黄色高温大曲(简称黄曲,编号为Y1~Y10)样品各10份,两种颜色的大曲生产于同一批次,采用的原料与制作工艺完全一致。该企业在生产高温大曲时对原料进行了改良,其原料不仅包括小麦等粮食作物,还包括辣蓼草(Polygonum hydropiper)、益母草(Leonurus japonicus)和青蒿(Artemisia apiacea)等中药材。每块大曲在发酵前均使用了荷叶进行包裹,以防发酵过程中大曲块发生粘连。采集的样品均装入无菌采样袋中在常温下运送回实验室,并将样品打碎至粉末状后分别装入自封袋中置于-40 ℃保存备用。
1.1.2 试剂
DNeasy mericon Food Kit 脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;正/反向引物ITS3F/ITS4R(ITS3F:5'-GCATCGATGAAGAACGCAGC-3';ITS4R:5'-TCCTCCGCTTATTGATATGC-3'):上海桑尼生物科技有限公司;Illumina MiSeq测序试剂盒v3:美国Illumina公司;氢氧化钠、盐酸、次甲基蓝、葡萄糖、碘、硫酸铜、酒石酸钾钠、甲醛、硫酸铵、硫酸、硼酸、甲基红、溴甲酚绿和乙醇(均为分析纯):西陇化工股份有限公司;聚合酶链式反应(polymerase chain reaction,PCR)扩增试剂:宝生物工程(大连)有限公司。
1.2 仪器与设备
SH-10A水分测定仪:上海力辰仪器科技有限公司;KBF1700高温箱式炉:南京南大仪器厂;PHS-3C数显台式酸度计:上海越平科学仪器有限公司;K1100全自动定氮仪:济南海能仪器股份有限公司;Vetiri PCR梯度基因扩增仪:美国AB公司;MiSeq PE300高通量测序平台:美国Illumina公司;R930机架式服务器:美国DELL公司。
1.3 实验方法
1.3.1 高温大曲的理化指标测定
高温大曲的水分含量、灰分、酸度、淀粉和氨基酸态氮含量:参照轻工行业标准QB/T 4257—2011《酿酒大曲通用分析方法》中的方法进行测定[12],蛋白质含量:参照国家标准GB/T 33862—2017《全(半)自动凯氏定氮仪》中的方法进行测定[13]。
1.3.2 宏基因组DNA提取、PCR扩增和MiSeq高通量测序
参照DNeasy mericon Food Kit DNA试剂盒使用说明对高温大曲中微生物宏基因组DNA进行提取,参照陈怡等[14]的方法使用引物ITS3F/ITS4R对真菌内源转录间隔区(internally transcribed spacer,ITS)2进行PCR扩增,PCR扩增产物寄至上海美吉生物医药科技有限公司完成高通量测序。
1.3.3 生物信息学分析
参照郭壮等[15]的方法对测序返回的序列进行质控,基于QIIME v1.95平台采用UCLUST两步法对有效序列分别按照100%和97%相似度划分操作分类单元(operational taxonomic units,OTU)[16],并进行嵌合体检查[17]。基于UNITE v7.2数据库对真菌类群进行物种注释[18]。
1.3.4 数据处理
采用GrahPad Prism v9软件绘制小提琴图,使用R v4.1.0软件绘制物种累积箱型图和气泡图;使用SAS v8软件中的Spearman分析计算优势真菌属与理化指标间的相关性系数和显著性,并使用Cytoscape v3.7.2软件绘制相关性网络图;使用Past3软件中的Mann-Whitney检验进行差异性分析。
2 结果与分析
2.1 鹿头黄酒酿造用黑色和黄色高温大曲理化指标分析
对不同类型鹿头黄酒酿造用高温大曲(黑曲和黄曲)的水分含量、灰分、酸度、淀粉、蛋白质和氨基酸态氮含量等理化指标进行测定,结果见图1。
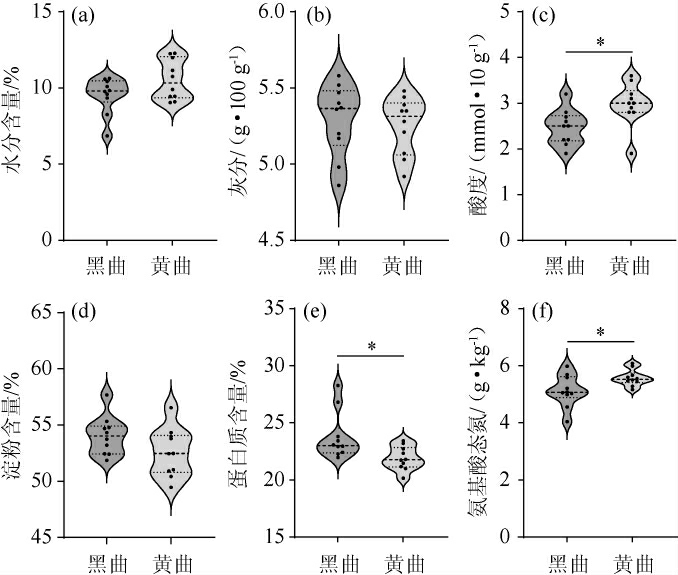
图1 鹿头黄酒酿造用高温大曲理化指标的比较分析
Fig.1 Comparative analysis of physicochemical indexes of hightemperature Daqu for Lutou Huangjiu brewing
“*”表示差异显著(P<0.05)。
由图1可知,鹿头黄酒酿造用高温大曲的水分含量为6.86%~12.28%,灰分为4.86~5.58 g/100 g,酸度为1.9~3.6 mmol/10 g,淀粉含量为49.45%~57.68%,蛋白质含量为20.16%~28.28%,氨基酸态氮含量为4.04~6.08 g/kg。通常水分含量降低到12.5%是曲培进入贮藏期的一个节点,这说明本研究所用高温大曲均到达成熟阶段[19]。经Mann-Whitnay检验发现,与黄曲相比,黑曲中蛋白质含量显著偏高(P<0.05),而酸度和氨基酸态氮含量显著偏低(P<0.05),黑曲蛋白质含量、酸度和氨基酸态氮含量分别为23.8%、2.5 mmol/10 g和5.1 g/kg,而在黄曲中则分别为21.9%、3.0 mmol/10 g和5.6 g/kg。将高温大曲应用在酱香型白酒酿造中,王颖等[20-21]分别对不同产区和不同曲层中高温大曲理化成分进行检测,结果发现不同颜色和不同曲层的大曲样品理化指标存在一定的差异性。大曲中的酸度主要来源于微生物代谢产生的有机酸和氨基酸,以及淀粉、蛋白质和脂质降解后进入三羧酸循环产生的各种酸类物质[19],这较好的解释了蛋白质与酸度和氨基酸态氮在样品中的含量高低呈现出相反趋势的原因。
2.2 鹿头黄酒酿造用黑色和黄色高温大曲物种累积箱型图分析
经高通量测序,20个样品共产生1 144 701条有效序列,平均每个样品包含57 235条,所有序列经97%相似度划分聚类共得到4 863个操作分类单元(operational taxonomic unit,OTU),所有样品中的真菌隶属于5个门、18个纲、32个目、46个科和76个属。为确定采集样本量是否满足实验要求,绘制20份高温大曲的真菌物种累计箱型图见图2。
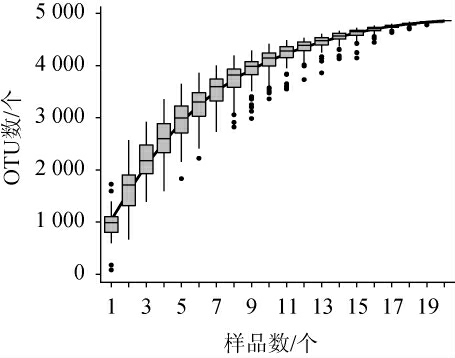
图2 鹿头黄酒酿造用高温大曲真菌物种累积箱型图
Fig.2 Cumulative boxplots of fungal species of high-temperature Daqu for Lutou Huangjiu brewing
由图2可知,随着样品数量的增加,物种累积曲线不断上升,且上升幅度逐渐减小,最终趋于平缓,表明本研究样品已几乎覆盖高温大曲中的所有真菌物种,继续增加样品数量并不会出现物种量显著增加的现象。因此,样品数量已达到后续分析的需求。
2.3 基于门和属水平鹿头黄酒酿造用黑色和黄色高温大曲真菌类群解析
将相对丰度>1.0%的门和属定义为优势门和优势属,基于门和属水平鹿头黄酒酿造用高温大曲中的真菌菌群结构见图3。
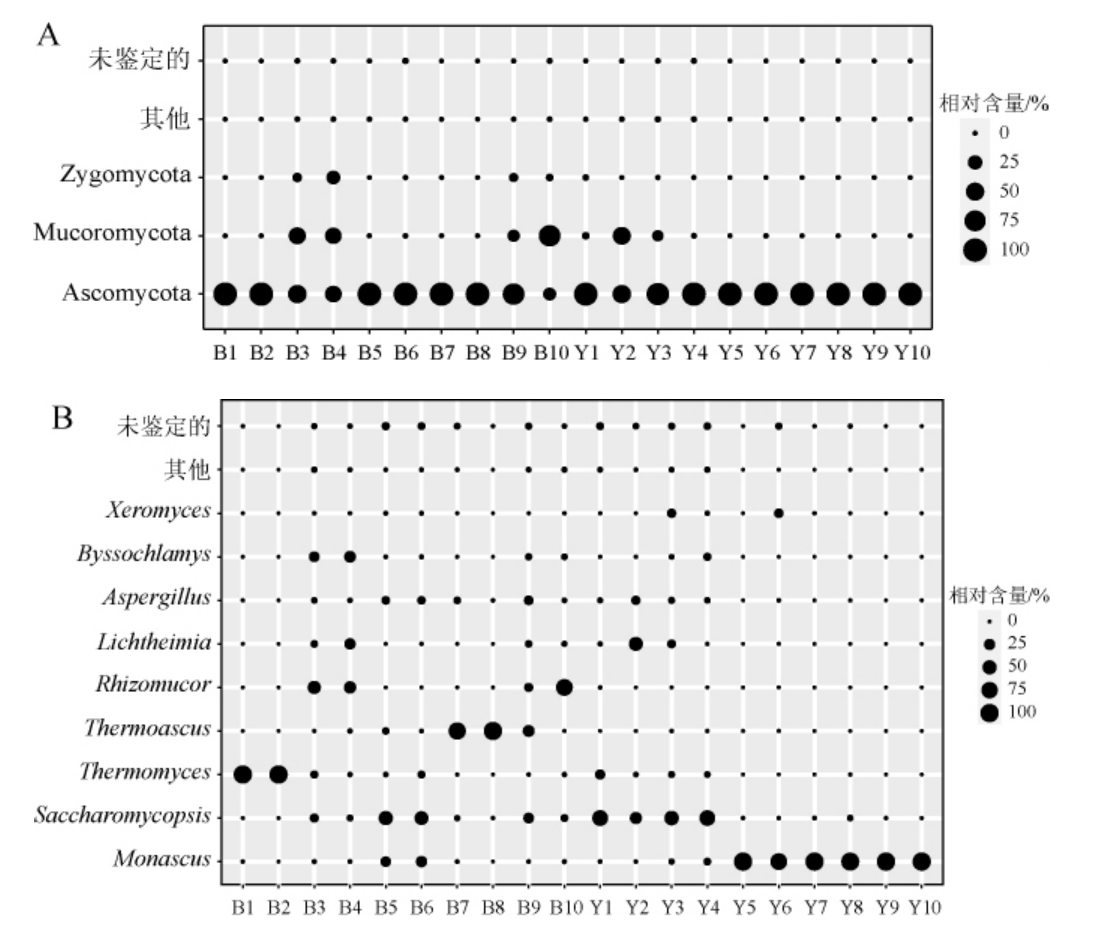
图3 基于门(a)和属(b)水平鹿头黄酒酿造用高温大曲真菌菌群结构
Fig.3 Structure of fungal community in high-temperature Daqu for Lutou Huangjiu brewing based on phylum(a)and genus(b)level
由图3A可知,鹿头黄酒酿造用高温大曲样品共含有3个优势门,分别为子囊菌门(Ascomycota)(86.24%)、毛霉门(Mucoromycota)(11.83%)和结合菌门(Zygomycota)(1.77%)。除样品B10以外,其他样品均以Ascomycota相对丰度为最高。经Mann-Whitnay检验发现,黑曲和黄曲中优势真菌门的相对丰度差异并不显著(P>0.05)。
由图3B可知,鹿头黄酒酿造用高温大曲中共有9个优势属,分别为红曲霉属(Monascus)(31.66%)、腹膜孢酵母属(Saccharomycopsis)(18.54%)、嗜热真菌属(Thermomyces)(12.39%)、嗜热子囊菌属(Thermoascus)(11.12%)、根毛霉属(Rhizomucor)(8.35%)、黄梗霉属(Lichtheimia)(5.11%)、曲霉属(Aspergillus)(3.72%)、丝衣霉属(Byssochlamys)(3.59%)和旱霉属(Xeromyces)(3.05%)。经Mann-Whitnay检验发现,与黄曲相比,黑曲中Monascus的相对丰度显著偏低(P<0.05),而Thermoascus的相对丰度显著偏高(P<0.05),其中Monascus和Thermoascus在黑曲中的相对丰度分别为4.97%和22.21%,在黄曲中分别为58.36%和4.97%。由此可见,鹿头黄酒酿造用高温大曲中蕴含的真菌类群主要为霉菌,累计相对丰度占总真菌类群的66.60%。黑曲是由于大曲在发酵前期升温较快所形成的,Thermoascus不仅可在45 ℃以上的环境中存活,还可产生具有高热稳定性的酶[22],因而在高热环境中能稳定生长繁殖,这或许是黑曲中Thermoascus丰度较高的原因。在对四川和贵州地区白酒酿造用高温大曲微生物类群进行解析时,DENG L等[23-24]研究发现,黑曲和黄曲的微生物类群存在一定的差异,且两类酒曲中均蕴含了丰富的Thermoascus,而未发现有Monascus,与本研究结果有较大不同。值得注意的是,Monascus属于不耐高温的真菌,通常在红曲和低温大曲中有较多富集[25-26],而在高温大曲中丰度较少。因而导致黄曲中Monascus相对丰度过高的原因或许与制曲温度偏低亦或是所经历的高温发酵时间较短有关。
2.4 基于OTU水平鹿头黄酒酿造用高温大曲核心真菌类群解析
将在20个样品中均存在的OTU定义为核心OTU,因这些真菌类群在所有酒曲中均存在,因而其在鹿头黄酒酿造中可能发挥着关键作用,如它们能分泌蛋白酶、淀粉酶和纤维素酶等多种酶,并合成风味物质及其前体物质[27]。鹿头黄酒酿造用高温大曲核心OTU平均相对丰度统计结果见表1。
表1 鹿头黄酒酿造用高温大曲核心操作分类单元平均相对丰度统计
Table 1 Statistics of the average relative abundance of core operational taxonomic units of high-temperature Daqu for Lutou Huangjiu brewing
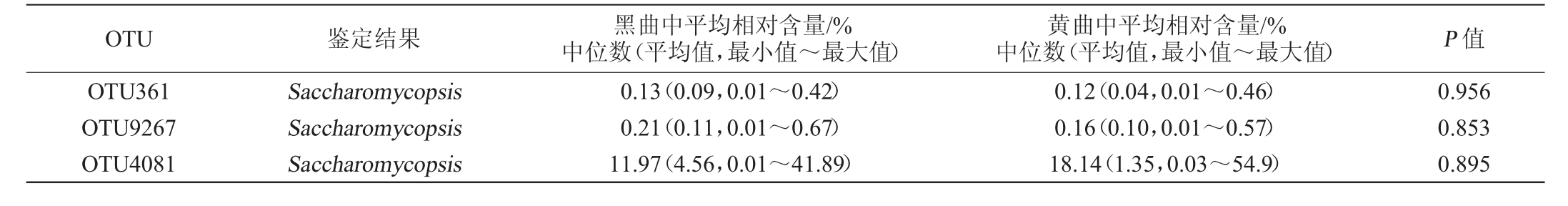
OTU 鉴定结果 黑曲中平均相对含量/%中位数(平均值,最小值~最大值)黄曲中平均相对含量/%中位数(平均值,最小值~最大值) P 值OTU361 OTU9267 OTU4081 Saccharomycopsis Saccharomycopsis Saccharomycopsis 0.13(0.09,0.01~0.42)0.21(0.11,0.01~0.67)11.97(4.56,0.01~41.89)0.12(0.04,0.01~0.46)0.16(0.10,0.01~0.57)18.14(1.35,0.03~54.9)0.956 0.853 0.895
由表1可知,有3个核心OTU在20个高温大曲中均存在,均被鉴定为覆膜孢酵母属(Saccharomycopsis),且黑曲和黄曲中核心OTU的平均相对含量间不存在显著差异(P>0.05)。由此可见,Saccharomycopsis对鹿头黄酒品质的形成可能具有积极的意义。通过纯培养技术,研究人员在小曲和大曲等多种类型的酒曲中发现了扣囊覆膜酵母菌(Saccharomycopsis fibuligera)的存在[28-29]。S.fibuligera通常被认为是发酵食品中降解淀粉的主要酵母菌菌种[30],因而在酿酒过程中它可能起到了将大分子的淀粉降解为低分子糖的作用,促使低分子糖被水解成葡萄糖,最终对酒精发酵产生了积极影响[31]。值得一提的是,本研究并未发现在所有黑曲中均存在但在黄曲中均不存在,或在所有黄曲中均存在但在黑曲中均不存在的OTU。
2.5 鹿头黄酒酿造用高温大曲真菌类群与理化指标之间的相关性分析
进一步对鹿头黄酒酿造中高温大曲蕴含的优势真菌类群与各理化指标间的相关性进行分析,结果见图4。
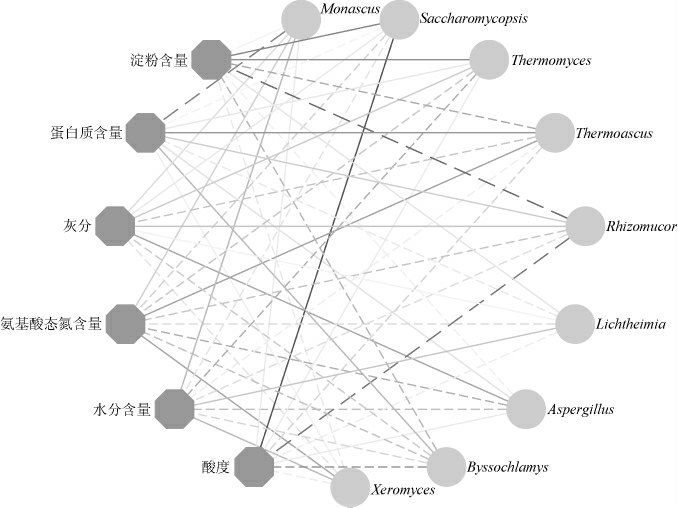
图4 鹿头黄酒酿造用高温大曲优势真菌属与理化指标之间的相关性分析
Fig.4 Correlation analysis between dominant fungal genera and physicochemical indexes of high-temperature Daqu for Lutou Huangjiu brewing
实线表示正相关关系,虚线表示负相关关系;线条颜色越深表示相关性系数绝对值越大;粗线条表示二者间相关性显著(P<0.05)。
由图4可知,Monascus与蛋白质含量之间呈显著负相关关系(P<0.05)(相关系数R=-0.492);Saccharomycopsis与淀粉呈极显著正相关(P<0.01)(相关系数R=0.484),与酸度呈显著正相关(P<0.05)(相关系数R=0.633);Thermomyces与淀粉含量呈显著正相关(P<0.05)(相关系数R=0.477);Rhizomucor与酸度呈显著负相关(P<0.05)(相关系数R=-0.539);Bssochlamys与淀粉呈显著负相关(P<0.05)(R=-0.579)。由此可见,高温大曲中的Monascus和Rhizomucor可能分别具有较强的降解蛋白质和淀粉能力,而Thermomyces和Rhizomucor降解淀粉的能力较弱。
3 结论
本研究对鹿头黄酒酿造用黑色和黄色高温大曲理化指标进行测定和真菌类群进行解析,并对两者的关联性进行了分析。结果发现,两类高温大曲理化指标和真菌类群均存在一定的差异,黑色高温大曲蛋白质含量偏高而酸度和氨基酸态氮含量偏低,Monascus、Saccharomycopsis、Thermomyces、Thermoascus、Rhizomucor、Lichtheimia、Aspergillus、Byssochlamys和Xeromyces为两类高温大曲中的主要真菌类群,Monascus在黄色大曲中含量偏高而Thermoascus在黑色大曲中含量偏高,且Monascus与高温大曲蛋白质含量呈显著负相关(P<0.05),而Thermomyces与高温大曲淀粉含量呈显著正相关(P<0.05)。
[1]LIU S P,CHEN Q L,ZOU H J,et al.A metagenomic analysis of the relationship between microorganisms and flavor development in Shaoxing mechanized Huangjiu fermentation mashes[J].Int J Food Microbiol,2019,303:9-18.
[2]刘慧杰,王娟,王忠朝,等.全二维气相色谱-质谱联用技术解析房县黄酒的挥发性成分[J].食品与发酵工业,2022,48(17):249-255.
[3]钱敏,汤斯斯,赵文红,等.广东客家黄酒中乳酸菌分离鉴定与菌株特性研究[J].中国酿造,2018,37(3):84-88.
[4]李斌,陈亚楠,孙旭,等.Illumina MiSeq高通量测序分析红谷黄酒酒曲微生物菌群多样性[J].中国酿造,2022,41(9):86-92.
[5]刘小改,李洪媛,周林艳,等.清香型大曲中产香细菌的分离筛选及鉴定[J].中国酿造,2022,41(5):96-100.
[6]CHEN G M,HUANG Z R,WU L,et al.Microbial diversity and flavor of Chinese rice wine(Huangjiu):an overview of current research and future prospects[J].Curr Opin Food Sci,2021,42:37-50.
[7]席啦,孔祥聪,杨少勇,等.基于Illunima Miseq测序技术的黄酒麦曲真菌多样性分析[J].食品研究与开发,2022,43(12):185-190.
[8]LIU S P,MAO J,LIU Y Y,et al.Bacterial succession and the dynamics of volatile compounds during the fermentation of Chinese rice wine from Shaoxing region[J].World J Microbiol Biotechnol,2015,31(12):1907-1921.
[9]HUANG Z R,GUO W L,ZHOU W B,et al.Microbial communities and volatile metabolites in different traditional fermentation starters used for Hong Qu glutinous rice wine[J].Food Res Int,2019,121:593-603.
[10]SHI W,CHAI L J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Res Int,2022,156:111298.
[11]DENG L,MAO X,LIU D,et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Front Microbiol,2020,11:588117.
[12]中华人民共和国国家质量监督检疫总局,中国国家标准化管理委员会.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国标准出版社,2011.
[13]中华人民共和国国家质量监督检疫总局,中国国家标准化管理委员会.GB/T 33862—2017 全(半)自动凯氏定氮仪[S].北京:中国标准出版社,2017.
[14]陈怡,刘洋,蒋立文,等.基于高通量测序分析不同浏阳豆豉中真菌的多样性[J].中国酿造,2020,39(11):66-70.
[15]郭壮,葛东颖,尚雪娇,等.退化和正常窖泥微生物多样性的比较分析[J].食品工业科技,2018,39(22):93-98.
[16] EDGAR R C, HAAS B J, CLEMENTE J C, et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[17]POLLOCK J,GLENDINNING L,WISEDCHANWET T,et al.The madness of microbiome:attempting to find consensus"best practice"for 16S microbiome studies[J].Appl Environ Microbiol,2018,84(7):1-12.
[18]KÕLJALG U,NILSSON R H,ABARENKOV K,et al.Towards a unified paradigm for sequence-based identification of fungi[J].Mol Ecol,2013,22(21):5271-5277.
[19]王俏,郭聃洋,王旭亮,等.中国白酒不同香型酒曲理化性能对比分析[J].酿酒科技,2015,72(6):6-10.
[20]王颖,邱勇,王隆,等.不同产区酱香型高温大曲黑、白、黄曲的理化、挥发性成分差异性分析[J].中国调味品,2022,47(6):155-159.
[21]彭璐,明红梅,董异,等.不同曲层中高温大曲质量差异性研究[J].食品与发酵工业,2020,46(3):58-64.
[22] CAI W C, XUE Y A, WANG Y R, et al.The fungal communities and flavor profiles in different types of high-temperature Daqu as revealed by high-throughput sequencing and electronic senses[J].Front Microbiol,2021,12:784651.
[23]DENG L,MAO X,LIU D,et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Front Microbiol,2020,11:588117.
[24]SHI W,CHAI L J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Res Int,2022,156:111298.
[25]HUANG Z R,HONG J L,XU J X,et al.Exploring core functional microbiota responsible for the production of volatile flavour during the traditional brewing of Wuyi Hong Qu glutinous rice wine[J].Food Microbiol,2018,76:487-496.
[26]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2021,9(2):1003-1016.
[27] CAI W C,WANG Y R, NI H, et al.Diversity of microbiota, microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150:110734.
[28]SU C,ZHANG K Z,CAO X Z,et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Res Int,2020,137:109425.
[29] ZHOU Q,MA K,SONG Y, et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu daqu starters made at low-mediumand high-temperatures[J].LWT-Food Sci Technol,2022,162:113408.
[30] JIANG Y J, LV X C, ZHANG C, et al.Microbial dynamics and flavor formation during the traditional brewing of Monascus vinegar[J].Food Res Int,2019,125:108531.
[31]LI R Y,ZHENG X W,ZHANG X,et al.Characterization of bacteria and yeasts isolated from traditional fermentation starter(Fen-Daqu)through a 1H NMR-based metabolomics approach[J].Food Microbiol,2018,76:11-20.